Method Article
Quantificação da lixiviação metálica na cromatografia imobilizada da afinidade metálica
Neste Artigo
Resumo
Apresentamos um ensaio para a fácil quantificação de metais introduzidos em amostras preparadas usando cromatografia de afinidade metálica imobilizada. O método utiliza hidroxinaphthol azul como o indicador de metal colorimétrico e um espectrômetro UV-Vis como o detector.
Resumo
A contaminação de enzimas com metais lixiviadas a partir de colunas de cromatografia de afinidade metálica imobilizada (IMAC) representa uma grande preocupação para os enzimologistas, já que muitas das cações comuns de di e trivalente usadas em resinas iMAC têm um efeito inibitório sobre as enzimas. No entanto, a extensão da lixiviação metálica e o impacto de vários reagentes de eluting e redução são mal compreendidos em grande parte devido à ausência de protocolos simples e práticos de quantificação metálica de transição que usam equipamentos normalmente disponíveis laboratórios de bioquímica. Para resolver esse problema, desenvolvemos um protocolo para quantificar rapidamente a quantidade de contaminação de metal em amostras preparadas usando imac como uma etapa de purificação. O método utiliza o azul hidroxinaphthol (HNB) como um indicador colorimétrico para o conteúdo de caminação metálica em uma solução de amostra e espectroscopia UV-Vis como um meio de quantificar a quantidade de metal presente, na faixa de nanomolar, com base na mudança no espectro HNB em 647 nm. Embora o conteúdo metálico em uma solução tenha sido historicamente determinado usando espectroscopia de absorção atômica ou técnicas de plasma indutivamente acopladas, esses métodos exigem equipamentos especializados e treinamento fora do escopo de um laboratório típico de bioquímica. O método proposto aqui fornece uma maneira simples e rápida para que os bioquímicos determinem o índice do metal das amostras que usam o equipamento e o conhecimento existentes sem sacrificar a exatidão.
Introdução
Desde a sua criação por Porath e colegas de trabalho1, a cromatografia de afinidade metálica imobilizada (IMAC) tornou-se um método de escolha para separar rapidamente as proteínas com base em sua capacidade de se relacionar com íons de metal de transição, como Zn2+, Ni2+,2+, e Co2+. Isso é mais comumente feito através de etiquetas de poli-histidina projetadas e agora é uma das técnicas de purificação cromatográfica mais comuns para o isolamento de proteínas recombinantes2. O IMAC também encontrou aplicações além da purificação de proteínarecombinante como uma forma de isolar quinolonas, tetraciclinas, aminoglicosídeos, macrolídeos e β-lacmas para análise de amostras alimentares3 e como um passo na identificação de marcadores de proteína sangue-soro para cânceres de fígado e pâncreas4,5. Não surpreendentemente, IMAC também se tornou um método de escolha para o isolamento de uma série de enzimas bioenergéticas nativas6,7,8,9,10. No entanto, a implementação bem-sucedida desses métodos de purificação para estudos sobre proteínas bioenergéticas enzimáticas ativas depende da presença de níveis insignificantes de caations metálicas lixiviadas da matriz da coluna para o eluate. As caations metálicas divalentes comumente usadas no IMAC têm significado biológico patológico conhecido, mesmo em baixas concentrações11,12. O efeito fisiológico desses metais é mais pronunciado em sistemas bioenergéticos, onde podem ser letais como inibidores da respiração celular ou fotossíntese13,14,15. Questões semelhantes são inevitáveis para a maioria das classes de proteínas onde metais contaminantes residuais podem interferir com as funções biológicas de uma proteína ou caracterização com técnicas bioquímicas e biofísicas.
Enquanto os níveis de contaminação de metal condições oxidantes e o uso de imidazol como eluante são tipicamente baixos16,os isolamentos proteicos realizados na presença de agentes redutores de cisteína (DTT, β-mercaptoethanol, etc.) ou com quelantes mais fortes como histidina17,18 ou ácido etilediátetraa (EDTA) resultam em níveis muito mais altos de contaminação de metal19,20. Da mesma forma, uma vez que os íons metálicos nas resinas iMAC são frequentemente coordenados por grupos carboxílicos, as eluções de proteínas realizadas em condições ácidas também são susceptíveis de ter níveis muito mais elevados de contaminação de metais. O conteúdo metálico em soluções pode ser avaliado usando espectroscopia de absorção atômica (AAS) e espectrometria de massa plasmática (ICP-MS) indutivamente acoplada até um limite de detecção na faixa ppb-ppt21,22,23,24. Infelizmente, a AAS e o ICP-MS não são meios realistas para detecção em um laboratório de bioquímica tradicional, pois esses métodos exigiriam acesso a equipamentos e treinamento especializados.
Trabalhos anteriores de Brittain25,26 investigaram o uso de hidroxinaphthol azul (HNB) como forma de identificar a presença de metais de transição em solução. No entanto, houve várias contradições internas nos dados20 e essas obras não ofereceram um protocolo adequado. Estudos de Temel et al.27 e Ferreira et al.28 expandiram o trabalho de Brittain com a HNB como um potencial indicador de metal. No entanto, Temel desenvolveu um protocolo que faz uso de AAS para análise de amostras, usando HNB apenas como agente quelante. O estudo de Ferreira utilizou a mudança nos espectros de absorção de HNB a 563 nm, região dos espectros HNB de corlivre que se sobrepõe fortemente aos espectros de complexos de metais HNB no pH 5.7, tornando a sensibilidade ao ensaio bastante baixa, bem como resultando em afinidade de ligação metálica relativamente fraca20. Para abordar problemas em nosso próprio laboratório com a lixiviação Ni2+ da IMAC, expandimos o trabalho feito pela Brittain25,26 e Ferreria28 para desenvolver um ensaio fácil capaz de detectar níveis de nanomolar de vários metais de transição. Mostramos que a HNB liga níquel e outros comuns para metais IMAC com afinidades de ligação subnamolar e formam 1:1 complexo em uma ampla gama de valores de pH20. O ensaio aqui relatado é baseado nestes resultados e utiliza mudanças do absorveance no espectro de HNB em 647 nm para o quantification do metal. O ensaio pode ser realizado na faixa de pH fisiológico usando amortecedores comuns e instrumentação encontrada em um laboratório típico de bioquímica usando detecção colorimétrica e quantificação de complexos de corante metálico e a mudança associada na absorção do corante livre quando se liga ao metal.
Protocolo
1. Preparação de componentes de ensaio
- Determine as frações de cromatografia a serem atentas usando absorção óptica a 280 nm ou métodos alternativos de quantificação de proteínapara identificar as frações enriquecidas com proteínas.
NOTA: Para este trabalho, usamos uma matriz de diodo UV-Vis espectrômetro. Para aumentar a entrada, um leitor de placa capaz de medir a absorção UV-Vis pode ser usado. - Preparação dos componentes necessários do ensaio
- Prepare ou obtenha 10-100 mM buffer ("Buffer de amostra") com um pH entre 7 e 12.
NOTA: Amortecedores bioquímicos comuns, como Tris, HEPES, MOPS e fosfato em pH neutro ou básico são todos aceitáveis para o ensaio. Tricine e histidina podem ser usados, mas exigirão curvas de calibração, pois ambos substancialmente chelate íons de metal. Um exemplo de calibração para histidina é mostrado na referência20. - Prepare uma solução de 12% w/v (20 vezes concentrada) de dispersão de hidroxinaphthol azul (HNB) no Buffer de amostra usando 120 mg de reagente HNB para cada mililitro de solução de estoque preparada.
CUIDADO: A exposição de HNB ao olho pode causar sérios danos e irritação. A proteção ocular deve ser usada ao manusear hnb e as mãos devem ser lavadas cuidadosamente após o manuseio.
NOTA: HNB é vendido como uma dispersão em KCl por fornecedores principais de reagents científicos. Como tal, a concentração real na solução variará de diferentes fabricantes, lotes, e onde na garrafa a dispersão HNB é retirado. Idealmente, uma absorção entre 0,5-0,8 em 647 nm após 20 vezes a diluição do estoque deve ser alcançado.
- Prepare ou obtenha 10-100 mM buffer ("Buffer de amostra") com um pH entre 7 e 12.
2. Preparação e medição da amostra
- Preparação do espectrômetro para coleta de dados
- Ligue e aqueça o espectrômetro UV-Vis. Defina o espectrômetro para coletar dados em 647 nm.
NOTA: Se o espectrômetro permitir, também coletar dados em 850 nm, ou algum outro comprimento de onda sem alterações significativas relacionadas com os espectros de corantes e corantes, seja usado para uma correção de linha de base. - Em branco o espectrômetro usando o buffer de amostra.
NOTA: Quartzo ou cuvettes de plástico descartáveis podem ser usados. Cuvettes de quartzo são preferidos para análise quantitativa, pois permitirão maior precisão e precisão sobre cuvettes de plástico descartáveis. No entanto, as cuvettes de plástico bloqueiam a luz UV, que pode estar presente nos feixes de medição de alguns espectrômetros de matriz de diodo. A exposição de HNB à luz UV intensa causa degradação notável do corante e uma diminuição de absorção lenta indesejada que pode ser confundida com a ligação de metal lento (por exemplo, ver a Figura 1 em Informações de Apoio à Referência 20).
- Ligue e aqueça o espectrômetro UV-Vis. Defina o espectrômetro para coletar dados em 647 nm.
- Medida de preparação e absorção do controle
- Prepare uma solução de controle contendo 50 μL de ações HNB por mililitro de volume total de ensaios. Para garantir uma boa mistura de todas as amostras, pipeta os pequenos volumes em primeiro lugar, em seguida, adicione o buffer de amostra seguido por mistura por pipetting. A solução diluída de HNB deve ser preparada fresca mas os estoques de HNB podem ser armazenados em 4 °C e protegidos da luz por semanas sem degradação significativa.
- Permita que o controle incubar por um mínimo de 3 min à temperatura ambiente.
NOTA: Um tempo de incubação mais longo pode ser necessário para amostras no pH alcalino ou na presença de fosfato devido à formação de complexos metálicos pouco solúveis, resultando em equilíbrio mais lento. - Medir e registrar a absorção em 647 nm para a amostra de controle.
- Medida de preparação e absorção de amostras
- Prepare as amostras de ensaio misturando 50 μL de caldo hnb com 950 μL de frações de proteína devidamente diluídas com o buffer de amostra.
NOTA: Uma vez que os níveis de contaminação do metal relatados na literatura variam em um fator de mais de 1000, dependendo das condições de elução16,20, pode ser necessário tentar algumas diluições das frações de proteína sumed com o Buffer amostra (ver passo 1.2.1 acima) para alcançar mudanças de absorção dentro da faixa dinâmica do ensaio.
CUIDADO: Níquel e outros metais usados no IMAC são conhecidos irritantes da pele, suspeitos de serem cancerígenos, e são capazes de danificar os rins e sangue após exposição prolongada. Luvas e proteção ocular devem ser usadas no manuseio de amostras de proteína preparadas com IMAC. - Permita que a amostra incuba por um mínimo de 3 min à temperatura ambiente e medir absorveções em 647 nm.
NOTA: O passo limitante do ensaio em termos de tempo investido é a etapa de incubação. Os dados para este papel foram coletados usando um único cuvette de quartzo que fosse lavado com cuidado entre cada amostra. Mesmo com o tempo de lavagem adicionado e preparação do estoque HNB, coleta de dados para 14 amostras e o controle levou aproximadamente uma hora e meia e, como tal, o protocolo pode ser facilmente concluído sem a necessidade de interrupção. - Repita os passos 2.3.1 e 2.3.2 para cada fração que será medida.
NOTA: Se vários cuvettes serão usados para várias amostras, as amostras devem ser preparadas de uma forma que permita tempo de incubação comparável e exposição à luz ambiente.
- Prepare as amostras de ensaio misturando 50 μL de caldo hnb com 950 μL de frações de proteína devidamente diluídas com o buffer de amostra.
3. Quantificação de metal
- Determinar a concentração de metal em cada amostra
- Encontre a diferença de cada absorção da amostra em 647 nm do controle de HNB.
- Determinar a concentração de metal (em μM) usando a fórmula abaixo:

onde df é o fator de diluição para a fração de ensaio, ΔAbs647 é a mudança de absorção em 647 nm, 3.65x10-2 representa o coeficiente de extinção de HNB (ε =36.5 mM-1·cm-1 ver Referência20 para mais detalhes) e l é o caminho óptico da cuvette em cm.
Resultados
O espectro de HNB livre em pH neutro (linha preta) e espectros representativos de frações afiguradas para Ni2+ do isolamento de MSP1E3D129 são mostrados na Figura 2. Uma série bem-sucedida do ensaio deve demonstrar uma absorção diminuída em 647 nm comparado ao controle de HNB, que corresponde à formação de complexos de HNB na presença de um metal da transição. Um ensaio falhado seria indicado por um aumento na absorção em 647 nm. Alternativamente, mais de 90% de diminuição da absorção inicial em 647 nm indicaria muito alto teor de metal e uma necessidade de atribuir frações mais diluídas. Um ensaio sem alterações de absorção do controle hnb livre não indica necessariamente uma falha. É possível que as amostras não contenham essencialmente nenhum metal lixiviado. No entanto, isso é improvável e qualquer amostra que não mostre nenhuma mudança de absorção deve ser preparada e medida novamente, de preferência com menos diluição, para confirmar o resultado. No total, a maioria das falhas para observar a mudança de absorção esperada pode ser atribuída à tubulação inadequada durante a preparação da amostra, um tempo de incubação inadequado antes da medição ou valores de pH fora da faixa recomendada de 7-12.
Para demonstrar a aplicação deste ensaio, analisamos 2 proteínas de andaimes de membrana sua etiqueta MSP1E3D1 (isoladas como em Denisov, I. G. et al.29), MSP2N2 (isolado como em Grinkova, Y. V.30), e um romance 3-heme c-tipo cytochrome GSU0105 de Geobacter sulfurreducens, que foi recombinantemente expresso em E.coli e eluted com 500 mM imidazole. Os perfis de elução do Ni2+ de uma coluna de resina Ni-NTA (ver Tabela de Materiais)e os perfis associados de elução de proteínas para essas 3 proteínas são mostrados na Figura 3. Qualquer proteína terá uma elução única de níquel que pode ou não alinhar com o perfil de elução de proteínas medida em 280 nm. Por exemplo, a Figura 3C mostra que a proteína e o conteúdo Ni2+ de cada fração para GSU0105 são significativamente deslocados um do outro, enquanto as frações para MSP1E3D1 e MSP2N2 (Figura 3A,B)que contêm mais proteínas também têm o maior teor de Ni2+. A Figura 3A,B também ilustra que o conteúdo metálico pode não ser distribuído uniformemente entre as frações coletadas usando o IMAC. Dependendo da embalagem da coluna, a composição do amortecedor de elução, equipamentos de bombeamento e condições, é possível ter elute de metal em frações consecutivas em concentrações muito diferentes, independentemente do teor proteico dessas frações.

Figura 1: Estrutura de hidroxinaphthol azul (HNB). Na faixa de pH funcional do ensaio, todos os grupos sulfonatos e um dos grupos de hidroxil são ionizados. Clique aqui para ver uma versão maior deste número.

Figura 2: Espectros de absorção para frações MSP1E3D1 selecionados e HNB. A absorção relativa de três frações de MSP1E3D1 (cores) em comparação com um controle HNB (linha preta grossa) são mostradas. As amostras foram preparadas em 20 mM Tris, pH 7.5. Clique aqui para ver uma versão maior deste número.
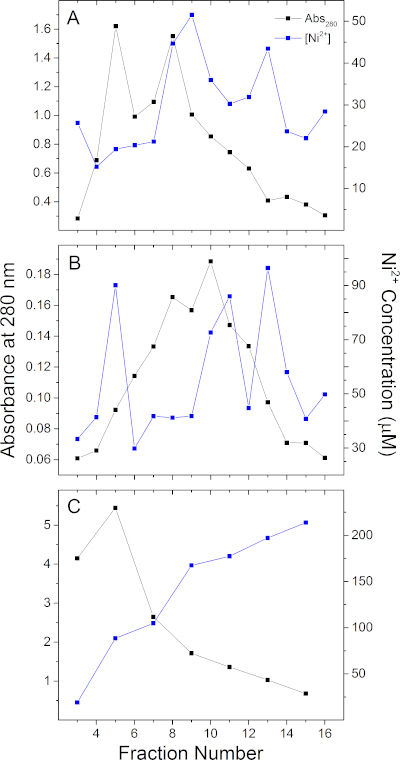
Figura 3: Ni2+ quantificação para 3 proteínas representativas de sua marca. Perfis de elução de proteína e Ni2+ para (A)MSP1E3D1, (B) MSP2N2, e (C)GSU0105. A elução de proteínas foi realizada por meio de 300 mM, 300 mM e 500 mM imidazol, respectivamente. Ni2+ quantificação foi realizada em 20 mM Tris, pH 7.5. Clique aqui para ver uma versão maior deste número.
Discussão
A detecção colorimétrica de metais usando HNB fornece uma maneira simples de quantificar o grau de contaminação por proteínas por íons metálicos de transição de resinas IMAC. Como estabelecemos em Ref. 20, o Ni2+ se liga à HNB com 1:1 stoichiometria e a constante de dissociação para as mudanças complexas de Ni-HNB com pH. No entanto, o complexo Kd está na faixa sub-nM para todos os valores recomendados (7-12) de pH. Em termos práticos, isso significa que todos os Ni2 + em todas as frações testadas vai ligar a HNB, enquanto nenhum outro forte quelating reagentes, como EDTA, estão presentes. Todas essas propriedades juntas resultam em curvas lineares de titration Ni2+, que observamos experimentalmente. Nesse relatório20,também estabelecemos que as mudanças espectrais devido à formação complexa de tine-metal será a mesma em toda a faixa de 7-12 pH. A detecção é limitada pelas medições mínimas de mudança de absorção confiável (10-4 - 10-3 OD, dependendo do espectrômetro usado) correspondente a 2,7-27 nM Ni2+. A faixa superior é limitada pela quantidade de HNB presente. Em nosso trabalho, usamos ~15 μM, correspondendo a ~0,6 OD em 647 nm. No entanto, isso pode ser aumentado até 50-80 μM HNB, se necessário. Praticamente, observamos ni2 + níveis de contaminação em frações cromatográficas comparáveis ou superiores ao limite superior forçando-nos a fazer 10 - a 50 vezes diluições de frações assumidas. No entanto, esta etapa de diluição adicional pode aumentar erros relativos, determinando a concentração de níquel em uma fração.
Embora não tenhamos investigado os detalhes, parecia que a ligação de outros metais usados em resinas IMAC (Co, Zn, Fe) também tem sub-μM dissociação constantes e praticamente nenhuma sobreposição entre tina e tina-metal absorção espectros em 647 nm, o comprimento de onda de pico de livre Hnb. Portanto, a ligação metálica completa ao tine e as mudanças espectrais associadas do tinuoso pode ser usada para determinação absoluta de metal em toda a faixa de pH recomendada.
A execução do protocolo é direta e depende mais fortemente da técnica laboratorial adequada. Os espectrômetros modernos têm respostas altamente lineares e faixas dinâmicas de magnitude 3-4. Consequentemente, o lugar mais provável para a introdução de erro no método é através das etapas de tubulação para a preparação da amostra. Conforme descrito neste texto, o método é baseado na quantificação do conteúdo metálico com base na diferença no pico de absorção de HNB em 647 nm de um controle hnb livre e amostras com HNB complexas com metal. Se não for cuidado para canalizar com precisão os alíquos HNB ou os volumes de buffer, a comparação do controle e absorções de amostras em 647 nm torna-se um ponto de erro. Da mesma forma, a fraca aperitamento de frações de proteína para a preparação de amostras pode distorcer a concentração percebida de metal em uma fração. Recomenda-se que, devido à sensibilidade do ensaio, todas as pipetas que estão sendo usadas para análises onde a quantificação precisa é exigida estejam calibradas antes do uso.
As limitações preliminares do método vêm com a escala funcional do pH do ensaio e a presença de agentes quelante fortes. O ensaio é melhor utilizado em uma faixa de pH de 7-12. Abaixo do pH 7, o espectro do tinuoso HNB livre muda, perdendo o pico em 647 nm usado para quantificação20. Acima do pH 12, muitas hidróxidos de metal começam a precipitar- se, incluindo os de metais comumente encontrados em resinas IMAC, tornando a quantificação mais lenta e menos reproduzível. Enquanto o máximo alcalino não representa um problema significativo, pois os procedimentos de purificação raramente exigem um pH tão alto, o mínimo ácido é mais provável que seja um fator limitante. Uma vez que os limites de detecção para Ni2+ e outros metais de transição são aproximadamente 1000 vezes inferiores aos níveis de contaminação metálica demonstrados acima (Figura 3),o baixo limite de pH para o ensaio pode ser contornado pela diluição das frações de proteína ácida ensaiou em amortecedores com valores neutros de pH e capacidade de buffer suficientemente alta. Alternativamente, o pH de frações analisadas pode ser ajustado ou a solução de ações HNB pode ser mais fortemente amortecida para manter o pH desejado após a mistura.
Se o procedimento de isolamento para a proteína que está sendo purificada requer o uso de reagentes com propriedades de quelação de metal de transição conhecidas ou suspeitas, uma modificação do método seria necessária para permitir a quantificação adequada de metais lixiviados. Uma curva padrão precisaria ser preparada usando o agente quelante usado para a lusão de proteínas e concentrações conhecidas de padrões metálicos para quantificar com precisão a concentração de metal lixiviado na presença do quelator. Um exemplo de quantificação de metal na presença de histidina está disponível em Kokhan & Marzolf20.
Quantificação precisa de metais em amostras biológicas ainda é em grande parte dependente do uso de técnicas analíticas e instrumentação, como AAS e ICP-MS, que permanecem fora do reino do típico bioquímico31,32. Bonta et al. descreveram a simples preparação de amostras biológicas em papel filtro comum para análise pelo ICP-MS, no entanto, seu método ainda depende de instrumentação não-padrão para um bioquímico31. O método que descrevemos permite a medição de conteúdo metálico em uma amostra a ser tomada sem treinamento adicional sobre nova instrumentação ou terceirização para outras pessoas. Protocolos colorimétricos semelhantes foram desenvolvidos para análise de metais em amostras biológicas33. No entanto, o método descrito por Shaymal et al.33 depende de um ensaio de fluorescência usando uma sonda fluorescente comercialmente indisponível que dá um limite maior de detecção do que no deste artigo. Considerando a relativa facilidade pela qual o método descrito pode ser realizado e o recente interesse no desenvolvimento de protocolos portáteis de detecção de metais para amostras aquosas34,35,poderia ser facilmente adaptado para testes de campo de amostras de água. Como um teste portátil, nosso método poderia ser modificado para uso com um espectrômetro portátil para quantificação ou como uma medida qualitativa para identificar amostras para análise mais aprofundada em um local de teste fixo.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este material é baseado no trabalho apoiado pela National Science Foundation Grant MCB-1817448 e por um prêmio do Thomas F. e Kate Miller Jeffress Memorial Trust, Bank of America, Trustee e doador especificado Hazel Thorpe Carman e George Gay Carman Confiar.
Materiais
| Name | Company | Catalog Number | Comments |
| 2xYT broth | Fisher Scientific | BP9743-500 | media for E.coli growth |
| HEPES, free acid | BioBasic | HB0264 | alternative buffer |
| HisPur Ni-NTA resin | Thermo Scientific | 88222 | |
| Hydroxynaphthol blue disoidum salt | Sigma-Aldrich | 219916-5g | |
| Imidazole | Fisher Scientific | O3196-500 | |
| Imidazole | BioBasic | IB0277 | |
| MOPS, free acid | BioBasic | MB0360 | alternative buffer |
| Sodium chloride | Fisher Scientific | S271-500 | |
| Sodium phosphate | Fisher Scientific | S369-500 | alternative buffer |
| Tricine | Gold Bio | T870-100 | |
| Tris base | Fisher Scientific | BP152-500 | |
| Triton X-100 | Sigma-Aldrich | T9284-500 |
Referências
- Porath, J., Carlsson, J. A. N., Olsson, I., Belfrage, G. Metal chelate affinity chromatography, a new approach to protein fractionation. Nature. 258 (5536), 598-599 (1975).
- Block, H., et al. Immobilized-Metal Affinity Chromatography (IMAC): A Review. Methods in Enzymology. 463, 439-473 (2009).
- Takeda, N., Matsuoka, T., Gotoh, M. Potentiality of IMAC as sample pretreatment tool in food analysis for veterinary drugs. Chromatographia. 72 (1/2), 127-131 (2010).
- Felix, K., et al. Identification of serum proteins involved in pancreatic cancer cachexia. Life sciences. 88 (5-6), 218-225 (2011).
- Wu, C., et al. Surface enhanced laser desorption/ionization profiling: New diagnostic method of HBV-related hepatocellular carcinoma. Journal of Gastroenterology and Hepatology. 24 (1), 55-62 (2009).
- Goldsmith, J. O., Boxer, S. G. Rapid isolation of bacterial photosynthetic reaction centers with an engineered poly-histidine tag. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1276 (3), 171-175 (1996).
- Guergova-Kuras, M., et al. Expression and one-step purification of a fully active polyhistidine-tagged cytochrome bc1 complex from Rhodobacter sphaeroides. Protein Expression and Purification. 15 (3), 370-380 (1999).
- Mitchell, D. M., Gennis, R. B. Rapid purification of wildtype and mutant cytochrome c oxidase from Rhodobacter sphaeroides by Ni(2+)-NTA affinity chromatography. FEBS Letters. 368 (1), 148-150 (1995).
- Tian, H., White, S., Yu, L., Yu, C. A. Evidence for the head domain movement of the rieske iron-sulfur protein in electron transfer reaction of the cytochrome bc1 complex. Journal of Biological Chemistry. 274 (11), 7146-7152 (1999).
- Tian, H., Yu, L., Mather, M. W., Yu, C. A. Flexibility of the neck region of the rieske iron-sulfur protein is functionally important in the cytochrome bc1 complex. Journal of Biological Chemistry. 273 (43), 27953-27959 (1998).
- Louie, A. Y., Meade, T. J. Metal complexes as enzyme inhibitors. Chemical Reviews. 99 (9), 2711-2734 (1999).
- Tamás, M. J., Sharma, S. K., Ibstedt, S., Jacobson, T., Christen, P. Heavy Metals and Metalloids As a Cause for Protein Misfolding and Aggregation. Biomolecules. 4 (1), 252-267 (2014).
- Gerencser, L., Maroti, P. Retardation of proton transfer caused by binding of the transition metal ion to the bacterial reaction center is due to pKa shifts of key protonatable residues. Biochemistry. 40 (6), 1850-1860 (2001).
- Klishin, S. S., Junge, W., Mulkidjanian, A. Y. Flash-induced turnover of the cytochrome bc1 complex in chromatophores of Rhodobacter capsulatus: binding of Zn2+ decelerates likewise the oxidation of cytochrome b, the reduction of cytochrome c1 and the voltage generation. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1553 (3), 177-182 (2002).
- Link, T. A., von Jagow, G. Zinc ions inhibit the QP center of bovine heart mitochondrial bc1 complex by blocking a protonatable group. Journal of Biological Chemistry. 270 (42), 25001-25006 (1995).
- Block, H., Kubicek, J., Labahn, J., Roth, U., Schäfer, F. Production and comprehensive quality control of recombinant human Interleukin-1beta: a case study for a process development strategy. Protein Expression and Purification. 57 (2), 244-254 (2008).
- Kokhan, O., Shinkarev, V. P., Wraight, C. A. Binding of imidazole to the heme of cytochrome c1 and inhibition of the bc1 complex from Rhodobacter sphaeroides: II. Kinetics and mechanism of binding. Journal of Biological Chemistry. 285 (29), 22522-22531 (2010).
- Kokhan, O., Shinkarev, V. P., Wraight, C. A. Binding of imidazole to the heme of cytochrome c1 and inhibition of the bc1 complex from Rhodobacter sphaeroides: I. Equilibrium and modeling studies. Journal of Biological Chemistry. 285 (29), 22513-22521 (2010).
- Bornhorst, J. A., Falke, J. J. Purification of proteins using polyhistidine affinity tags. Methods in Enzymology. 326, 245-254 (2000).
- Kokhan, O., Marzolf, D. R. Detection and quantification of transition metal leaching in metal affinity chromatography with hydroxynaphthol blue. Analytical Biochemistry. 582, 113347 (2019).
- Doyle, C., Naser, D., Bauman, H., Rumfeldt, J., Meiering, E. Spectrophotometric method for simultaneous measurement of zinc and copper in metalloproteins using 4-(2-pyridylazo)resorcinol. Analytical Biochemistry. 579, 44-56 (2019).
- Furrer, J., Smith, G. S., Therrien, B., Gasser, G. . Inorganic Chemical Biology. , (2014).
- Hogeling, S. M., Cox, M. T., Bradshaw, R. M., Smith, D. P., Duckett, C. J. Quantification of proteins in whole blood, plasma and DBS, with element-labelled antibody detection by ICP-MS. Analytical Biochemistry. 575, 10-16 (2019).
- Yamasaki, S., Tsumura, A., Takaku, Y. Ultratrace Elements in Terrestrial Water as Determined by High-Resolution ICP-MS. Microchemical Journal. 49 (2), 305-318 (1994).
- Brittain, H. G. Complex Formation Between Hydroxy Naphthol Blue and First Row Transition Metal Cyanide Complexes. Analytical Letters. 10 (13), 1105-1113 (1977).
- Brittain, H. G. Binding of Transition Metal Ions by the Calcium Indicator Hydroxy Naphthol Blue. Analytical Letters. 11 (4), 355-362 (1978).
- Temel, N. K., Sertakan, K., Gürkan, R. Preconcentration and Determination of Trace Nickel and Cobalt in Milk-Based Samples by Ultrasound-Assisted Cloud Point Extraction Coupled with Flame Atomic Absorption Spectrometry. Biological Trace Element Research. 186 (2), 597-607 (2018).
- Ferreira, S. L. C., Santos, B. F., de Andrade, J. B., Costa, A. C. S. Spectrophotometric and derivative spectrophotometric determination of nickel with hydroxynaphthol blue. Microchimica Acta. 122 (1), 109-115 (1996).
- Denisov, I. G., Grinkova, Y. V., Lazarides, A. A., Sligar, S. G. Directed Self-Assembly of Monodisperse Phospholipid Bilayer Nanodiscs with Controlled Size. Journal of the American Chemical Society. 126 (11), 3477-3487 (2004).
- Grinkova, Y. V., Denisov, I. G., Sligar, S. G. Engineering extended membrane scaffold proteins for self-assembly of soluble nanoscale lipid bilayers. Protein Engineering, Design and Selection. 23 (11), 843-848 (2010).
- Bonta, M., Hegedus, B., Limbeck, A. Application of dried-droplets deposited on pre-cut filter paper disks for quantitative LA-ICP-MS imaging of biologically relevant minor and trace elements in tissue samples. Analytica Chimica Acta. 908, 54-62 (2016).
- Olmedo, P., et al. Validation of a method to quantify chromium, cadmium, manganese, nickel and lead in human whole blood, urine, saliva and hair samples by electrothermal atomic absorption spectrometry. Analytica Chimica Acta. 659 (1), 60-67 (2010).
- Shyamal, M., et al. Highly Selective Turn-On Fluorogenic Chemosensor for Robust Quantification of Zn(II) Based on Aggregation Induced Emission Enhancement Feature. ACS Sensors. 1 (6), 739-747 (2016).
- Kudo, H., Yamada, K., Watanabe, D., Suzuki, K., Citterio, D. Paper-Based Analytical Device for Zinc Ion Quantification in Water Samples with Power-Free Analyte Concentration. Micromachines. 8 (4), 127 (2017).
- Liu, R., Zhang, P., Li, H., Zhang, C. Lab-on-cloth integrated with gravity/capillary flow chemiluminescence (GCF-CL): towards simple, inexpensive, portable, flow system for measuring trivalent chromium in water. Sensors and Actuators B: Chemical. 236 (C), 35-43 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados