Method Article
Cuantificación de la lixiviación de metal en la cromatografía de afinidad de metal inmovilizada
En este artículo
Resumen
Presentamos un ensayo para una fácil cuantificación de metales introducidos en muestras preparadas mediante cromatografía de afinidad de metales inmovilizadas. El método utiliza el azul hidroxinaphthol como indicador de metal colorimétrico y un espectrofotómetro UV-Vis como detector.
Resumen
La contaminación de enzimas con metales lixiviados a partir de columnas de cromatografía de afinidad de metales inmovilizadas (IMAC) plantea una preocupación importante para los enzimólogos, ya que muchos de los cationes di y trivalentes comunes utilizados en las resinas IMAC tienen un efecto inhibitorio sobre las enzimas. Sin embargo, el alcance de la lixiviación de metales y el impacto de varios reactivos de elución y reducción se entienden mal en gran parte debido a la ausencia de protocolos de cuantificación de metales de transición simples y prácticos que utilizan equipos típicamente disponibles en laboratorios de bioquímica. Para abordar este problema, hemos desarrollado un protocolo para cuantificar rápidamente la cantidad de contaminación metálica en muestras preparadas utilizando IMAC como paso de purificación. El método utiliza el azul hidroxinaphthol (HNB) como indicador colorimétrico para el contenido de catión de metal en una solución de muestra y la espectroscopia UV-Vis como medio para cuantificar la cantidad de metal presente, en el rango nanomolar, basado en el cambio en el espectro HNB a 647 nm. Mientras que el contenido de metal en una solución se ha determinado históricamente utilizando espectroscopia de absorción atómica o técnicas de plasma acoplado inductivamente, estos métodos requieren equipos especializados y entrenamiento fuera del alcance de un laboratorio de bioquímica típico. El método propuesto aquí proporciona una manera sencilla y rápida para que los bioquímicos determinen el contenido de metal de las muestras utilizando el equipo y el conocimiento existentes sin sacrificar la precisión.
Introducción
Desde sus inicios por Porath y sus compañeros de trabajo1, la cromatografía de afinidad de metal inmovilizado (IMAC) se ha convertido en un método de elección para separar rápidamente las proteínas en función de su capacidad de unirse con iones metálicos de transición como Zn2+,Ni2+,Cu2+y Co2+. Esto se hace más comúnmente a través de etiquetas de polihistidina de ingeniería y ahora es una de las técnicas de purificación cromatográfica más comunes para el aislamiento de proteínas recombinantes2. IMAC también ha encontrado aplicaciones más allá de la purificación de proteínas recombinantes como una forma de aislar quinolonas, tetraciclinas, aminoglucósidos, macrólidos y lactams para el análisis de muestras de alimentos3 y como un paso en la identificación de marcadores de proteínas de suero sanguíneo para cánceres de hígado y páncreas4,5. No es de extrañar que IMAC también se haya convertido en un método de elección para el aislamiento de una serie de enzimas bioenergéticas nativas6,7,8,9,10. Sin embargo, la implementación exitosa de estos métodos de purificación para estudios sobre proteínas bioenergéticas enzimáticamente activas depende de la presencia de niveles insignificantes de cationes metálicos lixiviados de la matriz de columna en el eluido. Los cationes metálicos divalentes comúnmente utilizados en IMAC han conocido significación biológica patológica, incluso a bajas concentraciones11,12. El efecto fisiológico de estos metales es más pronunciado en los sistemas bioenergéticos, donde pueden resultar letales como inhibidores de la respiración celular o fotosíntesis13,14,15. Problemas similares son inevitables para la mayoría de las clases de proteínas donde los metales contaminantes residuales pueden interferir con las funciones biológicas de una proteína o la caracterización con técnicas bioquímicas y biofísicas.
Mientras que los niveles de contaminación de metales en condiciones oxidantes y el uso de imidazol como eluyente son típicamentebajos16, los aislamientos proteicos realizados en presencia de agentes reductores de cisteína (TDT, é-mercaptoetanol, etc.) o con queladores más fuertes como la histidina17,18 o ácido etilendiaminetetraacético (EDTA) dan como resultado niveles mucho más altos de contaminación metálica19. Del mismo modo, dado que los iones metálicos en las resinas IMAC son frecuentemente coordinados por grupos carboxílicos, también es probable que las eluciones de proteínas realizadas en condiciones ácidas tengan niveles mucho más altos de contaminación metálica. El contenido de metal en soluciones se puede evaluar utilizando espectroscopía de absorción atómica (AAS) y espectrometría de masas plasmáticas acopladas inductivamente (ICP-MS) hasta un límite de detección en el rango ppb-ppt21,22,23,24. Desafortunadamente, AAS y ICP-MS no son medios realistas para la detección en un laboratorio de bioquímica tradicional, ya que esos métodos requerirían acceso a equipos especializados y capacitación.
Trabajo anterior de Brittain25,26 investigó el uso de azul hidroxinaphthol (HNB) como una manera de identificar la presencia de metales de transición en solución. Sin embargo, hubo varias contradicciones internas en los datos20 y esas obras no ofrecieron un protocolo adecuado. 27 y Ferreira et al.28 ampliaron el trabajo de Brittain con HNB como un indicador de metal potencial. Sin embargo, Temel desarrolló un protocolo que hace uso de AAS para el análisis de muestras, utilizando HNB sólo como agente quelante. El estudio de Ferreira utilizó el cambio en los espectros de absorbancia HNB a 563 nm, una región de los espectros HNB de tinte libre que se superpone en gran medida con los espectros de complejos de metal HNB a pH 5.7, haciendo que la sensibilidad del ensayo sea bastante baja, así como dando como resultado una afinidad de unión de metales relativamente débil20. Para abordar problemas en nuestro propio laboratorio con Ni2+ lixiviación de IMAC, hemos ampliado el trabajo realizado por Brittain25,26 y Ferreria28 para desarrollar un ensayo fácil capaz de detectar niveles nanomolares de varios metales de transición. Mostramos que HNB une níquel y otros comunes para los metales IMAC con afinidades de unión sub-nanomolar y forma 1:1 complejo en una amplia gama de valores de pH20. El ensayo aquí indicado se basa en estos hallazgos y utiliza cambios de absorbancia en el espectro HNB a 647 nm para la cuantificación de metales. El ensayo se puede realizar en el rango de pH fisiológico utilizando tampones e instrumentación comunes que se encuentran en un laboratorio de bioquímica típico mediante la detección colorimétrica y cuantificación de complejos de tinte metálico y el cambio asociado en la absorbancia del tinte libre cuando se une al metal.
Protocolo
1. Preparación de componentes de ensayo
- Determinar las fracciones de cromatografía que se deben ensayo utilizando absorbancia óptica a 280 nm o métodos alternativos de cuantificación de proteínas para identificar las fracciones enriquecidas con proteínas.
NOTA: Para este trabajo, utilizamos un espectrofotómetro UV-Vis de matriz de diodos. Para aumentar el rendimiento, se puede utilizar un lector de placas capaz de medir la absorbancia UV-Vis. - Preparación de los componentes de ensayo necesarios
- Preparar u obtener un búfer de 10-100 mM ("Buffer de muestra") con un pH entre 7 y 12.
NOTA: Los tampones bioquímicos comunes como Tris, HEPES, MOPS y fosfato a pH neutro o básico son aceptables para el ensayo. La tricina y la histidina se pueden utilizar, pero requerirán curvas de calibración, ya que ambos producen iones metálicos sustancialmente quelatos. En la referencia20se muestra un ejemplo de calibración de la histidina. - Preparar una solución de 12% p/v (20 veces concentrada) de dispersión azul hidroxinaftal (HNB) en el búfer de muestra utilizando 120 mg de reactivo HNB para cada mililitro de solución de stock preparada.
ADVERTENCIA: La exposición de HNB al ojo puede causar daños graves e irritación. Se debe utilizar protección ocular al manipular HNB y las manos deben lavarse a fondo después de la manipulación.
NOTA: HNB se vende como una dispersión en KCl por los principales proveedores de reactivos científicos. Como tal, la concentración real en solución variará de diferentes fabricantes, lotes, y donde en el frasco se toma la dispersión HNB. Idealmente, se debe lograr una absorbancia entre 0,5-0,8 a 647 nm después de una dilución de 20 veces de la población.
- Preparar u obtener un búfer de 10-100 mM ("Buffer de muestra") con un pH entre 7 y 12.
2. Preparación y medición de muestras
- Preparación del espectrofotómetro para la recopilación de datos
- Encienda y caliente el espectrofotómetro UV-Vis. Ajuste el espectrofotómetro para recopilar datos a 647 nm.
NOTA: Si el espectrofotómetro lo permite, recopile además datos a 850 nm, o alguna otra longitud de onda sin cambios significativos relacionados con los espectros de colorante-metal y tinte, que se utilizarán para una corrección de línea base. - Enblanco el espectrofotómetro utilizando el búfer de muestra.
NOTA: Se pueden utilizar cubetas de cuarzo o de plástico desechables. Las cubetas de cuarzo son preferidas para el análisis cuantitativo, ya que permitirán una mayor precisión y precisión sobre las cubetas de plástico desechables. Sin embargo, las cubetas de plástico bloquean la luz UV, que puede estar presente en los haces de medición de algunos espectrofotómetros de matriz de diodos. La exposición de HNB a la luz UV intensa provoca una degradación notable del tinte y una disminución de la absorción lenta no deseada que se puede confundir con la unión lenta de metales (por ejemplo, véase la Figura 1 en Información de apoyo de la referencia 20).
- Encienda y caliente el espectrofotómetro UV-Vis. Ajuste el espectrofotómetro para recopilar datos a 647 nm.
- Medición de la preparación y absorbancia del control
- Preparar una solución de control que contenga 50 ml de hnB por mililitro de volumen total de ensayo. Para garantizar una buena mezcla de todas las muestras, pipetee primero los volúmenes pequeños y luego agregue el búfer de muestra seguido de la mezcla mediante pipeteo. La solución diluida de HNB debe prepararse fresca, pero las existencias de HNB pueden almacenarse a 4 oC y protegerse de la luz durante semanas sin una degradación significativa.
- Deje que el control se incubadurante durante un mínimo de 3 minutos a temperatura ambiente.
NOTA: Puede ser necesario un tiempo de incubación más largo para las muestras a pH alcalino o en presencia de fosfato debido a la formación de complejos metálicos poco solubles, lo que resulta en un equilibrio más lento. - Mida y registre la absorbancia a 647 nm para la muestra de control.
- Medición de la preparación y absorción de muestras
- Preparar las muestras de ensayo mezclando 50 ml de stock de HNB con 950 ml de fracciones proteicas diluidas adecuadamente con el tampón de muestra.
NOTA: Dado que los niveles de contaminación metálica reportados en la literatura varían según un factor de más de 1000 dependiendo de las condiciones de elución16,20, puede ser necesario probar algunas diluciones de las fracciones de proteína ensayadas con el tampón de muestra (véase el paso 1.2.1 anterior) para lograr cambios de absorbancia dentro del rango dinámico del ensayo.
ADVERTENCIA: El níquel y otros metales utilizados en IMAC son irritantes de la piel conocidos, se sospecha que son cancerígenos, y son capaces de dañar los riñones y la sangre después de una exposición prolongada. Se deben utilizar guantes y protección ocular al manipular muestras de proteínas preparadas con IMAC. - Deje que la muestra se incuba durante un mínimo de 3 minutos a temperatura ambiente y mida las absorbancias a 647 nm.
NOTA: El paso limitante del ensayo en términos de tiempo invertido es el paso de incubación. Los datos de este papel se recopilaron utilizando una sola cubeta de cuarzo que se lavó cuidadosamente entre cada muestra. Incluso con el tiempo de lavado añadido y la preparación del stock de HNB, la recolección de datos para 14 muestras y el control tomó aproximadamente una hora y media y como tal, el protocolo se puede completar fácilmente sin necesidad de interrupción. - Repita los pasos 2.3.1 y 2.3.2 para cada fracción que se mida.
NOTA: Si se utilizarán varias cubetas para múltiples muestras, las muestras deben prepararse de manera que permita un tiempo de incubación comparable y una exposición a la luz ambiental.
- Preparar las muestras de ensayo mezclando 50 ml de stock de HNB con 950 ml de fracciones proteicas diluidas adecuadamente con el tampón de muestra.
3. Cuantificación de metales
- Determinar la concentración de metal en cada muestra
- Encuentre la diferencia de cada absorbancia de muestra a 647 nm del control HNB.
- Determinar la concentración de metales (en M) utilizando la siguiente fórmula:

donde df es el factor de dilución para la fracción de ensayo, el Valor647 es el cambio de absorbancia a 647 nm, 3.65x10-2 representa el coeficiente de extinción de HNB (36,5 mM-1cm-1 ver referencia20 para más detalles) y l es la trayectoria óptica de la cubeta en cm.
Resultados
El espectro de HNB libre a pH neutro (línea negra) y espectros representativos de fracciones saysaying para Ni2+ desde el aislamiento de MSP1E3D129 se muestran en la Figura 2. Una serie de ensayos exitosa debe demostrar una disminución de la absorbancia a 647 nm en comparación con el control HNB, que corresponde a la formación de complejos HNB en presencia de un metal de transición. Un ensayo fallido se indicaría mediante un aumento de la absorbancia de 647 nm. Alternativamente, más del 90% de disminución de la absorbancia inicial a 647 nm indicaría un contenido de metal demasiado alto y una necesidad de ensayo de fracciones más diluidas. Un ensayo sin cambios de absorbancia del control HNB libre no indica necesariamente un error. Es posible que las muestras no contengan esencialmente metales lixiviados. Sin embargo, esto es poco probable y cualquier muestra que no muestre ningún cambio de absorbancia debe prepararse y medirse de nuevo, preferiblemente con menos dilución, para confirmar el resultado. En total, la mayoría de las fallas en observar el cambio de absorbancia esperado se pueden atribuir a pipeteo inadecuado durante la preparación de la muestra, un tiempo de incubación inadecuado antes de la medición o valores de pH fuera del rango recomendado de 7-12.
Para demostrar la aplicación de este ensayo, analizamos 2 proteínas de andamios de membrana de hisetiqueta MSP1E3D1 (aisladas como en Denisov,29), MSP2N2 (aislado como en Grinkova, Y. V.30) y una novela 3-heme c-type csu0105 de Geobacter sulfurreducens, que se expresó recombinantemente en E.coli y eluida con 500 mM de imidazol. Los perfiles de elución de Ni2+ de una columna de resina Ni-NTA (ver Tabla de Materiales)y los perfiles de elución de proteínas asociados para estas 3 proteínas se muestran en la Figura 3. Cualquier proteína tendrá una elución de níquel única que puede o no alinearse con el perfil de elución de proteína según se mide a 280 nm. Por ejemplo, la Figura 3C muestra que la proteína y el contenido de Ni2+ de cada fracción para GSU0105 se desplazan significativamente entre sí, mientras que las fracciones de MSP1E3D1 y MSP2N2(Figura 3A,B) que contienen la mayor cantidad de proteína también tienen el contenido más alto de Ni2+. La Figura 3A,B también ilustra que el contenido metálico puede no distribuirse uniformemente entre las fracciones recopiladas mediante IMAC. Dependiendo del embalaje de la columna, la composición del tampón de elución, el equipo de bombeo y las condiciones, es posible tener eluto metálico en fracciones consecutivas a concentraciones muy diferentes independientes del contenido proteico de esas fracciones.

Figura 1: Estructura del azul hidroxinaphthol (HNB). En el rango de pH funcional del ensayo, todos los grupos de sulfonato y uno de los grupos hidroxilo están ionizados. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Espectros de absorción para fracciones MSP1E3D1 seleccionadas y HNB. Se muestra la absorbancia relativa de tres fracciones de MSP1E3D1 (colores) en comparación con un control HNB (línea gruesa negra). Se prepararon muestras en Tris de 20 mM, pH 7,5. Haga clic aquí para ver una versión más grande de esta figura.
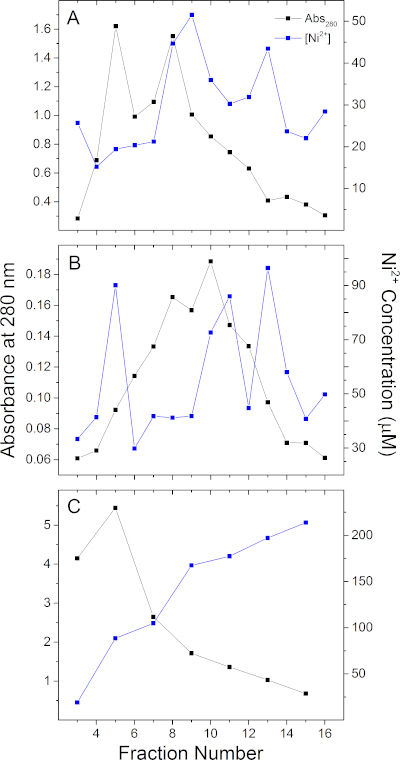
Figura 3: Ni2+ cuantificación para 3 proteínas representativas De etiqueta. Perfiles de elución de proteínas y Ni2+ para (A) MSP1E3D1, (B) MSP2N2 y (C) GSU0105. La elución de proteínas se realizó utilizando 300 mM, 300 mM y 500 mM de imidazol, respectivamente. Ni2+ cuantificación se realizó en Tris de 20 mM, pH 7.5. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La detección colorimétrica de metales mediante HNB proporciona una forma sencilla de cuantificar el grado de contaminación de proteínas mediante la transición de iones metálicos de resinas IMAC. Como establecimos en la Ref. 20, Ni2+ se une a HNB con estequiometría 1:1 y la constante de disociación para los cambios complejos de Ni-HNB con pH. Sin embargo, el complejo Kd está en el rango sub-nM para todos los valores de pH recomendados (7-12). En términos prácticos, significa que todos los Ni2+ en cualquier fracciones probadas se unirán a HNB siempre y cuando no haya otros reactivos quelantes fuertes, como EDTA. Todas estas propiedades juntas dan como resultado curvas lineales de valoración Ni2+, que observamos experimentalmente. En ese informe20,también establecimos que los cambios espectrales debidos a la formación compleja de tinte metálico serán los mismos en todo el rango de pH 7-12. La detección está limitada por las mediciones mínimas de cambio de absorbancia fiables (10-4 – 10-3 OD dependiendo del espectrofotómetro utilizado) correspondientes a 2,7-27 nM Ni2+. El rango superior está limitado por la cantidad de HNB presente. En nuestro trabajo, utilizamos 15 m, correspondientea a 0,6 oD a 647 nm. Sin embargo, esto se puede aumentar hasta 50-80 M HNB, si es necesario. Prácticamente, observamos niveles de contaminación de Ni2+ en fracciones cromatográficas comparables o superiores al límite superior, obligándonos a hacer diluciones de 10 a 50 veces de fracciones ensayadas. Sin embargo, este paso de dilución adicional puede aumentar los errores relativos mientras determina la concentración de níquel en una fracción.
Aunque no hemos investigado los detalles, parecía que la unión de otros metales utilizados en resinas IMAC (Co, Zn, Fe) también tiene constantes de disociación de sub-M y prácticamente no hay superposición entre el tinte y los espectros de absorción de metal de tinte a 647 nm, la longitud de onda máxima de la HNB. Por lo tanto, la unión completa de metal al tinte y los cambios espectrales asociados del tinte se pueden utilizar para la determinación absoluta del metal en todo el rango de pH recomendado.
La ejecución del protocolo es sencilla y depende en gran medida de la técnica de laboratorio adecuada. Los espectrofotómetros modernos tienen respuestas altamente lineales y rangos dinámicos de 3-4 órdenes de magnitud. Por consiguiente, el lugar más probable para la introducción del error en el método es a través de los pasos de pipeteo para la preparación de la muestra. Como se describe en este texto, el método se basa en la cuantificación del contenido de metal basado en la diferencia en el pico de absorbancia HNB a 647 nm de un control HNB libre y muestras con HNB complejo con un metal. Si no se tiene cuidado de pipetear con precisión las alícuotas HNB o los volúmenes de tampón, la comparación del control y las absorbancias de la muestra a 647 nm se convierte en un punto de error. Del mismo modo, un pipeteo deficiente de fracciones proteicas para la preparación de la muestra puede sesgar la concentración percibida de metal en una fracción. Se recomienda calibrar, debido a la sensibilidad del ensayo, las pipetas que se utilicen para los análisis en los que se requiera una cuantificación precisa antes de su uso.
Las limitaciones principales del método vienen con el rango de pH funcional del ensayo y la presencia de agentes quelantes fuertes. El ensayo se utiliza mejor en un rango de pH de 7-12. Por debajo del pH 7, el espectro del tinte HNB libre cambia, perdiendo el pico en 647 nm utilizado para la cuantificación20. Por encima del pH 12, muchos hidróxidos metálicos comienzan a precipitarse, incluyendo los de metales comúnmente encontrados en resinas IMAC, haciendo que la cuantificación sea más lenta y menos reproducible. Si bien el máximo alcalino no plantea un problema significativo, ya que los procedimientos de purificación rara vez requieren un pH tan alto, es más probable que el mínimo ácido sea un factor limitante. Dado que los límites de detección de Ni2+ y otros metales de transición son aproximadamente 1000 veces inferiores a los niveles de contaminación metálica demostrados anteriormente(Figura 3),el límite de pH bajo para el ensayo puede eludirse mediante la dilución de las fracciones de proteínaádica ensayadas en tampones con valores de pH neutros y una capacidad de amortiguación suficientemente alta. Alternativamente, el pH de las fracciones analizadas se puede ajustar o la solución de stock HNB se puede almacenar más fuertemente para mantener el pH deseado después de la mezcla.
Si el procedimiento de aislamiento de la proteína que se está purificando requiere el uso de reactivos con propiedades quelantantes de metales de transición conocidas o sospechosas, sería necesaria una modificación del método para permitir una cuantificación adecuada de los metales lixiviados. Sería necesario preparar una curva estándar utilizando el agente quelante utilizado para la elución de proteínas y las concentraciones conocidas de normas metálicas para cuantificar con precisión la concentración de metal lixiviado en presencia del quelante. Un ejemplo de cuantificación de metales en presencia de histidina está disponible en Kokhan & Marzolf20.
La cuantificación precisa de metales en muestras biológicas sigue dependiendo en gran medida del uso de técnicas analíticas e instrumentación, como AAS e ICP-MS, que permanecen fuera del ámbito del bioquímico típico31,32. Bonta et al. han descrito la simple preparación de muestras biológicas en papel de filtro común para su análisis por ICP-MS, sin embargo, su método todavía se basa en la instrumentación no estándar para un bioquímico31. El método que describimos permite la medición del contenido metálico en una muestra que se debe tomar sin formación adicional sobre nueva instrumentación o externalización a otros. Se han desarrollado protocolos colorimétricos similares para el análisis de metales en muestras biológicas33. Sin embargo, el método descrito por Shaymal y otros33 se basa en un ensayo de fluorescencia utilizando una sonda fluorescente comercialmente no disponible que da un límite de detección más alto que el de este documento. Teniendo en cuenta la relativa facilidad por la cual se puede realizar el método descrito y el reciente interés en el desarrollo de protocolos portátiles de detección de metales para muestras acuosas34,35,podría adaptarse fácilmente para las pruebas de campo de muestras de agua. Como prueba portátil, nuestro método podría modificarse para su uso con un espectrofotómetro portátil para la cuantificación o como medida cualitativa para identificar muestras para su posterior análisis en un lugar de prueba fijo.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este material se basa en el trabajo apoyado por la National Science Foundation bajo Grant MCB-1817448 y por un premio de Thomas F. y Kate Miller Jeffress Memorial Trust, Bank of America, Trustee y donante especificado Hazel Thorpe Carman y George Gay Carman Confianza.
Materiales
| Name | Company | Catalog Number | Comments |
| 2xYT broth | Fisher Scientific | BP9743-500 | media for E.coli growth |
| HEPES, free acid | BioBasic | HB0264 | alternative buffer |
| HisPur Ni-NTA resin | Thermo Scientific | 88222 | |
| Hydroxynaphthol blue disoidum salt | Sigma-Aldrich | 219916-5g | |
| Imidazole | Fisher Scientific | O3196-500 | |
| Imidazole | BioBasic | IB0277 | |
| MOPS, free acid | BioBasic | MB0360 | alternative buffer |
| Sodium chloride | Fisher Scientific | S271-500 | |
| Sodium phosphate | Fisher Scientific | S369-500 | alternative buffer |
| Tricine | Gold Bio | T870-100 | |
| Tris base | Fisher Scientific | BP152-500 | |
| Triton X-100 | Sigma-Aldrich | T9284-500 |
Referencias
- Porath, J., Carlsson, J. A. N., Olsson, I., Belfrage, G. Metal chelate affinity chromatography, a new approach to protein fractionation. Nature. 258 (5536), 598-599 (1975).
- Block, H., et al. Immobilized-Metal Affinity Chromatography (IMAC): A Review. Methods in Enzymology. 463, 439-473 (2009).
- Takeda, N., Matsuoka, T., Gotoh, M. Potentiality of IMAC as sample pretreatment tool in food analysis for veterinary drugs. Chromatographia. 72 (1/2), 127-131 (2010).
- Felix, K., et al. Identification of serum proteins involved in pancreatic cancer cachexia. Life sciences. 88 (5-6), 218-225 (2011).
- Wu, C., et al. Surface enhanced laser desorption/ionization profiling: New diagnostic method of HBV-related hepatocellular carcinoma. Journal of Gastroenterology and Hepatology. 24 (1), 55-62 (2009).
- Goldsmith, J. O., Boxer, S. G. Rapid isolation of bacterial photosynthetic reaction centers with an engineered poly-histidine tag. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1276 (3), 171-175 (1996).
- Guergova-Kuras, M., et al. Expression and one-step purification of a fully active polyhistidine-tagged cytochrome bc1 complex from Rhodobacter sphaeroides. Protein Expression and Purification. 15 (3), 370-380 (1999).
- Mitchell, D. M., Gennis, R. B. Rapid purification of wildtype and mutant cytochrome c oxidase from Rhodobacter sphaeroides by Ni(2+)-NTA affinity chromatography. FEBS Letters. 368 (1), 148-150 (1995).
- Tian, H., White, S., Yu, L., Yu, C. A. Evidence for the head domain movement of the rieske iron-sulfur protein in electron transfer reaction of the cytochrome bc1 complex. Journal of Biological Chemistry. 274 (11), 7146-7152 (1999).
- Tian, H., Yu, L., Mather, M. W., Yu, C. A. Flexibility of the neck region of the rieske iron-sulfur protein is functionally important in the cytochrome bc1 complex. Journal of Biological Chemistry. 273 (43), 27953-27959 (1998).
- Louie, A. Y., Meade, T. J. Metal complexes as enzyme inhibitors. Chemical Reviews. 99 (9), 2711-2734 (1999).
- Tamás, M. J., Sharma, S. K., Ibstedt, S., Jacobson, T., Christen, P. Heavy Metals and Metalloids As a Cause for Protein Misfolding and Aggregation. Biomolecules. 4 (1), 252-267 (2014).
- Gerencser, L., Maroti, P. Retardation of proton transfer caused by binding of the transition metal ion to the bacterial reaction center is due to pKa shifts of key protonatable residues. Biochemistry. 40 (6), 1850-1860 (2001).
- Klishin, S. S., Junge, W., Mulkidjanian, A. Y. Flash-induced turnover of the cytochrome bc1 complex in chromatophores of Rhodobacter capsulatus: binding of Zn2+ decelerates likewise the oxidation of cytochrome b, the reduction of cytochrome c1 and the voltage generation. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1553 (3), 177-182 (2002).
- Link, T. A., von Jagow, G. Zinc ions inhibit the QP center of bovine heart mitochondrial bc1 complex by blocking a protonatable group. Journal of Biological Chemistry. 270 (42), 25001-25006 (1995).
- Block, H., Kubicek, J., Labahn, J., Roth, U., Schäfer, F. Production and comprehensive quality control of recombinant human Interleukin-1beta: a case study for a process development strategy. Protein Expression and Purification. 57 (2), 244-254 (2008).
- Kokhan, O., Shinkarev, V. P., Wraight, C. A. Binding of imidazole to the heme of cytochrome c1 and inhibition of the bc1 complex from Rhodobacter sphaeroides: II. Kinetics and mechanism of binding. Journal of Biological Chemistry. 285 (29), 22522-22531 (2010).
- Kokhan, O., Shinkarev, V. P., Wraight, C. A. Binding of imidazole to the heme of cytochrome c1 and inhibition of the bc1 complex from Rhodobacter sphaeroides: I. Equilibrium and modeling studies. Journal of Biological Chemistry. 285 (29), 22513-22521 (2010).
- Bornhorst, J. A., Falke, J. J. Purification of proteins using polyhistidine affinity tags. Methods in Enzymology. 326, 245-254 (2000).
- Kokhan, O., Marzolf, D. R. Detection and quantification of transition metal leaching in metal affinity chromatography with hydroxynaphthol blue. Analytical Biochemistry. 582, 113347 (2019).
- Doyle, C., Naser, D., Bauman, H., Rumfeldt, J., Meiering, E. Spectrophotometric method for simultaneous measurement of zinc and copper in metalloproteins using 4-(2-pyridylazo)resorcinol. Analytical Biochemistry. 579, 44-56 (2019).
- Furrer, J., Smith, G. S., Therrien, B., Gasser, G. . Inorganic Chemical Biology. , (2014).
- Hogeling, S. M., Cox, M. T., Bradshaw, R. M., Smith, D. P., Duckett, C. J. Quantification of proteins in whole blood, plasma and DBS, with element-labelled antibody detection by ICP-MS. Analytical Biochemistry. 575, 10-16 (2019).
- Yamasaki, S., Tsumura, A., Takaku, Y. Ultratrace Elements in Terrestrial Water as Determined by High-Resolution ICP-MS. Microchemical Journal. 49 (2), 305-318 (1994).
- Brittain, H. G. Complex Formation Between Hydroxy Naphthol Blue and First Row Transition Metal Cyanide Complexes. Analytical Letters. 10 (13), 1105-1113 (1977).
- Brittain, H. G. Binding of Transition Metal Ions by the Calcium Indicator Hydroxy Naphthol Blue. Analytical Letters. 11 (4), 355-362 (1978).
- Temel, N. K., Sertakan, K., Gürkan, R. Preconcentration and Determination of Trace Nickel and Cobalt in Milk-Based Samples by Ultrasound-Assisted Cloud Point Extraction Coupled with Flame Atomic Absorption Spectrometry. Biological Trace Element Research. 186 (2), 597-607 (2018).
- Ferreira, S. L. C., Santos, B. F., de Andrade, J. B., Costa, A. C. S. Spectrophotometric and derivative spectrophotometric determination of nickel with hydroxynaphthol blue. Microchimica Acta. 122 (1), 109-115 (1996).
- Denisov, I. G., Grinkova, Y. V., Lazarides, A. A., Sligar, S. G. Directed Self-Assembly of Monodisperse Phospholipid Bilayer Nanodiscs with Controlled Size. Journal of the American Chemical Society. 126 (11), 3477-3487 (2004).
- Grinkova, Y. V., Denisov, I. G., Sligar, S. G. Engineering extended membrane scaffold proteins for self-assembly of soluble nanoscale lipid bilayers. Protein Engineering, Design and Selection. 23 (11), 843-848 (2010).
- Bonta, M., Hegedus, B., Limbeck, A. Application of dried-droplets deposited on pre-cut filter paper disks for quantitative LA-ICP-MS imaging of biologically relevant minor and trace elements in tissue samples. Analytica Chimica Acta. 908, 54-62 (2016).
- Olmedo, P., et al. Validation of a method to quantify chromium, cadmium, manganese, nickel and lead in human whole blood, urine, saliva and hair samples by electrothermal atomic absorption spectrometry. Analytica Chimica Acta. 659 (1), 60-67 (2010).
- Shyamal, M., et al. Highly Selective Turn-On Fluorogenic Chemosensor for Robust Quantification of Zn(II) Based on Aggregation Induced Emission Enhancement Feature. ACS Sensors. 1 (6), 739-747 (2016).
- Kudo, H., Yamada, K., Watanabe, D., Suzuki, K., Citterio, D. Paper-Based Analytical Device for Zinc Ion Quantification in Water Samples with Power-Free Analyte Concentration. Micromachines. 8 (4), 127 (2017).
- Liu, R., Zhang, P., Li, H., Zhang, C. Lab-on-cloth integrated with gravity/capillary flow chemiluminescence (GCF-CL): towards simple, inexpensive, portable, flow system for measuring trivalent chromium in water. Sensors and Actuators B: Chemical. 236 (C), 35-43 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados