Method Article
固定化金属アフィニティークロマトグラフィーにおける金属浸出の定量
要約
固定化金属アフィニティークロマトグラフィーを用いて調製した試料に導入した金属を容易に定量するためのアッセイを提示する。この方法は、比色金属指標としてヒドロキシナフトールブルーを使用し、UV-Vis分光光度計を検出器として使用する。
要約
固定化金属アフィニティークロマトグラフィー(IMAC)カラムから浸出した金属を含む酵素の汚染は、IMAC樹脂に使用される一般的な二価陽イオンの多くが酵素に対する阻害効果を有するので、酵素学者にとって大きな懸念事項です。しかし、金属浸出の程度と種々の溶出および還元試薬の影響は、一般的に利用可能な機器を使用するシンプルで実用的な遷移金属定量プロトコルがないため、大部分は十分に理解されていません。生化学研究室この問題に対処するために、精製工程としてIMACを用いて調製したサンプル中の金属汚染量を迅速に定量化するプロトコルを開発しました。この方法は、647nmにおけるHNBスペクトルの変化に基づいて、サンプル溶液中の金属カチオン含有量の比色指標としてヒドロキシナフトールブルー(HNB)を使用し、UV-Vis分光法を使用して、存在する金属の量を定量する手段として、ナノモル範囲に含まれる。溶液中の金属含有量は、原子吸光分光法または誘導結合プラズマ技術を使用して歴史的に決定されてきましたが、これらの方法は、典型的な生化学研究所の範囲外の特殊な機器とトレーニングを必要とします。ここで提案される方法は、生化学者が正確性を犠牲にすることなく、既存の装置と知識を使用してサンプルの金属含有量を決定するための簡単かつ迅速な方法を提供します。
概要
ポラスと同僚1による創業以来、固定化金属アフィニティークロマトグラフィー(IMAC)は、Zn2+、Ni2+、Cu2+、Co2+などの遷移金属イオンと結合する能力に基づいてタンパク質を迅速に分離する方法となっています。これは、最も一般的に設計されたポリヒスチジンタグを介して行われ、現在、組換えタンパク質2の分離のための最も一般的なクロマトグラフィー精製技術の一つです。IMACはまた、食品サンプル分析3のためのキノロン、テトラサイクリン、アミノグリコシド、マクロライド、およびβラクタムを単離する方法として組換えタンパク質精製を超えるアプリケーションを発見し、肝臓および膵臓癌のための血清タンパク質マーカーを同定するステップとして4、5.当然のことながら、IMACはまた、多くの天然生物エネルギー酵素6、7、8、9、10の単離のための選択の方法となっている。しかしながら、酵素活性バイオエネルギータンパク質に関する研究のためのこれらの精製方法の成功した実施は、カラムマトリックスから溶出物に浸出した金属カチオンのごくわずかなレベルの存在に依存する。IMACで一般的に使用される二価金属陽イオンは、低濃度11、12であっても病理学的生物学的意義を知っている。これらの金属の生理学的効果は、細胞呼吸または光合成13、14、15の阻害剤として致死性を証明することができる生物エネルギー系で最も顕著である。同様の問題は、残留汚染物質金属がタンパク質の生物学的機能や生化学的および生物物理学的手法による特徴付けを妨げる可能性のあるタンパク質クラスの大半では避けられない。
酸化条件下での金属汚染のレベルとイミダゾールを溶出剤として使用することは一般的に低い16ですが、システイン還元剤(DTT、β-メルカプトエタノールなど)の存在下で行われるタンパク質分離、またはヒスチジン17、18またはエチレンジアミンテトラ酢酸(EDTA)のようなより強いキレート剤を用いて行われるタンパク質分離は、金属汚染のはるかに高いレベルをもたらす。同様に、IMAC樹脂中の金属イオンはカルボン酸基によって頻繁に協調するため、酸性条件下で行われるタンパク質溶離物も、はるかに高いレベルの金属汚染を有する可能性が高い。溶液中の金属含有量は、ppb-ppt範囲21、22、23、24における検出限界まで原子吸光分析(AAS)および誘導結合プラズマ質量分析(ICP-MS)を用いて評価することができる。残念ながら、AASとICP-MSは、これらの方法は、特殊な機器やトレーニングへのアクセスを必要とするので、従来の生化学ラボで検出するための現実的な手段ではありません。
Brittain25,26による以前の研究は、溶液中の遷移金属の存在を同定する方法としてヒドロキシナフトールブルー(HNB)の使用を調査した。しかし、データ20にはいくつかの内部矛盾があり、それらの作品は適切なプロトコルを提供できませんでした。Temel et al.27および Ferreiraら28による研究は、潜在的な金属指標として HNB とのブリタインの研究に拡大しました。.しかし、Temel は、HNB をキレート剤としてのみ使用して、サンプル分析に AAS を使用するプロトコルを開発しました。フェレイラの研究は、563nmにおけるHNB吸光度スペクトルの変化を用いて、pH5.7におけるHNB金属錯体のスペクトルと重なり合う自由色素HNBスペクトルの領域であり、アッセイ感受性をかなり低くし、比較的弱い金属結合親和性20をもたらした。IMACからNi 2+浸出を行うNi2+のラボの問題に対処するために、我々はブリタイン25、26、フェレリア28によって行われた作業を拡大し、いくつかの遷移金属のナノモルレベルを検出することができる簡単なアッセイを開発しました。HNBは、IMAC金属に対してニッケルおよびその他の一般的な結合を亜ナノモル結合親和性と結合し、pH値20の広い範囲にわたって1:1複合体を形成することを示した。ここで報告されるアッセイは、これらの知見に基づいており、金属定量のために647nmのHNBスペクトルの吸光度変化を利用する。このアッセイは、金属色素錯体の比色検出と定量、および金属に結合する際の遊離色素の吸光度の変化を用いて、典型的な生化学ラボで見られる一般的な緩衝液および計装を用いて生理学的pH範囲で行うことができる。
プロトコル
1. アッセイ成分の準備
- 280 nmの光吸光度またはタンパク質定量の代替方法を使用してアッセイするクロマトグラフィー画分を決定し、タンパク質濃縮画分を同定します。
注:この作業では、ダイオードアレイUV-Vis分光度計を使用しました。スループットを高めるために、UV-Vis吸光度を測定できるプレートリーダーを使用できます。 - 必要なアッセイ成分の調製
- 7 ~ 12 の pH を使用して、10 ~ 100 mM バッファー (「サンプル バッファー」) を準備または取得します。
注:中性または塩基性pHにおけるトリス、HEPES、MOPS、リン酸塩などの一般的な生化学的緩衝液はすべてアッセイに適しています。トリシンとヒスチジンは使用できますが、両方とも実質的に金属イオンをキレートするので、較正曲線が必要になります。ヒスチジンのキャリブレーションの例を参照20に示す。 - 調製した原液1ミリリットル当てに対して120mgのHNB試薬を用いて、サンプルバッファー中にヒドロキシナフトールブルー(HNB)分散液の12%w/v(20倍濃縮)溶液を調製します。
注意:眼にHNBの暴露は深刻な損傷と刺激を引き起こす可能性があります。目の保護は、HNBを扱うときに使用する必要があり、ハンドリング後に手を十分に洗浄する必要があります。
注:HNBは、科学試薬の主要サプライヤーによってKCl上の分散として販売されています。そのため、溶液中の実際の濃度は、異なる製造業者、バッチ、およびボトル内のHNB分散液がどこから取られるかによって異なります。理想的には、ストックの20倍希釈後の647 nmで0.5〜0.8の間の吸光度を達成する必要があります。
- 7 ~ 12 の pH を使用して、10 ~ 100 mM バッファー (「サンプル バッファー」) を準備または取得します。
2. サンプル調製と測定
- データ収集のための分光光度計の作成
- UV-Vis分光光度計をオンにしてウォームアップします。分光光度計を設定して、647 nmでデータを収集します。
注:分光光度計で、さらに850nmでデータを収集したり、色素や色素スペクトルに関する大きな変化を伴わずに他の波長を収集したりして、ベースライン補正に使用することができます。 - サンプルバッファを使用して分光光度計を空白にします。
メモ:石英または使い捨てプラスチックキュベットを使用することができます。クォーツキュベットは、使い捨てプラスチックキュベットよりも高い精度と精度を可能にするため、定量分析に適しています。しかし、プラスチックキュベットはUV光を遮断し、一部のダイオードアレイ分光光計の測定ビームに存在し得る。強烈な紫外線へのHNBの暴露は、顕著な色素の劣化と、低速金属結合と混同することができる望ましくない遅い吸光度の低下を引き起こす(例えば、参照20のサポート情報の図1を参照してください)。
- UV-Vis分光光度計をオンにしてウォームアップします。分光光度計を設定して、647 nmでデータを収集します。
- 制御の準備と吸光度測定
- 総アッセイ量の1ミリリットル当たり50μLのHNBストックを含む制御溶液を調製します。すべてのサンプルの良好な混合を確保するために、最初に小さなボリュームをピペットし、次にサンプルバッファを追加し、ピペットで混合します。希釈されたHNB溶液は新鮮に調製する必要がありますが、HNBストックは4°Cで保存し、大幅な劣化なしに数週間光から保護することができます。
- コントロールが室温で最低3分間インキュベートできるようにします。
注:アルカリ性pHのサンプルや、難溶性金属錯体の形成によるリン酸塩の存在下で、より長いインキュベーション時間が必要になる場合があります。 - 制御試料の吸光度を647nmで測定し、記録する。
- 試料の調製・吸光度測定
- 50 μLのHNBストックと950μLの適切に希釈されたタンパク質画分をサンプルバッファと混合してアッセイサンプルを調製します。
注:文献で報告される金属汚染レベルは溶出条件16、20に応じて1000以上の係数によって異なるため、アッセイのダイナミックレンジ内の吸光度変化を達成するために、サンプルバッファ(上記のステップ1.2.1を参照)を使用してアッセイタンパク質画分の希釈を数回試す必要がある場合があります。
注意:IMACで使用されるニッケルおよび他の金属は、発癌性の疑いがある皮膚刺激性が知られており、長期暴露後に腎臓および血液に損傷を与える可能性がある。IMACで調製したタンパク質サンプルを取り扱う際には、手袋と目の保護を使用する必要があります。 - サンプルが室温で最低3分間インキュベートし、647 nmで吸光度を測定できるようにします。
注:投資時間の観点からアッセイの制限ステップは、インキュベーションステップです。この論文のデータは、各サンプルの間に慎重に洗浄された単一の石英キュベットを使用して収集された。HNBストックの洗浄時間と準備を追加しても、14サンプルのデータ収集と制御に約1時間半かかり、プロトコルを中断することなく簡単に完了できます。 - 測定する分数ごとに手順 2.3.1 と 2.3.2 を繰り返します。
注:複数のクベットを複数のサンプルに使用する場合は、サンプルを同等のインキュベーション時間と周囲光への暴露を可能にする方法で調製する必要があります。
- 50 μLのHNBストックと950μLの適切に希釈されたタンパク質画分をサンプルバッファと混合してアッセイサンプルを調製します。
3. 金属定量
- 各サンプル中の金属濃度の決定
- HNBコントロールから647nmで各サンプル吸光度の差を見つけます。
- 以下の式を使用して、金属濃度(μM単位)を決定します。

ここで、DFはアッセイ分数の希釈係数、ΔAbs647は647nmでの吸光度変化、3.65x10-2はHNBの消滅係数を表し(ε=36.5 mM-1・cm-1詳細は参考20参照)、lはcmにおけるキュベットの光経路である。
結果
中性pH(黒線)における遊離HNBのスペクトルと、MSP1E3D129の単離からNi2+に対してアッセイされた分画の代表的なスペクトルを図2に示す。成功したアッセイシリーズは、遷移金属の存在下でHNB複合体の形成に対応するHNB制御と比較して647nmでの吸光度の低下を実証すべきである。失敗したアッセイは、647 nmでの吸光度の増加によって示されるであろう。あるいは、647nmでの初期吸光度から90%以上減少すると、金属含有量が高すぎること、さらに希釈された画分をアッセイする必要があることを示す。フリーHNBコントロールからの吸光度変化のないアッセイは、必ずしも故障を示すものではありません。サンプルには本質的に浸出金属が含まれていない可能性があります。しかしながら、これは可能性が低く、吸光度変化を示さない任意のサンプルを調製し、再び測定し、好ましくは希釈を少なくして、結果を確認する。合計で、予想される吸光度変化を観察するほとんどの失敗は、サンプル調製中の不適切なピペット、測定前の不十分なインキュベーション時間、または推奨される7-12の範囲外のpH値に起因する可能性があります。
このアッセイの応用を実証するために、2つのHisタグ膜足場タンパク質MSP1E3D1(デニソフのように単離された、 I. G. et al.29),MSP2N2 (グリンコバのように単離された, Y. V.30),そして、大腸菌で組換え発現し、500 mMイミダゾールで溶出したジオバクター硫酸還元物から新しい3ヘムc型シトクロムGSU0105.Ni-NTA樹脂カラムからのNi2+の溶出プロファイル(材料表参照)とこれら3種類のタンパク質に関連するタンパク質溶出プロファイルを図3に示す。任意のタンパク質は、280 nmで測定されたタンパク質溶出プロファイルと一致する場合とそうでない場合があるユニークなニッケル溶出を有する。例えば、図3Cは、GSU0105の各画分のタンパク質およびNi2+含有量が互いに有意にシフトしている一方で、最も多くのタンパク質を含むMSP1E3D1およびMSP2N2(図3A、B)の画分も最も高いNi2+含有量を有することを示しています。図3A、Bはまた、IMACを使用して収集された画分間で金属含有量が均等に分布していない可能性があることを示す。カラムパッキングに応じて、溶出緩衝液の組成、ポンプ装置および条件は、それらの画分のタンパク質含有量に依存しない非常に異なる濃度で連続した画分で金属溶出を有することができる。

図1:ヒドロキシナフトールブルー(HNB)の構造。アッセイの機能的pH範囲では、全てのスルホン酸基およびヒドロキシル基の1つがイオン化される。この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:選択したMSP1E3D1分画およびHNBの吸光度スペクトルHNBコントロール(黒い太線)と比較したMSP1E3D1(色)の3画分の相対吸光度が示されています。試料を20mMトリス、pH7.5で調製した。この図の大きなバージョンを表示するには、ここをクリックしてください。
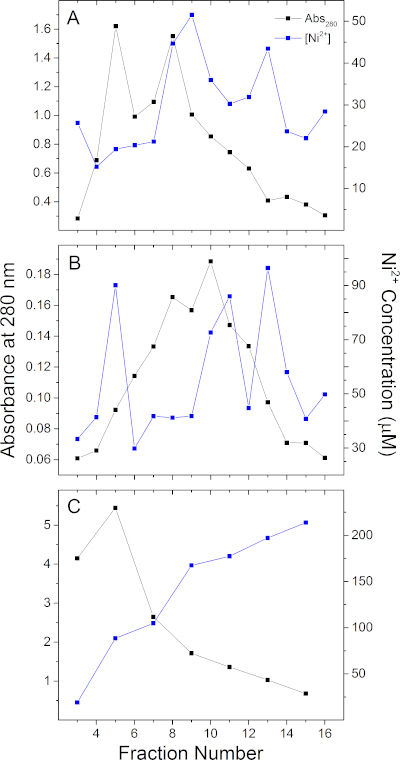
図3:3代表Hisタグタンパク質のNi2+定量プロテインおよびNi2+溶出プロファイル(A)MSP1E3D1、(B)MSP2N2、および(C)GSU0105。タンパク質溶出は、それぞれ300mM、300mM、および500mMイミダゾールを用いて行った。Ni2+定量は、20mMトリス、pH7.5で行った。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
HNBを用いた金属の比色検出は、IMAC樹脂からの金属イオンの遷移によるタンパク質汚染の程度を定量化する簡単な方法を提供します。Ref. 20で確立したように、Ni2+は1:1のストイチオメトリーとpHによるNi-HNB複合体の解離定数を用いてHNBに結合します。ただし、複素 Kdは、すべての推奨 (7-12) pH 値に対してサブ nM 範囲内にあります。実用的には、EDTAのような他の強力なキレート試薬が存在しない限り、任意の試験画分のすべてのNi2+がHNBに結合することを意味します。これらすべての特性を組み合わせることで、線形Ni2+滴定曲線が得られるため、実験的に観察しました。その報告書20では、金属色素複合体形成によるスペクトル変化が7-12pH範囲全体で同じになることを確立した。検出は、2.7-27 nM Ni2+に対応する最小の信頼性の高い吸光度変化測定(使用する分光光度計に応じて10-4~10-3 OD)によって制限されます。上の範囲は、存在するHNBの量によって制限される。私たちの仕事では、647 nmで〜0.6 ODに対応する〜15μMを使用しています。ただし、必要に応じて最大 50 ~ 80 μM HNB まで増やすことができます。実際には、クロマトグラフィー画分のNi2+汚染レベルを、上限以上に観測し、アッセイ画分の10~50倍の希釈を行うことを余儀なくされました。しかし、この追加希釈工程は、分数でニッケル濃度を決定する際に相対的な誤差を増加させることができる。
詳細は調べていないが、IMAC樹脂(Co、Zn、Fe)に使用される他の金属の結合もサブμM解離定数を有し、647nmで染料と色素金属吸光度スペクトルとの間に事実上重複していない、自由のピーク波長HNB.したがって、色素への完全な金属結合および色素の関連するスペクトル変化は、推奨pH範囲全体にわたる絶対金属決定に使用することができる。
プロトコルの実行は簡単で、適切な実験室の技術に最も大きく依存します。現代の分光光度計は、高度に線形応答し、3〜4桁のダイナミックレンジを持っています。したがって、メソッドにエラーが発生する可能性が最も高い場所は、サンプル調製のためのピペットステップを使用することです。このテキストで説明するように、この方法は、遊離HNBコントロールから647nmにおけるHNB吸光度ピークの差に基づく金属含有量の定量に基づくものであり、金属と錯体化したHNBを用いた試料である。HNBアリコートまたは緩衝体積を正確にピペットするように注意を払わない場合、647nmにおける対照とサンプル吸光度の比較は誤差点となる。同様に、サンプル調製のためのタンパク質画分のピペットが不十分な場合、金属の知覚濃度を分画で歪めることができる。アッセイの感度により、正確な定量が必要な分析に使用されるピペットは、使用前に校正することをお勧めします。
この方法の主な制限は、アッセイの機能的なpH範囲および強いキレート剤の存在に付属する。アッセイは7〜12のpH範囲で最もよく利用される。pH7以下では、遊離HNB色素のスペクトルが変化し、定量20に用いる647nmでピークを失う。pH12の上では、IMAC樹脂に一般的に見られる金属を含む多くの金属水酸化物が沈殿し始め、定量が遅くなり、再現性が低下する。アルカリ性最大値は、精製手順がそのような高いpHを求めることはめったにないので重大な問題を引き起こさないが、酸性最小値は制限因子である可能性が高い。Ni2+および他の遷移金属の検出限界は、上記(図3)より約1000倍低いため、アッセイの低いpH限界は、中性pH値と十分に高い緩衝能を有する緩衝能を有する緩衝能を有するバッファー内のアッセイ酸性タンパク質画分の希釈によって回避することができる。あるいは、分析された画分のpHを調整したり、HNB原液を混合後に所望のpHを維持するためにより強く緩衝したりすることができる。
精製されるタンパク質の単離手順で、既知または疑わしい遷移金属キレート特性を有する試薬の使用が必要な場合は、浸出金属の適切な定量を可能にするために方法の改変が必要となる。標準的な曲線は、キレート剤の存在下で浸出金属の濃度を正確に定量するために、タンパク質溶出および金属標準の既知の濃度に使用されるキレート剤を使用して調製する必要があります。ヒスチジンの存在下での金属定量の例は、コカン&マルゾルフ20で利用可能である。
生体試料中の金属の正確な定量は、典型的な生化学者31、32の領域外に残るAASおよびICP-MSなどの分析技術および計装の使用に依然として大きく依存する。Bonta etal.は、ICP-MS による分析のための一般的なフィルターペーパー上の生物学的サンプルの簡単な調製について説明しましたが、その方法は依然として生化学者31の非標準計装に依存しています。私たちが説明する方法は、新しい計装や他の人へのアウトソーシングに関する追加のトレーニングなしでサンプル中の金属含有量の測定を可能にします。同様の比色プロトコルは、生体試料33における金属分析のために開発されている。しかしながら、Shaymal et al.33によって記載される方法は、本論文よりも高い検出限界を与える市販の蛍光プローブを用いた蛍光アッセイに依存している。記載された方法が実行できる相対的な容易さと、水性サンプル34、35に対するポータブル金属検出プロトコルの開発に対する最近の関心を考慮すると、水試料のフィールド試験に容易に適応することができる。ポータブルテストとして、定量用のポータブル分光光度計や、固定試験場所でさらなる分析のためのサンプルを識別するための定性的尺度として使用するために、当社の方法を変更することができます。
開示事項
著者たちは何も開示する必要はない。
謝辞
この資料は、グラントMCB-1817448の下で国立科学財団によってサポートされ、トーマスFとケイトミラージェフリーズ記念信託、バンクオブアメリカ、トラスティと指定ドナーヘーゼルソープカーマンとジョージゲイカーマンからの賞によってサポートされた作品に基づいています信頼。
資料
| Name | Company | Catalog Number | Comments |
| 2xYT broth | Fisher Scientific | BP9743-500 | media for E.coli growth |
| HEPES, free acid | BioBasic | HB0264 | alternative buffer |
| HisPur Ni-NTA resin | Thermo Scientific | 88222 | |
| Hydroxynaphthol blue disoidum salt | Sigma-Aldrich | 219916-5g | |
| Imidazole | Fisher Scientific | O3196-500 | |
| Imidazole | BioBasic | IB0277 | |
| MOPS, free acid | BioBasic | MB0360 | alternative buffer |
| Sodium chloride | Fisher Scientific | S271-500 | |
| Sodium phosphate | Fisher Scientific | S369-500 | alternative buffer |
| Tricine | Gold Bio | T870-100 | |
| Tris base | Fisher Scientific | BP152-500 | |
| Triton X-100 | Sigma-Aldrich | T9284-500 |
参考文献
- Porath, J., Carlsson, J. A. N., Olsson, I., Belfrage, G. Metal chelate affinity chromatography, a new approach to protein fractionation. Nature. 258 (5536), 598-599 (1975).
- Block, H., et al. Immobilized-Metal Affinity Chromatography (IMAC): A Review. Methods in Enzymology. 463, 439-473 (2009).
- Takeda, N., Matsuoka, T., Gotoh, M. Potentiality of IMAC as sample pretreatment tool in food analysis for veterinary drugs. Chromatographia. 72 (1/2), 127-131 (2010).
- Felix, K., et al. Identification of serum proteins involved in pancreatic cancer cachexia. Life sciences. 88 (5-6), 218-225 (2011).
- Wu, C., et al. Surface enhanced laser desorption/ionization profiling: New diagnostic method of HBV-related hepatocellular carcinoma. Journal of Gastroenterology and Hepatology. 24 (1), 55-62 (2009).
- Goldsmith, J. O., Boxer, S. G. Rapid isolation of bacterial photosynthetic reaction centers with an engineered poly-histidine tag. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1276 (3), 171-175 (1996).
- Guergova-Kuras, M., et al. Expression and one-step purification of a fully active polyhistidine-tagged cytochrome bc1 complex from Rhodobacter sphaeroides. Protein Expression and Purification. 15 (3), 370-380 (1999).
- Mitchell, D. M., Gennis, R. B. Rapid purification of wildtype and mutant cytochrome c oxidase from Rhodobacter sphaeroides by Ni(2+)-NTA affinity chromatography. FEBS Letters. 368 (1), 148-150 (1995).
- Tian, H., White, S., Yu, L., Yu, C. A. Evidence for the head domain movement of the rieske iron-sulfur protein in electron transfer reaction of the cytochrome bc1 complex. Journal of Biological Chemistry. 274 (11), 7146-7152 (1999).
- Tian, H., Yu, L., Mather, M. W., Yu, C. A. Flexibility of the neck region of the rieske iron-sulfur protein is functionally important in the cytochrome bc1 complex. Journal of Biological Chemistry. 273 (43), 27953-27959 (1998).
- Louie, A. Y., Meade, T. J. Metal complexes as enzyme inhibitors. Chemical Reviews. 99 (9), 2711-2734 (1999).
- Tamás, M. J., Sharma, S. K., Ibstedt, S., Jacobson, T., Christen, P. Heavy Metals and Metalloids As a Cause for Protein Misfolding and Aggregation. Biomolecules. 4 (1), 252-267 (2014).
- Gerencser, L., Maroti, P. Retardation of proton transfer caused by binding of the transition metal ion to the bacterial reaction center is due to pKa shifts of key protonatable residues. Biochemistry. 40 (6), 1850-1860 (2001).
- Klishin, S. S., Junge, W., Mulkidjanian, A. Y. Flash-induced turnover of the cytochrome bc1 complex in chromatophores of Rhodobacter capsulatus: binding of Zn2+ decelerates likewise the oxidation of cytochrome b, the reduction of cytochrome c1 and the voltage generation. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1553 (3), 177-182 (2002).
- Link, T. A., von Jagow, G. Zinc ions inhibit the QP center of bovine heart mitochondrial bc1 complex by blocking a protonatable group. Journal of Biological Chemistry. 270 (42), 25001-25006 (1995).
- Block, H., Kubicek, J., Labahn, J., Roth, U., Schäfer, F. Production and comprehensive quality control of recombinant human Interleukin-1beta: a case study for a process development strategy. Protein Expression and Purification. 57 (2), 244-254 (2008).
- Kokhan, O., Shinkarev, V. P., Wraight, C. A. Binding of imidazole to the heme of cytochrome c1 and inhibition of the bc1 complex from Rhodobacter sphaeroides: II. Kinetics and mechanism of binding. Journal of Biological Chemistry. 285 (29), 22522-22531 (2010).
- Kokhan, O., Shinkarev, V. P., Wraight, C. A. Binding of imidazole to the heme of cytochrome c1 and inhibition of the bc1 complex from Rhodobacter sphaeroides: I. Equilibrium and modeling studies. Journal of Biological Chemistry. 285 (29), 22513-22521 (2010).
- Bornhorst, J. A., Falke, J. J. Purification of proteins using polyhistidine affinity tags. Methods in Enzymology. 326, 245-254 (2000).
- Kokhan, O., Marzolf, D. R. Detection and quantification of transition metal leaching in metal affinity chromatography with hydroxynaphthol blue. Analytical Biochemistry. 582, 113347 (2019).
- Doyle, C., Naser, D., Bauman, H., Rumfeldt, J., Meiering, E. Spectrophotometric method for simultaneous measurement of zinc and copper in metalloproteins using 4-(2-pyridylazo)resorcinol. Analytical Biochemistry. 579, 44-56 (2019).
- Furrer, J., Smith, G. S., Therrien, B., Gasser, G. . Inorganic Chemical Biology. , (2014).
- Hogeling, S. M., Cox, M. T., Bradshaw, R. M., Smith, D. P., Duckett, C. J. Quantification of proteins in whole blood, plasma and DBS, with element-labelled antibody detection by ICP-MS. Analytical Biochemistry. 575, 10-16 (2019).
- Yamasaki, S., Tsumura, A., Takaku, Y. Ultratrace Elements in Terrestrial Water as Determined by High-Resolution ICP-MS. Microchemical Journal. 49 (2), 305-318 (1994).
- Brittain, H. G. Complex Formation Between Hydroxy Naphthol Blue and First Row Transition Metal Cyanide Complexes. Analytical Letters. 10 (13), 1105-1113 (1977).
- Brittain, H. G. Binding of Transition Metal Ions by the Calcium Indicator Hydroxy Naphthol Blue. Analytical Letters. 11 (4), 355-362 (1978).
- Temel, N. K., Sertakan, K., Gürkan, R. Preconcentration and Determination of Trace Nickel and Cobalt in Milk-Based Samples by Ultrasound-Assisted Cloud Point Extraction Coupled with Flame Atomic Absorption Spectrometry. Biological Trace Element Research. 186 (2), 597-607 (2018).
- Ferreira, S. L. C., Santos, B. F., de Andrade, J. B., Costa, A. C. S. Spectrophotometric and derivative spectrophotometric determination of nickel with hydroxynaphthol blue. Microchimica Acta. 122 (1), 109-115 (1996).
- Denisov, I. G., Grinkova, Y. V., Lazarides, A. A., Sligar, S. G. Directed Self-Assembly of Monodisperse Phospholipid Bilayer Nanodiscs with Controlled Size. Journal of the American Chemical Society. 126 (11), 3477-3487 (2004).
- Grinkova, Y. V., Denisov, I. G., Sligar, S. G. Engineering extended membrane scaffold proteins for self-assembly of soluble nanoscale lipid bilayers. Protein Engineering, Design and Selection. 23 (11), 843-848 (2010).
- Bonta, M., Hegedus, B., Limbeck, A. Application of dried-droplets deposited on pre-cut filter paper disks for quantitative LA-ICP-MS imaging of biologically relevant minor and trace elements in tissue samples. Analytica Chimica Acta. 908, 54-62 (2016).
- Olmedo, P., et al. Validation of a method to quantify chromium, cadmium, manganese, nickel and lead in human whole blood, urine, saliva and hair samples by electrothermal atomic absorption spectrometry. Analytica Chimica Acta. 659 (1), 60-67 (2010).
- Shyamal, M., et al. Highly Selective Turn-On Fluorogenic Chemosensor for Robust Quantification of Zn(II) Based on Aggregation Induced Emission Enhancement Feature. ACS Sensors. 1 (6), 739-747 (2016).
- Kudo, H., Yamada, K., Watanabe, D., Suzuki, K., Citterio, D. Paper-Based Analytical Device for Zinc Ion Quantification in Water Samples with Power-Free Analyte Concentration. Micromachines. 8 (4), 127 (2017).
- Liu, R., Zhang, P., Li, H., Zhang, C. Lab-on-cloth integrated with gravity/capillary flow chemiluminescence (GCF-CL): towards simple, inexpensive, portable, flow system for measuring trivalent chromium in water. Sensors and Actuators B: Chemical. 236 (C), 35-43 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved