Method Article
Fraccionamento subcelular de células crônicas primárias de leucemia linfocítica para monitorar o tráfico de proteínas nucleares/citoplasmáticas
Neste Artigo
Resumo
Este protocolo permite a otimização e a geração eficiente subseqüente de frações nucleares e cytoplasmic das pilhas crônicas primárias da leucemia lymphocytic. Estas amostras são usadas para determinar a localização da proteína assim como mudanças no tráfico da proteína que acontecem entre os compartimentos nucleares e cytoplasmic em cima da estimulação da pilha e do tratamento da droga.
Resumo
A exportação nuclear de macromoléculas é muitas vezes desegulada em células cancerosas. As proteínas do supressor do tumor, tais como p53, podem ser tornados inativos devido à localização celular aberrante que interrompe seu mecanismo da ação. A sobrevida de células Crônicas de leucemia linfocítica (LLC), entre outras células cancerosas, é assistida pela desregulamentação de shuttling nuclear para citoplasma, pelo menos em parte através da desregulação do receptor de transporte XPO1 e a ativação constitutiva de Vias de sinalização mediadas por PI3K. É essencial compreender o papel das proteínas individuais no contexto de sua localização intracelular para obter uma compreensão mais profunda do papel de tais proteínas na patología da doença. Além disso, a identificação de processos que sustentam a estimulação celular e o mecanismo de ação de inibidores farmacológicos específicos, no contexto do tráfico de proteínas subcelulares, proporcionará uma compreensão mais abrangente do mecanismo de Ação. O protocolo descrito aqui permite a optimização e a geração eficiente subseqüente de frações nucleares e cytoplasmic das pilhas crônicas primárias da leucemia lymphocytic. Essas frações podem ser usadas para determinar mudanças no tráfico de proteínas entre as frações nuclear e citoplasmática após estimulação celular e tratamento medicamentoso. Os dados podem ser quantificados e apresentados em paralelo com as imagens imunofluorescentes, proporcionando assim dados robustos e quantificáveis.
Introdução
O transporte de macromoléculas entre o núcleo e o citoplasma tem sido estabelecido há muito tempo para desempenhar um papel fundamental na função celular normal e muitas vezes é desegulado em células cancerosas1,2. Tal desregulação pode resultar de superexpressão/mutação de proteínas que controlam a exportação nuclear. Uma dessas proteínas exportin-1 (XPO1), é um receptor de transporte que exporta > 200 proteínas contendo o sinal de exportação nuclear (NES) para o citoplasma do núcleo2. XPO1-cargas incluemp53, membrosda família Foxo e IB, contribuindo para sua inativação inibindo seu mecanismo de ação1,2,3. A deslocalização da proteína mais adicional pode ocorrer quando os sinais microambientais impinge em cima das pilhas de cancro, conduzindo à ativação de vias de sinalização intracelular tais como a via do Phosphatidyl-inositol-3-kinase (PI3K)/Akt, tendo por resultado inativação de membros da família Foxo e subsequente exportação do núcleo4,5. Tal seu de proteínas do supressor do tumor foi implicada na progressão de um número de tumores hematológicos e contínuos1,2,6.
O desenvolvimento de inibidores pequenos da molécula para o uso clínico em malignidades hematológicas (leucemia Myeloid aguda (AML)/CLL), que ligam e inibem seletivamente a função XPO1, sublinha a importância de desenvolver técnicas apropriadas para endereçar o impacto dos agentes farmacológicos no shuttling das proteínas entre os compartimentos nucleares e cytoplasmic6,7,8. As técnicas da imagem latente avançaram significativamente permitindo a identificação das proteínas em compartimentos subcellular em cima da estimulação externa de tratamentos da droga, entretanto, a importância de técnicas paralelas robustas e de suporte é crítica para confiantemente informar um público científico da validade de um resultado.
Linfócitos em repouso e células CLL-B malignas isoladas de amostras de sangue do paciente representam um desafio na geração de frações nucleares e citoplasmáticas devido à alta relação nuclear: citoplasmática. A otimização das condições experimentais para gerar dados experimentais robustos e confiáveis é, naturalmente, crítica para planejar futuros programas experimentais. O método descrito aqui possibilita a quantificação de proteínas nas frações nuclear e citoplasmática e determina como essas proteínas podem ser impactadas pela estimulação celular e/ou tratamento medicamentoso.
Protocolo
O uso de amostras primárias de pacientes com LLC descritos aqui foi aprovado pelo serviço de ética em pesquisa do oeste da Escócia, NHS Greater Glasgow e Clyde (Reino Unido) e todo o trabalho foi realizado de acordo com as diretrizes aprovadas.
1. isolamento de células CLL de amostras de sangue do paciente
-
Amostras de sangue periférico de pacientes com LLC previamente consentiram são recebidas da clínica em tubos de coleta de sangue de EDTA, acompanhadas pela contagem de células brancas (WCC). Purify as amostras de CLL do sangue periférico de acordo com o WCC. Para o WCC < 40 x 106 Cells/ml, avance para o passo 1.1.1; para WCC ≥ 40 x 106 Cells/ml, avance para o passo 1.1.2.
- Despeje o conteúdo de todos os tubos de sangue de EDTA em um tubo de centrífuga cônico 50 mL e adicione 50 μL de coquetel de enriquecimento de células B humanas por 1 mL de sangue. Incubar à temperatura ambiente (RT) durante 20 min. prossiga para o passo 1.1.2.
- Diluir a amostra em uma proporção de 1:1 com tampão de lavagem de RT CLL (Salin fosfato-tamponado (PBS), 0,5% soro fetal bovino (FBS) e 2 mM EDTA).
- O gradiente de densidade da alíquota RT em um tubo de centrífuga cônico apropriadamente dimensionado para a amostra (10 mL em um tubo de 50 mL para 30 mL de amostra ou 4 mL em um tubo de 15 mL para 10 mL de amostra).
- Cuidadosamente camada a amostra em cima do gradiente de densidade de mídia e centrífuga em 400 x g para 30 min em RT.
Nota: Assegure-se de que o centrifugador esteja em RT antes que as amostras estejam coloc na centrífuga como uma mudança na temperatura conduzirá ao enriquecimento pobre de pilhas mononucleares, e desligue o freio na centrífuga, porque a travagem repentina pode interromper a relação líquida. - Colher suavemente a camada branca de células mononucleares que coletam na interface do gradiente de densidade de mídia e CLL tampão de lavagem, em um fresco 50 mL tubo de centrífuga cônico usando um plástico Pasteur pipeta.
- Adicionar 40 mL de tampão de lavagem CLL à monocamada isolada para lavar as células e centrifugar a 300 x g durante 10 min em RT.
- Descarte o sobrenadante, ressuscitem o pellet sacudendo a parte inferior do tubo, em seguida, repita o passo de lavagem descrito na etapa 1,5.
- Descarte o sobrenadante, ressuscite o pellet como descrito na etapa 1,6, em seguida, ressuscite o pellet em um conjunto de volume de CLL tampão de lavagem (até 40 mL, dependendo do tamanho do pellet celular).
- Conte as células usando o azul do Tripan e um haemocytometer. Em seguida, proceder à citometria de fluxo para verificar a pureza das células CLL.
Nota: Nesta fase, as células CLL podem ser cultivadas em uma concentração de 10 x 106 células/ml em meios de comunicação a serem utilizados em experimentos, e/ou criopreservados em 10% dimetil sulfóxido (DMSO)/FBS para trabalhos futuros em concentrações de até 100 x 106 células/frasco.
2. citometria de fluxo de células CLL
- Etiqueta 12 mm x 75 mm redondos tubos de poliestireno com fundo, conforme descrito na tabela 1.
- Nos tubos 2 – 5, coloque uma gota de contas de compensação e armazene no gelo. Adicionar 1 μL do anticorpo apropriado (anti-CD5, CD19, CD23 ou CD45, como indicado na tabela 1) aos tubos 2 – 5, e incubar no gelo por 20 min, protegido da luz colocando a folha de estanho sobre a cubeta de gelo.
Nota: Estes tubos servem como controles de compensação para a criação do modelo de citometria de fluxo. -
Colocar até 1 x 106 células CLL em tubos 1, 6 e 7, adicionar 2 ml de tampão FACS (PBS + 2% FBS) para cada tubo e centrifugar a 300 x g por 5 min em RT para lavar as células. Descarte o sobrenadante e guarde os tubos contendo pelotas de células no gelo.
- Ressuscitem as pastilhas celulares e acrescentam a combinação adequada de anticorpos às células do tubo 7, conforme instruído na tabela 1, em um volume final de 100 μl com tampão FACS. Os anticorpos são usados em uma concentração apropriada de acordo com as directrizes do fabricante.
- Ressuscitem as pastilhas celulares nos tubos 2 e 6 em 100 μL de tampão FACS.
- Incubar as células no gelo, ao lado dos grânulos manchados nos tubos 2 – 5, protegidos da luz por 20 min.
- Após a incubação, adicione 2 mL de tampão FACS a todos os tubos e Centrifugue a 300 x g durante 5 min em RT para lavar as células. Descarte o sobrenadante e ressuscitem as pelotas do grânulo/pilha delicadamente flicking os tubos.
- Reressuscitar tubos 1-5 em 100 μL de tampão FACS e colocar no gelo até estar pronto para analisar o citometro de fluxo.
- Diluir a solução de DAPI para 0,05-0,2 μg/mL no tampão FACS imediatamente antes da utilização. A concentração óptima pode variar, e a titulação é recomendada.
- Resuspender os tubos 6 e 7 com 100 μL de solução de DAPI diluída e incubar os tubos no gelo durante um mínimo de 5 min para permitir que as células se manchem.
Nota: Nenhuma lavagem mais adicional é necessária porque o DAPI deve estar atual no amortecedor para que as pilhas inoperantes permaneçam etiquetadas. Uma vez que o DAPI foi adicionado, as pilhas devem ser analisadas no citômetro do fluxo dentro de 4 h. - Analise células usando um citometro de fluxo.
3. preparação de frações subcelulares de células CLL
Nota: Ao planejar a set-up experimental, inclua um poço de células não estimuladas/não tratadas das quais o extrato da célula inteira pode ser gerado.
- Realize a estimulação desejada e/ou tratamento medicamentoso da linha celular CLL MEC1 ou células CLL primárias isoladas usando 10 – 20 x 106 células/condição. As células serão então usadas para fraccionamento subcelular (etapas 3,4 & 3,5) ou para gerar extrato de células inteiras (etapa 3,6).
- Preparação de soluções/tubos: Prepare todas as soluções/buffers recentemente no dia do fraccionamento, antes que as células sejam colhidas. Armazene as soluções no gelo até que exigido e use dentro de 4 h da preparação.
- Solução de inibidor de PBS/fosfatase: Prepare os inibidores da fosfatase em PBS diluindo os inibidores da fosfatase 1:20 em 1X PBS (i.e., 0,5 mL de inibidores da fosfatase em 9,5 mL de 1X PBS).
Nota: Assegure-se de que os inibidores da fosfatase não precipitaram. Se um precipitado estiver presente, aqueça a 50 ° c durante 10 min. - Tampão hipotônica: Prepare O tampão hipotônica 1x fazendo uma diluição 1:10 do amortecedor 10x hipotônica na água destilada (isto é, 50 μl do amortecedor de 10x hipotônica em 450 μ L de DH2O).
- 10 mm ditiotreitol (DTT): Prepare 10 mm DTT fazendo uma diluição 1:100 de 1m DTT com água destilada (i.e., 10 μL de 1 M DTT em 990 μL de DH2O).
Nota: DTT é altamente lábil assim que prepare este recentemente cada vez. Evite ciclos repetidos do Freeze/Thaw. - Buffer de Lise completo: Determine quanta reserva é necessária para cada experimento. Cada amostra requer 50 μL de tampão de Lise completa, portanto, adicione 5 μL de DTT de 10 mM (passo 3.2.3) a 44,5 μL de tampão de Lise e, em seguida, adicione 0,5 μL de coquetel de inibidor de protease. Esse valor pode ser dimensionado dependendo do número de amostras no experimento.
- Rotule quatro conjuntos de tubos de microcentrífuga de 1,5 ml para cada estimulação e/ou tratamento medicamentoso para as células recém-estimuladas (etapa 3,3), as frações citoplasmáticas recém-geradas (etapa 3.4.3), as frações nucleares recém-geradas (etapa 3.5.3) e toda a célula lisados (passo 3.6.3). Pre-chill estes tubos do microcentrífuga no gelo até que exigido.
- Solução de inibidor de PBS/fosfatase: Prepare os inibidores da fosfatase em PBS diluindo os inibidores da fosfatase 1:20 em 1X PBS (i.e., 0,5 mL de inibidores da fosfatase em 9,5 mL de 1X PBS).
- Transfira as células para tubos de microcentrífuga 1,5 ml individualmente rotulados e pellet por centrifugação a 200 x g durante 5 min a 4 ° c. Retire o sobrenadante e ressuscita as células em 1 mL de inibidores da PBS/fosfatase gelada (passo 3.2.1). Pellet as células por centrifugação em 200 x g por 5 min a 4 ° c. Retire o sobrenadante e manter as pelotas de células no gelo.
- Preparação de frações citoplasmáticas: Ressuspender suavemente as pastilhas celulares a serem usadas para fraccionamento subcelular em 50 μL de tampão hipotônico 1x (etapa 3.2.2). Incubar as células no gelo por 15 min para permitir que as células inchar.
Nota: O volume de tampão hipotônica usado pode ser aumentado empiricamente dependendo do número de pilha.- Adicionar 0,8-2,5 μL (1:20 a 1:60) de detergente em cada amostra e vórtice no ajuste mais alto por 10 s.
- Para determinar a concentração ideal de detergente a ser usado para um tipo de célula específico para isolar frações nucleares e citoplasmáticas, realize um gradiente de detergente inicialmente. Uma gama de 1:20 a 1:60 (i.e., 2,5 μL a 0,8 μL de detergente em 50 μL de tampão Hipotônico) deve ser adequada.
Nota: se o volume do tampão hipotônico na etapa 3,4 é ajustado, assegure-se de que a relação apropriada do detergente esteja mantida. - Verifique a lise celular observando as células usando um microscópio de contraste de fase antes e depois da adição de detergente. Células inteiras parecem maiores com um núcleo denso e escuro. O citoplasma aparecerá como um halo brilhante em torno do núcleo.
Nota: A Lise apropriada é confirmada ainda mais usando western blotting para analisar proteínas específicas dentro das frações lisadas geradas a partir do gradiente de detergente.
- Para determinar a concentração ideal de detergente a ser usado para um tipo de célula específico para isolar frações nucleares e citoplasmáticas, realize um gradiente de detergente inicialmente. Uma gama de 1:20 a 1:60 (i.e., 2,5 μL a 0,8 μL de detergente em 50 μL de tampão Hipotônico) deve ser adequada.
- Uma vez lisada, Centrifugue as amostras a 14.000 x g por 30 s a 4 ° c.
- Transfira cuidadosamente o sobrenadante para um tubo de microcentrífuga pré-refrigerado e rotulado. Esta fração citoplasmática pode ser armazenada em-80 ° c até que seja necessário para uma análise mais aprofundada. O pellet remanescente contém a fração nuclear (etapa 3,5).
Nota: Evite ciclos repetidos de congelamento/descongelação das amostras.
- Adicionar 0,8-2,5 μL (1:20 a 1:60) de detergente em cada amostra e vórtice no ajuste mais alto por 10 s.
- Preparação de frações nucleares: Ressuscitar cada pellet nuclear em 50 μL de tampão de Lise completa (passo 3.2.4) pipetando para cima e para baixo.
Nota: O volume de tampão de Lise completo pode ser ajustado empiricamente de acordo com o número da célula inicial.- Adicionar 2,5 μL de detergente para solubilizar proteínas associadas à membrana nuclear e ao vórtice no cenário mais alto por 10 s. Incubar as amostras no gelo durante 30 min.
- Vortex no ajuste o mais elevado para 30 s, a seguir Centrifugue as amostras em 14.000 x g por 20 minutos em 4 ° c.
- Transfira o sobrenadante para um tubo de microcentrífuga pré-refrigerado e rotulado. Esta fração nuclear pode ser armazenada em-80 ° c até que exigido para uma análise mais adicional.
Nota: Evite ciclos repetidos de congelamento/descongelação das amostras.
- Preparação de lysates inteiros da pilha (WCL) das pilhas de CLL
Nota: A preparação do extrato da célula inteira pode ser realizada ao mesmo tempo que a preparação das frações nucleares (etapa 3,5).- Ressuscitar o extrato de células inteiras pelotas em 100 μL de tampão de Lise completa (preparado na etapa 3.2.4) por pipetagem para cima e para baixo, em seguida, adicione 5 μL de detergente para garantir a lise celular completa. Incubar as amostras no gelo durante 30 min.
- Vortex no ajuste o mais elevado para 30 s, a seguir Centrifugue as amostras em 14.000 x g por 20 minutos em 4 ° c.
- Transfira o sobrenadante para um tubo de microcentrífuga pré-refrigerado. Este lisado inteiro da pilha pode ser armazenado em-80 ° c até necessário para uma análise mais adicional.
Nota: Evite ciclos repetidos de congelamento/descongelação das amostras.
4. análise a jusante de frações subcelulares
Nota: Neste protocolo, a análise das frações celulares geradas foi realizada por western blotting utilizando protocolos padrão, carregando números de células iguais/pista (equivalente a ~ 10 μg de proteína) para frações nucleares e citoplasmáticas.
- Quantificação do tráfico de proteínas entre frações nucleares e citoplasmáticas: Realizar análise quantitativa Western blot através da quantificação da intensidade do sinal, ou densitometria usando livremente disponível software de análise Western Blot.
- Importando imagens: As imagens ocidentais do borrão geradas dos instrumentos de desenvolvimento diferentes devem ser importadas como limas do JPG, do PNG ou do TIFF. Um arquivo RAW de profundidade de 16 bits é recomendado. Para importar uma imagem, clique no ícone de software e passe o mouse sobre a importação. Em seguida, clique em imagens de terceiros. Selecione o arquivo de imagem e clique em abrir.
- Exibindo a imagem: Na faixa de opções imagem, clique no botão escolher no grupo de exibição . A caixa de diálogo ajustar exibição será aberta para permitir ajustes adicionais, se necessário. Implemente aprimoramentos adicionais, incluindo brilho ou contraste usando os controles deslizantes ajustáveis na guia Luts de imagem . Use a guia curvas para ajustes mais finos.
- Análise de dados (deseleição de canal): clique na faixa de opções análise. Para analisar apenas um canal, desmarque os canais que não estão sendo analisados. Clique na miniatura não mostrar canal do canal nos LUTs de imagem, deixando apenas o canal desejado exibido. As imagens importadas como arquivos JPG, PNG ou TIFF podem exigir a deseleição de vários canais RGB indesejados.
-
Adicionando formas: Para quantificar a intensidade do sinal, clique em Adicionar retângulo para adicionar um retângulo à imagem. Clique no centro de um recurso (por exemplo, uma banda de proteína) para colocar um retângulo em torno dele. Como alternativa, para desenhar manualmente uma forma, escolha desenhar retângulo. Depois de adicionar todas as formas desejadas, clique em selecionar para retornar o cursor para a ferramenta de seleção.
Nota: Adicione várias formas em uma ordem lógica, pois os dados são classificados por um número de ID gerado sequencialmente. -
Subtração de fundo: Para subtrair o ruído de fundo, clique no primeiro botão no grupo de fundo e selecione mediana no menu suspenso. Defina a largura da borda como 3 na caixa de diálogo plano de fundo e selecione os segmentos a serem usados para o cálculo de plano de fundo. Ao escolher quais segmentos usar, selecione os segmentos que melhor representam o plano de fundo da imagem.
Nota: O ruído de fundo pode afetar a quantificação do sinal, por isso deve ser subtraído para calcular com precisão o sinal das formas de interesse. -
Aparar o sinal e aparar fundo-opcional: Os arquivos importados em formatos JPG, PNG ou TIFF podem exibir saturação de pixel: regiões destacadas/brilhantes dentro de uma banda de proteínas. Trim Signal e Trim background (bkgnd) remove os pixels saturados da análise. Para exibir esses valores, adicione aparar sinal e aparar bkgnd para uma tabela clicando no botão colunas à direita da exibição de tabela.
Nota: A saturação de pixel pode levar à quantificação não confiável. Os pixels saturados só podem ser removidos se menos de 5% dos pixels dentro de uma forma estiverem saturados.
-
Adicionando formas: Para quantificar a intensidade do sinal, clique em Adicionar retângulo para adicionar um retângulo à imagem. Clique no centro de um recurso (por exemplo, uma banda de proteína) para colocar um retângulo em torno dele. Como alternativa, para desenhar manualmente uma forma, escolha desenhar retângulo. Depois de adicionar todas as formas desejadas, clique em selecionar para retornar o cursor para a ferramenta de seleção.
- Exportar dados: Clique na guia formas acima da tabela. Para densitometria, são necessários valores na coluna de sinal . O sinal é a soma dos valores de intensidade de pixel (total) para uma forma menos o produto do bkgnd e da área. Clique no botão relatório. Clique em salvar como ou Iniciar planilha.
Signal = total – (bkgnd x área)
Nota: A guia formas fornece uma tabela de valores quantitativos, incluindo Signal, total, area e bkgrnd. - Quantificando a expressão protéica: Dentro da planilha salva, calcule a expressão normalizada da proteína de interesse para cada faixa ou variável dividindo o sinal obtido para a proteína de interesse pelo sinal para a faixa de controle de carga de proteínas correspondente.
Nota: Comparações entre as quantidades de uma proteína normalizada de interesse em frações nucleares e citoplasmáticas não podem ser comparadas diretamente por causa dos diferentes controles de carga usados para distinguir frações nucleares e citoplasmáticas. No entanto, as comparações dentro de frações individuais, por exemplo, após o tratamento medicamentoso, são apropriadas. - Exportar imagem para publicação ou apresentação: Clique na guia imagens encontrada acima da tabela e, em seguida, clique na imagem a ser exportada. Se estiver usando a imagem para uma apresentação de slides ou outros formatos digitais, clique no ícone de software, passe o mouse sobre a exportação e clique em imagem para mídia digital. Salve a imagem como um arquivo JPG, PNG ou TIFF, conforme necessário.
Resultados
Ao planejar experimentos em células CLL primárias, se os ensaios exigirem um grande número de células (> 50 x 106 células), há uma preferência para usar células CLL recém-isoladas, em vez de células criopreservadas que necessitam de descongelamento, no entanto, isso nem sempre é Possível. Isto é porque o processo do Freeze/Thaw pode conduzir à morte de até 50% das pilhas de CLL, embora este seja dependente da amostra. O enriquecimento de células CLL com um WCC > 40 x 106/ml usando a centrifugação da densidade como descrito aqui (etapas 1,3 – 1,5) permite uma recuperação elevada da pilha com pureza elevada (≥ 95%) de células CLL primárias. Na amostra mostrada, o WCC = 177 x 106/ml: de uma amostra de sangue de 30 ml 5 x 109 células foram recuperados, o que representa um rendimento celular de 94% do total de células. A análise desta amostra por citometria de fluxo revelou uma pureza de células CLL de > 95% como indicado pela expressão de superfície dupla de marcadores de células CLL CD19 e CD5 após a gating em FSC/SSC, células únicas que foram DAPI negativa (células viáveis) (Figura 1).
A otimização do procedimento de fraccionamento subcelular foi realizada por meio de uma gama de proporções de detergente (1:20 a 1:60) durante a preparação da fração citoplasmática (etapa 3,4). Posteriormente, foram preparadas as frações nucleares e o WCLs (etapas 3,5 e 3,6 respectivamente). Os immunoblots foram executados nas frações resultantes da linha de pilha de CLL MEC1 (Figura 2A) e das pilhas CLL preliminares (Figura 2B). Os borrões foram sonados para os marcadores de fração lamin a/C (nuclear; 74/63 kDa) e β-tubulin (citoplasma; 55 KDa) para confirmar o fraccionamento de células com sucesso. O fracionamento indica que o nível de detergente ideal para as células MEC1 é uma diluição 1:60 (Figura 2a), comparado com uma diluição de 1:30, sendo ideal para as células CLL primárias (Figura 2B), como indicado por um enriquecimento de proteína nuclear e a falta de proteína citoplasmática nas frações e vice-versa. O WCLs representa a proteína total e atua como um controle positivo para anticorpos utilizados para sondar as frações subcelulares. É importante escolher proteínas apropriadas como marcadores de fração: a Figura 2C mostra immunoblots de frações nucleares/citoplasmáticas preparadas a partir de células MEC1 em que a RNA polimerase II (Rpb1 CTD; 250 kDa) e lamin A/C foram apagados como marcadores de as frações nucleares, quando o β-tubulin e o γ-tubulin (50 kDa) foram usados como marcadores cytoplasmic. É desobstruído que o γ-tubulin é enriquecido no citoplasma entretanto a expressão é evidente no núcleo, como mostrado previamente9.
Uma vez que as condições experimentais são otimizadas, um experimento pode ser realizado. Nos exemplos mostrados, a localização subcelular de FOXO1 em frações nucleares e citoplasmáticas foi determinada após a estimulação de células com o receptor de antígeno celular B (BCR) na presença ou ausência do inibidor Dual mTORC1/2 AZD8055, em células MEC1 ( Figura 3A) e células CLL primárias (Figura 3B)5,10. Em ambos os exemplos, a geração de frações nucleares e cytoplasmic altamente enriquecidas foi conseguida como indicada pela expressão quase exclusiva de lamin na fração nuclear e no β-tubulin nas frações cytoplasmic. Em ambos os tipos de células, a expressão FOXO1 foi reduzida no citoplasma após o tratamento com AZD8055 em relação ao NDC, acompanhada de um aumento da expressão de FOXO1 no compartimento nuclear, demonstrando assim a translocação de proteínas (Figura 3). Para remover a subjetividade da interpretação dos dados, foram quantificados os imunoblotes individuais de cinco amostras primárias de CLL em frações subcelulares (etapa 4; Figura 4a), utilizando as respectivas proteínas nucleares ou citoplasmáticas como controles de carga internos para cada amostra, e, em seguida, normalizando cada fração para o controle não estimulado (US) sem controle de drogas (NDC), como indicado. O gráfico resultante mostra as tendências do movimento FOXO1 entre as frações nuclear e citoplasmática, com AZD8055 reduzindo os níveis de expressão de FOXO1 no citoplasma, enquanto aumenta simultaneamente a expressão no núcleo. Além disso, uma elevação na expressão FOXO1 cytoplasmic é evidente em cima do crosslinking de BCR.
| Tubo | Nome do tubo | Células/grânulos | Antígeno | Fluoróforo |
| 1 | Unstained | Células | NA | NA |
| 2 | Única mancha | Contas | CD5 | FITC |
| 3 | Única mancha | Contas | CD19 | PE-Cy7 |
| 4 | Única mancha | Contas | CD23 | Apc |
| 5 | Única mancha | Contas | CD45 | APC-Cy7 |
| 6 | Única mancha | Células | Viabilidade | DAPI |
| 7 | Mancha de CLL | Células | CD5, CD19, CD23, CD45 & viabilidade | FITC, PE-Cy7, APC, APC-Cy7 & DAPI |
Tabela 1: tabela mostrando o conjunto ideal de tubos de amostra necessários para a citometria de fluxo de células CLL. Cada experimento deve incluir todos os controles apropriados para a análise acurada dos resultados obtidos.

Figura 1: gráfico de análise citométrica de fluxo representativo de pacientes com CLL enriquecidos. Células mononuclear-CLL enriquecidas a partir do sangue periférico de um paciente CLL individual foram bloqueadas utilizando-se FSC-A vs. SSC-a, e os doublets foram então excluídos usando FSC-a vs. FSC-H (a). Células não manchadas (tubo 1) e controles de compensação (tubos 2-6) foram usadas para configurar o citometro de fluxo para detectar células e compensar os canais fluorescentes, garantindo assim que os sinais de fluorescência foram detectados corretamente. (B) um exemplo de coloração negativa (células não manchadas; tubo 1) nos canais de fluorescência CD19 e CD5. As células positivas ao vivo (DAPI negativa) e CD45 foram fechadas (C) e a proporção de CD19+CD5+ (95,5%) e CD19+CD23+ (91,2%) células dentro da população DAPI-CD45+ foi determinada (D). Por favor clique aqui para ver uma versão maior desta figura.

Figura 2: otimização do fracionamento nuclear/citoplasmático. As frações cytoplasmic e nucleares, e os lysates inteiros da pilha (WCL), foram preparados das pelotas da pilha (10-20 x 106 pilhas) da linha celular de CLL (a) MEC1 ou (B) pilhas CLL preliminares enriquecidas do sangue periférico dos pacientes como descrito em Passo 3. A otimização do fracionamento subcelular foi realizada por meio de uma gama de proporções de detergente (1:20 a 1:60) na preparação da fração citoplasmática (conforme descrito na etapa 3,4). As amostras resultantes foram immunoblotted e sondado com anti-lamin a/C (nuclear) e anticorpos do anti-β-tubulin (cytoplasmic) para confirmar o fracionamento bem sucedido da pilha ao lado de WCL. Marcadores de peso molecular são mostrados à esquerda do borrão (M). * indica as condições ideais de detergente para lise celular. (C) immunoblot de frações nucleares e citoplasmáticas de células MEC1 com condições de controle (NDC) ou tratamento medicamentoso (8055) na presença de ausência de estimulação (+ ou – reticulação de BCR respectivamente). Os blots foram sondados com anticorpos Rbp1 CTD (clone 4h8; reconhecendo o RNA polymerase II subunidade B1), anti-lamin a/C, anti-β-tubulin ou anti-γ-tubulin (clone Gtu-88), para identificar frações subcelulares. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3: o fraccionamento subcelular demonstra o shuttling de FOXO1 entre o núcleo e o citoplasma em CLL. (A) as células MEC-1 e (B) as células CLL primárias foram pré-tratadas por 30 min com 100 nm AZD8055 (8055) ou não tratadas (NDC) como indicado e, em seguida, o BCR foi ligado por 1 h ou nos deixou. As frações nucleares e cytoplasmic foram preparadas então e immunoblotted. Após a confirmação do fraccionamento por sondagem com anticorpos anti-lamin A/C (nuclear) e anti-β-tubulina (citoplasmático), o efeito do tratamento medicamentoso e da ligadura de BCR foi avaliado na expressão protéica de FOXO1, utilizando um anticorpo anti-FOXO1. M indica marcador de peso molecular. Por favor clique aqui para ver uma versão maior desta figura.
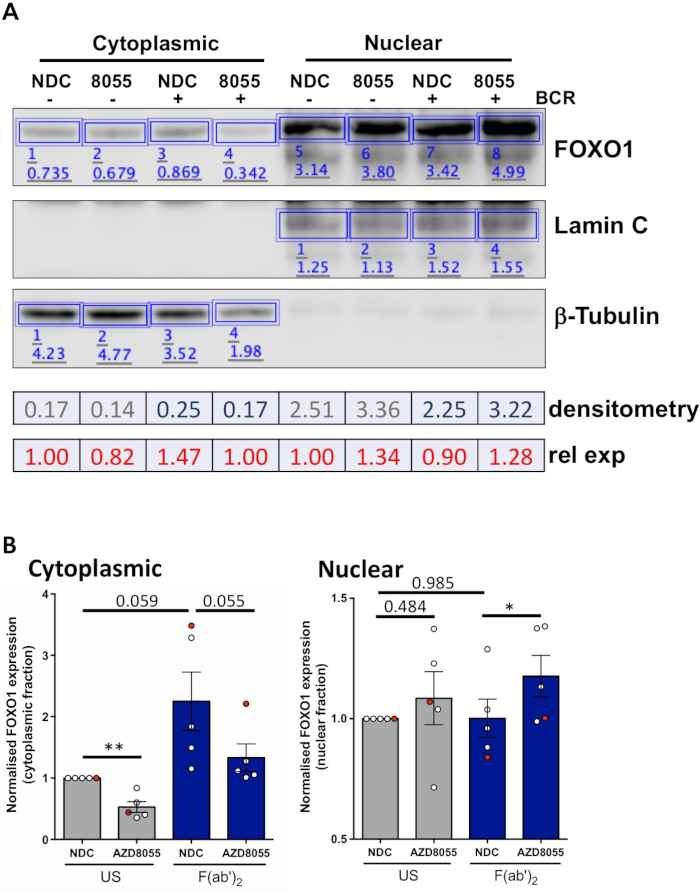
Figura 4: um exemplo trabalhado de análise quantitativa do Western blot (densitometria). (A) Adensitometria foi realizada usando o software de análise Western blot disponível on-line. Resumidamente, dentro da fita de análise, retângulos foram desenhados em torno de bandas de proteínas na imagem para calcular a intensidade do sinal. Representado é a densitometria de uma imagem ocidental representativa do borrão de uma amostra paciente de CLL que se submetesse ao fractionation cytoplasmic/nuclear. As frações citoplasmáticas e nucleares distinguem-se pela expressão de marcadores citoplasmáticos (β-tubulina) e nucleares (lamina A/C). A expressão normalizada de FOXO1 para uma determinada condição pode ser calculada dividindo-se o sinal obtido para FOXO1 pelo sinal correspondente para β-tubulin ou lamin A/C, dependendo da fração que está sendo analisada. A expressão FOXO1 relativa (relativa ao controle do veículo dos E.U.), pode ser calculada dividindo a expressão FOXO1 normalizada de uma condição dada pela expressão FOXO1 normalizada do controle do veículo dos E.U. de uma fração celular dada. (B) gráfico mostrando os níveis de expressão FOXO1 nas frações citoplasmáticas (esquerda) ou nuclear (direita) normalizadas para o controle de US-NDC dentro de cada fração celular. O ponto vermelho no gráfico é o exemplo trabalhado mostrado. Esses dados mostram a variação média da prega na expressão de FOXO1 em comparação com os valores de US-NDC ± SEM. P foram determinados pelo teste t pareado com duas caudas. n = 5 amostras individuais de pacientes com CLL. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
O protocolo descrito fornece um método rápido e eficiente para a geração de frações nucleares e cytoplasmic das pilhas preliminares de CLL, e a quantificação subseqüente do tráfico da proteína entre as frações nucleares e cytoplasmic em cima da estimulação da pilha e tratamento medicamentoso. Os dados apresentados demonstram a capacidade de detectar o tráfico de proteínas específicas, por exemplo, FOXO1, entre as frações nuclear e citoplasmática, após o tratamento com um inibidor de mTOR duplo AZD8055 na presença/ausência de reticulação do BCR através de F ( AB ')2 estimulação do fragmento (Figura 3 e Figura 4). O acoplamento desses experimentos com a quantificação de manchas ocidentais de amostras individuais de pacientes com LLC, possibilita análises objetivas dos dados gerados e demonstra a robustez do ensaio descrito para quantificar mudanças globais na localização de proteínas em Células CLL isoladas de coortes de pacientes (Figura 4). É desobstruído dos dados que uma média de cinco amostras pacientes nas frações cytoplasmic alcançou o significado próximo. Dada a heterogeneidade clínica dos pacientes com LLC11, essas análises seriam normalmente realizadas em coortes de pacientes maiores, e/ou concentradas em subgrupos prognósticos específicos para obter uma compreensão mais completa da resposta celular da CLL células para tratamentos medicamentoso específicos.
Os dados apresentados demonstram a importância da escolha de marcadores proteicos que residem exclusivamente nas frações citoplasmáticas ou nucleares, pois a pureza do fracionamento será confirmada por esses marcadores. o β-tubulin foi escolhido para a confirmação citoplasmática da fração, e lamin A/C como um marcador nuclear. Proteínas adicionais comumente utilizadas são GAPDH e α-tubulin para identificar a fração citoplasmática ou Brg1 (SMARCA4), TFIID e RNA polimerase II para a pureza da fração nuclear4,5. No entanto, deve-se tomar cuidado ao escolher proteínas altamente enriquecidas em frações específicas e não presentes em ambas as frações (por exemplo, γ-tubulina) (Figura 2C)9. De fato, GAPDH e actina, emborageralmente considerados proteínas citoplasmáticas, podem localizar o núcleo12,13, destacandoa importância da escolha de um marcador de fração que não se desloque quando a estimulação ou o tratamento é aplicadas às células. Além disso, é importante confirmar que o marcador de proteína escolhido é expresso na célula de interesse, executando a WCL ao lado dos fraccionamentos subcelulares.
No experimento representativo mostrado, o mesmo número de células CLL foi utilizado para cada condição (estimulação/tratamento medicamentoso) e, posteriormente, as amostras de fracionamento foram preparadas imediatamente. O carregamento de 10 μg de proteína/pista fraccionada fornece material suficiente para a detecção das proteínas de interesse. Como essas amostras só se submeteram a um tratamento medicamentoso de curto prazo e estimulação (até 4 h), assumiu-se que o nível de proteína permaneceria o mesmo em cada amostra, e um ensaio protéico não foi realizado. No entanto, se os tratamentos celulares são estendidos (18-72 h), o nível de morte celular ou proliferação nas células pode alterar significativamente a qualidade e quantidade de proteína extraída, dependente da estimulação medicamentosa/celular aplicada, alterando assim os níveis de proteína no Tratado /amostras estimuladas. Nestes casos para tratamentos de droga a longo prazo, é aconselhável realizar a quantificação da proteína usando um ensaio de Bradford ou equivalente, antes da mancha ocidental para assegurar-se de que a mesma quantidade de proteína esteja executada em cada pista do immunoblot. A presença de detergentes pode interferir com os ensaios proteicos específicos14, esta interferência pode ser reduzida diluindo amostras da proteína da fração da pilha. Além disso, use o tampão de Lise completo como o espaço em branco, usando a mesma diluição como nas amostras que estão sendo testadas.
Para fornecer evidências de suporte para os achados descritos aqui, experimentos paralelos poderiam ser realizados utilizando microscopia de fluorescência para analisar a localização de FOXO1 dentro das células CLL para possibilitar a visualização desses achados5. Além disso, as frações subcelulares geradas também podem ser usadas para ensaios de atividade enzimática ou análise proteômica em análises posteriores a jusante.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores gostariam de agradecer a Dr. Natasha Malik por rever criticamente o manuscrito. Este estudo foi financiado por uma subvenção do projeto Bloodwise concedida à AMM (18003). As instalações de análise da FACS foram financiadas pela Fundação Howat. MWM foi financiado por um Studentship PhD de Friends of Paul o ' Gorman Leukaemia Research Centre, JC foi financiado pelo Friends of Paul o ' Gorman Leukaemia Research Centre e JH foi financiado por uma concessão de projeto Bloodwise (18003).
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge Tubes | Griener Bio one | 616201 | |
| 3 mL Pasteur Pipettes | Griener Bio one | 612398 | |
| 12 mm x 75 mm FACS Tubes | Elkay | 2052-004 | |
| 15 mL Tube | Griener Bio one | 188271 | |
| 50 mL Tube | Griener Bio one | 227261 | |
| anti-CD5 FITC antibody | BD Biosciences | 555352 | phenotypic surface marker |
| anti-CD19 PE Cy7 antibody | BD Biosciences | 557835 | phenotypic surface marker |
| anti-CD23 APC antibody | BD Biosciences | 558690 | phenotypic surface marker |
| anti-CD45 APC Cy7 antibody | BD Biosciences | 557833 | phenotypic surface marker |
| anti-β-Tubulin antibody | Cell Signaling | 2146 | cytoplasmic marker |
| anti-γ-Tubulin Mouse antibody (clone GTU-88) | Sigma-Aldrich | T5326 | |
| anti-FoxO1 (C29H4) Rabbit antibody | Cell Signaling | 2880 | |
| anti-Lamin A/C antibody | Cell Signaling | 2032 | nuclear marker |
| anti-mouse IgG, HRP-linked Antibody | Cell Signaling | 7076 | Secondary antibody |
| anti-rabbit IgG, HRP-linked Antibody | Cell Signaling | 7074 | Secondary antibody |
| anti-Rpb1 CTD antibody (clone 4H8) | Cell Signaling | 2629 | nuclear marker |
| BDFACS Canto II | BD Biosciences | By Request | Flow Cytometer |
| DAPI Solution | BD Biosciences | 564907 | live/dead discriminator |
| DMSO | Sigma | D2650 | |
| EDTA | Sigma | EDS | |
| Fetal Bovine Serum | Thermofisher | 10500064 | |
| GraphPad Prism 6 | GraphPad Software | Software | |
| Histopaque1077 density gradient media | Sigma | H8889 | |
| HyperPAGE 10 - 190 kDa protein marker | Bioline | BIO-33066 | Molecular weight marker |
| Image Studio Lite (version 5.2.5) | LI-COR | www.licor.com | Software |
| Labnet VX100 | Fisher Scientific | Vortex | |
| Nucelar Extract Kit | Active Motif | 40010 | |
| OneComp eBeads | Thermofisher | 01-111-42 | |
| Trypan Blue Solution | Thermofisher | 15250061 | |
| PageRuler Plus Prestained Protein Ladder | Thermo Fisher Scientific | 26619 | Molecular weight marker |
| PBS Tablets | Fisher Scientific | BR0014G | |
| RosetteSep Human B Cell Enrichment Cocktail | Stem Cell Technologies | 15064 | |
| Sigma 3-16P | SciQuip | Centrifuge | |
| Sigma 1-15PK | SciQuip | Centrifuge | |
Referências
- Kau, T. R., Way, J. C., Silver, P. A. Nuclear transport and cancer: from mechanism to intervention. Nature Reviews Cancer. 4, 106-117 (2004).
- Turner, J. G., Dawson, J., Sullivan, D. M. Nuclear export of proteins and drug resistance in cancer. Biochemical Pharmacology. 83, 1021-1032 (2012).
- Nakamura, N., et al. Forkhead transcription factors are critical effectors of cell death and cell cycle arrest downstream of PTEN. Molecular and Cellular Biology. 20, 8969-8982 (2000).
- Calnan, D. R., Brunet, A. The FoxO code. Oncogene. 27, 2276-2288 (2008).
- Cosimo, E., et al. AKT/mTORC2 inhibition activates FOXO1 function in CLL cells reducing B cell receptor-mediated survival. Clinical Cancer Research. 25, 1574-1587 (2019).
- Mahipal, A., Malafa, M. Importins and exportins as therapeutic targets in cancer. Pharmacology & Therapeutics. 164, 135-143 (2016).
- Hing, Z. A., et al. Next-generation XPO1 inhibitor shows improved efficacy and in vivo tolerability in hematological malignancies. Leukemia. 30, 2364-2372 (2016).
- Lapalombella, R., et al. Selective inhibitors of nuclear export show that CRM1/XPO1 is a target in chronic lymphocytic leukemia. Blood. 120, 4621-4634 (2012).
- Hořejší, B., et al. Nuclear γ-tubulin associates with nucleoli and interacts with tumor suppressor protein C53. Journal of Cellular Physiology. 227, 367-382 (2012).
- McCaig, A. M., Cosimo, E., Leach, M. T., Michie, A. M. Dasatinib inhibits B cell receptor signalling in chronic lymphocytic leukaemia but novel combination approaches are required to overcome additional pro-survival microenvironmental signals. British Journal of Haematology. 153, 199-211 (2011).
- Fischer, K., Hallek, M. Optimizing frontline therapy of CLL based on clinical and biological factors. Hematology. American Society of Hematology. Education Program. 2017, 338-345 (2017).
- Butera, G., et al. Regulation of autophagy by nuclear GAPDH and its aggregates in cancer and neurodegenerative disorders. International Journal of Molecular Sciences. 20, 2062(2019).
- Virtanen, J. A., Vartiainen, M. K. Diverse functions for different forms of nuclear actin. Current Opinion in Cell Biology. 46, 33-38 (2017).
- Friedenauer, S., Berlet, H. H. Sensitivity and variability of the Bradford protein assay in the presence of detergents. Analytical Biochemistry. 178, 263-268 (1989).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados