Method Article
Fractionnement subcellulaire des cellules de leucémie lymphocytique chronique primaire pour surveiller le trafic de protéines nucléaires/cytoplasmiques
Dans cet article
Résumé
Ce protocole permet l'optimisation et la production efficace subséquente de fractions nucléaires et cytoplasmiques à partir de cellules lymphocytiques chroniques primaires. Ces échantillons sont utilisés pour déterminer la localisation des protéines ainsi que les changements dans le trafic de protéines qui ont lieu entre les compartiments nucléaire et cytoplasmique lors de la stimulation cellulaire et le traitement médicamenteux.
Résumé
L'exportation nucléaire de macromolécules est souvent déréglementée dans les cellules cancéreuses. Les protéines suppressrices de tumeurs, telles que p53, peuvent être rendues inactives en raison de la localisation cellulaire aberrante perturbant leur mécanisme d'action. La survie des cellules lymphocytiques chroniques de leucémie (LCL), entre autres cellules cancéreuses, est facilitée par la déréglementation de l'encrassement nucléaire à cytoplasmique, au moins en partie grâce à la déréglementation du récepteur de transport XPO1 et à l'activation constitutive de Voies de signalisation médiées par PI3K. Il est essentiel de comprendre le rôle des protéines individuelles dans le contexte de leur emplacement intracellulaire pour acquérir une compréhension plus profonde du rôle de ces protéines dans la pathobiologie de la maladie. En outre, l'identification des processus qui sous-tendent la stimulation cellulaire et le mécanisme d'action d'inhibiteurs pharmacologiques spécifiques, dans le contexte du trafic de protéines sous-cellulaires, fournira une compréhension plus complète du mécanisme de action. Le protocole décrit ici permet l'optimisation et la génération efficace subséquente de fractions nucléaires et cytoplasmiques à partir de cellules lymphocytiques chroniques primaires. Ces fractions peuvent être utilisées pour déterminer les changements dans le trafic de protéines entre les fractions nucléaires et cytoplasmiques lors de la stimulation cellulaire et le traitement médicamenteux. Les données peuvent être quantifiées et présentées en parallèle avec des images immunofluorescentes, fournissant ainsi des données robustes et quantifiables.
Introduction
Le transport des macromolécules entre le noyau et le cytoplasme a longtemps été établi pour jouer un rôle clé dans la fonction cellulaire normale et est souvent déréglementé dans les cellules cancéreuses1,2. Une telle déréglementation peut résulter de la surexpression/mutation des protéines qui contrôlent l'exportation nucléaire. Une telle protéine Exportin-1 (XPO1), est un récepteur de transport qui exporte des protéines contenant des signaux d'exportation nucléaire (NES) dans le cytoplasme du noyau2. XPO1-cargos comprennent p53, les membres de la famille FOXO et l'IB, contribuant à leur inactivation en inhibant leur mécanisme d'action1,2,3. D'autres erreurs de localisation des protéines peuvent se produire lorsque des signaux microenvironnementaux empiètent sur les cellules cancéreuses, ce qui entraîne l'activation de voies de signalisation intracellulaires telles que la voie phosphatidyl-inositol-3-kinase (PI3K)/Akt, l'inactivation des membres de la famille FOXO et l'exportation subséquente du noyau4,5. Une telle mauvaise localisation des protéines suppressrices de tumeur a été impliquée dans la progression d'un certain nombre de tumeurs hématologiques et solides1,2,6.
Le développement d'inhibiteurs de petites molécules pour une utilisation clinique dans les malignités hématologiques (leucémie myéloïde aigue (LAAm)/CLL), qui se lient à la fonction XPO1 et inhibent sélectivement, souligne l'importance de mettre au point des techniques appropriées pour l'impact des agents pharmacologiques sur l'enfermant des protéines entre lescompartimentsnucléaire et cytoplasmique 6,7,8. Les techniques d'imagerie ont progressé de manière significative permettant l'identification des protéines dans les compartiments subcellulaires sur la stimulation externe des traitements médicamenteux, cependant, l'importance de techniques parallèles robustes et de soutien est essentielle pour fiable informer un public scientifique de la validité d'un résultat.
Les lymphocytes au repos et les cellules cLL-B malignes isolées des échantillons de sang des patients représentent un défi dans la génération de fractions nucléaires et cytoplasmiques dues au rapport nucléaire élevé : cytoplasmique. L'optimisation des conditions expérimentales pour générer des données expérimentales robustes et fiables est bien sûr essentielle afin de planifier de futurs programmes expérimentaux. La méthode décrite ici permet de quantifier les protéines dans les fractions nucléaires et cytoplasmiques et détermine comment ces protéines peuvent être affectées par la stimulation cellulaire et / ou le traitement médicamenteux.
Protocole
L'utilisation d'échantillons primaires de patients atteints de LCL décrits ici a été approuvée par le West of Scotland Research Ethics Service, le NHS Greater Glasgow and Clyde (Royaume-Uni) et tous les travaux ont été effectués conformément aux lignes directrices approuvées.
1. Isolement des cellules CLL à partir d'échantillons de sang de patients
-
Des échantillons de sang périphériques provenant de patients atteints de LCL précédemment consentis sont reçus de la clinique dans des tubes de collecte de sang EDTA, accompagnés du nombre de cellules blanches (WCC). Purifie les échantillons de Sang Périphérique CLL selon le COE. Pour le COE et 40 x 106 cellules/mL, passez à l'étape 1.1.1; pour le COE 40 x 106 cellules/mL, passez à l'étape 1.1.2.
- Verser le contenu de tous les tubes sanguins EDTA dans un tube conique de centrifugeuse de 50 ml et ajouter 50 l de cocktail d'enrichissement des cellules B humaine par 1 ml de sang. Incuber à température ambiante (RT) pendant 20 min. Procéder à l'étape 1.1.2.
- Diluer l'échantillon à un rapport de 1:1 avec le tampon de lavage RT CLL (salin tamponné par phosphate (PBS), 0,5 % de sérum bovin fœtal (SGF) et 2 mM EDTA).
- Aliquot RT densité gradient media dans un tube de centrifugeuse conique de taille appropriée pour l'échantillon (10 ml dans un tube de 50 ml pour 30 ml d'échantillon ou 4 ml dans un tube de 15 ml pour 10 ml d'échantillon).
- Couchez soigneusement l'échantillon au-dessus du support de gradient de densité et de la centrifugeuse à 400 x g pendant 30 min à RT.
REMARQUE: Assurez-vous que la centrifugeuse est à RT avant que les échantillons soient placés dans la centrifugeuse comme un changement de température se traduira par un mauvais enrichissement des cellules mononucléaires, et éteindre le frein sur la centrifugeuse, comme le freinage soudain peut perturber l'interface liquide. - Récoltez doucement la couche blanche de cellules mononucléaires qui s'accumulent à l'interface du support de gradient de densité et du tampon de lavage CLL, dans un tube de centrifugeuse conique frais de 50 ml à l'aide d'une pipette Pasteur en plastique.
- Ajouter 40 ml de tampon de lavage CLL à la monocouche isolée pour laver les cellules et la centrifugeuse à 300 x g pendant 10 min à RT.
- Jeter le supernatant, resuspendre la pastille en faisant glisser le fond du tube, puis répéter l'étape de lavage décrite à l'étape 1.5.
- Jetez le supernatant, suspendez la pastille telle qu'elle est décrite à l'étape 1.6, puis suspendez la pastille dans un volume de tampon de lavage CLL (jusqu'à 40 ml, selon la taille de la pastille cellulaire).
- Comptez les cellules à l'aide du bleu trypan et d'un hémocytomètre. Ensuite, procéder à la cytométrie de flux pour vérifier la pureté des cellules CLL.
REMARQUE: À ce stade, les cellules CLL peuvent être cultivées à une concentration de 10 x 106 cellules/mL dans les médias à utiliser dans des expériences, et / ou cryoconservé dans 10% de sulfoxyde de diméthyle (DMSO)/FBS pour les travaux futurs à des concentrations allant jusqu'à 100 x 106 cellules / flacon.
2. Cytométrie de flux des cellules de CLL
- Étiquette 12 mm x 75 mm tubes de polystyrène à fond rond comme décrit dans le tableau 1.
- Dans les tubes 2 à 5, mettre une goutte de perles de compensation et entreposer sur la glace. Ajouter 1 oL de l'anticorps approprié (anti-CD5, CD19, CD23 ou CD45, comme indiqué dans le tableau 1) aux tubes 2 à 5, et incuber sur la glace pendant 20 min, protégé de la lumière en plaçant du papier d'aluminium sur le seau à glace.
REMARQUE: Ces tubes servent de contrôles de compensation pour la mise en place du modèle de cytométrie de flux. -
Mettre jusqu'à 1 x 106 cellules CLL dans les tubes 1, 6 et 7, ajouter 2 mL de tampon FACS (PBS - 2% FBS) à chaque tube et centrifugeuse à 300 x g pendant 5 min à RT pour laver les cellules. Jetez le supernatant et rangez les tubes contenant des granulés de cellules sur la glace.
- Resuspendre les granulés cellulaires et ajouter la combinaison appropriée d'anticorps aux cellules du tube 7, comme indiqué dans le tableau 1, dans un volume final de 100 L avec tampon FACS. Les anticorps sont utilisés à une concentration appropriée selon les directives du fabricant.
- Resuspendre les granulés cellulaires dans les tubes 2 et 6 sur 100 l de tampon FACS.
- Incuber les cellules sur la glace, aux côtés des perles tachées dans les tubes 2 à 5, à l'abri de la lumière pendant 20 min.
- Après l'incubation, ajouter 2 mL de tampon FACS à tous les tubes et centrifugeuse à 300 x g pendant 5 min à RT pour laver les cellules. Jeter le supernatant et resuspendre les boulettes de perles/cellules en faisant glisser doucement les tubes.
- Resuspendre les tubes 1 - 5 sur 100 'L de tampon FACS et placer sur la glace jusqu'à ce qu'il soit prêt à analyser sur le cytomètre d'écoulement.
- Diluer la solution DAPI à 0,05-0,2 g/mL dans le tampon FACS immédiatement avant l'utilisation. La concentration optimale peut varier, et la titration est recommandée.
- Resuspendre les tubes 6 et 7 avec 100 l de solution Diluée DAPI et incuber les tubes sur la glace pendant un minimum de 5 min pour permettre aux cellules de tacher.
REMARQUE: Aucun autre lavage n'est nécessaire car le DAPI doit être présent dans le tampon pour que les cellules mortes restent étiquetées. Une fois que Le DAPI a été ajouté, les cellules doivent être analysées sur le cytomètre de flux dans un délai de 4 h. - Analyser les cellules à l'aide d'un cytomètre d'écoulement.
3. Préparation des fractions subcellulaires des cellules CLL
REMARQUE: Lors de la planification de la mise en place expérimentale, inclure un puits de cellules non stimulées / non traitées à partir de laquelle l'extrait de cellules entière s'agit peut être généré.
- Effectuer la stimulation souhaitée et/ou le traitement médicamenteux de la lignée cellulaire MEC1 CLL ou des cellules CLL primaires isolées à l'aide de 10 à 20 x 106 cellules/condition. Les cellules seront ensuite utilisées pour la fractionnement subcellulaire (étapes 3.4 et 3.5) ou pour générer de l'extrait de cellules entières (étape 3.6).
- Préparation des solutions/tubes : Préparer toutes les solutions/tampons fraîchement le jour de la fractionnement, avant que les cellules ne soient récoltées. Conserver les solutions sur la glace jusqu'à ce que nécessaire et l'utiliser dans les 4 h suivant la préparation.
- PBS/phosphatase inhibitor solution: Préparer les inhibiteurs de la phosphatase dans PBS en diluant les inhibiteurs de la phosphatase 1:20 dans 1x PBS (c.-à-d., 0,5 mL d'inhibiteurs de la phosphatase dans 9,5 mL de 1x PBS).
REMARQUE: Assurez-vous que les inhibiteurs de la phosphatase n'ont pas précipité. Si un précipité est présent, chauffer jusqu'à 50 oC pendant 10 min. - Tampon hypotonique : Préparer 1x tampon hypotonique en faisant une dilution de 1:10 de 10x tampon hypotonique dans l'eau distillée (c.-à-d., 50 'L de tampon hypotonique 10x en 450 'L de dH2O).
- 10 mM dithiothreitol (TNT) : Préparer 10 mM DTT en faisant une dilution de 1 m 100 de 1 M DTT avec de l'eau distillée (c.-à-d. 10 l de 1 M TNT sur 990 oL de dH2O).
REMARQUE: La TNT est très labile, alors préparez-le à chaque fois. Évitez les cycles répétés de gel/dégel. - Tampon de lyse complet : Déterminez la quantité de mémoire tampon requise pour chaque expérience. Chaque échantillon nécessite 50 l de tampon de lyse complète, alors ajoutez 5 l de 10 mL DTT (étape 3.2.3) à 44,5 'L de tampon de lyse, puis ajoutez 0,5 'L de cocktail inhibiteur de la protéase. Cette quantité peut être étendue en fonction du nombre d'échantillons dans l'expérience.
- Étiqueter quatre ensembles de tubes microfuge de 1,5 ml pour chaque traitement de stimulation et/ou de traitement médicamenteux pour les cellules fraîchement stimulées (étape 3.3), les fractions cytoplasmiques fraîchement générées (étape 3.4.3), les fractions nucléaires fraîchement générées (étape 3.5.3), et la cellule entière lysates (étape 3.6.3). Pré-réfrigérer ces tubes de microfuge sur la glace jusqu'à ce que nécessaire.
- PBS/phosphatase inhibitor solution: Préparer les inhibiteurs de la phosphatase dans PBS en diluant les inhibiteurs de la phosphatase 1:20 dans 1x PBS (c.-à-d., 0,5 mL d'inhibiteurs de la phosphatase dans 9,5 mL de 1x PBS).
- Transférer les cellules dans des tubes de microfuge de 1,5 ml étiquetés individuellement et des granulés en centrifuge à 200 x g pendant 5 min à 4 oC. Retirez le supernatant et suspendez les cellules dans 1 ml d'inhibiteurs de la PBS/phosphatase à froid (étape 3.2.1). Pelleter les cellules par centrifugation à 200 x g pendant 5 min à 4 oC. Retirer le supernatant et garder les granulés de cellules sur la glace.
- Préparation des fractions cytoplasmiques : Resuspendre doucement les granulés cellulaires à utiliser pour la fractionnement subcellulaire dans 50 'L de 1x tampon hypotonique (étape 3.2.2). Incuber les cellules sur la glace pendant 15 min pour permettre aux cellules de gonfler.
REMARQUE: Le volume de tampon hypotonique utilisé peut être augmenté empiriquement en fonction du nombre de cellules.- Ajouter 0,8 à 2,5 L (1:20 à 1:60) de détergent dans chaque échantillon et vortex sur le réglage le plus élevé pour 10 s.
- Pour déterminer la concentration optimale de détergent à utiliser pour un type de cellule spécifique pour isoler les fractions nucléaires et cytoplasmiques, effectuer un gradient de détergent au départ. Une plage de 1:20 à 1:60 (c.-à-d. 2,5 à 0,8 l de détergent en 50 oL de tampon hypotonique) devrait être adéquate.
REMARQUE : Si le volume de tampon hypotonique à l'étape 3.4 est ajusté, assurez-vous que le rapport détergent approprié est maintenu. - Vérifier la lyse cellulaire en observant les cellules à l'aide d'un microscope à contraste de phase avant et après l'ajout de détergent. Les cellules entières semblent plus grandes avec un noyau dense et foncé. Le cytoplasme apparaîtra comme un halo lumineux autour du noyau.
REMARQUE: La lyse appropriée est encore confirmée en utilisant le ballonnement occidental pour analyser des protéines spécifiques dans les fractions lysées générées par le gradient détergent.
- Pour déterminer la concentration optimale de détergent à utiliser pour un type de cellule spécifique pour isoler les fractions nucléaires et cytoplasmiques, effectuer un gradient de détergent au départ. Une plage de 1:20 à 1:60 (c.-à-d. 2,5 à 0,8 l de détergent en 50 oL de tampon hypotonique) devrait être adéquate.
- Une fois lysés, centrifuger les échantillons à 14 000 x g pour 30 s à 4 oC.
- Transférer délicatement le supernatant dans un tube de microfuge préréfrigéré et étiqueté. Cette fraction cytoplasmique peut être stockée à -80 oC jusqu'à ce qu'elle soit nécessaire pour une analyse plus approfondie. Le granule restant contient la fraction nucléaire (étape 3.5).
REMARQUE: Évitez les cycles répétés de gel/dégel des échantillons.
- Ajouter 0,8 à 2,5 L (1:20 à 1:60) de détergent dans chaque échantillon et vortex sur le réglage le plus élevé pour 10 s.
- Préparation des fractions nucléaires : Resuspendre chaque granule nucléaire dans 50 l de tampon de lyse complète (étape 3.2.4) par pipetting de haut en bas.
REMARQUE: Le volume de la mémoire tampon complète de lyse peut être ajusté empiriquement en fonction du nombre de cellules de départ.- Ajouter 2,5 l de détergent pour solubiliser les protéines associées à la membrane nucléaire et le vortex sur le réglage le plus élevé pendant 10 s. Incuber les échantillons sur la glace pendant 30 min.
- Vortex sur le réglage le plus élevé pour 30 s, puis centrifuger les échantillons à 14.000 x g pendant 20 min à 4 oC.
- Transférer le supernatant dans un tube de microfuge préréfrigéré et étiqueté. Cette fraction nucléaire peut être stockée à -80 oC jusqu'à ce qu'elle soit nécessaire pour une analyse plus approfondie.
REMARQUE: Évitez les cycles répétés de gel/dégel des échantillons.
- Préparation de lysates cellulaires entiers (WCL) à partir de cellules CLL
REMARQUE: La préparation de l'extrait de cellule entier peut être effectuée en même temps que la préparation des fractions nucléaires (étape 3.5).- Resuspendre l'extrait de cellules entières en 100 l de tampon complet de lyse (préparé à l'étape 3.2.4) en pipetting de haut en bas, puis ajouter 5 L de détergent pour assurer la lyse cellulaire complète. Incuber les échantillons sur la glace pendant 30 min.
- Vortex sur le réglage le plus élevé pour 30 s, puis centrifuger les échantillons à 14.000 x g pendant 20 min à 4 oC.
- Transférer le supernatant dans un tube de microfuge préréfrigéré. Ce lysate de cellule entière peut être stocké à -80 oC jusqu'à ce qu'il soit nécessaire pour une analyse plus approfondie.
REMARQUE: Évitez les cycles répétés de gel/dégel des échantillons.
4. Analyse en aval des fractions subcellulaires
REMARQUE: Dans ce protocole, l'analyse des fractions cellulaires générées a été effectuée par le ballonnement occidental à l'aide de protocoles standard, chargeant des nombres de cellules/voie égales (équivalent à 10 g de protéines) pour les fractions nucléaires et cytoplasmiques.
- Quantification du trafic de protéines entre les fractions nucléaires et cytoplasmiques : Effectuer l'analyse quantitative de la tache occidentale par quantitation de l'intensité du signal, ou densitométrie à l'aide d'un logiciel d'analyse de tache occidentale disponible gratuitement.
- Importation d'images : Les images western blot générées à partir de différents instruments en développement doivent être importées sous forme de fichiers JPG, PNG ou TIFF. Un fichier RAW de profondeur 16 bits est recommandé. Pour importer une image, cliquez sur l'icône du logiciel et planer sur Import. Cliquez ensuite sur Third-Party Images. Sélectionnez le fichier d'image et cliquez sur Ouvrez.
- Affichage de l'image: Dans le ruban Image, cliquez sur le bouton Choisissez dans le groupe Affichage. Le dialogue d'affichage d'ajustement s'ouvrira pour permettre d'autres ajustements si nécessaire. Implémentez des améliorations supplémentaires, y compris La luminosité ou le contraste, à l'aide des curseurs réglables sur l'onglet Image LUTs. Utilisez l'onglet Courbes pour des ajustements plus fins.
- Analyse des données (désélection du canal) : Cliquez sur le ruban d'analyse. Pour analyser un seul canal, désélectionnez le canal (s) non analysé. Cliquez sur la vignette Don't Show Channel d'une chaîne dans les LUTs Image, ne laissant que le canal désiré affiché. Les images importées sous forme de fichiers JPG, PNG ou TIFF peuvent nécessiter la désélection de plusieurs canaux RGB indésirables.
-
Ajout de formes : Pour quantifier l'intensité du signal, cliquez sur Ajouter Rectangle pour ajouter un rectangle à l'image. Cliquez sur le centre d'une fonctionnalité (p. ex., une bande protéique) pour placer un rectangle autour d'elle. Alternativement, pour dessiner manuellement une forme, choisissez Draw Rectangle. Après avoir ajouté toutes les formes souhaitées, cliquez sur Sélectionnez pour retourner le curseur à l'outil de sélection.
REMARQUE: Ajoutez plusieurs formes dans un ordre logique, car les données sont triées par un numéro d'ID qui est généré de façon séquentielle. -
Soustraction de fond : Pour soustraire le bruit de fond, cliquez sur le premier bouton du groupe Contexte et sélectionnez Median dans le menu déroulant. Définir la largeur de la bordure à 3 dans le dialogue d'arrière-plan et sélectionner les segments à utiliser pour le calcul d'arrière-plan. Lorsque vous choisissez les segments à utiliser, sélectionnez les segments qui représentent le mieux l'arrière-plan de l'image.
REMARQUE: Le bruit de fond peut affecter la quantification du signal, de sorte qu'il doit être soustrait pour calculer avec précision le signal à partir des formes d'intérêt. -
Fond de signal et de coupe - OPTIONAL : Les fichiers importés dans les formats JPG, PNG ou TIFF peuvent présenter une saturation de pixels : des régions surlignées/brillantes au sein d'une bande de protéines. Trim Signal et Trim Background (Bkgnd) supprime les pixels saturés de l'analyse. Pour afficher ces valeurs, ajoutez Trim Signal et Trim Bkgnd à une table en cliquant sur le bouton Colonnes à droite de la vue de table.
REMARQUE: La saturation des pixels peut conduire à une quantification peu fiable. Les pixels saturés ne peuvent être supprimés que si moins de 5 % des pixels d'une forme sont saturés.
-
Ajout de formes : Pour quantifier l'intensité du signal, cliquez sur Ajouter Rectangle pour ajouter un rectangle à l'image. Cliquez sur le centre d'une fonctionnalité (p. ex., une bande protéique) pour placer un rectangle autour d'elle. Alternativement, pour dessiner manuellement une forme, choisissez Draw Rectangle. Après avoir ajouté toutes les formes souhaitées, cliquez sur Sélectionnez pour retourner le curseur à l'outil de sélection.
- Données sur les exportations : Cliquez sur l'onglet Formes au-dessus de la table. Pour la densitométrie, les valeurs dans la colonne Signal sont requises. Le signal est la somme des valeurs d'intensité de pixel (Total) pour une forme moins le produit du Bkgnd et de la zone. Cliquez sur le bouton Rapport. Cliquez sur Enregistrer As ou Lancer feuille de calcul.
Signal total (Zone Bkgnd x)
REMARQUE: L'onglet formes fournit un tableau de valeurs quantitatives, y compris Signal, Total, Area et Bkgrnd. - Quantification de l'expression des protéines : Dans la feuille de calcul enregistrée, calculez l'expression normalisée de la protéine d'intérêt pour chaque voie ou variable en divisant le signal obtenu pour la protéine d'intérêt par le Signal pour la bande de contrôle correspondante de chargement de protéine.
REMARQUE: Les comparaisons entre les quantités d'une protéine normalisée d'intérêt entre les fractions nucléaires et cytoplasmiques ne peuvent pas être directement comparées en raison des différents contrôles de chargement utilisés pour distinguer les fractions nucléaires et cytoplasmiques. Cependant, des comparaisons à l'intérieur des fractions individuelles, par exemple après un traitement médicamenteux, sont appropriées. - Image d'exportation pour publication ou présentation : Cliquez sur l'onglet Images trouvées au-dessus de la table, puis cliquez sur l'image à exporter. Si vous utilisez l'image pour une présentation de diapositives ou d'autres formats numériques, cliquez sur l'icône logicielle, survolez Export et cliquez sur Image pour les médias numériques. Enregistrez l'image sous forme de fichier JPG, PNG ou TIFF, au besoin.
Résultats
Lors de la planification d'expériences sur les cellules CLL primaires, si les essais nécessitent un grand nombre de cellules (50 x 106 cellules), il ya une préférence pour utiliser des cellules CLL fraîchement isolées, plutôt que des cellules cryoconservées qui nécessitent la décongélation, mais ce n'est pas toujours possible. C'est parce que le processus de gel/dégel peut entraîner la mort de jusqu'à 50% des cellules CLL, bien que cela dépende de l'échantillon. L'enrichissement des cellules CLL avec un COE 40 x 106/mL en utilisant la centrifugation de densité tel que décrit ici (étapes 1.3 - 1.5) permet une récupération cellulaire élevée avec une haute pureté (-95%) cellules CLL primaires. Dans l'échantillon montré, le COE 177 x 106/mL : à partir d'un échantillon sanguin de 30 ml, 5 x 109 cellules ont été récupérées, ce qui représente un rendement cellulaire de 94 % du total des cellules. L'analyse de cet échantillon par cytométrie de flux a révélé une pureté des cellules CLL de 'gt;95% comme indiqué par l'expression double surface des marqueurs de cellules CLL CD19 et CD5 après gating sur FSC/SSC, cellules simples qui étaient DAPI négatif (cellules viables) (Figure 1).
L'optimisation de la procédure de fractionnement subcellulaire a été effectuée à l'aide d'une gamme de rapports de détergent (1:20 à 1:60) pendant la préparation de la fraction cytoplasmique (étape 3.4). Par la suite, les fractions nucléaires et les LCM ont été préparées (étapes 3,5 et 3,6 respectivement). Des immunoblots ont été exécutés sur les fractions résultantes de la lignée cellulaire cLL MEC1 (figure 2A) et des cellules cLL primaires (figure 2B). Les taches ont été sondées pour les marqueurs de fraction Lamin A/C (nucléaire ; 74/63 kDa) et '-tubulin (cytoplasmique ; 55 kDa) pour confirmer la fractionnement réussi de cellules. La fractionnement indique que le niveau optimal de détergent pour les cellules MEC1 est une dilution de 1:60 (figure 2A), par rapport à une dilution de 1:30 étant optimale pour les cellules CLL primaires (figure 2B), comme indiqué par un enrichissement de protéine nucléaire et un manque de protéines cytoplasmiques dans les fractions et vice versa. Les WCL représentent la protéine totale et agissent comme un contrôle positif pour les anticorps utilisés pour sonder les fractions subcellulaires. Il est important de choisir les protéines appropriées comme marqueurs de fractions : La figure 2C montre que les immunoblots de fractions nucléaires/cytoplasmiques préparées à partir de cellules MEC1 dans lesquelles la polymérase II d'ARN (Rpb1 CTD ; 250 kDa) et Lamin A/C ont été effacés comme marqueurs de les fractions nucléaires, tandis que la tubuline et la tubuline (50 kDa) ont été utilisées comme marqueurs cytoplasmiques. Il est clair que la tubuline est enrichie dans le cytoplasme mais l'expression est évidente dans le noyau, comme indiqué précédemment9.
Une fois que les conditions expérimentales sont optimisées, une expérience peut être effectuée. Dans les exemples montrés, la localisation subcellulaire de FOXO1 dans les fractions nucléaires et cytoplasmiques a été déterminée sur la stimulation des cellules avec le récepteur d'antigène de cellules B (BCR) en présence ou en absence de l'inhibiteur dual mTORC1/2 AZD8055, dans les cellules MEC1 ( Figure 3A) et cellules CLL primaires ( Figure3B)5,10. Dans les deux exemples, la génération de fractions nucléaires et cytoplasmiques hautement enrichies a été réalisée comme indiqué par l'expression presque exclusive de Lamin dans la fraction nucléaire et de la tubuline dans les fractions cytoplasmiques. Dans les deux types de cellules, l'expression FOXO1 a été réduite dans le cytoplasme après traitement avec AZD8055 par rapport à NDC, accompagnée d'une augmentation de l'expression FOXO1 dans le compartiment nucléaire, démontrant ainsi la translocation des protéines (figure 3). Pour enlever la subjectivité de l'interprétation de données, les immunoblots individuels de cinq échantillons principaux de CLL ont été quantifiés dans les fractions subcellulaires (étape 4 ; Figure 4A), en utilisant les protéines nucléaires ou cytoplasmiques respectives comme contrôles de chargement interne pour chaque échantillon, puis en normalisant chaque fraction pour le contrôle non stimulé (US) sans contrôle des médicaments (NDC), comme indiqué. Le graphique qui en résulte montre les tendances du mouvement FOXO1 entre les fractions nucléaires et cytoplasmiques, avec AZD8055 réduisant les niveaux d'expression FOXO1 dans le cytoplasme, tout en augmentant simultanément l'expression dans le noyau. En outre, une élévation dans l'expression cytoplasmique DE l'ONÉ1 est évidente sur le rattachement du BCR.
| Tube | Nom du tube | Cellules/perles | antigène | Fluorophore |
| 1 | Non taché | Cellules | Na | Na |
| 2 | Tache unique | Perles | CD5 (en) | Fitc |
| 3 | Tache unique | Perles | CD19 (en) | PE-Cy7 (en) |
| 4 | Tache unique | Perles | CD23 (en) | Apc |
| 5 | Tache unique | Perles | CD45 (en) | APC-Cy7 (en anglais seulement) |
| 6 | Tache unique | Cellules | viabilité | Dapi |
| 7 | CLL Tache | Cellules | CD5, CD19, CD23, CD45 et viabilité | FITC, PE-Cy7, APC, APC-Cy7 et DAPI |
Tableau 1 : Tableau montrant l'ensemble idéal de tubes d'échantillon requis pour la cytométrie d'écoulement des cellules CLL. Chaque expérience doit inclure tous les contrôles appropriés pour une analyse précise des résultats obtenus.

Figure 1 : Parcelle représentative d'analyse de cytométrie de flux des patients enrichis de CLL. Les cellules mononucléaires-CLL enrichies du sang périphérique d'un patient individuel de CLL ont été fermées utilisant FSC-A contre SSC-A, et les doublets ont alors été exclus utilisant FSC-A contre FSC-H (A). Des cellules non tachées (tube 1) et des contrôles de compensation (tubes 2-6) ont été utilisés pour installer le cytomètre d'écoulement pour détecter les cellules et compenser entre les canaux fluorescents, assurant ainsi que les signaux de fluorescence ont été détectés correctement. (B) Exemple de coloration négative (cellules non tachées; tube 1) dans les canaux de fluorescence CD19 et CD5. Les cellules positives vivantes (DAPI négatives) et CD45 ont été fermées (C) et la proportion de CD19etCD5 (95,5 %) et CD19etCD23 (91,2%) cellules au sein de la population DAPI-CD45a été déterminée (D). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Optimisation de la fractionnement nucléaire/cytoplasmique. Des fractions cytoplasmiques et nucléaires, et des lysates de cellules entières (WCL), ont été préparés à partir de granulés cellulaires (10 à 20 x 106 cellules) de la lignée cellulaire CLL (A) MEC1 ou (B) cellules CLL primaires enrichies du sang périphérique des patients tel que décrit dans Étape 3. L'optimisation de la fractionnement subcellulaire a été effectuée en utilisant une gamme de rapports de détergent (1:20 à 1:60) lors de la préparation de la fraction cytoplasmique (comme décrit à l'étape 3.4). Les échantillons résultants ont été immunoblotted et sondés avec des anticorps anti-Lamin A/C (nucléaires) et anti-tubulin (cytoplasmique) pour confirmer la fractionnement réussi de cellules aux côtés de WCL. Les marqueurs de poids moléculaires sont indiqués à gauche de la tache (M). indique les conditions détergentes optimales pour la lyse cellulaire. (C) Immunoblot des fractions nucléaires et cytoplasmiques des cellules MEC1 avec des conditions de contrôle (NDC) ou un traitement médicamenteux (8055) en présence de l'absence de stimulation (md ou - BCR crosslinking respectivement). Des blots ont été sondés avec des anticorps anti-Rbp1 CTD (clone 4H8 ; reconnaissant la polymérase d'ARN II b1), anti-Lamin A/C, anti-tubulin ou anti-tubulin (clone GTU-88) anticorps, pour identifier des fractions subcellulaires. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : La fractionnement subcellulaire démontre l'enfermant de FOXO1 entre le noyau et le cytoplasme dans CLL. (A) mec-1 et (B) cellules cLL primaires ont été pré-traités pendant 30 min avec 100 nM AZD8055 (8055) ou laissés non traités (NDC) comme indiqué et puis BCR a été ligated pendant 1 h ou à gauche des ÉTATS-Unis. Des fractions nucléaires et cytoplasmiques ont alors été préparées et immunoblotted. Après confirmation de fractionnement en sondant avec des anticorps anti-Lamin A/C (nucléaire) et anti-tubulin (cytoplasmique), l'effet du traitement médicamenteux et de la ligature de BCR a été évalué sur l'expression de protéine DE FOXO1, utilisant un anticorps anti-FOXO1. M indique le marqueur de poids moléculaire. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
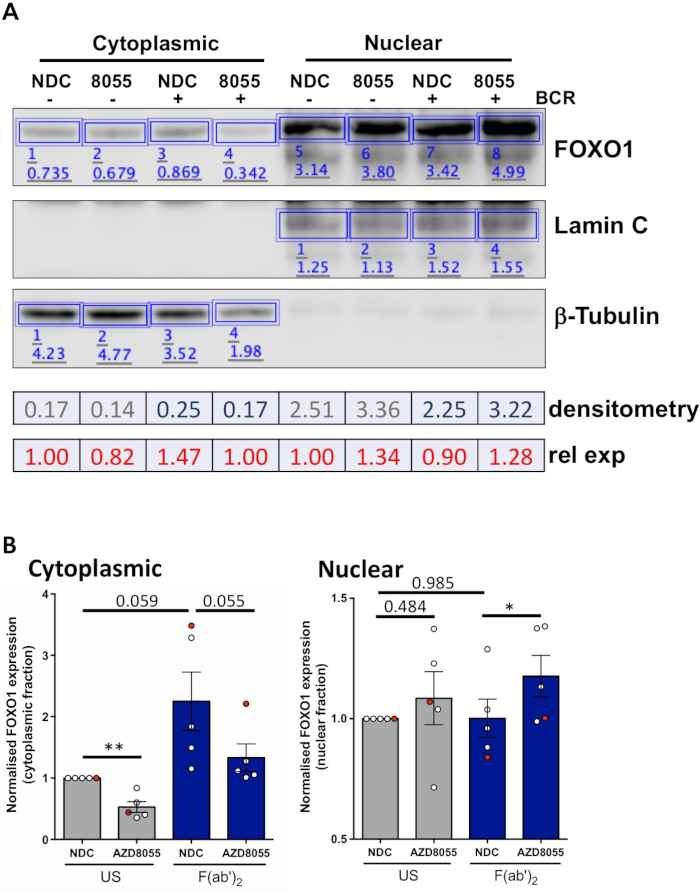
Figure 4 : Exemple travaillé d'analyse quantitative de tache occidentale (densitométrie). (A) La densitométrie a été réalisée à l'aide du logiciel d'analyse western blot disponible en ligne. En bref, à l'intérieur du ruban d'analyse, des rectangles ont été dessinés autour de bandes protéiques dans l'image pour calculer l'intensité du signal. La densitométrie d'une image occidentale représentative d'un échantillon de patient de CLL qui a subi la fractionnement cytoplasmique/nucléaire est dépeinte. Les fractions cytoplasmiques et nucléaires se distinguent par l'expression des marqueurs cytoplasmiques (tubuline) et nucléaires (Lamin A/C). L'expression normalisée de FOXO1 pour une condition donnée peut être calculée en divisant le signal obtenu pour FOXO1 par le signal correspondant pour 'Tubulin ou Lamin A/C, selon la fraction analysée. L'expression relative FOXO1 (par rapport au contrôle du véhicule américain) peut être calculée en divisant l'expression NORMALISÉe DE FOXO1 d'une condition donnée par l'expression FOXO1 normalisée du contrôle du véhicule américain d'une fraction cellulaire donnée. (B) Graphique montrant les niveaux d'expression FOXO1 dans les fractions cytoplasmiques (gauche) ou nucléaires (droite) normalisées au contrôle US-NDC dans chaque fraction cellulaire. Le point rouge sur le graphique est l'exemple travaillé montré. Ces données montrent que le changement moyen de pli dans l'expression FOXO1 par rapport aux valeurs US-NDC - SEM. P ont été déterminés par le test t apparié des étudiants à deux queues. n - 5 échantillons individuels de patients CLL. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Le protocole décrit fournit une méthode rapide et efficace pour la génération de fractions nucléaires et cytoplasmiques à partir de cellules CLL primaires, et la quantification subséquente du trafic de protéines entre les fractions nucléaires et cytoplasmiques lors de la stimulation cellulaire traitement de la toxicomanie. Les données présentées démontrent la capacité de détecter le trafic de protéines spécifiques, par exemple, FOXO1, entre les fractions nucléaires et cytoplasmiques, sur traitement avec un inhibiteur de mTOR double AZD8055 en présence/absence de BCR reliant flà/flandage par F( ab')2 stimulation de fragment(figure 3 et figure 4). Le couplage de ces expériences avec la quantification des taches occidentales à partir d'échantillons individuels de patients atteints de LCL permet d'analyser objectivement les données générées et démontre la robustesse de l'analyse décrite pour quantifier les changements globaux dans la localisation des protéines Cellules CLL isolées dans des cohortes de patients (figure 4). Il ressort clairement des données qu'une moyenne de cinq échantillons de patients dans les fractions cytoplasmiques a atteint une importance proche. Étant donné l'hétérogénéité clinique des patients atteints deLCL 11, ces analyses seraient normalement effectuées sur de plus grandes cohortes de patients, et/ou axées sur des sous-groupes pronostiques spécifiques de patients afin d'acquérir une meilleure compréhension de la réponse cellulaire de CLL aux traitements médicamenteux spécifiques.
Les données présentées démontrent l'importance de choisir des marqueurs protéiques qui résident exclusivement dans les fractions cytoplasmiques ou nucléaires, car la pureté de la fractionnement sera confirmée par ces marqueurs. La tubuline a été choisie pour la confirmation de fraction cytoplasmique, et Lamin A/C comme marqueur nucléaire. D'autres protéines couramment utilisées sont GAPDH et 'tubulin pour identifier la fraction cytoplasmique ou Brg1 (SMARCA4), TFIID et RNA Polymerase II pour la pureté des fractions nucléaires4,5. Cependant, il faut faire attention au choix de protéines qui sont fortement enrichies en fractions spécifiques et qui ne sont pas présentes dans les deux fractions (p. ex., la tubuline) (figure 2C)9. En effet, GAPDH et actine bien que généralement considérés comme des protéines cytoplasmiques peuvent se localiser au noyau12,13, soulignant l'importance de choisir un marqueur de fraction qui ne se déplace pas lorsque la stimulation ou le traitement est appliquées sur les cellules. En outre, il est important de confirmer que le marqueur protéique choisi est exprimé dans la cellule d'intérêt en exécutant le WCL aux côtés des fractionnements subcellulaires.
Dans l'expérience représentative montrée, le même nombre de cellules de CLL a été employé pour chaque condition (stimulation/traitement de drogue), et par la suite les échantillons de fractionnement ont été préparés immédiatement. Le chargement de 10 g de protéines/voies fractionnée fournit suffisamment de matériel pour la détection des protéines d'intérêt. Comme ces échantillons n'ont subi qu'un traitement médicamenteux et une stimulation à court terme (jusqu'à 4 h), on a supposé que le niveau de protéines resterait le même dans chaque échantillon, et un test de protéines n'a pas été effectué. Cependant, si les traitements cellulaires sont prolongés (18 - 72 h), le niveau de mort cellulaire ou de prolifération dans les cellules peut modifier considérablement la qualité et la quantité de protéines extraites, dépendant de la stimulation médicamenteuse/cellulaire appliquée, modifiant ainsi les niveaux de protéines dans le traitement /échantillons stimulés. Dans ces cas pour les traitements médicamenteux à plus long terme, il est conseillé d'effectuer la quantification des protéines à l'aide d'un essai Bradford ou équivalent, avant le ballonnement occidental pour s'assurer que la même quantité de protéines est exécuté dans chaque voie de l'immunoblot. La présence de détergents peut interférer avec des analyses de protéines spécifiques14,cette interférence peut être réduite en diluant des échantillons de protéines de fraction cellulaire. En outre, utilisez le tampon de lyse complète comme le blanc, en utilisant la même dilution que dans les échantillons testés.
Pour fournir des preuves à l'appui des résultats décrits ici, des expériences parallèles pourraient être effectuées à l'aide de la microscopie de fluorescence pour analyser l'emplacement de FOXO1 dans les cellules CLL pour permettre la visualisation de ces résultats5. En outre, les fractions subcellulaires générées peuvent également être utilisées pour des analyses d'activité enzymatiques ou des analyses protéomiques dans d'autres analyses en aval.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les auteurs tenons à remercier la Dre Natasha Malik d'avoir examiné de façon critique le manuscrit. Cette étude a été financée par une subvention de projet Bloodwise accordée à l'AMM (18003). Les installations d'analyse facÉAd ont été financées par la Fondation Howat. MWM a été financé par un doctorat des Amis du Centre de recherche sur la leucémie Paul O'Gorman, JC a été financé par le Centre de recherche sur la leucémie des Amis de Paul O'Gorman et JH a été financé par une subvention de projet Bloodwise (18003).
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge Tubes | Griener Bio one | 616201 | |
| 3 mL Pasteur Pipettes | Griener Bio one | 612398 | |
| 12 mm x 75 mm FACS Tubes | Elkay | 2052-004 | |
| 15 mL Tube | Griener Bio one | 188271 | |
| 50 mL Tube | Griener Bio one | 227261 | |
| anti-CD5 FITC antibody | BD Biosciences | 555352 | phenotypic surface marker |
| anti-CD19 PE Cy7 antibody | BD Biosciences | 557835 | phenotypic surface marker |
| anti-CD23 APC antibody | BD Biosciences | 558690 | phenotypic surface marker |
| anti-CD45 APC Cy7 antibody | BD Biosciences | 557833 | phenotypic surface marker |
| anti-β-Tubulin antibody | Cell Signaling | 2146 | cytoplasmic marker |
| anti-γ-Tubulin Mouse antibody (clone GTU-88) | Sigma-Aldrich | T5326 | |
| anti-FoxO1 (C29H4) Rabbit antibody | Cell Signaling | 2880 | |
| anti-Lamin A/C antibody | Cell Signaling | 2032 | nuclear marker |
| anti-mouse IgG, HRP-linked Antibody | Cell Signaling | 7076 | Secondary antibody |
| anti-rabbit IgG, HRP-linked Antibody | Cell Signaling | 7074 | Secondary antibody |
| anti-Rpb1 CTD antibody (clone 4H8) | Cell Signaling | 2629 | nuclear marker |
| BDFACS Canto II | BD Biosciences | By Request | Flow Cytometer |
| DAPI Solution | BD Biosciences | 564907 | live/dead discriminator |
| DMSO | Sigma | D2650 | |
| EDTA | Sigma | EDS | |
| Fetal Bovine Serum | Thermofisher | 10500064 | |
| GraphPad Prism 6 | GraphPad Software | Software | |
| Histopaque1077 density gradient media | Sigma | H8889 | |
| HyperPAGE 10 - 190 kDa protein marker | Bioline | BIO-33066 | Molecular weight marker |
| Image Studio Lite (version 5.2.5) | LI-COR | www.licor.com | Software |
| Labnet VX100 | Fisher Scientific | Vortex | |
| Nucelar Extract Kit | Active Motif | 40010 | |
| OneComp eBeads | Thermofisher | 01-111-42 | |
| Trypan Blue Solution | Thermofisher | 15250061 | |
| PageRuler Plus Prestained Protein Ladder | Thermo Fisher Scientific | 26619 | Molecular weight marker |
| PBS Tablets | Fisher Scientific | BR0014G | |
| RosetteSep Human B Cell Enrichment Cocktail | Stem Cell Technologies | 15064 | |
| Sigma 3-16P | SciQuip | Centrifuge | |
| Sigma 1-15PK | SciQuip | Centrifuge | |
Références
- Kau, T. R., Way, J. C., Silver, P. A. Nuclear transport and cancer: from mechanism to intervention. Nature Reviews Cancer. 4, 106-117 (2004).
- Turner, J. G., Dawson, J., Sullivan, D. M. Nuclear export of proteins and drug resistance in cancer. Biochemical Pharmacology. 83, 1021-1032 (2012).
- Nakamura, N., et al. Forkhead transcription factors are critical effectors of cell death and cell cycle arrest downstream of PTEN. Molecular and Cellular Biology. 20, 8969-8982 (2000).
- Calnan, D. R., Brunet, A. The FoxO code. Oncogene. 27, 2276-2288 (2008).
- Cosimo, E., et al. AKT/mTORC2 inhibition activates FOXO1 function in CLL cells reducing B cell receptor-mediated survival. Clinical Cancer Research. 25, 1574-1587 (2019).
- Mahipal, A., Malafa, M. Importins and exportins as therapeutic targets in cancer. Pharmacology & Therapeutics. 164, 135-143 (2016).
- Hing, Z. A., et al. Next-generation XPO1 inhibitor shows improved efficacy and in vivo tolerability in hematological malignancies. Leukemia. 30, 2364-2372 (2016).
- Lapalombella, R., et al. Selective inhibitors of nuclear export show that CRM1/XPO1 is a target in chronic lymphocytic leukemia. Blood. 120, 4621-4634 (2012).
- Hořejší, B., et al. Nuclear γ-tubulin associates with nucleoli and interacts with tumor suppressor protein C53. Journal of Cellular Physiology. 227, 367-382 (2012).
- McCaig, A. M., Cosimo, E., Leach, M. T., Michie, A. M. Dasatinib inhibits B cell receptor signalling in chronic lymphocytic leukaemia but novel combination approaches are required to overcome additional pro-survival microenvironmental signals. British Journal of Haematology. 153, 199-211 (2011).
- Fischer, K., Hallek, M. Optimizing frontline therapy of CLL based on clinical and biological factors. Hematology. American Society of Hematology. Education Program. 2017, 338-345 (2017).
- Butera, G., et al. Regulation of autophagy by nuclear GAPDH and its aggregates in cancer and neurodegenerative disorders. International Journal of Molecular Sciences. 20, 2062(2019).
- Virtanen, J. A., Vartiainen, M. K. Diverse functions for different forms of nuclear actin. Current Opinion in Cell Biology. 46, 33-38 (2017).
- Friedenauer, S., Berlet, H. H. Sensitivity and variability of the Bradford protein assay in the presence of detergents. Analytical Biochemistry. 178, 263-268 (1989).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon