Method Article
핵/세포질 단백질 인신 매매를 모니터링하기 위한 1차 만성 림프구성 백혈병 세포의 세포 분열
요약
이 프로토콜은 1 차적인 만성 림프구성 백혈병 세포에서 핵 및 세포질 분획의 최적화 그리고 연속적인 효율적인 생성을 가능하게 합니다. 이 견본은 세포 자극 및 약 처리에 핵과 세포질 구획 사이에서 일어나는 단백질 인신 매매에 있는 단백질 현지화 그리고 변경을 결정하기 위하여 이용됩니다.
초록
거대 분자의 핵 수출은 종종 암세포에서 조절됩니다. p53과 같은 종양 억제 단백질은 그들의 작용 메커니즘을 방해하는 비정상적인 세포 국소화로 인해 비활성 상태로 렌더링될 수 있다. 만성 림프구성 백혈병 (CLL) 세포의 생존은 다른 암 세포 중에서, 세포질 폐쇄에 핵의 규제 완화에 의해 지원됩니다, 적어도 부분적으로 수송 수용체 XPO1의 규제 완화및 구성활성화를 통해 PI3K 매개 신호 경로. 질병의 병리학에 있는 그 같은 단백질의 역할의 더 깊은 이해를 얻기 위하여 그들의 세포내 위치의 맥락에서 개별 적인 단백질의 역할을 이해하는 것이 필수적입니다. 또한, 세포 자극과 특정 약리학적 억제제의 작용 메커니즘의 기초가되는 프로세스를 식별하는 것은 세포 내 단백질 인신 매매의 맥락에서, 의 메커니즘에 대한 보다 포괄적 인 이해를 제공 할 것입니다 작업. 여기에 기술된 프로토콜은 원발성 만성 림프구성 백혈병 세포로부터 핵 및 세포질 분획의 최적화 및 후속 효율적인 생성을 가능하게 한다. 이 분획은 세포 자극 및 약물 처리에 따라 핵 및 세포질 분획 사이의 단백질 인신 매매의 변화를 결정하는 데 사용할 수 있습니다. 데이터는 면역 형광 이미지와 병행하여 정량화되고 제공될 수 있으므로 강력하고 정량화 가능한 데이터를 제공합니다.
서문
핵과 세포질 사이의 거대분자의 수송은 정상적인 세포 기능에 중요한 역할을 하기 위하여 오랫동안 확립되어 왔으며 종종암세포1,2에서조절된다. 이러한 규제 완화는 핵 수출을 제어하는 단백질의 과발현/돌연변이로 인해 발생할 수 있습니다. 이러한 단백질 Exportin-1(XPO1)은핵으로부터세포질내로 단백질을 >200 핵 수출 신호(NES)를 포함하는 수송 수용체이다. XPO1-카고는 p53, FOXO 패밀리 멤버 및 IB를 포함하며, 작용 의 메커니즘을 억제함으로써 그들의 불활성화에기여1,2,3. 추가 단백질 mislocalization는 현미경 신호가 암세포에 충돌할 때 생길 수 있고, 포스파티딜-이노시톨-3-키나아제 (PI3K)/Akt 통로와 같은 세포내 신호 통로의 활성화로 이끌어 내는, 그 결과 FOXO 가족 구성원의 비활성화 및 핵에서 후속 수출4,5. 이러한 종양 억제단백질의 잘못된 국화는 다수의 혈액학적 및 고형 종양의 진행에 연루되어1,2,6.
XPO1 기능을 결합하고 선택적으로 억제하는 혈액학적 악성 종양(급성 골수성 백혈병(AML)/CLL)에서 임상적 사용을 위한 소분자 억제제의 개발은 이를 해결하기 위한 적절한 기술 개발의 중요성을 강조합니다. 핵과 세포질 구획 사이의 단백질 의 폐쇄에 약리작용제의 영향6,7,8. 이미징 기술은 약물 치료의 외부 자극시 세포 외 구획에서 단백질을 식별할 수 있게 하는 데 크게 발전했지만, 견고하고 지지적인 병렬 기술의 중요성은 안정적으로 중요합니다. 과학적 청중에게 결과의 타당성을 알립니다.
환자 혈액 샘플로부터 분리된 림프구 및 악성 CLL-B 세포는 높은 핵: 세포질 비로 인한 핵 및 세포질 분획의 생성에 도전을 나타낸다. 견고하고 신뢰할 수 있는 실험 데이터를 생성하기 위한 실험 조건의 최적화는 물론 미래의 실험 프로그램을 계획하는 데 매우 중요합니다. 여기에 설명된 방법은 핵 및 세포질 분획에서 단백질의 정량화를 가능하게 하고 이 단백질이 세포 자극 및/또는 약물 치료에 의해 어떻게 영향을 받을 수 있는지 결정합니다.
프로토콜
여기에 기술된 CLL 환자에게서 1 차적인 견본의 사용은 스코틀랜드 연구 윤리 서비스, NHS 그레이터 글래스고 및 클라이드 (UK)의 서쪽에 의해 승인되고 모든 일은 승인된 지침에 따라 수행되었습니다.
1. 환자 혈액 샘플에서 CLL 세포의 격리
-
이전에 동의한 CLL 환자에게서 말초 혈액 샘플은 백혈구 수 (WCC)를 동반한 EDTA 혈액 수집 관에 있는 진료소에서 수신됩니다. WCC에 따라 말초 혈액 CLL 샘플을 정화합니다. WCC < 40 x 106 셀/mL의 경우, 1.1.1단계로 진행; WCC ≥ 40 x 106 셀/mL의 경우 1.1.2단계로 진행합니다.
- 모든 EDTA 혈액 관의 내용물을 50 mL 원유 원심 분리관에 붓고 혈액 1 mL 당 인간 B 세포 농축 칵테일 50 μL을 추가하십시오. 실온(RT)에서 20분 동안 배양합니다.
- RT CLL 세척 버퍼 (인산 완충 살린 (PBS), 0.5 % 태아 소 혈청 (FBS) 및 2 mM EDTA로 1 :1의 비율로 샘플을 희석하십시오.
- Aliquot RT 밀도 그라데이션 매질은 시료에 대해 적절한 크기의 원원원심분리관내로(샘플의 30 mL에 대해 50 mL 튜브로 10 mL 또는 4 mL를 시료의 10 mL에 대한 15 mL 튜브내로)
- RT에서 30분 동안 밀도 그라데이션 매제와 원심분리기 위에 샘플을 400 x g으로 조심스럽게 겹쳐서 다듬습니다.
참고: 온도 변화로 인해 원심분리기에 시료가 배치되기 전에 원심분리기가 RT에 있는지 확인하고, 갑작스런 제동으로 액체 계면이 중단될 수 있기 때문에 단핵 전지의 농축이 불량해질 수 있으며 원심분리기의 브레이크를 끄기 합니다. - 밀도 그라데이션 매질 및 CLL 세척 버퍼의 계면에서 수집되는 단일 핵 세포의 흰색 층을 플라스틱 파스퇴르 피펫을 사용하여 신선한 50mL 원추형 원심 분리튜브로 부드럽게 수확합니다.
- 40 mL의 CLL 세척 버퍼를 분리 된 단층으로 추가하여 RT에서 10 분 동안 300 x g에서 세포와 원심 분리기를 씻으하십시오.
- 상급체를 버리고, 튜브의 바닥을 가볍게 하여 펠릿을 다시 일시 중단한 다음 1.5단계에서 설명한 세척 단계를 반복합니다.
- 상온액을 버리고, 1.6단계에서 설명한 바와 같이 펠릿을 다시 일시 중단한 다음, CLL 세척 버퍼의 세트 부피에서 펠릿을 다시 일시 중단합니다(셀 펠릿의 크기에 따라 최대 40 mL).
- 트라이판 블루와 혈세포계를 사용하여 세포를 계산합니다. 그런 다음 CLL 세포의 순도를 확인하기 위해 세포 분석 흐름을 진행합니다.
참고: 이 단계에서 CLL 세포는 실험에 사용되는 배지에서 10 x 106 세포 / mL의 농도로 배양 될 수 있으며, 10 % 디메틸 설폭화물 (DMSO)/ FBS로 저온 보존되어 최대 100 x 106 세포 / 바이알의 농도에서 향후 작업을 할 수 있습니다.
2. CLL 세포의 유세포 분석
- 표 1에설명된 바와 같이 라벨 12 mm x 75mm 원형 바닥 폴리스티렌 튜브.
- 튜브 2 - 5에서 보상 구슬 한 방울을 넣고 얼음에 보관하십시오. 적절한 항체(항CD5, CD19, CD23 또는 CD45)의 1 μL을 튜브 2 – 5에 넣고 20분 동안 얼음에 배양하고, 얼음 양동이 위에 주석 호일을 놓음으로써 빛으로부터 보호한다.
참고: 이러한 튜브는 유세포 분석 템플릿을 설정하기 위한 보정 제어 역할을 합니다. -
튜브 1, 6 및 7에 최대 1 x 106 CLL 세포를 넣고 각 튜브에 2 mL의 FACS 버퍼 (PBS + 2 % FBS)를 추가하고 RT에서 5 분 동안 300 x g에서 원심 분리기를 추가하여 세포를 세척합니다. 상급물질을 버리고 세포 펠릿이 들어있는 튜브를 얼음 위에 보관하십시오.
- 세포 펠릿을 재중단하고 FACS 버퍼를 사용하여 최종 부피 100 μL에서 표 1에지시된 바와 같이 튜브 7의 세포에 항체의 적절한 조합을 추가한다. 항체는 제조자 지침에 따라 적당한 농도에서 이용됩니다.
- FACS 완충액의 100 μL에서 튜브 2 및 6에서 세포 펠릿을 다시 중단합니다.
- 2 -5 튜브에 스테인드 비드와 함께 얼음에 세포를 배양, 20 분 동안 빛으로부터 보호.
- 배양 후, 모든 튜브및 원심분리기에 2 mL의 FACS 버퍼를 넣고 RT에서 5분 동안 300 x g에서 세포를 세척한다. 상급을 버리고 튜브를 가볍게 가볍게 두드려 비드 /셀 펠릿을 다시 일시 중단하십시오.
- FACS 버퍼의 100 μL에서 튜브 1 - 5를 다시 일시 중단하고 유세포계를 분석 할 준비가 될 때까지 얼음위에 놓습니다.
- 사용 직전에 FACS 버퍼에서 DAPI 용액을 0.05-0.2 μg/mL로 희석하십시오. 최적의 농도는 다를 수 있으며 적정을 권장합니다.
- 희석된 DAPI 용액 100 μL로 튜브 6과 7을 다시 중단하고 최소 5분 동안 얼음에 튜브를 배양하여 세포가 얼룩질 수 있도록 합니다.
참고: 죽은 세포가 라벨을 유지하려면 DAPI가 버퍼에 있어야 하기 때문에 더 이상 세척할 필요가 없습니다. DAPI가 추가되면, 세포는 4 시간 안에 유동 세포계에 분석되어야 합니다. - 유세포계를 사용하여 세포를 분석합니다.
3. CLL 세포에서 세포 분획의 준비
참고: 실험 설정을 계획할 때, 전체 세포 추출물이 생성될 수 있는 자극되지 않은/치료되지 않은 세포의 우물을 포함합니다.
- MEC1 CLL 세포주 또는 10 - 20 x 106 세포/상태를 사용하여 1차 CLL 세포의 원하는 자극 및/또는 약물 치료를 수행합니다. 세포는 세포 분획(단계 3.4 & 3.5 단계) 또는 전체 세포 추출물을 생성하기 위해 사용될 것이다(단계 3.6).
- 솔루션/튜브 준비: 셀을 수확하기 전에 분획 당일에 모든 솔루션/버퍼를 신선하게 준비합니다. 필요한 때까지 얼음에 용액을 보관하고 준비 후 4시간 이내에 사용하십시오.
- PBS/인산염 억제제 용액: 1x PBS에서 1:20에서 인산염 억제제 1:20을 희석시킴으로써 PBS에서 인산염 억제제(즉, 1x PBS의 9.5 mL에서 인산염 억제제의 0.5 mL)를 준비한다.
참고: 인산염 억제제가 침전되지 않았는지 확인하십시오. 침전이 존재하는 경우, 10 분 동안 50 °C로 가열하십시오. - 저혈압 버퍼: 증류수에서 1:10의 저혈압 버퍼를 1:10 희석하여 1x 저혈압 버퍼를 준비합니다(즉, 10x 저혈압 완충액의 50 μL을 dH2O의 450 μL로).
- 10 mM 디티오트라이톨(DTT): 증류수로 1M DTT의 1:100 희석을 함으로써 10 mM DTT를 준비합니다(즉, dH2O의 990 μL에서 1M DTT의 10 μL).
참고: DTT는 매우 불안정하므로 매번 신선하게 준비하십시오. 반복되는 동결/해동 주기를 피하십시오. - 전체 용해 버퍼: 각 실험에 필요한 버퍼의 양을 결정합니다. 각 샘플은 완전한 용해 완충제의 50 μL을 필요로 하므로 용해 완충제의 44.5 μL에 10 mM DTT (단계 3.2.3)의 5 μL을 추가한 다음 프로테아제 억제제 칵테일0.5 μL을 추가합니다. 이 양은 실험에서 샘플 의 수에 따라 확장 될 수있다.
- 신선자극된 세포에 대한 각 자극 및/또는 약물 치료에 대해 1.5 mL 마이크로퍼지 튜브4세트라벨(단계 3.3), 새로 생성된 세포질 분획(단계 3.4.3), 갓 생성된 핵분획(단계 3.5.3), 및 전체 세포 (3.6.3단계). 필요한 때까지 얼음에 이 마이크로 퍼지 튜브를 미리 식힙니다.
- PBS/인산염 억제제 용액: 1x PBS에서 1:20에서 인산염 억제제 1:20을 희석시킴으로써 PBS에서 인산염 억제제(즉, 1x PBS의 9.5 mL에서 인산염 억제제의 0.5 mL)를 준비한다.
- 4°C에서 5분 동안 200 x g에서 원심분리하여 개별적으로 라벨이 부착된 1.5 mL 마이크로퍼지 튜브 및 펠렛으로 세포를 옮긴다. 상류를 제거하고 얼음 차가운 PBS / 인산염 억제제의 1 mL에서 세포를 다시 중단하십시오 (단계 3.2.1). 4°C에서 5분 동안 200 x g에서 원심분리에 의해 세포를 펠렛. 상급체를 제거하고 얼음에 세포 펠릿을 유지합니다.
- 세포질 분획의 준비 : 1x 저혈압 완충액의 50 μL에서 세포 분획에 사용되는 세포 펠릿을 부드럽게 다시 일시 중단합니다(단계 3.2.2). 세포가 팽창할 수 있도록 15분 동안 얼음 위에 세포를 배양합니다.
참고: 사용되는 저혈압 완충액의 부피는 세포 수에 따라 경험적으로 증가될 수 있다.- 0.8 - 2.5 μL (1:20 ~ 1:60)의 세제를 각 시료에 넣고 10초 동안 가장 높은 설정으로 와류를 넣습니다.
- 핵 및 세포질 분획을 분리하기 위해 특정 세포 유형에 사용할 세제의 최적 농도를 결정하려면 처음에 세제 구배를 수행하십시오. 1:20 ~ 1:60(즉, 2.5 μL ~ 0.8 μL의 세제를 50 μL의 저혈압 완충제)의 범위가 적절해야 합니다.
참고: 3.4단계에서 저혈압 완충액이 조정되면 적절한 세제 비율이 유지되도록 하십시오. - 세제를 첨가하기 전과 후에 위상 대비 현미경을 사용하여 세포를 관찰하여 세포 용해를 확인합니다. 전체 세포는 조밀하고 어두운 핵으로 더 크게 나타납니다. 세포질은 핵 의 주위에 밝은 후광으로 나타납니다.
참고: 적절한 용해는 세제 구배에서 생성된 용해 분획 내의 특정 단백질을 분석하기 위해 웨스턴 블로팅을 사용하여 추가로 확인됩니다.
- 핵 및 세포질 분획을 분리하기 위해 특정 세포 유형에 사용할 세제의 최적 농도를 결정하려면 처음에 세제 구배를 수행하십시오. 1:20 ~ 1:60(즉, 2.5 μL ~ 0.8 μL의 세제를 50 μL의 저혈압 완충제)의 범위가 적절해야 합니다.
- 일단 용해되면, 4 °C에서 30 s에 대한 14,000 x g에서 샘플을 원심 분리.
- 조심스럽게 미리 차가운, 라벨 마이크로 퍼지 튜브에 상급을 전송합니다. 이 세포질 분획은 추가 분석을 위해 필요할 때까지 -80°C에서 보관할 수 있습니다. 나머지 펠릿은 핵 분획을 포함합니다(단계 3.5).
참고: 시료의 반복된 동결/해동 주기를 피하십시오.
- 0.8 - 2.5 μL (1:20 ~ 1:60)의 세제를 각 시료에 넣고 10초 동안 가장 높은 설정으로 와류를 넣습니다.
- 핵 분획의 준비: 각 핵 펠릿을 50 μL의 완전 분해 완충제(단계 3.2.4)에서 위아래로 파이펫팅하여 다시 중단합니다.
참고: 완전한 용해 완충제의 부피는 시작 셀 수에 따라 경험적으로 조절될 수 있다.- 2.5 μL의 세제를 첨가하여 핵막과 소용돌이와 관련된 단백질을 10초 동안 가장 높은 설정으로 용해시킵니다.
- 30 초 동안 가장 높은 설정에 소용돌이, 다음 4 °C에서 20 분 동안 14,000 x g에서 샘플을 원심 분리.
- 상급체를 미리 차갑게 표시한 마이크로퍼지 튜브로 옮니다. 이 핵 분획은 추가 분석을 위해 필요할 때까지 -80°C에서 보관할 수 있습니다.
참고: 시료의 반복된 동결/해동 주기를 피하십시오.
- CLL 세포에서 전체 세포 가해 (WCL)의 준비
참고: 전체 세포 추출물의 제조는 핵 분획의 제조와 동시에 수행될 수 있다(단계 3.5).- 전체 세포 추출물 펠릿을 100 μL의 완전 분해 완충액(단계 3.2.4에서 준비)에서 상하로 파이펫팅한 다음 5 μL의 세제를 추가하여 완전한 세포 분해를 보장합니다. 샘플을 얼음 위에 30분 동안 배양합니다.
- 30 초 동안 가장 높은 설정에 소용돌이, 다음 4 °C에서 20 분 동안 14,000 x g에서 샘플을 원심 분리.
- 상급체를 미리 냉각된 마이크로 퍼지 튜브로 옮니다. 이 전체 세포 용해는 추가 분석을 위해 필요할 때까지 -80°C에서 보관될 수 있다.
참고: 시료의 반복된 동결/해동 주기를 피하십시오.
4. 세포 이하 분획의 다운스트림 분석
참고: 이 프로토콜에서, 생성된 세포 분획의 분석은 표준 프로토콜을 사용하여 서양 블로팅에 의해 수행되었고, 핵 및 세포질 분획에 대해 동일한 세포 수/레인(단백질의 ~10 μg에 해당)을 로드하였다.
- 핵 및 세포질 분획 사이의 단백질 인신 매매정량화: 자유롭게 사용할 수 있는 웨스턴 블롯 분석 소프트웨어를 사용하여 신호 강도 또는 밀도 측정의 정량화를 통해 정량적 웨스턴 블롯 분석을 수행합니다.
- 이미지 가져오기: 다른 개발 기기에서 생성 된 웨스턴 블롯 이미지는 JPG, PNG 또는 TIFF 파일로 가져와야합니다. 16비트 깊이 RAW 파일을 권장합니다. 이미지를 가져오려면 소프트웨어 아이콘을 클릭하고 가져오기 위로 마우스를 가져갑니다. 그런 다음 타사 이미지를 클릭합니다. 이미지 파일을 선택하고 열기를클릭합니다.
- 이미지 표시: 이미지 리본에서 표시 그룹의 선택 단추를 클릭합니다. 필요한 경우 추가 조정을 위해 디스플레이 조정 대화 상자가 열립니다. 이미지 LUT 탭에서 조정 가능한 슬라이더를 사용하여 밝기 또는 대비를 비롯한 추가 개선 사항을 구현합니다.
- 데이터 분석(채널 선택 해제): 분석 리본을 클릭합니다. 하나의 채널만 분석하려면 분석되지 않는 채널을 선택 취소합니다. 이미지 LUT에서 채널 표시 하지 않는 채널 축소판을 클릭 하 고 원하는 채널만 표시 합니다. JPG, PNG 또는 TIFF 파일로 가져온 이미지는 원치 않는 여러 RGB 채널을 선택 해제해야 할 수 있습니다.
-
셰이프 추가: 신호 강도를 정량화하려면 사각형 추가를 클릭하여 이미지에 사각형을 추가합니다. 피처의 중심(예: 단백질 밴드)을 클릭하여 사각형을 배치합니다. 또는 수동으로 셰이프를 그리려면 사각형 그리기를선택합니다. 원하는 셰이프를 모두 추가한 후 선택을 클릭하여 커서를 선택 도구로 반환합니다.
참고: 데이터가 순차적으로 생성되는 ID 번호로 정렬될 때 여러 셰이프를 논리적 순서로 추가합니다. -
배경 빼기: 배경 노이즈를 빼려면 배경 그룹의 첫 번째 단추를 클릭하고 드롭다운 메뉴에서 중앙값을 선택합니다. 배경 대화에서 테두리 너비를 3으로 설정하고 배경 계산에 사용할 세그먼트를 선택합니다. 사용할 세그먼트를 선택할 때 이미지 배경을 가장 잘 나타내는 세그먼트를 선택합니다.
참고: 배경 잡음은 신호 정량화에 영향을 줄 수 있으므로 관심 있는 모양에서 신호를 정확하게 계산하려면 빼야 합니다. -
신호 트림 및 배경 트림 - 선택 사항: JPG, PNG 또는 TIFF 형식으로 가져온 파일은 단백질 대역 내에서 강조 표시/밝은 영역의 픽셀 포화를 나타낼 수 있습니다. 신호 트림 및 배경 트림(Bkgnd)은 해석에서 포화 픽셀을 제거합니다. 이러한 값을 보려면 테이블 뷰 의 오른쪽에 있는 열 단추를 클릭하여 테이블에 Bkgnd 자르기 및 트림을 추가합니다.
참고: 픽셀 채도는 신뢰할 수 없는 정량화로 이어질 수 있습니다. 셰이프 내의 픽셀 수가 5% 미만인 경우 채도가 낮은 픽셀은 제거할 수 있습니다.
-
셰이프 추가: 신호 강도를 정량화하려면 사각형 추가를 클릭하여 이미지에 사각형을 추가합니다. 피처의 중심(예: 단백질 밴드)을 클릭하여 사각형을 배치합니다. 또는 수동으로 셰이프를 그리려면 사각형 그리기를선택합니다. 원하는 셰이프를 모두 추가한 후 선택을 클릭하여 커서를 선택 도구로 반환합니다.
- 데이터 내보내기: 표 위의 셰이프 탭을 클릭합니다. 밀도 측정의 경우 신호 열의 값이 필요합니다. 신호는 Bkgnd 및 영역의 곱을 뺀 모양에 대한 픽셀 강도 값(Total)의 합계입니다. 보고서 버튼을 클릭합니다. 로 저장또는 스프레드시트 를 실행합니다.
신호 = 총 – (Bkgnd x 영역)
참고: 셰이프 탭은 신호, 총, 면적 및 Bkgrnd를 포함한 정량적 값의 테이블을 제공합니다. - 단백질 발현 정량화: 저장된 스프레드시트 내에서, 각 차선 또는 변수에 대한 관심 단백질의 정규화된 발현을 해당 단백질 로딩 제어 대역에 대한 신호로 관심 단백질에 대해 얻은 신호를 나누어 계산한다.
참고: 핵 및 세포질 분획에 걸쳐 관심있는 정규화 된 단백질의 양 사이의 비교는 핵 및 세포질 분획을 구별하는 데 사용되는 다른 로딩 제어 때문에 직접 비교 할 수 없습니다. 그러나, 개별 분획 내의 비교는, 예를 들면 약물 처리다음, 적당한다. - 출판 또는 프레젠테이션용 이미지 내보내기: 테이블 위에 있는 이미지 탭을 클릭한 다음 내보낼 이미지를 클릭합니다. 슬라이드 프레젠테이션 또는 기타 디지털 형식에 이미지를 사용하는 경우 소프트웨어 아이콘을 클릭하고 내보내기 위로 마우스를 가져가서 디지털 미디어의 이미지를 클릭합니다. 필요에 따라 이미지를 JPG, PNG 또는 TIFF 파일로 저장합니다.
결과
1 차적인 CLL 세포에 실험을 계획할 때, 실험이 많은 수의 세포 (>50 x 106 세포)를 요구하는 경우에, 해동을 요구하는 냉동 보존된 세포 보다는 오히려 신선하게 단리된 CLL 세포를 사용하는 특혜가 있습니다, 그러나 이것은 항상 아닙니다 가능한. 이는 동결/해동 과정이 CLL 세포의 최대 50%의 사망을 초래할 수 있지만 샘플에 의존하기 때문입니다. 여기에 설명된 대로 밀도 원심분리를 사용하여 WCC>40 x 10 6/mL를 사용한 CLL 세포의 농축(단계 1.3 – 1.5단계)을 사용하면 고순도(≥ 95%)로 높은 세포 회수가 가능합니다(단계 1.3 – 1.5). 1 차 적인 CLL 세포의. 도시된 샘플에서, WCC = 177 x 10 6/mL: 30 mL 혈액 샘플로부터 5 x 109 세포를 회수하였고, 이는 전체 세포의 94%의 세포 수율을 나타낸다. 유세포분석에 의한 이 샘플의 분석은 FSC/SSC, DAPI 음성(실행 가능한 세포)이었던 단일 세포에 게이팅 후 CLL 세포 마커 CD19 및 CD5의 이중 표면 발현에 의해 나타난 바와 같이 >95%의 CLL 세포의 순도를 밝혀냈다(그림1).
세포분열의 최적화는 세포질 분획의 제조 동안 다양한 세제 비(1:20 to 1:60)를 사용하여 수행하였다(단계 3.4). 그 후, 핵분획과 WFL(각각 3.5단계 및 3.6단계)을 준비하였다. 면역블롯은 CLL 세포주 MEC1(도2A)및 1차 CLL 세포의 결과분획(도2B)에서수행되었다. 블롯은 성공적인 세포 분획을 확인하기 위해 중분형 마커 인 라민 A/C(핵; 74/63 kDa) 및 β-tubulin(세포질; 55 kDa)에 대해 조사하였다. 분별은 MEC1 세포에 대한 최적의 세제 수준이 1:60희석(그림 2A)임을나타내며, 1차 CLL 세포에 대해 최적인 1:30 희석과 비교하여(그림2B),농축에 의해 지시된 바와 같이 핵 단백질과 분획에 세포질 단백질의 부족과 그 반대의 경우도마찬가지입니다. WCL은 전체 단백질을 나타내고 세포전 분열을 조사하는 데 사용되는 항체에 대한 양성 대조군으로서 작용한다. 분수 마커로 적절한 단백질을 선택하는 것이 중요합니다: 그림 2C는 RNA 폴리머라제 II (Rpb1 CTD; 250 kDa) 및 Lamin A/C가 마커로 점선된 MEC1 세포에서 제조된 핵/세포질 분획의 면역 브롯을 보여줍니다. 핵 분획은 β-tubulin 및 γ-tubulin (50 kDa)가 세포질 마커로 사용되었던 동안. γ-tubulin이 세포질에서 농축되는 것은 분명하지만 발현은이전에9에 나타난 바와 같이 핵에서 분명하다.
실험 조건이 최적화되면 실험을 수행할 수 있습니다. 도시된 예에서, 핵 및 세포질 분획에서 FOXO1의 세포 외 국소화는 MEC1 세포에서 이중 mTORC1/2 억제제 AZD8055의 존재 또는 부재 상태에서 B 세포 항원 수용체(BCR)를 가진 세포의 자극에 따라 결정되었다( 도 3A)및 1차 CLL 셀(그림3B)5,10. 두 예에서, 고도로 농축된 핵 및 세포질 분획의 생성은 세포질 분획에서 핵 분획 및 β-tubulin에서 의 거의 배타적인 라민 발현에 의해 지시된 바와 같이 달성되었다. 두 세포 유형 모두에서, FOXO1 발현은 NDC에 비해 AZD8055로 처리한 후 세포질에서 감소하였고, 핵 구획에서 FOXO1 발현의 증가를 수반하여, 따라서 단백질 전좌를 입증하였다(도3). 데이터 해석의 주관성을 제거하기 위해, 5개의 1차 CLL 샘플로부터의 개별 면역혈전을 세포내 분획 내에서 정량화하였다(4단계; 도 4A는)각각의 핵 또는 세포질 단백질을 각 시료에 대한 내부 로딩 제어로서 사용하고, 그 후 각 분획을 비자극(US) 약물 대조군(NDC) 대조군으로 정상화하였다. 결과 그래프는 핵과 세포질 분획 사이의 FOXO1 운동의 동향을 보여 주며, AZD8055는 세포질에서 FOXO1 발현 수준을 감소시키면서 핵에서 동시에 발현을 증가시킵니다. 더욱이, 세포질 FOXO1 표현의 고도는 BCR 가교시 분명하게 드러난다.
| 튜브 | 튜브 이름 | 셀/구슬 | Antigen | 플루오로포어 |
| 1 | 얼룩이 없는 | 셀 | Na | Na |
| 2 | 단일 얼룩 | 구슬 | CD5 | Fitc |
| 3 | 단일 얼룩 | 구슬 | CD19 | PE-Cy7 |
| 4 | 단일 얼룩 | 구슬 | CD23 | Apc |
| 5 | 단일 얼룩 | 구슬 | CD45 | APC-Cy7 |
| 6 | 단일 얼룩 | 셀 | 생존 능력 | DAPI |
| 7 | CLL 얼룩 | 셀 | CD5, CD19, CD23, CD45 및 생존 가능성 | FITC, PE-Cy7, APC, APC-Cy7 및 DAPI |
표 1: CLL 세포의 유세포분석기에 필요한 샘플 튜브의 이상적인 세트를 나타낸 표. 각 실험은 얻어진 결과의 정확한 분석을 위해 모든 적절한 대조군을 포함해야 한다.

도 1: 농축된 CLL 환자의 대표적인 유세포 분석 플롯. 개별 CLL 환자의 말초 혈액으로부터 농축된 단핵-CLL 세포는 FSC-A 대 SSC-A를 사용하여 게이트되었고, 더블릿은 FSC-A 대 FSC-H(A)를 사용하여 배제되었다. 얼룩이 없는 세포(튜브 1) 및 보상 제어(튜브 2-6)는 세포를 검출하고 형광 채널 사이에서 보정하기 위해 유동 세포계를 설정하여 형광 신호가 올바르게 검출되도록 하는 데 사용되었습니다. (B)CD19 및 CD5 형광 채널에서 음성 염색(비염색 세포; 튜브 1)의 예. 라이브(DAPI 음수) 및 CD45 양성 세포가게이트(C)되었고CD19+CD5+ (95.5%)의 비율이 및 CD19+CD23+ (91.2%) DAPI내의 세포-CD45+모집단(D)을 결정하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 핵/세포질 분획의 최적화. 세포질 및 핵 분획, 및 전체 세포 포액질(WCL)은, CLL세포주(A)MEC1 또는(B)환자의 말초 혈액으로부터 농축된 1차 CLL 세포의 세포 펠릿(10~ 20 x 106세포)으로부터 제조하였다. 3단계. 세포분열의 최적화는 세포질 분획을 준비할 때 의 범위의 세제 비(1:20 to 1:60)를 이용하여 수행하였다(단계 3.4에 기재된 바와 같이). 결과 샘플은 면역 블로틴화및 항-라민 A/C (핵) 및 항 β-tubulin (세포질) 항체로 조사되어 WCL과 함께 성공적인 세포 분획을 확인하였다. 분자량 마커는블롯(M)의왼쪽에 도시된다. * 세포 용해에 대한 최적의 세제 조건을 나타냅니다. (C)제어 조건 (NDC) 또는 약물 치료 (8055)와 MEC1 세포로부터 핵 및 세포질 분획의 면역 블롯 자극의 부재의 존재 (+ 또는 - BCR 가교 각각). 블롯은 항-Rbp1 CTD(클론 4H8; 인식 RNA 폴리머라제 II 소단위 B1), 항-라민 A/C, 항 β-tubulin(클론 GTU-88) 항체로 프로브하여, 세포내 분획을 식별하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 3: 세포외 분획은 CLL에서 핵과 세포질 사이의 FOXO1의 폐쇄를 보여준다. (a)MEC-1 세포 및(B)1차 CLL 세포를 100 nM AZD8055(8055) 또는 좌측 미처리(NDC)로 30분 동안 전처리한 후 BCR을 1시간 또는 미국 좌측으로 결찰하였다. 핵 및 세포질 분획을 준비하고 면역블로이트하였다. 항-라민 A/C(핵) 및 항 β-tubulin(세포질) 항체로 프로빙함으로써 분획의 확인을 받은 후, 약물 치료 및 BCR 결찰의 효과는 항 FOXO1 항체를 사용하여 FOXO1 단백질 발현에 대해 평가되었다. M은 분자량 마커를 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
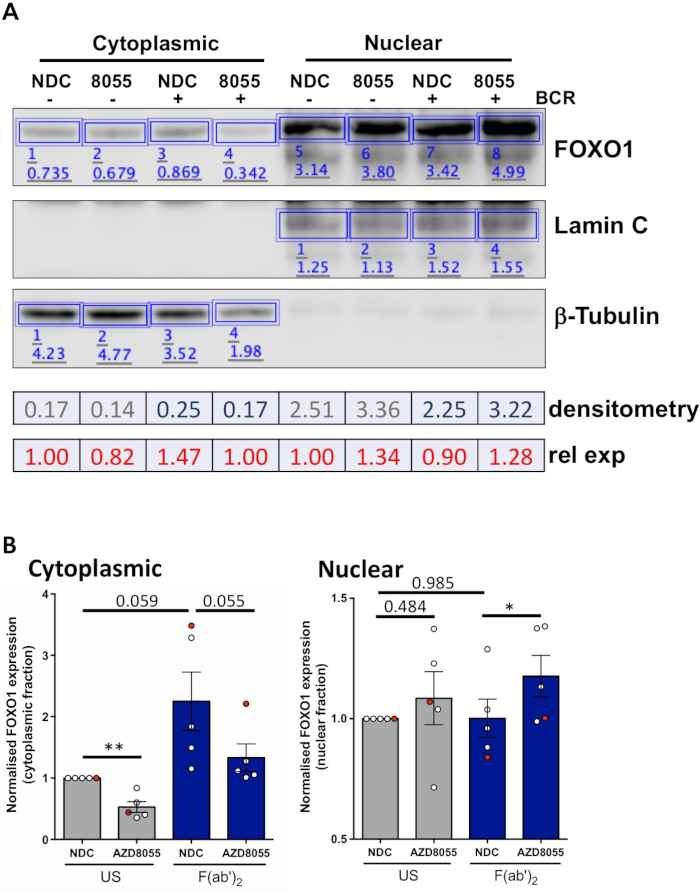
그림 4: 정량적 웨스턴 블롯 분석(밀도 측정)의 작업 예. (A)밀치성 측정은 온라인으로 이용 가능한 웨스턴 블롯 분석 소프트웨어를 사용하여 수행하였다. 간단히, 분석 리본 내에서, 직사각형은 신호 강도를 계산하기 위해 이미지의 단백질 밴드 주위에 그려졌다. 묘사된 것은 세포질/핵 분획을 겪은 CLL 환자 샘플의 대표적인 서양 얼룩 이미지의 밀도 측정이다. 세포질 및 핵 분획은 세포질 (β-tubulin) 및 핵 (Lamin A/C) 마커의 발현에 의해 구별됩니다. 주어진 조건에 대한 FOXO1의 정규화된 발현은 분석되는 분획에 따라 Β-Tubulin 또는 Lamin A/C에 대한 상응하는 신호로 FOXO1에 대해 얻어진 신호를 분할함으로써 계산될 수 있다. 상대 FOXO1 발현(미국 차량 제어에 상대적)은 주어진 셀룰러 분획의 미국 차량 제어의 정규화된 FOXO1 발현에 의해 주어진 조건의 정규화된 FOXO1 발현을 나누어 계산할 수 있다. (B)각 셀룰러 분획 내에서 미국-NDC 제어로 정규화된 세포질(왼쪽) 또는 핵(오른쪽) 분획에서 FOXO1 발현 수준을 나타내는 그래프. 그래프의 빨간색 점은 표시된 작업 예제입니다. 이 데이터는 US-NDC±SEM. P 값과 비교하여 FOXO1 발현의 평균 배 변화를 나타내며, P 값은 쌍이 t 시험을 페어링한 학생에 의해 결정되었다. n = 개별 CLL 환자 샘플 5개. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
설명된 프로토콜은 1차 CLL 세포로부터 핵 및 세포질 분획의 생성을 위한 빠르고 효율적인 방법을 제공하며, 세포 자극 시 핵 및 세포질 분획 사이의 단백질 트래피킹을 정량화합니다. 및 약물 치료. 제시된 데이터는 F를 통해 BCR 가교의 존재/부재에서 이중 mTOR 억제제 AZD8055로 처리시, 핵 및 세포질 분획 사이 특정 단백질의 인신 매매를 검출하는 능력을 보여줍니다, 예를 들어, 핵 및 세포질 분획 사이 ab')2 개의 단편 자극(그림 3 및 그림 4). 개별 CLL 환자 샘플에서 웨스턴 블롯의 정량화와 이러한 실험을 결합, 생성 된 데이터의 객관적인 분석을 가능하게하고 단백질 국소화의 글로벌 변화를 정량화하기 위해 설명 된 분석의 견고성을 보여줍니다 CLL 세포는 환자 코호트로부터 단리된것이다(그림 4). 세포질 분획에서 평균 5명의 환자 샘플이 거의 유의에 도달했다는 것은 데이터에서 분명합니다. CLL 환자11의임상 이질성을 감안할 때, 이러한 분석은 일반적으로 더 큰 환자 집단에서 수행될 것이며, 환자의 특정 예후 하위 집단에 초점을 맞추어 CLL의 세포 반응에 대한 완전한 이해를 얻을 수 있습니다. 특정 약물 치료에 세포.
제시된 데이터는 분수의 순도가 이 마커에 의해 확인될 것이기 때문에 세포질 또는 핵 분획에 독점적으로 상주하는 단백질 마커선택의 중요성을 보여줍니다. β-tubulin은 세포질 분획 확인을 위해 선택되었고, 라민 A/C는 핵 마커로 하였다. 일반적으로 사용되는 추가 단백질은 핵 분획순도4,5에대한 세포질 분획 또는 Brg1 (SMARCA4), TFIID 및 RNA 폴리머라제 II를 확인하기 위해 GAPDH 및 α-tubulin이다. 그러나, 특정 분획에서 고도로 농축되고 두 분획(예를 들어, γ-tubulin)에 존재하지 않는 단백질을 선택할 때 주의해야한다(도 2C)9. 실제로, GAPDH 및 액틴은 일반적으로 세포질 단백질로 간주하면서 핵12,13에국소화할 수 있으며, 자극 또는 치료 시 재배치되지 않는 분획 마커를 선택하는 것의 중요성을 강조한다. 세포에 적용됩니다. 더욱이, 선택된 단백질 마커가 세포 외 분획과 함께 WCL을 실행하여 관심 있는 세포에서 발현되는것을 확인하는 것이 중요하다.
도시된 대표적인 실험에서, 동일한 수의 CLL 세포를 각 조건(자극/약물 치료)에 대해 사용하였고, 그 후 분획 샘플을 즉시 제조하였다. 분별된 단백질/레인10 μg를 적재하면 관심 있는 단백질을 검출하기에 충분한 물질을 제공합니다. 이들 시료는 단기 약물 치료 및 자극(최대 4시간)을 겪었기 때문에, 단백질 수준이 각 샘플에서 동일하게 유지될 것으로 가정하고, 단백질 분석이 수행되지 않았다. 그러나, 세포 처리가 연장되는 경우에 (18 - 72 h), 세포에 있는 세포 사멸 또는 증식의 수준은 현저하게 추출된 단백질의 질 그리고 양을 바꿀 수 있습니다, 적용된 약/세포 자극에 따라, 따라서 처리에 있는 단백질 수준을 변경합니다 /자극 된 샘플. 이러한 경우 장기 약물 치료에 대해, 면역블롯의 각 레인에서 동일한 양의 단백질이 실행되도록 하기 위해 서양 블로팅 전에 브래드포드 분석또는 이에 상응하는 단백질 정량화를 수행하는 것이 바람직하다. 세제의 존재는 특정 단백질검소(14)를방해할 수 있으며, 이러한 간섭은 세포 분획 단백질 샘플을 희석시킴으로써 감소될 수 있다. 또한, 테스트중인 샘플과 동일한 희석을 사용하여 전체 용해 버퍼를 블랭크로 사용하십시오.
여기에서 기술된 사실 인정을 위한 지원 기록을 제공하기 위하여는, 병렬 실험은 이 사실 인정의 가시화를 가능하게 하기 위하여 CLL 세포 내의 FOXO1의 위치를 분석하기 위하여 형광 현미경 검사법을 사용하여 수행될 수 있었습니다5. 더욱이, 생성된 세포분열은 또한 추가하류 분석에서 효소 활성 분석 또는 프로테오믹스 분석을 위해 사용될 수 있다.
공개
저자는 공개 할 것이 없다.
감사의 말
저자들은 나타샤 말릭 박사에게 원고를 비판적으로 검토해 준 것에 대해 감사를 표하고 싶습니다. 이 연구는 AMM (18003)에 수여 된 블러드 와이즈 프로젝트 보조금에 의해 지원되었다. FACS 분석 시설은 하와트 재단의 자금지원을 받았습니다. MWM은 폴 오고먼 백혈병 연구 센터의 친구에서 박사 과정 학생에 의해 투자되었다, JC는 폴 O'Gorman 백혈병 연구 센터의 친구에 의해 투자되었고 JH는 블러드 와이즈 프로젝트 보조금에 의해 지원되었다 (18003).
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge Tubes | Griener Bio one | 616201 | |
| 3 mL Pasteur Pipettes | Griener Bio one | 612398 | |
| 12 mm x 75 mm FACS Tubes | Elkay | 2052-004 | |
| 15 mL Tube | Griener Bio one | 188271 | |
| 50 mL Tube | Griener Bio one | 227261 | |
| anti-CD5 FITC antibody | BD Biosciences | 555352 | phenotypic surface marker |
| anti-CD19 PE Cy7 antibody | BD Biosciences | 557835 | phenotypic surface marker |
| anti-CD23 APC antibody | BD Biosciences | 558690 | phenotypic surface marker |
| anti-CD45 APC Cy7 antibody | BD Biosciences | 557833 | phenotypic surface marker |
| anti-β-Tubulin antibody | Cell Signaling | 2146 | cytoplasmic marker |
| anti-γ-Tubulin Mouse antibody (clone GTU-88) | Sigma-Aldrich | T5326 | |
| anti-FoxO1 (C29H4) Rabbit antibody | Cell Signaling | 2880 | |
| anti-Lamin A/C antibody | Cell Signaling | 2032 | nuclear marker |
| anti-mouse IgG, HRP-linked Antibody | Cell Signaling | 7076 | Secondary antibody |
| anti-rabbit IgG, HRP-linked Antibody | Cell Signaling | 7074 | Secondary antibody |
| anti-Rpb1 CTD antibody (clone 4H8) | Cell Signaling | 2629 | nuclear marker |
| BDFACS Canto II | BD Biosciences | By Request | Flow Cytometer |
| DAPI Solution | BD Biosciences | 564907 | live/dead discriminator |
| DMSO | Sigma | D2650 | |
| EDTA | Sigma | EDS | |
| Fetal Bovine Serum | Thermofisher | 10500064 | |
| GraphPad Prism 6 | GraphPad Software | Software | |
| Histopaque1077 density gradient media | Sigma | H8889 | |
| HyperPAGE 10 - 190 kDa protein marker | Bioline | BIO-33066 | Molecular weight marker |
| Image Studio Lite (version 5.2.5) | LI-COR | www.licor.com | Software |
| Labnet VX100 | Fisher Scientific | Vortex | |
| Nucelar Extract Kit | Active Motif | 40010 | |
| OneComp eBeads | Thermofisher | 01-111-42 | |
| Trypan Blue Solution | Thermofisher | 15250061 | |
| PageRuler Plus Prestained Protein Ladder | Thermo Fisher Scientific | 26619 | Molecular weight marker |
| PBS Tablets | Fisher Scientific | BR0014G | |
| RosetteSep Human B Cell Enrichment Cocktail | Stem Cell Technologies | 15064 | |
| Sigma 3-16P | SciQuip | Centrifuge | |
| Sigma 1-15PK | SciQuip | Centrifuge | |
참고문헌
- Kau, T. R., Way, J. C., Silver, P. A. Nuclear transport and cancer: from mechanism to intervention. Nature Reviews Cancer. 4, 106-117 (2004).
- Turner, J. G., Dawson, J., Sullivan, D. M. Nuclear export of proteins and drug resistance in cancer. Biochemical Pharmacology. 83, 1021-1032 (2012).
- Nakamura, N., et al. Forkhead transcription factors are critical effectors of cell death and cell cycle arrest downstream of PTEN. Molecular and Cellular Biology. 20, 8969-8982 (2000).
- Calnan, D. R., Brunet, A. The FoxO code. Oncogene. 27, 2276-2288 (2008).
- Cosimo, E., et al. AKT/mTORC2 inhibition activates FOXO1 function in CLL cells reducing B cell receptor-mediated survival. Clinical Cancer Research. 25, 1574-1587 (2019).
- Mahipal, A., Malafa, M. Importins and exportins as therapeutic targets in cancer. Pharmacology & Therapeutics. 164, 135-143 (2016).
- Hing, Z. A., et al. Next-generation XPO1 inhibitor shows improved efficacy and in vivo tolerability in hematological malignancies. Leukemia. 30, 2364-2372 (2016).
- Lapalombella, R., et al. Selective inhibitors of nuclear export show that CRM1/XPO1 is a target in chronic lymphocytic leukemia. Blood. 120, 4621-4634 (2012).
- Hořejší, B., et al. Nuclear γ-tubulin associates with nucleoli and interacts with tumor suppressor protein C53. Journal of Cellular Physiology. 227, 367-382 (2012).
- McCaig, A. M., Cosimo, E., Leach, M. T., Michie, A. M. Dasatinib inhibits B cell receptor signalling in chronic lymphocytic leukaemia but novel combination approaches are required to overcome additional pro-survival microenvironmental signals. British Journal of Haematology. 153, 199-211 (2011).
- Fischer, K., Hallek, M. Optimizing frontline therapy of CLL based on clinical and biological factors. Hematology. American Society of Hematology. Education Program. 2017, 338-345 (2017).
- Butera, G., et al. Regulation of autophagy by nuclear GAPDH and its aggregates in cancer and neurodegenerative disorders. International Journal of Molecular Sciences. 20, 2062(2019).
- Virtanen, J. A., Vartiainen, M. K. Diverse functions for different forms of nuclear actin. Current Opinion in Cell Biology. 46, 33-38 (2017).
- Friedenauer, S., Berlet, H. H. Sensitivity and variability of the Bradford protein assay in the presence of detergents. Analytical Biochemistry. 178, 263-268 (1989).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유