Method Article
Expressão, purificação e ligação lipossoma dos heterodimers brotamentos do SNX-BAR do fermento
Neste Artigo
Resumo
Aqui, apresentamos um fluxo de trabalho para a expressão, purificação e ligação liposoma de heterodimers SNX-BAR em levedura.
Resumo
As proteínas SNX-BAR são uma classe evolutivamente conservada de proteínas de remodelação da membrana que desempenham papéis fundamentais na triagem e tráfico de proteínas e lipídios durante a endocitose, classificação dentro do sistema endosômico e autofagia. Central para a função de proteína SNX-BAR é a capacidade de formar homodimers ou heterodimers que ligam membranas usando altamente conservado phox-homologia (PX) e BAR (Bin / Anfiphysin / Rvs) domínios. Além disso, a oligomerização dos dimers SNX-BAR nas membranas pode provocar a formação de túbulos e vesículas de membrana e esta atividade é pensada para refletir suas funções como proteínas de revestimento para transportadores de transporte derivados do endosome. Os investigadores têm utilizado por muito tempo estudos de ligação in vitro usando proteínas recombinantes de SNX-BAR em lipossomos sintéticos ou vesículas unilamellares gigantes (GUVs) para revelar a composição precisa dos lipids necessários para conduzir a remodelação da membrana, assim revelando seu mecanismo da ação. No entanto, devido a desafios técnicos com sistemas de dupla expressão, toxicidade da expressão de proteína SNX-BAR em bactérias e falta de solubilidade de proteínas SNX-BAR individuais, a maioria dos estudos até o momento examinaram homodimers SNX-BAR, incluindo dimers não fisiológicos que se formam durante a expressão em bactérias. Recentemente, otimizamos um protocolo para superar as principais deficiências de um sistema típico de expressão bacteriana. Usando este fluxo de trabalho, demonstramos como expressar e purificar com sucesso grandes quantidades de heterodimers SNX-BAR e como reconstituí-los em lipossomos sintéticos para ensaios de ligação e tubulação.
Introdução
Organelas ligadas à membrana, como a membrana plasmática, o retículo endoplasmico, o aparelho Golgi, o lisósoma (vacuole de levedura) e o endosome compõem o sistema de endosmembrana da célula eucariótica. A maioria das organelas tem a capacidade de comunicar e trocar material com outras organelas através de transportadores de transporte de vesículas. Como a célula coordena a embalagem e formação de transportadores de transporte de vesículas dentro do sistema de endosmembrana não é bem compreendida. No entanto, as proteínas e lipídios que constituem grande parte do sistema de endosmembrana são conhecidos por se originar de internalizar vesículas endócticas da membrana plasmática (PM). O endosome é o organela principal do acceptor para estas vesículas e é compreendido de jogos interconectados múltiplos de organelas tubulares. A principal função do endosome é facilitar a aquisição de nutrientes, regular o volume de negócios de proteínas e lipídios, proteger contra a infecção por patógenos e servir como a principal fonte de reposição de lipídios para a membrana plasmática. Como o endosome recebe a maior parte das proteínas de carga e lipídios da membrana plasmática, ele atua como um compartimento de triagem, isolando as cargas em transportadores de transporte endosômico tubular (ETCs). Quaisquer proteínas não seqüecidas em ETCs são deixadas para serem degradadas através do sistema endo-lossômico. A desregulação da classificação de carga em ETCs pode levar à perda de absorção de nutrientes, rotatividade de proteínas ou homeostase lipídica, resultando em inúmeras distúrbios metabólicos, de desenvolvimento e neurológicos1,2. No entanto, apesar do papel central dos ETCs no endossômico, o mecanismo subjacente de como o endossôpode pode coordenar seletivamente a embalagem de uma infinidade de cargas heterogêneas em portadores tubulares não é conhecido.
A família de triagem nexina (SNX) é uma classe evolutivamente conservada de proteínas que foram consideradas críticas para muitas reações de transporte de vesículana na célula3,4,5. A triagem de nexinas é recrutada para a membrana endossômica e ajuda na captura de carga através de seu domínio característico de homologia foscar (PX), que liga fosphatidylinositol-3-monofosfato (PtdIns(3)P), um lipídio enriquecido na membrana endossô. Mamíferos codificam trinta e três proteínas SNX, que podem ser ainda mais divididas em várias subfamílias, de acordo com a presença de outros domínios1. Mais notavelmente, a subfamília SNX-BAR é a maior subfamília composta por doze em humanos, enquanto no fermento em ascensão, Saccharomyces cerevisiae, a subfamília é reduzida para apenas sete SNX-BARs. As proteínas SNX-BAR têm um domínio PX e um domínio Bin-Anfiphysin-Rvs (BAR) que desencadeia reservatórios lipídicos para ligar membranas de curvatura positiva. Consequentemente, a família SNX-BAR tem uma afinidade natural com o endossôe e pode mediar a formação etc através de suas habilidades de remodelação da membrana. In vitro, as propriedades de remodelação dos SNX-BARs podem ser induzidas pela adição de SNX-BARs purificados a lipossomos sintéticos e a formação subsequente de tubulos estreitos e revestidos pode ser visualizada por microscopia eletrônica. Usando esses métodos, os pesquisadores determinaram que tanto a concentração de oligomerização quanto a força de constrição parecem variar entre a família SNX-BAR, sugerindo que eles poderiam ajudar tanto na formação quanto na scission dos ETCs.
Os SNX-BARs podem ser classificados ainda mais por suas propriedades exclusivas de dimerização. Ensaios e estudos estruturais in vitro vinculativos demonstraram que as proteínas SNX-BAR só podem formar homodimers ou heterodimers específicos. Portanto, em princípio, cada potencial dimer-oligomer SNX-BAR poderia fornecer um casaco tubule para uma via de tráfico específico de carga e, da mesma forma, a oligomerização restrita dos outros protomermers SNX-BAR, também pode definir caminhos de exportação distintos. No entanto, devido ao grande número de SNX-BARs e diversidade dentro da família SNX, uma hipótese de carga nexina-one de triagem é altamente improvável. Em vez disso, um esforço coordenado usando uma infinidade de fatores, como SNX-BARs, carga, especificidade lipídicas e outras dependências é mais provável. Da mesma forma, estudos recentes da família levedura SNX4 revelaram evidências de especificidade lipídica adicional, além de PtdIns (3)P, para potencializar transportadores de transporte endôssomo6. Neste estudo, SNX-BAR homodimer Mvp1-Mvp1 foi purificado de bactérias e heterodimers nativos Snx4-Atg20 e Vps5-Vps17 foram expressos e purificados em alto rendimento de levedura, enquanto apenas Snx4-Atg20 foi encontrado para ligar preferencialmente phosphatidylserine (PS) e forma estreita tubo-como estruturas em estudos de ligação liposome6. Enquanto outros no campo revelaram propriedades importantes dos SNX-BARs usando homodimers SNX-BAR recombinantemente purificados de bactérias, toxicidade associada à expressão heterodimers SNX-BAR em sistemas semelhantes têm dificultado a sua caracterização nativa7,8,9,10. Portanto, sem um sistema confiável para obter heterodimers nativos recombinantemente expressos, os pesquisadores devem renunciar a essas linhas de investigação. Na Figura 1,apresentamos um fluxo de trabalho em quatro partes para 1) construímos uma cepa de levedura superexpressando heterodimers SNX-BAR para purificação de afinidade tandem, 2) expressar e purificar heterodimers nativos SNX-BAR, 3) preparar lipossomos sintéticos unilamellares, e 4) configurar uma tubulação liossoma ou ensaio sedimentações, fornecendo uma ferramenta vital para os pesquisadores para investigar o catálogo crescente de nexinos classificação encontradona natureza.
Protocolo
1. Construção da tensão do fermento
- Comece com TVY614 (pep4Δ::LEU2 prb1Δ::hisG prc1Δ::HIS3)11 como a cepa pai. Esta cepa é deficiente para proteases vacuolares, que contribuem para a maioria da degradação da proteína após a lisose celular e, portanto, permite uma purificação mais limpa e eficiente.
- Projetar primers12 e integrar aplicação em conjunto purificação (TAP) tag no C-terminus de Atg20 (SNX-BAR ORF 1) usando recombinação homóloga. Use a reação em cadeia de polimerase (PCR) para confirmar integrações(Figura 2).
- Executar uma mancha ocidental de lysate celular contra a tag TAP para confirmar a integração adequada13.
Nota: Recomendamos a colheita de 3 OD (1 OD - 1 x 107 células) de células para sds-page e verificação de manchas ocidentais. Note-se que a integração da tag TAP deve ocorrer antes de substituir os promotores endógenos com o promotor GAL1 para permitir uma verificação mais fácil tag TAP via mancha ocidental. - Substitua os promotores endógenos do Snx4 (SNX-BAR ORF1) e atg20 (SNX-BAR ORF 2) pelo promotor GAL1 não escalotado usando recombinação homóloga sequencial e etapas de transformação de cada ORFindividual 14.
- Use primers flanqueados fora dos locais de integração para PCR confirmar integrações bem sucedidas(Figura 2). Isso resultará em um fenótipo nulo dos SNX-BARs direcionados na ausência de galactose no meio de crescimento.
2. Indução de Levedura e Purificação SNX-BAR Dimer
Nota: As células de levedura podem ser propagadas em YPD padrão (extrato de levedura, peptone e 2% de placa de ágar de glicose) à medida que as modificações são cromossomicamente integradas.
- Inocular um grande cotonete de células em 50 mL de YP padrão (extrato de levedura e peptone) médio com 2% raffinose e 0,1% de glicose como fonte de carbono em um frasco de pelo menos 4x o volume da cultura e crescer durante a noite em 30 ° C shaker para permitir a aeração adequada. Espere que o crescimento neste meio será mais lento em comparação com ypd padrão.
- Na manhã seguinte, use a precultura de 50 mL para inocular em 1 L do meio yp padrão com 2% de raffinose e 0,1% de glicose e crescer para 4-5 h em 30 °C shaker.
Nota: O volume de pré-cultura usado para inocular a cultura 1 L pode ser ajustado dependendo do OD600 da precultura. O OD600 da cultura 1 L após a inoculação deve ser em torno de 0,2 para permitir pelo menos duas duplicações durante o crescimento de 4-5 h.- Use um frasco de Fernbach perplexo para o crescimento para permitir a aeração adequada, um frasco de volume 2.8 L é suficiente. Menos aeração pode resultar em crescimento mais lento e pelota celular menor após a colheita.
- Verifique OD600 para se certificar de que a cultura está na fase de log (0,5-1) após 4-5 h de crescimento. Dependendo do crescimento da tensão, faça ajustes ao tempo de crescimento para permitir pelo menos duas duplicações. Adicione a 2% de galactose e cresça durante a noite em 30 °C shaker.
Nota: O OD600 após o crescimento durante a noite pode variar, mas a cultura deve ser saturada. Note-se que as células não precisam ser removidas de 0,1% de glicose antes da adição de 2% de galactose para este protocolo de crescimento. Recomendamos a colheita de 3 OD de células não induzidas e induzidas nesta etapa para SDS-PAGE e mancha ocidental para verificação (Figura 3A,B, Pista 1-2). - Colheas células por centrífuga a 4500 x g por 15 min. Um rotor balançando do balde que acomode a cultura do volume de 1 L pode ser usado aqui.
- Transfira a pelota do fermento em um tubo cónico de 50 mL; um segundo passo de centrífuga pode ser realizado conforme necessário. A pelota celular geralmente será em torno de 10-15 mL em volume medido por marcações de graduação e pode ser usado imediatamente ou armazenado a -80 °C.
- Resuspender a pelota em 15 mL purificação buffer (50 mM Tris pH 7.4, 300 mM NaCl, 1.5 mM MgCl2, 1 mM Dithiothreitol (DTT), protease inibidor cocktail) para fazer volume final em torno de 30 mL.
- Chill um homogeneizador 4 °C antes de usar e equilibrá-lo com tampão de purificação. Células de lyse usando um disruptor de células mecânicas ou homogeneizador. Amostra de carga no homogeneizador e lyse em 20.000-25.000 psi para 2-3 rodadas; note que, à medida que as células ficam lysed, mais pressão de entrada é necessária para manter 20.000-25.000 psi. Recolher o lysate celular em um tubo cônico de 50 mL no gelo.
Nota: Se amostras adicionais precisarem ser lysed, o homogeneizador deve ser completamente limpo e equilibrado antes de carregar a próxima amostra. Mantenha todas as corsadas celulares no gelo. - Imediatamente limpar o lysate celular em 35.000 x g para 1 h a 4 °C. Transfira cuidadosamente o supernatant em novo tubo. Note-se que os lipídios da lyse celular flutuarão até o topo durante a centrifugação e não afetarão a purificação.
Nota: Recomendamos economizar 0,5-1% do lysate e pelota para amostras SDS-PAGE. Normalmente, não são observadas grandes diferenças e uma mancha ocidental adicional pode ser feita para confirmar a solubilidade proteica tap (Figura 4, Pistas 1 e 2, respectivamente). - Equilibre 300 μL de contas de sefarof IgG com tampão de purificação. Adicione ao lysate de células limpas e incubada por 2 h, girando a 4 °C.
- Coletar contas em uma coluna de cromatografia de 10 mL e permitir que o lysate desvinculado flua completamente.
- Lave contas usando 10 mL de tampão de lavagem (50 mM Tris pH 7.4, 300 mM NaCl, 1.5 mM MgCl2,1 mM DTT), adicionando 1 mL de cada vez e permitindo que flua completamente.
Nota: Recomendamos economizar 2% das contas de IgG para a amostra SDS-PAGE. Normalmente, observamos quatro grandes bandas; duas proteínas SNX-BAR e IgG Heavy and Light Chains(Figura 4,Pista 3). Recomendamos economizar quantidades equivalentes de 'eluate' e 'contas IgG após TEV' para comparar para a eficiência de clivagem TEV. - Coletar contas e transferi-los para um tubo de microcentrífuga. Adicione a 500 μL de volume total com tampão de lavagem fresca e 2 μL de 10 mg/mL TEV protease e incubar durante a noite, girando a 4 °C.
- Na manhã seguinte, retire o supernatant completamente usando uma agulha 27 G e avaliar a pureza da proteína por 10% poliacrilamida SDS-PAGE (Figura 4, Pista 4).
Nota: Normalmente obtemos 500 μL de 0,5-1 mg/mL de 95% heterodemer puro (Figura 4,Pista 4). Purificação adicional usando resina de calmodulina também pode ser feito, no entanto, normalmente vemos uma redução significativa no rendimento e recomendamos parar aqui se a pureza é >90%. TEV não interfere com ensaios de ligação lipossoma, embora TEV pode adicionalmente ser removido usando Contas agarose Ni-NTA15. - Para se concentrar, transfira a amostra para um filtro centrífuga de 0,5 mL com 10 kda de corte e centrífuga de acordo com as instruções do fabricante para 50 μL ou menos. Quantificar as proteínas concentradas usando o ensaio proteico bradford. Guarde a 4 °C e use dentro de uma semana.
3. Preparação para Lipossoma
- Comprar lipídios comercialmente disponíveis: fósforoarfrina (PS), PI3P, ergosterol e fosfatatidylcholine (PC). Se necessário, resuspender em solvente recomendado para fazer lipídios de ações.
Nota: Os lipídios são resuspensos em uma mistura de metanol/clorofórmio por recomendações do fabricante. Certifique-se de estoques lipídicos são claras e aquecidas à temperatura ambiente antes de usar. Lipídios resuspendidos podem ser armazenados gás argônio e selados usando filme de cera (ou equivalente) a -20 °C por 6-12 meses ou até que a perda de atividade seja observada. - Calcule o volume exigido de cada estoque lipídico para criar uma mistura com a composição lipídica desejada (ver Tabela 1). Assuma um total de 1 toupeira de lipídios na mistura lipídicas.
- Executar este passo em um capô de fumaça química. Limpe seringas de vidro elaborando um volume completo de seringa de clorofórmio e descartando-o em um recipiente de resíduos. Repita mais duas vezes. Ao transferir clorofórmio, use apenas seringas de vidro ou pipetas. Ao elaborar clorofórmio, puxe a rolha lentamente para evitar a introdução de bolhas de gás na seringa.
- Use seringas de vidro para transferir lipídios de estoque calculados em um tubo de cultura de vidro limpo para fazer uma mistura lipídica final de 1% PI3P, 20% ergosterol, 30% PS, PC (Tabela 1). Dependendo dos solventes cada lipídio é resuspendido, a mistura pode ficar turva após a adição de cada lipídio.
Nota: Para variar as concentrações de PS (0-30%), ajustar os volumes em conformidade e compensar com pc variável (Tabela 1). - Seque cuidadosamente a mistura lipídica usando gás nitrogênio direcionado à mistura lipídica em um movimento circular para secar lipídios uniformemente. Use o baixo fluxo de gás para manter os lipídios na parte inferior do tubo de vidro durante o processo de secagem. Envolva o tubo de cultura de vidro com papel alumínio, deixando a abertura descoberta, e desidratar ainda mais no vácuo por 1 h.
- Adicione 400 μL de buffer de ligação (50 mM Tris pH 7.4, 300 mM NaCl, 1 mM MgCl2)para desidratar completamente lipídios para fazer uma concentração liposoma final de 2,5 mM.
Nota: A concentração lipossoma final pode ser ajustada adicionando mais ou menos tampão de ligação. Por exemplo, 200 μL tampão de ligação pode ser adicionado para produzir uma concentração de lipososoma de 5 mM, se necessário (veja abaixo).- Suspender os lipídios agitando em velocidade média em um vórtice à temperatura ambiente por 30 min. Buffer deve aparecer nublado como lipídios são resuspensos.
- Transfira lipossomas resuspendidos para um tubo de microcentrífuga. A partir deste ponto, as pontas de pipetas de plástico podem ser usadas como lipídios não são mais resuspensas em clorofórmio. Note-se que a solução de lipossoma deve parecer nublado.
- Liofreça-descongele lipossomos sete a oito vezes submergindo o tubo de microcentrífuga primeiro em nitrogênio líquido, depois em um banho de água de 37 °C. A mistura de lipossoma deve aparecer completamente congelada e sólida por olho antes de descongelar.
- Executar etapas envolvendo clorofórmio em um capô de fumaça química. Limpe duas seringas de vidro de 1 mL, elaborando e descartando volumes completos de seringa de clorofórmio, três vezes cada, para remover quaisquer lipídios residuais. Equilibre cada seringa de vidro com água ultrapura através da elaboração de dois volumes de seringas, em seguida, equilibrar com tampão de ligação através da elaboração de dois volumes de seringa.
- Monte o mini-extruso de acordo com as recomendações do fabricante. Equilibre uma membrana de 200 nm e duas peças de suportes de filtro (ver Tabela de Materiais),submergindo cada um em tampão de ligação.
- Sanduíche a membrana entre o filtro suporta e coloque no mini-extruso. Para reduzir o volume morto no mini-extruso montado e para se certificar de que a montagem é hermética, passe um volume de tampão de ligação comparável ao volume da mistura de lipossoma através de mini-extruso usando as seringas de vidro 1 mL.
- Use uma das seringas de vidro 1 mL e misture a mistura de lipososoma. Inverte o tubo de microcentrífuga para coletar o último da mistura de lipossoma na tampa do tubo para o desenho para a seringa de vidro.
- Extrude os lipossomos, passando pela membrana de 200 nm 19-21 vezes. Colete lipossomos extrudados em um novo tubo de microcentrífuga.
Nota: Os lipossomos extruded devem parecer menos nebulosos do que lipossomos antes da extrusão. Os lipossomas devem ser usados no mesmo dia e armazenados no gelo. A última extrusão deve colocar lipossomas na seringa oposta à que começou.
4. SNX-BAR Liposome Binding e Tubulation
- Proteína purificada pré-clara a 100.000 x g em um ultracentrífuga por 20 minutos a 4 °C antes de realizar experimentos de ligação lipossoma e sedimentação. Retire o supernatant e transfira-o para um novo tubo de microcentrífuga; não perturbe a pelota se houver uma.
- Para realizar ensaios de encadernação lipossoma e tubulação, incubar 4 μM purificado Snx4-Atg20 e 2,5 mM lipossomos em um volume de reação total de 20 μL, variando o volume de lipossomas adicionados.
Nota: No mesmo experimento, o mesmo volume de lipossomos deve ser usado. - Incubar a reação a 30 °C por 30 min.
Nota: Sugerimos maximizar a quantidade de lipossomos de 2,5 mM adicionados a cada reação usando nada menos que 10 lipossomas μL para permitir a visualização durante a sedimentação. Se 10 μL de 2,5 mM lipossomos é usado em uma reação de 20 μL, a concentração final de lipossomas será de 1,25 mM. Se as proteínas purificadas forem diluídas e for necessário mais volume para a proteína 4 μM, os lipídios podem ser resuspensos em 200 μL durante o passo de reidratação para dobrar a concentração de lipossomas (ver Passo 3.6); no entanto, isso vai exigir saber a concentração de proteínaantes de fazer os lipossomos. -
Visualize e quantifique a tubulação dos lipossoma.
- Processe reações de ligação lipossoma imediatamente para análise de microscopia eletrônica. Detectar amostras em uma grade de malha de cobre revestida de carbono e mancha negativa usando acetato uranyl de 1%(Figura 5B)16.
- Analise amostras em um microscópio eletrônico de transmissão (200 kV).
- Use o software de análise de imagem para medir e quantificar o diâmetro do túbulo. Para quantificar com precisão o diâmetro do túbulo de um único tubule, tome três medições de diâmetro ao longo do comprimento de um tubule e média(Figura 5B).
Nota: A análise biscada da variação foi usada para determinar o significado estatístico (Figura 5E). O acetato uranyl é radioativo e tóxico. A certificação apropriada da segurança do laboratório é exigida executar esta etapa.
-
Ligação e sedimentação de lipossoma.
- Transfira a reação (20 μL, do passo 4.3) para um tubo de centrífuga de policarbonato e use um rotor compatível para girar a 100.000 x g em um ultracentrífuga por 20 min a 4 °C. Retire cuidadosamente o supernatant e transfira para o novo tubo de microcentrífuga. Note-se que a pelota deve permanecer intacta.
- Resuspenda a pelota em SDS-PAGE 40 μL de buffer de amostra e transfira para um novo tubo de microcentrífuga. Adicione 20 μL de buffer de amostra para o supernatant. Carregar quantidades equivalentes de pelota e supernatant em um 10% poliacrilamida SDS-PAGE gel e realizar coloração Coomassie para visualizar SNX-BARs obrigados a lipossomas (Figura 5A).
- Para quantificar a quantidade de complexo SNX-BAR na fração de pelotas, quantifique as intensidades da banda usando densitometria e quantifique a proporção de proteínas SNX-BAR na fração de pelotas.
Nota: A análise biscada da variação foi usada para determinar o significado estatístico (Figura 5C).
Resultados
Este protocolo descreve um método para a produção reproduzível e robusta de complexos endógenos de levedura SNX-BAR que podem ser usados para ensaios de remodelação da membrana a jusante (Figura 1). A construção da cepa de levedura utilizada para purificação aproveita a eficiência da recombinação homóloga no fermento em brotamento, permitindo modificações nos loci genômicos dos SNX-BARs alvo (Figura 2). Este projeto tem duas vantagens, (i) como a seleção não é necessária para manter as modificações, o meio YP padrão pode ser usado, permitindo o crescimento de uma maior densidade celular e, portanto, maior produção de proteína e (ii) os níveis de expressão dos SNX-BARs direcionados serão mesmo, otimizando a produção do complexo heterodimer. Antes da adição de galactose, os SNX-BARs direcionados exibirão um fenótipo nulo e, portanto, podem resultar em um defeito de crescimento ou outros defeitos conhecidos específicos para os SNX-BARs direcionados. Além disso, o crescimento em 2% de rifosa e 0,1% de glicose é mais lento do que o crescimento em 2% de glicose. Portanto, o período de crescimento antes da indução de galactose pode exigir otimização para cada cepa específica. Para verificar se há uma indução adequada da expressão SNX-BAR, uma mancha ocidental contra a tag TAP é provavelmente necessária, uma vez que os níveis de proteína dos SNX-BARs não podem ser detectados através da mancha Coomassie (Figura 3). No entanto, como apenas um membro do complexo SNX-BAR tem uma etiqueta, a expressão da proteína não marcada (s) não pode ser confirmada a menos que todas as etapas da purificação sejam concluídas. Após a purificação do heterodimer SNX-BAR, as bandas dos dois SNX-BARs devem parecer estar em 1:1 razão estoquiométrica e deve haver pouca ou nenhuma faixa de contaminação (Figura 4, pista 4). Se houver bandas contaminantes adicionais, e a cepa de levedura inicial já é deficiente em protease, mais inibidor da protease pode ser adicionado durante a lyse celular. Além disso, uma segunda etapa de purificação usando resina de calmodulina pode ser realizada.
Ao realizar ensaios de remodelação da membrana(Figura 5),a mesma preparação de lipossomos e proteínas purificadas deve ser usada no mesmo experimento. Se forem necessárias várias preparações de purificação da proteína para atingir a concentração desejada, combine toda a proteína purificada antes da realização do experimento. Os lipossomas devem ser feitos e usados dentro do mesmo dia(Tabela 1). Ao realizar ensaios de sedimentação lipossoma, é fundamental que a proteína purificada seja pré-limpa usando as mesmas condições de sedimentação de 100.000 x g por 20 minutos imediatamente antes de incubar com lipossomas, pois a proteína precipitada pode distorcer os resultados. Além disso, a pelota de lipossoma deve permanecer intacta após a sedimentação.
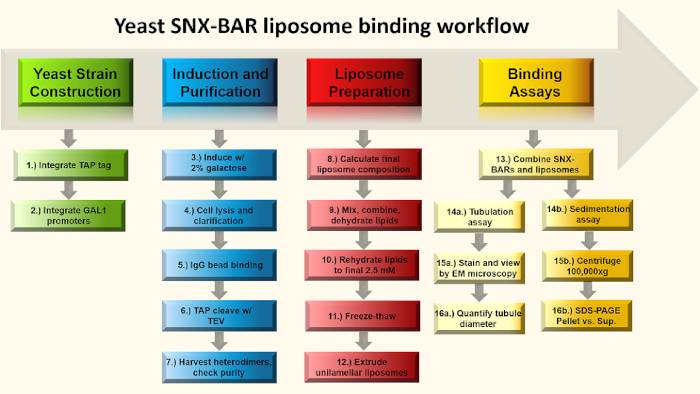
Figura 1: SNX-BAR fluxo de ensaio vinculativo. Resumidamente, nos passos 1-2, nós engenheiro promotores GAL em dois snx-bar genómico loci, substituindo cada um dos promotores endógenos e engenheiro de um C-terminal TAP tag em um dos dois SNX-BAR loci. Em seguida, nos passos 3-7, induzemos as células com galactose e purificamos os heterodimers SNX-BAR à homogeneidade. Nos passos 8-12, calculamos e preparamos os lipossomas unilamellares. Por último, podemos combinar os heterodimers SNX-BAR com lipossomas unilamellares e realizar dois ensaios; O passo 14a-16a envolve tubulação de membrana e 14b-16a envolvem o ensaio de sedimentação. Veja o texto para mais detalhes. Clique aqui para ver uma versão maior deste número.

Figura 2: Estratégia de integração SNX-BAR. Dois loci SNX-BAR foram alvo de expressão GAL usando recombinação homóloga. SNX-BAR ORF1 (Atg20) foi adicionalmente alvo de expressar uma tag TAP c-terminal. Clique aqui para ver uma versão maior deste número.

Figura 3: Verificação de indução de galactose. (A-B) A fim de verificar a indução gal de Atg20-TAP, recomendamos um SDS-PAGE e análise borrão ocidental de extratos de células induzidas com 2% de galactose (A, B, pista 2) e não induzida (A, B, pista 1). (C)A membrana ocidental da mancha é descascada igualmente e sondada com anti-pgk1 para um controle de carregamento. Clique aqui para ver uma versão maior deste número.
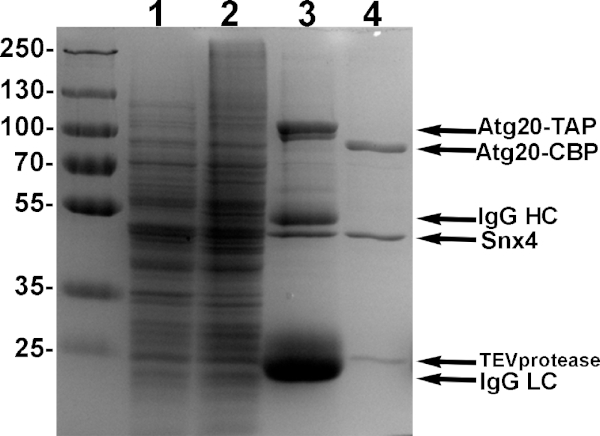
Figura 4: Exemplo de purificação dos heterodimers Atg20-Snx4. Células de levedura projetadas para expressar Atg20-TAP e Snx4 impulsionadas por promotores de galactose foram induzidas com 2% de galactose, lysed e encadernadas usando sefarose IgG e eluted com protease TEV. Amostras de cada etapa de purificação são mostradas em 10% sds-page. Pista 1: supernatant induzido do lysate. Pista 2: pelota induzida de lysate. Pista 3: amostra de proteínas vinculadas ao sepharose IgG. Pista 4: TEV eluate de heterodimers Atg20-Snx4 puro sofroso de Sepharose IgG. Clique aqui para ver uma versão maior deste número.
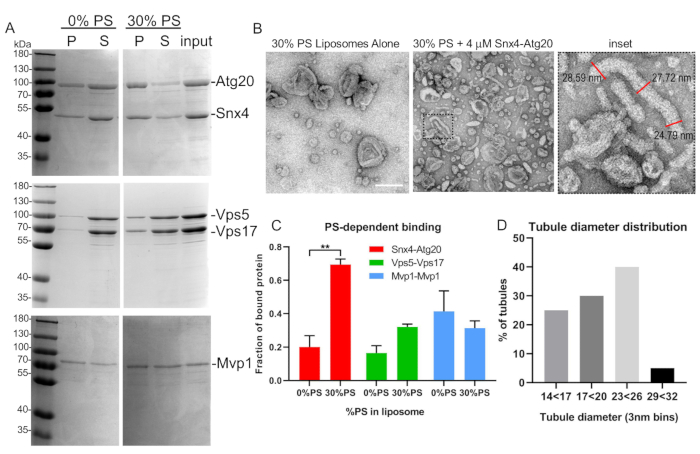
Figura 5: Ensaio representativo de ligação e tubulação de lipossoma. (A) Heterodimers SNX-BAR, Atg20-Snx4 e Vps5-Vps17 de levedura, foram expressos, purificados e ligados a lipossomas sintéticos, como descrito no texto. Note-se que Mvp1 forma homodimers e foi expresso em bactérias. (B) MICROgrafias EM de ensaio de tubulação de lipossoma Snx4-Atg20 e medições de túbulos (inserção). (C)SNX-BAR ligação a diferentes composições de lipossoma foi quantificada pela densitometria. Gráfico indica erro médio e padrão da média. **p< 0,002. (D) Os diâmetros tubule foram quantificados e grafizados conforme descrito no texto. Barra de escala = 200 nm. As barras de erro representam uma análise de variação em dois sentidos. Clique aqui para ver uma versão maior deste número.
| Composição lipossoma típica | DOPC DOPC | Dops | Ergosterol | PI3P-C16 PI3P-C16 |
| Mw | 786.1 | 810.0 | 396.7 | 957.0 |
| fração de mol | 49% | 30% | 20% | 1% |
| Stock mM Stock mM | 32.0 | 12.0 | 25.0 | 1.0 |
| Missa (mg) | 385.2 | 243.0 | 79.3 | 9.6 |
| Concentração (mg/mL) | 25.2 | 9.7 | 9.9 | 1.0 |
| Volume para RXN (mL) | 15.3 | 25.0 | 8.0 | 10.0 |
Tabela 1: Receita de lipossoma. Os lipossomos sintéticos foram preparados usando uma combinação de DOPC, DOPS, ergosterol e PI3P. Calculamos a concentração final para 1 mol de lipídio. Nossa composição padrão inclui 20% ergosterol, 1% PI3P, DOPS (até 30%) e quantidades variáveis de DOPC. A tabela inclui uma formulação típica para 400 μL de 30% DOPS.
Discussão
Aqui, demonstramos um fluxo de trabalho otimizado para purificar os dimers SNX-BAR em levedura e dois ensaios para avaliar suas propriedades biofísicas em lipossomas sintéticos. A principal vantagem sobre a expressão típica de proteína recombinante em Escherichia coli ou outros sistemas é a capacidade de expressar uniformemente as proteínas SNX-BAR em um hospedeiro nativo, evitando assim as questões de toxicidade e insolubilidade encontradas na purificação de SNX-BARs em outros sistemas. Também é notável que o nosso sistema não requer clonagem molecular ou o abrigo de múltiplos vetores de expressão17. Nossas cepas de levedura SNX-BAR duplas são impulsionadas por promotores de galactose cromossomicamente projetados, garantindo assim até mesmo a expressão após a indução. Uma consideração importante é que, na ausência de galactose, haverá pouca ou nenhuma expressão dos SNX-BARs direcionados, resultando assim em um fenótipo nulo. Além disso, descobrimos que os SNX-BARs tendem a tolerar bem as etiquetas do terminal C, o que nos permite adicionar a etiqueta TAP no C-terminus. No entanto, dependendo da proteína que está sendo marcada, uma tag TAP n-terminal também pode ser usada12. Além disso, uma vez que os SNX-BARs formam apenas 1:1 mais escuros, apenas uma proteína é necessária para ser etiquetada para fins de purificação. No entanto, alguns SNX-BARs que normalmente formam heterodimers na célula foram mostrados para formar homodimers concentrações não fisiológicas7. Portanto, é fundamental que, após a purificação do heterodimer, a proporção stoichiométrica dos dois SNX-BARs deve ser 1:1, que pode ser verificada executando um alibamento do complexo purificado em um gel SDS-PAGE e realizando coloração Coomassie. Uma vez projetadas, essas cepas de levedura podem ser salvas em perpetuidade como 15% (v/v) estoque de glicerol a -80 °C e/ou adicionalmente modificado para consultar parceiros de ligação adicionais. Nosso fluxo de trabalho normalmente leva 2-3 semanas para a construção de cepas e 3-4 dias para expressão e purificação e 1 dia para ensaios de ligação lipossoma. Acreditamos que este fluxo de trabalho pode ajudar os pesquisadores a entender ainda mais a especificidade lipídica das proteínas SNX-BAR usando proteínas BAR nativas em lipossomos sintéticos ou vesículas unilamellares gigantes (GUVs) e revelar a composição precisa dos lipídios necessários para impulsionar a remodelação da membrana, revelando assim seu mecanismo de ação.
Passos críticos
Durante nossas primeiras tentativas de purificar heterodimers SNX-BAR de células deficientes não protease, muitas vezes encontramos produtos reduzidos de rendimentos e degradação. Portanto, durante as etapas iniciais da construção de cepas, acreditamos que é fundamental começar com uma cepa de levedura parental que é deficiente para uma ou mais das principais proteínas vacuolares. Em particular, encontramos cepa de levedura TVY614, que está esgotado para pep4, prb1,e prc1, para ser o mais ideal. Usando a cepa TVY614, nós rotineiramente obter >90% puro Heterodimers Snx4-Atg20 (Figura 4 e Figura 5A). No entanto, a necessidade de todas as três proteínas serem ablated pode ser a combinação SNX-BAR específica. Por exemplo, os heterodimers Vps5-Vps17 foram purificados com sucesso em cepas deficientes não protease10 e quando incluímos a adição de uma ablação pep4, observamos aumentos modestos no rendimento e pureza(Figura 5A). Portanto, dependendo dos aplicativos a jusante do usuário e da necessidade de pureza ou marcadores selecionáveis, pode haver flexibilidade ao projetar cepas de expressão.
A ordem da construção de genes também é importante. Recomendamos a marcação c-terminal tap SNX-BAR ORF 1 primeiro, a fim de confirmar a expressão por borrão ocidental sem a necessidade de indução de galactose (Figura 1). Durante a indução de galactose, é fundamental pré-condicionar as células durante a noite em 2% de raffinose e 0,1% de glicose. A incapacidade de pré-condicionar as células resulta em crescimento extremamente lento ou morte celular. No entanto, também é fundamental para as células esgotar a glicose restante durante o crescimento durante a noite, caso contrário, a indução de galactose pode ser impactada negativamente. Também é recomendado verificar vários isolados por borrão ocidental para avaliar a homogeneidade de expressão das proteínas Tap marcados SNX-BAR. Nós normalmente tela 2-3 isolados e escolher o candidato mais robusta expressando.
Modificação, abordagens alternativas e aplicações futuras
Na etapa 2.8, a purificação da afinidade tandem (TAP) normalmente requer uma purificação de afinidade em duas etapas usando contas IgG e calmodulin após a clivagem TEV12. No entanto, neste protocolo, nós elutes snx-bar dimers por tev protease com muito alto rendimento e pureza. Encontramos purificação de afinidade subseqüente usando contas de calmodulina produz rendimentos inconsistentes e reduzidos, portanto, recomendamos parar após a clivagem TEV. O eluate TEV contendo as proteínas SNX-BAR e sua protease TEV (6) marcada pode ser ainda mais purificado por contas agarose Ni-NTA. No entanto, também descobrimos que esta etapa pode reduzir o rendimento geral da proteína SNX-BAR e é desnecessária, uma vez que a protease TEV não interfere com ensaios de ligação ou tubulação de lipossoma. Portanto, se os SNX-BARs purificados serão usados para qualquer outro aplicativo, recomendamos que o usuário avalie o impacto da protease TEV em seus ensaios.
Até agora, temos sido bem sucedidos usando este protocolo e as modificações descritas para purificar heterodimers Snx4-Atg20 e Vps5-Vps17 em levedura e avaliaram com sucesso sua especificidade lipídica em lipossomos sintéticos. No entanto, acreditamos que o protocolo pode ser adaptado com sucesso a qualquer um dos SNX-BARs em levedura. Também é possível usar o sistema para produzir proteínas Recombinantes SNX-BAR de quaisquer outros organismos. No entanto, isso exigiria uma etapa adicional de construção de cepas para integrar um locus genético exógeno no genoma do fermento. Também acreditamos que o sistema pode ser expandido para purificar complexos multiméricos, incluindo proteínas de carga. Assim, acreditamos que nosso sistema de expressão pode ir além da compreensão das especificações lipídicas dos SNX-BARs. Aplicações futuras permitirão que os pesquisadores reconstituam complexos inteiros de captura de carga em lipossomas para entender como as assembléias completas podem influenciar a remodelação da membrana.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Pesquisa relatada nesta publicação foi apoiada pelo Instituto Nacional de Ciências Médicas Gerais dos Institutos Nacionais de Saúde o número de premiação GM060221 e em parte pelo Instituto Nacional de Ciências Médicas Gerais dos Institutos Nacionais de Saúde o número de prêmio T32GM007223. R.C. foi apoiado em parte pelo Programa de Bolsas de Pesquisa da Faculdade UNC-Charlotte.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.2 μm PC Membranes | Avanti | 610006 | |
| 10 mL Poly-Prep Chromatography column (Bio-Rad) | Bio-Rad | 731-1550 | |
| 27 G needle | BD Biosciences | 301629 | |
| Amicon Ultra Centrifugal Filter with 10K cutoff | Amicon | UFC501024 | |
| Avestin EmulsiFlex-C3 Homogenizer | Avestin | EF-C3 | |
| BCA assay | Pierce | 23225 | |
| Beckman Optima MAX-XP Ultracentrifuge | Beckman Coulter | 393315 | |
| Complete Protease Inhibitor Cocktail | Roche | 4693116001 | |
| DOPC | Avanti | 850375 | |
| DOPS | Avanti | 840035 | |
| Ergosterol (Sigma) | Sigma | 47130-U | |
| Extruder Set with Block 0.2 μL/1 mL | Avanti | 610000 | |
| FEI Tecnai F20 transmission electron microscope (200 kV) | |||
| Glass culture tubes | VWR | 47729-570 | |
| IgG sepharose beads (GE Healthcare) | GE Healthcare | 17-0969-01 | |
| Microlter glass syringes | Hamilton | 7637-01 | |
| New Brunswick Excella E25 | Eppendorf | M1353-0000 | or equivalent shaking 30 °C |
| Ni-NTA Magnetic Agarose Beads | Pierce | 78605 | |
| Optima XE-90 Ultracentrifuge | Beckman Coulter | A94516 | |
| Parafilm M | VWR | 52858-076 | |
| PI3P | Echelon | P-3016 | or Echelon equivalent |
| Polycarbonate bottle assembly | Beckman Coulter | 355622 | |
| TLA-100 Fixed-Angle Rotor | Beckman Coulter | 343840 | |
| Type 45 Ti Rotor | Beckman Coulter | ||
| Vacuum Desiccator, Bottom and Lid with Socket Valve | VWR | 75871-436 | |
| Vacuum Pump Alcatel (Pascal 2005 C1) | A&J Vacuum | PN07050 | |
| Vortex with foam holder | VWR | 10153-838 | |
| VWR KIT MICROTUBE | VWR | 12620-880 |
Referências
- Teasdale, R. D., Collins, B. M. Insights into the PX (phox-homology) domain and SNX (sorting nexin) protein families: structures, functions and roles in disease. The Biochemical Journal. 441 (1), 39-59 (2012).
- Zhang, H., et al. The Retromer Complex and Sorting Nexins in Neurodegenerative Diseases. Frontiers in Aging Neuroscience. 10, 79(2018).
- Burd, C., Cullen, P. J. Retromer: a master conductor of endosome sorting. Cold Spring Harbor perspectives in Biology. 6 (2), (2014).
- Chi, R. J., Harrison, M. S., Burd, C. G. Biogenesis of endosome-derived transport carriers. Cellular and Molecular Life Sciences. 72 (18), 3441-3455 (2015).
- Wang, J., et al. Endosomal receptor trafficking: Retromer and beyond. Traffic (Copenhagen, Denmark). 19 (8), 578-590 (2018).
- Ma, M., et al. Lipid trafficking by yeast Snx4 family SNX-BAR proteins promotes autophagy and vacuole membrane fusion. Molecular Biology of the Cell. , (2018).
- van Weering, J. R., et al. Molecular basis for SNX-BAR-mediated assembly of distinct endosomal sorting tubules. The EMBO Journal. 31 (23), 4466-4480 (2012).
- Chi, R. J., et al. Fission of SNX-BAR-coated endosomal retrograde transport carriers is promoted by the dynamin-related protein Vps1. The Journal of Cell Biology. 204 (5), 793-806 (2014).
- Purushothaman, L. K., Arlt, H., Kuhlee, A., Raunser, S., Ungermann, C. Retromer-driven membrane tubulation separates endosomal recycling from Rab7/Ypt7-dependent fusion. Molecular Biology of the Cell. 28 (6), 783-791 (2017).
- Purushothaman, L. K., Ungermann, C. Cargo induces retromer-mediated membrane remodeling on membranes. Molecular Biology of the Cell. 29 (22), 2709-2719 (2018).
- Wurmser, A. E., Emr, S. D. Phosphoinositide signaling and turnover: PtdIns(3)P, a regulator of membrane traffic, is transported to the vacuole and degraded by a process that requires lumenal vacuolar hydrolase activities. The EMBO journal. 17 (17), 4930-4942 (1998).
- Puig, O., et al. The tandem affinity purification (TAP) method: a general procedure of protein complex purification. Methods. 24 (3), 218-229 (2001).
- Kushnirov, V. V. Rapid and reliable protein extraction from yeast. Yeast. 16 (9), 857-860 (2000).
- Longtine, M. S., et al. Additional modules for versatile and economical PCR-based gene deletion and modification in Saccharomyces cerevisiae. Yeast. 14 (10), 953-961 (1998).
- Tropea, J. E., Cherry, S., Waugh, D. S. Expression and purification of soluble His(6)-tagged TEV protease. Methods in Molecular Biology. 498, 297-307 (2009).
- Zhang, L., et al. Morphology and structure of lipoproteins revealed by an optimized negative-staining protocol of electron microscopy. Journal of Lipid Research. 52 (1), 175-184 (2011).
- Yong, X., et al. Expression and purification of the SNX1/SNX6 complex. Protein Expression and Purification. 151, 93-98 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados