Method Article
Expression, Reinigung und Liposomenbindung von angehenden Hefe-SNX-BAR-Heterodimeren
In diesem Artikel
Zusammenfassung
Hier stellen wir einen Workflow für die Expression, Reinigung und Liposomenbindung von SNX-BAR Heterodimeren in Hefe vor.
Zusammenfassung
SNX-BAR-Proteine sind eine evolutionär konservierte Klasse von Membran-Remodeling-Proteinen, die eine Schlüsselrolle bei der Sortierung und dem Handel mit Proteinen und Lipiden während der Endozytose, der Sortierung innerhalb des endosomalen Systems und der Autophagie spielen. Zentral für die SNX-BAR-Proteinfunktion ist die Fähigkeit, Homodimere oder Heterodimere zu bilden, die Membranen mit hochkonservierten Phox-Homologie-Domänen (PX) und BAR (Bin/Amphiphysin/Rvs) binden. Darüber hinaus kann die Oligomerisierung von SNX-BAR-Dimern auf Membranen die Bildung von Membrantubuli und Vesikeln auslösen, und diese Aktivität wird angenommen, dass sie ihre Funktionen als Mantelproteine für Endosomen-abgeleitete Transportträger widerspiegelt. Forscher haben lange In-vitro-Bindungsstudien mit rekombinanten SNX-BAR-Proteinen an synthetischen Liposomen oder riesigen Unilamellar-Vesikeln (GUVs) verwendet, um die genaue Zusammensetzung von Lipiden zu enthüllen, die für die Remodellierung der Membran erforderlich sind, und so ihren Wirkmechanismus zu offenbaren. Aufgrund technischer Herausforderungen mit dualen Expressionssystemen, der Toxizität der SNX-BAR-Proteinexpression in Bakterien und der schlechten Löslichkeit einzelner SNX-BAR-Proteine haben die meisten Bisherigen Studien SNX-BAR-Homodimere untersucht, einschließlich nicht-physiologischer Dicher, die sich während der Expression in Bakterien bilden. Kürzlich haben wir ein Protokoll optimiert, um die großen Mängel eines typischen bakteriellen Expressionssystems zu überwinden. Anhand dieses Workflows zeigen wir, wie man große Mengen von SNX-BAR Heterodimeren erfolgreich ausdrückt und reinigt und wie man sie auf synthetischen Liposomen für Bindungs- und Tubulationstests rekonstituiert.
Einleitung
Membrangebundene Organellen wie die Plasmamembran, das endoplasmatische Retikulum, das Golgi-Gerät, Dassosom (Hefe-Vakuole) und endosom bilden das Endomembransystem der eukaryotischen Zelle. Die meisten Organellen haben die Fähigkeit, Material mit anderen Organellen durch Vesikeltransportträger zu kommunizieren und auszutauschen. Wie die Zelle die Verpackung und Bildung von Vesikeltransportträgern innerhalb des Endomembransystems koordiniert, ist nicht genau bekannt. Es ist jedoch bekannt, dass die Proteine und Lipide, die einen Großteil des Endomembransystems ausmachen, aus der Internalisierung endozytärer Vesikel aus der Plasmamembran (PM) stammen. Das Endosom ist die primäre Akzeptor-Organelle für diese Vesikel und besteht aus mehreren miteinander verbundenen Sätzen von röhrenförmigen Organellen. Die Hauptfunktion des Endosomes besteht darin, die Nährstofferfassung zu erleichtern, den Protein- und Lipidumsatz zu regulieren, vor Krankheitserregerinfektionen zu schützen und als primäre Wiederauffüllungsquelle für Lipide für die Plasmamembran zu dienen. Da das Endosom den Großteil der Ladungsproteine und Lipide aus der Plasmamembran erhält, fungiert es als Sortierraum, indem es Ladungen in röhrenförmige endosomale Transportträger (ETCs) isoliert. Alle Proteine, die nicht in ETCs sequestriert werden, müssen über das endolysosomale System abgebaut werden. Die Dysregulation der Ladungsortierung in ETCs kann zum Verlust der Nährstoffaufnahme, des Proteinumsatzes oder der Lipidhomöostase führen, was zu zahlreichen stoffwechsel-, Entwicklungs- und neurologischenStörungen1,2führt. Trotz der zentralen Rolle der ETCs beim Endosome ist jedoch der zugrunde liegende Mechanismus, wie das Endosom selektiv die Verpackung einer Vielzahl heterogener Ladungen in Röhrenträger koordinieren kann, nicht bekannt.
Die Sertiernexin-Familie (SNX) ist eine evolutionär konservierte Klasse von Proteinen, die für viele Vesikeltransportreaktionen in der Zelle3,4,5kritisch sind. Sortiernvonnexine werden an die Endosome-Membran rekrutiert und helfen bei der Ladungsaufnahme über ihre charakteristische Phox-Homologie(PX)-Domäne, die Phosphatidylinositol-3-Monophosphat (PtdIns(3)P bindet, ein Lipid, das an der Endosome-Membran angereichert ist. Säugetiere kodieren 33 SNX-Proteine, die je nach Vorhandensein andererDomänenweiter in mehrere Unterfamilien unterteilt werden können. Vor allem die SNX-BAR-Unterfamilie ist die größte Unterfamilie, die aus zwölf menschlichen Unterfamilien besteht, während in der aufkeimenden Hefe Saccharomyces cerevisiaedie Unterfamilie auf nur sieben SNX-BARs reduziert wird. SNX-BAR-Proteine haben sowohl eine PX-Domäne als auch eine Bin-Amphiphysin-Rvs (BAR)-Domäne, die Lipidreservoirs auslöst, um positive Krümmungsmembranen zu binden. Folglich hat die SNX-BAR-Familie eine natürliche Affinität zum Endosom und kann die ETC-Bildung über ihre Membran-Remodellierungsfähigkeiten vermitteln. In vitro können die Remodellierungseigenschaften von SNX-BARs durch Zugabe von gereinigten SNX-BARs zu synthetischen Liposomen induziert werden und die anschließende Bildung schmaler, beschichteter Tubuli kann durch Elektronenmikroskopie visualisiert werden. Mit diesen Methoden haben die Forscher festgestellt, dass sowohl die Oligomerisierungskonzentration als auch die Verengungsfestigkeit in der SNX-BAR-Familie zu variieren scheinen, was darauf hindeutet, dass sie sowohl bei der Bildung als auch bei der Sission von ETCs helfen könnten.
Die SNX-BARs können weiter nach ihren exklusiven Dimerisierungseigenschaften klassifiziert werden. In-vitro-Bindungstests und Strukturstudien haben gezeigt, dass SNX-BAR-Proteine nur spezifische Homodimere oder Heterodimere bilden können. Daher könnte grundsätzlich jedes potentielle SNX-BAR Dimer-Oligomer einen Tubulenmantel für einen ladungsspezifischen Handelsweg liefern und ebenso kann die eingeschränkte Oligomerisierung der anderen SNX-BAR-Protomere auch unterschiedliche Exportwege definieren. Aufgrund der großen Anzahl von SNX-BARs und der Vielfalt innerhalb der SNX-Familie ist eine Einzige-Sortierung nexin-one-Frachthypothese jedoch höchst unwahrscheinlich. Stattdessen ist eine koordinierte Anstrengung mit einer Vielzahl von Faktoren wie SNX-BARs, Fracht, Lipidspezifität und anderen Abhängigkeiten wahrscheinlicher. Ebenso ergaben neuere Studien der Hefe-SNX4-Familie Hinweise auf zusätzliche Lipidspezifität, über PtdIns(3)P hinaus, um Endosome-Transportträger zu potenzieren6. In dieser Studie wurde SNX-BAR Homodimer Mvp1-Mvp1 von Bakterien gereinigt und native Heterodimere Snx4-Atg20 und Vps5-Vps17 wurden in hoher Ausbeute aus Hefe exprimiert und gereinigt, während nur Snx4-Atg20 gefunden wurde, um phosphatidylserin (PS) bevorzugt zu binden und in Liposomenbindungsstudien schmale röhrenartige Strukturen zu bilden6. Während andere auf diesem Gebiet wichtige Eigenschaften der SNX-BARs mit rekombinant gereinigten SNX-BAR-Homodimeren von Bakterien aufgedeckt haben, hat die Toxizität, die mit der Exzessierung von SNX-BAR-Heterodimeren in ähnlichen Systemen verbunden ist, ihre native Charakterisierung7,8,9,10behindert. Daher müssen Forscher ohne ein zuverlässiges System, um rekombinant eduzierte native Heterodimere zu erhalten, auf diese Untersuchungslinien verzichten. In Abbildung 1präsentieren wir einen vierteiligen Workflow zu 1) konstruieren einen Hefestamm, der SNX-BAR-Heterodimere zur Tandemaffinitätsreinigung überexprimiert, 2) native SNX-BAR-Heterodimere ausdrücken und reinigen, 3) unilamellare synthetische Liposomen vorbereiten und 4) einen Liposomentubulations- oder Sedimentations-Assay einrichten, der ein wichtiges Werkzeug für Forscher darstellt, um den wachsenden Katalog von Nexinen zu untersuchen.
Protokoll
1. Hefe-Stamm-Konstruktion
- Beginnen Sie mit TVY614 (pep4x::LEU2 prb1'::hisG prc1'::HIS3)11 als übergeordnete Raufe. Dieser Stamm ist mangelhaft für vakuolare Proteasen, die zum Großteil des Proteinabbaus nach der Zelllyse beitragen, und ermöglicht somit eine sauberere und effizientere Reinigung.
- Designprimer12 und integrieren Tandem Affinitätsreinigung (TAP) Tag am C-Terminus von Atg20 (SNX-BAR ORF 1) mit homologe Rekombination. Verwenden Sie die Polymerase-Kettenreaktion (PCR), um Integrationen zu bestätigen (Abbildung 2).
- Führen Sie einen westlichen Zelllysatfleck mit dem TAP-Tag aus, um die richtige Integration zu bestätigen13.
HINWEIS: Wir empfehlen die Ernte von 3 OD (1 OD bei 1 x 107 Zellen) von Zellen für sDS-PAGE und Western Blot Verifikation. Beachten Sie, dass die Integration des TAP-Tags erfolgen sollte, bevor die endogenen Promotoren durch den GAL1-Promoter ersetzt werden, um eine einfachere ÜBERPRÜFUNG des TAP-Tags über Western Blot zu ermöglichen. - Ersetzen Sie endogene Snx4 (SNX-BAR ORF1) und Atg20 (SNX-BAR ORF 2) Promoter durch nicht markierte GAL1-Promoter mit sequenziellen homologen Rekombinations- und Transformationsschritten jedes einzelnen ORF14.
- Verwenden Sie flankierende Primer außerhalb der Integrationssites, um erfolgreiche Integrationen zu bestätigen (Abbildung 2). Dies führt zu einem Null-Phänotyp der angestrebten SNX-BARs ohne Galaktose im Wachstumsmedium.
2. Hefeinduktion und SNX-BAR Dimerreinigung
HINWEIS: Hefezellen können auf Standard-YPD (Hefeextrakt, Pepton und 2% Glukose) Agarplatten vermehrt werden, da die Modifikationen chromosomal integriert sind.
- Impfen Sie einen großen Tupfer von Zellen in 50 ml Standard-YP (Hefeextrakt und Pepton) Medium mit 2% Raffinose und 0,1% Glukose als Kohlenstoffquelle in einem Kolben mindestens 4x des Volumens der Kultur und wachsen über Nacht in 30 °C Shaker, um eine ordnungsgemäße Belüftung zu ermöglichen. Erwarten Sie, dass das Wachstum in diesem Medium im Vergleich zu Standard-YPD langsamer sein wird.
- Am nächsten Morgen die 50 ml-Präkultur verwenden, um 1 L Standard-YP-Medium mit 2% Raffinose und 0,1% Glukose zu impfen und für 4-5 h in 30 °C Shaker zu wachsen.
HINWEIS: Das Volumen der Präkultur, mit der die 1-L-Kultur impfen soll, kann je nach OD600 der Vorkultur angepasst werden. Die OD600 der 1 L-Kultur nach der Impfung sollte etwa 0,2 betragen, um mindestens zwei Verdoppelungen während des 4-5 h-Wachstums zu ermöglichen.- Verwenden Sie einen verwirrten Fernbachkolben für Das Wachstum, um eine ordnungsgemäße Belüftung zu ermöglichen, ein 2,8 L Volumenkolben ist ausreichend. Weniger Belüftung kann zu einem langsameren Wachstum und einem kleineren Zellpellet bei der Ernte führen.
- Überprüfen Sie OD600, um sicherzustellen, dass sich die Kultur nach 4-5 h Wachstum in der Protokollphase (0,5-1) befindet. Je nach Wachstum der Belastung, Anpassungen an der Wachstumszeit, um mindestens zwei Verdoppelungen zu ermöglichen. Auf 2% Galaktose geben und über Nacht in 30 °C Shaker wachsen.
HINWEIS: Die OD600 nach dem Wachstum über Nacht kann variieren, aber die Kultur sollte gesättigt sein. Beachten Sie, dass Zellen nicht von 0,1% Glukose entfernt werden müssen, bevor 2% Galaktose für dieses Wachstumsprotokoll hinzukommen. Wir empfehlen die Ernte von 3 OD nicht induzierter und induzierter Zellen in diesem Schritt für SDS-PAGE und Western Blot zur Verifizierung(Abbildung 3A,B, Lane 1-2). - Erntezellen durch Zentrifugation bei 4500 x g für 15 min. Hier kann ein schwingender Schaufelrotor verwendet werden, der die 1 L-Volumenkultur aufnimmt.
- Das Hefepellet in ein 50 ml konisches Rohr übertragen; ein zweiter Zentrifugationsschritt kann bei Bedarf durchgeführt werden. Das Zellpellet wird in der Regel etwa 10-15 ml Volumen betragen, gemessen durch Graduierungsmarkierungen und kann sofort verwendet oder bei -80 °C gelagert werden.
- Pellet im 15 ml Reinigungspuffer (50 mM Tris pH 7,4, 300 mM NaCl, 1,5 mM MgCl2, 1 mM Dithiothreitol (DTT), Protease-Inhibitor-Cocktail) wieder aufsetzen, um das Endvolumen um 30 ml zu machen.
- Vor Gebrauch einen Homogenisator 4 °C abkühlen und mit einem Reinigungspuffer ausbessern. Lysezellen mit einem mechanischen Zellstörer oder Homogenisator. Probe in den Homogenisator einladen und bei 20.000-25.000 psi für 2-3 Runden lysieren; Beachten Sie, dass bei der Lysed-Zelle mehr Eingangsdruck erforderlich ist, um 20.000-25.000 psi beizubehalten. Sammeln Sie die Zelle lysieren in einem 50 ml konischen Rohr auf Eis.
HINWEIS: Wenn zusätzliche Proben lysiert werden müssen, sollte der Homogenisator gründlich gereinigt und ausgeglichen werden, bevor die nächste Probe geladen wird. Alle Zelllysate auf Eis halten. - Löschen Sie das Zelllysat sofort bei 35.000 x g für 1 h bei 4 °C. Übertragen Sie den Überstand vorsichtig in eine neue Röhre. Beachten Sie, dass die Lipide aus der Zelllyse während der Zentrifugation nach oben schweben und die Reinigung nicht beeinflussen.
HINWEIS: Wir empfehlen, 0,5-1% des Lysats und Pellets für SDS-PAGE-Proben einzusparen. In der Regel werden keine größeren Unterschiede beobachtet und ein zusätzlicher westlicher Fleck kann getan werden, um die TAP-Proteinlöslichkeit zu bestätigen(Abbildung 4, Bahnen 1 bzw. 2). - Equilibrate 300 l IgG-Sepharoseperlen mit Reinigungspuffer. Fügen Sie in die gelöschte Zelle lysieren und inkubieren für 2 h, rotieren bei 4 °C.
- Sammeln Sie Perlen in einer 10 ml Chromatographie-Säule und lassen Sie ungebundenes Lysat durchfließen.
- Waschen Sie Perlen mit 10 ml Waschpuffer (50 mM Tris pH 7,4, 300 mM NaCl, 1,5 mM MgCl2, 1 mM DTT), Hinzufügen von 1 ml auf einer Zeit und so dass es vollständig durchfließen.
HINWEIS: Wir empfehlen, 2% der gebundenen IgG-Perlen für sDS-PAGE-Proben zu sparen. Typischerweise beobachten wir vier Hauptbänder; zwei SNX-BAR-Proteine und IgG Heavy and Light Chains (Abbildung 4, Lane 3). Wir empfehlen, äquivalente Mengen an "Eluat" und "IgG-Perlen nach TEV" einzusparen, um die TEV-Spaltungseffizienz zu vergleichen. - Sammeln Sie Perlen und übertragen Sie sie in ein Mikrozentrifugenrohr. Fügen Sie das Gesamtvolumen mit frischem Waschpuffer und 2 l mit 10 mg/ml TEV-Protease auf 500 l l und über Nacht inkubieren und bei 4 °C rotieren.
- Am nächsten Morgen den Überstand mit einer 27 G Nadel vollständig entfernen und die Proteinreinheit um 10% Polyacrylamid SDS-PAGE bewerten(Abbildung 4,Lane 4).
HINWEIS: In der Regel erhalten wir 500 l 0,5-1 mg/ml von 95% reinem Heterodimer(Abbildung 4, Lane 4). Zusätzliche Reinigung mit Calmodulin Harz kann auch durchgeführt werden, aber wir sehen in der Regel eine signifikante Verringerung der Ausbeute und empfehlen, hier zu stoppen, wenn Reinheit ist >90%. TEV stört liposome-Bindungstests nicht, obwohl TEV zusätzlich mit Ni-NTA Agarose Perlen15entfernt werden kann. - Zum Konzentrieren die Probe auf einen 0,5 ml Zentrifugalfilter mit 10 KDa-Cutoff und Zentrifuge nach Herstelleranleitung auf 50 l oder weniger übertragen. Quantifizieren Sie die konzentrierten Proteine mit dem Bradford-Protein-Assay. Bei 4 °C lagern und innerhalb einer Woche verwenden.
3. Liposomen-Vorbereitung
- Kaufen Sie handelsübliche Lipide: Phosphatidylserin (PS), PI3P, Ergosterol, und Phosphatidylcholin (PC). Bei Bedarf in empfohlenem Lösungsmittel wieder aufsetzen, um Lagerlipide herzustellen.
HINWEIS: Lipide werden in einem Methanol/Chlorform-Gemisch nach Herstellerempfehlungen resuspendiert. Stellen Sie sicher, dass die Lipidvorräte vor der Verwendung klar und auf Raumtemperatur erwärmt sind. Resuspendierte Lipide können unter Argongas gelagert und mit Wachsfolie (oder gleichwertig) bei -20 °C für 6-12 Monate oder bis zum Verlust der Aktivität versiegelt werden. - Berechnen Sie das Volumen, das von jedem Lipidbestand benötigt wird, um eine Mischung mit der gewünschten Lipidzusammensetzung zu erzeugen (siehe Tabelle 1). Nehmen wir insgesamt 1 Mol Lipide in der Lipidmischung an.
- Führen Sie diesen Schritt in einer chemischen Rauchhaube aus. Reinigen Sie Glasspritzen, indem Sie ein vollständiges Spritzenvolumen von Chloroform aufstellen und in einem Abfallbehälter entsorgen. Wiederholen Sie dies noch zwei Mal. Verwenden Sie bei der Übertragung von Chloroform nur Glasspritzen oder Pipetten. Ziehen Sie beim Aufstellen von Chloroform langsam am Stopfen, um das Eindringen von Gasblasen in die Spritze zu verhindern.
- Verwenden Sie Glasspritzen, um Stocklipide, wie in einem sauberen Glaskulturrohr berechnet, um eine endgültige Lipidmischung von 1% PI3P, 20% Ergosterol, 30% PS, PC(Tabelle 1) zu übertragen Je nach Lösungsmittel nionenin jedem Lipid kann sich die Mischung nach Zugabe jedes Lipids trüb drehen.
HINWEIS: Um die PS-Konzentrationen (0-30%) zu variieren, passen Sie die Volumina entsprechend an und kompensieren Sie sie mit unterschiedlichen PC (Tabelle 1). - Trocknen Sie das Lipidgemisch vorsichtig mit Stickstoffgas, das auf das Lipidgemisch gerichtet ist, in einer kreisförmigen Bewegung, um Lipide gleichmäßig zu trocknen. Verwenden Sie einen niedrigen Gasstrom, um die Lipide an der Unterseite des Glasrohrs während des Trocknungsprozesses zu halten. Wickeln Sie das Glaskulturrohr mit Folie, so dass die Öffnung freigelegt, und weiter im Vakuum für 1 h dehydrieren.
- Fügen Sie 400 l Bindungspuffer (50 mM Tris pH 7,4, 300 mM NaCl, 1 mM MgCl2) hinzu, um Lipide vollständig zu dehydrieren, um eine endgültige Liposomenkonzentration von 2,5 mM zu erreichen.
HINWEIS: Die endgültige Liposomenkonzentration kann durch Zugabe von mehr oder weniger Bindungspuffer eingestellt werden. So kann z. B. ein Bindungspuffer von 200 l hinzugefügt werden, um bei Bedarf eine Liposomenkonzentration von 5 mM zu erzeugen (siehe unten).- Resuspend Lipide durch Schütteln auf mittlerer Geschwindigkeit auf einem Wirbel bei Raumtemperatur für 30 min. Puffer sollte trübe erscheinen, wie Lipide resuspendiert werden.
- Resuspendierte Liposomen in ein Mikrozentrifugenrohr übertragen. Ab diesem Zeitpunkt können Kunststoffpipettenspitzen verwendet werden, da Lipide nicht mehr in Chloroform resuspendiert werden. Beachten Sie, dass die Liposomenlösung trüb aussehen sollte.
- Liposomen sieben- bis achtmal einfrieren, indem man das Mikrozentrifugenrohr zuerst in flüssigen Stickstoff, dann in ein 37 °C-Wasserbad taucht. Die Liposomenmischung sollte vor dem Auftauen vollständig gefroren und fest vom Auge erscheinen.
- Führen Sie Schritte mit Chloroform in einer chemischen Rauchhaube durch. Reinigen Sie zwei 1 ml Glasspritzen, indem Sie das gesamte Spritzenvolumen von Chloroform, jeweils dreimal, aufstellen und entsorgen, um Restlipide zu entfernen. Equilibrate jede Glasspritze mit reinem Reinstwasser durch Die Erstellung von zwei Spritzenvolumen, dann mit Bindungspuffer durch Die Erstellung von zwei Spritzenvolumen ausgleichn.
- Montieren Sie den Miniextruder gemäß den Empfehlungen des Herstellers. Equilibrate eine 200 nm Membran und zwei Teile von Filterstützen (siehe Tabelle der Materialien) durch Untertauchen jeder in Bindungspuffer.
- Sandwich die Membran zwischen den Filterstützen und legen Sie in den Mini-Extruder. Um das Totvolumen im montierten Miniextruder zu reduzieren und sicherzustellen, dass die Baugruppe luftdicht ist, übergeben Sie mit den 1 ml Glasspritzen ein Volumen an Bindungspuffer, das mit dem Volumen der Liposomenmischung vergleichbar ist.
- Verwenden Sie eine der 1 ml Glasspritzen und ziehen Sie die Liposomenmischung. Invertieren Sie das Mikrozentrifugenrohr, um das letzte Liposomengemisch in der Rohrkappe für die Aufnahme in die Glasspritze zu sammeln.
- Extrudieren Sie Liposomen, indem Sie die 200 nm Membran 19-21 Mal durchlaufen. Sammeln Sie extrudierte Liposomen in einem neuen Mikrozentrifugenrohr.
HINWEIS: Extrudierte Liposomen sollten vor der Extrusion weniger trübe als Liposomen erscheinen. Liposomen sollten noch am selben Tag verwendet und auf Eis gelagert werden. Die letzte Extrusion sollte Liposomen in die Spritze gegenüber der Spritze legen, in der sie begonnen hat.
4. SNX-BAR Liposomenbindung und Tubulation
- Vorfrei gereinigtes Protein bei 100.000 x g in einer Ultrazentrifuge für 20 min bei 4 °C vor der Durchführung von Liposomenbindungs- und Sedimentationsexperimenten. Entfernen Sie den Überstand und übertragen Sie ihn in ein neues Mikrozentrifugenrohr; stören Sie das Pellet nicht, wenn es eine gibt.
- Um Liposomenbindungs- und Tubulations-Assays durchzuführen, inkubieren Sie 4 'M gereinigte Snx4-Atg20 und 2,5 mM Liposomen in einem Gesamtreaktionsvolumen von 20 'L, wobei das Volumen der hinzugefügten Liposomen variiert.
HINWEIS: Im selben Experiment sollte das gleiche Volumen an Liposomen verwendet werden. - Inkubieren Sie die Reaktion bei 30 °C für 30 min.
HINWEIS: Wir empfehlen, die Menge von 2,5 mM Liposomen, die jeder Reaktion zugesetzt werden, zu maximieren, indem nicht weniger als 10 L Liposomen verwendet werden, um eine Visualisierung während der Sedimentation zu ermöglichen. Wird bei einer 20-L-Reaktion 10 l mit 2,5 mM Liposomen verwendet, beträgt die Endkonzentration von Liposomen 1,25 mM. Wenn die gereinigten Proteine verdünnt sind und mehr Volumen für 4 M Protein benötigt wird, können die Lipide während des Rehydrierungsschritts in 200 l resuspendiert werden, um die Konzentration von Liposomen zu verdoppeln (siehe Schritt 3.6); Dies erfordert jedoch, die Proteinkonzentration zu kennen, bevor die Liposomen gemacht werden. -
Visualisieren und quantifizieren Sie die Liposomentubulation.
- Verarbeiten Sie Liposomenbindungsreaktionen sofort für die Elektronenmikroskopie-Analyse. Punktproben auf einem kohlenstoffbeschichteten Kupfernetzgitter und negativer Fleck mit 1% Uranylacetat (Abbildung 5B)16.
- Analysieren Sie Proben auf einem Transmissionselektronenmikroskop (200 kV).
- Verwenden Sie Bildanalyse-Software, um den Tubulidurchmesser zu messen und zu quantifizieren. Um den Tubulidurchmesser eines einzelnen Tubuli genau zu quantifizieren, nehmen Sie drei Durchmessermessungen entlang der Länge eines Tubuli und des Durchschnitts (Abbildung 5B).
HINWEIS: Zur Ermittlung der statistischen Signifikanz wurde eine zweiseitige Varianzanalyse verwendet (Abbildung 5E). Uranlacetat ist sowohl radioaktiv als auch toxisch. Für diesen Schritt ist eine ordnungsgemäße Laborsicherheitszertifizierung erforderlich.
-
Liposomenbindung und Sedimentation.
- Übertragen Sie die Reaktion (20 l, ab Schritt 4.3) auf ein Polycarbonatzentrifugenrohr und drehen Sie mit einem kompatiblen Rotor bei 100.000 x g in einer Ultrazentrifuge 20 min bei 4 °C. Entfernen Sie vorsichtig den Überstand und übertragen Sie ihn in ein neues Mikrozentrifugenrohr. Beachten Sie, dass das Pellet intakt bleiben sollte.
- Setzen Sie das Pellet in SDS-PAGE 40 L Probenpuffer wieder auf und übertragen Sie es in ein neues Mikrozentrifugenrohr. Fügen Sie dem Überstand 20 L Probenpuffer hinzu. Belasten Sie äquivalente Mengen an Pellet und Überstand in einem 10% Polyacrylamid SDS-PAGE Gel und führen Sie Coomassie Färbung durch, um SNX-BARs, die an Liposomen gebunden sind, zu visualisieren (Abbildung 5A).
- Um die Menge des SNX-BAR-Komplexes in der Pelletfraktion zu quantifizieren, quantifizieren Sie Bandintensitäten mittels Densitometrie und quantifizieren Sie den Anteil der SNX-BAR-Proteine in der Pelletfraktion.
HINWEIS: Zur Bestimmung der statistischen Signifikanz wurde eine zweiseitige Varianzanalyse verwendet (Abbildung 5C).
Ergebnisse
Dieses Protokoll beschreibt ein Verfahren zur reproduzierbaren und robusten Herstellung von endogenen Hefe-SNX-BAR-Komplexen, die für nachgeschaltete Membran-Remodellierungstests verwendet werden können (Abbildung 1). Die Konstruktion des Hefestamms, der zur Reinigung verwendet wird, nutzt die Effizienz der homologen Rekombination in angehender Hefe und ermöglicht Modifikationen an der genomischen Loci der gezielten SNX-BARs (Abbildung 2). Dieses Design hat zwei Vorteile, (i) da die Auswahl nicht erforderlich ist, um die Modifikationen beizubehalten, kann Standard-YP-Medium verwendet werden, was ein Wachstum auf eine höhere Zelldichte und damit eine höhere Proteinproduktion und (ii) die Expressionsniveaus der angestrebten SNX-BARs gleichmäßig sein wird, wodurch die Produktion des Heterodimer-Komplexes optimiert wird. Vor dem Zusatz von Galactose weisen die zielgerichteten SNX-BARs einen Null-Phänotyp auf und können daher zu einem Wachstumsfehler oder anderen bekannten Defekten führen, die für die angestrebten SNX-BARs spezifisch sind. Darüber hinaus ist das Wachstum in 2% Raffinose und 0,1% Glukose langsamer als Wachstum in 2% Glukose. Daher kann die Wachstumsperiode vor der Galaktose-Induktion für jede einzelne Sorte optimiert werden. Um die korrekte Induktion der SNX-BAR-Expression zu überprüfen, ist wahrscheinlich ein westlicher Fleck gegen das TAP-Tag erforderlich, da der Proteingehalt der SNX-BARs möglicherweise nicht über Coomassie-Färbung nachgewiesen wird (Abbildung 3). Da jedoch nur ein Element des SNX-BAR-Komplexes über ein Tag verfügt, kann die Expression der nicht markierten Proteine nur bestätigt werden, wenn alle Schritte der Reinigung abgeschlossen sind. Nach der Reinigung des SNX-BAR Heterodimers sollten die Bänder der beiden SNX-BARs im stochiometrischen Verhältnis von 1:1 erscheinen und es sollte wenig bis gar keine kontaminierenden Bänder geben(Abbildung 4, Spur 4). Wenn es zusätzliche kontaminierende Bänder gibt und der beginnende Hefestamm bereits protease-mangelhaft ist, kann während der Zelllyse ein stärkerer Protease-Inhibitor zugesetzt werden. Darüber hinaus kann ein zweiter Reinigungsschritt mit Calmodulinharz durchgeführt werden.
Bei der Durchführung von Membran-Remodeling-Assays (Abbildung 5) muss die gleiche Zubereitung von Liposomen und gereinigten Proteinen im selben Experiment verwendet werden. Wenn mehrere Reinigungspräparate von Protein benötigt werden, um die gewünschte Konzentration zu erreichen, kombinieren Sie das gesamte vor dem Durchführen des Experiments gereinigte Protein. Liposomen sollten am selben Tag hergestellt und verwendet werden (Tabelle 1). Bei der Durchführung von Liposomensedimentationstests ist es entscheidend, dass das gereinigte Protein unmittelbar vor der Inkubation mit Liposomen, da gefälltes Protein die Ergebnisse verzerren kann, mit den gleichen Sedimentationsbedingungen von 100.000 x g für 20 min unmittelbar vor der Inkubation mit Liposomen vorgereinigt wird. Darüber hinaus sollte das Liposomenpellet nach der Sedimentation intakt bleiben.
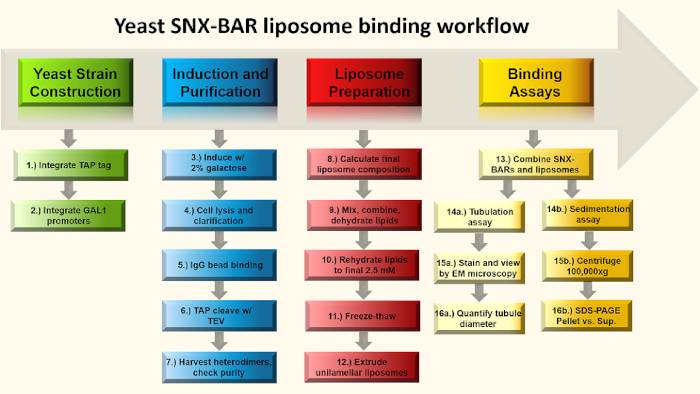
Abbildung 1: SNX-BAR-Bindungs-Assay-Flussdiagramm. Kurz gesagt, in den Schritten 1-2 entwickeln wir GAL-Promotoren in zwei SNX-BAR genomische Loci, die jeden der endogenen Promotoren ersetzen und ein C-Terminal TAP-Tag in einen der beiden SNX-BAR loci konstruieren. Als nächstes induzieren wir in den Schritten 3-7 die Zellen mit Galaktose und reinigen die SNX-BAR Heterodimere zur Homogenität. In den Schritten 8-12 berechnen und bereiten wir unilamellare Liposomen vor. Schließlich können wir die SNX-BAR Heterodimere mit unilamellalaren Liposomen kombinieren und zwei Assays durchführen; Schritt 14a-16a beinhalten Membrantubulation und 14b-16a beinhalten den Sedimentationstest. Weitere Informationen finden Sie im Text. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: SNX-BAR Integrationsstrategie. Zwei SNX-BAR-Loci wurden für die GAL-Expression mittels homologe Rekombination eingesetzt. SNX-BAR ORF1 (Atg20) wurde zusätzlich zum Ausdruck eines C-Terminal TAP-Tags ins Visier genommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Galactose-Induktionsprüfung. (A-B) Um die GAL-Induktion von Atg20-TAP zu überprüfen, empfehlen wir eine SDS-PAGE- und Western-Blot-Analyse von Zellextrakten, die mit 2% Galaktose (A, B, Spur 2) und uninduziert (A, B, Spur 1) induziert wurden. (C) Die westliche Blotmembran wird ebenfalls abgestreift und mit Anti-pgk1 für eine Ladekontrolle abgetastet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
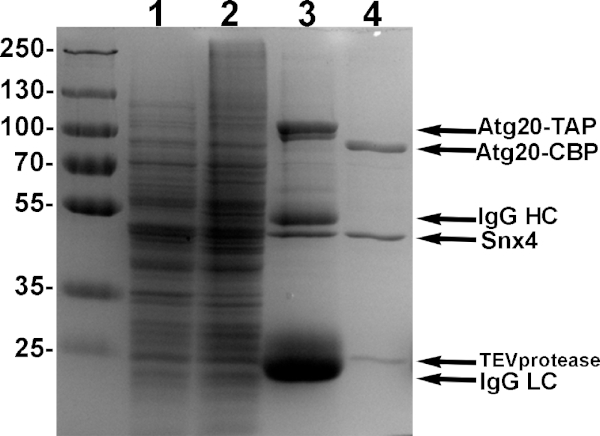
Abbildung 4: Beispielreinigung von Atg20-Snx4-Heterodimen. Hefezellen, die entwickelt wurden, um Atg20-TAP und Snx4 auszudrücken, die von Galaktose-Promotoren angetrieben wurden, wurden mit 2% Galaktose induziert, lysiert und mit IgG-Sepharose gebunden und mit TEV-Protease elutiert. Proben aus jedem Reinigungsschritt werden in 10% SDS-PAGE gezeigt. Spur 1: induzierter Überstand von Lysat. Lane 2: induziertes Lysatpellet. Lane 3: Probe gebundener Proteine zu IgG-Sepharose. Spur 4: TEV-Eluat von reinen Atg20-Snx4-Heterodimeren aus IgG-Sepharose. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
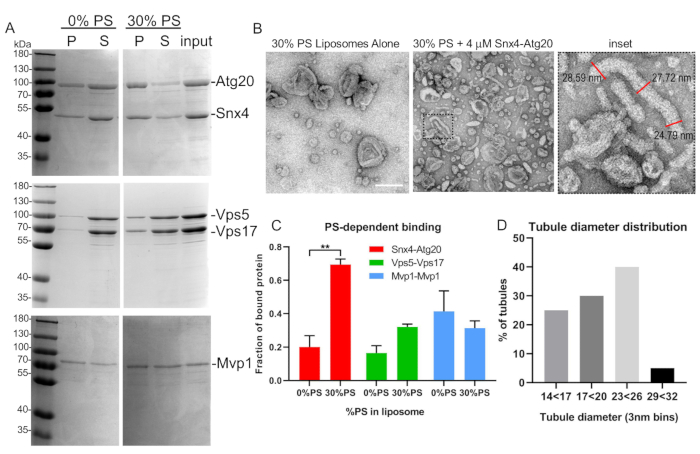
Abbildung 5: Repräsentativer Liposomenbindungs- und Tubulationstest. (A) SNX-BAR-Heterodimere, Atg20-Snx4 und Vps5-Vps17 aus Hefe, wurden ausgedrückt, gereinigt und an synthetische Liposomen gebunden, wie im Text beschrieben. Beachten Sie, dass Mvp1 Homodimere bildet und in Bakterien exprimiert wurde. (B) EM-Mikrographien von Snx4-Atg20 Liposomen-Tubulations-Assay und Tubule-Messungen (Einset). (C) Die SNX-BAR-Bindung an unterschiedliche Liposomenzusammensetzungen wurde durch Densitometrie quantifiziert. Diagramm gibt Mittelwert und Standardfehler des Mittelwerts an. **p < 0.002. (D) Die Tubulendurchmesser wurden quantifiziert und wie im Text beschrieben grafisch dargestellt. Skalenbalken = 200 nm. Fehlerbalken stellen eine zweiseitige Varianzanalyse dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Typische Liposomenzusammensetzung | DOPC | DOPS | Ergosterol | PI3P-C16 |
| Mw | 786.1 | 810.0 | 396.7 | 957.0 |
| mol Fraktion | 49% | 30% | 20% | 1% |
| Lager mM | 32.0 | 12.0 | 25.0 | 1.0 |
| Masse (mg) | 385.2 | 243.0 | 79.3 | 9.6 |
| Konzentration (mg/ml) | 25.2 | 9.7 | 9.9 | 1.0 |
| Volume zu RXN(mL) | 15.3 | 25.0 | 8.0 | 10.0 |
Tabelle 1: Liposome-Rezept. Synthetische Liposomen wurden mit einer Kombination aus DOPC, DOPS, Ergosterol und PI3P hergestellt. Wir berechnen die Endkonzentration auf 1 Mol Lipid. Unsere Standardzusammensetzung umfasst 20% Ergosterol, 1% PI3P, DOPS (bis zu 30%) und unterschiedliche Mengen an DOPC. Die Tabelle enthält eine typische Formulierung für 400 l mit 30 % DOPS.
Diskussion
Hier zeigen wir einen optimierten Workflow zur Reinigung von SNX-BAR-Dimeren in Hefe und zwei Assays zur Bewertung ihrer biophysikalischen Eigenschaften auf synthetischen Liposomen. Der Hauptvorteil gegenüber der typischen rekombinanten Proteinexpression in Escherichia coli oder anderen Systemen ist die Fähigkeit, SNX-BAR-Proteine in einem nativen Wirt gleichmäßig auszudrücken und so die Toxizitäts- und Unlöslichkeitsprobleme zu vermeiden, die bei der Reinigung von SNX-BARs in anderen Systemen auftreten. Bemerkenswert ist auch, dass unser System kein molekulares Klonen oder die Beherbergung mehrerer Expressionsvektoren erfordert17. Unsere zwei SNX-BAR-Hefestämme werden von chromosomal enzentwickelten Galaktose-Promotoren angetrieben und sorgen so für eine gleichmäßige Expression bei Induktion. Eine wichtige Überlegung ist, dass es in Ermangelung von Galaktose wenig bis gar keinen Ausdruck der angestrebten SNX-BARs geben wird, was zu einem Null-Phänotyp führt. Darüber hinaus stellen wir fest, dass SNX-BARs C-Terminal-Tags gut tolerieren, so dass wir das TAP-Tag am C-Terminus hinzufügen können. Je nach markiertem Protein kann jedoch auch ein N-Terminal TAP-Tag verwendet werden12. Da SNX-BARs nur 1:1-Dimere bilden, muss nur ein Protein für Reinigungszwecke getaggt werden. Einige SNX-BARs, die normalerweise Heterodimere in der Zelle bilden, haben jedoch gezeigt, dass sie Homodimere unter nicht-physiologischen Konzentrationen bilden7. Daher ist es wichtig, dass bei der Reinigung des Heterodimers das stoichiometrische Verhältnis der beiden SNX-BARs 1:1 betragen sollte, was durch Ausführen eines Aliquots des gereinigten Komplexes auf einem SDS-PAGE-Gel und Coomassie-Färbung überprüft werden kann. Nach der Errichtung können diese Hefestämme dauerhaft als 15% (v/v) Glycerinbestand bei -80 °C gespeichert und/oder zusätzlich modifiziert werden, um weitere Bindungspartner abzufragen. Unser Workflow dauert in der Regel 2-3 Wochen für die Dehnungskonstruktion und 3-4 Tage für die Expression und Reinigung und 1 Tag für Liposomenbindungstests. Wir glauben, dass dieser Workflow Forschern helfen kann, die Lipidspezifität von SNX-BAR-Proteinen mit nativen BAR-Proteinen auf synthetischen Liposomen oder riesigen Unilamellar-Vesikeln (GUVs) besser zu verstehen und die genaue Zusammensetzung von Lipiden zu enthüllen, die für den Umbau der Membran erforderlich sind, und so ihren Wirkmechanismus zu offenbaren.
Kritische Schritte
Bei unseren ersten Versuchen, SNX-BAR-Heterodimere aus nicht-protease-mangelhaften Zellen zu reinigen, fanden wir oft reduzierte Erträge und Abbauprodukte. Daher glauben wir, dass es während der ersten Schritte der Stammkonstruktion entscheidend ist, mit einem elterlichen Hefestamm zu beginnen, der für eine oder mehrere der großen Vakuumproteinasen mangelhaft ist. Insbesondere fanden wir hefe Stamm TVY614, die für pep4, prb1und prc1erschöpft ist, um die optimal. Mit dem TVY614-Stamm erhalten wir routinemäßig >90% reine Snx4-Atg20-Heterodimere (Abbildung 4 und Abbildung 5A). Die Notwendigkeit, dass alle drei Proteinasen ablated werden müssen, kann jedoch SNX-BAR-Kombinationsspezifisch sein. Zum Beispiel wurden Vps5-Vps17 Heterodimere erfolgreich in nicht-protease mangelhaften Stämmen10 gereinigt und wenn wir die Zugabe einer PEP4 Ablation einschlossen, beobachten wir bescheidene Steigerungen der Ausbeute und Reinheit (Abbildung 5A). Je nach den nachgelagerten Anwendungen des Benutzers und dem Bedarf an Reinheit oder wählbaren Markern kann es daher zu Flexibilität beim Entwerfen von Ausdrucksstämmen kommen.
Wichtig ist auch die Reihenfolge der Genkonstruktion. Wir empfehlen zunächst das C-terminale TAP-Tagging SNX-BAR ORF 1, um den Ausdruck durch Western Blot ohne Galaktose-Induktion zu bestätigen (Abbildung 1). Während der Galaktose-Induktion ist es wichtig, die Zellen über Nacht in 2% Raffinose und 0,1% Glukose vorzukonditionieren. Wenn die Zellen nicht vorkonditioniert werden, führt dies zu einem extrem langsamen Wachstum oder zelltötenden Zellen. Es ist jedoch auch entscheidend für die Zellen, die verbleibende Glukose während des Übernachtwachstums zu erschöpfen, da sonst die Galaktose-Induktion negativ beeinflusst werden kann. Es wird auch empfohlen, mehrere Isolate durch Western Blot zu überprüfen, um die Expressionhomogenität der TAP-markierten SNX-BAR-Proteine zu bewerten. Wir überprüfen in der Regel 2-3 Isolate und wählen den robustesten ausdrückenden Kandidaten.
Modifikation, alternative Ansätze und zukünftige Anwendungen
In Schritt 2.8 erfordert die Tandemaffinitätsreinigung (TAP) in der Regel eine zweistufige Affinitätsreinigung mit IgG- und Calmodulin-Perlen nach TEV-Spaltung12. In diesem Protokoll werden jedoch SNX-BAR-Dimere von TEV-Protease mit sehr hoher Ausbeute und Reinheit entkernt. Wir finden, dass eine nachträgliche Affinitätsreinigung mit Calmodulin-Perlen inkonsistente und reduzierte Ausbeuten erzeugt, daher empfehlen wir, nach der TEV-Spaltung aufzuhören. Das TEV-Eluat, das die SNX-BAR-Proteine und seine(6)-getaggte TEV-Protease enthält, kann durch Ni-NTA-Agaroseperlen weiter gereinigt werden. Wir stellen jedoch auch fest, dass dieser Schritt die Gesamtausbeute von SNX-BAR-Proteinen reduzieren kann und unnötig ist, da die TEV-Protease keine Liposomenbindung oder Tubulationstests beeinträchtigt. Wenn die gereinigten SNX-BARs für jede andere Anwendung verwendet werden, empfehlen wir dem Anwender, die Auswirkungen der TEV-Protease in seinen Assays zu bewerten.
Bisher haben wir mit diesem Protokoll und den beschriebenen Modifikationen zur Reinigung von Snx4-Atg20- und Vps5-Vps17-Heterodimeren in Hefe erfolgreich versucht und ihre Lipidspezifität an synthetischen Liposomen erfolgreich bewertet. Wir glauben jedoch, dass das Protokoll erfolgreich an alle SNX-BARs in Hefe angepasst werden kann. Es ist auch möglich, das System zu verwenden, um rekombinante SNX-BAR-Proteine aus anderen Organismen zu produzieren. Dies würde jedoch einen zusätzlichen Schritt der Stammkonstruktion erfordern, um einen exogenen Gen-Lokus in das Hefegenom zu integrieren. Wir glauben auch, dass das System erweitert werden kann, um multimere Komplexe einschließlich Frachtproteinen zu reinigen. Daher glauben wir, dass unser Expressionssystem über das Verständnis der Lipidangaben von SNX-BARs hinausgehen kann. Zukünftige Anwendungen werden es Forschern ermöglichen, ganze Frachterfassungskomplexe auf Liposomen zu rekonstruieren, um zu verstehen, wie vollständige Baugruppen den Membranumbau beeinflussen können.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die in dieser Publikation berichtete Forschung wurde vom National Institute of General Medical Sciences der National Institutes of Health unter der Vergabenummer GM060221 und teilweise vom National Institute of General Medical Sciences der National Institutes unterstützt. gesundheitsamt t32GM007223. R.C. wurde teilweise vom UNC-Charlotte Faculty Research Grants Program unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.2 μm PC Membranes | Avanti | 610006 | |
| 10 mL Poly-Prep Chromatography column (Bio-Rad) | Bio-Rad | 731-1550 | |
| 27 G needle | BD Biosciences | 301629 | |
| Amicon Ultra Centrifugal Filter with 10K cutoff | Amicon | UFC501024 | |
| Avestin EmulsiFlex-C3 Homogenizer | Avestin | EF-C3 | |
| BCA assay | Pierce | 23225 | |
| Beckman Optima MAX-XP Ultracentrifuge | Beckman Coulter | 393315 | |
| Complete Protease Inhibitor Cocktail | Roche | 4693116001 | |
| DOPC | Avanti | 850375 | |
| DOPS | Avanti | 840035 | |
| Ergosterol (Sigma) | Sigma | 47130-U | |
| Extruder Set with Block 0.2 μL/1 mL | Avanti | 610000 | |
| FEI Tecnai F20 transmission electron microscope (200 kV) | |||
| Glass culture tubes | VWR | 47729-570 | |
| IgG sepharose beads (GE Healthcare) | GE Healthcare | 17-0969-01 | |
| Microlter glass syringes | Hamilton | 7637-01 | |
| New Brunswick Excella E25 | Eppendorf | M1353-0000 | or equivalent shaking 30 °C |
| Ni-NTA Magnetic Agarose Beads | Pierce | 78605 | |
| Optima XE-90 Ultracentrifuge | Beckman Coulter | A94516 | |
| Parafilm M | VWR | 52858-076 | |
| PI3P | Echelon | P-3016 | or Echelon equivalent |
| Polycarbonate bottle assembly | Beckman Coulter | 355622 | |
| TLA-100 Fixed-Angle Rotor | Beckman Coulter | 343840 | |
| Type 45 Ti Rotor | Beckman Coulter | ||
| Vacuum Desiccator, Bottom and Lid with Socket Valve | VWR | 75871-436 | |
| Vacuum Pump Alcatel (Pascal 2005 C1) | A&J Vacuum | PN07050 | |
| Vortex with foam holder | VWR | 10153-838 | |
| VWR KIT MICROTUBE | VWR | 12620-880 |
Referenzen
- Teasdale, R. D., Collins, B. M. Insights into the PX (phox-homology) domain and SNX (sorting nexin) protein families: structures, functions and roles in disease. The Biochemical Journal. 441 (1), 39-59 (2012).
- Zhang, H., et al. The Retromer Complex and Sorting Nexins in Neurodegenerative Diseases. Frontiers in Aging Neuroscience. 10, 79 (2018).
- Burd, C., Cullen, P. J. Retromer: a master conductor of endosome sorting. Cold Spring Harbor perspectives in Biology. 6 (2), (2014).
- Chi, R. J., Harrison, M. S., Burd, C. G. Biogenesis of endosome-derived transport carriers. Cellular and Molecular Life Sciences. 72 (18), 3441-3455 (2015).
- Wang, J., et al. Endosomal receptor trafficking: Retromer and beyond. Traffic (Copenhagen, Denmark). 19 (8), 578-590 (2018).
- Ma, M., et al. Lipid trafficking by yeast Snx4 family SNX-BAR proteins promotes autophagy and vacuole membrane fusion. Molecular Biology of the Cell. , (2018).
- van Weering, J. R., et al. Molecular basis for SNX-BAR-mediated assembly of distinct endosomal sorting tubules. The EMBO Journal. 31 (23), 4466-4480 (2012).
- Chi, R. J., et al. Fission of SNX-BAR-coated endosomal retrograde transport carriers is promoted by the dynamin-related protein Vps1. The Journal of Cell Biology. 204 (5), 793-806 (2014).
- Purushothaman, L. K., Arlt, H., Kuhlee, A., Raunser, S., Ungermann, C. Retromer-driven membrane tubulation separates endosomal recycling from Rab7/Ypt7-dependent fusion. Molecular Biology of the Cell. 28 (6), 783-791 (2017).
- Purushothaman, L. K., Ungermann, C. Cargo induces retromer-mediated membrane remodeling on membranes. Molecular Biology of the Cell. 29 (22), 2709-2719 (2018).
- Wurmser, A. E., Emr, S. D. Phosphoinositide signaling and turnover: PtdIns(3)P, a regulator of membrane traffic, is transported to the vacuole and degraded by a process that requires lumenal vacuolar hydrolase activities. The EMBO journal. 17 (17), 4930-4942 (1998).
- Puig, O., et al. The tandem affinity purification (TAP) method: a general procedure of protein complex purification. Methods. 24 (3), 218-229 (2001).
- Kushnirov, V. V. Rapid and reliable protein extraction from yeast. Yeast. 16 (9), 857-860 (2000).
- Longtine, M. S., et al. Additional modules for versatile and economical PCR-based gene deletion and modification in Saccharomyces cerevisiae. Yeast. 14 (10), 953-961 (1998).
- Tropea, J. E., Cherry, S., Waugh, D. S. Expression and purification of soluble His(6)-tagged TEV protease. Methods in Molecular Biology. 498, 297-307 (2009).
- Zhang, L., et al. Morphology and structure of lipoproteins revealed by an optimized negative-staining protocol of electron microscopy. Journal of Lipid Research. 52 (1), 175-184 (2011).
- Yong, X., et al. Expression and purification of the SNX1/SNX6 complex. Protein Expression and Purification. 151, 93-98 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten