Method Article
Expression, purification et liposome Binding of Budding Yeast SNX-BAR Heterodimers
Dans cet article
Résumé
Ici, nous présentons un flux de travail pour l'expression, la purification et la liaison liposome des hétérodimères DeNX-BAR dans la levure.
Résumé
Les protéines SNX-BAR sont une classe évolutivement conservée de protéines de remodelage membranaire qui jouent un rôle clé dans le tri et le trafic de protéines et de lipides pendant l'endocytose, le tri dans le système endosomal, et l'autophagie. La fonction protéique SNX-BAR est au cœur de la fonction protéique SNX-BAR, soit la capacité de former des homodimères ou des hétérodistes qui lient les membranes en utilisant des domaines phox-homologie (PX) et BAR (Bin/Amphiphysin/Rvs) très conservés. En outre, l'oligomerisation des diététistes SNX-BAR sur les membranes peut provoquer la formation de tubules et de vésicules membranaires et cette activité est censée refléter leurs fonctions de protéines de couche pour les transporteurs de transport dérivés de l'endosome. Les chercheurs ont longtemps utilisé des études de liaison in vitro utilisant des protéines Recombinantes SNX-BAR sur des liposomes synthétiques ou des vésicules unilamellaires géantes (VGU) pour révéler la composition précise des lipides nécessaires pour conduire le remodelage de la membrane, révélant ainsi leur mécanisme d'action. Cependant, en raison de défis techniques avec les systèmes à double expression, la toxicité de l'expression des protéines SNX-BAR chez les bactéries, et la faible solubilité des protéines SNX-BAR individuelles, la plupart des études à ce jour ont examiné les homodimères SNX-BAR, y compris les dieux non physiologiques qui se forment lors de l'expression chez les bactéries. Récemment, nous avons optimisé un protocole pour surmonter les lacunes majeures d'un système d'expression bactérienne typique. À l'aide de ce flux de travail, nous démontrons comment exprimer et purifier avec succès de grandes quantités d'hétérodistes SNX-BAR et comment les reconstituer sur des liposomes synthétiques pour les essais de liaison et de tubulation.
Introduction
Les organites membranaires tels que la membrane plasmatique, le réticulum endoplasmique, l'appareil Golgi, le lysosome (vacuole de levure) et l'endosome composent le système endomembrane de la cellule eucaryotique. La plupart des organites ont la capacité de communiquer et d'échanger du matériel avec d'autres organites par l'intermédiaire de transporteurs de vésicules. La façon dont la cellule coordonne l'emballage et la formation des transporteurs de vésicules dans le système endomembrane n'est pas bien comprise. Cependant, les protéines et les lipides qui constituent une grande partie du système endomembrane sont connus pour provenir de l'intériorisation des vésicules endocytiques de la membrane plasmatique (PM). L'endosome est l'organelle d'acceptation primaire pour ces vésicules et est composé de multiples ensembles interconnectés d'organites tubulaires. La fonction principale de l'endosome est de faciliter l'acquisition de nutriments, de réguler le renouvellement des protéines et des lipides, de protéger contre les infections pathogènes et de servir de principale source de réapprovisionnement en lipides pour la membrane plasmatique. Comme l'endosome reçoit la majeure partie des protéines de cargaison et des lipides de la membrane plasmatique, il agit comme un compartiment de tri en isolant les cargaisons dans les transporteurs tubulaires de transport endosomal (ETC). Toutes les protéines non séquestrées dans les ETC sont laissées à être dégradées par le système endo-lysosomal. La dysrégulation du tri des cargaisons dans les ETC peut entraîner une perte d'absorption des nutriments, d'un renouvellement des protéines ou d'une homéostasie lipidique, ce qui entraîne de nombreux troubles métaboliques, développementaux et neurologiques1,2. Cependant, en dépit du rôle central des ETC à l'endosome, le mécanisme sous-jacent de la façon dont l'endosome peut coordonner sélectivement l'emballage d'une multitude de cargaisons hétérogènes dans les transporteurs tubulaires n'est pas connu.
La famille de la nexinde de tri (SNX) est une classe évolutivement conservée de protéines qui se sont avérées critiques pour de nombreuses réactions de transport de vésicules dans la cellule3,4,5. Les nexins de tri sont recrutés à la membrane endosome et aident à capturer la cargaison par leur domaine caractéristique d'homologie de phox (PX), qui lie le phosphatidylinositol-3-monophosphate (PtdIns(3)P), un lipide enrichi sur la membrane endosome. Les mammifères codent trente-trois protéines SNX, qui peuvent être encore divisées en plusieurs sous-familles, selon la présence d'autres domaines1. Plus particulièrement, la sous-famille SNX-BAR est la plus grande sous-famille composée de douze chez l'homme, tandis que dans la levure en herbe, Saccharomyces cerevisiae, la sous-famille est réduite à seulement sept SNX-BARs. Les protéines SNX-BAR ont à la fois un domaine PX et un domaine Bin-Amphiphysin-Rvs (BAR) qui déclenche des réservoirs lipidiques pour lier les membranes de courbure positives. Par conséquent, la famille SNX-BAR a une affinité naturelle pour l'endosome et peut médiatisation formation ETC via leurs capacités de remodelage de la membrane. In vitro, les propriétés de remodelage de SNX-BARs peuvent être induites par l'ajout de SNX-BARs purifiés aux liposomes synthétiques et la formation ultérieure de tubules étroits et enduits peut être visualisée par microscopie électronique. En utilisant ces méthodes, les chercheurs ont déterminé que la concentration d'oligomerisation et la force de constriction semblent varier parmi la famille SNX-BAR suggérant qu'ils pourraient aider à la fois dans la formation et la scission des ETC.
Les SNX-BARs peuvent être classés par leurs propriétés de dimerisation exclusives. Des essais de liaison in vitro et des études structurelles ont démontré que les protéines SNX-BAR ne peuvent former que des homodimères ou des hétérodistes spécifiques. Par conséquent, en principe, chaque dimère-oligomère SNX-BAR potentiel pourrait fournir un manteau de tubule pour une voie de trafic spécifique à la cargaison et, de même, l'oligomerisation restreinte des autres protomères SNX-BAR, peut également définir des voies d'exportation distinctes. Cependant, en raison du grand nombre de SNX-BARs et de la diversité au sein de la famille SNX, une hypothèse de chargement nexin-one est très peu probable. Au lieu de cela, un effort coordonné utilisant une multitude de facteurs tels que SNX-BARs, la cargaison, la spécificité lipidique et d'autres dépendances est plus probable. De même, des études récentes de la famille de levure SNX4 ont révélé des preuves pour la spécificité lipidique supplémentaire, au-delà de PtdIns(3)P, pour potentialiser les transporteurs de transport endosome6. Dans cette étude, SNX-BAR homodimer Mvp1-Mvp1 a été purifié à partir de bactéries et les hétérodistes indigènes Snx4-Atg20 et Vps5-Vps17 ont été exprimés et purifiés à haut rendement de levure, tandis que seulement Snx4-Atg20 a été trouvé pour lier de préférence phosphatidylserine (PS) et la forme étroite tube-comme les structures dans les études de liposome liaison6. Alors que d'autres dans le domaine ont révélé des propriétés importantes de la SNX-BARs en utilisant recombinantly purifié SNX-BAR homodimers de bactéries, la toxicité associée à l'expression SNX-BAR hétérodistes dans des systèmes similaires ont entravé leur caractérisation indigène7,8,9,10. Par conséquent, sans un système fiable pour obtenir des hétérodimères natifs exprimés de façon recombinante pure, les chercheurs doivent renoncer à ces lignes d'investigation. Dans la figure 1, nous présentons un flux de travail en quatre parties à 1) construire une souche de levure surexprimant SNX-BAR hétérodistes pour la purification d'affinité tandem, 2) exprimer et purifier les hétérodistes natifs de SNX-BAR, 3) préparer des liposomes synthétiques unilamellar, et 4) mettre en place une tubulation liposome ou des sédimentations d'analyse, fournissant un outil essentiel pour les chercheurs d'étudier le catalogue croissant de nexins de tri trouvés dans la nature.
Protocole
1. Construction de souche de levure
- Commencez par TVY614 (pep4MD::LEU2 prb1MD::hisG prc1MD::HIS3)11 comme la souche parente. Cette souche est déficiente pour les protéases vacuolar, qui contribuent à la majorité de la dégradation des protéines après la lyse cellulaire, et permet donc une purification plus propre et plus efficace.
- Concevoir les amorces12 et intégrer la balise de purification d'affinité tandem (TAP) au terminus C d'Atg20 (SNX-BAR ORF 1) en utilisant une recombinaison homologue. Utiliser la réaction en chaîne de polymérase (PCR) pour confirmer les intégrations (figure 2).
- Effectuer une tache occidentale de lysate cellulaire contre l'étiquette TAP pour confirmer une bonne intégration13.
REMARQUE: Nous recommandons la récolte de 3 OD (1 OD 1 x 107 cellules) de cellules pour la vérification SDS-PAGE et western blot. Notez que l'intégration de l'étiquette TAP devrait avoir lieu avant de remplacer les promoteurs endogènes par le promoteur GAL1 afin de permettre une vérification plus facile de l'étiquette TAP via western blot. - Remplacer les promoteurs endogènes Snx4 (SNX-BAR ORF1) et Atg20 (SNX-BAR ORF 2) par des promoteurs GAL1 non étiquetés en utilisant des étapes de recombinaison et de transformation homologues séquentielles de chaque ORF14.
- L'utilisation d'amorces de flanc à l'extérieur des sites d'intégration pour confirmer les intégrations réussies (figure 2). Il en résultera un phénotype nul des SNX-BARs ciblés en l'absence de galactose dans le milieu de croissance.
2. Induction de levure et purification de dimère de SNX-BAR
REMARQUE: Les cellules de levure peuvent être propagées sur les plaques standard de yPD (extrait de levure, peptone, et 2% glucose) des plaques d'agar pendant que les modifications sont chromosomiquement intégrées.
- Inoculer un grand écouvillon de cellules en 50 ml de yP standard (extrait de levure et peptone) milieu avec 2% de raffinose et 0,1% de glucose comme source de carbone dans un flacon au moins 4x le volume de la culture et de croître pendant la nuit dans un shaker de 30 oC pour permettre une aération appropriée. Attendez-vous à ce que la croissance de ce milieu soit plus lente par rapport à la JPD standard.
- Le lendemain matin, utilisez la préculture de 50 ml pour inoculer 1 L de milieu YP standard avec 2% de raffinose et 0,1% de glucose et de croître de 4 à 5 h dans un shaker de 30 oC.
REMARQUE: Le volume de la préculture utilisée pour inoculer la culture de 1 L peut être ajusté en fonction de l'OD600 de la préculture. L'OD600 de la culture 1 L après l'inoculation devrait être d'environ 0,2 pour permettre au moins deux doubles au cours de la croissance de 4-5 h.- Utilisez un flacon fernbach déconcerté pour la croissance pour permettre une aération appropriée, un flacon de volume de 2,8 L est suffisant. Une diminution de l'aération peut entraîner une croissance plus lente et une diminution des granulés de cellules lors de la récolte.
- Vérifiez OD600 pour vous assurer que la culture est dans la phase de journal (0.5-1) après 4-5 h de croissance. Selon la croissance de la souche, ajuster le temps de croissance pour permettre au moins deux doublements. Ajouter à 2% de galactose et grandir toute la nuit dans un shaker de 30 oC.
REMARQUE: L'OD600 après la croissance du jour au lendemain peut varier, mais la culture doit être saturée. Notez que les cellules n'ont pas besoin d'être retirés de 0,1% de glucose avant l'ajout de 2% galactose pour ce protocole de croissance. Nous recommandons la récolte de 3 OD de cellules non induites et induites à cette étape pour SDS-PAGE et tache occidentale pour la vérification (Figure 3A,B, Lane 1-2). - Récolter les cellules par centrifugation à 4500 x g pendant 15 min. Un rotor de seau oscillant qui adapte la culture de volume de 1 L peut être utilisé ici.
- Transférer la granule de levure dans un tube conique de 50 ml; une deuxième étape de centrifugation peut être effectuée au besoin. Le granule de cellules sera généralement d'environ 10-15 ml de volume tel que mesuré par les marques d'obtention de diplôme et peut être utilisé immédiatement ou stocké à -80 oC.
- Resuspendre le granule dans un tampon de purification de 15 ml (50 mM Tris pH 7,4, 300 mM NaCl, 1,5 mM MgCl2, 1 mM Dithiothreitol (TNT), cocktail inhibiteur de la protéase) pour faire un volume final autour de 30 ml.
- Refroidir un homogénéisateur à 4 oC avant de l'utiliser et l'équilibrer avec un tampon de purification. Lyse les cellules à l'aide d'un perturbateur cellulaire mécanique ou d'un homogénéisateur. Charger l'échantillon dans l'homogénéisateur et lyse à 20 000 à 25 000 psi pendant 2 à 3 tours; notez qu'à mesure que les cellules se lysent, il faut plus de pression d'entrée pour maintenir 20 000 à 25 000 psi. Recueillir le lysate cellulaire dans un tube conique de 50 ml sur la glace.
REMARQUE: Si d'autres échantillons doivent être lysés, l'homogénéisateur doit être soigneusement nettoyé et équilibré avant de charger l'échantillon suivant. Gardez tous les lysates cellulaires sur la glace. - Effacer immédiatement le lysate cellulaire à 35 000 x g pendant 1 h à 4 oC. Transférer soigneusement le supernatant dans un nouveau tube. Notez que les lipides de la lyse cellulaire flotteront vers le haut pendant la centrifugation et n'affecteront pas la purification.
REMARQUE: Nous recommandons d'économiser 0,5 à 1 % du lysate et des granulés pour les échantillons de SDS-PAGE. En règle générale, aucune différence majeure n'est observée et une tache occidentale supplémentaire peut être faite pour confirmer la solubilité des protéines TAP(figure 4, voies 1 et 2, respectivement). - Équilibrez 300 l de perles de sépharose IgG avec tampon de purification. Ajouter au lysate de la cellule défriché et incuber pendant 2 h, en tournant à 4 oC.
- Recueillir les perles dans une colonne de chromatographie de 10 ml et laisser le lysate non lié s'écouler à travers.
- Laver les perles à l'aide de 10 ml de tampon de lavage (50 mM Tris pH 7,4, 300 mM NaCl, 1,5 mM MgCl2, 1 mM DTT), en ajoutant 1 ml à la fois et en lui permettant de circuler complètement.
REMARQUE: Nous recommandons d'économiser 2 % des perles D'IgG pour l'échantillon SDS-PAGE. En général, nous observons quatre bandes principales; deux protéines SNX-BAR et igG Heavy and Light Chains(figure 4, Lane 3). Nous recommandons d'économiser des quantités équivalentes de «eluate» et «igG perles après TEV» à comparer pour l'efficacité de clivage TEV. - Recueillir les perles et les transférer dans un tube de microcentrifuge. Ajouter à 500 l de volume total avec un tampon de lavage frais et 2 l de 10 mg/mL de protéase TEV et incuber toute la nuit, en tournant à 4 oC.
- Le lendemain matin, retirez complètement le supernatant à l'aide d'une aiguille de 27 G et évaluez la pureté des protéines de 10 % de polyacrylamide SDS-PAGE(figure 4, Lane 4).
REMARQUE: Nous obtenons généralement 500 l de 0,5-1 mg/mL de 95% d'hétérodimère pure (Figure 4, Lane 4). Purification supplémentaire à l'aide de résine calmoduline peut également être fait, mais nous voyons généralement une réduction significative du rendement et de recommander de s'arrêter ici si la pureté est de 'gt;90%. TEV n'interfère pas avec les essais de liaison liposome, bien que TEV peut être en outre enlevé en utilisant ni-NTA perles agarose15. - Pour vous concentrer, transférer l'échantillon dans un filtre centrifuge de 0,5 ml avec 10 coupures et centrifugeuses KDa selon les instructions du fabricant à 50 l ou moins. Quantifier les protéines concentrées à l'aide de l'assay de la protéine Bradford. Conserver à 4 oC et l'utiliser dans un délai d'une semaine.
3. Préparation Liposome
- Achetez des lipides disponibles dans le commerce : phosphatidylserine (PS), PI3P, ergosterol et phosphatidylcholine (PC). Si nécessaire, suspendre dans le solvant recommandé pour faire des lipides de stock.
REMARQUE: Les lipides sont resuspendus dans un mélange méthanol/chloroforme selon les recommandations du fabricant. Assurez-vous que les stocks lipidiques sont clairs et réchauffés à température ambiante avant de les utiliser. Les lipides en suspension peuvent être stockés sous du gaz argon et scellés à l'aide d'un film de cire (ou équivalent) à -20 oC pendant 6 à 12 mois ou jusqu'à ce que la perte d'activité soit observée. - Calculer le volume requis de chaque stock lipidique pour créer un mélange avec la composition lipidique désirée (voir tableau 1). Supposons un total de 1 taupe de lipides dans le mélange lipidique.
- Effectuez cette étape dans une hotte de fumée chimique. Nettoyez les seringues en verre en élaborant un volume complet de seringues de chloroforme et en les jetant dans un contenant à déchets. Répétez deux fois de plus. Lors du transfert de chloroforme, n'utilisez que des seringues en verre ou des pipettes. Lors de l'élaboration du chloroforme, tirez sur le bouchon lentement pour empêcher l'introduction de bulles de gaz dans la seringue.
- Utilisez des seringues en verre pour transférer les lipides du stock tels que calculés dans un tube de culture de verre propre pour faire un mélange lipidique final de 1% PI3P, 20% ergostérol, 30% PS, PC (tableau 1). Selon les solvants de chaque lipide est resuspendu, le mélange peut devenir trouble à l'ajout de chaque lipide.
REMARQUE: Pour varier les concentrations de PS (0-30%), ajuster les volumes en conséquence et compenser avec pc variable (tableau 1). - Séchez soigneusement le mélange lipidique à l'aide de gaz azoté dirigé vers le mélange lipidique dans un mouvement circulaire pour sécher uniformément les lipides. Utilisez un faible débit de gaz pour garder les lipides au fond du tube de verre pendant le processus de séchage. Envelopper le tube de culture en verre avec du papier d'aluminium, en laissant l'ouverture à découvert, et déshydrater davantage dans le vide pendant 1 h.
- Ajouter 400 l de tampon de liaison (50 mM Tris pH 7,4, 300 mM NaCl, 1 mM MgCl2) pour déshydrater complètement les lipides pour faire une concentration finale de liposome de 2,5 mM.
REMARQUE: La concentration finale de liposome peut être ajustée en ajoutant plus ou moins de tampon de liaison. Par exemple, un tampon de liaison de 200 l peut être ajouté pour produire une concentration liposome de 5 mM si nécessaire (voir ci-dessous).- Resuspendre les lipides en secouant à vitesse moyenne sur un vortex à température ambiante pendant 30 min. Le tampon devrait sembler trouble au fur et à mesure que les lipides sont suspendus.
- Transférer les liposomes resuspendus dans un tube de microcentrifuge. À partir de ce moment, des pointes de pipette en plastique peuvent être utilisées car les lipides ne sont plus en suspension dans le chloroforme. Notez que la solution liposome devrait sembler trouble.
- Les liposomes de congélation-dégel sept à huit fois en submergeant le tube de microcentrifuge d'abord dans l'azote liquide, puis dans un bain d'eau de 37 oC. Le mélange liposome doit apparaître complètement congelé et solide à l'œil avant la décongélation.
- Effectuer des étapes impliquant le chloroforme dans une hotte de fumée chimique. Nettoyez deux seringues en verre de 1 ml en élaborant et en jetant des volumes complets de chloroforme, trois fois chacun, pour éliminer les lipides résiduels. Équilibrez chaque seringue en verre avec de l'eau ultrapure en réparant deux volumes de seringues, puis équilibrez avec tampon de liaison en élaborant deux volumes de seringues.
- Assemblez le mini-extrudeur selon les recommandations du fabricant. Équilibrez une membrane de 200 nm et deux morceaux de supports de filtre (voir Tableau des matériaux)en submergeant chacun dans un tampon de liaison.
- Sandwich de la membrane entre les supports filtre et placer dans le mini-extrudeur. Pour réduire le volume mort dans le mini-extrudeur assemblé et pour s'assurer que l'assemblage est étanche à l'air, passer un volume de tampon de liaison comparable au volume du mélange liposome à travers mini-extrudeur à l'aide des seringues en verre de 1 ml.
- Utilisez l'une des seringues en verre de 1 ml et dessinez le mélange de liposome. Inverser le tube de microcentrifuge pour recueillir le dernier du mélange liposome dans le bouchon de tube pour l'élaboration dans la seringue en verre.
- Extrude liposomes en passant par la membrane de 200 nm 19-21 fois. Recueillir des liposomes extrudés dans un nouveau tube de microcentrifuge.
REMARQUE: Les liposomes extrudés devraient sembler moins nuageux que les liposomes avant l'extrusion. Les liposomes doivent être utilisés le même jour et stockés sur de la glace. La dernière extrusion devrait placer des liposomes dans la seringue en face de celle dans laquelle elle a commencé.
4. Liaison Et tubulation SNX-BAR Liposome
- Protéines purifiées préclaires à 100 000 x g dans un ultracentrifuge pendant 20 min à 4 oC avant de mener des expériences de liaison et de sédimentation liposome. Retirez le supernatant et transférez-le dans un nouveau tube de microcentrifuge; ne pas déranger le granule s'il y en a un.
- Pour effectuer des essais de liaison et de tubulation liposome, incubez 4 'M purifié snx4-Atg20 et 2.5 mM liposomes dans un volume total de réaction de 20 L, variant le volume de liposomes ajoutés.
REMARQUE: Dans la même expérience, le même volume de liposomes doit être utilisé. - Incuber la réaction à 30 oC pendant 30 min.
REMARQUE: Nous suggérons de maximiser la quantité de 2,5 mM de liposomes ajoutés à chaque réaction en utilisant pas moins de 10 liposomes lllpour tenir la visualisation pendant la sédimentation. Si 10 liposomes de 2,5 mL sont utilisés dans une réaction de 20 L, la concentration finale de liposomes sera de 1,25 mM. Si les protéines purifiées sont diluées et qu'il faut plus de volume pour 4 m de protéines, les lipides peuvent être résuspendus en 200 L pendant l'étape de réhydratation pour doubler la concentration de liposomes (voir l'étape 3.6); cependant, ceci exigera connaître la concentration de protéine avant de faire les liposomes. -
Visualiser et quantifier la tubulation liposome.
- Traiter immédiatement les réactions de liaison liposome pour l'analyse de microscopie électronique. Préperlez des échantillons sur une grille de maille de cuivre recouverte de carbone et une tache négative à l'aide de 1 % d'acétate uranyl (figure 5B)16.
- Analyser des échantillons sur un microscope électronique de transmission (200 kV).
- Utilisez un logiciel d'analyse d'image pour mesurer et quantifier le diamètre des tubules. Pour quantifier avec précision le diamètre du tubule d'un seul tubule, prendre des mesures de trois diamètres le long de la longueur d'un tubule et de la moyenne (figure 5B).
REMARQUE: L'analyse bidirectionnelle de la variance a été utilisée pour déterminer la signification statistique (figure 5E). L'acétate d'uranyl est à la fois radioactif et toxique. Une certification appropriée en matière de sécurité en laboratoire est requise pour effectuer cette étape.
-
Liposome liaison et sédimentation.
- Transférer la réaction (20 l, de l'étape 4.3) à un tube de centrifugeuse en polycarbonate et utiliser un rotor compatible pour tourner à 100 000 x g dans un ultracentrifugeur pendant 20 min à 4 oC. Retirez soigneusement le supernatant et transférez-le dans un nouveau tube de microcentrifuge. Notez que le granule doit rester intact.
- Resuspendre le granule dans SDS-PAGE 40 'L de tampon d'échantillon et transférer à un nouveau tube de microcentrifuge. Ajouter 20 ll de tampon d'échantillon au supernatant. Chargez des quantités équivalentes de granulés et de supernatants dans un gel SDS-PAGE en polyacrylamide de 10 % et effectuez la coloration Coomassie pour visualiser les SNX-BARs liés aux liposomes (Figure 5A).
- Pour quantifier la quantité de complexe SNX-BAR dans la fraction de granulés, quantifier les intensités de bande à l'aide de la densitométrie et quantifier la proportion de protéines SNX-BAR dans la fraction de granulés.
REMARQUE: L'analyse bidirectionnelle de la variance a été utilisée pour déterminer la signification statistique (figure 5C).
Résultats
Ce protocole décrit une méthode de production reproductible et robuste de complexes endogènes de levure SNX-BAR qui peuvent être utilisés pour les essais de remodelage de la membrane en aval (Figure 1). La construction de la souche de levure utilisée pour la purification tire parti de l'efficacité de la recombinaison homologue dans la levure en herbe, permettant des modifications au loci génomique des SNX-BARs ciblés (Figure 2). Cette conception a deux avantages, (i) que la sélection n'est pas nécessaire pour maintenir les modifications, le milieu YP standard peut être utilisé, permettant la croissance à une densité cellulaire plus élevée et donc une production plus élevée de protéines et (ii) les niveaux d'expression des SNX-BARs ciblés seront égaux, l'optimisation de la production du complexe hétérodiste. Avant l'ajout de galactose, les SNX-BARs ciblés présenteront un phénotype nul et peuvent donc entraîner un défaut de croissance ou d'autres défauts connus spécifiques aux SNX-BARs ciblés. En outre, la croissance de 2% de raffinose et de 0,1% de glucose est plus lente que la croissance de 2% de glucose. Par conséquent, la période de croissance avant l'induction du galactose peut nécessiter une optimisation pour chaque souche particulière. Pour vérifier l'induction appropriée de l'expression SNX-BAR, une tache occidentale contre l'étiquette TAP est probablement nécessaire puisque les niveaux de protéines des SNX-BARs peuvent ne pas être détectés via la tache Coomassie (Figure 3). Cependant, parce qu'un seul membre du complexe SNX-BAR a une étiquette, l'expression de la protéine non étiquetée (s) ne peut pas être confirmée à moins que toutes les étapes de la purification sont terminées. Après la purification de l'hétérodiste SNX-BAR, les bandes des deux SNX-BARs devraient apparaître en 1:1 rapport stochiométrique et il devrait y avoir peu ou pas de bandes contaminantes (Figure 4, voie 4). S'il y a d'autres bandes contaminantes, et que la souche de levure de départ est déjà déficiente en protéase, plus d'inhibiteur de la protéase peut être ajouté pendant la lyse cellulaire. En outre, une deuxième étape de purification utilisant la résine de calmodulin peut être exécutée.
Lors de la réalisation des essais de remodelage de membrane (Figure 5), la même préparation de liposomes et de protéines purifiées doit être utilisée dans la même expérience. Si plusieurs préparations de purification de protéines sont nécessaires pour atteindre la concentration désirée, combiner toutes les protéines purifiées avant de mener une expérience. Les liposomes doivent être fabriqués et utilisés dans la même journée (tableau 1). Lors des essais de sédimentation liposome, il est essentiel que la protéine purifiée soit prédéclearée en utilisant les mêmes conditions de sédimentation de 100 000 x g pendant 20 minutes immédiatement avant d'incuber avec des liposomes, car les protéines précipitées peuvent fausser les résultats. De plus, le granule liposome devrait rester intact après la sédimentation.
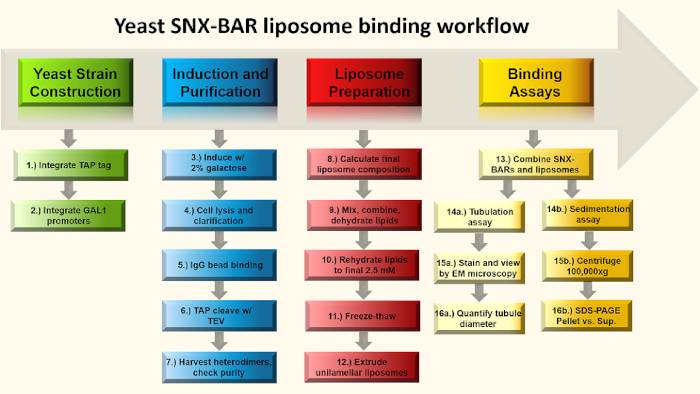
Figure 1 : Graphique de flux d'assay de liaison SNX-BAR. En bref, dans les étapes 1-2, nous concevons les promoteurs DE GAL en deux loci génomiques SNX-BAR, remplaçant chacun des promoteurs endogènes et concevons une étiquette C-terminal TAP dans l'un des deux loci SNX-BAR. Ensuite, dans les étapes 3-7, nous induisons les cellules avec galactose et purifions les hétéroodimères SNX-BAR à l'homogénéité. Dans les étapes 8-12, nous calculons et préparons des liposomes unilamellar. Enfin, nous pouvons combiner les hétérodimères SNX-BAR avec des liposomes unilamellar et effectuer deux essais; L'étape 14a-16a implique la tubulation de membrane et 14b-16a impliquent l'assay de sédimentation. Voir le texte pour plus de détails. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Stratégie d'intégration SNX-BAR. Deux loci de SNX-BAR ont été visés pour l'expression de GAL utilisant la recombinaison homologue. SNX-BAR ORF1 (Atg20) a en outre été ciblé pour exprimer une étiquette C-terminal TAP. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Vérification de l'induction de Galactose. (A-B) Afin de vérifier l'induction GAL d'Atg20-TAP, nous recommandons une analyse SDS-PAGE et western blot des extraits de cellules induits avec 2% galactose (A, B, voie 2) et non induit (A, B, voie 1). (C) La membrane de tache occidentale est également dépouillée et sondée avec anti-pgk1 pour un contrôle de chargement. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
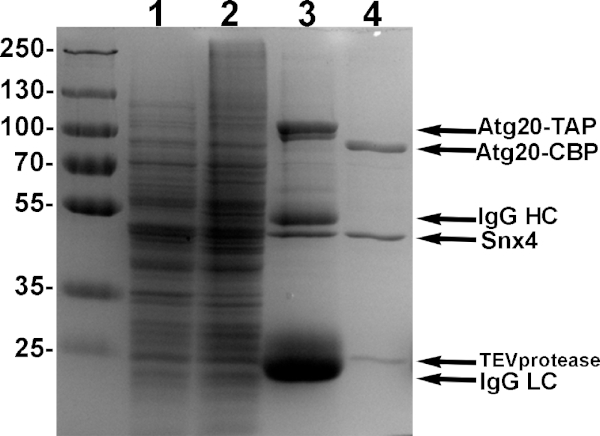
Figure 4 : Exemple de purification des hétérodistes Atg20-Snx4. Les cellules de levure conçues pour exprimer Atg20-TAP et Snx4 conduits par des promoteurs de galactose ont été induites avec 2% de galactose, lysed et lié utilisant le sépharose d'IgG, et éludé avec la protéase de TEV. Les échantillons de chaque étape de purification sont montrés dans 10% SDS-PAGE. Voie 1 : supernatant induit du lysate. Voie 2 : granule induit de lysate. Voie 3 : échantillon de protéines liées au sépharose igG. Voie 4: TEV élutation de purats Atg20-Snx4 de IgG sepharose. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
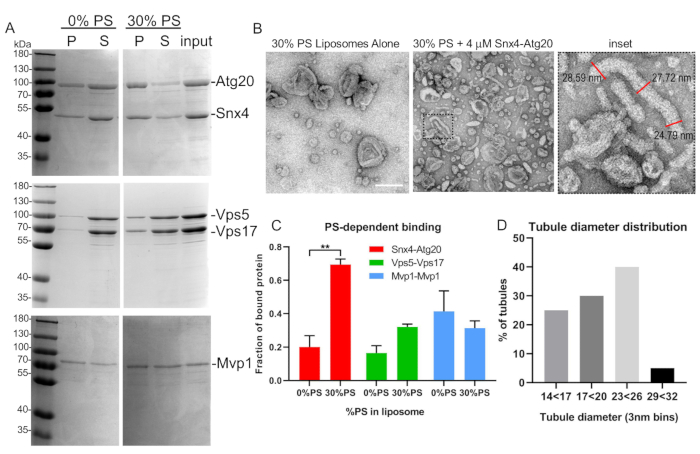
Figure 5 : Test de liaison et de tubulation liposome représentatif. (A) Les hétérodistes SNX-BAR, Atg20-Snx4 et Vps5-Vps17 de levure, ont été exprimés, purifiés et liés à des liposomes synthétiques tels que décrits dans le texte. Notez que Mvp1 forme des homodimers et a été exprimé en bactéries. (B) Micrographies EM d'analyse de la tubulation et des mesures de tubule de Snx4-Atg20 (inset). (C) La liaison SNX-BAR à diverses compositions liposome a été quantifiée par densitométrie. Le graphique indique l'erreur moyenne et standard de la moyenne. p 'lt; 0.002. (D) Les diamètres de Tubule ont été quantifiés et graphiques comme décrit dans le texte. Barre d'échelle de 200 nm. Les barres d'erreur représentent une analyse bidirectionnelle de la variance. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| Composition typique de Liposome | DOPC DOPC | DOPS (DOPS) | Ergosterol Ergosterol | PI3P-C16 |
| Mw | 786.1 | 810.0 | 396.7 | 957.0 |
| mol fraction | 49% | 30% | 20% | 1% |
| Stock mM | 32.0 | 12.0 | 25.0 | 1.0 |
| Masse (mg) | 385.2 | 243.0 | 79.3 | 9.6 |
| Concentration (mg/mL) | 25.2 | 9.7 | 9.9 | 1.0 |
| Volume à RXN(mL) | 15.3 | 25.0 | 8.0 | 10.0 |
Tableau 1 : Recette Liposome. Des liposomes synthétiques ont été préparés utilisant une combinaison de DOPC, DOPS, ergosterol, et PI3P. Nous calculons la concentration finale à 1 mol de lipide. Notre composition standard comprend 20% d'ergostérol, 1% DE PI3P, DOPS (jusqu'à 30%), et des quantités variables de DOPC. Le tableau comprend une formulation typique pour 400 OL de 30 % DE DOPS.
Discussion
Ici, nous démontrons un flux de travail optimisé pour purifier les dissipateurs SNX-BAR dans la levure et deux essais pour évaluer leurs propriétés biophysiques sur des liposomes synthétiques. Le principal avantage par rapport à l'expression typique des protéines recombinantes dans Escherichia coli ou d'autres systèmes est la capacité d'exprimer uniformément les protéines SNX-BAR dans un hôte indigène, évitant ainsi les problèmes de toxicité et d'insolubilité présents dans la purification des SNX-BARs dans d'autres systèmes. Il est également remarquable que notre système ne nécessite pas de clonage moléculaire ou l'abri de vecteurs d'expression multiples17. Nos deux souches de levure SNX-BAR sont pilotées par des promoteurs de galactose chromosomiques, assurant ainsi une expression uniforme lors de l'induction. Une considération importante est qu'en l'absence de galactose, il y aura peu ou pas d'expression des SNX-BARs ciblés, ce qui entraîne un phénotype nul. En outre, nous constatons que Les SNX-BARs ont tendance à tolérer bien les étiquettes C-terminal, ce qui nous permet d'ajouter l'étiquette TAP au terminus C. Cependant, selon la protéine étiquetée, une étiquette N-terminal TAP peut également être utilisée12. En outre, puisque Les SNX-BARs ne forment que des dimers 1:1, une seule protéine doit être étiquetée à des fins de purification. Cependant, certains SNX-BARs qui forment normalement des hétérodistes dans la cellule ont été montrés pour former des homodimères sous des concentrations non physiologiques7. Par conséquent, il est essentiel que lors de la purification de l'hétérodiste, le rapport stoichiométrique des deux SNX-BARs devrait être 1:1, ce qui peut être vérifié en exécutant un aliquot du complexe purifié sur un gel SDS-PAGE et en exécutant la coloration Coomassie. Une fois conçues, ces souches de levure peuvent être sauvegardées à perpétuité à mesure que 15 % (v/v) stock de glycérol à -80 oC et/ou modifiés en plus pour interroger d'autres partenaires de liaison. Notre flux de travail prend généralement 2-3 semaines pour la construction de la souche et 3-4 jours pour l'expression et la purification et 1 jour pour les essais de liaison liposome. Nous croyons que ce flux de travail peut aider les chercheurs à mieux comprendre la spécificité lipidique des protéines SNX-BAR à l'aide de protéines BAR indigènes sur des liposomes synthétiques ou des vésicules unilamellaires géantes (VGU) et révéler la composition précise des lipides nécessaires pour conduire le remodelage de la membrane, révélant ainsi leur mécanisme d'action.
Étapes critiques
Au cours de nos premières tentatives pour purifier les hétérodistes SNX-BAR à partir de cellules non déficientes en protéase, nous avons souvent constaté des rendements réduits et des produits de dégradation. Par conséquent, pendant les premières étapes de la construction de la souche, nous croyons qu'il est essentiel de commencer par une souche de levure parentale qui est déficiente pour une ou plusieurs des protéines vacuolaire majeures. En particulier, nous avons trouvé la souche de levure TVY614, qui est épuisépour pep4, prb1, et prc1, pour être le plus optimal. En utilisant la souche TVY614, nous obtenons régulièrement des hétérodistes Snx4-Atg20 purs(figure 4 et figure 5A). Cependant, la nécessité pour chacun des trois proteinases d'être ablated peut être sNX-BAR combinaison spécifique. Par exemple, les hétérodificateurs Vps5-Vps17 ont été purifiés avec succès dans des souches non déficientes de protéase10 et lorsque nous avons inclus l'ajout d'une ablation PEP4, nous observons des augmentations modestes du rendement et de la pureté (Figure 5A). Par conséquent, selon les applications en aval de l'utilisateur et le besoin de pureté ou de marqueurs sélectionnables, il peut y avoir une flexibilité lors de la conception des souches d'expression.
L'ordre de la construction de gènes est également important. Nous recommandons C-terminally TAP marquage SNX-BAR ORF 1 d'abord, afin de confirmer l'expression par western blot sans avoir besoin d'induction galactose (Figure 1). Pendant l'induction de galactose, il est essentiel de pré-conditionner les cellules pendant la nuit dans le raffinose de 2% et le glucose de 0.1%. L'échec de la pré-condition des cellules entraîne une croissance extrêmement lente ou la mort cellulaire. Cependant, il est également essentiel pour les cellules d'épuiser le glucose restant pendant la croissance de nuit, sinon l'induction de galactose peut être négativement affectée. Il est également recommandé de vérifier plusieurs isolats par tache occidentale pour évaluer l'homogénéité de l'expression des protéines SNX-BAR étiquetées TAP. Nous sélectionnons généralement 2-3 isolats et choisissons le candidat le plus solidement exprimé.
Modification, approches alternatives et applications futures
Dans l'étape 2.8, la purification d'affinité de tandem (TAP) exige typiquement une purification d'affinité de deux étapes utilisant IgG et perles calmodulin après clivage de TEV12. Cependant, dans ce protocole, nous éliquons SNX-BAR dimers par tEV protéase avec un rendement et une pureté très élevés. Nous trouvons la purification d'affinité suivante utilisant des perles de calmodulin produit des rendements incohérents et réduits, ainsi nous recommandons d'arrêter après clivage de TEV. L'éluate TEV contenant les protéines SNX-BAR et sa protéase TEV (6) étiquetée peut être purifiée par les perles d'agarose Ni-NTA. Cependant, nous trouvons également cette étape peut réduire le rendement global de protéine de SNX-BAR et est inutile, puisque la protéase de TEV n'interfère pas avec des essais de liaison ou de tubulation de liposome. Par conséquent, si les SNX-BARs purifiés seront utilisés pour toute autre application, nous recommandons à l'utilisateur d'évaluer l'impact de la protéase TEV dans leurs essais.
Jusqu'ici, nous avons réussi utilisant ce protocole et les modifications décrites pour purifier Snx4-Atg20 et Vps5-Vps17 heterodimers dans la levure et avons avec succès évalué leur spécificité lipidique sur les liposomes synthétiques. Cependant, nous croyons que le protocole peut être adapté avec succès à n'importe lequel des SNX-BARs dans la levure. Il est également possible d'utiliser le système pour produire des protéines Recombinantes SNX-BAR à partir de tout autre organisme. Cependant, cela nécessiterait une étape supplémentaire de la construction de souches pour intégrer un locus génique exogène dans le génome de la levure. Nous croyons également que le système peut être élargi pour purifier les complexes multimériques, y compris les protéines de fret. Ainsi, nous croyons que notre système d'expression peut s'étendre au-delà de la compréhension des spécifies lipidiques de SNX-BARs. Les applications futures permettront aux chercheurs de reconstituer des complexes entiers de capture de cargaison sur des liposomes afin de comprendre comment les assemblages complets peuvent influencer le remodelage des membranes.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les recherches rapportées dans cette publication ont été soutenues par l'Institut national des sciences médicales générales des National Institutes of Health sous le numéro de prix GM060221 et en partie par l'Institut national des sciences médicales générales des Instituts nationaux de la santé sous le numéro de récompense T32GM007223. R.C. a reçu l'appui en partie du Programme de subventions de recherche de la Faculté de l'UNC-Charlotte.
matériels
| Name | Company | Catalog Number | Comments |
| 0.2 μm PC Membranes | Avanti | 610006 | |
| 10 mL Poly-Prep Chromatography column (Bio-Rad) | Bio-Rad | 731-1550 | |
| 27 G needle | BD Biosciences | 301629 | |
| Amicon Ultra Centrifugal Filter with 10K cutoff | Amicon | UFC501024 | |
| Avestin EmulsiFlex-C3 Homogenizer | Avestin | EF-C3 | |
| BCA assay | Pierce | 23225 | |
| Beckman Optima MAX-XP Ultracentrifuge | Beckman Coulter | 393315 | |
| Complete Protease Inhibitor Cocktail | Roche | 4693116001 | |
| DOPC | Avanti | 850375 | |
| DOPS | Avanti | 840035 | |
| Ergosterol (Sigma) | Sigma | 47130-U | |
| Extruder Set with Block 0.2 μL/1 mL | Avanti | 610000 | |
| FEI Tecnai F20 transmission electron microscope (200 kV) | |||
| Glass culture tubes | VWR | 47729-570 | |
| IgG sepharose beads (GE Healthcare) | GE Healthcare | 17-0969-01 | |
| Microlter glass syringes | Hamilton | 7637-01 | |
| New Brunswick Excella E25 | Eppendorf | M1353-0000 | or equivalent shaking 30 °C |
| Ni-NTA Magnetic Agarose Beads | Pierce | 78605 | |
| Optima XE-90 Ultracentrifuge | Beckman Coulter | A94516 | |
| Parafilm M | VWR | 52858-076 | |
| PI3P | Echelon | P-3016 | or Echelon equivalent |
| Polycarbonate bottle assembly | Beckman Coulter | 355622 | |
| TLA-100 Fixed-Angle Rotor | Beckman Coulter | 343840 | |
| Type 45 Ti Rotor | Beckman Coulter | ||
| Vacuum Desiccator, Bottom and Lid with Socket Valve | VWR | 75871-436 | |
| Vacuum Pump Alcatel (Pascal 2005 C1) | A&J Vacuum | PN07050 | |
| Vortex with foam holder | VWR | 10153-838 | |
| VWR KIT MICROTUBE | VWR | 12620-880 |
Références
- Teasdale, R. D., Collins, B. M. Insights into the PX (phox-homology) domain and SNX (sorting nexin) protein families: structures, functions and roles in disease. The Biochemical Journal. 441 (1), 39-59 (2012).
- Zhang, H., et al. The Retromer Complex and Sorting Nexins in Neurodegenerative Diseases. Frontiers in Aging Neuroscience. 10, 79(2018).
- Burd, C., Cullen, P. J. Retromer: a master conductor of endosome sorting. Cold Spring Harbor perspectives in Biology. 6 (2), (2014).
- Chi, R. J., Harrison, M. S., Burd, C. G. Biogenesis of endosome-derived transport carriers. Cellular and Molecular Life Sciences. 72 (18), 3441-3455 (2015).
- Wang, J., et al. Endosomal receptor trafficking: Retromer and beyond. Traffic (Copenhagen, Denmark). 19 (8), 578-590 (2018).
- Ma, M., et al. Lipid trafficking by yeast Snx4 family SNX-BAR proteins promotes autophagy and vacuole membrane fusion. Molecular Biology of the Cell. , (2018).
- van Weering, J. R., et al. Molecular basis for SNX-BAR-mediated assembly of distinct endosomal sorting tubules. The EMBO Journal. 31 (23), 4466-4480 (2012).
- Chi, R. J., et al. Fission of SNX-BAR-coated endosomal retrograde transport carriers is promoted by the dynamin-related protein Vps1. The Journal of Cell Biology. 204 (5), 793-806 (2014).
- Purushothaman, L. K., Arlt, H., Kuhlee, A., Raunser, S., Ungermann, C. Retromer-driven membrane tubulation separates endosomal recycling from Rab7/Ypt7-dependent fusion. Molecular Biology of the Cell. 28 (6), 783-791 (2017).
- Purushothaman, L. K., Ungermann, C. Cargo induces retromer-mediated membrane remodeling on membranes. Molecular Biology of the Cell. 29 (22), 2709-2719 (2018).
- Wurmser, A. E., Emr, S. D. Phosphoinositide signaling and turnover: PtdIns(3)P, a regulator of membrane traffic, is transported to the vacuole and degraded by a process that requires lumenal vacuolar hydrolase activities. The EMBO journal. 17 (17), 4930-4942 (1998).
- Puig, O., et al. The tandem affinity purification (TAP) method: a general procedure of protein complex purification. Methods. 24 (3), 218-229 (2001).
- Kushnirov, V. V. Rapid and reliable protein extraction from yeast. Yeast. 16 (9), 857-860 (2000).
- Longtine, M. S., et al. Additional modules for versatile and economical PCR-based gene deletion and modification in Saccharomyces cerevisiae. Yeast. 14 (10), 953-961 (1998).
- Tropea, J. E., Cherry, S., Waugh, D. S. Expression and purification of soluble His(6)-tagged TEV protease. Methods in Molecular Biology. 498, 297-307 (2009).
- Zhang, L., et al. Morphology and structure of lipoproteins revealed by an optimized negative-staining protocol of electron microscopy. Journal of Lipid Research. 52 (1), 175-184 (2011).
- Yong, X., et al. Expression and purification of the SNX1/SNX6 complex. Protein Expression and Purification. 151, 93-98 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon