Method Article
Reação aperfeiçoada de Griess para a determinação UV-VIS e nu-olho do Primaquine anti-malarial
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo descreve um método colorimétrico novo para a deteção antimaláricos do primaquina (pmq) em urinas sintéticos e em serums humanos.
Resumo
A primaquina (PMQ), uma importante droga antimalarial, tem sido recomendada pela Organização Mundial de saúde (OMS) para o tratamento de infecções que ameaçam a vida causadas por P. vivax e ovale. No entanto, o PMQ tem efeitos adversos indesejados que levam à hemólise aguda em pacientes com deficiência de glicose-6-fosfato desidrogenase (G6PD). Há uma necessidade de desenvolver métodos simples e confiáveis para a determinação do PMQ com o objetivo de monitoramento de dosagem. No início de 2019, temos relatado uma abordagem baseada em UV-VIS e olho nu para quantificação colorimétrica PMQ. A detecção foi baseada em uma reação de Griess-like entre o PMQ e as anilinas, que podem gerar produtos azo coloridos. O limite de detecção para a medição direta de PMQ em urina sintética está na faixa de nanomolar. Além disso, este método mostrou o grande potencial para a quantificação de PMQ das amostras humanas do soro em concentrações clìnica relevantes. Neste protocolo, descreveremos os detalhes técnicos sobre as sínteses e caracterização de produtos azo coloridos, a preparação do reagente e os procedimentos para determinação do PMQ.
Introdução
O pmq é uma das mais importantes drogas antimaláricas, ele funciona não apenas como um schizontocida tecidual para prevenir a recidiva, mas também como um gametocitocide para interromper a transmissão da doença1,2,3,4. A hemólise intravascular é um dos efeitos colaterais relacionados ao PMQ, que se torna extremamente grave naqueles deficientes em G6PD. Sabe-se que a desordem genética de G6PD é distribuída no mundo inteiro com uma freqüência do gene entre 3-30% em áreas endêmicas da malária. A gravidade da fraqueza do pmq depende do grau de deficiência de G6PD, bem como da dose e da duração da exposição ao pmq5,6. Para reduzir o risco, a OMS recomendou uma dose única baixa (0,25 mg base/kg) de PMQ para o tratamento da malária. No entanto, isso ainda é desafiado pelas variações na sensibilidade do fármaco do paciente5,7. A monitorização da dose é necessária para avaliar a farmacocinética após a administração de PMQ, que pode efetuar o ajuste posológico para um tratamento bem-sucedido com toxicidade limitada.
A cromatografia líquida de alta eficiência (HPLC) é a técnica mais utilizada para a determinação clínica do PMQ. Endoh et al. relataram um sistema de HPLC com detector de UV para quantificação sérica de PMQ usando uma coluna de gel de polímero C-188. Em seu sistema, as proteínas do soro foram precipitadas primeiramente com acetonitrile, e então o PMQ no sobrenadante foi separado para a HPLC. A curva de calibração foi linear sobre a faixa de concentração de 0,01-1,0 μg/mL8. Outro método baseado em uma HPLC de fase reversa com detecção de UV a 254 nm foi relatado para a quantificação de PMQ e seus principais metabólitos9. A curva de calibração para PMQ foi linear na faixa entre 0,025-100 μg/mL. Uma extração líquida-líquida adicional com hexano misto e acetato de etila como fase orgânica foi utilizada para a separação do PMQ com recuperação percentual alcançada para 89%9. Mais recentemente, Miranda et al. desenvolveram um método UPLC com detecção de UV a 260 nm para análise de PMQ em formulações de comprimidos com limite de detecção a 3 μg/mL10.
Embora os métodos da HPLC apresentem a sensibilidade prometedora na determinação da droga e a sensibilidade pode mais ser melhorada se o HPLC é equipado com um espectrómetro maciço, há ainda algumas desvantagens. As medidas diretas da droga em líquidos biológicos são geralmente inacessíveis pela HPLC, desde que muitas biomoléculas podem extremamente influenciar a análise. Extrações adicionais são necessárias para remover moléculas endógenas antes daanálise de HPLC11,12. Além disso, a deteção de PMQ por um detector HPLC-UV é executada tipicamente em seu comprimento de onda máximo da absorção (260 nanômetro).; no entanto, existem muitas moléculas endógenas em fluidos biológicos com uma forte absorvência a 260 nm (por exemplo, aminoácidos, vitaminas, ácidos nucleicos e pigmentos urocromo), interferindo assim com a detecção de UV do PMQ. Há a necessidade de desenvolver métodos simples e rentáveis para a determinação do PMQ com sensibilidade e seletividade razoáveis.
A reação de Griess foi apresentada pela primeira vez em 1879 como um teste colorimétrico para a detecção de nitrito13,14,15,16. Recentemente, esta reação tem sido extensivamente explorada para detectar não só nitrito, mas também outras moléculas biologicamente relevantes17,18,19,20. Nós temos relatado previamente o primeiro estudo sistemático de uma reação inesperada de Griess com PMQ (Figura 1). Neste sistema, o pmq é capaz de formar e coloridos quando acoplado com anilinas substituídas na presença de íons nitrito condições ácidas. Descobrimos ainda que a cor dos e variou de amarelo a azul ao aumentar o efeito de doação de elétrons do substituente nas anilinas21. Um método colorimétrico baseado na absorção UV-VIS para a quantificação de PMQ foi desenvolvido com a reação aperfeiçoada entre o 4-methoxyaniline e o PMQ. Este método demonstrou grande potencial para detecção sensível e seletiva de PMQ em fluidos biorelevantes. Aqui, pretendemos descrever os procedimentos detalhados para a determinação do PMQ com base nessa estratégia colorimétrica.
Protocolo
1. síntese de AZOs coloridos
- Em um balão de fundo redondo de 25 mL (RBF), dissolva anilina (0,1 mmol) e bisfosfato de primaquina (45,5 mg, 0,1 mmol) em 10 mL de solução de H3po4 (5% v/v). Põr o RBF sobre um banho de gelo, adicione uma barra do stir com o tamanho apropriado na solução, e põr o RBF sobre uma placa do stir.
Nota: Para a síntese de azo 3G (Figura 2), utilizar 0,2 mmol de primaquina bisfosfato. - Dissolver NaNO2 (6,9 mg, 0,1 mmol) em 1 ml de água arrefecida e, em seguida, adicionar à mistura de reacção Dropwise. Retire o banho de gelo e mantenha a mistura de reacção agitada à temperatura ambiente.
- Monitore a reação com uma placa de cromatografia em camada fina (TLC) revestida com gel de sílica. Use uma mistura de diclorometano (DCM)/metanol (MeOH) (Vol/Vol = 5:1) como o eluente para TLC. O produto azo exibe manchas coloridas na placa TLC, que é fácil de distinguir por olhos nus. Pare a reação quando os pontos de PMQ desaparecem no TLC.
- Ajuste a mistura de reacção ao pH > 10 por NaOH (2 M) num banho de gelo. Use um funil de separação de 50 mL para extrair a mistura 3 vezes com 20 mL de acetato de etilo para cada um, combine e concentre a fase orgânica vácuo usando um evaporador rotativo.
Nota: Antes da extração, ajuste o valor de pH das soluções de reação acima de 10. Isso pode manter a amina primária como sua forma não-ionizada, facilitando assim a extração. - Purificar os resíduos por cromatografia flash com gel de sílica de fase reversa pressão normal, usando MeOH/H2o como o eluente. Seque a solução do produto através da liofilização para dar produtos azo desejados.
Nota: A mesma reação também pode ser realizada em soluções de HCl diluídas (0,2 M).
2. medições de UV-VIS e cálculo teórico
- Dissolver azo puro (50 μM) em água destilada ou em 5% H3po4 solução (pH 1,1), respectivamente. Grave os espectros de absorção UV-VIS (250-700 nm) num espectrofotômetro à temperatura ambiente (25 ° c). Exporte os dados como arquivos. xls/. xlsx para análise posterior.
-
Realize todos os cálculos teóricos para o próprio PMQ e produtos azo usando o programa Gaussian 16. Use a teoria funcional da densidade dependente do tempo (TD-DFT) com um jogo da base 6-31G. Inclua efeitos do solvente pelo formalismo polarizadas do modelo do continuum (PCM) usando a água.
- Use software (por exemplo, ChemDraw Office) para desenhar as estruturas e, em seguida, salvar a estrutura como um arquivo de entrada Gaussian (. gif).
- Abra o arquivo GIF com Gauss View e clique no botão calcular. Selecione configuração de cálculo Gaussian, opt + freqe Ground State-DFT-B3LYP-6-31G; em seguida, clique em Submit. A otimização de geometria gerará um arquivo. log.
- Seguindo o procedimento acima, use Gauss View para abrir este arquivo de log. Clique em calcular-configuração de cálculo Gaussian e selecione energia e td-SCF-DFT-B3LYP-6-31G-singlet somente. Em seguida, submeter. O cálculo de energia gerará outro arquivo de log e um arquivo de cubo.
- Use Gauss View para abrir o arquivo de log a partir do cálculo de energia. Clique em Results-UV/VIS para ver a absorção prevista.
- Use Gauss View para abrir o arquivo de cubo. Clique em resultados e selecione superfície e contornos-ações de superfície e nova superfície para ver as órbitas.
-
Compare os resultados da medida experimental e do cálculo Gaussian. Calcule o erro percentual entre os valores calculados e medidos, de acordo com a equação a seguir.
Erro = | (WMax Cal.-wMaxexper.) /WMaxexper. | × 100%
onde WMax Cal. representa o comprimento de onda máximo da absorvância do cálculo teórico e do exper de WMax . representa o comprimento de onda do resultado experimental.
3. determinação do PMQ
- Medição de pmq usando uma placa 96-well (Figura 5)
- Dissolver 4-methoxyaniline em 0,2 M HCl para uma solução de anilina de 200 mM, R1. Dissolver o nitrito de sódio em água destilada para obter uma solução de 5 mM, R2. Mantenha todas as soluções na geladeira a 4 ° c antes de usar.
- Adicione 100 μL de R1 em uma placa 96-well, e adicione 50 μL do PMQ que contem a amostra na placa para misturar com o R1. Em seguida, adicione 50 μL de R2 na placa. Misture as soluções através de pipetagem repetida.
- Mantenha a placa à temperatura ambiente durante 15 minutos e, em seguida, grave a absorvância UV-Vis a 504 nm. Repita 3x para cada teste. O produto do azo é estável com exposição clara do quarto; Não é necessário manter a placa a obscuridade.
- Exporte os dados como arquivos. xls/. xlsx para análise posterior.
- Curva de calibração para medição direta de PMQ em amostra de urina
- Prepare soluções de PMQ usando urina sintética com concentrações de PMQ em 0, 1, 2, 5, 10, 20, 50, 100, 200 μM, respectivamente.
- Adicione 100 μL de R1 em uma placa 96-well, e adicione 50 μL da solução da urina de PMQ para misturar com o R1. Em seguida, adicione 50 μL de R2 à mistura acima. Misture as soluções através de pipetagem repetida. Mantenha a placa à temperatura ambiente durante 15 minutos e, em seguida, grave a absorvância UV-Vis a 504 nm.
- Gerar uma curva de calibração com base na absorvência I504 e concentrações de pmq. Use os valores dos poços sem o PMQ como um espaço em branco e subtraia os valores em branco de todos os testes antes do processamento de dados.
- Realize um ajuste linear para gerar as equações lineares como y = ax + b, onde y é a intensidade da absorvência em 504 nm, X é a concentração de pmq, a é a inclinação, e b é o intercepto y da linha linear.
- Curva da calibração para a medida direta de PMQ em uma amostra humana do soro
- Prepare soluções de PMQ usando soro humano com concentrações de PMQ em 0, 1, 2, 5, 10, 20, 50, 100, 200, μM respectivamente.
- Adicione 100 μL de R1 em uma placa 96-well e adicione 50 μL da solução do soro de PMQ para misturar com o R1. Adicione 50 μL de R2 à mistura acima e misture as soluções por pipetagem repetida. Mantenha a placa à temperatura ambiente durante 15 minutos e, em seguida, grave a absorvância UV-Vis a 504 nm. Exporte os dados como arquivo. xls/. xlsx para análise posterior.
- Gerar uma curva de calibração com base na absorvência I504 e concentrações de pmq. Use os valores dos poços sem o PMQ como um espaço em branco e subtraia os valores em branco de todos os testes antes do processamento de dados.
- Realize um ajuste linear para gerar as equações lineares como y = ax + b, onde y é a intensidade da absorvência em 504 nm, X é a concentração de pmq, a é a inclinação, e b é o intercepto y da linha linear.
- Extração de PMQ do soro
- Adicione uma certa quantidade de PMQ no soro humano para simular o soro contendo PMQ. Para a extração de PMQ, adicione 6 mL de mistura de acetato de etila/hexano (7:1 v/v) em 2 mL de soro contendo PMQ em um tubo de centrífuga de 15 mL.
- Adicionar 100 μL de solução de hidróxido de sódio (2 M) ao sistema de extracção. Agitar violentamente o tubo usando um misturador Vortex para 30 s. colete a camada orgânica e concentre-a usando um evaporador rotativo vácuo.
- Redissolva o resíduo com 200 μL de água destilada e remova os componentes lipídicos insolúveis por filtração através de uma membrana em forma de disco com tamanho de poros de 220 nm. Use a solução final para o teste.
- Determine o PMQ do soro com extração
- Siga as etapas 3,2 ou 3,3 para gerar a curva de calibração para PMQ em água destilada. Extraia o pmq de soros contendo pmq de acordo com a etapa 3,4.
- Adicionar 100 μL de R1 e 50 μL de solução de PMQ em uma placa de 96 poços. Adicione 50 μL de R2 à mistura acima, e misture as soluções por pipetagem repetida.
- Mantenha a placa à temperatura ambiente durante 15 min e grave a absorvância UV-Vis a 504 nm. Use os poços com R1 e R2 mas sem PMQ como controles. Exporte os dados como arquivos. xls/. xlsx para análise posterior.
- Subtrair os valores de controle dos valores de absorbância I504 para cada teste e, em seguida, use o resultado para cálculos de concentração de acordo com a equação do forro da curva de calibração.
Nota: O limite de detecção (LOD) para PMQ em todos os casos pode ser calculado de acordo com um método padrão22. O cálculo baseou-se na função de calibração: LOD = 3,3 × SD/b, onde SD é o desvio padrão do espaço em branco e b é a inclinação da linha de regressão
Resultados
Para otimizar as condições de reação (Figura 2), várias anilinas foram usadas para o casal com pmq através da reação de Griess. Nós alcançamos uma série de e com cores diferentes. Verificou-se que anilinas com um elétron doar substituente pode causar uma mudança de vermelho no espectro de absorção UV-VIS. Os cálculos teóricos foram realizados por meio da teoria funcional da densidade dependente do tempo (TD-DFT). Conforme apresentado na Figura 2a, o resultado do cálculo foi em boa concordância com as medidas ópticas com erro médio de 3,1%. 4-methoxyaniline foi usado então para conduzir a reação da deteção de PMQ devido a seu bom desempenho na taxa de reação, na solubilidade do produto, e na estabilidade21. Além disso, o produto azo de 4-methoxyaniline é de cor vermelha, o que é fácil de distinguir com os olhos nus. Portanto, essa reação oferece potencial para detecção de PMQ de olho nu (Figura 3).
A figura 4a mostra o efeito do pH no espectro de absorção UV-Vis do produto azo 3D. I504 não muda ao aumentar o pH de 1,0 para 6,0. I504 pH 7,0 apresenta uma ligeira diminuição, enquanto um pH básico (8,0 e 9,0) afeta muito a absorção. A Figura 4B mostra os efeitos de pH das soluções de pmq na reação de Griess. PMQ (50 μM) em tampão PBS com vários pHs (4,0, 5,0, 6,0, 7,0, 8,0, 9,0) foram misturados individualmente com o reagente de teste, conforme descrito na seção 3,1. I504 foi então medido após 15 min à temperatura ambiente. Como indicado, os pHs básicos (8,0, 9,0) das soluções de PMQ influenciam potencialmente a reação. A Figura 5 mostra o procedimento geral para realizar a reação de Griess para a detecção de pmq. Conforme descrito na seção de protocolo, quatro etapas são necessárias para obter os dados de absorção I504 para análise. Figura 6a e 6B mostram as curvas de calibração para detecção direta de pmq a partir de amostras de urina e soro, respectivamente, sem pré-tratamentos de amostra. Uma excelente relação linear (R2 = 0,998) foi encontrada quando o pmq em urina sintética varia de 0 a 200 μm. No termo da amostra do soro, uma relação linear foi encontrada na concentração que varia de 10 a 200 μM.
A Figura 7a mostra o procedimento para extrair o pmq do soro. Os resíduos foram redissolvidos em água destilada após extração e concentração e, em seguida, filtrados. Para simular um soro real contendo PMQ, o PMQ foi adicionado ao soro humano com concentrações finais em 0, 0,2, 0,5, 1,0, 2,0 μM. Utilizando as etapas 3,4 e 3,5, verificou-se que as concentrações de PMQ em soros foram de 0, 2, 0,14, 0,44, 0,90 e 1,78 μM, respectivamente (Figura 7C). Com base no resultado, verificou-se que a porcentagem de recuperação do PMQ era de cerca de 90% quando o PMQ tinha mais de 0,5 μM no soro, o que foi comparável aos relatos anteriores9.

Figura 1: esquema da reação de GRIESS no pmq. (a) uma reação clássica de Griess para a análise do nitrito. (B) a reação de Griess no método proposto de detecção de pmq. Este valor foi modificado com permissão do trabalho anterior21. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2: Propriedades fotofísicas de AZOs sintéticos. (A) medida UV-VIS e cálculo teórico da absorção máxima de e gerados a partir de diferentes anilinas. Os números fora dos suportes representam para a medida máxima da absorvência em H2o destilada perto das condições do pH neutro; os números nos suportes referem-se à medição em 5% H3po4 solution (pH ≈ 1,1). exper doABS/nm do λ. representa os dados do experimento e λABS/Calc. representa os dados teóricos do cálculo. Eexc é a energia de excitação (EV), e f é a força do oscilador. (B) imagens fotográficas de pmq e os produtos azo com diferentes substituintes, 50 μm em solução de ácido fosfórico a 5%. (C) espectros UV-VIS dos produtos sintéticos. Os valores foram normalizados para um intervalo entre 0 e 1. Este valor foi modificado com permissão do trabalho anterior21. Por favor clique aqui para ver uma versão maior desta figura.
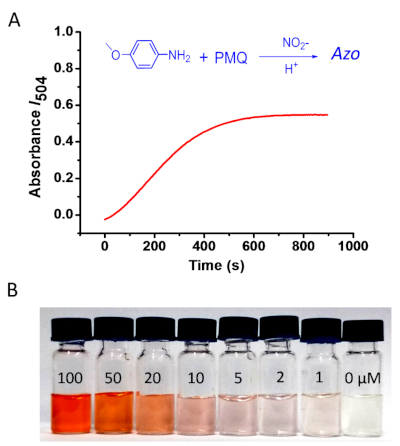
Figura 3: determinação colorimétrica do pmq. (A) monitorização das alterações de absorvência no máximo I504 de uma forma dependente do tempo. A reação foi realizada utilizando-se 4-metoxyanilina, e o PMQ foi utilizado em 100 μM; (B) alterações de cor da reação com diferentes concentrações de pmq: 400 μL de solução de 4-metoxyanilina (200 mM em 0,2 M HCL) e 200 μL de nitrito de sódio em água (5 mm), com 200 μL de solução de pmq de diferentes concentrações (0, 1, 2, 5 , 10, 20, 50, 100 μM). Por favor clique aqui para ver uma versão maior desta figura.
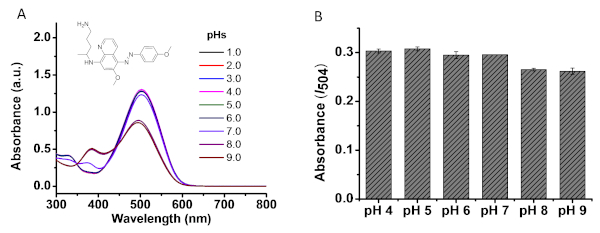
Figura 4: efeito de pH na detecção de pmq. (A) efeitos de pH na ABSORVÂNCIA UV-Vis do produto azo 3D (50 μm); (B) pmq (50 μm) em tampão PBS com diferentes pHs (4,0, 5,0, 6,0, 7,0, 8,0, 9,0) foram utilizados para realizar a reação descrita na etapa 3,1. Quinze minutos mais tarde, a absorbância em 504 nanômetro foi medida. Por favor clique aqui para ver uma versão maior desta figura.
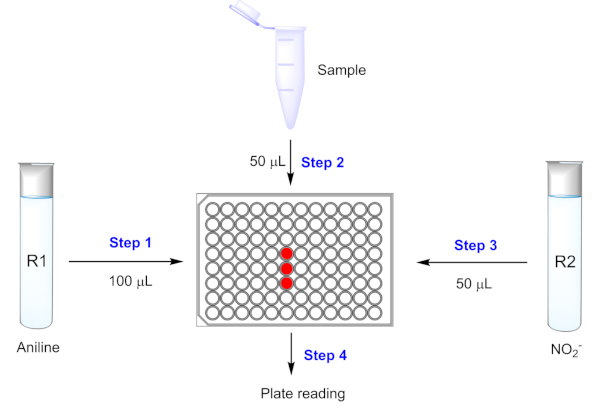
Figura 5: determinação de pmq através de uma reação de Griess em um sistema 96-well baseado placa. R1 refere-se a 200 mM 4-methoxyaniline solução em 0,2 M HCl; R2 refere-se a 5 mM de nitrito de sódio em água destilada. Por favor clique aqui para ver uma versão maior desta figura.

Figura 6: curvas de calibração para determinação de pmq a partir de (a) urina sintética e (B) amostras de soro humano. A concentração de PMQ varia de 0-200 μM. Por favor clique aqui para ver uma versão maior desta figura.
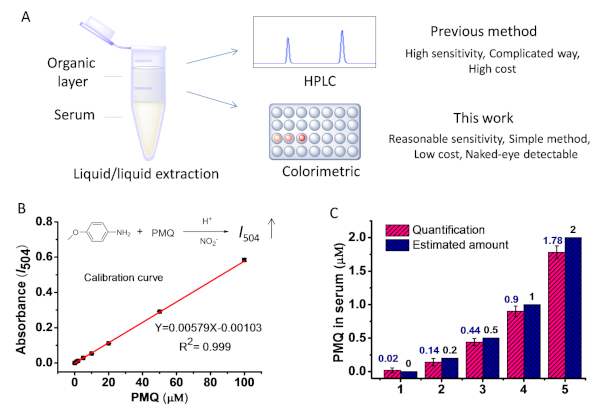
Figura 7: determinação do pmq a partir de amostras de soro. (a) ilustração esquemática da extração de pmq de amostras de soro para a análise quantitativa. (B) a relação linear encontrada entre a concentração de I504 e de pmq dentro da escala de 0 a 100 μm. (C) o pmq no soro foi quantificável pelo método baseado na reação de Griess em comparação com a quantidade exata adicionada no soro. Este valor foi modificado com permissão do trabalho anterior21. Por favor clique aqui para ver uma versão maior desta figura.
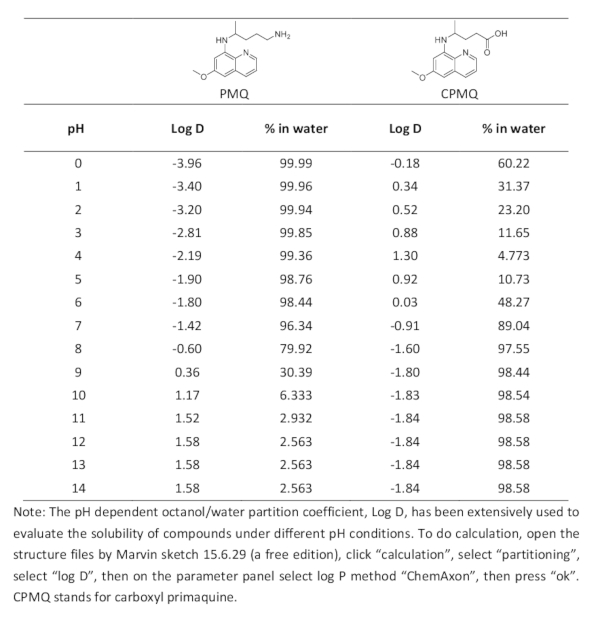
Tabela 1. Cálculo teórico do log D e o percentual de distribuição de água de PMQ e CPMQ.
Discussão
Nós descrevemos um método colorimétrico para a quantificação conveniente de PMQ. É potencialmente o método de corrente mais simples e rentável. Mais importante, este método oferece permite a medição de PMQ com base no olho nu sem usar nenhum equipamento.
A reação aperfeiçoada de Griess para a deteção de PMQ pode gerar um azo da cor vermelha com uma absorção máxima em 504 nanômetro. A influência potencial da absorção UV-VIS de biomoléculas endógenas é limitada, fazendo assim o método prometedor para a medida direta de PMQ em líquidos biológicos. Como indicado pelo resultado, foi encontrada uma excelente relação linear (R2 = 0,998) para detecção de pmq de urina sobre a faixa de concentração de 0-200 ΜM (Figura 6a). O limite de detecção (LOD) para PMQ foi encontrado para ser 0,63 μM. Este método também demonstrou grandes potencialidades para a medição direta do PMQ no soro humano. Uma excelente relação linear foi encontrada na concentração variando de 10 a 200 μM para detecção sérica de PMQ (Figura 6B). Podemos melhorar ainda mais a sensibilidade por pré-tratamento da amostra de soro através da extração e concentração. Como a Figura 7 mostra com um processo de extração simples, este método pode quantificar o soro pmq em intervalos clinicamente relevantes. Com base no mecanismo de reação, o principal metabolito carboxilo do PMQ (CPMQ) pode potencialmente formar um produto azo com propriedades semelhantes de UV-VIS. No entanto, a extração líquido-líquido condições básicas de pH pode potencialmente minimizar a interferência do CPMQ. A tabela 1 mostra o log calculado D e a distribuição de água do pmq e do cpmq. Conforme demonstrado, no pH > 10, menos de 6,33% do PMQ será encontrado na fase hídrica, enquanto que mais de 98,54% do CPMQ estará na fase hídrica. Portanto, teoricamente, mais de 93,7% do PMQ e menos de 1,56% do CPMQ poderiam ser extraídos para teste. Pode-se concluir que a interferência do metabolito principal CPMQ é limitada.
O procedimento para a detecção de PMQ é muito fácil de manusear. Tomando o sistema placa-baseado 96-well como um exemplo, o procedimento inteiro consiste em quatro etapas: 1) adicionando 100 μL da solução 4-methoxyaniline (200 milímetros no HCl de 0,2 M) R1 em uma placa de 96 poços; 2) adicionando 50 μL de concentração de PMQ-amostra desconhecida para misturar com R1; 3) adicionando 50 μL de R2 (solução de nitrito de sódio a 5 mM) para realizar a reação à temperatura ambiente; e 4) gravando a absorção UV-Vis em 504 nanômetro usando um espectrómetro. A concentração de PMQ de uma amostra desconhecida pode ser calculada com base na intensidade de absorção I504 e na equação linear da curva de calibração. Todo o procedimento é realizado à temperatura ambiente sem a necessidade de incubação. Um ambiente escuro não é necessário para todo o procedimento, pois o produto colorido não é sensível à luz do quarto.
Deve notar-se que o tempo para a solução de reacção para atingir o seu saturado I504 é dependente da temperatura. Como mostrado na Figura 3, pelo menos 12 min foi exigido à temperatura ambiente (25 ° c). O tempo de reação seria mais longo se realizando a reação em temperaturas abaixo de 25 ° c. A condição de pH básico das soluções de PMQ pode potencialmente afetar a absorvência I504. Para resolver este problema, ajuste o pH da solução de PMQ para ser inferior a 7,0. Caso contrário, uma nova curva de calibração é necessária para a solução com pH acima de 7,0. Além disso, os nitritos intrínsecos nas amostras testadas podem influenciar a detecção. No entanto, isso só pode ocorrer quando a concentração de nitritos intrínsecos é extremamente alta, uma vez que uma alta concentração de nitrito (5 mM) foi usada em um teste padrão.
Divulgações
Os autores não têm nada a declarar.
Agradecimentos
Os autores reconhecem a concessão do start-up da Universidade de Guangzhou da medicina chinesa e do projeto de treinamento da pesquisa científica da juventude de GZUCM (2019QNPY06). Nós igualmente reconhecemos o centro médico da pesquisa de Lingnan da Universidade de Guangzhou da medicina chinesa para o apoio em facilidades.
Materiais
| Name | Company | Catalog Number | Comments |
| 4-Methoxyaniline | Aladdin | K1709027 | |
| 2,4-Dimethoxyaniline | Heowns | 10154207 | |
| 3,4-Dimethoxyaniline | Bidepharm | BD21914 | |
| 4-Methylaniline | Adamas-beta | P1414526 | |
| 4-Nitroaniline | Macklin | C10191447 | |
| 96-wells,Flat Botton | Labserv | 310109008 | |
| Gaussian@16 software | Gaussian, Inc | Version:x86-64 SSE4_2-enabled/Linux | |
| Hydrochloric acid | GCRF | 20180902 | |
| Marvin sketch (software) | CHEMAXON | free edition: 15.6.29 | |
| Phosphoric acid | Macklin | C10112815 | |
| Primaquine bisiphosphate | 3A Chemicals | CEBK200054 | |
| Sodium nitrite | Alfa Aesar | 5006K18R | |
| Sulfonamides | TCI(shanghai) | GCPLO-BP | |
| Varioskan LUX Plate reader | Thermo Fisher | Supplied with SkanIt Software 4.1 |
Referências
- Fernando, D., Rodrigo, C., Rajapakse, S. Primaquine in vivax malaria: an update and review on management issues. Malar Journal. 10, 351 (2011).
- Deng, C., et al. Large-scale Artemisinin-Piperaquine Mass Drug Administration With or Without Primaquine Dramatically Reduces Malaria in a Highly Endemic Region of Africa. Clinical Infectious Diseases. 67 (11), 1670-1676 (2018).
- Pavic, K., et al. Primaquine hybrids as promising antimycobacterial and antimalarial agents. European Journal of Medical Chemistry. 143, 769-779 (2018).
- McQueen, A., et al. Synthesis, characterization, and cellular localization of a fluorescent probe of the antimalarial 8-aminoquinoline primaquine. Bioorganic & Medicinal Chemistry Letters. 27 (20), 4597-4600 (2017).
- Ashley, E. A., Recht, J., White, N. J. Primaquine: the risks and the benefits. Malaria Journal. 13 (1), 418 (2014).
- Watson, J., Taylor, W. R., Menard, D., Kheng, S., White, N. J. Modelling primaquine-induced haemolysis in G6PD deficiency. Elife. 6, (2017).
- Beutler, E. Glucose-6-phosphate dehydrogenase deficiency: a historical perspective. Blood. 111 (1), 16-24 (2008).
- Endoh, Y. S., et al. High-performance liquid chromatographic determination of pamaquine, primaquine and carboxy primaquine in calf plasma using electrochemical detection. Journal of Chromatography B: Biomedical Sciences and Applications. 579 (1), 123-129 (1992).
- Dua, V. K., Kar, P. K., Sarin, R., Sharma, V. P. High-performance liquid chromatographic determination of primaquine and carboxyprimaquine concentrations in plasma and blood cells in Plasmodium vivax malaria cases following chronic dosage with primaquine. Journal of Chromatography B: Biomedical Applications. 675 (1), 93-98 (1996).
- Miranda, T. A., Silva, P. H. R., Pianetti, G. A., César, I. C. Simultaneous quantitation of chloroquine and primaquine by UPLC-DAD and comparison with a HPLC-DAD method. Malaria Journal. 14, 29 (2015).
- Tatsuno, M., Nishikawa, M., Katagi, M., Tsuchihashi, H. Simultaneous determination of illicit drugs in human urine by liquid chromatography-mass spectrometry. Journal of Analytical Toxicology. 20 (5), 281-286 (1996).
- Erni, F. Use of high-performance liquid chromatography in the pharmaceutical industry. Journal of Chromatography A. 507, 141-149 (1990).
- Tsikas, D. Analysis of nitrite and nitrate in biological fluids by assays based on the Griess reaction: Appraisal of the Griess reaction in the l-arginine/nitric oxide area of research. Journal of Chromatography B. 851 (1), 51-70 (2007).
- Zurcher, D. M., Adhia, Y. J., Romero, J. D., McNeil, A. J. Modifying a known gelator scaffold for nitrite detection. Chemical Communications. 50 (58), 7813-7816 (2014).
- Kunduru, K. R., Basu, A., Tsah, T., Domb, A. J. Polymer with pendant diazo-coupling functionality for colorimetric detection of nitrates. Sensors and Actuators B: Chemical. 251, 21-26 (2017).
- Li, D., Ma, Y., Duan, H., Deng, W., Li, D. Griess reaction-based paper strip for colorimetric/fluorescent/SERS triple sensing of nitrite. Biosensors and Bioelectronics. 99, 389-398 (2018).
- Deng, T., et al. A novel strategy for colorimetric detection of hydroxyl radicals based on a modified Griess test. Talanta. 195, 152-157 (2019).
- Pang, H., et al. A photo-responsive macroscopic switch constructed using a chiral azo-calix[4]arene functionalized silicon surface. Chemical Communications (Camb). 54 (24), 2978-2981 (2018).
- Kaur, N., Dhaka, G., Singh, J. Simple naked-eye ratiometric and colorimetric receptor for anions based on azo dye featuring with benzimidazole unit. Tetrahedron Letters. 56 (9), 1162-1165 (2015).
- Liu, F., Lou, J., Hristov, D. X-Ray responsive nanoparticles with triggered release of nitrite, a precursor of reactive nitrogen species, for enhanced cancer radiosensitization. Nanoscale. 9 (38), 14627-14634 (2017).
- Deng, T., et al. An unexpected Griess reaction on the important anti-malarial drug primaquine and its application for drug determination. Journal of Pharmaceutical and Biomedical Analysis. 171, 8-14 (2019).
- Shrivastava, A., Gupta, V. Methods for the determination of limit of detection and limit of quantitation of the analytical methods. Chronicles of Young Scientists. 2 (1), 21-25 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados