Method Article
Reazione Griess ottimizzata per UV-Vis e determinazione a occhio nudo di Primaquine antimalarico
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive un nuovo metodo colorimetrico per il rilevamento dei primachi antimalarici (PMQ) nelle urine sintetiche e nei sieri umani.
Abstract
Primachina (PMQ), un importante farmaco antimalarico, è stato raccomandato dall'Organizzazione Mondiale della Sanità (OMS) per il trattamento delle infezioni potenzialmente letali causate da P. vivax e ovale. Tuttavia, PMQ ha effetti avversi indesiderati che portano a emolisi acuta in pazienti con carenza di dehydrogenasi glucosio-6 fosfato (G6PD). C'è la necessità di sviluppare metodi semplici e affidabili per la determinazione PMQ con lo scopo di monitoraggio del dosaggio. All'inizio del 2019, abbiamo segnalato un approccio UV-Vis e basato ad occhio nudo per la quantificazione colorimetrica PMQ. Il rilevamento si è basato su una reazione simile a Griess tra PMQ e aniline, che può generare prodotti azo colorati. Il limite di rilevazione per la misurazione diretta del PMQ nelle urine sintetiche è nella gamma nanomolare. Inoltre, questo metodo ha mostrato un grande potenziale per la quantificazione di PMQ da campioni di siero umano a concentrazioni clinicamente rilevanti. In questo protocollo, descriveremo i dettagli tecnici riguardanti le sintesi e la caratterizzazione dei prodotti azo colorati, la preparazione del reagente e le procedure per la determinazione del PMQ.
Introduzione
PMQ è uno dei più importanti farmaci antimalarici, funziona non solo come uno schizontocidio tissutale per prevenire le ricadute, ma anche come un gametocitocide per interrompere la trasmissione della malattia1,2,3,4. L'emolisi intravascolare è uno degli effetti collaterali relativi al PMQ, che diventa estremamente grave in quelli carenti in G6PD. È noto che la malattia genetica del G6PD è distribuita in tutto il mondo con una frequenza genica tra il 3-30% nelle aree endemiche della malaria. La gravità della debolezza della PMQ dipende dal grado di carenza di G6PD, nonché dalla dose e dalla durata dell'esposizione al PMQ5,6. Per ridurre il rischio, l'OMS ha raccomandato una singola dose bassa (0,25 mg di base/kg) di PMQ per il trattamento della malaria. Tuttavia, questo è ancora messo in discussione dalle variazioni nella sensibilità del farmaco paziente5,7. Il monitoraggio della dose è necessario per valutare la farmacocinetica dopo la somministrazione di PMQ, che può effettuare la regolazione del dosaggio per un trattamento di successo con tossicità limitata.
La cromatografia liquida ad alte prestazioni (HPLC) è la tecnica più utilizzata per la determinazione clinica del PMQ. Endoh et al. ha segnalato un sistema HPLC con un rilevatore UV per la quantificazione del siero PMQ utilizzando una colonna8 . Nel loro sistema, le proteine del siero sono state prima precipitate con acetonitrile, e poi il PMQ nel supernatanto è stato separato per HPLC. La curva di calibrazione era lineare sull'intervallo di concentrazione da 0,01-1,0 g/mL8. Un altro metodo basato su un HPLC in fase inversa con rilevamento UV a 254 nm è stato segnalato per la quantificazione del PMQ e dei suoi principali metaboliti9. La curva di calibrazione per PMQ era lineare nell'intervallo compreso tra 0,025 e 100 g/mL. Un'ulteriore estrazione liquida-liquido con eano e acetato etilico misto come fase organica è stata utilizzata per la separazione PMQ con recupero percentuale raggiunto all'89%9. Più di recente, Miranda e altri hanno sviluppato un metodo UPLC con rilevamento UV a 260 nm per l'analisi PMQ nelle formulazioni delle compresse con un limite di rilevamento a 3 g/mL10.
Anche se i metodi HPLC mostrano una sensibilità promettente nella determinazione della droga e la sensibilità può essere ulteriormente migliorata se l'HPLC è dotato di uno spettrometro di massa, ci sono ancora alcuni svantaggi. Le misurazioni dirette dei farmaci nei fluidi biologici sono solitamente inaccessibili dall'HPLC, poiché molte biomolecole possono influenzare notevolmente l'analisi. Ulteriori estrazioni sono necessarie per rimuovere le molecole endogene prima dell'analisi HPLC11,12. Inoltre, il rilevamento PMQ da parte di un rilevatore HPLC-UV viene in genere eseguito alla sua lunghezza d'onda massima di assorbimento (260 nm).; tuttavia, ci sono molte molecole endogene nei fluidi biologici con una forte assorbimento a 260 nm (ad esempio, aminoacidi, vitamine, acidi nucleici e pigmenti uromedi), interferendo così con il rilevamento UV PMQ. È necessario sviluppare metodi semplici ed economici per la determinazione del PMQ con ragionevole sensibilità e selettività.
La reazione di Griess è stata presentata per la prima volta nel 1879 come test colorimetrico per il rilevamento dei nitriti13,14,15,16. Recentemente, questa reazione è stata ampiamente esplorata per rilevare non solo il nitrito, ma anche altre molecole biologicamente rilevanti17,18,19,20. In precedenza abbiamo riportato il primo studio sistematico di una reazione inaspettata di Griess con PMQ(Figura 1). In questo sistema, PMQ è in grado di formare azoi colorati quando accoppiato con aniline sostituite in presenza di ioni nitriti in condizioni acide. Abbiamo inoltre scoperto che il colore degli azoi variava dal giallo al blu quando aumentava l'effetto di donazione di elettroni del sostituendore su aniline21. Un metodo colorimetrico basato sull'assorbimento UV-vis per la quantificazione del PMQ è stato sviluppato attraverso la reazione ottimizzata tra 4-methoxyaniline e PMQ. Questo metodo ha mostrato un grande potenziale per il rilevamento sensibile e selettivo del PMQ nei fluidi bio-rilevanti. In questo caso, il nostro obiettivo è descrivere le procedure dettagliate per la determinazione del PMQ sulla base di questa strategia colorimetrica.
Protocollo
1. Sintesi di Azos colorati
- In un flacone rotondo da 25 mL (RBF), sciogliere l'anilina (0,1 mmol) e il bisphosphate primachina (45,5 mg, 0,1 mmol) in 10 mL di H3PO4 soluzione (5% v/v). Mettere l'RBF su un bagno di ghiaccio, aggiungere una barra di mescolare con le dimensioni corrette nella soluzione, e mettere l'RBF su un piatto di mescolare.
NOT: Per la sintesi di azo 3g (Figura 2), utilizzare 0.2 mmol di bisfosfato primadotra. - Sciogliere NaNO2 (6,9 mg, 0,1 mmol) in 1 mL di acqua raffreddata e quindi aggiungere nella miscela di reazione dropwise. Rimuovere il bagno di ghiaccio e mantenere la miscela di reazione mescolata a temperatura ambiente.
- Monitorare la reazione con una piastra cromatica a strato sottile rivestita di gel di silice (TLC). Utilizzare come eluente per tLC una miscela di clorometano (DCM)/metanolo (MeOH). Il prodotto azo presenta macchie colorate sulla piastra TLC, che è facile da distinguere a occhio nudo. Interrompere la reazione quando le macchie PMQ scompaiono sul TLC.
- Regolare la miscela di reazione a pH >10 di NaOH (2 M) su un bagno di ghiaccio. Utilizzare un imbuto di separazione da 50 mL per estrarre la miscela 3 volte con 20 mL di acetato etilico per ciascuno, combinare e concentrare la fase organica sotto vuoto utilizzando un evaporatore rotativo.
NOT: Prima dell'estrazione, regolare il valore di pH delle soluzioni di reazione su 10. Questo può mantenere l'ammina primaria come sua forma non ionizzata, facilitando così l'estrazione. - Purificare i residui con cromatografia flash con gel di silice in fase inversa sotto pressione normale, utilizzando MeOH/H2O come eluente. Asciugare la soluzione del prodotto attraverso la liofilizzazione per dare i prodotti azodesiderati.
NOT: La stessa reazione può essere eseguita anche in soluzioni HCl diluite (0,2 M).
2. Misurazioni UV-Vis e calcolo teorico
- Sciogliere l'azo puro (50 m) in acqua distillata o in 5% H3PO4 soluzione (pH 1.1), rispettivamente. Registrare gli spettri di assorbimento UV-vis (250-700 nm) su uno spettrometro a temperatura ambiente (25 gradi centigradi). Esportare i dati come file .xls/.xlsx per ulteriori analisi.
-
Eseguire tutti i calcoli teorici per PMQ stesso e prodotti azo utilizzando il programma Gaussian 16. Utilizzare la teoria funzionale della densità dipendente dal tempo (TD-DFT) con un set di base 6-31G. Includere gli effetti del solvente mediante formalismo del modello di continuum polarizzabile (PCM) utilizzando l'acqua.
- Utilizzare il software (ad esempio, Chemdraw Office) per disegnare le strutture e quindi salvare la struttura come file di input gaussiano (.gif).
- Aprire il file gif con Gauss View e fare clic sul pulsante Calcola. Selezionare Impostazione calcolo gaussiana, Opt , Freqe stato del terreno-DFT-B3LYP-6-31G; quindi fare clic su Invia. L'ottimizzazione della geometria genererà un file .log.
- Seguendo la procedura descritta in precedenza, utilizzare la visualizzazione Gauss per aprire questo file di registro. Fare clic su Calcola-Gaussian Calculation Setup (Calcola-Gaussian Calculation Setup) e selezionare solo Energy (Calcola-Gaussian Calculation Setup) e selezionare TD-SCF-DFT-B3LYP-6-31G-Singlet (Solo). Quindi Invia. Il calcolo dell'energia genererà un altro file di registro e un file cubo.
- Utilizzare La visualizzazione Gauss per aprire il file di registro dal calcolo dell'energia. Fare clic su Risultati-UV/Vis per visualizzare l'assorbimento previsto.
- Utilizzare La visualizzazione Gauss per aprire il file cubo. Fare clic su Risultatos e selezionare la superficie e i contorni- azioni di superficie e nuova superficie per visualizzare le orbite.
-
Confrontare i risultati sia della misurazione sperimentale che del calcolo gaussiano. Calcolare l'errore percentuale tra i valori calcolati e misurati, in base alla seguente equazione.
Errore : (Wmax cal.-Wmaxexper.) / Wmaxexper. | 100%
dove Wmax cal. rappresenta la lunghezza d'onda massima di assorbimento dal calcolo teorico e Wmax exper. rappresenta la lunghezza d'onda dal risultato sperimentale.
3. Determinazione PMQ
- Misurazione PMQ utilizzando una piastra da 96 pozze (Figura 5)
- Sciogliere 4-methoxyaniline in 0.2 M HCl per una soluzione anilina 200 mM, R1. Sciogliere il nitrito di sodio in acqua distillata per ottenere una soluzione da 5 mM, R2. Conservare tutte le soluzioni in frigorifero a 4 gradi centigradi prima dell'uso.
- Aggiungete 100 L di R1 in una piastra di 96 pozze, e aggiungete 50 l di PMQ contenenti il campione nella piastra da mescolare con R1. Quindi, aggiungere 50 L di R2 nella piastra. Mescolare le soluzioni con il pipettaggio ripetuto.
- Mantenere la piastra a temperatura ambiente per 15 min, e quindi registrare l'assorbimento UV-vis a 504 nm. Ripetere 3x per ogni test. Il prodotto azo è stabile con esposizione alla luce della stanza; non è necessario tenere la piastra buia.
- Esportare i dati come file .xls/.xlsx per ulteriori analisi.
- Curva di calibrazione per la misurazione diretta del PMQ in un campione di urina
- Preparare le soluzioni PMQ utilizzando urine sintetiche con concentrazioni di PMQ rispettivamente a 0, 1, 2, 5, 10, 20, 5, 100, 200 M.
- Aggiungete 100 L di R1 in una piastra di 96 pozze, e aggiungete 50 l di soluzione di urina PMQ da mescolare con R1. Quindi, aggiungere 50 -L di R2 alla miscela di cui sopra. Mescolare le soluzioni con il pipettaggio ripetuto. Mantenere la piastra a temperatura ambiente per 15 min, e quindi registrare l'assorbimento UV-vis a 504 nm.
- Generare una curva di calibrazione in base alle concentrazioni di assorbimento I504 e PMQ. Utilizzare i valori dei pozze vita senza PMQ come spazio vuoto e sottrarre i valori vuoti da tutti i test prima dell'elaborazione dei dati.
- Eseguire un adattamento lineare per generare le equazioni lineari come Y , aX, dove Y è l'intensità di assorbimento a 504 nm, X è la concentrazione di PMQ, a è la pendenza e b è l'intercetta y della linea lineare.
- Curva di calibrazione per la misurazione diretta del PMQ in un campione di siero umano
- Preparare le soluzioni PMQ utilizzando il siero umano con concentrazioni di PMQ rispettivamente a 0, 1, 2, 5, 10, 20, 5, 100, 200, M.
- Aggiungete 100 L di R1 in una piastra di 96 pozze e aggiungete 50 l di soluzione di siero PMQ da mescolare con R1. Aggiungere 50 -L di R2 alla miscela di cui sopra e mescolare le soluzioni con il pipettaggio ripetuto. Mantenere la piastra a temperatura ambiente per 15 min e quindi registrare l'assorbimento UV-vis a 504 nm. Esportare i dati come file .xls/.xlsx per ulteriori analisi.
- Generare una curva di calibrazione in base alle concentrazioni di assorbimento I504 e PMQ. Utilizzare i valori dei pozze vita senza PMQ come spazio vuoto e sottrarre i valori vuoti da tutti i test prima dell'elaborazione dei dati.
- Eseguire un adattamento lineare per generare le equazioni lineari come Y , aX, dove Y è l'intensità di assorbimento a 504 nm, X è la concentrazione di PMQ, a è la pendenza e b è l'intercetta y della linea lineare.
- Estrazione PMQ dal siero
- Aggiungere una certa quantità di PMQ nel siero umano per simulare il siero contenente PMQ. Per l'estrazione PMQ, aggiungere 6 mL di miscela di acetato/esano di etila (7:1 v/v) in 2 mL di siero contenente PMQ in un tubo di centrifuga 15 mL.
- Aggiungere 100 l di idrossido di sodio (2 M) soluzione al sistema di estrazione. Scuotere violentemente il tubo utilizzando un miscelatore vortice per 30 s. Raccogliere lo strato organico e concentrarlo utilizzando un evaporatore rotante sotto vuoto.
- Sciogliere i residui con 200 o L di acqua distillata e rimuovere i componenti lipidi insolubili filtrando attraverso una membrana a forma di disco con 220 nm di dimensioni dei pori. Utilizzare la soluzione finale per il test.
- Determinare il PMQ dal siero con l'estrazione
- Seguire i passaggi 3.2 o 3.3 per generare la curva di calibrazione per PMQ in acqua distillata. Estrarre PMQ dai sieri contenenti PMQ in base al passaggio 3.4.
- Aggiungere 100 ll di R1 e 50 -L di soluzione PMQ in una piastra di 96 pozze. Aggiungere 50 -L di R2 alla miscela superiore e mescolare le soluzioni con una pipa ripetuta.
- Mantenere la piastra a temperatura ambiente per 15 min e registrare l'assorbimento UV-vis a 504 nm. Utilizzare i pozzi con R1 e R2 ma senza PMQ come controlli. Esportare i dati come file .xls/.xlsx per ulteriori analisi.
- Sottrarre i valori di controllo dai valori di assorbimento I504 per ogni test, quindi utilizzare il risultato per i calcoli di concentrazione in base all'equazione di rivestimento dalla curva di calibrazione.
NOT: Il limite di rilevamento (LOD) per PMQ in tutti i casi può essere calcolato secondo un metodo standard22. Il calcolo è stato basato sulla funzione di calibrazione: LOD - 3,3 sD/b, dove SD è la deviazione standard dello spazio vuoto e b è la pendenza della retta di regressione
Risultati
Per ottimizzare le condizioni di reazione (Figura 2), sono state utilizzate varie aniline per accoppiarsi con PMQ attraverso la reazione di Griess. Abbiamo raggiunto una serie di azos con colori diversi. È stato scoperto che le aniline con un elettrone che dona un solvente possono causare uno spostamento rosso nello spettro di assorbimento della visone UV. I calcoli teorici sono stati effettuati attraverso la teoria funzionale della densità dipendente dal tempo (TD-DFT). Come illustrato nella Figura 2A, il risultato del calcolo è stato in buon accordo con le misurazioni ottiche con errore medio del 3,1%. 4-methoxyaniline è stato poi utilizzato per condurre la reazione di rilevamento PMQ a causa delle sue buone prestazioni nel tasso di reazione, solubilità del prodotto, e la stabilità21. Inoltre, il prodotto azo da 4-methoxyaniline è di colore rosso, che è facile distinguere a occhio nudo. Pertanto, questa reazione offre il potenziale per il rilevamento PMQ ad occhio nudo (Figura 3).
La figura 4A mostra l'effetto pH sullo spettro di assorbimento UV-vis assorbimento del prodotto azo 3d. I504 non cambia quando si aumenta il pH da 1.0 a 6.0. I504 sotto pH 7.0 presenta una leggera diminuzione, mentre un pH di base (8.0 e 9.0) influisce notevolmente sull'assorbimento. La figura 4B mostra gli effetti pH delle soluzioni PMQ sulla reazione di Griess. Il PMQ (50 M) nel buffer PBS con vari pH (4,0, 5,0 ,6,0, 7,0, 8,0, 9,0) sono stati mescolati singolarmente con il reagente di test, come descritto nella sezione 3.1. I504 è stato poi misurato dopo 15 min a temperatura ambiente. Come indicato, i pH di base (8.0, 9.0) delle soluzioni PMQ influenzano potenzialmente la reazione. Nella figura 5 è illustrata la procedura generale per eseguire la reazione Griess per il rilevamento PMQ. Come descritto nella sezione del protocollo, sono necessari quattro passaggi per ottenere i dati di assorbimento I504 per l'analisi. La figura 6A e 6B mostrano le curve di calibrazione per il rilevamento diretto del PMQ dai campioni di urina e siero, rispettivamente, senza pretrattamenti dei campioni. Un'eccellente relazione lineare (R2 - 0,998) è stata trovata quando il PMQ nelle urine sintetiche varia da 0 a 200 M. In termini del campione di siero, è stata trovata una relazione lineare alla concentrazione che va da 10 a 200 M.
Nella figura 7A è illustrata la procedura per estrarre il PMQ dal siero. I residui sono stati dissolti in acqua distillata dopo l'estrazione e la concentrazione, e poi filtrati. Per simulare un siero reale contenente PMQ, PMQ è stato aggiunto al siero umano con concentrazioni finali a 0, 0,2, 0,5, 1,0, 2,0 M. Utilizzando i passaggi 3.4 e 3.5, le concentrazioni di PMQ nei sieri sono risultate rispettivamente 0,02, 0,14, 0,44, 0,90 e 1,78 M (Figura 7C). Sulla base del risultato, la percentuale di recupero da PMQ è risultata intorno al 90% quando il PMQ era superiore a 0,5 m nel siero, che era paragonabile ai rapporti precedenti9.

Figura 1: Schematica della reazione griess sul PMQ. (A) Una classica reazione Griess per l'analisi dei nitriti. (B) La reazione di Griess nel metodo di rilevamento PMQ proposto. Questa cifra è stata modificata con il permesso del lavoro precedente21. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Proprietà fotofisiche degli azos sintetici. (A) Misurazione UV-vis e calcolo teorico del massimo assorbimento degli azoi generati da diverse anilinee. I numeri al di fuori delle parentesi rappresentano per la misurazione massima dell'assorbimento in condizioni dipH2O distillate vicino a neutro; i numeri tra parentesi si riferiscono alla misura nella soluzione 5% H3PO4 (pH - 1,1). /nmexper. rappresenta i dati dell'esperimento el'abs/calc. rappresenta i dati teorici di calcolo. Eexc è l'energia di eccitazione (eV), e f è la forza dell'oscillatore. (B) Foto di PMQ e dei prodotti azo con diversi sostituti, 50 M in soluzione di acido fosforico del 5%. (C) Spettri UV-vis dei prodotti sintetici. I valori sono stati normalizzati in un intervallo compreso tra 0 e 1. Questa cifra è stata modificata con il permesso del lavoro precedente21. Fare clic qui per visualizzare una versione più grande di questa figura.
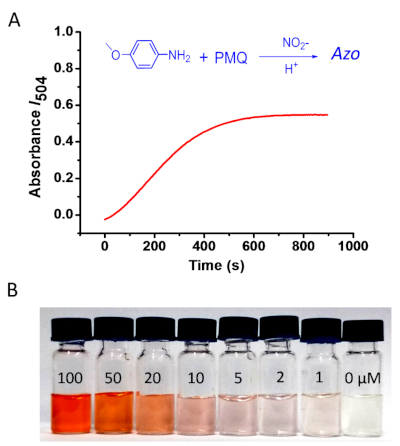
Figura 3: Determinazione colorimetrica del PMQ. (A) Monitorare le variazioni di assorbimento al massimo I504 in modo dipendente dal tempo. La reazione è stata eseguita utilizzando 4-methoxyaniline, e il PMQ è stato utilizzato a 100 M; (B) Cambiamenti di colore della reazione con diverse concentrazioni di PMQ: 400 -L di soluzione a 4 methoxyaniline (200 mM in 0,2 M HCl) e 200 L di nitrito di sodio in acqua (5 mM), con 200 gradi di soluzione PMQ di diverse concentrazioni (0, 1, 2, 5 , 10, 20, 50, 100 M). Fare clic qui per visualizzare una versione più grande di questa figura.
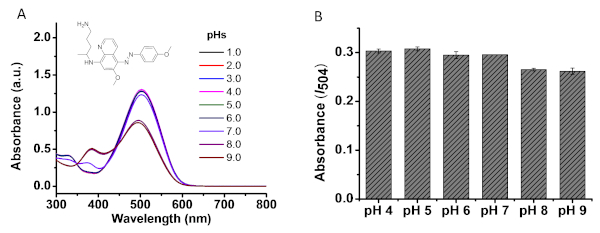
Figura 4: effetto pH sul rilevamento PMQ. (A) effetti di pH sull'assorbimento UV-vis del prodotto azo 3d (50 M); (B) PMQ (50 m) nel buffer PBS con pH diversi (4.0, 5.0, 6.0, 7.0, 8.0, 9.0) sono stati utilizzati per eseguire la reazione come descritto nel passaggio 3.1. Quindici minuti dopo, è stata misurata l'assorbimento a 504 nm. Fare clic qui per visualizzare una versione più grande di questa figura.
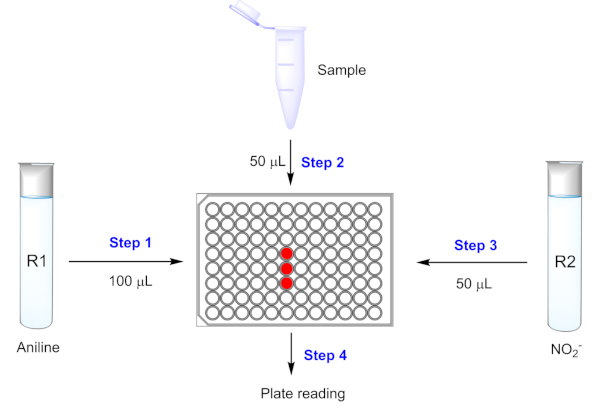
Figura 5: Determinazione PMQ attraverso una reazione Griess su un sistema a base di piastra 96-pozzo. R1 si riferisce alla soluzione 4-methoxyaniline da 200 mM in 0,2 M HCl; R2 si riferisce a 5 mM di nitrito di sodio in acqua distillata. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: Curve dicalibrazione per la determinazione del PMQ da (A) campioni di siero umano sintetici e (B). La concentrazione di PMQ varia da 0 a 200 M. Fare clic qui per visualizzare una versione più grande di questa figura.
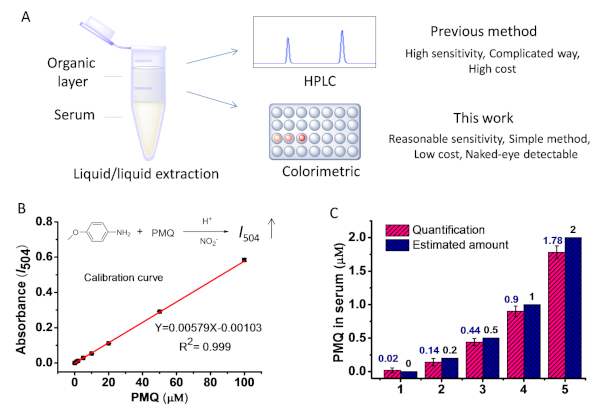
Figura 7: Determinazione PMQ da campioni disiero. ( (A) Illustrazione schematica dell'estrazione PMQ da campioni di siero per l'analisi quantitativa. (B) La relazione lineare trovata tra la concentrazione di I504 e la concentrazione di PMQ all'interno dell'intervallo da 0 a 100 M. (C) Il PMQ nel siero è stato quantificato dal metodo basato sulla reazione di Griess rispetto all'importo esatto aggiunto al siero. Questa cifra è stata modificata con il permesso del lavoro precedente21. Fare clic qui per visualizzare una versione più grande di questa figura.
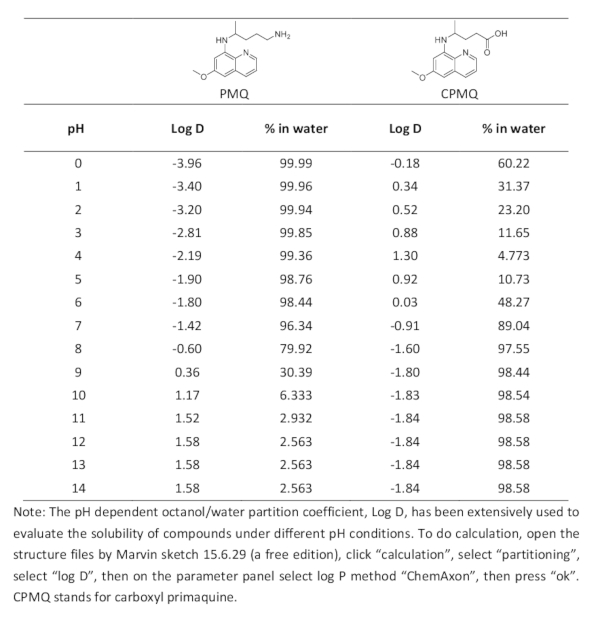
Tabella 1. Calcolo teorico del Log D e percentuale di distribuzione dell'acqua di PMQ e CPMQ.
Discussione
Abbiamo descritto un metodo colorimetrico per una comoda quantificazione PMQ. È potenzialmente il metodo attuale più semplice ed economico. Ancora più importante, questo metodo offre la misurazione basata su PMQ ad occhio nudo senza utilizzare alcuna apparecchiatura.
La reazione Griess ottimizzata per il rilevamento PMQ può generare un azo di colore rosso con un massimo assorbimento a 504 nm. La potenziale influenza derivante dall'assorbimento UV-vis è limitata, rendendo così il metodo promettente per la misurazione diretta del PMQ nei fluidi biologici. Come indicato dal risultato, è stata riscontrata un'eccellente relazione lineare (R2 - 0,998) per il rilevamento del PMQ delle urine sull'intervallo di concentrazione di 0-200 m (Figura 6A). Il limite di rilevamento (LOD) per PMQ è risultato essere 0,63 M. Questo metodo ha anche mostrato grandi potenzialità per la misurazione diretta del PMQ nel siero umano. Un'eccellente relazione lineare è stata trovata nella concentrazione che va da 10 a 200 M per il rilevamento PMQ del siero (Figura 6B). Possiamo migliorare ulteriormente la sensibilità pre-trattando il campione di siero attraverso l'estrazione e la concentrazione. Come illustrato nella figura 7 con un semplice processo di estrazione, questo metodo può quantificare il PMQ del siero a intervalli clinicamente rilevanti. Sulla base del meccanismo di reazione, il metabolita principale del carboxyl del PMQ (CPMQ) può potenzialmente formare un prodotto azo con proprietà UV-Vis simili. Tuttavia, l'estrazione di liquidi in condizioni di pH di base può potenzialmente ridurre al minimo l'interferenza da CPMQ. La tabella 1 mostra il log D calcolato e la distribuzione dell'acqua sia del PMQ che del CPMQ. Come mostrato, a pH >10, meno del 6,33% del PMQ si troverà nella fase dell'acqua, mentre oltre il 98,54% del CPMQ sarà in fase di acqua. Pertanto, teoricamente, più del 93,7% del PMQ e meno dell'1,56% del CPMQ potrebbe essere estratto per il test. Si può concludere che l'interferenza dal Metabolita principale CPMQ è limitata.
La procedura per il rilevamento PMQ è molto semplice da gestire. Prendendo ad esempio il sistema a base di piastra 96-well, l'intera procedura è composta da quattro passaggi: 1) aggiungendo 100 -L di soluzione a 4 methoxyaniline (200 mM in 0,2 M HCl) R1 in una piastra da 96 pozze; 2) aggiungendo 50 l of PMQ concentration-unknown sample da mescolare con R1; 3) aggiungendo 50 - L di R2 (soluzione di nitrito di sodio 5 mM) per eseguire la reazione a temperatura ambiente; e 4) la registrazione dell'assorbimento UV-vis a 504 nm utilizzando uno spettrometro. La concentrazione di PMQ da un campione sconosciuto può essere calcolata in base all'intensità di assorbimento I504 e all'equazione lineare dalla curva di calibrazione. L'intera procedura viene eseguita a temperatura ambiente senza la necessità di incubazione. Un ambiente scuro non è necessario per l'intera procedura, in quanto il prodotto colorato non è sensibile alla luce della stanza.
Va notato che il tempo per la soluzione di reazione per raggiungere il suo saturo I504 è dipendente dalla temperatura. Come mostrato nella Figura 3, erano necessari almeno 12 min a temperatura ambiente (25 gradi centigradi). Il tempo di reazione sarebbe più lungo se eseguisse la reazione a temperature inferiori a 25 gradi centigradi. La condizione di pH di base delle soluzioni PMQ può potenzialmente influenzare l'assorbimento I504. Per risolvere questo problema, regolare il pH della soluzione PMQ in modo che sia inferiore a 7.0. In caso contrario, è necessaria una nuova curva di calibrazione per la soluzione con pH superiore a 7.0. Inoltre, i nitriti intrinseci nei campioni testati possono influenzare il rilevamento. Tuttavia, ciò può verificarsi solo quando la concentrazione di nitriti intrinseci è estremamente elevata poiché un'alta concentrazione di nitrito (5 mM) è stata utilizzata in un test standard.
Divulgazioni
Gli autori non hanno nulla da dichiarare.
Riconoscimenti
Gli autori riconoscono la Start-Up Grant dell'Università di Medicina Cinese di Guangzhou e il progetto di formazione per la ricerca scientifica per i giovani di G'UMCm (2019QNPY06). Riconosciamo anche il Lingnan Medical Research Center dell'Università di Medicina Cinese di Guangzhou per il supporto sulle strutture.
Materiali
| Name | Company | Catalog Number | Comments |
| 4-Methoxyaniline | Aladdin | K1709027 | |
| 2,4-Dimethoxyaniline | Heowns | 10154207 | |
| 3,4-Dimethoxyaniline | Bidepharm | BD21914 | |
| 4-Methylaniline | Adamas-beta | P1414526 | |
| 4-Nitroaniline | Macklin | C10191447 | |
| 96-wells,Flat Botton | Labserv | 310109008 | |
| Gaussian@16 software | Gaussian, Inc | Version:x86-64 SSE4_2-enabled/Linux | |
| Hydrochloric acid | GCRF | 20180902 | |
| Marvin sketch (software) | CHEMAXON | free edition: 15.6.29 | |
| Phosphoric acid | Macklin | C10112815 | |
| Primaquine bisiphosphate | 3A Chemicals | CEBK200054 | |
| Sodium nitrite | Alfa Aesar | 5006K18R | |
| Sulfonamides | TCI(shanghai) | GCPLO-BP | |
| Varioskan LUX Plate reader | Thermo Fisher | Supplied with SkanIt Software 4.1 |
Riferimenti
- Fernando, D., Rodrigo, C., Rajapakse, S. Primaquine in vivax malaria: an update and review on management issues. Malar Journal. 10, 351 (2011).
- Deng, C., et al. Large-scale Artemisinin-Piperaquine Mass Drug Administration With or Without Primaquine Dramatically Reduces Malaria in a Highly Endemic Region of Africa. Clinical Infectious Diseases. 67 (11), 1670-1676 (2018).
- Pavic, K., et al. Primaquine hybrids as promising antimycobacterial and antimalarial agents. European Journal of Medical Chemistry. 143, 769-779 (2018).
- McQueen, A., et al. Synthesis, characterization, and cellular localization of a fluorescent probe of the antimalarial 8-aminoquinoline primaquine. Bioorganic & Medicinal Chemistry Letters. 27 (20), 4597-4600 (2017).
- Ashley, E. A., Recht, J., White, N. J. Primaquine: the risks and the benefits. Malaria Journal. 13 (1), 418 (2014).
- Watson, J., Taylor, W. R., Menard, D., Kheng, S., White, N. J. Modelling primaquine-induced haemolysis in G6PD deficiency. Elife. 6, (2017).
- Beutler, E. Glucose-6-phosphate dehydrogenase deficiency: a historical perspective. Blood. 111 (1), 16-24 (2008).
- Endoh, Y. S., et al. High-performance liquid chromatographic determination of pamaquine, primaquine and carboxy primaquine in calf plasma using electrochemical detection. Journal of Chromatography B: Biomedical Sciences and Applications. 579 (1), 123-129 (1992).
- Dua, V. K., Kar, P. K., Sarin, R., Sharma, V. P. High-performance liquid chromatographic determination of primaquine and carboxyprimaquine concentrations in plasma and blood cells in Plasmodium vivax malaria cases following chronic dosage with primaquine. Journal of Chromatography B: Biomedical Applications. 675 (1), 93-98 (1996).
- Miranda, T. A., Silva, P. H. R., Pianetti, G. A., César, I. C. Simultaneous quantitation of chloroquine and primaquine by UPLC-DAD and comparison with a HPLC-DAD method. Malaria Journal. 14, 29 (2015).
- Tatsuno, M., Nishikawa, M., Katagi, M., Tsuchihashi, H. Simultaneous determination of illicit drugs in human urine by liquid chromatography-mass spectrometry. Journal of Analytical Toxicology. 20 (5), 281-286 (1996).
- Erni, F. Use of high-performance liquid chromatography in the pharmaceutical industry. Journal of Chromatography A. 507, 141-149 (1990).
- Tsikas, D. Analysis of nitrite and nitrate in biological fluids by assays based on the Griess reaction: Appraisal of the Griess reaction in the l-arginine/nitric oxide area of research. Journal of Chromatography B. 851 (1), 51-70 (2007).
- Zurcher, D. M., Adhia, Y. J., Romero, J. D., McNeil, A. J. Modifying a known gelator scaffold for nitrite detection. Chemical Communications. 50 (58), 7813-7816 (2014).
- Kunduru, K. R., Basu, A., Tsah, T., Domb, A. J. Polymer with pendant diazo-coupling functionality for colorimetric detection of nitrates. Sensors and Actuators B: Chemical. 251, 21-26 (2017).
- Li, D., Ma, Y., Duan, H., Deng, W., Li, D. Griess reaction-based paper strip for colorimetric/fluorescent/SERS triple sensing of nitrite. Biosensors and Bioelectronics. 99, 389-398 (2018).
- Deng, T., et al. A novel strategy for colorimetric detection of hydroxyl radicals based on a modified Griess test. Talanta. 195, 152-157 (2019).
- Pang, H., et al. A photo-responsive macroscopic switch constructed using a chiral azo-calix[4]arene functionalized silicon surface. Chemical Communications (Camb). 54 (24), 2978-2981 (2018).
- Kaur, N., Dhaka, G., Singh, J. Simple naked-eye ratiometric and colorimetric receptor for anions based on azo dye featuring with benzimidazole unit. Tetrahedron Letters. 56 (9), 1162-1165 (2015).
- Liu, F., Lou, J., Hristov, D. X-Ray responsive nanoparticles with triggered release of nitrite, a precursor of reactive nitrogen species, for enhanced cancer radiosensitization. Nanoscale. 9 (38), 14627-14634 (2017).
- Deng, T., et al. An unexpected Griess reaction on the important anti-malarial drug primaquine and its application for drug determination. Journal of Pharmaceutical and Biomedical Analysis. 171, 8-14 (2019).
- Shrivastava, A., Gupta, V. Methods for the determination of limit of detection and limit of quantitation of the analytical methods. Chronicles of Young Scientists. 2 (1), 21-25 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon