Method Article
Síntese de facile de Nanoplaquetas perovskite coloidal da ligação do Halide através de reprecipitação ligand-ajudada
Neste Artigo
Resumo
Este trabalho demonstra a síntese do quarto-temperatura do facile de nanoplaquetas de perovskita do Halide da ligação Quantum-confinada coloidal pelo método ligand-ajudado da reprecipitação. As nanoplaquetas sintetizadas mostram características ópticas espectralmente estreitas e uma tunabilidade espectral contínua em toda a faixa visível, variando a composição e as espessuras.
Resumo
Neste trabalho, Nós demonstramos um método facile para a síntese coloidal do nanoplaqueta perovskita do Halide da ligação (fórmula química: l2[ABX3]n-1BX4, l: n e octylammonium, a: methylammonium ou formamidinium, B: chumbo, X: brometo e iodeto, n: número de camadas de [BX6]4- octaédricos na direção da espessura de nanoplaquetas) via reprecipitação assistida por ligante. Soluções precursoras de perovskita individuais são preparadas dissolvendo cada sal constituinte de nanoplaquetas em N, N-dimetilformamida (DMF), que é um solvente orgânico polar, e depois misturando em proporções específicas para a espessura e composição de nanoplaquetas direcionadas. Uma vez que a solução precursora mista é deixada cair em tolueno não polar, a mudança abrupta na solubilidade induz a cristalização instantânea de nanoplaquetas com ligantes de alquilamónio de superfície ligado que proporcionam estabilidade coloidal. Os espectros da fotoluminescência e da absorção revelam características emissive e fortemente Quantum-confinadas. A difração de raios X e a microscopia eletrônica de transmissão confirmam a estrutura bidimensional das nanoplaquetas. Além disso, Nós demonstramos que a abertura da faixa de nanoplaquetas do perovskita pode continuamente ser ajustada na escala visível variando a estequiometria do íon do Halide (s). Finalmente, nós Demonstramos a flexibilidade do método ligand-ajudado da reprecipitação introduzindo a espécie múltipla como ligands Surface-tampando. Esta metodologia representa um procedimento simples para preparar dispersões de semicondutores coloidais 2D emissivos.
Introdução
Na última década, a fabricação de células solares de Halide de chumbo perovskitas1,2,3,4,5,6 realçou efetivamente as excelentes propriedades deste material do semicondutor, incluindo comprimentos longos7,8,9,10da difusão do portador, ajuste composicional4,5,11 e síntese de baixo custo12. Em particular, a natureza única da tolerância de defeitos13,14faz com que o Halide perovskitas de chumbo seja fundamentalmente diferente de outros semicondutores e, portanto, altamente promissor para aplicações optoeletrônicas de próxima geração.
Além do que as pilhas solares, os perovskitas do Halide da ligação foram mostrados para fazer dispositivos optoelectronic excelentes tais como diodos luminescentes6,15,16,17,18, 19,20,21,22, lasers23,24,25, e photodetectores26,27, a 28. Especialmente, quando preparados a forma de nanocristais coloidais18,29,30,31,32,33,34, 35,36,37,38,39,40,41,42,43, chumbo os perovskitas de Halide podem expor o Quantum-e o Dielectric-confinamento forte, grande energiaobrigatória 44do exciton,45, e luminescência brilhante17,19 junto com asolução defacile Processabilidade. Várias geometrias relatadas, incluindo pontos quânticos29,30,31,32, Nanorods33,34 e nanoplaquetas18, 35,36,37,38,39,40,41,43 demonstre ainda mais a tunabilidade da forma de nanocristais de Halide perovskita de chumbo.
Entre esses nanocristais, os perovskites de iodetos bidimensionais coloidais (2D), ou "nanoplaquetas perovskita", são especialmente promissores para aplicações luminescentes devido ao forte confinamento de portadores de carga, grande energia de ligação de exciton atingindo até centenas de MeV44, e a emissão espectralmente estreita dos conjuntos espessura-puros de nanoplaquetas39. Adicionalmente, a emissão anisotrópica relatada para nanocristais 2D do perovskita46 e outros semicondutores 2D47,48 destaca o potencial de maximizar a eficiência do acoplamento do perovskita nanoplaqueta-baseado dispositivos emissores de luz.
Aqui, Nós demonstramos um protocolo para a síntese simples, universal, da quarto-temperatura de nanoplaquetas coloidal do perovskita do Halide da ligação através de uma técnica ligand-ajudada do reprecipitação36,38,49. As nanoplaquetas de perovskite que incorporam o iodeto e/ou os anions do Halide do brometo, os cátions orgânicos do methylammonium ou do formamidinium, e os ligantes orgânicos variáveis da superfície são demonstrados. Os procedimentos para controlar a energia da absorção e da emissão e a pureza da espessura da dispersão coloidal são discutidos.
Protocolo
Nota: as notações mais simples de 'n = 1 BX ' e 'n = 2 ABX ' serão usadas a partir daqui, em vez da fórmula química complexa de l2BX4 e l2[ABX3] BX4, respectivamente. Para uma melhor estabilidade e propriedades ópticas de nanoplaquetas resultantes de perovskita, recomenda-se completar todo o procedimento condições inertes49 (i.e., um Glovebox de nitrogênio).
1. preparação da solução precursora de nanoplaquetas perovskita
- Prepare ~ 1 mL de soluções de 0,2 M de brometo de metilamónio (MABr), brometo de formamidínio (FABr), brometo de chumbo (PbBr2), brometo de Butylamónio (BABR), brometo de Octilamónio (oabr), iodeto de METILAMÓNIO (Mai), iodeto de FORMAMIDÍNIO (FAI), chumbo iodeto (PbI2), iodeto de BUTYLAMÔNIO (BAI) e iodeto de octilamónio (OAI) em N, n-dimetilformamida (Dmf), quer dissolvendo cada sal em Dmf ou diluindo soluções comercialmente disponíveis.
- PbBr2 não é prontamente solúvel em Dmf à temperatura ambiente, manter a solução em 80 ° c por 10 min ou mais para dissolução completa. Uma vez dissolvido, resfrie a solução de volta à temperatura ambiente antes de usar.
Nota: a concentração de soluções precursoras individuais pode ser aumentada para sintetizar mais nanoplaquetas, mas a concentração máxima é geralmente limitada pelas solubilidades de PbBr2 e PBI2 em Dmf.
- PbBr2 não é prontamente solúvel em Dmf à temperatura ambiente, manter a solução em 80 ° c por 10 min ou mais para dissolução completa. Uma vez dissolvido, resfrie a solução de volta à temperatura ambiente antes de usar.
- Misture essas soluções de precursores individuais em proporções volumétricas específicas para cada espessura e composição alvo.
- Para sintetizar nanoplaquetas apenas de brometo ou de iodeto, ver tabela 1, que resume as proporções volumétricas para n = 1 e n = 2 brometo e nanoplaquetas de iodeto.
- Para sintetizar nanoplaquetas com composições de iodeto misto, combine soluções de precursores de nanoplaquetas perovskita apenas com brometo e apenas iodeto da mesma espessura na proporção volumétrica desejada para a composição do alvo. Por exemplo, para fazer 30%-brometo-70%-iodeto n = 2 nanoplaquetas perovskita, misture as soluções precursoras de n = 2 mapbbr e n = 2 mapbi em uma relação volumétrica 3:7.
Nota: a alteração do cátion orgânico não afecta significativamente as energias de transição óptica13. A absorção e a luminescência são afinadas primeiramente mudando a composição do Halide ou a espessura do nanoplaqueta.
2. síntese de nanoplaquetas perovskita via método de reprecipitação assistida por ligantes
- Injete 10 μL de solução precursora mista em 10 mL de tolueno agitação vigorosa. As nanoplaquetas se cristalizam instantaneamente devido à mudança abrupta na solubilidade.
Nota: a quantidade de solução mista precursora injectada em tolueno pode ser aumentada até ~ 100 μL. a quantidade total de solução precursora injetada e a velocidade de injeção não parecem afetar significativamente a morfologia da nanoplaqueta perovskita (Figura S1). No entanto, a injeção de muito DMF aumenta a polaridade da solução e reduz a cristalização. - Deixe a solução agitação por 10 min até que nenhuma mudança de cor adicional seja observada a partir da solução para garantir a cristalização completa de nanoplaquetas perovskita.
Nota: as nanoplaquetas de perovskita recém-sintetizadas de soluções precursoras recém-preparadas costumam mostrar a melhor produtividade quântica de fotoluminescência e fotoestabilidade49. E ao longo do tempo, as nanoplaquetas irão agregar lentamente (Figura S2), deteriorando a estabilidade coloidal. Assim, recomenda-se usar soluções de nanoplaquetas o mais rápido possível uma vez sintetizada.
3. Caracterização da preparação da amostra e purificação da solução de nanoplaquetas coloidal perovskita.
-
Preparação da amostra da microscopia eletrônica de transmissão (TEM).
- Centrifugue a solução em 2050 x g por 10 min.
- Descarte o sobrenadante.
- Redispersar as nanoplaquetas em 1 mL de tolueno.
- Solte 1 gota em uma grade TEM.
- Seque a amostra vácuo.
-
Preparação da amostra de difração de raios X (XRD)
- Centrifugue a solução em 2050 x g por 10 min.
- Descarte o sobrenadante.
- Redispersar as nanoplaquetas em 30 μL de tolueno.
- Dropcast em uma corrediça de vidro.
- Seque a amostra vácuo.
-
Purificação geral
- Centrifugue a solução em 2050 x g por 10 min.
- Descarte o sobrenadante.
- Redispersar as nanoplaquetas na quantidade desejada de solvente, dependendo do uso.
Nota: dependendo do uso de nanoplaquetas, o volume do solvente de redispersão pode ser ajustado livremente e outros solventes orgânicos não polares, como hexano, octano ou clorobenzeno, podem ser usados em vez de tolueno.
Resultados
A ilustração esquemática de nanoplaquetas perovskita e o procedimento de síntese dão uma visão geral dos detalhes materiais e sintéticos (Figura 1). Imagens de soluções de nanoplaquetas coloidais perovskita luz ambiente e UV (Figura 2), combinadas com fotoluminescência e espectros de absorção (Figura 3) confirmam ainda a natureza emissiva e absortiva das nanoplaquetas. As imagens de TEM (Figura 4) e os padrões de DRX (Figura 5) são utilizados para estimar as dimensões laterais e empilhar espaçamentos de nanoplaquetas, respectivamente, ao mesmo tempo que confirmam a estrutura bidimensional. Os espectros de absorção de soluções de nanoplaquetas perovskita com halogenetos mistos demonstram a possibilidade de sintonabilidade do bandgap (Figura 6). A insensibilidade do espectro de fotoluminescência à identidade química de ligantes orgânicos de superfície-tampando destaca a flexibilidade composicional desses materiais (Figura 7).
| Suez | FABr | PbBr2 | BABr | O OABr | Mai | Fai | PbI2 | Bai | Oai | |
| n = 1 PbBr | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 |
| n = 2 FAPbBr | 0 | 1 | 2 | 5 | 5 | 0 | 0 | 0 | 0 | 0 |
| n = 2 MAPbBr | 1 | 0 | 2 | 5 | 5 | 0 | 0 | 0 | 0 | 0 |
| n = 1 PbI | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 |
| n = 2 FAPbI | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 2 | 5 | 5 |
| n = 2 MAPbI | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 2 | 5 | 5 |
Tabela 1. Diretrizes de formulação para soluções precursoras de nanoplaquetas perovskita.
Os números na tabela indicam os equivalentes volumétricos de cada solução precursora (colunas) que devem ser combinadas para atingir a nanoplaqueta alvo (linhas), de acordo com as especificações de concentração no texto do protocolo.

Figura 1. Estrutura de nanoplaquetas de perovskite e procedimento de síntese.
(a) ilustração da pilha da unidade do perovskita e da estrutura da nanoplaqueta. (b) ilustração esquemática da síntese coloidal de nanoplaquetas perovskita. Reprinted (adaptado) com permissão de ref. 48. Copyright 2019 sociedade química americana. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2. Soluções de nanoplaquetas de perovskita coloidal iluminadas por luz UV.
A emissão das nanoplaquetas pode ser claramente observada ao longo do trajeto do feixe. Reprinted (adaptado) com permissão de ref. 48. Copyright 2019 sociedade química americana. Por favor clique aqui para ver uma versão maior desta figura.
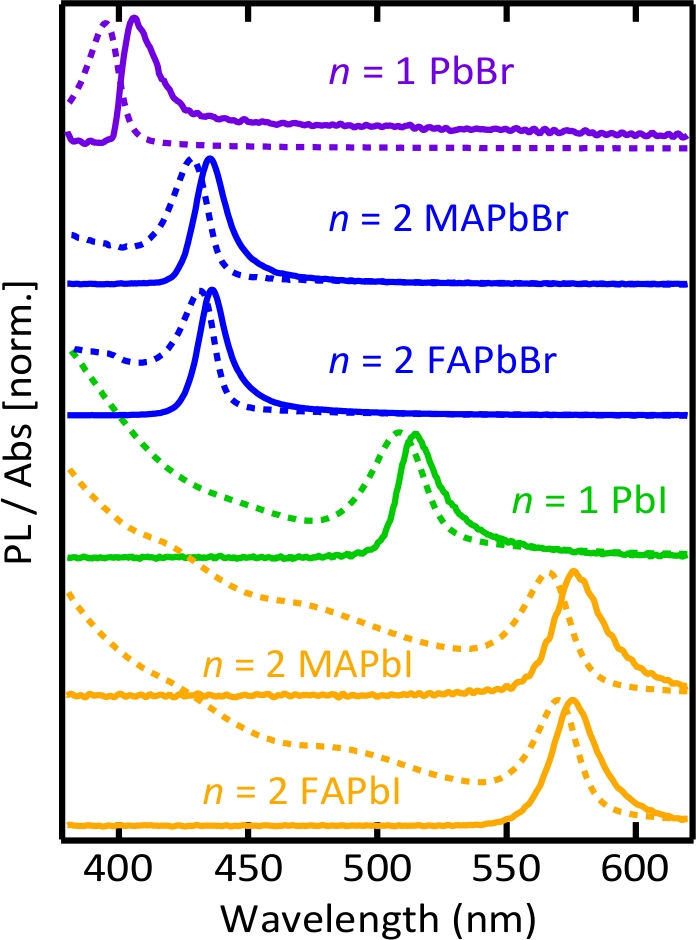
Figura 3. Espectros de fotoluminescência e absorção de soluções de nanoplaquetas coloidais perovskita.
O bandgap das nanoplaquetas pode ser ajustado com espessura e composição. Filtro longpass (comprimento de onda Cut-on: 400 nm) foi usado para filtrar a luz UV de excitação antes da coleta de espectro de fotoluminescência e poderia ter um pouco alterado n = 1 brometo de chumbo de nanoplaquetas espectro de emissão.

Figura 4. Imagens da microscopia de elétron da transmissão (tem) de nanoplaquetas do perovskita.
As imagens mostram nanoplaquetas de sobreposição aleatória. Veja também a Figura S7. Por favor clique aqui para ver uma versão maior desta figura.
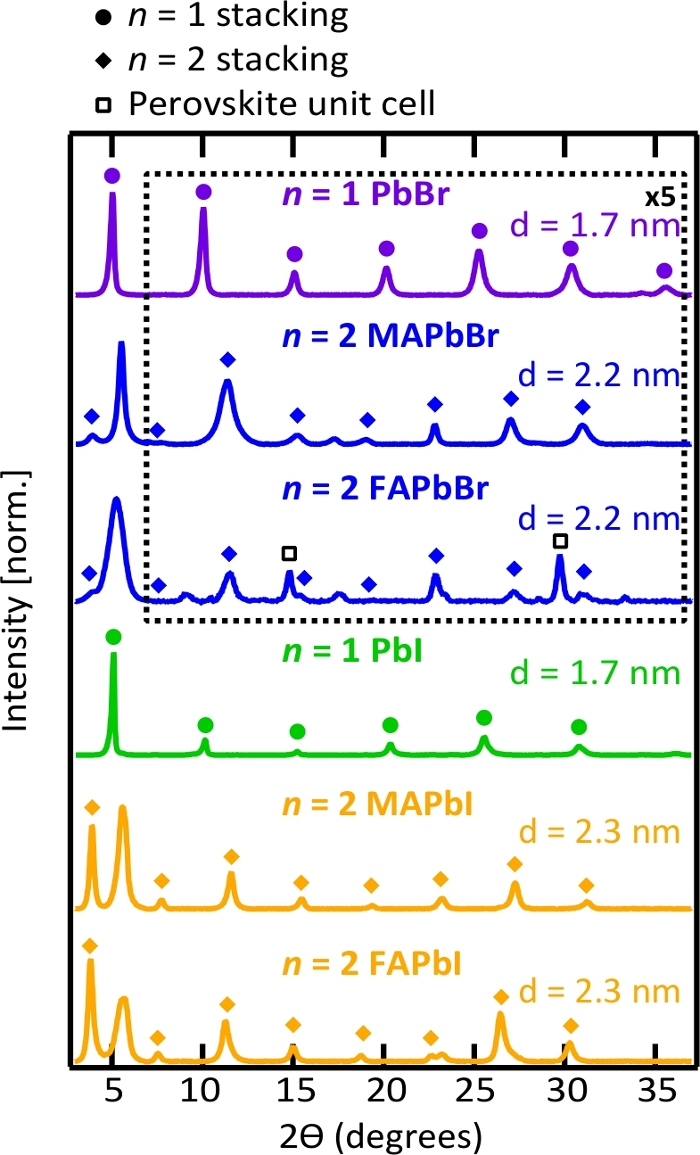
Figura 5. Padrões de difração de raios X (XRD) e d-espaçamentos de nanoplaquetas perovskita.
Os padrões de XRD são dominados por picos de empilhamento de nanoplaquetas que confirmam a natureza bidimensional das nanoplaquetas e sua automontagem cara a cara em filmes dropcasted. Por favor clique aqui para ver uma versão maior desta figura.
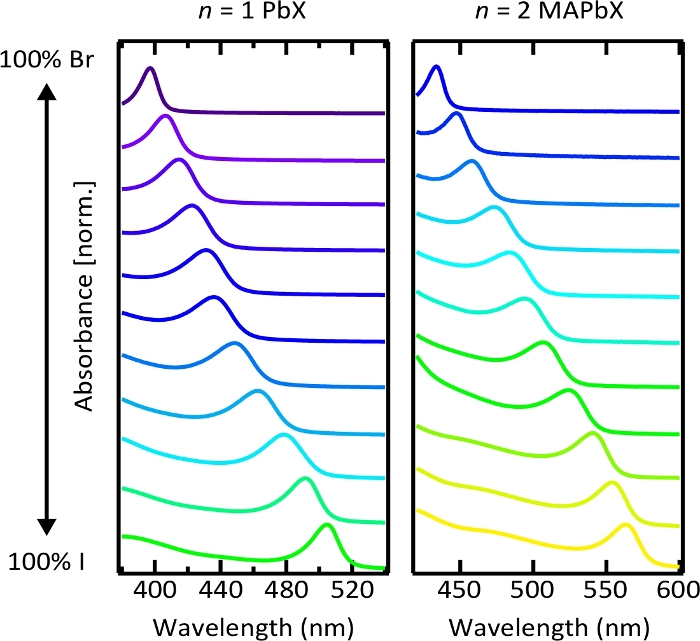
Figura 6. Espectros de absorção de soluções de nanoplaquetas coloidais perovskita com halogenetos mistos.
O deslocamento contínuo de primeiras características excitónicas da absorção mostra a ajuste do bandgap com composição do Halide. Por favor clique aqui para ver uma versão maior desta figura.
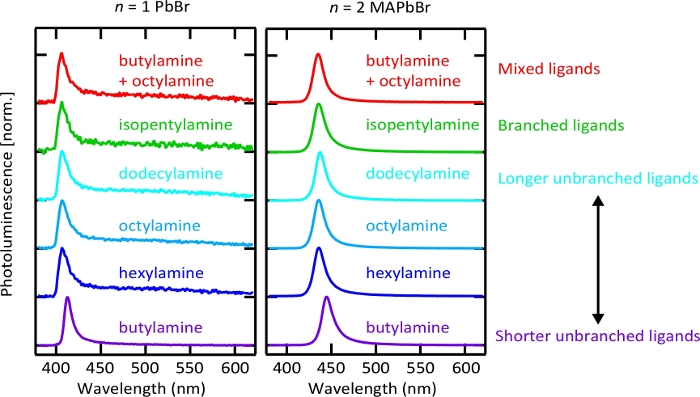
Figura 7. Espectros de fotoluminescência de n = 1 pbbr e n = 2 Nanoplaquetas de mapbbr sintetizadas com diferentes espécies de ligantes.
O método da reprecipitação pode facilmente ser estendido a outros chemistries do ligante. Ver também tabela S2 para as diretrizes de formulação. Filtro longpass (comprimento de onda Cut-on: 400 nm) foi usado para filtrar a luz UV de excitação antes da coleta de espectro de fotoluminescência e poderia ter um pouco alterado n = 1 brometo de chumbo de nanoplaquetas espectro de emissão. Por favor clique aqui para ver uma versão maior desta figura.
Arquivo suplementar. Informação de apoio. Por favor, clique aqui para baixar este arquivo.
Discussão
O produto desta síntese é nanoplaquetas coloidal do Halide da ligação tampado por ligantes da superfície do Halide do amidobenzoate (Figura 1a). A Figura 1b demonstra o procedimento sintético de nanoplaquetas coloidais perovskita via reprecipitação assistida por ligantes. Para resumir, os sais precursor constituintes foram dissolvidos em um DMF solvente polar em proporções específicas para a espessura desejada e composição, e depois injetado em tolueno, que é nonpolar. Devido à mudança abrupta na solubilidade, os nanoplaquetas coloidal do perovskita começaram a cristalizar-se instantaneously. Ao preparar a solução precursora mista, as proporções entre os precursores constituintes determinaram principalmente a espessura das nanoplaquetas resultantes (Figura S3), e a presença de ligantes em excesso na solução precursora foi crucial para garantir a homogeneidade da espessura do produto (Figura S4). Em geral, qualquer solvente polar pode ser usado para dissolver os sais precursores perovskita, enquanto qualquer solvente não polar pode ser usado para dispersar as nanoplaquetas coloidais. No entanto, a miscibilidade desses solventes não polares e polares é crucial para a síntese homogênea de nanoplaquetas coloidais perovskita, e assim escolhemos o DMF e o tolueno. Também, é importante ter o solvente apolares no grande excesso ao solvente polar adicionado para que a cristalização de nanoplaquetas do perovskita ocorra. A adição de muito solvente polar aumenta a polaridade da mistura solvente resultante (ou seja, DMF + tolueno), que pode dissolver as nanoplaquetas. Os nanopatelets que incorporam cloreto e césio também podem ser sintetizados por essa abordagem (Figura S5), embora as nanoplaquetas contendo cloreto sejam não-Emissivas e as nanoplaquetas baseadas em césio sofram de estabilidade e espessura inferiores homogeneidade em relação às nanoplaquetas à base de metilamónio quando sintetizada através deste método38. Por fim, nota-se que apenas os membros n = 1 e n = 2 foram sintetizados com boa homogeneidade de espessura por esse método; tentativas de fazer mais espessa (n ≥ 3) nanoplaquetas tipicamente produzem dispersões de espessura mista (Figura S6).
A Figura 2 mostra as imagens das soluções de nanoplaquetas coloidais perovskita, sintetizadas por luz UV, onde a emissão das nanoplaquetas pode ser claramente observada ao longo do trajeto do feixe. A Figura 3 mostra a fotoluminescência normalizada (pl) e os espectros de absorção de soluções de nanoplaquetas coloidais perovskita, que são consistentes com os relatórios anteriores37,38,50,51 , demonstrando a tunabilidade de nanoplaquetas perovskita com espessura e espécies constituintes. Para todas as nanoplaquetas, as características excitónicas fortes nos espectros de absorção e o azul-deslocamento significativo dos espectros comparados aos perovskitas maiorias35 foram observados devido ao forte Quantum-e ao dielétrico-confinamento. A alteração do cátion orgânico do metilamónio ao formamidínio não afetou significativamente o Gap da banda – seja para brometo ou nanoplaquetas de iodeto – de acordo com a compreensão da estrutura eletrônica de Valência em perovskitas de iodetos de chumbo13 . A tabela S1 resume os rendimentos quânticos de fotoluminescência (PLQYs) dessas soluções de nanoplaquetas coloidais perovskita.
A estrutura bidimensional das nanoplaquetas perovskita foi confirmada por Met e XRD. Na Figura 4, as imagens tem mostram parcialmente sobreposição de nanoplaquetas perovskita bidimensional, com dimensões laterais individuais variando de algumas centenas de nanômetros a um micrômetro. O contraste de imagem e a configuração aleatória de nanoplaquetas na grade TEM sugerem que eles são dispersos em solução como folhas individuais – em vez de cristais lamelares empilhados. Pequenos pontos esféricos escuros apareceram em cima da irradiação do feixe de elétrons como observado na Figura 4, e acredita-se ser PB metálico como relatado anteriormente36,52. Devido às grandes dimensões laterais das nanoplaquetas perovskitas, elas preferencialmente colocam-se planas em cima umas das outras quando moldadas em um filme, e os picos de empilhamento periódicos dominaram o padrão XRD como mostrado na Figura 5. Considerando que a constante de treliça para a célula da unidade perovskita cúbico é ~ 0,6 Nm53, pode-se deduzir que a camada de ligante orgânico é de 1 nm de espessura em filmes de nanoplaquetas empilhadas, independentemente da espécie nanoplaquetária38.
A absorção e a ressonância de emissão puderam ser ajustadas continuamente variando a composição do Halide. A Figura 6 mostra os espectros de absorção normalizados de n = 1 PbX coloidal e n = 2 soluções de nanoplaquetas de mapbx com diferentes proporções de brometo e iodeto. Os picos de absorção excitônicas claras indicam forte confinamento de portadores em nanoplaquetas, e o deslocamento contínuo desses picos com composição de Iode demonstra a capacidade de sintonização da fenda de banda através da variação da composição de Halide (Figura S8). Entretanto, os espectros da fotoluminescência de nanoplaquetas do misturado-Halide exibem características largas ou múltiplas (Figura S9), que é possivelmente devido à segregação fotoinduzida do Halide. 54
O método de reprecipitação assistida por ligante é particularmente capaz de alterar a identidade do ligante de tampagem de cadeia longa, como mostra a Figura 7. Isso abre a possibilidade de ajustar a natureza das espécies orgânicas ligadas à superfície para o desempenho otimizado de um dispositivo específico ou aplicação55. No entanto, nota-se que as proporções entre os precursores individuais podem necessitar de um ligeiro ajustamento quando se empregam novas espécies de ligantes para a melhor homogeneidade da espessura do sistema resultante (Figura S10 e tabela S2).
Em conclusão, Nós demonstramos um método simples, versátil para sintetizar nanoplaquetas de perovskita do Halide da ligação coloidal da composição de variação (Figura S11). A abordagem de reprecipitação assistida por ligantes é potencialmente capaz de síntese de alta taxa de transferência e análise mais orientada por dados. A espessura-, a composição-e o ligand-tunability podem ser conseguidos sem nenhumas modificações principais nos protocolos sintéticos. Avançando, seria desejável aumentar ainda mais a eficiência de fotoluminescência para níveis proporcionais com outros nanocristais perovskita29,32,56.
Divulgações
Os autores não declaram interesses financeiros concorrentes.
Agradecimentos
Este trabalho foi apoiado pelo departamento de energia dos EUA, escritório de ciência, Ciências energéticas básicas (BES) o número DE prêmio DE-SC0019345. Seung Kyun ha foi parcialmente apoiado pelo Kwanjeong Education Foundation programa de doutorado no exterior Scholarship. Este trabalho fez uso das instalações experimentais compartilhadas do MRSEC no MIT, apoiadas pela National Science Foundation o número de premiação DMR-08-19762. Agradecemos a Eric Powers por assistência com provas e edição.
Materiais
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 365nm fiber-coupled LED | Thorlabs | M365FP1 | Excitation source (Photoluminescence) |
| Avantes fiber-optic spectrometer | Avantes | AvaSpec-2048XL | Photoluminescence detector (Photoluminescence spectra) |
| Cary 5000 | Agilent Technologies | UV-Vis spectrophotometer (Absorption spectra) | |
| FEI Tecnai G2 Spirit Twin TEM | FEI Company | Transmission electron microscopy (TEM) operating at 120kV | |
| PANalytical X'Pert Pro MPD | Malvern Panalytical | X-ray diffraction (XRD) operating at 45 kV and 40 mA with a copper radiation source. | |
| Materials | |||
| n-butylammonium bromide (BABr) | GreatCell Solar | MS305000-50G | |
| n-butylammonium chloride (BACl) | Fisher Scientific | B071025G | butylamine hydrochloride |
| n-butylammonium iodide (BAI) | Sigma-Aldrich | 805874-25G | |
| N,N-dimethylforamide (DMF) | Sigma-Aldrich | 227056-1L | Anhydrous, 99.8% |
| n-dodecylammonium bromide (DDABr) | GreatCell Solar | MS300880-05 | |
| formamidinium bromide (FABr) | GreatCell Solar | MS350000-100G | |
| formamidinium iodide (FAI) | GreatCell Solar | MS150000-100G | |
| n-hexylammonium bromide (HABr) | GreatCell Solar | MS300860-05 | |
| lead bromide (PbBr2) | Sigma-Aldrich | 398853-5G | .99.999% |
| lead chloride (PbCl2) | Sigma-Aldrich | 268-690-5G | 98% |
| lead iodide (PbI2) solution | Sigma-Aldrich | 795550-10ML | 0.55M in DMF |
| methylammonium bromide (MABr) | GreatCell Solar | MS301000-100G | |
| methylammonium iodide (MAI) | GreatCell Solar | MS101000-100G | |
| n-octylammonium bromide (OABr) | GreatCell Solar | MS305500-50G | |
| n-octylammonium chloride (OACl) | Fisher Scientific | O04841G | octylamine hydrochloride |
| n-octylammonium iodide (OAI) | GreatCell Solar | MS105500-50G | |
| iso-pentylammonium bromide (i-PABr) | GreatCell Solar | MS300710-05 | |
| toluene | Sigma-Aldrich | 244511-1L | Anhydrous, 99.8% |
Referências
- Kim, H. S., et al. Lead iodide perovskite sensitized all-solid-state submicron thin film mesoscopic solar cell with efficiency exceeding 9%. Scientific Reports. 2, 591 (2012).
- Zhou, H., et al. Interface engineering of highly efficient perovskite solar cells. Science. 345 (6196), 542-546 (2014).
- Yang, W. S., et al. Iodide management in formamidinium-lead-halide–based perovskite layers for efficient solar cells. Science. 356 (6345), 1376-1379 (2017).
- Saliba, M., et al. Cesium-containing triple cation perovskite solar cells: improved stability, reproducibility and high efficiency. Energy & Environmental Science. 9 (6), 1989-1997 (2016).
- Jeon, N. J., et al. Compositional engineering of perovskite materials for high-performance solar cells. Nature. 517 (7535), 476-480 (2015).
- Stranks, S. D., Snaith, H. J. Metal-halide perovskites for photovoltaic and light-emitting devices. Nature Nanotechnology. 10 (5), 391-402 (2015).
- Ma, L., et al. Carrier diffusion lengths of over 500 nm in lead-free perovskite CH3NH3SnI3 films. Journal of the American Chemical Society. 138 (44), 14750-14755 (2016).
- Dong, Q., et al. Electron-hole diffusion lengths> 175 μm in solution grown CH3NH3PbI3 single crystals. Science. 347 (6225), 967-970 (2015).
- Stranks, S. D., et al. Electron-Hole Diffusion Lengths Exceeding 1 Micrometer in an Organometal Trihalide Perovskite Absorber. Science. 342 (6156), 341-344 (2013).
- Shi, D., et al. Low trap-state density and long carrier diffusion in organolead trihalide perovskite single crystals. Science. 347 (6221), 519-522 (2015).
- McMeekin, D. P., et al. A mixed-cation lead mixed-halide perovskite absorber for tandem solar cells. Science. 351 (6269), 151-155 (2016).
- Saidaminov, M. I., et al. High-quality bulk hybrid perovskite single crystals within minutes by inverse temperature crystallization. Nature Communications. 6, 7586 (2015).
- Kovalenko, M. V., Protesescu, L., Bodnarchuk, M. I. Properties and potential optoelectronic applications of lead halide perovskite nanocrystals. Science. 358 (6364), 745-750 (2017).
- Akkerman, Q. A., Rainò, G., Kovalenko, M. V., Manna, L. Genesis, challenges and opportunities for colloidal lead halide perovskite nanocrystals. Nature Materials. 17, 394-405 (2018).
- Gangishetty, M. K., Hou, S., Quan, Q., Congreve, D. N. Reducing Architecture Limitations for Efficient Blue Perovskite Light-Emitting Diodes. Advanced Materials. 30 (20), 1706226 (2018).
- Congreve, D. N., et al. Tunable Light-Emitting Diodes Utilizing Quantum-Confined Layered Perovskite Emitters. ACS Photonics. 4 (3), 476-481 (2017).
- Kumar, S., et al. Ultrapure Green Light-Emitting Diodes Using Two-Dimensional Formamidinium Perovskites: Achieving Recommendation 2020 Color Coordinates. Nano Letters. 17 (9), 5277-5284 (2017).
- Kumar, S., et al. Efficient blue electroluminescence using quantum-confined two-dimensional perovskites. ACS Nano. 10 (10), 9720-9729 (2016).
- Pan, J., et al. Bidentate Ligand-Passivated CsPbI3 Perovskite Nanocrystals for Stable Near-Unity Photoluminescence Quantum Yield and Efficient Red Light-Emitting Diodes. Journal of the American Chemical Society. 140 (2), 562-565 (2018).
- Kim, Y. H., et al. Multicolored organic/inorganic hybrid perovskite light-emitting diodes. Advanced Materials. 27 (7), 1248-1254 (2015).
- Pan, J., et al. Highly Efficient Perovskite-Quantum-Dot Light-Emitting Diodes by Surface Engineering. Advanced Materials. 28 (39), 8718-8725 (2016).
- Tsai, H., et al. Stable Light-Emitting Diodes Using Phase-Pure Ruddlesden–Popper Layered Perovskites. Advanced Materials. 30 (6), 1704217 (2018).
- Sutherland, B. R., Hoogland, S., Adachi, M. M., Wong, C. T., Sargent, E. H. Conformal organohalide perovskites enable lasing on spherical resonators. ACS Nano. 8 (10), 10947-10952 (2014).
- Deschler, F., et al. High photoluminescence efficiency and optically pumped lasing in solution-processed mixed halide perovskite semiconductors. The Journal of Physical Chemistry Letters. 5 (8), 1421-1426 (2014).
- Zhu, H., et al. Lead halide perovskite nanowire lasers with low lasing thresholds and high quality factors. Nature Materials. 14 (6), 636-642 (2015).
- Fang, Y., Huang, J. Resolving weak light of sub-picowatt per square centimeter by hybrid perovskite photodetectors enabled by noise reduction. Advanced Materials. 27 (17), 2804-2810 (2015).
- Shen, L., et al. A Self-Powered, Sub-nanosecond-Response Solution-Processed Hybrid Perovskite Photodetector for Time-Resolved Photoluminescence-Lifetime Detection. Advanced Materials. 28 (48), 10794-10800 (2016).
- Dou, L., et al. Solution-processed hybrid perovskite photodetectors with high detectivity. Nature Communications. 5, 5404 (2014).
- Protesescu, L., et al. Nanocrystals of Cesium Lead Halide Perovskites (CsPbX(3), X = Cl, Br, and I): Novel Optoelectronic Materials Showing Bright Emission with Wide Color Gamut. Nano Letters. 15 (6), 3692-3696 (2015).
- Schmidt, L. C., et al. Nontemplate synthesis of CH3NH3PbBr3 perovskite nanoparticles. Journal of the American Chemical Society. 136 (3), 850-853 (2014).
- Imran, M., et al. Shape-Pure, Nearly Monodispersed CsPbBr3 Nanocubes Prepared Using Secondary Aliphatic Amines. Nano Letters. 18 (12), 7822-7831 (2018).
- Dong, Y., et al. Precise Control of Quantum Confinement in Cesium Lead Halide Perovskite Quantum Dots via Thermodynamic Equilibrium. Nano Letters. 18 (6), 3716-3722 (2018).
- Sun, S., Yuan, D., Xu, Y., Wang, A., Deng, Z. Ligand-mediated synthesis of shape-controlled cesium lead halide perovskite nanocrystals via reprecipitation process at room temperature. ACS Nano. 10 (3), 3648-3657 (2016).
- Zhang, D., Eaton, S. W., Yu, Y., Dou, L., Yang, P. Solution-phase synthesis of cesium lead halide perovskite nanowires. Journal of the American Chemical Society. 137 (29), 9230-9233 (2015).
- Weidman, M. C., Goodman, A. J., Tisdale, W. A. Colloidal halide perovskite nanoplatelets: An exciting new class of semiconductor nanomaterials. Chemistry of Materials. 29 (12), 5019-5030 (2017).
- Sichert, J. A., et al. Quantum Size Effect in Organometal Halide Perovskite Nanoplatelets. Nano Letters. 15 (10), 6521-6527 (2015).
- Bohn, B. J., et al. Boosting Tunable Blue Luminescence of Halide Perovskite Nanoplatelets through Postsynthetic Surface Trap Repair. Nano Letters. 18 (8), 5231-5238 (2018).
- Weidman, M. C., Seitz, M., Stranks, S. D., Tisdale, W. A. Highly Tunable Colloidal Perovskite Nanoplatelets Through Variable Cation, Metal, and Halide Composition. ACS Nano. 10 (8), 7830-7839 (2016).
- Bekenstein, Y., Koscher, B. A., Eaton, S. W., Yang, P., Alivisatos, A. P. Highly Luminescent Colloidal Nanoplates of Perovskite Cesium Lead Halide and Their Oriented Assemblies. Journal of the American Chemical Society. 137 (51), 16008-16011 (2015).
- Shamsi, J., et al. Colloidal synthesis of quantum confined single crystal CsPbBr3 nanosheets with lateral size control up to the micrometer range. Journal of the American Chemical Society. 138 (23), 7240-7243 (2016).
- Vybornyi, O., Yakunin, S., Kovalenko, M. V. Polar-solvent-free colloidal synthesis of highly luminescent alkylammonium lead halide perovskite nanocrystals. Nanoscale. 8 (12), 6278-6283 (2016).
- Huang, H., et al. Colloidal lead halide perovskite nanocrystals: synthesis, optical properties and applications. NPG Asia Materials. 8 (11), e328 (2016).
- Tyagi, P., Arveson, S. M., Tisdale, W. A. Colloidal Organohalide Perovskite Nanoplatelets Exhibiting Quantum Confinement. J Phys Chem Lett. 6 (10), 1911-1916 (2015).
- Saidaminov, M. I., Mohammed, O. F., Bakr, O. M. Low-Dimensional-Networked Metal Halide Perovskites: The Next Big Thing. ACS Energy Letters. 2 (4), 889-896 (2017).
- Zheng, K., et al. Exciton binding energy and the nature of emissive states in organometal halide perovskites. The Journal of Physical Chemistry Letters. 6 (15), 2969-2975 (2015).
- Jurow, M. J., et al. Manipulating the Transition Dipole Moment of CsPbBr3 Perovskite Nanocrystals for Superior Optical Properties. Nano Letters. , (2019).
- Gao, Y., Weidman, M. C., Tisdale, W. A. CdSe Nanoplatelet Films with Controlled Orientation of their Transition Dipole Moment. Nano Letters. 17 (6), 3837-3843 (2017).
- Schuller, J. A., et al. Orientation of luminescent excitons in layered nanomaterials. Nature Nanotechnology. 8 (4), 271-276 (2013).
- Ha, S. K., Mauck, C. M., Tisdale, W. A. Towards Stable Deep-Blue Luminescent Colloidal Lead Halide Perovskite Nanoplatelets: Systematic Photostability Investigation. Chemistry of Materials. 31 (7), 2486-2496 (2019).
- Paritmongkol, W., Dahod, N., Mao, N., Zheng, S. L., Tisdale, W. Synthetic Variation and Structural Trends in Layered Two-Dimensional Alkylammonium Lead Halide Perovskites. ChemRxiv. , (2019).
- Stoumpos, C. C., et al. Ruddlesden–Popper hybrid lead iodide perovskite 2D homologous semiconductors. Chemistry of Materials. 28 (8), 2852-2867 (2016).
- Akkerman, Q. A., et al. Solution Synthesis Approach to Colloidal Cesium Lead Halide Perovskite Nanoplatelets with Monolayer-Level Thickness Control. Journal of the American Chemical Society. 138 (3), 1010-1016 (2016).
- Kojima, A., Teshima, K., Shirai, Y., Miyasaka, T. Organometal Halide Perovskites as Visible-Light Sensitizers for Photovoltaic Cells. Journal of the American Chemical Society. 131 (17), 6050-6051 (2009).
- Bischak, C. G., et al. Origin of reversible photoinduced phase separation in hybrid perovskites. Nano Letters. 17 (2), 1028-1033 (2017).
- Mauck, C. M., Tisdale, W. A. Excitons in 2D Organic–Inorganic Halide Perovskites. Trends in Chemistry. , (2019).
- Gong, X., et al. Electron-phonon interaction in efficient perovskite blue emitters. Nat. Mater. 17 (6), 550-556 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados