Method Article
Facile Synthese von kolloidalen BleiHalogenid Perowskit Nanoplättchen über Ligand-Assisted Reprecipitation
In diesem Artikel
Zusammenfassung
Diese Arbeit zeigt eine einfache Raumtemperatursynthese von kolloidalen quantengebundenen Bleihalogenidperowskinperowskit-Nanoplättchen mittels Liganden-unterstützter Repräzipitierungsmethode. Synthetisierte Nanoplättchen weisen spektral enge optische Merkmale und kontinuierliche spektrale Tunabilität im gesamten sichtbaren Bereich auf, indem sie die Zusammensetzung und die Dicken variieren.
Zusammenfassung
In dieser Arbeit zeigen wir eine einfache Methode für kolloidales Bleihalogenid Perowskit-Nanothromboletsynthese (Chemische Formel: L2[ABX3]n-1BX4, L: Butylammonium und Octylammonium, A: Methylammonium oder Formamidinium, B: Blei, X: Bromid und Jodid, n: Anzahl [BX6]4- Oktaederschichten in Richtung Nanothrombosedicke) über Liganden-unterstützte Repräzipitierung. Individuelle Perowskit-Vorläuferlösungen werden hergestellt, indem jedes Nanoplättchen-Konstituentensalz in N,N-Dimethylformamid (DMF), einem polaren organischen Lösungsmittel, gelöst und anschließend in spezifischen Verhältnissen für gezielte Nanoplättchendicke und -zusammensetzung gemischt wird. Sobald die gemischte Vorläuferlösung in unpolares Toluol abgeworfen wird, induziert die abrupte Veränderung der Löslichkeit die sofortige Kristallisation von Nanoplättchen mit oberflächengebundenen Alkylammoniumhalogenid-Liganden, die kolloidale Stabilität bieten. Photolumineszenz- und Absorptionsspektren zeigen emissive und stark quantenbeschränkte Merkmale. Röntgenbeugung und Transmissionselektronenmikroskopie bestätigen die zweidimensionale Struktur der Nanoplättchen. Darüber hinaus zeigen wir, dass die Bandlücke von Perowskit-Nanoplättchen kontinuierlich im sichtbaren Bereich gestimmt werden kann, indem die Stoichiometrie des Halid-Ions(s) variiert wird. Schließlich zeigen wir die Flexibilität der Liganden-unterstützten Repräzipitierungsmethode, indem wir mehrere Arten als oberflächenverdeckende Liganden einführen. Diese Methode stellt ein einfaches Verfahren zur Vorbereitung von Dispersionen von emissiven 2D-kolloidalen Halbleitern dar.
Einleitung
In den letzten zehn Jahren hat die Herstellung von Bleihalogenid perovskites Solarzellen1,2,3,4,5,6 die ausgezeichneten Eigenschaften dieser Halbleitermaterial, einschließlich langer Trägerdiffusionslängen7,8,9,10, kompositorische Tunabilität4,5,11 und kostengünstige Synthese12. Insbesondere die Einzigartigkeit der Fehlertoleranz13,14 macht Bleihalogenidperowskite grundlegend anders als andere Halbleiter und damit vielversprechend für optoelektronische Anwendungen der nächsten Generation.
Neben Solarzellen, Bleihalogenid Perowskite haben gezeigt, dass ausgezeichnete optoelektronische Geräte wie Leuchtdioden6,15,16,17,18, 19,20,21,22, Laser23,24,25und Photodetektoren26,27, 28. Insbesondere bei Der Präparation in Form von kolloidalen Nanokristallen18,29,30,31,32,33,34, 35,36,37,38,39,40,41,42,43, blei HalidePerowskite können starke Quanten- und Dielektrizitäts-Eingrenzung, große Exzitonbindungsenergie44,45und helle Lumineszenz17,19 zusammen mit einer einfachen Lösung aufweisen Verarbeitbarkeit. Verschiedene gemeldete Geometrien einschließlich Quantenpunkte29,30,31,32, Nanostäbchen33,34 und Nanoplättchen18, 35,36,37,38,39,40,41,43 weiter demonstrieren die Form-Tunbarkeit von Bleihalogenid Perowskit-Nanokristallen.
Unter diesen Nanokristallen sind kolloidale zweidimensionale (2D) Bleihalogenidperowskiter oder "Perowskit-Nanoplättchen" besonders vielversprechend für lichtemittierende Anwendungen aufgrund der starken Einschließung von Ladungsträgern, große Exzitonbindungsenergie, die bis zu Hunderten von meV44und spektral schmale Emission von dicken-reinen Ensembles von Nanoplättchen39. Darüber hinaus zeigt die anisotrope Emission, die für 2D-Perowskit-Nanokristalle46 und andere 2D-Halbleiter47,48 gemeldet wurde, das Potenzial der Maximierung der Auskopplungseffizienz von Perowskit-Nanoplopenit-basierten Licht emittierende Geräte.
Hier zeigen wir ein Protokoll zur einfachen, universellen Raumtemperatursynthese von kolloidalen Bleihalogenidperowskin-Nanoplättchen über eine Liganden-unterstützte Repräzipitierungstechnik36,38,49. Perowskit-Nanoplättchen mit Jod- und/oder Bromidhalogenid-Anionen, Methylammonium- oder Formamidinium-organischen Kationen und variablen organischen Oberflächenligaden werden nachgewiesen. Es werden Verfahren zur Kontrolle der Absorptions- und Emissionsenergie und der Dickenreinheit der kolloidalen Dispersion diskutiert.
Protokoll
ANMERKUNG: Von hier aus werden einfachere Notationen von 'n = 1 BX' und 'n = 2 ABX' anstelle der komplexen chemischen Formel von L2BX4 und L2[ABX3]BX4" verwendet. Für eine bessere Stabilität und optische Eigenschaften der resultierenden Perowskit-Nanoplättchen wird empfohlen, das gesamte Verfahren unter inerten Bedingungen49 (d. h. einem Stickstoffhandschuhkasten) abzuschließen.
1. Herstellung der Perowskit-Nanoplättler-Vorläuferlösung
- Herstellung von 0,2 M-Lösungen von Methylammoniumbromid (MABr), Formamidiniumbromid (FABr), Bleibromid (PbBr2), Butylammoniumbromid (BABr), Octylammoniumbromid (OABr), Methylammoniumiodid (MAI), Formamidiniumiodid (FAI), Blei Iodid (PbI2), Butylammoniumjodid (BAI) und Octylammoniumiodid (OAI) in N,N-Dimethylformamid (DMF) entweder durch Auflösen jedes Salzes in DMF oder durch Verdünnung kommerziell erhältlicher Lösungen.
- PbBr2 ist in DMF bei Raumtemperatur nicht leicht löslich, halten Sie die Lösung bei 80 °C für 10 min oder länger für eine vollständige Auflösung. Nach dem Lösen die Lösung vor Gebrauch wieder auf Raumtemperatur abkühlen lassen.
HINWEIS: Die Konzentration einzelner Vorläuferlösungen kann erhöht werden, um mehr Nanoplättchen zu synthetisieren, aber die maximale Konzentration wird in der Regel durch die Löslichkeiten von PbBr2 und PbI2 in DMF begrenzt.
- PbBr2 ist in DMF bei Raumtemperatur nicht leicht löslich, halten Sie die Lösung bei 80 °C für 10 min oder länger für eine vollständige Auflösung. Nach dem Lösen die Lösung vor Gebrauch wieder auf Raumtemperatur abkühlen lassen.
- Mischen Sie diese einzelnen Vorläuferlösungen in spezifischen volumetrischen Verhältnissen für jede Zieldicke und -zusammensetzung.
- Um nur Bromid- oder Iodid-Nanoplättchen zu synthetisieren, siehe Tabelle 1, in der die volumetrischen Verhältnisse für n = 1 und n = 2 Bromid- und Jodid-Nanoplättchen zusammengefasst werden.
- Um Nanoplättchen mit gemischten Halogenidzusammensetzungen zu synthetisieren, kombinieren Sie reine Bromid- und Iodid-Perowskit-Perowskit-Nanoplättchen-Vorläuferlösungen gleicher Dicke bei gewünschtem Volumenverhältnis für die Zielzusammensetzung. Um beispielsweise 30%-Bromid-70%-iodid n = 2 Perowskit-Nanoplättchen herzustellen, mischen Sie die Vorläuferlösungen von n = 2 MAPbBr und n = 2 MAPbI mit einem Volumenverhältnis von 3:7.
HINWEIS: Die Änderung des organischen Kationes hat keinen signifikanten Einfluss auf die optischen Übergangsenergien13. Absorption und Lumineszenz werden in erster Linie durch Veränderung der Halogenidzusammensetzung oder Nanoplättletdicke abgestimmt.
2. Synthese von Perowskit-Nanoplättchen über Liganden-unterstützte Repräzipitationsmethode
- Injizieren Sie 10 l gemischte Vorläuferlösung in 10 ml Toluluus unter kräftigem Rühren. Nanoplättchen kristallisieren durch die abrupte Veränderung der Löslichkeit sofort.
ANMERKUNG: Die Menge der in Toluol injizierten gemischten Vorläuferlösung kann bis zu 100 l erhöht werden. Die Gesamtmenge der injizierten Vorläuferlösung und die Injektionsgeschwindigkeit scheinen die Perowskit-Nanothrombosmorphologie nicht signifikant zu beeinflussen (Abbildung S1). Die Injektion von zu viel DMF erhöht jedoch die Polarität der Lösung und reduziert die Kristallisation. - Lassen Sie die Lösung 10 min unter Rühren, bis keine weiteren Farbänderungen von der Lösung beobachtet werden, um eine vollständige Kristallisation der Perowskit-Nanoplättchen zu gewährleisten.
HINWEIS: Frisch synthetisierte Perowskit-Nanoplättchen aus frisch zubereiteten Vorläuferlösungen zeigen in der Regel die beste Photolumineszenz-Quantenausbeute und Photostabilität49. Und im Laufe der Zeit werden Nanoplättchen langsam aggregieren (Abbildung S2), verschlechterung die kolloidale Stabilität. Daher wird empfohlen, Nanoplättlet-Lösungen so schnell wie möglich zu verwenden, sobald sie synthetisiert sind.
3. Charakterisierung Probenvorbereitung und Reinigung der kolloidalen Perowskit-Nanoplättigenlösung.
-
Probenvorbereitung (Transmission Electron Microscopy) (TEM).
- Zentrifugieren Sie die Lösung bei 2050 x g für 10 min.
- Entsorgen Sie den Überstand.
- Die Nanoplättchen in 1 ml Toluen redisperse.
- Drop 1 Tröpfchen auf einem TEM-Raster.
- Trocknen Sie die Probe unter Vakuum.
-
Röntgenbeugung (XRD) Probenvorbereitung
- Zentrifugieren Sie die Lösung bei 2050 x g für 10 min.
- Entsorgen Sie den Überstand.
- Die Nanoplättchen in 30 l Toluin redisperse.
- Dropcast auf einer Glasrutsche.
- Trocknen Sie die Probe unter Vakuum.
-
Allgemeine Reinigung
- Zentrifugieren Sie die Lösung bei 2050 x g für 10 min.
- Entsorgen Sie den Überstand.
- Dispergieren Sie die Nanoplättchen in der gewünschten Menge an Lösungsmittel in Abhängigkeit von der Verwendung.
HINWEIS: Je nach Verwendung von Nanoplättchen kann das Volumen des Redispersing-Lösungsmittels frei eingestellt und andere unpolare organische Lösungsmittel wie Hexan, Oktan oder Chlorbenzol anstelle von Toluol verwendet werden.
Ergebnisse
Die schematische Darstellung von Perowskit-Nanoplättchen und Syntheseverfahren gibt einen Überblick über das Material und die synthetischen Details (Abbildung 1). Bilder von kolloidalen Perowskit-Nanoplättchenlösungen unter Umgebungslicht und UV (Abbildung 2), kombiniert mit Photolumineszenz- und Absorptionsspektren (Abbildung 3) bestätigen die emissive und absorptive Natur von Nanoplättchen. TEM-Bilder (Abbildung 4) und XRD-Muster (Abbildung 5) werden verwendet, um die seitlichen Abmessungen bzw. Stapelabstände von Nanoplättchen zu schätzen und gleichzeitig die zweidimensionale Struktur zu bestätigen. Absorptionsspektren von Perowskit-Nanoplätttenlösungen mit gemischten Halogeniden zeigen Diekbarkeit der Bandlücke (Abbildung 6). Die Unempfindlichkeit des Photolumineszenzspektrums gegenüber der chemischen Identität organischer Oberflächenverschlussligaden unterstreicht die kompositorische Flexibilität dieser Materialien (Abbildung 7).
| MABr | FABr | PbBr2 | BABr | OABr | MAI | Fai | PbI2 | Bai | Oai | |
| n=1 PbBr | 0 | 0 | 1 | 1 | 1 | 0 | 0 | 0 | 0 | 0 |
| n=2 FAPbBr | 0 | 1 | 2 | 5 | 5 | 0 | 0 | 0 | 0 | 0 |
| n=2 MAPbBr | 1 | 0 | 2 | 5 | 5 | 0 | 0 | 0 | 0 | 0 |
| n=1 PbI | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 1 | 1 |
| n=2 FAPbI | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 2 | 5 | 5 |
| n=2 MAPbI | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 2 | 5 | 5 |
Tabelle 1. Formulierungsrichtlinien für Perowskit-Nanothrombose-Vorläuferlösungen.
Zahlen in der Tabelle geben die volumetrischen Äquivalente jeder Vorläuferlösung (Spalten) an, die kombiniert werden sollten, um das angestrebte Nanoplättchen (Zeilen) gemäß den Konzentrationsspezifikationen im Protokolltext zu erreichen.

Abbildung 1. Perowskit Nanoplättchen Struktur und Syntheseverfahren.
(a) Abbildung der Perowskit-Einheitszelle und Nanothrombozytenstruktur. (b) Schematische Darstellung der kolloidalen Perowskit-Nanothrombose. Nachdruck (angepasst) mit Genehmigung von Ref. 48. Copyright 2019 American Chemical Society. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2. Kolloidale Perowskit-Nanoplättigenlösungen, die durch UV-Licht beleuchtet werden.
Die Emission der Nanoplättchen ist entlang des Strahlweges deutlich zu sehen. Nachdruck (angepasst) mit Genehmigung von Ref. 48. Copyright 2019 American Chemical Society. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
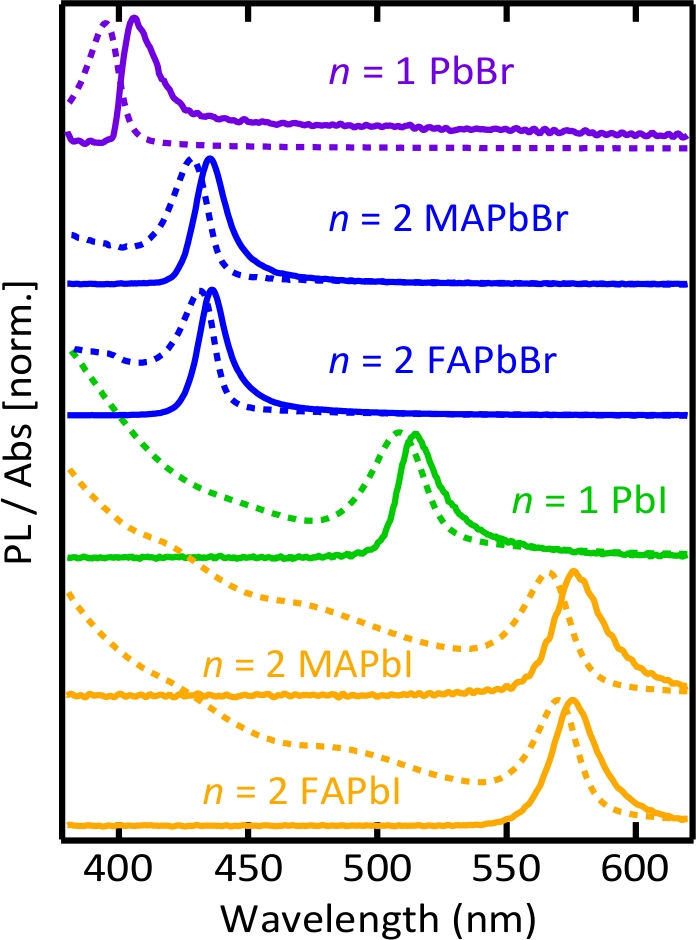
Abbildung 3. Photolumineszenz- und Absorptionsspektren kolloidaler Perowskit-Nanoplätttenlösungen.
Bandgap der Nanoplättchen kann mit Dicke und Zusammensetzung abgestimmt werden. Langpassfilter (Cut-on-Wellenlänge: 400 nm) wurde verwendet, um AnregungUV-Licht vor der Photolumineszenz-Spektrum-Sammlung herauszufiltern und es könnte leicht verändert n = 1 Bleibromid Nanoplätt Emissionsspektrum.

Abbildung 4. Transmissionselektronenmikroskopie (TEM) Bilder von Perowskit-Nanoplättchen.
Bilder zeigen zufällig überlappende Nanoplättchen. Siehe auch Abbildung S7. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
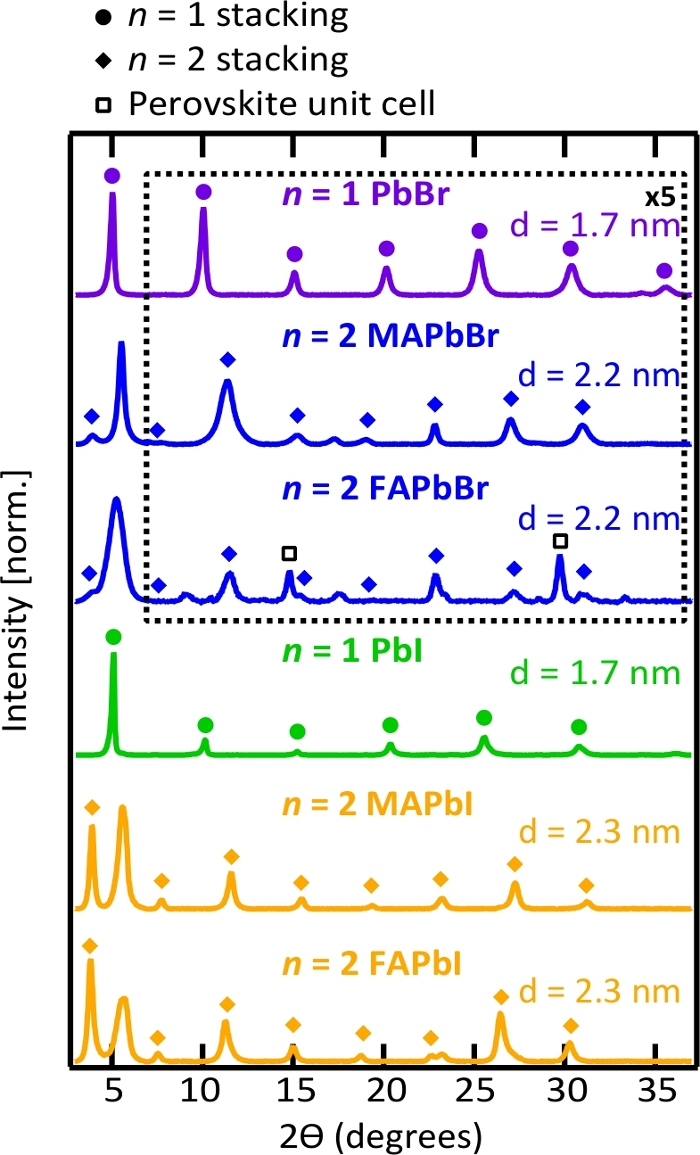
Abbildung 5. Röntgenbeugungsmuster (XRD) und D-Abstände von Perowskit-Nanoplättchen.
XRD-Muster werden von Nanoplättchen-Stapelspitzen dominiert, die die zweidimensionale Natur der Nanoplättchen und ihre face-to-face-Selbstmontage in Dropcasted-Filmen bestätigen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
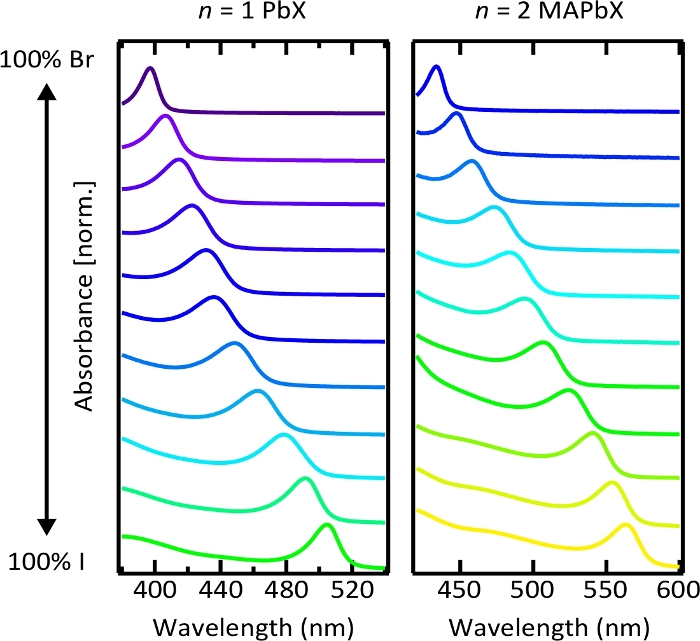
Abbildung 6. Absorptionsspektren kolloidaler Perowskit-Nanoplätt-Lösungen mit gemischten Halogeniden.
Kontinuierliche Verschiebung der ersten exzitonischen Absorptionsmerkmale zeigt Bandgap-Tunabilität mit Halogenid-Zusammensetzung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
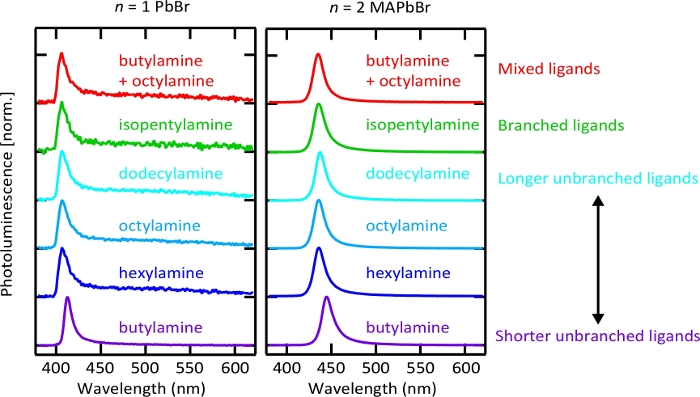
Abbildung 7. Photolumineszenzspektren von n = 1 PbBr und n = 2 MAPbBr Nanoplättchen, die mit verschiedenen Ligandenarten synthetisiert werden.
Die Rezipitungsmethode kann leicht auf andere Ligandenchemikalien ausgedehnt werden. Siehe auch Tabelle S2 für Formulierungsrichtlinien. Langpassfilter (Cut-on-Wellenlänge: 400 nm) wurde verwendet, um AnregungUV-Licht vor der Photolumineszenz-Spektrum-Sammlung herauszufiltern und es könnte leicht verändert n = 1 Bleibromid Nanoplätt Emissionsspektrum. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Datei. Unterstützende Informationen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Das Produkt dieser Synthese sind kolloidale Bleihalogenid-Nanoplättchen, die von Alkylammoniumhalogenid-Oberflächenliganden gekrönt werden (Abbildung 1a). Abbildung 1b zeigt das synthetische Verfahren der kolloidalen Perowskit-Nanoplättchen über Liganden-unterstützte Rezipit. Zusammenfassend lässt sich sagen, dass konstituierende Vorläufersalze in einem polaren Lösungsmittel DMF in spezifischen Verhältnissen für die gewünschte Dicke und Zusammensetzung gelöst und dann in Dasolol injiziert wurden, das unpolar ist. Aufgrund der abrupten Änderung der Löslichkeit begannen kolloidale Perowskit-Nanoplättchen sofort zu kristallisieren. Bei der Herstellung der gemischten Vorläuferlösung bestimmten die Verhältnisse zwischen den konstituierenden Vorläufern in erster Linie die Dicke der resultierenden Nanoplättchen (Abbildung S3), und das Vorhandensein von überschüssigen Liganden in der Vorläuferlösung war entscheidend, um sicherzustellen, dass die Dicke Homogenität des Produkts (Abbildung S4). Im Allgemeinen kann jedes polare Lösungsmittel verwendet werden, um Perowskit-Vorläufersalze aufzulösen, während jedes unpolare Lösungsmittel verwendet werden kann, um kolloidale Nanoplättchen zu dispergieren. Die Mischbarkeit dieser unpolaren und polaren Lösungsmittel ist jedoch entscheidend für die homogene Synthese von kolloidalen Perowskit-Nanoplättchen, und daher haben wir uns für DMF und Toluol entschieden. Außerdem ist es wichtig, unpolares Lösungsmittel in großem Überschuss an dem zugesetzten polaren Lösungsmittel zu haben, damit die Kristallisation von Perowskit-Nanoplättchen auftritt. Die Zugabe von zu viel polarem Lösungsmittel erhöht die Polarität des resultierenden Lösungsmittelgemisches (z.B. DMF + Toluol), das die Nanoplättchen auflösen kann. Chlorid- und Cäsium-integrierende Nanopatele können auch durch diesen Ansatz synthetisiert werden (Abbildung S5), obwohl die chloridhaltigen Nanoplättchen nicht fehlenundd sind und die Cäsium-basierten Nanoplättchen unter geringerer Stabilität und Dicke leiden. Homogenität im Verhältnis zu den Methylammonium-basierten Nanoplättchen bei der Synthese über diese Methode38. Schließlich stellen wir fest, dass nur die n = 1 und n = 2 Elemente mit guter Dicke Homogenität durch diese Methode synthetisiert wurden; Versuche, dickere(n 3) Nanoplättchen herzustellen, ergeben in der Regel gemischte Streuungen (Abbildung S6).
Abbildung 2 zeigt die Bilder von as-synthetisierten kolloidalen Perowskit-Nanoplättchenlösungen, die durch UV-Licht beleuchtet werden, wo die Emission der Nanoplättchen entlang des Strahlwegs deutlich zu sehen ist. Abbildung 3 zeigt die normalisierte Photolumineszenz (PL) und Absorptionsspektren kolloidaler Perowskit-Nanothromboletslösungen, die mit früheren Berichtenübereinstimmen 37,38,50,51 , der die Abstimmbarkeit von Perowskit-Nanoplättchen mit Dicke und Konstituenten zeigt. Bei allen Nanoplättchen wurden aufgrund einer starken Quanten- und Dielektrikumsbeschränkung starke exzitonische Merkmale in den Absorptionsspektren und eine signifikante Blauverschiebung der Spektren im Vergleich zu Massenperowskiten35 beobachtet. Die Umwandlung des organischen Kationen von Methylammonium zu Formamidinium hatte keinen signifikanten Einfluss auf die Bandlücke – weder bei Bromid- noch bei Jodid-Nanoplättchen – im Einvernehmen mit dem Verständnis der valenzelektronischen Struktur in Bleihalogenidperowskiten13 . Tabelle S1 fasst die Photolumineszenzquantenausbeute (PLQYs) dieser kolloidalen Perowskit-Nanoplätttenlösungen zusammen.
Die zweidimensionale Struktur der Perowskit-Nanoplättchen wurde durch TEM und XRD bestätigt. In Abbildung 4zeigen TEM-Bilder teilweise überlappende zweidimensionale Perowskit-Nanoplättchen mit individuellen seitlichen Abmessungen von wenigen hundert Nanometern bis zu einem Mikrometer. Der Bildkontrast und die zufällige Konfiguration von Nanoplättchen im TEM-Raster deuten darauf hin, dass sie in Lösung als einzelne Platten verteilt werden – und nicht als gestapelte Lamellenkristalle. Kleine, dunkle kugelförmige Punkte erschienen bei der Elektronenstrahlbestrahlung, wie in Abbildung 4beobachtet, und es wird angenommen, dass sie metallische Pb wie zuvor berichtet36,52. Aufgrund der großen seitlichen Abmessungen von Perowskit-Nanoplopenlagen lagen sie bevorzugt flach übereinander, wenn sie in eine Folie gegossen wurden, und periodische Stapelspitzen dominierten das XRD-Muster, wie in Abbildung 5 dargestellt. Wenn man bedenkt, dass die Gitterkonstante für die zelle der kubischen Perowskiteinheit 0,6 nm53 beträgt,lässt sich daraus ableiten, dass die organische Ligandenschicht in gestapelten Nanoplättchenfilmen unabhängig von der Nanoplättchenart381 nm dick ist.
Die Absorption und Emissionsresonanz konnte kontinuierlich durch Variation der Halogenidzusammensetzung gestimmt werden. Abbildung 6 zeigt die normalisierten Absorptionsspektren von kolloidalen n = 1 PbX und n = 2 MAPbX Nanothromboletlösungen mit unterschiedlichen Verhältnissen von Bromid und Jod. Klare exzitonische Absorptionsspitzen deuten auf eine starke Einschließung von Trägern in Nanoplättchen hin, und die kontinuierliche Verschiebung dieser Spitzen mit Halogenidzusammensetzung zeigt die Bandspalt-Tunabilität durch Halid-Zusammensetzungsvariation (Abbildung S8). Photolumineszenzspektren von Mischhalogenid-Nanoplättchen weisen jedoch breite oder mehrere Merkmale auf (Abbildung S9), was möglicherweise auf eine photoinduzierte Halogenid-Trennung zurückzuführen ist. 54
Die Liganden-unterstützte Repräzipitationsmethode ist besonders geeignet, die Identität des langkettigen Verschlussliganden zu ändern, wie in Abbildung 7dargestellt. Dies eröffnet die Möglichkeit, die Natur der oberflächengebundenen organischen Arten auf die optimierte Leistung eines bestimmten Geräts oder einer Anwendung55zu optimieren. Wir stellen jedoch fest, dass die Verhältnisse zwischen den einzelnen Vorläufern bei der Verwendung neuer Ligandenarten für die beste Dickehomogenität des resultierenden Systems leicht angepasst werden müssen(Abbildung S10 und Tabelle S2).
Zusammenfassend haben wir eine einfache, vielseitige Methode zur Synthese von kolloidalem Bleihalogenid Perowskit-Nanoplättchen unterschiedlicher Zusammensetzung gezeigt (Abbildung S11). Der Liganand-unterstützte Repräzipationsansatz ist potenziell für eine Hochdurchsatzsynthese und weitere datengesteuerte Analysen geeignet. Dicke-, Zusammensetzungs- und Liganden-Tunabilität können ohne wesentliche Änderungen in den synthetischen Protokollen erreicht werden. In Zukunft wäre es wünschenswert, die Photolumineszenzeffizienz weiter auf ein Niveau zu erhöhen, das anderen Perowskit-Nanokristallen29,32,56entspricht.
Offenlegungen
Die Autoren erklären keine konkurrierenden finanziellen Interessen.
Danksagungen
Diese Arbeit wurde vom U.S. Department of Energy, Office of Science, Basic Energy Sciences (BES) unter der Nummer DE-SC0019345 unterstützt. Seung Kyun Ha wurde teilweise vom Stipendium der Kwanjeong Education Foundation Overseas Doctoral Program unterstützt. Diese Arbeit stützte sich auf die MRSEC Shared Experimental Facilities am MIT, unterstützt von der National Science Foundation unter der Nummer DMR-08-19762. Wir danken Eric Powers für die Unterstützung beim Nachweis und der Bearbeitung.
Materialien
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 365nm fiber-coupled LED | Thorlabs | M365FP1 | Excitation source (Photoluminescence) |
| Avantes fiber-optic spectrometer | Avantes | AvaSpec-2048XL | Photoluminescence detector (Photoluminescence spectra) |
| Cary 5000 | Agilent Technologies | UV-Vis spectrophotometer (Absorption spectra) | |
| FEI Tecnai G2 Spirit Twin TEM | FEI Company | Transmission electron microscopy (TEM) operating at 120kV | |
| PANalytical X'Pert Pro MPD | Malvern Panalytical | X-ray diffraction (XRD) operating at 45 kV and 40 mA with a copper radiation source. | |
| Materials | |||
| n-butylammonium bromide (BABr) | GreatCell Solar | MS305000-50G | |
| n-butylammonium chloride (BACl) | Fisher Scientific | B071025G | butylamine hydrochloride |
| n-butylammonium iodide (BAI) | Sigma-Aldrich | 805874-25G | |
| N,N-dimethylforamide (DMF) | Sigma-Aldrich | 227056-1L | Anhydrous, 99.8% |
| n-dodecylammonium bromide (DDABr) | GreatCell Solar | MS300880-05 | |
| formamidinium bromide (FABr) | GreatCell Solar | MS350000-100G | |
| formamidinium iodide (FAI) | GreatCell Solar | MS150000-100G | |
| n-hexylammonium bromide (HABr) | GreatCell Solar | MS300860-05 | |
| lead bromide (PbBr2) | Sigma-Aldrich | 398853-5G | .99.999% |
| lead chloride (PbCl2) | Sigma-Aldrich | 268-690-5G | 98% |
| lead iodide (PbI2) solution | Sigma-Aldrich | 795550-10ML | 0.55M in DMF |
| methylammonium bromide (MABr) | GreatCell Solar | MS301000-100G | |
| methylammonium iodide (MAI) | GreatCell Solar | MS101000-100G | |
| n-octylammonium bromide (OABr) | GreatCell Solar | MS305500-50G | |
| n-octylammonium chloride (OACl) | Fisher Scientific | O04841G | octylamine hydrochloride |
| n-octylammonium iodide (OAI) | GreatCell Solar | MS105500-50G | |
| iso-pentylammonium bromide (i-PABr) | GreatCell Solar | MS300710-05 | |
| toluene | Sigma-Aldrich | 244511-1L | Anhydrous, 99.8% |
Referenzen
- Kim, H. S., et al. Lead iodide perovskite sensitized all-solid-state submicron thin film mesoscopic solar cell with efficiency exceeding 9%. Scientific Reports. 2, 591 (2012).
- Zhou, H., et al. Interface engineering of highly efficient perovskite solar cells. Science. 345 (6196), 542-546 (2014).
- Yang, W. S., et al. Iodide management in formamidinium-lead-halide–based perovskite layers for efficient solar cells. Science. 356 (6345), 1376-1379 (2017).
- Saliba, M., et al. Cesium-containing triple cation perovskite solar cells: improved stability, reproducibility and high efficiency. Energy & Environmental Science. 9 (6), 1989-1997 (2016).
- Jeon, N. J., et al. Compositional engineering of perovskite materials for high-performance solar cells. Nature. 517 (7535), 476-480 (2015).
- Stranks, S. D., Snaith, H. J. Metal-halide perovskites for photovoltaic and light-emitting devices. Nature Nanotechnology. 10 (5), 391-402 (2015).
- Ma, L., et al. Carrier diffusion lengths of over 500 nm in lead-free perovskite CH3NH3SnI3 films. Journal of the American Chemical Society. 138 (44), 14750-14755 (2016).
- Dong, Q., et al. Electron-hole diffusion lengths> 175 μm in solution grown CH3NH3PbI3 single crystals. Science. 347 (6225), 967-970 (2015).
- Stranks, S. D., et al. Electron-Hole Diffusion Lengths Exceeding 1 Micrometer in an Organometal Trihalide Perovskite Absorber. Science. 342 (6156), 341-344 (2013).
- Shi, D., et al. Low trap-state density and long carrier diffusion in organolead trihalide perovskite single crystals. Science. 347 (6221), 519-522 (2015).
- McMeekin, D. P., et al. A mixed-cation lead mixed-halide perovskite absorber for tandem solar cells. Science. 351 (6269), 151-155 (2016).
- Saidaminov, M. I., et al. High-quality bulk hybrid perovskite single crystals within minutes by inverse temperature crystallization. Nature Communications. 6, 7586 (2015).
- Kovalenko, M. V., Protesescu, L., Bodnarchuk, M. I. Properties and potential optoelectronic applications of lead halide perovskite nanocrystals. Science. 358 (6364), 745-750 (2017).
- Akkerman, Q. A., Rainò, G., Kovalenko, M. V., Manna, L. Genesis, challenges and opportunities for colloidal lead halide perovskite nanocrystals. Nature Materials. 17, 394-405 (2018).
- Gangishetty, M. K., Hou, S., Quan, Q., Congreve, D. N. Reducing Architecture Limitations for Efficient Blue Perovskite Light-Emitting Diodes. Advanced Materials. 30 (20), 1706226 (2018).
- Congreve, D. N., et al. Tunable Light-Emitting Diodes Utilizing Quantum-Confined Layered Perovskite Emitters. ACS Photonics. 4 (3), 476-481 (2017).
- Kumar, S., et al. Ultrapure Green Light-Emitting Diodes Using Two-Dimensional Formamidinium Perovskites: Achieving Recommendation 2020 Color Coordinates. Nano Letters. 17 (9), 5277-5284 (2017).
- Kumar, S., et al. Efficient blue electroluminescence using quantum-confined two-dimensional perovskites. ACS Nano. 10 (10), 9720-9729 (2016).
- Pan, J., et al. Bidentate Ligand-Passivated CsPbI3 Perovskite Nanocrystals for Stable Near-Unity Photoluminescence Quantum Yield and Efficient Red Light-Emitting Diodes. Journal of the American Chemical Society. 140 (2), 562-565 (2018).
- Kim, Y. H., et al. Multicolored organic/inorganic hybrid perovskite light-emitting diodes. Advanced Materials. 27 (7), 1248-1254 (2015).
- Pan, J., et al. Highly Efficient Perovskite-Quantum-Dot Light-Emitting Diodes by Surface Engineering. Advanced Materials. 28 (39), 8718-8725 (2016).
- Tsai, H., et al. Stable Light-Emitting Diodes Using Phase-Pure Ruddlesden–Popper Layered Perovskites. Advanced Materials. 30 (6), 1704217 (2018).
- Sutherland, B. R., Hoogland, S., Adachi, M. M., Wong, C. T., Sargent, E. H. Conformal organohalide perovskites enable lasing on spherical resonators. ACS Nano. 8 (10), 10947-10952 (2014).
- Deschler, F., et al. High photoluminescence efficiency and optically pumped lasing in solution-processed mixed halide perovskite semiconductors. The Journal of Physical Chemistry Letters. 5 (8), 1421-1426 (2014).
- Zhu, H., et al. Lead halide perovskite nanowire lasers with low lasing thresholds and high quality factors. Nature Materials. 14 (6), 636-642 (2015).
- Fang, Y., Huang, J. Resolving weak light of sub-picowatt per square centimeter by hybrid perovskite photodetectors enabled by noise reduction. Advanced Materials. 27 (17), 2804-2810 (2015).
- Shen, L., et al. A Self-Powered, Sub-nanosecond-Response Solution-Processed Hybrid Perovskite Photodetector for Time-Resolved Photoluminescence-Lifetime Detection. Advanced Materials. 28 (48), 10794-10800 (2016).
- Dou, L., et al. Solution-processed hybrid perovskite photodetectors with high detectivity. Nature Communications. 5, 5404 (2014).
- Protesescu, L., et al. Nanocrystals of Cesium Lead Halide Perovskites (CsPbX(3), X = Cl, Br, and I): Novel Optoelectronic Materials Showing Bright Emission with Wide Color Gamut. Nano Letters. 15 (6), 3692-3696 (2015).
- Schmidt, L. C., et al. Nontemplate synthesis of CH3NH3PbBr3 perovskite nanoparticles. Journal of the American Chemical Society. 136 (3), 850-853 (2014).
- Imran, M., et al. Shape-Pure, Nearly Monodispersed CsPbBr3 Nanocubes Prepared Using Secondary Aliphatic Amines. Nano Letters. 18 (12), 7822-7831 (2018).
- Dong, Y., et al. Precise Control of Quantum Confinement in Cesium Lead Halide Perovskite Quantum Dots via Thermodynamic Equilibrium. Nano Letters. 18 (6), 3716-3722 (2018).
- Sun, S., Yuan, D., Xu, Y., Wang, A., Deng, Z. Ligand-mediated synthesis of shape-controlled cesium lead halide perovskite nanocrystals via reprecipitation process at room temperature. ACS Nano. 10 (3), 3648-3657 (2016).
- Zhang, D., Eaton, S. W., Yu, Y., Dou, L., Yang, P. Solution-phase synthesis of cesium lead halide perovskite nanowires. Journal of the American Chemical Society. 137 (29), 9230-9233 (2015).
- Weidman, M. C., Goodman, A. J., Tisdale, W. A. Colloidal halide perovskite nanoplatelets: An exciting new class of semiconductor nanomaterials. Chemistry of Materials. 29 (12), 5019-5030 (2017).
- Sichert, J. A., et al. Quantum Size Effect in Organometal Halide Perovskite Nanoplatelets. Nano Letters. 15 (10), 6521-6527 (2015).
- Bohn, B. J., et al. Boosting Tunable Blue Luminescence of Halide Perovskite Nanoplatelets through Postsynthetic Surface Trap Repair. Nano Letters. 18 (8), 5231-5238 (2018).
- Weidman, M. C., Seitz, M., Stranks, S. D., Tisdale, W. A. Highly Tunable Colloidal Perovskite Nanoplatelets Through Variable Cation, Metal, and Halide Composition. ACS Nano. 10 (8), 7830-7839 (2016).
- Bekenstein, Y., Koscher, B. A., Eaton, S. W., Yang, P., Alivisatos, A. P. Highly Luminescent Colloidal Nanoplates of Perovskite Cesium Lead Halide and Their Oriented Assemblies. Journal of the American Chemical Society. 137 (51), 16008-16011 (2015).
- Shamsi, J., et al. Colloidal synthesis of quantum confined single crystal CsPbBr3 nanosheets with lateral size control up to the micrometer range. Journal of the American Chemical Society. 138 (23), 7240-7243 (2016).
- Vybornyi, O., Yakunin, S., Kovalenko, M. V. Polar-solvent-free colloidal synthesis of highly luminescent alkylammonium lead halide perovskite nanocrystals. Nanoscale. 8 (12), 6278-6283 (2016).
- Huang, H., et al. Colloidal lead halide perovskite nanocrystals: synthesis, optical properties and applications. NPG Asia Materials. 8 (11), e328 (2016).
- Tyagi, P., Arveson, S. M., Tisdale, W. A. Colloidal Organohalide Perovskite Nanoplatelets Exhibiting Quantum Confinement. J Phys Chem Lett. 6 (10), 1911-1916 (2015).
- Saidaminov, M. I., Mohammed, O. F., Bakr, O. M. Low-Dimensional-Networked Metal Halide Perovskites: The Next Big Thing. ACS Energy Letters. 2 (4), 889-896 (2017).
- Zheng, K., et al. Exciton binding energy and the nature of emissive states in organometal halide perovskites. The Journal of Physical Chemistry Letters. 6 (15), 2969-2975 (2015).
- Jurow, M. J., et al. Manipulating the Transition Dipole Moment of CsPbBr3 Perovskite Nanocrystals for Superior Optical Properties. Nano Letters. , (2019).
- Gao, Y., Weidman, M. C., Tisdale, W. A. CdSe Nanoplatelet Films with Controlled Orientation of their Transition Dipole Moment. Nano Letters. 17 (6), 3837-3843 (2017).
- Schuller, J. A., et al. Orientation of luminescent excitons in layered nanomaterials. Nature Nanotechnology. 8 (4), 271-276 (2013).
- Ha, S. K., Mauck, C. M., Tisdale, W. A. Towards Stable Deep-Blue Luminescent Colloidal Lead Halide Perovskite Nanoplatelets: Systematic Photostability Investigation. Chemistry of Materials. 31 (7), 2486-2496 (2019).
- Paritmongkol, W., Dahod, N., Mao, N., Zheng, S. L., Tisdale, W. Synthetic Variation and Structural Trends in Layered Two-Dimensional Alkylammonium Lead Halide Perovskites. ChemRxiv. , (2019).
- Stoumpos, C. C., et al. Ruddlesden–Popper hybrid lead iodide perovskite 2D homologous semiconductors. Chemistry of Materials. 28 (8), 2852-2867 (2016).
- Akkerman, Q. A., et al. Solution Synthesis Approach to Colloidal Cesium Lead Halide Perovskite Nanoplatelets with Monolayer-Level Thickness Control. Journal of the American Chemical Society. 138 (3), 1010-1016 (2016).
- Kojima, A., Teshima, K., Shirai, Y., Miyasaka, T. Organometal Halide Perovskites as Visible-Light Sensitizers for Photovoltaic Cells. Journal of the American Chemical Society. 131 (17), 6050-6051 (2009).
- Bischak, C. G., et al. Origin of reversible photoinduced phase separation in hybrid perovskites. Nano Letters. 17 (2), 1028-1033 (2017).
- Mauck, C. M., Tisdale, W. A. Excitons in 2D Organic–Inorganic Halide Perovskites. Trends in Chemistry. , (2019).
- Gong, X., et al. Electron-phonon interaction in efficient perovskite blue emitters. Nat. Mater. 17 (6), 550-556 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten