Method Article
Síntese e Bioconjugation dos reagentes Thiol-reativa para a criação de Site-seletivamente modificado Immunoconjugates
Neste Artigo
Resumo
Neste protocolo, descreveremos a síntese de vagens, phenyoxadiazolyl metil sulfona-baseado reagente para a ligação local-seletivo de cargas para os tióis de biomoléculas, especialmente de anticorpos. Além disso, descreveremos a síntese e caracterização de um quelante bifuncional PODS-rolamento e sua conjugação com um anticorpo de modelo.
Resumo
Maleimide-rolamento bifuncionais sondas têm sido empregadas há décadas para a modificação de local-seletiva de tióis em biomoléculas, especialmente de anticorpos. Ainda conjugados com base em maleimide exibem limitada estabilidade in vivo, porque a ligação Tioéter de grufo pode sofrer uma reação retrô-Michael. Isso, claro, pode levar à liberação de carga radioativa ou sua troca com biomoléculas thiol-rolamento em circulação. Ambos estes processos podem produzir concentrações elevadas de atividade em órgãos saudáveis bem como diminuíram a concentrações de actividade em tecidos-alvo, resultando em menor contraste de imagem e inferiores relações terapêuticas. Em 2018, informamos a criação de um modular, estável e facilmente acessível phenyloxadiazolyl metil sulfona reagente — apelidado de 'PODS' — como uma plataforma para bioconjugations tiol-baseado. Temos claramente demonstrado que bioconjugations local-seletiva baseada em vagens reproducibly e robustamente criar radioimmunoconjugates homogênea, bem definidas, altamente immunoreactive e altamente estável. Além disso, experimentos pré-clínicos em modelos murino de câncer colorretal demonstraram que estes site-seletivamente rotulado radioimmunoconjugates exposição muito superior desempenho in vivo em comparação com radiolabeled anticorpos sintetizados através de baseada em maleimide conjugações. Neste protocolo, descreveremos a síntese de quatro etapas de vagens, a criação de uma variante de vagens-rolamento bifuncional do quelante onipresente DOTA (PODS-DOTA) e a conjugação de vagens-DOTA para o direcionamento de HER2-anticorpo Trastuzumabe.
Introdução
Radiofarmacêuticos químicos têm explorado a seletividade e especificidade dos anticorpos para biomarcadores da doença para ambos imagem nuclear e direcionados a radioterapia1. Abordagem de longe o mais comum para o radioativos de anticorpos baseia-se a penhora indiscriminada de radiolabeled grupos prostético ou radiometal quelantes de aminoácidos — mais frequentemente lisinas — dentro da estrutura da imunoglobulina ( Figura 1A)2. Enquanto esta estratégia é certamente eficaz, sua natureza aleatória, não-local-específica pode criar problemas. Especificamente, bioconjugation tradicionais abordagens produzem mal definidos e immunoconjugates heterogêneo composto por misturas de milhares de regioisomers diferentes, cada um com seu próprio conjunto de propriedades biológicas e farmacológicas3. Além disso, bioconjugation aleatório pode impedir a imunorreatividade dos anticorpos se a carga é acrescentada aos domínios de antígeno-ligando a imunoglobulina.
Ao longo dos anos, uma variedade de estratégias de bioconjugation site-specific e local-seletiva foram desenvolvidos a fim de abordar estes problemas4,5. A mais comum dessas abordagens depende a ligadura de sondas de maleimide-rolamento aos grupos sulfidrila das cisteínas (figura 1B). Anticorpos IgG1 contêm naturalmente 4 pontes de dissulfeto inter cadeia, vínculos que podem ser seletivamente reduzidos para render capaz de sofrer reações de adição de Michael com maleimides para formar grufo Tioéter ligações grátis tióis. O uso de tióis e maleimides é, certamente, uma melhoria em relação a métodos tradicionais e uma grande variedade de synthons de maleimide-rolamento e quelantes bifuncionais estão atualmente disponíveis. No entanto, é importante notar que esta metodologia tem sérias limitações também. Immunoconjugates baseada em maleimide apresentam estabilidade limitada em vivo, pois a ligação Tioéter pode sofrer uma reação retrô-Michael (Figura 2),6,7,8,9, 10. isto, claro, pode levar à liberação de carga radioativa ou sua troca com biomoléculas thiol-rolamento em circulação (por exemplo, glutationa ou albumina). Ambos estes processos podem aumentar as concentrações de atividade em órgãos saudáveis bem como diminuir as concentrações de actividade em tecidos-alvo, resultando em menor contraste de imagem e inferiores relações terapêuticas. Vários reagentes thiol-reactivos alternativos foram desenvolvidos na tentativa de contornar esses problemas, incluindo tosylates, bromo e iodo-acetyls e vinil sulfonas11,12,13, 14 , 15 , 16 , 17. no entanto, todas essas abordagens têm limitações que têm dificultado a sua aplicação generalizada.
Há cinco anos, o laboratório do falecido Carlos Barbas III no Scripps Research Institute foi pioneira no uso de sulfonas de metil phenyloxadiazolyl como reagentes para a formação seletiva de ligações altamente estáveis com tióis (Figura 1 e Figura 3) 18 , 19. os autores empregou uma variante de sulfona-rolamento de metil phenyloxadiazolyl de fluoresceína para modificar diversos anticorpos projetados para conter resíduos de cisteína livre, em última análise, produzindo immunoconjugates com maior estabilidade do que o análogo construções criadas usando sondas baseadas em maleimide. Ao ver este trabalho promissor, ficamos um pouco surpresos que esta tecnologia só tinha sido usada raramente em radioquímica e não tinha ainda sido usada em tudo na síntese de quelantes bifuncionais ou radioimmunoconjugates20,21 . Esta escassez de aplicativos, no entanto, logo começou a fazer mais sentido: várias tentativas de adquirir o reagente da Sigma-Aldrich resultaram no recebimento de misturas complexas de produtos de degradação com < 15% do composto desejado. Além disso, sintetizar o reagente relatado nos não era uma opção realista também, como a rota sintética publicada é um pouco complicada e requer equipamento sofisticado de química orgânica que mais radioquímica e imagem molecular laboratórios — incluindo a nossa — simplesmente não possuem.
Em resposta a esses obstáculos, nos propusemos a criar uma facilmente acessível e altamente estável phenyloxadiazolyl reagente de sulfona de metila que pode ser obtido através de uma rota sintética robusta e razoavelmente fáceis. No início deste ano, informamos a criação de um modular, estável e facilmente acessível phenyloxadiazolyl metil sulfona reagente — apelidado de 'PODS' — como uma plataforma para bioconjugations tiol-baseado (Figura 1 e Figura 3)22. A principal diferença entre cápsulas e o reagente relatado por Barbas, et al é que o antigo emprega um anel da anilina anexado para o agrupamento de sulfona de metil phenyloxadiazolyl, enquanto este último dispõe de um fenol na mesma posição (Figura 4). Essa mudança facilita uma rota sintética mais simples e acessível, bem como — se nossa experiência com o composto comercialmente disponível é emblemática — um reagente final mais estável. Neste trabalho, nós também sintetizado um par de vagens-rolamento bifuncionais quelantes — PODS-DFO e vagens-CHX-A '-DTPA — para facilitar a criação de 89Zr - e 177Lu-rotulados radioimmunoconjugates, respectivamente. Como vamos discutir, temos demonstrado que bioconjugations local-seletiva baseada em vagens reproducibly e robustamente criar radioimmunoconjugates homogênea, bem definidas, altamente immunoreactive e altamente estável. Além disso, experimentos pré-clínicos em modelos murino de câncer colorretal demonstraram que estes site-seletivamente rotulado radioimmunoconjugates exposição superior desempenho in vivo comparado ao radiolabeled anticorpos sintetizados através de baseado em maleimide conjugações.
O over-arching objetivo deste trabalho é facilitar a criação de immunoconjugates bem definidas, homogêneas, altamente estável e altamente immunoreactive para aplicações in vitro e in vivo. A abordagem sintética é bastante simples de ser realizada em quase qualquer laboratório, e o reagente de vagens do pai pode ser modificado com uma infinidade de diferentes quelantes, fluorophores ou cargas. No presente protocolo e o vídeo que acompanha, descreveremos a síntese simples, quatro etapas de vagens (Figura 5); a criação de uma variante de vagens-rolamento do DOTA, um quelante amplamente utilizado para a coordenação de 64Cu, 68Ga, 111, em 177Lu e 225Ac (Figura 6); e o bioconjugation de vagens-DOTA de um anticorpo de modelo, o Trastuzumabe HER2-direcionamento IgG1 (Figura 7).
Protocolo
1. a síntese de 4-[5-(methylthio)-1,3,4-oxadiazol-2-yl]-aniline (1)
Nota: Devido à luz-sensibilidade do composto, mantenha todas as reacções em vasos de folha-cobertas.
- Em um 10 mL redondo balão de fundo, dissolver 100 mg (0.517 mmol, 1 equivalente) de 5-(4-aminophenyl)-1,3,4-oxadiazole-2-thiol em 3 mL de metanol.
- Para esta solução, adicionar 360 μL de diisopropylethylamine (DIPEA; 2,07 mmol; 4 equivalentes; anidro) e uma barra de agitação magnética pequena. Cubra o frasco com uma rolha de borracha e agitar a solução durante 10 minutos à temperatura ambiente.
- Utilizando uma seringa de vidro de 1 mL, picar um buraco através da rolha de borracha e rapidamente adicionar 32 μL (0.517 mmol, 1 equivalente) de Iodometano para esta mistura. Permita que a mistura se reagir durante 45 minutos à temperatura ambiente.
Nota: Devido os potenciais efeitos nocivos de Iodometano, esta reação deve ser feita em uma coifa de química. - Definir o banho de água de um evaporador rotativo para 40 ° C e reduzir lentamente a pressão para remover o solvente para pagar um sólido branco.
- Dissolver o sólido em 3 mL de acetato de etilo e lave pelo menos três vezes com um 5 mL de solução de carbonato de sódio 0,1 M, usando um funil de separação.
Nota: Levar periodicamente local-testes da fase aquosa sob uma lâmpada UV; uma vez que nada é visto sob a lâmpada, você pode parar as lavagens. - Recolher a fase orgânica em um funil de separação e lave-o com água até que o pH da fase aquosa atinge 6,8-7,0 (usando papel de pH).
- Recolher a fase orgânica e adicionar sulfato de magnésio para eliminar quaisquer vestígios de água.
Nota: O sulfato de magnésio deve ser adicionado com uma espátula pequena, após o qual a solução deve ser rodada. Se as partículas finas do agente de secagem ainda são vistas, a solução é seca. Se não, adicione pequenas quantidades de sulfato de magnésio até partículas finas podem ser vistas. - Filtre a mistura usando um fritas de vidro médio ou papel de filtro.
- Evapore os voláteis usando um evaporador rotativo, um processo que deveria produzir o produto desejado como agulhas brancas.
2. a síntese de tert-butyl[18-({4-[5-(methylthio)-1,3,4-oxadiazol-2-yl]phenyl}amino)-15,18-dioxo-4,7,10-trioxa-14-azaoctadecyl] carbamato (2)
Nota: Devido à luz-sensibilidade do composto, mantenha todas as reacções em vasos de folha-cobertas.
- Em 25 mL de uma rodada de balão, dissolver 387 mg (0,92 mmol, 1,0 equivalente), de NBoc-n-Succinil-4,7,10-trioxa-1,13-tridecanediamine, em 10 mL de diclorometano.
- Para esta solução, adicionar 480 μL (2.76 mmol, 3 equivalentes) de DIPEA, 264 mg (1.38 mmol; 1,5 equivalentes) de N-etil - n-[3-(dimetilamino) propil] carbodiimida cloridrato (EDCI) e 200 mg (0,97 mmol, 1,1 equivalentes) de 1. Selar o recipiente com uma tampa de vidro e deixe-a reação mexa por 5 dias à temperatura ambiente.
Nota: Esteja atento a evaporação de diclorometano. Se necessário, adicione mais durante toda a semana. - Lave a mistura em um funil de separação com uma solução de ácido clorídrico de 1 M (3 x 5 mL).
- Recolher a fase orgânica e continuar a lavá-la em um funil de separação, primeiro com uma solução de 1 M Na2CO3 (2 x 5 mL) e, em seguida, com água (3 x 5 mL).
- Recolher a fase orgânica e adicionar sulfato de magnésio para eliminar quaisquer vestígios de água (ver passo 1.7). Filtre a mistura usando um fritas de vidro médio ou papel de filtro.
- Usando um evaporador rotativo, remova os solventes voláteis sob pressão reduzida para pagar um sólido esbranquiçado.
- Dissolver novamente este sólido em 10 mL de acetato de etilo e precipitar o produto através da adição de gradual (por exemplo, 2 mL de cada vez) de 30 mL de ciclo-hexano.
- Filtre a solução com papel de filtro ou uma fritas de vidro médio para obter o produto como um pó branco.
3. a síntese de tert-butyl[18-({4-[5-(methylsulfonyl)-1,3,4-oxadiazol-2-yl]phenyl}amino)-15,18-dioxo-4,7,10-trioxa-14-azaoctadecyl] carbamato (3)
Nota: Devido à luz-sensibilidade do composto, mantenha todas as reacções em vasos de folha-cobertas.
- Em um balão de fundo redondo de 10 mL, dissolva 30 mg (0,05 mmol; 1 equivalente) de 2 em 4 mL de diclorometano.
- Lentamente adicione 49 mg (0,2 mmol; 4 equivalentes) do ácido m-chloroperbenzoic de 70% a esta mistura e cobrir o recipiente de reação com uma rolha de vidro. Agite a solução durante a noite à temperatura ambiente, em última análise, produzindo uma mistura de amarela.
- Lave a mistura de amarela em um funil de separação, primeiro com uma solução 0,1 M de NaOH (3 x 5 mL) e, em seguida, com água (3 x 5 mL).
- Seque a fase orgânica com sulfato de magnésio e filtrar a mistura usando um fritas de vidro médio ou papel de filtro.
- Usando um evaporador rotativo, remova os solventes sob pressão reduzida para obter o produto como um pálido sólido.
4. síntese de N1-(3-{2-[2-(3-aminopropoxy)ethoxy]-ethoxy}propyl)-N4- succinamide {4-[5-(methylsulfonyl)-1,3,4-oxadiazol-2-yl] fenil} (PODS)
- Em 25 mL de uma rodada de balão, dissolver 30 mg de 3 em 2,0 mL de diclorometano.
- Adicionar 400 μL de ácido trifluoroacético e selar o balão com uma rolha de vidro.
- Agite a mistura de reação em temperatura ambiente por 3 horas.
- Usando um evaporador rotativo, remova os compostos voláteis sob pressão reduzida à temperatura ambiente, deixando um resíduo oleoso.
- Dissolver o resíduo oleoso em 7 mL de água e, usando um funil de separação, lavar com acetato de etila (3 x 4 mL). Mantenha a camada aquosa.
- Lyophilize a camada aquosa para pagar vagens como um pó branco.
Nota: Os coeficientes de absorção molar para sachês em 298 e 280 nm são 9.900 e 12.400 cm-1M-1, respectivamente.
5. a síntese de vagens-DOTA
- Em um tubo de microcentrifugadora de 1,5 mL, dissolver em 300 μL de dimetil sulfóxido (0,018 mmol; 1 equivalente) de 10 mg de vagens e adicionar 26 μL de N, N-diisopropylethylamine (0,15 mmol; 8 equivalentes).
- Dissolver 15,2 mg de DOTA-Bn-NCS (0,02 mmol; 1,2 equivalentes) em 100 μL de Dimetilsulfóxido e combinar esta solução com a solução da etapa 5.1. Feche o tubo de microcentrifugadora.
- Permitir que a reação a incubar durante uma noite em temperatura ambiente.
- Purifica o produto usando reverso-fase C18 HPLC cromatografia para remover qualquer DOTA-Bn-NCS não tenha reagido.
Nota: Tempos de retenção são obviamente altamente dependentes do equipamento de HPLC de cada laboratório (bombas, colunas, tubos, etc.), e controles apropriados devem ser executados antes da purificação. No entanto, apresentar um exemplo, se um gradiente de 5:95 MeCN/H2O (ambos com 0,1% TFA) para 70:30 MeCN/H2O (ambos com 0,1% TFA) são utilizados mais de 30 min, uma coluna de18 semipreparativa 19 x 250 mm C e uma vazão de 6 mL/min , Vagens, p-SCN-Bn-DOTA e DOTA-vagens terão tempos de retenção de 14,4, 18,8 e 19,6 min, respectivamente. Todos os três compostos podem ser monitorados em 254 nm.
6. o bioconjugation de vagens-DOTA de Trastuzumabe
Nota: Para esta etapa, iniciamos com uma solução stock de 16,4 mg/mL de trastuzumab.
- Em um tubo de microcentrifugadora baixa proteína ligação 1,5 mL, dilua 61 μL da solução estoque de trastuzumab (1mg; 6,67 nmol, 1 equivalente) com 859 μL de tampão fosfato solução salina (pH 7,4).
- A esta mistura, adicione 6.7 μL de 10mm recém-feitos solução do TCEP em H2O (66,7 nmol, 10 equivalentes).
- Preparar uma solução de 1 mg/mL de vagens-DOTA em DMSO e adicionar 73 μL desta solução de vagens-DOTA a mistura de reacção (66.67 nmol, 10 equivalentes).
- Selar o microcentrifuga tubo e incubar a solução por 2 horas a temperatura ambiente.
- Depois de 2 horas, purifica o immunoconjugate usando uma coluna do desalting exclusão de tamanho descartáveis pré-embalados.
- Primeiro, equilibrar a coluna de exclusão de tamanho, conforme descrito pelo fornecedor para remover quaisquer conservantes presentes na coluna durante o armazenamento. Um procedimento típico envolve a coluna 5 vezes com um volume de PBS que corresponde ao volume da coluna de lavagem: 5 x 2,5 mL de PBS.
- Em seguida, adicione a mistura de reação à coluna de exclusão de tamanho, observando o volume da mistura de reação.
- Após a mistura de reação entrou a coluna, adicionar uma quantidade adequada de PBS para trazer o volume total da solução adicionado à coluna de 2,5 mL. Por exemplo, se a reação de conjugação resultou em um volume total de 1,3 mL, 1,2 mL de PBS adicional precisa ser adicionado à coluna.
- Finalmente, recolha o produto usando 2 mL de PBS como eluente.
- Concentre-se no final immunoconjugate com unidades de filtragem centrífuga com um corte de peso molecular 50 kDa.
Resultados
As quatro primeiras etapas deste protocolo — a síntese de vagens — ter sido projetado para ser robusto e confiável. A deprotonação e substituição de 5-(4-aminophenyl)-1,3,4-oxadiazole-2-thiol para formar o produto desejado Tioéter proporciona o Tioéter em > 99% de rendimento após apenas 45 minutos. Em seguida, a ligadura entre 1 e N-Boc-N'-succinyl-4,7,10-trioxa-1,13-tridecanediamine foi conseguida através de um peptídeo padrão procedimento de acoplamento, resultando na coleção do produto (2) com 55% de rendimento. Em seguida, a oxidação de 2 foi realizada usando ácido m-chloroperoxybenzoic, um oxidante amplamente utilizado. Seguindo os passos de lavagem, 3 foi obtido como um sólido pálido com ~ 90% de rendimento. Finalmente, a eliminação do grupo tert-butyloxycarbonyl protegendo de 3 foi feita de acordo com os procedimentos padrão, usando uma proporção de 4:1 de ácido dichloromethane:trifluoroacetic. Após a liofilização da fase aquosa, nosso produto — PODS — obteve-se como um pó branco com 98% de rendimento. Seguiu-se o progresso da reação através de cromatografia em camada fina, e a identidade de cada produto foi confirmada via 1H-NMR, 13C-NMR e HRMS-ESI (tabela 1).
Uma das principais vantagens do reagente vagens é sua modularidade. Uma variedade de quelantes, fluorophores, toxinas ou outras cargas pode ser acrescentada a amina de pingente do composto. O protocolo em mãos, estamos usando o onipresente quelante DOTA (ácido 1,4,7,10-tetraazacyclododecane-1,4,7,10-etilenodiaminotetracético) como uma carga representativa. DOTA, é claro, tem sido utilizado em uma ampla gama de produtos radiofarmacêuticos biomolecular como um quelante para radiometals incluindo 68Ga, 64Cu, 111, em 90Y, 177Lu e 225Ac. Para este fim, uma variante de isotiocianato-rolamento do DOTA (p-SCN-Bn-DOTA) foi empregado e acoplado à amina de pingente de vagens através de condições de acoplamento direto. O quelante bifuncional resultante foi então purificado através de fase reversa C18 HPLC e isolado em ~ 75% de rendimento. Como com os outros precursores, seguiu-se o progresso da reação através de cromatografia em camada fina, e a identidade do produto foi confirmada via 1H-NMR, 13C-NMR e HRMS-ESI (tabela 1).
Na etapa final do protocolo, discutimos o bioconjugation site-seletiva de vagens-DOTA de uma imunoglobulina de modelo, o Trastuzumabe HER2-direcionamento de anticorpo. Para este efeito, as ligações de bissulfeto de região de dobradiça do anticorpo são seletivamente reduzidas com o agente redutor TCEP [tris(2-carboxyethyl) fosfina]. Após esta etapa de redução, o anticorpo é incubado com vagens-DOTA para 2 h à temperatura ambiente e posteriormente purificado através de cromatografia de exclusão. Neste caso, o immunoconjugate purificado, DOTA-rolamento foi obtido com ~ 80% de rendimento, e MALDI-ToF análise revelou um grau de rotulagem (DOL) de ~1.8 DOTA/mAb. De um modo geral, achamos que 10 equivalentes do TCEP, 10 equivalentes de reagente de vagens e uma incubação de 2 h são suficientes para produzir um immunoconjugate com um DOL de 2 cápsulas/mAb (tabela 2). Este resultado permanece consistente em toda uma gama de anticorpos de IgG1 quiméricoes humanos e humanizados; no entanto, as mesmas condições produzem immunoconjugates com um DOL de apenas ~1.5 ao trabalhar com anticorpos de IgG1 murino. Tudo isto dito, pesquisadores devem otimizar a estas condições de reação para novos anticorpos e cargas de vagens-rolamento. Finalmente e importante, com relação ao produto final, repetidamente e reproducibly encontramos que immunoconjugates baseados em vagens apresentam immunoreactivities iguais ou melhores do que construções análogas criadas usando aleatório ou baseados em maleimide estratégias de conjugação.
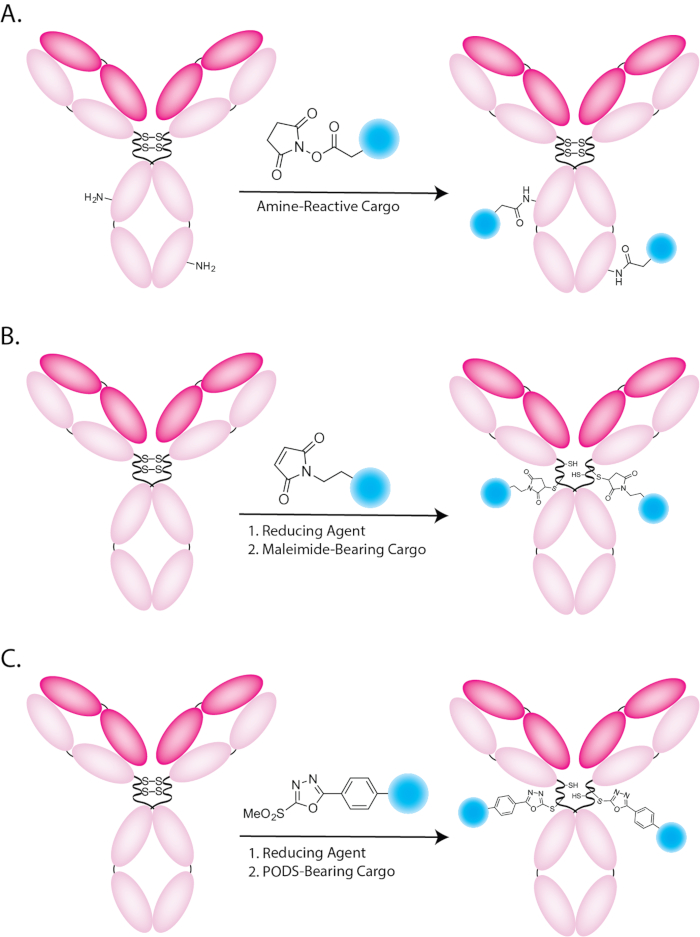
Figura 1: Ilustração esquemática de bioconjugations usando o (A) (B) amina reativos, maleimide-rolamento e as cargas (C) PODS-rolamento. Clique aqui para ver uma versão maior desta figura.

Figura 2: A adição de Michael de uma biomolécula thiol-rolamento (verde) e um radionuclídeo-rolamento maleimide (amarelo) para formar um bioconjugate radiolabeled, bem como as reações adicionais a construção radiolabeled pode sofrer na presença endógena moléculas de Thiol-rolamento (rosa). RT = temperatura ambiente. Figura reimpressa com permissão da Adumeau, P., Davydova, M., Zeglis, b. M. de quelantes Thiol-reativos bifuncionais para a criação de Site-seletivamente modificado Radioimmunoconjugates com estabilidade melhorada. Bioconjugate química. 29, 1364-1372 (2018). Copyright 2018 American Chemical Society. Clique aqui para ver uma versão maior desta figura.
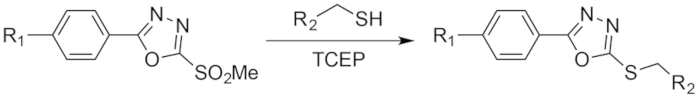
Figura 3: Esquema da reação entre PODS e um tiol. Figura reimpressa com permissão da Adumeau, P., Davydova, M., Zeglis, b. M. de quelantes Thiol-reativos bifuncionais para a criação de Site-seletivamente modificado Radioimmunoconjugates com estabilidade melhorada. Bioconjugate química. 29, 1364-1372 (2018). Copyright 2018 American Chemical Society. Clique aqui para ver uma versão maior desta figura.
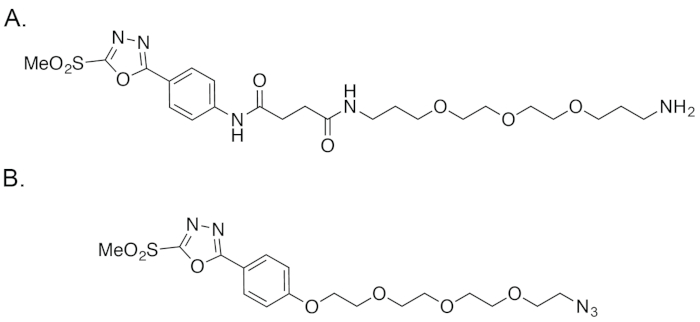
Figura 4: A estrutura de vagens (A) , bem como (B) o reagente relatado por Barbas, et al.18,19clique aqui para ver uma versão maior desta figura.
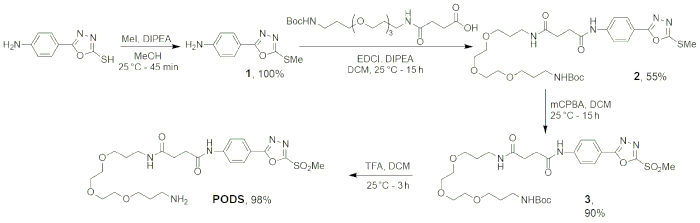
Figura 5: Esquema da síntese quatro etapas de vagens. Figura reimpressa com permissão da Adumeau, P., Davydova, M., Zeglis, b. M. de quelantes Thiol-reativos bifuncionais para a criação de Site-seletivamente modificado Radioimmunoconjugates com estabilidade melhorada. Bioconjugate química. 29, 1364-1372 (2018). Copyright 2018 American Chemical Society. Clique aqui para ver uma versão maior desta figura.

Figura 6: Esquema da síntese de vagens-DOTA. Clique aqui para ver uma versão maior desta figura.
Figura 7: Esquema da bioconjugation de Trastuzumabe com vagens-DOTA. Clique aqui para ver uma versão maior desta figura.

Figura 8: Comparação do comportamento in vivo de 89radioimmunoconjugates Zr-rotulado de huA33 criado usando baseado em vagens (89Zr-DFO-PODS-huA33) e estratégias de bioconjugation baseada em maleimide (89Zr-DFO-mal-huA33). Planar (à esquerda) e imagens de PET de projeção (à direita) de intensidade máxima de camundongos modelo A33 antígeno-expressando SW1222 câncer colorretal xenografts (seta branca) após a injeção de 89Zr-DFO-PODS-huA33 e 89 do rolamento ZR-DFO-mal-huA33 (µCi 140, 60-65 µ g). As fatias coronais cruzam o centro dos tumores. Figura reimpressa com permissão da Adumeau, P., Davydova, M., Zeglis, b. M. de quelantes Thiol-reativos bifuncionais para a criação de Site-seletivamente modificado Radioimmunoconjugates com estabilidade melhorada. Bioconjugate química. 29, 1364-1372 (2018). Copyright 2018 American Chemical Society. Clique aqui para ver uma versão maior desta figura.
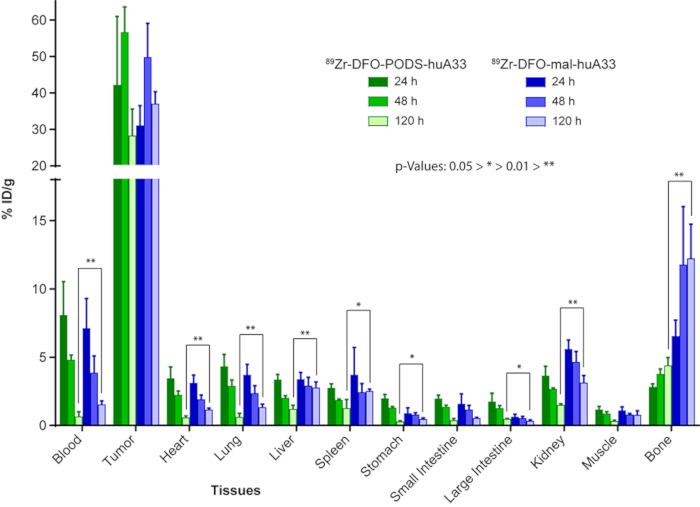
Figura 9: Comparação do comportamento in vivo de 89radioimmunoconjugates Zr-rotulado de huA33 criado usando baseado em vagens (89Zr-DFO-PODS-huA33) e estratégias de bioconjugation baseada em maleimide (89Zr-DFO-mal-huA33). Dados de biodistribuição após a administração de 89Zr-DFO-PODS-huA33 e 89Zr-DFO-mal-huA33 (µCi 30, 15-18 µ g) de camundongos modelo rolamento A33 antígeno-expressando subcutâneos xenografts SW1222 humana de cancro colo-rectal. Os valores para o estômago, intestino delgado e intestino grosso incluem conteúdo. Figura reimpressa com permissão da Adumeau, P., Davydova, M., Zeglis, b. M. de quelantes Thiol-reativos bifuncionais para a criação de Site-seletivamente modificado Radioimmunoconjugates com estabilidade melhorada. Bioconjugate química. 29, 1364-1372 (2018). Copyright 2018 American Chemical Society. Clique aqui para ver uma versão maior desta figura.
| Composto | 1 H-NMR turnos | 13 C-NMR turnos | HRMS | |||
| 1 | (500 MHz, CDCl3) 7,79 (2 H, d, J = 8,5 Hz), 6.72 (2 H, d, J = 8,5 Hz), 4.04 (2 H, br s), 2,75 (3h, s) | (125 MHz, CDCl3) 166.3 163.7, 149.7, 128.5, 114.8, 113.5, 14,8 | m/z calculado para [C9H9N3OS + H]+: 208.0539; encontrado: 208.0539; Δ: 0.0 ppm | |||
| 2 | (500 MHz, CDCl3) 9.68 (1H, s), 7.91 (2H, d, J = 9,0 Hz), 7,71 (2H, d, J = 8,5 Hz), 6,82 (1H, s), 4,99 (1H, s), 3.70-3,45 (12H, m), 3.41 (2H, q, J = 6,0 Hz), 3.20 (2H, q, J = 6,5 Hz), 2,76 (3h, s), 2,71 (2H, m), 2,63 (2h m), 1,70-1,80 (4 H, m), 1,42 (9 H, s) | (125 MHz, CDCl3) 172.6, 171.3, 165.8, 164.6, 156.2, 141,8, 127,7, 1.19.6, 118,6, 79,2, 70.6, 70,5, 70,3, 70.1, 69,6, 38,8, 38,5, 33,5, 31,6, 29,9, 28,6, 14,8 | m/z calculado para [C28H43N5O8S + nd]+: 632.2725; encontrado: 632.2722; Δ:-0,470 ppm | |||
| 3 | (500 MHz, CDCl3) 9,99 (1 H, s), 7,98 (2 H, d, J = 9,0 Hz), 7,75 (2 H, d, J = 8,5 Hz), 6,88 (1 H, s), 4,99 (1 H, s), 3,66-3,50 (15 H, m), 3.41 (2 H, q, J = 6,0 Hz), 3.20 (2 H, q, J = 6,5 Hz), 2,71 (2 H, m), 2,65 (2 H, m) , 1,70-1,80 (4H, m), 1,43 (9H, s) | (125 MHz, CDCl3) 172.6, 171,5, 166.5, 161,6, 156.1, 143.4, 128,7, 1.19.6, 116,4, 79.1, 70,5, 70,4, 70,2, 70,0, 69,4, 43.0, 38,8, 38,4, 33,2, 31,3, 29,7, 28,4 | m/z Calculado por [C28H43N5O10S + H]+: 642.2803; encontrado: 642.2797; Δ:-0,930 ppm | |||
| VAGENS | (500 MHz, O D2) 7.85 (2 H, d, J = 9,0 Hz), 7.55 (2 H, d, J = 8,5 Hz), 3.60-3,45 (15 H, m), 3,45 (2 H, t, J = 6,5 Hz), 3.20 (2 H, t, J = 6,5 Hz), 3.04 (2 H, t, J = 7,0 Hz), 2,67 (2 H, t, J = 6,5 Hz), 2.54 (2h t, J = 6,5 Hz), 1.87 (H 2, qt, J = 6,5 Hz), 1,70 (H 2, qt, J = 6,5 Hz) | (125 MHz, O D2) 174,5, 173,2, 166,8, 161.4, 142.2, 128,6, 120.3, 116.6, 69,4, 69,4, 69,3, 69.2, 68,2, 68,2, 42,5, 37,6, 36,2, 31,9, 30.7, 28,2, 26,4 | m/z Calculado para [C23H35N5O8S + H]+: 542.2279; encontrado: 542.2281; Δ: 0,37 ppm | |||
| VAGENS-DOTA | (600 MHz, DMSO-d6) 10,46 (1 H, s), 9,74 (1h, bs), 8.04 (2 H, d, J = 8,6 Hz), 7.99 (1 H, s), 7,90 (1 H, t, J = 5,0 Hz), 7,86 (2 H, d, J = 6,5 Hz), 7.44 (2 H, d, J = 7,9 Hz), 7,24 (2 H, d, J = 7,1 Hz), 4.35-2,41 (45 H, m) , 3.70 (3h, s), 1,76 (2H, q, J = 6,3 Hz), 1.61 (2H, q, J = 6,5 Hz) | (125 MHz, DMSO-d6) 171.8, 171.4, 166.1, 162,2, 158,8, 158.6, 129.8, 129.0, 127.6, 123.3, 119,5, 118,5, 116,5, 116,4, 70,2, 70.1, 70,0, 68,7, 68,5, 43,4, 41,8, 36,3, 32,2, 30,4, 29,8, 29,1 | m/z Calculado para [C47H68N10Ó16S2+ H]+: 1093.4334; encontrado: 1093.4327; Δ:-0,640 ppm | |||
Tabela 1. Dados de caracterização para os intermediários sintéticos descreveram assim como vagens e vagens-DOTA.
| Anticorpo | Tipo | Região constante | Proporção de vagens: mAb |
| Plasma humano IgG | Humana | IgG humano | 2,1 ± 0.1 |
| Trastuzumabe | Humanizado | IgG1 humana | 2,0 ± 0.1 |
| huA33 | Humanizado | IgG1 humana | 2,1 ± 0.1 |
| Cetuximab | Quimérico | IgG1 humana | 2.2 ± 0.1 |
| AR 9.6 | Murino | IgG1 murino | 1.4 ± 0.1 |
| Plasma de mouse IgG | Murino | IgG murino | 1,5 ± 0.1 |
Tabela 2. Grau de rotulagem de diferentes anticorpos após conjugação com um fluoróforo PODS-rolamento. Os valores são mostrados os desvios-padrão. Tabela reimpressa com permissão da Adumeau, P., Davydova, M., Zeglis, b. M. de quelantes Thiol-reativos bifuncionais para a criação de Site-seletivamente modificado Radioimmunoconjugates com estabilidade melhorada. Bioconjugate química. 29, 1364-1372 (2018). Copyright 2018 American Chemical Society.
Discussão
Neste relatório, decidimos não incluir quaisquer protocolos para experimentação radioativos ou in vivo. Nossos motivos são simples. No que diz respeito ao primeiro, o radioativos de uma immunoconjugate baseada em vagens não difere em tudo isso de um immunoconjugate sintetizado usando outras estratégias bioconjugation, e esses procedimentos têm sido exaustivamente analisado em outro lugar2 . No que diz respeito a último, as especificidades de pré-clínicos experimentos in vivo (i.e., modelos de rato, doses, etc.) podem variar amplamente de acordo com o aplicativo e o sistema de anticorpo/antigénio.
Nossas investigações anteriores com 89Zr-rotulado variantes de huA33 fornecem uma ilustração convincente das vantagens do bioconjugations baseado em vagens. HuA33 é um anticorpo IgG1 humanizado que tem como alvo o antígeno A33, uma glicoproteína transmembrana expressado em > 95% dos cancros colo-rectais23,24. No nosso manuscrito anterior22, relatamos a síntese de 89Zr-DFO-huA33 radioimmunoconjugate usando os dois PODS e maleimide-estratégias baseadas em bioconjugation. Os dois radiolabeled anticorpos — 89Zr-DFO-PODS-huA33 e 89Zr-DFO-mal-huA33 — foram produzidos na imunorreatividade, pureza, atividade de especificidade e rendimento quase idêntico. Criticamente, no entanto, os dois radioimmunoconjugates exibiu estabilidades dramaticamente diferentes no soro humano: após incubação durante sete dias a 37 ° C, 89Zr-DFO-PODS-huA33 permaneceu 86 ± 1% intacta, enquanto seu primo maleimide-baseado era apenas 61 ± 5% intacto. Imagens de PET in vivo e biodistribuição experimentos em camundongos modelo rolamento A33 antígeno-expressando SW1222 humano câncer colorretal xenografts revelou austeros diferenças no comportamento in vivo das duas radioimmunoconjugates (Figura 8 e Figura 9). Tanto 89Zr-DFO-PODS-huA33 e 89Zr-DFO-mal-huA33 produzem concentrações de alta atividade no tecido do tumor: 56,4 ± 6.9%ID/g e 49,6 ± 9.3%ID/g, respectivamente, 48 h após a administração. No entanto, a radioimmunoconjugate baseada em maleimide produzido significativamente altas concentrações de actividade em tecidos saudáveis do que o agente baseado em vagens. Por exemplo, 89Zr-DFO-mal-huA33 produzidas concentrações de atividade de 3,1 ± 0,5 2,7 ± 0,4 e 0,4 ± 12,2% ID/g nos rins, fígado e ossos, respectivamente, no pós-injeção de 120h, valores que excedam drasticamente as concentrações de atividade produzido por 89Zr-DFO-PODS-huA33 nos mesmos tecidos (1,4 ± 0.1, 1,2 ± 0,3 e 4,3 ± 0,6% ID/g). Com efeito, 89Zr-DFO-PODS-huA33 produzidas concentrações de actividade em todos os tecidos não-alvo (exceto o intestino grosso) no pós-injeção de 120h em comparação com 89Zr-DFO-mal-huA33. Como resultado, as proporções de concentração de atividade do tumor-para-órgão para 89Zr-DFO-PODS-huA33 são geralmente superiores aos de 89Zr-DFO-mal-huA33; em particular, o tumor-de-fígado, tumor-para-baço, tumor-para-renal e concentração de atividade do tumor-de-osso rácios são quase o dobro para o immunoconjugate baseada em vagens em comparação com seu primo maleimide-derivado. Considerando que a principal diferença entre os dois radioimmunoconjugates era o identificador de bioconjugation do quelante, o aumento da estabilidade da ligação PODS-tiol é quase certamente responsável por este desempenho melhorado em vivo.
Tendo uma visão mais ampla, o bioconjugation não-site-seletivo de sondas de lisinas dentro de anticorpos é, reconhecidamente, uma abordagem simples e fáceis para a modificação de anticorpos. No entanto, a presença de várias lisinas distribuído em toda a estrutura de imunoglobulinas significa que é impossível exercer controle sobre o local exato ou grau de bioconjugation2. Como resultado, esta estratégia aleatória produz muitas vezes mal definidos e immunoconjugates altamente heterogêneos que podem exibir diminuiu imunorreatividade se ligadura ocorre dentro de domínios o antígeno-ligando3. Os benefícios de abordagens local-seletiva para bioconjugation tem sido ilustrados repetidamente para ambos radioimmunoconjugates e droga-anticorpo cojugado8,14,25,26, 27,28,29,30. Em suma, não só bioconjugation site-seletiva estratégias produzem mais bem definida e homogênea immunoconjugates do que as metodologias tradicionais, também criam imagens agentes, radioimmunotherapeutics e ADCs com desempenho melhorado em vivo. No entanto, onde baseado em vagens ligadura coloco em comparação a outras estratégias de modificação local-seletiva? De um modo geral, as abordagens para a modificação de local-seletiva de anticorpos podem ser classificadas em quatro categorias: (1) ligadura de resíduos de cisteína, (2) a manipulação dos cadeia pesada os glicanos e transformações (3) chemoenzymatic (4) a utilização de engenharia genética4,5. Claro, este sistema de classificação não é perfeito, e algumas abordagens (por exemplo, a modificação de com enzimas, os glicanos a cadeia pesada), inevitavelmente, qualificar-se para duas categorias. Cada estratégia tem suas próprias vantagens e desvantagens. Abordagens baseadas em engenharia genética fornecem requintado controle sobre o site de conjugação, no entanto, são complexos e caros31,32,33. Acoplamentos oxidativos do cadeia pesada os glicanos são baratos e simples, no entanto, correm o risco de danos oxidativos para a integridade estrutural da imunoglobulina34,35,36,37 ,38.
A vantagem principal de thiol-baseado bioconjugations — vagens incluídas — é a sua simplicidade e modularidade. Sua principal limitação, por outro lado, decorre da presença de tióis múltiplas dentro de um anticorpo, uma característica que reduz o grau de controle sobre o site tanto de conjugação e o número de modificações por anticorpos. Neste sentido, a combinação de ligadura thiol-baseado e anticorpos que tem sido geneticamente projetados para possuir a resíduos de cisteína livre é uma abordagem particularmente atraente. Como já observamos, outra limitação de ligadura tiol baseada em maleimide é a susceptibilidade da ligação Tioéter grufo para retro-Michael adições em vivo. Ainda criticamente, o uso de PODS revoga este problema.
Antes de concluir, é importante observar que a natureza emergente da tecnologia vagens pode criar seu próprio conjunto de obstáculos. Por exemplo, não quelantes bifuncionais PODS-rolamento (atualmente) são comercialmente disponíveis e não há dados abordando a farmacologia clínica, toxicologia ou imunogenicidade de immunoconjugates baseado em vagens. No entanto, acreditamos que bioconjugations baseados em vagens têm o potencial de mudar fundamentalmente a maneira de immunoconjugates são sintetizados em laboratório e clínica. Neste momento, temos apenas aplicado esta tecnologia química para o desenvolvimento de radioimmunoconjugates para imagem nuclear e radioimmunotherapy, embora investigações sobre a utilidade desta abordagem para a construção de droga-anticorpo cojugado e outros medicamentos biomolecular estão em andamento. No final, esperamos sinceramente que este protocolo — e particularmente a química fácil e simples que nós desenvolvemos — ajudará a promover o uso de sulfonas de metil phenyloxadiazolyl baseados em sulfidrila conjugações e estimular uma mudança no campo de maleimides a alternativas mais estáveis e mais confiáveis.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores agradecer Dr. Sai Kiran Sharma conversas úteis.
Materiais
| Name | Company | Catalog Number | Comments |
| 5-(4-aminophenyl)-1,3,4-oxadiazole-2-thiol | Sigma-Aldrich | 675024 | |
| 1.5 mL LoBind Microcentrifugal Tube | Eppendorf | 925000090 | |
| 1.5 mL Microcentrifugal Tube | Fisherbrand | 05-408-129 | |
| Acetonitrile | Fisher Scientific | A998-4 | |
| Amicon Ultra-2 Centrifugal Filter Unit | EMD Millipore | EN300000141G | |
| Cyclohexane | Fisher Scientific | C556-4 | |
| Dichloromethane | Fisher Scientific | AC383780010 | |
| Diisopropylethylamine | MP Biomedicals, LLC | 150915 | |
| Dimethylsulfoxide | Fisher Scientific | 31-727-5100ML | |
| Ethyl Acetate | Fisher Scientific | E145 4 | |
| Hydrochloric Acid | Fisher Scientific | A144-500 | |
| Iodomethane | Sigma-Aldrich | 289566-100G | |
| Magnesium Sulfate | Acros Organics | 413485000 | |
| m-chloroperbenzoic acid | Sigma-Aldrich | 273031 | |
| Methanol | Fisher Scientific | A412 1 | |
| NBoc-N′-succinyl-4,7,10-trioxa-1,13-tridecanediamine | Sigma-Aldrich | 671401 | Store at -80 °C |
| N-ethyl-N′- [3- (dimethylamino)propyl] carbodiimide hydrochloride | Sigma-Aldrich | 3450 | |
| Phosphate Buffered Saline | Sigma-Aldrich | P5493 | 10× Concentration |
| p-SCN-Bn-DOTA | Macrocyclics | B-205 | Store at -80 °C |
| Sephadex G-25 in PD-10 Desalting Columns | GE Healthcare | 17085101 | |
| Sodium Carbonate | Sigma-Aldrich | S7795 | |
| Sodium Hydroxide | Fisher Scientific | S318-1 | |
| TCEP | ThermoFischer Scientific | 20490 | |
| Triethylamine | Fisher Scientific | AC157911000 | |
| Trifluoroacetic Acid | Fisher Scientific | A116-50 |
Referências
- Wu, A. M. Antibodies and antimatter: The resurgence of immuno-PET. Journal of Nuclear Medicine. 50 (1), 2-5 (2009).
- Zeglis, B. M., Lewis, J. S. A practical guide to the construction of radiometallated bioconjugates for positron emission tomography. Dalton Transactions. 40 (23), 6168-6195 (2011).
- Agarwal, P., Bertozzi, C. R. Site-specific antibody-drug conjugates: the nexus of bioorthogonal chemistry, protein engineering, and drug development. Bioconjugate Chemistry. 26 (2), 176-192 (2015).
- Adumeau, P., Sharma, S. K., Brent, C., Zeglis, B. M. Site-specifically labeled immunoconjugates for molecular imaging-part 1: Cysteine residues and glycans. Molecular Imaging and Biology. 18 (1), 1-17 (2016).
- Adumeau, P., Sharma, S. K., Brent, C., Zeglis, B. M. Site-specifically labeled immunoconjugates for molecular imaging-part 2: Peptide tags and unnatural amino acids. Molecular Imaging and Biology. 18 (1), 153-165 (2016).
- Alley, S. C., et al. Contribution of linker stability to the activities of anticancer immunoconjugates. Bioconjugate Chemistry. 19 (3), 759-765 (2008).
- Baldwin, A. D., Kiick, K. L. Tunable degradation of maleimide-thiol adducts in reducing environments. Bioconjugate Chemistry. 22 (10), 1946-1953 (2011).
- Shen, B. -. Q., et al. Conjugation site modulates the in vivo stability and therapeutic activity of antibody-drug conjugates. Nature Biotechnology. 30 (2), 184-189 (2012).
- Jackson, D., et al. In vitro and in vivo evaluation of cysteine and site specific conjugated herceptin antibody-drug conjugates. Plos One. 9 (1), (2014).
- Ponte, J. F., et al. Understanding how the stability of the thiol-maleimide linkage impacts the pharmacokinetics of lysine-linked antibody-maytansinoid conjugates. Bioconjugate Chemistry. 27 (7), 1588-1598 (2016).
- Stimmel, J. B., et al. Site-specific conjugation on serine -> cysteine variant monoclonal antibodies. Journal of Biological Chemistry. 275 (39), 30445-30450 (2000).
- Li, L., et al. Reduction of kidney uptake in radiometal labeled peptide linkers conjugated to recombinant antibody fragments. site-specific conjugation of DOTA-peptides to a cys-diabody. Bioconjugate Chemistry. 13 (5), 985-995 (2002).
- Li, J., Wang, X. H., Wang, X. M., Chen, Z. L. Site-specific conjugation of bifunctional chelator BAT to mouse IgG(1) Fab' fragment. Acta Pharmacologica Sinica. 27 (2), 237-241 (2006).
- Tinianow, J. N., et al. Site-specifically Zr-89-labeled monoclonal antibodies for ImmunoPET. Nuclear Medicine and Biology. 37 (3), 289-297 (2010).
- Li, L., et al. Site-specific conjugation of monodispersed DOTA-PEGn to a thiolated diabody reveals the effect of increasing PEG size on kidney clearance and tumor uptake with improved 64-copper PET imaging. Bioconjugate Chemistry. 22 (4), 709-716 (2011).
- Khalili, H., Godwin, A., Choi, J. -. w., Lever, R., Brocchini, S. Comparative binding of disulfide-bridged PEG-Fabs. Bioconjugate Chemistry. 23 (11), 2262-2277 (2012).
- Koniev, O., Wagner, A. Developments and recent advancements in the field of endogenous amino acid selective bond forming reactions for bioconjugation. Chemical Society Reviews. 44 (15), 5495-5551 (2015).
- Patterson, J. T., Asano, S., Li, X., Rader, C., Barbas, C. F. Improving the serum stability of site-specific antibody conjugates with sulfone linkers. Bioconjugate Chemistry. 25 (8), 1402-1407 (2014).
- Toda, N., Asano, S., Barbas, C. F. Rapid, stable, chemoselective labeling of thiols with Julia-Kocienski-like reagents: A serum-stable alternative to maleimide-based protein conjugation. Angewandte Chemie-International Edition. 52 (48), 12592-12596 (2013).
- Zhang, Q., et al. Last-step enzymatic F-18-fluorination of cysteine-tethered RGD peptides using modified Barbas linkers. Chemistry-a European Journal. 22 (31), 10998-11004 (2016).
- Chiotellis, A., et al. Novel chemoselective F-18-radiolabeling of thiol-containing biomolecules under mild aqueous conditions. Chemical Communications. 52 (36), 6083-6086 (2016).
- Adumeau, P., Davydova, M., Zeglis, B. M. Thiol-reactive bifunctional chelators for the creation of site-selectively modified radioimmunoconjugates with improved stability. Bioconjugate Chemistry. 29, 1364-1372 (2018).
- Sakamoto, J., Kojima, H., Kato, J., Hamashima, H., Suzuki, H. Organ-specific expression of the intestinal epithelium-related antigen A33, a cell surface target for antibody-based imaging and treatment in gastrointestinal cancer. Cancer Chemotherapy and Pharmacology. 46, S27-S32 (2000).
- Sakamoto, J., et al. A phase I radioimmunolocalization trial of humanized monoclonal antibody huA33 in patients with gastric carcinoma. Cancer Science. 97 (11), 1248-1254 (2006).
- Junutula, J. R., et al. Site-specific conjugation of a cytotoxic drug to an antibody improves the therapeutic index. Nature Biotechnology. 26 (8), 925-932 (2008).
- Pillow, T. H., et al. Site-specific trastuzumab maytansinoid antibody-drug conjugates with improved therapeutic activity through linker and antibody engineering. Journal of Medicinal Chemistry. 57 (19), 7890-7899 (2014).
- Boswell, C. A., et al. Enhanced tumor retention of a radiohalogen label for site-specific modification of antibodies. Journal of Medicinal Chemistry. 56 (23), 9418-9426 (2013).
- Boswell, C. A., et al. Impact of drug conjugation on pharmacokinetics and tissue distribution of anti-STEAP1 antibody-drug conjugates in rats. Bioconjugate Chemistry. 22 (10), 1994-2004 (2011).
- Alvarez, V. L., et al. Site-specifically modified 111In labelled antibodies give low liver backgrounds and improved radioimmunoscintigraphy. Nuclear Medicine and Biology. 13 (4), 347-352 (1986).
- Strop, P., et al. Location matters: SIte of conjugation modulates stability and pharmacokinetics of antibody drug conjugates. Chemistry, Biology. 20 (2), 161-167 (2013).
- Hallam, T. J., Wold, E., Wahl, A., Smider, V. V. Antibody conjugates with unnatural amino acids. Molecular Pharmaceutics. 12 (6), 1848-1862 (2015).
- Axup, J. Y., et al. Synthesis of site-specific antibody-drug conjugates using unnatural amino acids. Proceedings of the National Academy of Sciences. 109 (40), 16101-16106 (2012).
- Lang, K., Chin, J. W. Cellular incorporation of unnatural amino acids and bioorthogonal labeling of proteins. Chemical Reviews. 114 (9), 4764-4806 (2014).
- Yamasaki, R. B., Osuga, D. T., Feeney, R. E. Periodate oxidation of methionine in proteines. Analytical Biochemistry. 126 (1), 183-189 (1982).
- Wang, W., et al. Impact of methionine oxidation in human IgG1 Fc on serum half-life of monoclonal antibodies. Molecular Immunology. 48 (6-7), 860-866 (2011).
- O'Shannessy, D. J., Dobersen, M. J., Quarles, R. H. A novel procedure for labeling immunoglobulins by conjugation to oligosaccharide moieties. Immunology Letters. 8 (5), 273-277 (1984).
- Panowski, S., Bhakta, S., Raab, H., Polakis, P., Junutula, J. R. Site-specific antibody drug conjugates for cancer therapy. Mabs. 6 (1), 34-45 (2014).
- Hu, M. D., et al. Site-specific conjugation of HIV-1 tat peptides to IgG: a potential route to construct radioimmunoconjugates for targeting intracellular and nuclear epitopes in cancer. European Journal of Nuclear Medicine and Molecular Imaging. 33 (3), 301-310 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados