Method Article
Sintesi e Bioconjugation di tiolo-reattive reagenti per la creazione del sito-selettivamente per volta efattori
In questo articolo
Riepilogo
In questo protocollo, descriveremo la sintesi di cialde, un reagente basati su solfone metil phenyoxadiazolyl per il fissaggio dei carichi sito selettivo i tioli di biomolecole, in particolare gli anticorpi. Inoltre, descriveremo la sintesi e la caratterizzazione di un chelante bifunzionale baccelli-cuscinetto e la sua coniugazione di un anticorpo di modello.
Abstract
Sonde bifunzionale maleimide-cuscinetto sono state impiegate per decenni per la modifica sito-selettiva di tioli in biomolecole, soprattutto gli anticorpi. Ancora basato su maleimide coniugati visualizzazione limitata stabilità in vivo perché il sollevatore thioether succinimidyl possa subire una reazione di retrò-Michael. Questo, naturalmente, può portare al rilascio di payload radioattivo o relativo scambio con biomolecole di tiolo-cuscinetto in circolazione. Entrambi questi processi può produrre concentrazioni di attività elevati in organi sani come pure in diminuzione di concentrazioni di attività nei tessuti bersaglio, con conseguente ridotta formazione immagine contrasto e rapporti terapeutici più bassi. Nel 2018, abbiamo segnalato la creazione di un modulare, stalla e facilmente raggiungibile phenyloxadiazolyl metil solfone reagente — soprannominato 'Baccelli' — come una piattaforma per bioconiugazione tiolo-basato. Abbiamo chiaramente dimostrato che bioconiugazione sito-selettivo basato su cialde riproducibile e robustamente creare radioimmunoconjugates omogeneo, ben definito, altamente immunoreactive e altamente stabile. Inoltre, esperimenti preclinici in modelli murini di cancro colorettale hanno dimostrato che questi sito-selettivamente etichettato radioimmunoconjugates espositivo molto superiore in vivo delle prestazioni rispetto agli anticorpi radiomarcati sintetizzati tramite maleimide-basato coniugazioni. In questo protocollo, descriveremo la sintesi di quattro fasi di baccelli, la creazione di una variante di baccelli-cuscinetto bifunzionale dell'onnipresente chelante DOTA (cialde-DOTA) e la coniugazione di baccelli-DOTA per il targeting per HER2 anticorpo trastuzumab.
Introduzione
Radiofarmaci chimici lungo hanno sfruttato la selettività e specificità degli anticorpi per biomarcatori della malattia per entrambi imaging nucleare e mirata radioterapia1. Gran lunga il più comune approccio per la radiomarcatura di anticorpi si basa sull'attacco indiscriminato di radiomarcato gruppi prostetici o radiometal chelatori agli aminoacidi — più spesso lisine — all'interno della struttura dell'immunoglobulina ( Figura 1A)2. Mentre questa strategia è certamente efficace, la sua natura casuale, non sito specifico può creare problemi. In particolare, gli approcci tradizionali bioconjugation producono mal definito ed efattori eterogenei costituiti da miscele di migliaia di regioisomeri differenti, ognuna con un proprio set di proprietà biologiche e farmacologiche3. Inoltre, bioconjugation casuale può ostacolare il immunoreactivity di anticorpi, se il carico viene aggiunto ai domini di antigene-legante di immunoglobulina.
Nel corso degli anni, una varietà di strategie bioconjugation site-specific e sito-selettivi sono stati sviluppati al fine di affrontare questi problemi4,5. Il più comune di questi approcci si basa sulla legatura delle sonde maleimide-cuscinetto ai gruppi solfidrilici di cisteine (Figura 1B). Gli anticorpi IgG1 contengono naturalmente 4 ponti disolfuro di inter-catena, legami che possono essere ridotti in modo selettivo per produrre i tioli gratuiti in grado di subire reazioni di addizione di Michael con le maleimidi per formare legami tioetere succinimidyl. L'uso dei tioli e le maleimidi è certamente un miglioramento rispetto ai metodi tradizionali e un'ampia varietà di maleimide-cuscinetto Sintoni e chelanti bifunzionali attualmente disponibili. Tuttavia, è importante notare che questa metodologia ha seri limiti pure. Basato su maleimide efattori presentano limitata stabilità in vivo, poiché il sollevatore thioether possa subire una reazione di retrò-Michael (Figura 2)6,7,8,9, 10. questo, naturalmente, può portare al rilascio di payload radioattivo o relativo scambio con biomolecole di tiolo-cuscinetto in circolazione (ad es., glutatione o albumina). Entrambi questi processi possono aumentare le concentrazioni di attività in organi sani, nonché diminuire le concentrazioni di attività nei tessuti bersaglio, con conseguente ridotta formazione immagine contrasto e rapporti terapeutici più bassi. Sono stati sviluppati diversi reagenti alternativi tiolo-reattive nel tentativo di eludere questi problemi, tra cui tosylates, bromo - e iodo-acetili e vinile solfoni11,12,13, 14 , 15 , 16 , 17. Tuttavia, tutti questi approcci presentano limitazioni che hanno ostacolato la loro applicazione diffusa.
Circa cinque anni fa, il laboratorio di Carlos Barbas III allo Scripps Research Institute ha sperimentato l'uso dei solfoni metil phenyloxadiazolyl come reagenti per la formazione selettiva di legami altamente stabile con tioli (Figura 1 e figura 3) 18 , 19. gli autori hanno impiegato una variante del solfone-cuscinetto di metile phenyloxadiazolyl di fluorescina per modificare parecchi anticorpi ingegnerizzati per contenere residui di cisteina libera, producendo infine efattori con più alta stabilità che analoga costrutti creati utilizzando sonde maleimide-basato. Vedendo questo lavoro promettente, siamo rimasti un po' sorpresi che questa tecnologia era stata utilizzata solo a malapena in radiochimica e non era stato ancora utilizzata affatto nella sintesi di chelanti bifunzionali o radioimmunoconjugates20,21 . Questa scarsità di applicazioni, tuttavia, ben presto cominciò ad avere più senso: parecchi tentativi di procurarsi il reagente da Sigma-Aldrich ha provocato la ricevuta di miscele complesse di prodotti di degradazione con < 15% del composto desiderato. Inoltre, sintetizzando il reagente segnalato noi stessi non era un'opzione realistica, come il percorso sintetico pubblicato è alquanto complesso e richiede attrezzature sofisticate chimica organica che la maggior parte radiochimica e imaging molecolare laboratori — compreso il nostro — semplicemente non possiedono.
In risposta a questi ostacoli, abbiamo deciso di creare un facilmente accessibile e altamente stabile reagente del solfone di metile phenyloxadiazolyl che può essere ottenuto tramite un percorso sintetico robusto e ragionevolmente facile. All'inizio di quest'anno, abbiamo segnalato la creazione di un modulare, stalla e facilmente raggiungibile phenyloxadiazolyl metil solfone reagente — soprannominato 'Baccelli' — come una piattaforma per bioconiugazione tiolo-base (Figura 1 e figura 3)22. La differenza fondamentale tra le cialde e il reagente segnalato da Barbas, et al è che il primo impiega un anello di anilina attaccato nella frazione di phenyloxadiazolyl metil solfone, mentre quest'ultimo dispone di un fenolo nella stessa posizione (Figura 4). Questo cambiamento facilita un percorso sintetico più semplice e accessibile come pure — se la nostra esperienza con il composto commercialmente disponibile è emblematico — un reagente finale più stabile. In questo lavoro, abbiamo sintetizzato anche un paio di chelanti bifunzionali baccelli-cuscinetto — cialde-DFO e cialde-CHX-A cm-DTPA — per facilitare la creazione di 89Zr - e 177radioimmunoconjugates Lu-etichettati, rispettivamente. Come vedremo, abbiamo dimostrato che bioconiugazione sito-selettivo basato su cialde riproducibile e robustamente creare radioimmunoconjugates omogeneo, ben definito, altamente immunoreactive e altamente stabile. Inoltre, esperimenti preclinici in modelli murini di cancro colorettale hanno dimostrato che questi sito-selettivamente etichettato radioimmunoconjugates espositivo superior in vivo delle prestazioni rispetto agli anticorpi radiomarcati sintetizzati tramite maleimide-basato coniugazioni.
L'obiettivo generale di questo lavoro è quello di facilitare la creazione di ben definito, omogeneo, altamente stabile e altamente immunoreactive efattori per applicazioni in vitro e in vivo. L'approccio sintetico è abbastanza semplice da essere eseguito in quasi tutti i laboratori e il reagente di baccelli del genitore può essere modificato con una pletora di diversi chelatori, fluorofori o carichi. In questo protocollo e il video di accompagnamento, descriveremo la sintesi semplice, quattro fasi di baccelli (Figura 5); la creazione di una variante di baccelli-cuscinetto di DOTA, un chelatore ampiamente usato per il coordinamento di 64Cu, 68Ga, 111a, 177Lu e 225Ac (Figura 6); e il bioconjugation di baccelli-DOTA di un anticorpo di modello, il IgG1 come destinazione HER2 trastuzumab (Figura 7).
Protocollo
1. la sintesi di 4-[5-(methylthio)-1,3,4-oxadiazol-2-yl]-aniline (1)
Nota: A causa della sensibilità alla luce del composto, tenere tutte le reazioni nei vasi coperti di stagnola.
- In 10 mL di un pallone, sciogliere 100 mg (0.517 mmol, 1 equivalente) di 5-(4-aminophenyl)-1,3,4-oxadiazole-2-thiol in 3 mL di metanolo.
- Per questa soluzione, aggiungere 360 μL di diisopropylethylamine (DIPEA; 2.07 mmol; 4 equivalenti; anidro) e una piccola ancoretta magnetica. Coprire il recipiente con un tappo di gomma e agitare la soluzione per 10 minuti a temperatura ambiente.
- Utilizzando una siringa di vetro da 1 mL, poke un buco attraverso il tappo di gomma e aggiungere rapidamente 32 μL (0.517 mmol, 1 equivalente) di iodometano a questa miscela. Lasciare che la miscela di reazione per 45 minuti a temperatura ambiente.
Nota: A causa degli effetti nocivi potenziali di iodometano, questa reazione deve essere eseguita in una cappa chimica. - Impostare il bagno di acqua di un evaporatore rotante a 40 ° C e lentamente ridurre la pressione per rimuovere il solvente per permettersi un solido bianco.
- Sciogliere il solido in 3 mL di acetato di etile e lavare almeno tre volte con 5 mL di soluzione di carbonato di sodio 0,1 M utilizzando un imbuto separatore.
Nota: Periodicamente prendere posto-test della fase acquosa sotto una lampada UV; una volta che non si vede sotto la lampada, è possibile interrompere i lavaggi. - Raccogliere la fase organica in un imbuto separatore e lavarlo con acqua fino a quando il pH della fase acquosa raggiunge 6,8-7,0 (utilizzando carta pH).
- Raccogliere la fase organica e aggiungere solfato di magnesio per rimuovere eventuali tracce di acqua.
Nota: Il solfato di magnesio deve essere aggiunto con una spatolina, dopo di che la soluzione dovrebbe essere roteata. Se le particelle fini di agente essiccatore sono ancora visti, la soluzione è asciutta. In caso contrario, aggiungere piccole quantità di solfato di magnesio fino a quando le particelle fini possono essere visto. - Filtrare la miscela utilizzando un setto di vetro medio o carta da filtro.
- Far evaporare le sostanze volatili utilizzando un evaporatore rotante, un processo che dovrebbe produrre il prodotto desiderato come aghi bianchi.
2. la sintesi di tert-butyl[18-({4-[5-(methylthio)-1,3,4-oxadiazol-2-yl]phenyl}amino)-15,18-dioxo-4,7,10-trioxa-14-azaoctadecyl] carbammato (2)
Nota: A causa della sensibilità alla luce del composto, tenere tutte le reazioni nei vasi coperti di stagnola.
- In 25 mL di un pallone, sciogliere 387 mg (0,92 mmol, 1,0 equivalenti) di NBoc-N′-succinil-4,7,10-trioxa-1,13-tridecanediamine in 10 mL di diclorometano.
- Per questa soluzione, aggiungere 480 μL (2,76 mmol, 3 equivalenti) di DIPEA, 264 mg (1,38 mmol; 1,5 equivalenti) di N-etil - N′-[3-(dimetilammino) propil] carbidimiide cloridrato (EDCI) e 200 mg (0.97 mmol, 1,1 equivalenti) di 1. Sigillare il recipiente con un tappo di vetro e lasciare che la reazione di mescolare per 5 giorni a temperatura ambiente.
Nota: Essere consapevoli dell'evaporazione del diclorometano. Se necessario, aggiungere più per tutta la settimana. - Lavare la miscela in un imbuto separatore con una soluzione di acido cloridrico 1 M (3 x 5 mL).
- Raccogliere la fase organica e continuare a lavare in un imbuto separatore, prima con una soluzione di 1m Na2CO3 (2 x 5 mL) e poi con acqua (3 x 5 mL).
- Raccogliere la fase organica e aggiungere solfato di magnesio per rimuovere eventuali tracce di acqua (Vedi punto 1.7). Filtrare la miscela utilizzando un setto di vetro medio o carta da filtro.
- Utilizzando un evaporatore rotante, rimuovere i solventi volatili sotto pressione ridotta per permettersi un solido biancastro.
- Ri-sciogliere questo solido in 10 mL di acetato di etile e precipitare il prodotto tramite l'aggiunta graduale (ad es., 2 mL in un momento) di 30 mL di cicloesano.
- Filtrare la soluzione con carta da filtro o un setto di vetro medio per ottenere il prodotto come una polvere bianca.
3. la sintesi di tert-butyl[18-({4-[5-(methylsulfonyl)-1,3,4-oxadiazol-2-yl]phenyl}amino)-15,18-dioxo-4,7,10-trioxa-14-azaoctadecyl] carbammato (3)
Nota: A causa della sensibilità alla luce del composto, tenere tutte le reazioni nei vasi coperti di stagnola.
- In un pallone da 10 mL, sciogliere 30 mg (0,05 mmol; 1 equivalente) di 2 a 4 mL di diclorometano.
- Lentamente aggiungere a 49 mg (0,2 mmol; 4 equivalenti) di 70% di acido m-chloroperbenzoic a questa miscela e coprire il recipiente di reazione con un tappo di vetro. Agitare la soluzione durante la notte a temperatura ambiente, in ultima analisi, producendo una miscela di gialla.
- Lavare la miscela gialla in un imbuto separatore, prima con una soluzione 0,1 M di NaOH (3 x 5 mL) e poi con acqua (3 x 5 mL).
- Asciugare la fase organica con il solfato di magnesio e filtrare la miscela utilizzando un setto di vetro medio o carta da filtro.
- Utilizzando un evaporatore rotante, rimuovere i solventi sotto pressione ridotta per ottenere il prodotto come un solido pallido.
4. la sintesi di N1-(3-{2-[2-(3-aminopropoxy)ethoxy]-ethoxy}propyl)-N4-{4-[5-(methylsulfonyl)-1,3,4-oxadiazol-2-yl] fenil} succinamide (PODS)
- In 25 mL di un pallone, sciogliere 30 mg di 3 a 2,0 mL di diclorometano.
- Aggiungere 400 μL di acido trifluoroacetico e sigillare il recipiente con un tappo di vetro.
- Mescolare la miscela di reazione a temperatura ambiente per 3 ore.
- Utilizzando un evaporatore rotante, rimuovere le sostanze volatili sotto pressione ridotta a temperatura ambiente, lasciando un residuo oleoso.
- Sciogliere il residuo oleoso in 7 mL di acqua e, utilizzando un imbuto separatore, lavare con acetato di etile (3 x 4 mL). Mantenere lo strato acquoso.
- Lyophilize lo strato acquoso per permettersi baccelli come una polvere bianca.
Nota: I coefficienti di assorbimento molare per cialde a 280 e 298 nm sono 9.900 e 12.400 cm-1M-1, rispettivamente.
5. la sintesi di baccelli-DOTA
- In una provetta da microcentrifuga da 1,5 mL, sciogliere 10 mg di cialde in 300 μL di solfossido dimetilico (0.018 mmol; 1 equivalente) e aggiungere 26 μL di N, N-diisopropylethylamine (0,15 mmol; 8 equivalenti).
- Sciogliere 15,2 mg di DOTA-Bn-NCS (0.02 mmol; 1,2 equivalenti) in 100 μL del dimetilsulfossido e combinare questa soluzione con la soluzione dal passaggio 5.1. Sigillare il tubo del microcentrifuge.
- Consentire la reazione a incubare per una notte a temperatura ambiente.
- Purificare il prodotto mediante cromatografia HPLC di inverso-fase C18 per rimuovere qualsiasi non reagito DOTA-Bn-NCS.
Nota: Tempi di ritenzione sono ovviamente fortemente dipendente dalle apparecchiatura HPLC di ogni laboratorio (pompe, colonne, tubi, ecc.), e controlli appropriati devono essere eseguiti prima della purificazione. Tuttavia, per presentare un esempio, se una pendenza di 5: 95 MeCN/H2O (entrambi con 0,1% TFA) a 70: 30 MeCN/H2O (entrambi con 0,1% TFA) vengono utilizzati oltre 30 min, una colonna di18 semi-preparatorio 19 x 250 mm C e una portata di 6 mL/min , Baccelli, p-SCN-Bn-DOTA e cialde-DOTA avranno tempi di ritenzione di circa 14,4 e 18,8 19,6 min, rispettivamente. Tutti e tre i composti possono essere monitorati a 254 nm.
6. il bioconjugation di baccelli-DOTA al trastuzumab
Nota: Per questo passaggio, abbiamo iniziato con una soluzione di riserva di 16,4 mg/mL di trastuzumab.
- In un tubo del microcentrifuge di proteina bassa associazione 1,5 mL, diluire 61 μL della soluzione madre trastuzumab (1 mg; 6.67 nmol, 1 equivalente) con 859 μL di soluzione salina tampone fosfato (pH 7,4).
- A questa miscela, aggiungere 6,7 μL di soluzione preparata 10mm di TCEP in H2O (66,7 nmol, 10 equivalenti).
- Preparare una soluzione di 1 mg/mL di baccelli-DOTA in DMSO e aggiungere 73 μL di questa soluzione di baccelli-DOTA la miscela di reazione (66.67 nmol, 10 equivalenti).
- Il tubo del microcentrifuge ed incubare la soluzione per 2 ore a temperatura ambiente.
- Dopo 2 ore, purificare il immunoconjugate utilizzando una colonna di dissalazione esclusione dimensioni monouso pre-confezionati.
- In primo luogo, equilibrare la colonna di esclusione di dimensione come descritto dal fornitore per rimuovere eventuali conservanti presenti nella colonna durante la conservazione. Una tipica procedura coinvolge la colonna 5 volte con un volume di PBS che corrisponde al volume della colonna di lavaggio: 5 x 2,5 mL di PBS.
- Successivamente, aggiungere la miscela di reazione nella colonna di esclusione di dimensione notando il volume della miscela di reazione.
- Dopo la miscela di reazione è entrato la colonna, aggiungere una quantità appropriata di PBS per portare il volume totale della soluzione aggiunto alla colonna fino a 2,5 mL. Ad esempio, se la reazione di coniugazione è provocato da un volume totale di 1,3 mL, 1,2 mL di PBS ulteriori avrebbe bisogno di essere aggiunto alla colonna.
- Infine, raccogliere il prodotto utilizzando 2 mL di PBS come eluente.
- Concentrare il immunoconjugate finale con unità di filtrazione centrifuga con un limite di peso molecolare 50 kDa.
Risultati
I primi quattro passaggi del presente protocollo — la sintesi dei baccelli — sono stati progettati per essere robusti ed affidabili. La deprotonazione e sostituzione di 5-(4-aminophenyl)-1,3,4-oxadiazole-2-thiol per formare il prodotto desiderato thioether permette il thioether in > 99% di rendimento dopo appena 45 minuti. Successivamente, la legatura tra 1 e N-Boc-N'-succinyl-4,7,10-trioxa-1,13-tridecanediamine è stata realizzata via un peptide standard procedura di accoppiamento, con conseguente raccolta del prodotto (2) in 55% di rendimento. Quindi, l'ossidazione di 2 è stata eseguita utilizzando acido m-cloroperossibenzoico, un ossidante ampiamente usato. Seguendo le fasi di lavaggio, 3 è stata ottenuta come un solido pallido in ~ 90% di rendimento. Infine, la rimozione del gruppo tert-butyloxycarbonyl protezione da 3 è stato fatto secondo le procedure standard, utilizzando un rapporto di 4:1 di acido dichloromethane:trifluoroacetic. Dopo la liofilizzazione della fase acquosa, nostro prodotto — cialde — è stata ottenuta come una polvere bianca in 98% di rendimento. Lo stato di avanzamento della reazione è stato seguito tramite cromatografia su strato sottile, e l'identità di ciascun prodotto è stata confermata tramite 1H-NMR, 13C-NMR e HRMS-ESI (tabella 1).
Uno dei vantaggi principali del reagente baccelli è la sua modularità. Una varietà di chelanti, fluorofori, tossine o altri carichi possa essere aggiunti al ammina pendente del composto. Nel protocollo a portata di mano, stiamo usando il chelante onnipresente DOTA (acido 1,4,7,10-tetraazaciclododecano-1,4,7,10-tetraacetico) come rappresentante payload. DOTA, naturalmente, è stato utilizzato in una vasta gamma di radiofarmaci biomolecolari come un chelante per radiometalli compresi 68Ga, 64Cu, 111a, 90Y, 177Lu e 225Ac. A tal fine, una variante di isotiocianato-cuscinetto di DOTA (p-SCN-Bn-DOTA) è stata impiegata e accoppiata ad ammina tramite condizioni di accoppiamento semplice ciondolo dei baccelli. Il chelante bifunzionale risultante è stato poi purificato tramite fase inversa C18 HPLC e isolato in ~ 75% di rendimento. Come con altri precursori, lo stato di avanzamento della reazione è stato seguito tramite cromatografia su strato sottile, e l'identità del prodotto è stata confermata tramite 1H-NMR, 13C-NMR e HRMS-ESI (tabella 1).
Nel passaggio finale del protocollo, discutiamo il bioconjugation sito-selettiva di baccelli-DOTA di un'immunoglobulina di modello, il targeting per HER2 anticorpo trastuzumab. A tal fine, i legami bisolfurico della regione cerniera dell'anticorpo attenuare selettivamente con l'agente riducente TCEP [tris(2-carboxyethyl) fosfina]. A seguito di questa fase di riduzione, l'anticorpo è incubato con baccelli-DOTA per 2 h a temperatura ambiente e successivamente purificato tramite cromatografia di esclusione di formato. In questo caso, il immunoconjugate purificato, DOTA-cuscinetto è stata ottenuta in ~ 80% di rendimento, e l'analisi MALDI-ToF ha rivelato un grado di etichettatura (DOL) del ~1.8 DOTA/mAb. In generale, abbiamo trovato che 10 equivalenti di TCEP, 10 equivalenti del reagente di baccelli e un 2 h di incubazione sono sufficienti a produrre un immunoconjugate con un DOL di 2 cialde/mAb (tabella 2). Questo risultato rimane coerenza in tutta una gamma di anticorpi IgG1 umane, umanizzati e chimerici; Tuttavia, le stesse condizioni di producono efattori con un DOL di solo ~1.5 quando si lavora con gli anticorpi IgG1 murini. Detto questo, i ricercatori dovrebbero ottimizzare queste condizioni di reazione per nuovi anticorpi e carichi di baccelli-cuscinetto. Infine e soprattutto, rispetto al prodotto finale, abbiamo ripetutamente e riproducibile trovato che basati su cialde efattori esibiscono immunoreactivities pari o meglio di costrutti analoghi creati utilizzando casuale o basata su maleimide strategie di coniugazione.
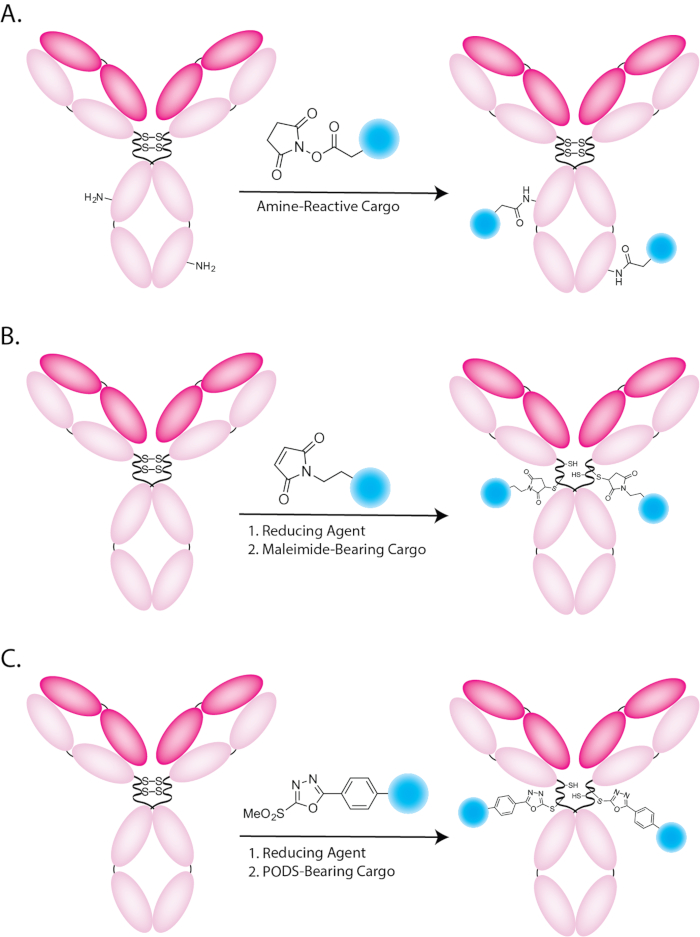
Figura 1: Illustrazione schematica di bioconiugazione utilizzando (A) (B) ammina-reattivo, maleimide-cuscinetto e carichi di baccelli-cuscinetto (C). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: L'aggiunta di Michael di una biomolecola tiolo-cuscinetto (verde) e un maleimide del radionuclide-cuscinetto (giallo) per formare un bioconjugate radioattivo, come pure le reazioni aggiuntive che il costrutto radiomarcato può subire in presenza di endogeno molecole di tiolo-cuscinetto (rosa). RT = temperatura ambiente. Figura ristampata con il permesso di Adumeau, P., Davydova, M., Zeglis, b. M. chelanti bifunzionali tiolo-reattive per la creazione del sito-selettivamente per volta Radioimmunoconjugates con stabilità migliorata. Bioconjugate chimica. 29, 1364-1372 (2018). Copyright 2018 American Chemical Society. Clicca qui per visualizzare una versione più grande di questa figura.
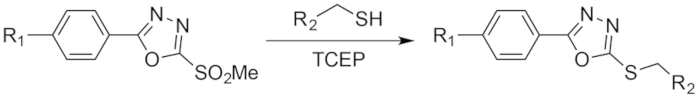
Figura 3: Schema della reazione tra cialde e un tiolo. Figura ristampata con il permesso di Adumeau, P., Davydova, M., Zeglis, b. M. chelanti bifunzionali tiolo-reattive per la creazione del sito-selettivamente per volta Radioimmunoconjugates con stabilità migliorata. Bioconjugate chimica. 29, 1364-1372 (2018). Copyright 2018 American Chemical Society. Clicca qui per visualizzare una versione più grande di questa figura.
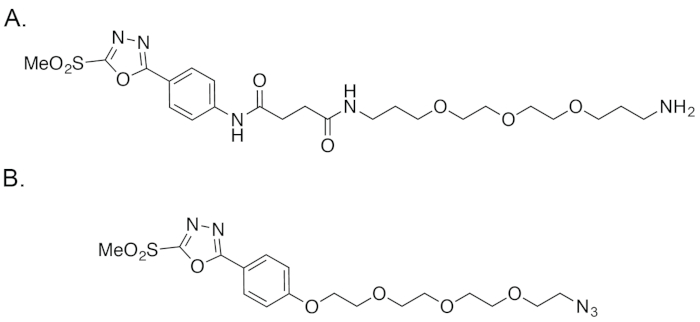
Figura 4: La struttura dei baccelli (A) , nonché (B) il reagente segnalato da Barbas, et al.18,19Clicca qui per visualizzare una versione più grande di questa figura.
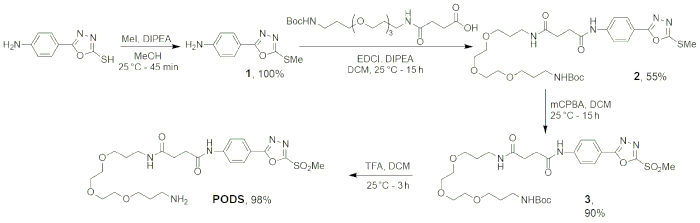
Figura 5: Schema di sintesi quattro fasi di cialde. Figura ristampata con il permesso di Adumeau, P., Davydova, M., Zeglis, b. M. chelanti bifunzionali tiolo-reattive per la creazione del sito-selettivamente per volta Radioimmunoconjugates con stabilità migliorata. Bioconjugate chimica. 29, 1364-1372 (2018). Copyright 2018 American Chemical Society. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Schema di sintesi dei baccelli-DOTA. Clicca qui per visualizzare una versione più grande di questa figura.
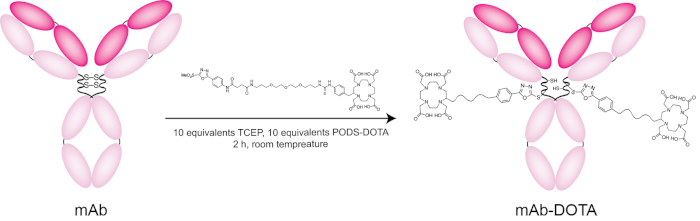
Figura 7: Schema di bioconjugation di trastuzumab con baccelli-DOTA. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 8: Confronto tra il comportamento in vivo di 89radioimmunoconjugates Zr-etichetta di huA33 creato utilizzando basati su cialde (89Zr-DFO-cialde-huA33) e strategie bioconjugation maleimide-basato (89Zr-DFO-mal-huA33). Planar (a sinistra) e intensità massima proiezione (a destra) PET immagini di nudi athymic cuscinetto A33 che esprimono l'antigene SW1222 cancro colorettale xenotrapianti (freccia bianca) dopo l'iniezione di 89Zr-DFO-cialde-huA33 e 89 ZR-DFO-mal-huA33 (140 µ ci, 60-65 µ g). Le sezioni coronale si intersecano al centro dei tumori. Figura ristampata con il permesso di Adumeau, P., Davydova, M., Zeglis, b. M. chelanti bifunzionali tiolo-reattive per la creazione del sito-selettivamente per volta Radioimmunoconjugates con stabilità migliorata. Bioconjugate chimica. 29, 1364-1372 (2018). Copyright 2018 American Chemical Society. Clicca qui per visualizzare una versione più grande di questa figura.
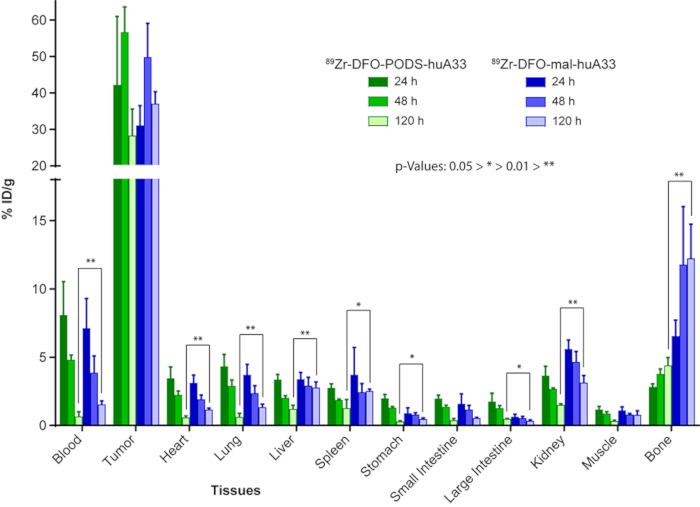
Figura 9: Confronto tra il comportamento in vivo di 89radioimmunoconjugates Zr-etichetta di huA33 creato utilizzando basati su cialde (89Zr-DFO-cialde-huA33) e strategie bioconjugation maleimide-basato (89Zr-DFO-mal-huA33). Biodistribuzione dati dopo la somministrazione di 89Zr-DFO-cialde-huA33 e 89Zr-DFO-mal-huA33 (30 µ ci, 15-18 µ g) di topi nudi athymic cuscinetto A33 che esprimono l'antigene di una SW1222 di sottocutaneo xenotrapianti di cancro colorettale umano. I valori per stomaco, intestino tenue e crasso includono contenuto. Figura ristampata con il permesso di Adumeau, P., Davydova, M., Zeglis, b. M. chelanti bifunzionali tiolo-reattive per la creazione del sito-selettivamente per volta Radioimmunoconjugates con stabilità migliorata. Bioconjugate chimica. 29, 1364-1372 (2018). Copyright 2018 American Chemical Society. Clicca qui per visualizzare una versione più grande di questa figura.
| Composto | 1 H-NMR turni | 13 C-NMR turni | HRMS | |||
| 1 | (500 MHz, CDCl3) 7.79 (2h, d, J = 8,5 Hz), 6.72 (2h, d, J = 8,5 Hz), 4,04 (2h, br s), 2.75 (3h, s) | (125 MHz, CDCl3) 166,3, 163,7, 149,7, 128,5, 114,8, 113.5, 14,8 | m/z calcolato per [C9H9N3OS + H]+: 208.0539; trovato: 208.0539; Δ: 0,0 ppm | |||
| 2 | (500 MHz, CDCl3) 9.68 (1H, s), 7,91 (2h, d, J = 9,0 Hz), 7.71 (2h, d, J = 8,5 Hz), 6,82 (1H, s), 4.99 (1H, s), 3.70-3.45 (12H, m), 3.41 (2H, q, J = 6,0 Hz), 3.20 (2H, q, J = 6,5 Hz), 2.76 (3h, s), 2.71 (2H, m), 2.63 (2H m), 1,80-1.70 (4 H, m), 1.42 (9 H, s) | (125 MHz, CDCl3) 172.6, 171.3, 165,8, 164,6, 156,2, 141,8, 127,7, 119,6, 118.6, 79,2, 70,6, 70,5, 70.3, 70,1, 69,6, 38,8, 38.5, 33.5, 31,6, 29.9, 28.6, 14,8 | m/z calcolato per [C28H43N5O8S + Na]+: 632.2725; trovato: 632.2722; Δ:-0,470 ppm | |||
| 3 | (500 MHz, CDCl3) 9.99 (1 H, s), 7,98 (2h, d, J = 9,0 Hz), 7.75 (2h, d, J = 8,5 Hz), 6,88 (1 H, s), 4.99 (1 H, s), 3,66-3.50 (15 H, m), 3.41 (2 H, q, J = 6,0 Hz), 3.20 (2 H, q, J = 6,5 Hz), 2.71 (2 H, m), 2.65 (2 H, m) , 1.80-1.70 (4H, m), 1.43 (9H, s) | (125 MHz, CDCl3) 172.6, 171,5, 166,5, 161.6, 156,1, 143,4, 128,7, 119,6, 116.4, 79,1, 70,5, 70,4, 70.2, 70,0, 69,4, 43.0, 38,8, 38,4, 33.2, 31.3, 29,7, 28,4 | m/z Calcolato per [C28H43N5O10S + H]+: 642.2803; trovato: 642.2797; Δ:-0,930 ppm | |||
| BACCELLI | (500 MHz, D2O) 7,85 (2h, d, J = 9,0 Hz), 7,55 (2h, d, J = 8,5 Hz), 3,60-3.45 (15 H, m), 3.45 (2 H, t, J = 6,5 Hz), 3.20 (2 H, t, J = 6,5 Hz), 3,04 (2 H, t, J = 7,0 Hz), 2,67 (2 H, t, J = 6,5 Hz), 2,54 (2 H t, J = 6,5 Hz), 1,87 (2h, qt, J = 6,5 Hz), 1.70 (2h, qt, J = 6,5 Hz) | (125 MHz, D2O) 174,5, 173,2, 166.8, 161,4, 142,2, 128,6, 120,3, 116,6, 69,4, 69,4, 69,3, 69,2, 68,2, 68,2, 42.5, 37,6, 36,2, 31,9, 30,7, 28.2, 26,4 | m/z Calcolato per [C23H35N5O8S + H]+: 542.2279; trovato: 542.2281; Δ: 0,37 ppm | |||
| CIALDE-DOTA | (600 MHz, DMSO-d6) 10,46 (1 H, s), 9,74 (1h, bs), 8.04 (2h, d, J = 8,6 Hz), 7.99 (1 H, s), 7,90 (1h, t, J = 5,0 Hz), 7.86 (2h, d, J = 6,5 Hz), 7.44 (2h, d, J = 7,9 Hz), 7,24 (2h, d, J = 7,1 Hz), 4,35-2,41 (45 H, m) , 3.70 (3h, s), 1.76 (2H, q, J = 6,3 Hz), 1.61 (2H, q, J = 6,5 Hz) | (125 MHz, DMSO-d6) 171,8, 171,4, 166.1, 162,2, 158,8, 158,6, 129,8, 129.0, 127.6, 123.3, 119,5, 118,5, 116,5, 116.4, 70.2, 70,1, 70,0, 68,7, 68,5, 43.4, 41,8, 36,3, 32.2, 30.4, 29,8, 29.1 | m/z Calcolato per [C47H68N10O16S2+ H]+: 1093.4334; trovato: 1093.4327; Δ:-0,640 ppm | |||
Tabella 1. Dati di caratterizzazione per i prodotti intermedi sintetici descritto così come le cialde e cialde-DOTA.
| Anticorpo | digitare | Regione costante | Rapporto di baccelli: mAb |
| Plasma umano IgG | Umano | IgG umano | 2,1 ± 0,1 |
| Trastuzumab | Umanizzato | IgG1 umana | 2,0 ± 0,1 |
| huA33 | Umanizzato | IgG1 umana | 2,1 ± 0,1 |
| Cetuximab | Chimerico | IgG1 umana | 2,2 ± 0,1 |
| AR 9,6 | Murino | IgG1 murina | 1,4 ± 0,1 |
| Al plasma mouse IgG | Murino | Murino IgG | 1,5 ± 0,1 |
Tabella 2. Grado di etichettatura di diversi anticorpi dopo coniugazione con un fluoroforo baccelli-cuscinetto. Deviazioni standard sono indicati valori. Tabella ristampato con il permesso di Adumeau, P., Davydova, M., Zeglis, b. M. chelanti bifunzionali tiolo-reattive per la creazione del sito-selettivamente per volta Radioimmunoconjugates con stabilità migliorata. Bioconjugate chimica. 29, 1364-1372 (2018). Copyright 2018 American Chemical Society.
Discussione
In questo rapporto, abbiamo scelto di non includere eventuali protocolli per la sperimentazione radiolabeling o in vivo. Le ragioni sono semplici. Per quanto riguarda i primi, la radiomarcatura di un immunoconjugate basato su cialde non differisce affatto da quella di un immunoconjugate sintetizzati utilizzando altre strategie bioconjugation, e queste procedure sono state completamente recensione altrove2 . Per quanto riguarda quest'ultimo, le specifiche di preclinici esperimenti in vivo (cioè, modelli murini, dosi, ecc.) possono variare ampiamente secondo l'applicazione e il sistema di anticorpi e antigeni.
Le nostre indagini precedenti con 89Zr-identificato varianti di huA33 forniscono una convincente illustrazione dei vantaggi di bioconiugazione basati su cialde. HuA33 è un anticorpo IgG1 umanizzato che gli obiettivi l'antigene A33, una glicoproteina transmembrana espressa su > 95% dei cancri colorettali23,24. Nel nostro precedente manoscritto22, segnaliamo la sintesi di 89Zr-DFO-huA33 radioimmunoconjugate utilizzando entrambe le strategie basate su cialde e maleimide bioconjugation. I due radioattivi anticorpi — 89Zr-DFO-cialde-huA33 e 89Zr-DFO-mal-huA33 — sono state prodotte in quasi identica resa, purezza, attività di specificità e il immunoreactivity. Criticamente, tuttavia, i due radioimmunoconjugates hanno esibito drammaticamente diversa stabilità nel siero umano: dopo incubazione per sette giorni a 37 ° C, 89Zr-DFO-cialde-huA33 intatto 86 ± 1%, mentre il relativo cugino maleimide-base era solo 61 ± 5% intatto. In vivo imaging PET e biodistribuzione esperimenti in topi nudi athymic cuscinetto A33 che esprimono l'antigene SW1222 cancro colorettale umano xenotrapianti rivelato nette differenze nel comportamento in vivo delle due radioimmunoconjugates (Figura 8 e Figura 9). Sia 89Zr-DFO-cialde-huA33 e 89Zr-DFO-mal-huA33 produrre concentrazioni di alta attività nel tessuto del tumore: 56,4 ± 6.9%ID/g e 49,6 ± 9.3%ID/g, rispettivamente, 48 h dopo la somministrazione. Tuttavia, il radioimmunoconjugate base di maleimide prodotto significativamente più alte concentrazioni di attività in tessuti sani che l'agente basato su cialde. Per esempio, 89Zr-DFO-mal-huA33 prodotto concentrazioni di attività di 3,1 ± 0.5, 2,7 ± 0,4 e 12,2 ± 0,4% ID/g a reni, fegato e osso, rispettivamente, a 120 h post-iniezione, valori che superano notevolmente le concentrazioni di attività prodotto da 89Zr-DFO-cialde-huA33 negli stessi tessuti (1,4 ± 0.1, 1,2 ± 0,3 e 4,3 ± 0,6% ID/g). Effetti, 89Zr-DFO-cialde-huA33 produce concentrazioni più basse di attività in tutti i tessuti non bersaglio (eccetto l'intestino crasso) a 120 h post-iniezione rispetto a 89Zr-DFO-mal-huA33. Di conseguenza, i rapporti di concentrazione di attività del tumore--organo per 89Zr-DFO-cialde-huA33 sono generalmente superiori a quelle di 89Zr-DFO-mal-huA33; in particolare, il tumore al fegato, tumore alla milza, tumore al rene e concentrazione di attività del tumore-osso rapporti sono quasi il doppio per il immunoconjugate basato su cialde rispetto al suo cugino maleimide-derivato. Considerando che la differenza principale tra le due radioimmunoconjugates era il manico bioconjugation del chelante, la maggiore stabilità del collegamento baccelli-tiolo è quasi certamente responsabile di questo miglioramento delle prestazioni in vivo.
Prendendo una visione più ampia, il bioconjugation non-sito-selettivi di sonde di Lisine all'interno di anticorpi è certamente un approccio semplice e facile alla modificazione degli anticorpi. Tuttavia, la presenza di multiple lisine distribuiti in tutta la struttura delle immunoglobuline significa che è impossibile esercitare un controllo sul sito preciso o il grado di bioconjugation2. Di conseguenza, questa strategia casuale produce spesso mal definito ed efattori altamente eterogenei che possono esibire ridotta immunoreattività se legature si verificano all'interno di domini l'antigene-legante3. I vantaggi degli approcci selettivi sito a bioconjugation sono stati illustrati più volte per entrambi radioimmunoconjugates e anticorpo-farmaco coniugati8,14,25,26, 2728,,29,30. In breve, non solo fanno sito selettivo bioconjugation strategie producono più ben definiti ed efattori omogeneo rispetto a metodologie tradizionali, essi inoltre creare imaging agenti, radioimmunotherapeutics e ADC con prestazioni migliorate in vivo. Ma dove trovo basati su cialde legature in confronto ad altre strategie di modifica sito-selettiva? In linea generale, gli approcci alla modifica sito-selettivo di anticorpi possono essere classificati in quattro categorie: (1) legature a residui di cisteina, (2) la manipolazione dei glicani la catena pesante, trasformazioni (3) chemoenzimatica e (4) l'uso di ingegneria genetica4,5. Naturalmente, questo sistema di classificazione non è perfetto, e alcuni approcci (ad esempio, modifica i glicani catena pesante con enzimi) inevitabilmente qualificano per due categorie. Ogni strategia ha i suoi vantaggi e svantaggi. Gli approcci basati su ingegneria genetica forniscono controllo squisito sul sito di coniugazione, eppure sono complesse e costose31,32,33. Ossidativi giunti per la catena pesante glicani sono poco costoso e semplice, eppure rischiano di danno ossidativo per l'integrità strutturale delle immunoglobuline34,35,36,37 ,38.
Il vantaggio principale di tiolo-based bioconiugazione — cialde incluse — è la loro semplicità e modularità. Loro principale limitazione, invece, deriva dalla presenza dei tioli multipli all'interno di un anticorpo, una caratteristica che riduce il grado di controllo sia il sito di Coniugazione e il numero di modifiche per l'anticorpo. In questo senso, la combinazione di legature del tiolo-basato e gli anticorpi che sono stati geneticamente per possedere residui di cisteina libera è un approccio particolarmente attraente. Come abbiamo notato, un altro limite delle legature maleimide-basato del tiolo è la suscettibilità del legame tioetere succinimidyl retrò-Michael aggiunte in vivo. Ancora criticamente, l'uso di cialde abroga questo problema.
Prima di concludere, è importante tenere presente che la natura emergente di baccelli tecnologia può creare una propria serie di ostacoli. Ad esempio, nessun chelanti bifunzionali baccelli-cuscinetto (attualmente) sono disponibili in commercio e non sono disponibili dati riguardanti la farmacologia clinica, tossicologia o immunogenicità di efattori basato su cialde. Tuttavia, crediamo che basati su cialde bioconiugazione hanno il potenziale per cambiare radicalmente il modo efattori sono sintetizzati in laboratorio e clinica. Allo stato attuale, abbiamo solo applicato questa tecnologia chimica per lo sviluppo di radioimmunoconjugates per l'imaging nucleare e radioimmunotherapy, anche se le indagini nell'utilità di questo approccio per la costruzione di anticorpo-farmaco coniugati e altri farmaci biomolecolari sono attualmente in corso. Alla fine, speriamo sinceramente che questo protocollo — e in particolare la chimica semplice e semplice che abbiamo sviluppato — contribuirà a promuovere l'uso dei solfoni metil phenyloxadiazolyl per basati su solfidrilici coniugazioni e stimolare un cambiamento nel campo da maleimidi alle alternative più stabile e più affidabile.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori ringraziano il Dr. Sai Kiran Sharma per conversazioni utili.
Materiali
| Name | Company | Catalog Number | Comments |
| 5-(4-aminophenyl)-1,3,4-oxadiazole-2-thiol | Sigma-Aldrich | 675024 | |
| 1.5 mL LoBind Microcentrifugal Tube | Eppendorf | 925000090 | |
| 1.5 mL Microcentrifugal Tube | Fisherbrand | 05-408-129 | |
| Acetonitrile | Fisher Scientific | A998-4 | |
| Amicon Ultra-2 Centrifugal Filter Unit | EMD Millipore | EN300000141G | |
| Cyclohexane | Fisher Scientific | C556-4 | |
| Dichloromethane | Fisher Scientific | AC383780010 | |
| Diisopropylethylamine | MP Biomedicals, LLC | 150915 | |
| Dimethylsulfoxide | Fisher Scientific | 31-727-5100ML | |
| Ethyl Acetate | Fisher Scientific | E145 4 | |
| Hydrochloric Acid | Fisher Scientific | A144-500 | |
| Iodomethane | Sigma-Aldrich | 289566-100G | |
| Magnesium Sulfate | Acros Organics | 413485000 | |
| m-chloroperbenzoic acid | Sigma-Aldrich | 273031 | |
| Methanol | Fisher Scientific | A412 1 | |
| NBoc-N′-succinyl-4,7,10-trioxa-1,13-tridecanediamine | Sigma-Aldrich | 671401 | Store at -80 °C |
| N-ethyl-N′- [3- (dimethylamino)propyl] carbodiimide hydrochloride | Sigma-Aldrich | 3450 | |
| Phosphate Buffered Saline | Sigma-Aldrich | P5493 | 10× Concentration |
| p-SCN-Bn-DOTA | Macrocyclics | B-205 | Store at -80 °C |
| Sephadex G-25 in PD-10 Desalting Columns | GE Healthcare | 17085101 | |
| Sodium Carbonate | Sigma-Aldrich | S7795 | |
| Sodium Hydroxide | Fisher Scientific | S318-1 | |
| TCEP | ThermoFischer Scientific | 20490 | |
| Triethylamine | Fisher Scientific | AC157911000 | |
| Trifluoroacetic Acid | Fisher Scientific | A116-50 |
Riferimenti
- Wu, A. M. Antibodies and antimatter: The resurgence of immuno-PET. Journal of Nuclear Medicine. 50 (1), 2-5 (2009).
- Zeglis, B. M., Lewis, J. S. A practical guide to the construction of radiometallated bioconjugates for positron emission tomography. Dalton Transactions. 40 (23), 6168-6195 (2011).
- Agarwal, P., Bertozzi, C. R. Site-specific antibody-drug conjugates: the nexus of bioorthogonal chemistry, protein engineering, and drug development. Bioconjugate Chemistry. 26 (2), 176-192 (2015).
- Adumeau, P., Sharma, S. K., Brent, C., Zeglis, B. M. Site-specifically labeled immunoconjugates for molecular imaging-part 1: Cysteine residues and glycans. Molecular Imaging and Biology. 18 (1), 1-17 (2016).
- Adumeau, P., Sharma, S. K., Brent, C., Zeglis, B. M. Site-specifically labeled immunoconjugates for molecular imaging-part 2: Peptide tags and unnatural amino acids. Molecular Imaging and Biology. 18 (1), 153-165 (2016).
- Alley, S. C., et al. Contribution of linker stability to the activities of anticancer immunoconjugates. Bioconjugate Chemistry. 19 (3), 759-765 (2008).
- Baldwin, A. D., Kiick, K. L. Tunable degradation of maleimide-thiol adducts in reducing environments. Bioconjugate Chemistry. 22 (10), 1946-1953 (2011).
- Shen, B. -. Q., et al. Conjugation site modulates the in vivo stability and therapeutic activity of antibody-drug conjugates. Nature Biotechnology. 30 (2), 184-189 (2012).
- Jackson, D., et al. In vitro and in vivo evaluation of cysteine and site specific conjugated herceptin antibody-drug conjugates. Plos One. 9 (1), (2014).
- Ponte, J. F., et al. Understanding how the stability of the thiol-maleimide linkage impacts the pharmacokinetics of lysine-linked antibody-maytansinoid conjugates. Bioconjugate Chemistry. 27 (7), 1588-1598 (2016).
- Stimmel, J. B., et al. Site-specific conjugation on serine -> cysteine variant monoclonal antibodies. Journal of Biological Chemistry. 275 (39), 30445-30450 (2000).
- Li, L., et al. Reduction of kidney uptake in radiometal labeled peptide linkers conjugated to recombinant antibody fragments. site-specific conjugation of DOTA-peptides to a cys-diabody. Bioconjugate Chemistry. 13 (5), 985-995 (2002).
- Li, J., Wang, X. H., Wang, X. M., Chen, Z. L. Site-specific conjugation of bifunctional chelator BAT to mouse IgG(1) Fab' fragment. Acta Pharmacologica Sinica. 27 (2), 237-241 (2006).
- Tinianow, J. N., et al. Site-specifically Zr-89-labeled monoclonal antibodies for ImmunoPET. Nuclear Medicine and Biology. 37 (3), 289-297 (2010).
- Li, L., et al. Site-specific conjugation of monodispersed DOTA-PEGn to a thiolated diabody reveals the effect of increasing PEG size on kidney clearance and tumor uptake with improved 64-copper PET imaging. Bioconjugate Chemistry. 22 (4), 709-716 (2011).
- Khalili, H., Godwin, A., Choi, J. -. w., Lever, R., Brocchini, S. Comparative binding of disulfide-bridged PEG-Fabs. Bioconjugate Chemistry. 23 (11), 2262-2277 (2012).
- Koniev, O., Wagner, A. Developments and recent advancements in the field of endogenous amino acid selective bond forming reactions for bioconjugation. Chemical Society Reviews. 44 (15), 5495-5551 (2015).
- Patterson, J. T., Asano, S., Li, X., Rader, C., Barbas, C. F. Improving the serum stability of site-specific antibody conjugates with sulfone linkers. Bioconjugate Chemistry. 25 (8), 1402-1407 (2014).
- Toda, N., Asano, S., Barbas, C. F. Rapid, stable, chemoselective labeling of thiols with Julia-Kocienski-like reagents: A serum-stable alternative to maleimide-based protein conjugation. Angewandte Chemie-International Edition. 52 (48), 12592-12596 (2013).
- Zhang, Q., et al. Last-step enzymatic F-18-fluorination of cysteine-tethered RGD peptides using modified Barbas linkers. Chemistry-a European Journal. 22 (31), 10998-11004 (2016).
- Chiotellis, A., et al. Novel chemoselective F-18-radiolabeling of thiol-containing biomolecules under mild aqueous conditions. Chemical Communications. 52 (36), 6083-6086 (2016).
- Adumeau, P., Davydova, M., Zeglis, B. M. Thiol-reactive bifunctional chelators for the creation of site-selectively modified radioimmunoconjugates with improved stability. Bioconjugate Chemistry. 29, 1364-1372 (2018).
- Sakamoto, J., Kojima, H., Kato, J., Hamashima, H., Suzuki, H. Organ-specific expression of the intestinal epithelium-related antigen A33, a cell surface target for antibody-based imaging and treatment in gastrointestinal cancer. Cancer Chemotherapy and Pharmacology. 46, S27-S32 (2000).
- Sakamoto, J., et al. A phase I radioimmunolocalization trial of humanized monoclonal antibody huA33 in patients with gastric carcinoma. Cancer Science. 97 (11), 1248-1254 (2006).
- Junutula, J. R., et al. Site-specific conjugation of a cytotoxic drug to an antibody improves the therapeutic index. Nature Biotechnology. 26 (8), 925-932 (2008).
- Pillow, T. H., et al. Site-specific trastuzumab maytansinoid antibody-drug conjugates with improved therapeutic activity through linker and antibody engineering. Journal of Medicinal Chemistry. 57 (19), 7890-7899 (2014).
- Boswell, C. A., et al. Enhanced tumor retention of a radiohalogen label for site-specific modification of antibodies. Journal of Medicinal Chemistry. 56 (23), 9418-9426 (2013).
- Boswell, C. A., et al. Impact of drug conjugation on pharmacokinetics and tissue distribution of anti-STEAP1 antibody-drug conjugates in rats. Bioconjugate Chemistry. 22 (10), 1994-2004 (2011).
- Alvarez, V. L., et al. Site-specifically modified 111In labelled antibodies give low liver backgrounds and improved radioimmunoscintigraphy. Nuclear Medicine and Biology. 13 (4), 347-352 (1986).
- Strop, P., et al. Location matters: SIte of conjugation modulates stability and pharmacokinetics of antibody drug conjugates. Chemistry, Biology. 20 (2), 161-167 (2013).
- Hallam, T. J., Wold, E., Wahl, A., Smider, V. V. Antibody conjugates with unnatural amino acids. Molecular Pharmaceutics. 12 (6), 1848-1862 (2015).
- Axup, J. Y., et al. Synthesis of site-specific antibody-drug conjugates using unnatural amino acids. Proceedings of the National Academy of Sciences. 109 (40), 16101-16106 (2012).
- Lang, K., Chin, J. W. Cellular incorporation of unnatural amino acids and bioorthogonal labeling of proteins. Chemical Reviews. 114 (9), 4764-4806 (2014).
- Yamasaki, R. B., Osuga, D. T., Feeney, R. E. Periodate oxidation of methionine in proteines. Analytical Biochemistry. 126 (1), 183-189 (1982).
- Wang, W., et al. Impact of methionine oxidation in human IgG1 Fc on serum half-life of monoclonal antibodies. Molecular Immunology. 48 (6-7), 860-866 (2011).
- O'Shannessy, D. J., Dobersen, M. J., Quarles, R. H. A novel procedure for labeling immunoglobulins by conjugation to oligosaccharide moieties. Immunology Letters. 8 (5), 273-277 (1984).
- Panowski, S., Bhakta, S., Raab, H., Polakis, P., Junutula, J. R. Site-specific antibody drug conjugates for cancer therapy. Mabs. 6 (1), 34-45 (2014).
- Hu, M. D., et al. Site-specific conjugation of HIV-1 tat peptides to IgG: a potential route to construct radioimmunoconjugates for targeting intracellular and nuclear epitopes in cancer. European Journal of Nuclear Medicine and Molecular Imaging. 33 (3), 301-310 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon