Method Article
Injeção intratecal de vírus Adeno-associado recombinantes em ratos adultos
Neste Artigo
Resumo
Aqui apresentamos uma técnica de injeção intratecal direto usando cloridrato de lidocaína a 1% em uma solução viral para assegurar a entrega eficiente de vírus adeno-associado aos pequenos animais e estabelecer um sistema de Pontuação para prever a eficiência de transdução no central sistema nervoso de acordo com o grau de fraqueza transitória induzida pela lidocaína.
Resumo
Injeção intratecal (IT) do vírus adeno-associado (AAV) tem atraído considerável interesse na terapia de gene CNS em virtude de sua segurança, noninvasiveness e transdução excelente eficácia no SNC. Estudos anteriores têm demonstrado a potência terapêutica da terapia do gene AAV-entregue em doenças neurodegenerativas por esta administração. No entanto, altas taxas de falha imprevisível devido a limitação técnica de administração de ti em pequenos animais têm sido relatadas. Aqui, nós estabelecemos um sistema de Pontuação para indicar o grau de sucesso de punção lombar em pequenos animais pela adição de cloridrato de lidocaína a 1% para a solução de injeção. Vamos mostrar ainda mais que a extensão da fraqueza transitória após injeção pode prever a eficiência de transdução de AAV. Assim, este método de injeção de IT pode ser usado para otimizar os ensaios terapêuticos em modelos do rato de doenças CNS que afligem largas regiões do SNC.
Introdução
AAV pode mediar a expressão do gene a longo prazo e generalizada na transdução de CNS com poucos efeitos colaterais e, portanto, tornou-se um dos veículos mais promissoras para terapia gênica tratar doenças do CNS, incluindo esclerose lateral amiotrófica (ela), Huntington doença (HD), a doença de Alzheimer (AD), doenças de depósito lisossômico (LSD), doença de Gaucher (GD) e neuronal ceroid Doenà (NCL)1. Atualmente, mais de 100 sorotipos de vírus adeno-associados têm sido isolados de humanos e animais. Entre estes, pelo menos 12 foram usados em pré-clínicos e clínicos, incluindo o mais comumente usado vetores de gene como AAV1, 2, 4, 5, 6, 8, 9, rAAVrh.8 e rAAVrh.101,2,3,4, 5,6.
Doenças de CNS diferentes exigem diferentes estratégias de entrega AAV, devido a várias regiões afectadas do CNS e tipos de células. As regiões de CNS e célula tipos que AAV pode transduce varia dependendo do serótipo bem como método de entrega. Por exemplo, rAAVrh10 tem demonstrado transduce predominantemente astrócitos quando entregue por sistêmica injeção intravenosa (IV), Considerando que ele nao tanto neurônios e glia quando entregue por intratecal injeção4,7. Além disso, a injeção de parênquima resultou na transdução de local para as imediações do local da injeção, Considerando que a injeção no fluido cerebrospinal (CSF) através de intraventricular ou injeção intratecal resultou na transdução generalizada de CNS8 . Estudos também demonstraram potência terapêutica da terapia do gene AAV-entregue em doenças neurodegenerativas por esta administração9,10,11. Em doenças que afetam grandes áreas do SNC tais como ALS, injeção intratecal para o CSF foi mostrada para cobrir a maior parte das áreas que são afectados pela doença com uma dose mais baixa, em comparação com um método de entrega sistêmica4,10. Estudos recentes têm mostrado também que a punção lombar pode ser usada para injetar o vírus adeno-associados em modelos do rato para ALS, que evita lesões potenciais associados com laminectomia e intratecal cateterismo4.
Experimental punção direta foi usada primeiramente para entregar agentes anestésicos, especialmente, para a medula espinhal para analgesia e anestesia em 188512,13. Neste relatório, podemos ilustrar a punção lombar método de injeção é em ratos adultos, com o auxílio de 1% de cloridrato de lidocaína, um anestésico local Amida derivada, na solução de injeção para avaliar e monitorar a qualidade de injeção. Injeções bem sucedidas foram marcadas por paralisia transitória induzida por lidocaína, Considerando que a falha de injeções não mostrou esse comportamento. Estamos classificados o nível de fraqueza transitória, como uma das cinco classes para ajudar a prever a eficiência de injeção. Finalmente, mostramos que o nível de transdução de rAAVrh10 pode ser previsto pelo grau de paralisia. Portanto, este método de entrega AAV intratecal pode ser usado para melhorar a AAV-mediada gene-entrega para terapia experimental das doenças do CNS.
Protocolo
Camundongos FVB/NJ foram criados na instalação de animais de laboratório chave de Neurologia de Hebei. Todos os experimentos de rato foram aprovados pelo segundo Hospital de Hebei médica Universidade Comitê de ética e realizados de acordo com os regulamentos de animais de laboratório, promulgada pelo Ministério da ciência e tecnologia da República Popular da China.
1. preparação da solução-mãe cloridrato de lidocaína 20%
- Pese 2 g de cloridrato de lidocaína. Adicione 5 a 6 mL de água estéril e vórtice suavemente. Aumente o volume para um total de 10 mL com água estéril.
- 1.2 filtre a solução através de filtros de 0,2 mícron. Alíquota da solução, 1ml por microcentrifuga de 1,5 mL do tubo e selá-lo com uma película de vedação. Loja a 4 ° C.
2. direct intratecal AAV entrega em ratos acordados
- Limpe a área de trabalho usando gaze esterilizada com 70% de etanol e preparar os materiais necessários, conforme mencionado na tabela 1.
- Prepare-se 100 µ l de cloridrato de lidocaína AAVrh.10/1% complexo adicionando 95 µ l de solução rAAVrh10 (5 x 1012 genoma cópias/mL) em um tubo estéril de microcentrifuga µ l 200 e adicione 5 µ l de solução-mãe cloridrato de lidocaína 20%. Misture bem pipetando para cima e para baixo. Em seguida, armazene a solução de vírus no gelo (4 ° C).
Nota: 8 µ l por rato4 será usado. -
Preparar a seringa com a solução AAV para injeção
- Monte um 25 µ l Hamilton a seringa com uma agulha 27G e alinhe a ponta chanfrada da agulha com a escala volumétrica na seringa.
- Desenhe 8 µ l com 4 x 1010 cópias do genoma da solução de vírus para a seringa delicadamente. Certifique-se de remover as bolhas de ar.
-
Preparando o mouse
Nota: ratos FVB/NJ masculino ou femininos (30 a 70 dias de idade) foram utilizados neste estudo. Injeção foi operada no capô.- Esterilize a área de trabalho em um capuz com etanol a 70%. Coloque o mouse acordado (masculinos ou femininos, 30-70 dias de idade, 13-20 g de peso) em um bedpiece em posição de capuz. Cubra a parte superior do corpo com gaze estéril para acalmar o mouse e evitar ser mordido.
- Corrigi o animal, agarrando-se adequadamente e firme em sua cintura pélvica com um polegar em um lado e o dedo indicador/médio dedo do outro lado. Manter a pele entre bilaterais cinturas pélvicas tensa com o polegar e o indicador. Segure suavemente na parte superior do corpo do animal com a palma da mão.
- Raspar o pelo nas costas entre a cintura pélvica bilateral e, em seguida, esterilizar a superfície da pele com um iodeto esfoliante e 70% do etanol.
-
De injeção intratecal12
- Sinta o espaço intervertebral ao longo da linha média entre a cintura pélvica bilateral com um polegar ou o dedo indicador da outra mão e pressione uma marca com uma unha para indicar o espaço intervertebral L5-L6 (localizar o local da injeção).
- Girar a base da cauda ligeiramente e suavemente para indicar a linha média da coluna vertebral. Ajuste o bisel da agulha para a cabeça do animal antes da injeção (mencionado na etapa 2.3.1).
- Certifique-se que os animais são fixados firmemente e alinham a agulha ao longo da linha mediana da coluna vertebral.
- Inserir a agulha suavemente e verticalmente (ou incline ligeiramente a 70-80°) na interseção de recuo e mantenha a seringa em um plano sagital central. Reduzir o ângulo de aproximadamente 30° lentamente, quando ele se conecta ao osso e, em seguida, enfiar a agulha no espaço intervertebral.
Nota: Um filme de cauda evidente de repente é um sinal de entrada bem sucedida no espaço intradural. Uma vez que a agulha entra no espaço intervertebral, vai sentir a ponta da agulha firmemente preso. A agulha 27G utilizada neste estudo é adequada para a entrega IT em ratos, mas não ratos. - Injecte a solução de vetor (mencionada na etapa 2.2). Iniciar o temporizador e injetar 8 µ l da solução de vetor a uma velocidade de 1 µ l/4 s. reter a agulha aproximadamente 1 min depois de terminar entrega. Retire a agulha com rotação suave para evitar vazamento.
- Marca a fraqueza transitória do mouse Membros imediatamente após o parto para avaliar a qualidade de injeção4.
Nota: O padrão é da seguinte forma4. Pontuação 0: nenhuma fraqueza; escore 1: menor fraqueza dos membros posteriores sem anormalidade da marcha; Pontuação 2: moderada fraqueza dos membros posteriores com anormalidade óbvia da marcha; Pontuação 3: completar a paralisia dos membros posteriores; marcar 4: completar a paralisia dos membros posteriores, falta de ar e fraqueza moderada dos membros dianteiros; e pontuação 5: completa paralisia de todos os quatro membros e evidente falta de ar. - Mova o mouse de volta para a gaiola para a recuperação da paralisia.
-
Limpar
- Lave a seringa com 1 mL de água estéril. Classificar materiais de laboratório e coletar todos os materiais não-descartáveis para a esterilização autoclave. Limpe o banco com etanol a 70%.
3. tecido preparação para a coloração imuno-histoquímica
-
Coleção de tecido
- Anestesia profundamente ratos no pós-injeção de 21 dias com 3% hidrato de cloral (0,1 mL/10g) por injeção intraperitoneal.
- Perfuse transcardially com 20 mL de PBS gelado de 0,01 M (NaCl 147 mM; NaH2PO4 1,9 mM; K.2HPO4 8,1 mM, pH 7,4) em primeiro lugar, então 4% gelada paraformaldeído (em PBS de 0,01 M) com bomba (10 mL/min por 1 min, em seguida 5 mL/min. para 9 min).
Atenção: Paraformaldeído é tóxico e cancerígeno. Amanhar-apenas a coifa usando luvas.
-
Dissecação do cérebro e da medula espinhal
- Corrigir os membros e a cabeça de cada animal em posição na capa de uma caixa de espuma com agulhas de seringa, em seguida, tira e remover a pele da cabeça ao Sacro com tesoura.
- Clip do crânio entre os olhos, corte ao lado da rota média do crânio e linha horizontal sobre o cerebelo e, em seguida, abrir o crânio para cada lado.
- Levante o osso occipital com pinças e abrir o canal medular bilateral com tesouras oftálmicas. Corte as costelas em ambos os lados e remova a metade superior das vértebras com cuidado.
- Levante o cérebro com uma pinça curvada e cortar os nervos da base do crânio e, em seguida, dissecar cuidadosamente para fora o cérebro ea medula espinhal. Fixar os tecidos em paraformaldeído 4% por 24 h.
-
Preparação de fatias de tecido
- Crioproteção do cérebro e da medula espinhal cervical e lombar em 30% de solução de sacarose durante a noite a 4 ° C. Incorporar o tecido no ideal da temperatura de corte (OCT) composto e congelar rapidamente com nitrogênio líquido.
- Corte o tecido na 25 µm usando um criostato e armazenar as seções congeladas em PBS 0,01 M a 4 ° C para uso.
4. imuno-histoquímica
- Pré-tratamento seções flutuantes em 1% H2O2 por 10 min, em seguida, lave em PBS durante 10 min. Incubar em uma solução de bloqueio contendo 5% de soro e detergente não-iônico 0,3% em PBS por 1h.
- Incubar as fatias com anticorpos primários correspondentes durante a noite a 4 ° C. Lave as seções em PBST (0,2% Tween 20 em PBS) por 30 min (3 vezes por 10 min cada).
- Incube as fatias com anticorpo de biotina-secundário correspondente à temperatura ambiente por 1 h. lavagem em PBST por 30 min (3 vezes por 10 min cada).
- Incubar as secções com peroxidase de biotina afinidade complexa por 40 min e mancha com agente achromogenic. Montar as seções sobre guias e seque bem.
- Mergulhe os slides em etanol anidro por 5 min e xileno por 10 min e, em seguida, selar os slides com um meio de montagem. Finalmente, imagem dos slides com um microscópio equipado com um dispositivo de carga acoplada (CCD) em x 100 x 200 e 400 ampliações de x.
Resultados
Camundongos mostraram graus diferentes de fraqueza transitória logo após ele injeção da solução AAV no cloridrato de lidocaína 1% devido a vários qualidade de injeção intratecal. De acordo com o semigrau 5 sistema de pontuação que estabelecemos, nós testamos os padrões de transdução da AAV em camundongos com graus diferentes de fraqueza induzida por lidocaína membro (Pontuação 0, n = 2; escore 1, n = 1; marcar 4, n = 4; Pontuação 5, n = 3). EGFP imunocoloração de espinais mostrou nenhuma ou pouca transdução na medula espinhal lombar de ratos marcando 0, transdução ligeiramente melhorada em ratos marcando 1 e transductions fortes e generalizadas em ratos marcando 4 ou 5 (Figura 1A). Nós quantificada a GFP manchando a intensidade daqueles ratos exibindo vários graus de fraqueza transitória dos Membros (Figura 1B) e concluiu que a severidade da fraqueza após injeção estreitamente correlacionada com a extensão da medula espinhal transdução.
Nós ainda mais explorado o perfil detalhado de transdução de rAAVrh10 no SNC todo e notei que o comprimento total da medula espinhal e amplas áreas do cérebro bem foram transfectadas em camundongos bem injetados que marcou 4 ou 5. No cérebro, detectou-se sinais de EGFP robustos no bulbo olfatório(Figura 2), o córtex pré-frontal dorsolateral (Figura 2B), giro denteado e zona CA3 do hipocampo (figuras 2 e 2D), cerebelar córtex(Figura 2)e áreas marginais do tronco cerebral, incluindo o núcleo facial (Figura 2-F), plexo coroide e células ependimárias (Figura 2G). No entanto, menos células EGFP positivos foram detectadas em regiões profundas do cérebro. Na medula espinhal e cornos ventrais e dorsais, o ventrais efluentes motor axônios e dorsal afluente sensorial foram fortemente GFP-positivo. Neurônios motores nos cornos anteriores foram transformados fortemente em diferentes níveis da medula espinhal (figuras 2h-2J). Além disso, os neurônios de GFP-positivo no córtex, incluindo células piramidais foram detectados (Figs. 3A e 3B). Vários tipos de células gliais, incluindo microglia, astrócitos e oligodendrócitos, também foram encontrados para ser positivo EGFP (figuras 3C-3E).
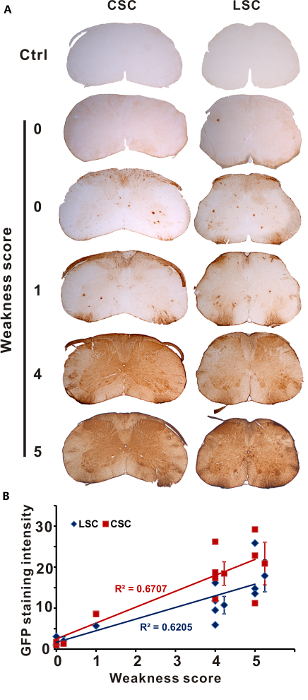
Figura 1 : Medida de fraqueza induzida por lidocaína prediz a eficiência de transdução. Vírus adeno-associados com lidocaína a 1% ou PBS (controle) foi injetado por injecção directa de IT. Ratos foram sacrificados e examinados para a expressão de GFP por IHQ 3 semanas depois (Pontuação 0, n = 2; escore 1, n = 1; marcar 4, n = 4; Pontuação 5, n = 3). (A) GFP coloração (CSC) cervical e lombar da medula espinhal (LSC) seções é mostrado. GFP (B) coloração de intensidade na LSC e CSC foi diretamente correlacionada com o grau de fraqueza transitória. Cada marca representa valores (média ± DP) de um rato. Esta figura foi adaptada da publicação anterior4. Clique aqui para ver uma versão maior desta figura.

Figura 2 : Transdução generalizada da rAAVrh10 do cérebro e da medula espinhal. Bulbo olfatório de (A); (B) córtex; (C) giro dentate4; e (D) CA3 do hipocampo; Córtex cerebelar (E); (F) núcleo facial; Ventrículo lateral (G); (H) corno anterior cervical4; (eu) corno anterior torácica4; e (J) lombar corno anterior4. Barras de escala = 100 µm. clique aqui para ver uma versão maior desta figura.

Figura 3 : Transdução de vários tipos de células no cérebro após a injeção de rAAVrh10 intratecal direto. (A) células piramidais; (B) neurônio multipolar; (C) microglial célula; (D) astrocyte; e (E) oligodendrocyte. Barras de escala = 100 µm. clique aqui para ver uma versão maior desta figura.
Discussão
Tecnicamente, há várias etapas críticas durante a injeção de IT em ratos acordados. Primeiro, bom gesto e firme controle dos ratos ao longo de toda a operação é um pré-requisito para o sucesso na entrega. Em segundo lugar, o ponto mais difícil é sentir o espaço intervertebral com a ponta da agulha, como é necessário para não inserir profundamente sem resistência ou inserir forçadamente sob forte resistência no caso de ferir os animais ou dobra a ponta da agulha. Em terceiro lugar, embora a paralisia transitória devido a lidocaína, apresenta um indicador objetivo para qualidade de injeção, mais prática é necessária para alcançar resultados consistentes e bem sucedidos.
Neste relatório, nós desenvolvemos um método de injeção intratecal direto em ratos acordados para a entrega de AAV, no qual lidocaína serve como um indicador para a medida do sucesso de injeção de IT e como um preditor para a eficiência da terapia gênica. Experimental punção direta foi usada primeiramente para entregar agentes anestésicos, especialmente, para a medula espinhal para analgesia e anestesia, e foi altamente recomendado na terapia genética para doenças do CNS. Dada a dificuldade de injeção é em pequenos animais como ratos, estamos combinados os dois aplicativos de punção direta e escolheu anestésicos locais (lidocaína, que tem sido usado em clínicas amplamente como um indicador objetivo da qualidade de injeção através da avaliação paralisia transitório e restaurável). Além disso, temos definido um padrão para prever a eficiência de entrega de AAV através de níveis de paralisia e confirmou por imunocoloração. Temos demonstrado que os animais bem injetados tinham níveis mais elevados de transdução de rAAVrh10-EGFP no SNC em ratos adultos.
Comparado com o método de entrega intratecal anterior envolvendo anestesia profunda do animal e intratecal cateterismo com laminectomia14,15, nosso atual método tem várias vantagens. Primeiro, o procedimento de simples punção lombar pode ser concluído dentro de alguns minutos para cada animal, Considerando que o procedimento anterior leva ~ 1 h por animal. Em segundo lugar, o método atual não emprega anestesia e cirurgia e, portanto, reduz o risco de lesão4. Em terceiro lugar, pela adição de cloridrato de lidocaína 1% para a solução AAV, temos estabelecido um sistema de Pontuação de cinco pontos para classificação paralisia transitória após a injeção e provou que o grau de fraqueza induzida por lidocaína pode ser usado para prever a extensão do CNS transdução por cada injeção. Nossos dados demonstraram que os animais bem injetados têm altos níveis de transdução de rAAVrh10-EGFP no SNC de camundongos adultos. A transdução é também generalizada em uma medida semelhante do método anterior envolvendo o cateterismo laminectomia e intratecal. Comparado com o existente métodos de punção em ratos acordados, fornecemos um indicador objetivo da qualidade de injeção com o uso de lidocaína e evitar a cegueira a injeção falhou e subsequente interferência na eficácia terapêutica.
Tomados em conjunto, a atual entrega intratecal contendo 1% lidocaína é um método promissor para as doenças do CNS em terapias experimentais entregando genes ou drogas em ratos. Além disso, é uma abordagem prática e conveniente para praticá-lo injeção em pequenos animais como ratos.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi financiado por uma concessão do Departamento Provincial de recursos humanos da HEBEI e Segurança Social (CY201605) e uma bolsa da Fundação ciência Natural da província de Hebei (H2017206101), e agradecemos muito ao Dr. Gao Guangping, que forneceu o vírus adeno-associados para Este estudo.
Materiais
| Name | Company | Catalog Number | Comments |
| FVB/NJ mice | Charles River Laboratories China | ||
| Lidocaine hydrochloride monohydrate | HEOWNS | 73-78-9 | |
| AAV | Viral Vector Core of the Gene Therapy Center at University of Massachusetts Medical School | ||
| 25 µL Hamilton syringe/27-30 G needle | GASTIGHT | 1702 | |
| O.C.T compond | SAKURA | 4583 | |
| H 2O 2 | SHUI HUAN PAI | 170401 | |
| Goat serum | Solarbio | S9070 | |
| Triton X-100 | LIFE SCIENCES | T8200 | |
| Rabbit anti-GFP | Life tech | G10362 | 1:333 dilution |
| The second antibody (goat-anti rabbit) | Jackson Immuno Research | 111-005-144 | 1:1,000 dilution |
| VECTASTAIN ABC REAGENT | Vector Lab | PK-6100 | |
| ImmPACT DAB Peroxidase Substrate Kit | Vector Lab | SK-4105 | |
| Mounting medium for fluorescence with DAPI | Vectorshield | H-1200 | |
| NaCl | Yong Da Chemical | ||
| NaH2PO4·2H2O | Yong Da Chemical | ||
| Na2HPO4·12H2O | Yong Da Chemical | ||
| Paraformaldehyde | Yong Da Chemical | 307699 | |
| Adhesion Microscope Slides | CITOGLAS | 17083 | 25 mm x 75 mm |
| SUPER-SLIP MICRO-GLAS | Electro Microscopy Siences | 72236-60 | 24 mm x 60 mm |
| 15 mL Centrifuge tube | CORNING | 430790 | |
| 96 well cell culture cluster | Coster | 3599 | |
| 24 well cell culture cluster | Coster | 3524 | |
| 70% Ethanol | WEN ZHI | ||
| Gauze | Wei AN | 05171112 | 8 cm x 10 cm x 12 cm |
| 1 mL syringe | Hong Da | ||
| Microtubes | Plasmed | ||
| Micropipet | eppendorf | ||
| Peppet tips | Rainin | ||
| Centirifuge | eppendorf | 5427R | |
| Regerator | Haier | BCD-539WT | |
| Filter | MILLEX GP | R4PA42342 | |
| Pump | LongerPump | BT-100-2J/YZ1515X | |
| Microscope | Olympus | BX53 | |
| Freezing-microtome | Leica | CM1520 |
Referências
- Murlidharan, G., Samulski, R. J., Asokan, A. Biology of adeno-associated viral vectors in the central nervous system. Frontiers in Molecular Neuroscience. 7, 76(2014).
- Lentz, T. B., Gray, S. J., Samulski, R. J. Viral vectors for gene delivery to the central nervous system. Neurobiology Disease. 48 (2), 179-188 (2012).
- Yang, B., et al. Global CNS transduction of adult mice by intravenously delivered rAAVrh.8 and rAAVrh.10 and nonhuman primates by rAAVrh.10. Molecular Therapy. 22 (7), 1299-1309 (2014).
- Guo, Y., et al. A Single Injection of Recombinant Adeno-Associated Virus into the Lumbar Cistern Delivers Transgene Expression Throughout the Whole Spinal Cord. Molecular Neurobiology. 53 (5), 3235-3248 (2016).
- Hastie, E., Samulski, R. J. Adeno-associated virus at 50: a golden anniversary of discovery, research, and gene therapy success--a personal perspective. Human Gene Therapy. 26 (5), 257-265 (2015).
- Hocquemiller, M., Giersch, L., Audrain, M., Parker, S., Cartier, N. Adeno-Associated Virus-Based Gene Therapy for CNS Diseases. Human Gene Therapy. 27 (7), 478-496 (2016).
- Tanguy, Y., et al. Systemic AAVrh10 provides higher transgene expression than AAV9 in the brain and the spinal cord of neonatal mice. Frontiers in Molecular Neuroscience. 8, 36(2015).
- Federic, T., et al. Robust spinal motor neuron transduction following intrathecal delivery of AAV9 in pigs. Gene Therapy. 19, 852-859 (2012).
- Ayers, J. I., et al. Widespread and efficient transduction of spinal cord and brain following neonatal AAV injection and potential disease modifying effect in ALS mice. Molecular Therapy. 23 (1), 53-62 (2015).
- Li, D., et al. Slow Intrathecal Injection of rAAVrh10 Enhances its Transduction of Spinal Cord and Therapeutic Efficacy in a Mutant SOD1 Model of ALS. Neuroscience. 365, 192-205 (2017).
- Borel, F., et al. Therapeutic rAAVrh10 Mediated SOD1 Silencing in Adult SOD1(G93A) Mice and Nonhuman Primates. Human Gene Therapy. 27 (1), 19-31 (2016).
- Fairbanks, C. A. Spinal delivery of analgesics in experimental models of pain and analgesia. Advanced Drug Delivery Reviews. 55 (8), 1007-1041 (2003).
- Hylden, J. L., Wilcox, G. L. Intrathecal morphine in mice: a new technique. European Journal of Pharmacology. 67, 313-316 (1980).
- Wang, H., et al. Widespread spinal cord transduction by intrathecal injection of rAAV delivers efficacious RNAi therapy for amyotrophic lateral sclerosis. Human Molecular Genetics. 23 (3), 668-681 (2014).
- Wang, Y., et al. scAAV9-VEGF prolongs the survival of transgenic ALS mice by promoting activation of M2 microglia and PI3K/Akt pathway. Brain Research. 1648, Pt A 1-10 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados