Method Article
성인 쥐에 있는 재조합 형 Adeno 관련 바이러스의 직접 Intrathecal 주입
요약
여기에 우리가 작은 동물에 게 효율적인 adeno 관련 바이러스 전달 되도록 하 여 중앙에서 변환 효율 예측 점수 시스템 구축 바이러스 솔루션에서 1 %lidocaine 염 산 염을 사용 하 여 직접 intrathecal 사출 기법 제시 lidocaine에 의해 유도 된 과도 함의 정도 따라 신경 시스템.
초록
Adeno 관련 바이러스 (AAV)의 Intrathecal (IT) 주사는 CNS에 CNS 유전자 치료의 안전, noninvasiveness, 그리고 우수한 전달 효능 덕에 상당한 관심을 받고 있다. 이전 연구는 관리 그것에 의해 신경 장애에서 AAV 전달 유전자 치료의 치료 효능 입증. 그러나, 작은 동물에서 IT 관리의 기술적 제한으로 인해 예측할 수 없는 실패의 높은 속도 보고 되었습니다. 여기, 우리는 주입 솔루션으로 1 %lidocaine 염 산을 추가 하 여 작은 동물에 허리 빵 꾸의 성공 정도 나타내는 점수 시스템 설립. 우리는 추가 주입 다음 과도 함의 정도 AAV의 변환 효율을 예측할 수 있습니다 보여줍니다. 따라서,이 IT 주입 방법 CNS의 넓은 영역을 괴롭히다 CNS 질병 마우스 모델에서 치료 실험을 최적화 하기 위해 사용할 수 있습니다.
서문
AAV 몇 가지 부작용, CNS 변환에 장기적이 고 광범위 한 유전자 발현을 중재할 수 및 따라서 루 경화 증 (ALS), 헌팅턴의를 포함 하 여 CNS 질병을 치료 하는 유전자 치료에 대 한 가장 유망한 차량 중 하나 되고있다 (HD) 질병, Alzheimer의 질병 (광고), lysosomal 저장 질병 (LSD), Gaucher 질환 (GD), 그리고 신경 ceroid lipofuscinosis (NCL)1 현재, 이상의 100 AAV serotypes 인간과 동물에서 분리 되었습니다. 이러한 가운데, 적어도 12 전 임상에서 사용 되 고 AAV1, 2, 4, 5, 6, 8, 9, 같은 유전자 벡터를 사용 하는 가장 일반적으로 포함 하는 임상 시험, rAAVrh.8, 및 rAAVrh.10,12,3,4, 5,6.
다른 CNS 질병 때문에 다양 한 영향을 받는 CNS 영역 및 세포 유형 다른 AAV 배달 전략 필요합니다. CNS 영역 및 셀 AAV transduce 수 종류는 serotype에 따라 전달 방법 뿐만 아니라. 예를 들어 rAAVrh10 transduce 주로 조직의 정 맥 주사 (IV)에 의해 전달 하는 때 이다 그것은 신경 및 명과 intrathecal 주입4,7에 의해 전달 될 때 불리고 반면에 표시 되었습니다. 또한, 실질 주입 결과 사출 사이트의 부근을 로컬 변환 반면 intraventricular 통해 뇌 척추 액체 (CSF)에 주입 또는 intrathecal 주입 결과 광범위 한 CNS 변환8 . 연구는 또한 신경 장애에서 AAV 전달 유전자 치료의 치료 힘에 의해 증명 그것 관리9,,1011. ALS 같은 CNS의 넓은 영역에 영향을 주는 질병에 CSF에 intrathecal 주입 체계 배달 방법4,10에 비해 낮은 복용량으로 질병에 의해 시달리는 대부분 영역을 커버 하 표시 되었습니다. 최근 연구는 또한 ALS laminectomy 및 intrathecal catheterization4와 관련 된 잠재적인 부상 방지에 대 한 마우스 모델에서 AAV를 주입 하는 허리 빵 꾸를 사용할 수 있습니다 나타났습니다.
실험적인 직접 요 추 찔린 에이전트, 특히 마 취약, 진통 및 188512,13마 취 척수에 전달 하 처음 사용 되었다. 이 보고서에서 우리 허리 빵 꾸 1 %lidocaine 염 산 염는 지역 아 미드 파생 취 평가 하 고 사출 품질 모니터링 주입 솔루션에서의 도움으로 성인 쥐에 주입 방법으로 그것을 설명 합니다. 반면 실패 한 주사는이 동작을 보여주지 않았다 성공적인 주사 일시적인 마비 lidocaine 유도 의해 표를 했다. 우리는 주입 효율을 예측할 수 있도록 다섯 등급 중 하나로 과도 약점의 수준을 분류. 마지막으로, 우리는 rAAVrh10 변환 수준 마비의 급료에 의해 예측 될 수 있습니다 보여줍니다. 따라서,이 intrathecal AAV 전달 방법 AAV 중재 CNS 질환의 실험적 치료를 위한 유전자 납품을 향상 시키기 위해 사용할 수 있습니다.
프로토콜
FVB/뉴저지 쥐 허베이 신경과 키 실험실의 동물 시설에서 자란 했다. 모든 마우스 실험에 의해 두 번째 병원의 허베이 의료 대학 윤리 위원회 승인 되었고 실험실 동물 관리 과학과의 인민 공화국의 기술에 의해의 규정에 따라 실시 중국입니다.
1. 20 %Lidocaine 염 산 염 재고 솔루션의 준비
- Lidocaine 염 산 염의 2 세대의 무게. 부드럽게 살 균 물과 소용돌이의 5-6 mL를 추가 합니다. 멸 균 물 10 mL의 총 볼륨을 증가.
- 1.2 0.2 미크론 필터를 통해 재고 솔루션을 필터링 합니다. 약 수 재고 솔루션, 1.5 mL microcentrifuge 당 1 mL 튜브, 및 씰링 필름으로 그것을 봉인. 4 ° c.에 게
2. 깨어 있는 마우스에 직접 Intrathecal AAV 배달
- 70% 에탄올과 멸 균 거 즈를 사용 하 여 작업 영역을 닦 고 표 1에서 설명한 대로 필요한 용품을 준비.
- 살 균 200 µ L microcentrifuge 튜브에 rAAVrh10 재고 솔루션 (5 x 1012 게놈 사본/mL)의 95 µ L을 추가 하 여 복잡 한 AAVrh.10/1% lidocaine 염 산 염의 100 µ L를 준비 하 고 20 %lidocaine 염 산 염 재고 솔루션의 5 µ L를 추가 합니다. 아래로 pipetting으로 잘 섞는다. 다음, 얼음 (4 ° C)에 바이러스 솔루션을 저장 합니다.
참고: 8 µ L 마우스4 당 사용 됩니다. -
주입을 위한 AAV 솔루션 주사기 준비
- 해밀턴 주사기 27 G 바늘 및 주사기에 체적 규모와 바늘의 경사진 끝 25 µ L를 조립.
- 주사기로 부드럽게 바이러스 솔루션의 4 x 1010 게놈 사본 8 µ L를 그립니다. 공기 방울을 제거 해야 합니다.
-
마우스를 준비
참고: 남성 또는 여성 FVB/뉴저지 쥐 (30-70 일)이이 연구에 사용 되었다. IT 분사 후드에서 운영 했다.- 70% 에탄올과 후드에 작업 영역을 소독. 후드에서 발생 하기 쉬운 위치에 bedpiece에 깨어 마우스 (남성 또는 여성, 30-70 일, 13-20 g 체중)을 넣어. 마우스를 진정 하 고 물린 피하기 위해 멸 균 거 즈와 상체를 커버.
- 다른 쪽에 한 쪽과 집게/중간 손가락에 엄지는 골반 거 들에 적절 하 고 단단히 창과 하 여 동물을 해결. 엄지와 집게손가락으로 긴장 된 양측 골반 거 들 사이의 피부 유지. 부드럽게 손바닥으로 동물의 상체에 개최.
- 양측 골반 거 들 사이 그것의 뒤에 모피를 면도 다음 요오드 화 기반 스크럽과 70% 에탄올과 피부 표면에 소독.
-
Intrathecal 주입12
- L6 L5 척추 공간을 나타내기 위해 손톱으로 들여쓰기를 누르고 엄지 또는 검지로 다른 손의 양측 골반 거 들 사이 중간 선 따라 척추 공간 느낌 (주사 사이트를 찾습니다).
- 약간 하며 부드럽게 회전 하는 꼬리의 척추의 중간을 나타냅니다. (단계 2.3.1에서에서 언급) 주입 전에 동물의 머리 쪽으로 바늘 경사를 조정 합니다.
- 동물 단단히 고정 하는 척추의 중간을 따라 바늘을 정렬 되었는지 확인 합니다.
- 부드럽게 하 고 수직으로 바늘을 삽입 (또는 약간 70-80 ° 기울기) 들여쓰기와 계속 중앙 화살 평면에서 주사기의 교차로에서. 뼈, 연결할 때 천천히 약 30 ° 각도 줄이기 위해 다음 척추 공간에 바늘을 풀.
참고: 분명 갑자기 꼬리 영화 intradural 공간에 성공적인 항목의 표시 이다. 일단 바늘 척추 공간 입력, 바늘 팁 단단히 채워 느낄 것 이다. 27 G 니 들이이 연구에 사용 된 쥐 쥐 하지에 그것 배달에 적합 합니다. - 벡터 솔루션 (2.2 단계에서 언급 한)을 주입. 타이머를 시작 하 고 마친 후 1 µ L/4 미 유지 바늘 약 1 분의 속도 벡터 솔루션의 8 µ L를 주사 배달. 누수를 방지 하려면 부드러운 회전 바늘을 철회 한다.
- 4사출 품질 평가 하기 위해 배달 후 즉시 마우스의 일시적인 약점 사지를 점수.
참고: 표준4는 다음과 같습니다. 점수 0: 없음 약점; 1 점수: 걸음 걸이 이상; 없이 뒷 다리 사지의 약점을 마이너 2 점수: 분명 한 걸음 걸이 이상;으로 뒷 다리 사지의 약점을 적당 한 3 점수: 완료; 뒷 다리 사지의 마비 4 점수: 뒷 다리 사지의 마비, 호흡 곤란, 그리고 포어 사지;의 온건한 약점 완료 5 점수: 완전 한 모든 4 개의 사지의 마비 및 호흡 분명 곤란. - 마비에서 회복을 위한 감 금 소에 다시 마우스를 이동 합니다.
-
정리
- 메 마른 물 1 mL 주사기를 플러시. 실험실 공급을 정렬 하 고 압력가 마로 소독 살 균에 대 한 모든 비 일회용 재료를 수집 합니다. 70% 에탄올과 벤치를 청소.
3. 조직 Immunohistochemical 얼룩을 위한 준비
-
조직 컬렉션
- 복 주입 깊이 3 %chloral 하이드 레이트 (0.1 mL/10 g)와 21 일 후 주입에 쥐를 anesthetize.
- 얼음 처럼 차가운 0.01 M PBS (NaCl 147 m m;의 20 mL와 함께 transcardially perfuse NaH2포4 1.9 m m; K2HPO4 8.1 m m, pH 7.4) 첫째, 다음 4% 얼음 paraformaldehyde (0.01 M PBS)에서 펌프 (1 분, 9 분 다음 5 mL/min 10 mL/min).
주의: Paraformaldehyde은 발암 성 독성. 장갑을 착용 하는 동안 연기 후드에만 처리 합니다.
-
척수와 뇌의 해 부
- 주사기 바늘, 거품 상자 덮개에서 발생 하기 쉬운 위치에 사지와 각 동물의 머리를 해결 다음 제거 하 고가 위로 천 골을 머리에서 피부를 제거.
- 두개골과 뇌, 시 가로 라인의 중간 경로 함께 잘라 다음 각 측에 두개골을 열고, 눈 사이 두개골을 클립 합니다.
- 핀셋으로 후 두 뼈를 들어올린 안과 위 양측 척추 운하를 엽니다. 양쪽에 있는 갈비뼈에서 잘라내어 신중 하 게 척추의 위쪽 절반을 제거.
- 곡선된 핀셋으로 두뇌를 들어올린 두개골 기지의 신경을 절단 하는 다 다음 뇌와 척수를 신중 하 게 해 부 합니다. 후에 24 h에 대 한 4 %paraformaldehyde 조직 수정 했다.
-
조직 조각의 준비
- Cryoprotect 뇌와 경 추 및 요 추 척수 30% 자당 해결책에서 4 ° c.에서 하룻밤 최적의 절삭 온도 (10 월) 화합물에 조직을 포함 하 고 액체 질소로 빨리 동결.
- 25 µ m는 cryostat를 사용 하 여 조직을 잘라 고 사용 4 ° C에서 0.01 M PBS에 냉동된 섹션을 저장 합니다.
4입니다. Immunohistochemistry
- 10 분의 1% H2O2 에 부동성 섹션을 pretreat 다음 10 분 품 5% 혈 청 및 1 시간에 대 한 PBS에 0.3% 비 이온 세제 차단 솔루션에 대 한 PBS에 세척 합니다.
- 4 ° c.에 하룻밤 해당 기본 항 체와 슬라이스를 품 어 PBST에 섹션을 세척 (0.2 %PBS 트윈 20) 30 분 (3 시간 10 분 동안 각).
- (3 시간 10 분 동안 각) 30 분 동안 1 h. PBST에 세척에 대 한 실 온에서 해당 biotin 이차 항 체와 슬라이스를 품 어.
- 40 분, 복잡 한 선호도 biotin 과산화 효소와 섹션을 품 어 그리고 achromogenic 에이전트와 얼룩. 슬라이드에 섹션을 탑재 하 고 제대로 건조.
- 슬라이드 5 분 무수 에탄올과 자일 렌 10 분에 담가 다음 설치 매체와 함께 슬라이드를 밀봉 합니다. 마지막으로, 100 배, 200, 및 400 x 배율에는 전 하 결합 소자 (CCD)를 갖춘 현미경 슬라이드 이미지.
결과
마우스 과도 약점의 다른도 바로 뒤 AAV 솔루션의 주사로 intrathecal 주입의 다양 한 품질 1 %lidocaine 염 산 염 보였다. 시스템에 따라 반 양적 5 학년 점수 우리는 설립, 우리 AAV의 변환 패턴에에서 테스트 쥐 lidocaine 유도 사지 약점의 다른도로 (점수 0, n = 2; 1, n 점수 = 1; 4, n 점수 = 4; 점수 5, n = 3). 척수의 EGFP immunostaining 보였다 중 "없음" 또는 "작은 0를 득점 하는 쥐의 요 추 척수에 전달, 마우스 1, 점수에 약간 향상 된 변환 및 강력 하 고 광범위 한 transductions 마우스 4 또는 5 (그림 1A) 점수. 우리 계량 GFP 과도 사지 약점 (그림 1B)의 다양 한 학위를 표시 하는 그 쥐의 강렬을 얼룩이 지 고 결론을 척수의 범위와 밀접 하 게 상관 주입 후 약점의 심각도 변환입니다.
우리 더 전체 CNS에 rAAVrh10의 상세한 변환 프로필을 탐험 척수의 전체 길이 발견 하 고 두뇌의 넓은 영역 4 또는 5 득점 잘 주입 된 쥐에 잘 불리고 있었다. 뇌에서 강력한 EGFP 신호 후 각 전구 (그림 2A), dorsolateral 전 두 엽 피 질 (그림 2B)가 뇌 (그림 2C 및 2D), 해 마의 CA3 영역에서 발견 된 소 뇌 피 질 (그림 2E), 그리고 brainstem 얼굴 핵 (그림 2F), 衣 상피 세포 (그림 2G), 맥락 막 신경 총 등의 한계 영역. 그러나, 적은 EGFP 긍정적인 세포는 뇌의 깊은 지역에서 발견 했다. 척수에 복 부와 등 쪽 뿔, 유출 모터 축 삭 복 부와 등 풍요로운 감각 축 삭 강하게 GFP-긍정적인 했다. 앞쪽 뿔에 모터 신경 척수 (인물 2 H-2J)의 서로 다른 수준에서 불리고 강하게 했다. 또한, 피라미드 세포를 포함 하 여 피 질 신경 세포 GFP-긍정적인 발견 되었습니다 (그림 3A 와 3B). Microglia, 이다 그리고 oligodendrocytes를 포함 하 여 다양 한 glial 세포 유형 또한 EGFP 양성 (그림 3 C-3E) 것을 발견 했다.
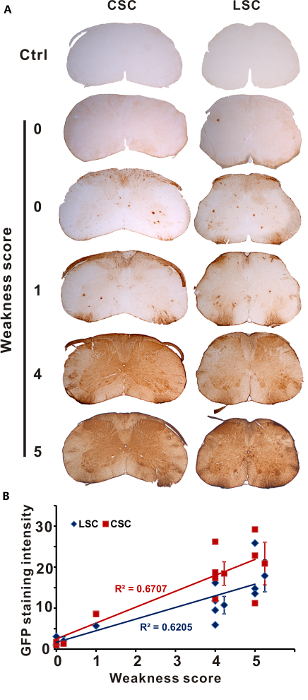
그림 1 : Lidocaine 유도 약점 범위 예측 변환 효율. 1 %lidocaine AAV 또는 PBS (제어) 직접 IT 주사로 주입 했다. 마우스 희생 되었고 immunohistochemistry에 의해 GFP 식에 대 한 검사를 3 주 후 (점수 0, n = 2; 1, n 점수 = 1; 4, n 점수 = 4; 점수 5, n = 3). 표시는 (A) GFP 경부 (CSC)와 요 추 척수 (LSC) 섹션의 얼룩. (B) GFP LSC에 CSC 강도 얼룩 과도 함의 정도 직접 상관 했다. 각 마크 한 마우스에서 (평균 ± SD) 값을 나타냅니다. 이 그림은 이전 게시4에서 적응 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2 : 뇌와 척수에 rAAVrh10의 광범위 한 변환. (A) 후 각 전구; (B) 피 질; (C)가 이랑4; 그리고 (D) 해 마;의 CA3 (E) 소 뇌 피 질; (F) 얼굴 핵; (G) 측면 뇌 실; (H) 자 궁 경부 앞쪽 호른4; (나) 흉부 앞쪽 호른4; 그리고 (J) 허리 앞쪽 혼4. 바 규모 = 100 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 3 : 직접 intrathecal rAAVrh10 주입 후 다양 한 종류의 세포는 두뇌에 있는 변환. (A) 피라미드 세포; (B) 다 극 신경; (C) microglial 셀; (D) 사이토; 그리고 (E) oligodendrocyte입니다. 바 규모 = 100 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
기술적으로, 깨어 있는 쥐의 IT 주입 하는 동안 몇 가지 중요 한 단계가 있다. 첫째, 적절 한 제스처 및 회사 전체 작업을 통해 쥐의 관리는 배달 하기 위해 필수. 둘째, 그것은 저항 없이 너무 깊게 삽입 하거나 동물 부상 또는 절곡 바늘 팁의 경우 강력한 저항에서 강제로 삽입 하지 필요한 가장 어려운 포인트 바늘 팁과 척추 공간을 느낌입니다. 셋째, lidocaine 인해 일시적인 마비 제공 하지만 객관적인 지표로 그것에 대 한 사출 품질, 더 많은 연습 일관 되 고 성공적인 결과 달성 하기 위해 필요 합니다.
이 보고서에서 AAV, lidocaine 역할 IT 주입 성공의 정도 대 한 지표로 서, 유전자 치료의 효율성에 대 한 예측으로의 배달을 위해 깨어 마우스에 직접 intrathecal 주입 방법을 개발 했습니다. 실험적인 직접 요 추 찔린 처음 에이전트, 특히 마 취약, 진통 및 마 취, 척수에 전달 하기 위해 사용 그리고 CNS 질병에 대 한 유전자 치료에 매우 권장 되었습니다. 쥐 같은 작은 동물에서 IT 주입의 어려움을 감안할 때 우리는 직접 허리 빵 꾸의 두 개의 응용 프로그램을 결합 하 고 현지 마 취약 (리도 카 인, 사용 되었습니다 클리닉에서 광범위 하 게 사출 품질의 객관적인 지표로 서 평가 하 여 선택 과도 하 고 복원 마비)입니다. 또한, 우리 마비 레벨을 통해 AAV의 배달 효율성을 예측 하는 표준 정의 하 고 immunostaining에 의해 이것을 확인 했다. 우리는 잘 주입 된 동물 성인 쥐에서 CNS에 rAAVrh10 EGFP 변환의 높은 수준을 했다 설명 했다.
이전 intrathecal 전달 방법 포함 laminectomy14,15동물과 intrathecal catheterization의 깊은 마 취에 비해, 우리의 현재 메서드는 몇 가지 장점이 있습니다. 첫째, 간단한 허리 빵 꾸 절차 이전 절차 동물 당 ~ 1 시간 걸립니다 반면 각 동물에 대 일 분 안에 완료할 수 있습니다. 둘째, 현재 메서드 마 취와 수술을 고용 하지 않습니다 하 고 따라서 부상4의 위험을 감소 시킨다. 셋째, AAV 솔루션 1 %lidocaine 염 산 염의 추가에 의해 우리 순위 일시적인 마비 다음 주사를 5 포인트 득점 시스템 설립 및 lidocaine에 의해 유도 된 약점의 정도 CNS의 정도 예측 하기 위해 사용할 수 있습니다 입증 각 주사로 변환입니다. 우리의 데이터 잘 주입 된 동물 성인 쥐의 CNS에 rAAVrh10 EGFP 변환의 높은 수준을 입증. 변환 포함 laminectomy 및 intrathecal catheterization 이전 방법의 비슷한 정도로 광범위 한 이기도 합니다. 에 비해 우리 lidocaine을 사용 하 여 사출 품질의 객관적인 지표를 제공 깨어 있는 쥐 펑크 방법 기존, 그리고 실패 한 주입 및 치료 효능에 대 한 후속 간섭에 실명을 방지.
합쳐 1% 포함 된 현재 intrathecal 배달 lidocaine은 쥐에 있는 유전자 또는 약물을 제공 함으로써 CNS 질병에 대 한 실험적인 치료에서 유망한 방법입니다. 또한, 쥐 같은 작은 동물에 주사 그것을 실천 하는 실용적이 고 편리한 접근 이다.
공개
저자는 공개 없다.
감사의 말
이 작품 허베이 지방 부의 인적 자원 및 사회 보장 (CY201605)에서 부여와 자연 과학 재단의 허베이 성 (H2017206101)에서 교부 금에 의해 투자 되었다 그리고 우리는 Guangping가 오, AAV에 대 한 제공에 대 한 박사에 게 매우 감사 이 연구는.
자료
| Name | Company | Catalog Number | Comments |
| FVB/NJ mice | Charles River Laboratories China | ||
| Lidocaine hydrochloride monohydrate | HEOWNS | 73-78-9 | |
| AAV | Viral Vector Core of the Gene Therapy Center at University of Massachusetts Medical School | ||
| 25 µL Hamilton syringe/27-30 G needle | GASTIGHT | 1702 | |
| O.C.T compond | SAKURA | 4583 | |
| H 2O 2 | SHUI HUAN PAI | 170401 | |
| Goat serum | Solarbio | S9070 | |
| Triton X-100 | LIFE SCIENCES | T8200 | |
| Rabbit anti-GFP | Life tech | G10362 | 1:333 dilution |
| The second antibody (goat-anti rabbit) | Jackson Immuno Research | 111-005-144 | 1:1,000 dilution |
| VECTASTAIN ABC REAGENT | Vector Lab | PK-6100 | |
| ImmPACT DAB Peroxidase Substrate Kit | Vector Lab | SK-4105 | |
| Mounting medium for fluorescence with DAPI | Vectorshield | H-1200 | |
| NaCl | Yong Da Chemical | ||
| NaH2PO4·2H2O | Yong Da Chemical | ||
| Na2HPO4·12H2O | Yong Da Chemical | ||
| Paraformaldehyde | Yong Da Chemical | 307699 | |
| Adhesion Microscope Slides | CITOGLAS | 17083 | 25 mm x 75 mm |
| SUPER-SLIP MICRO-GLAS | Electro Microscopy Siences | 72236-60 | 24 mm x 60 mm |
| 15 mL Centrifuge tube | CORNING | 430790 | |
| 96 well cell culture cluster | Coster | 3599 | |
| 24 well cell culture cluster | Coster | 3524 | |
| 70% Ethanol | WEN ZHI | ||
| Gauze | Wei AN | 05171112 | 8 cm x 10 cm x 12 cm |
| 1 mL syringe | Hong Da | ||
| Microtubes | Plasmed | ||
| Micropipet | eppendorf | ||
| Peppet tips | Rainin | ||
| Centirifuge | eppendorf | 5427R | |
| Regerator | Haier | BCD-539WT | |
| Filter | MILLEX GP | R4PA42342 | |
| Pump | LongerPump | BT-100-2J/YZ1515X | |
| Microscope | Olympus | BX53 | |
| Freezing-microtome | Leica | CM1520 |
참고문헌
- Murlidharan, G., Samulski, R. J., Asokan, A. Biology of adeno-associated viral vectors in the central nervous system. Frontiers in Molecular Neuroscience. 7, 76(2014).
- Lentz, T. B., Gray, S. J., Samulski, R. J. Viral vectors for gene delivery to the central nervous system. Neurobiology Disease. 48 (2), 179-188 (2012).
- Yang, B., et al. Global CNS transduction of adult mice by intravenously delivered rAAVrh.8 and rAAVrh.10 and nonhuman primates by rAAVrh.10. Molecular Therapy. 22 (7), 1299-1309 (2014).
- Guo, Y., et al. A Single Injection of Recombinant Adeno-Associated Virus into the Lumbar Cistern Delivers Transgene Expression Throughout the Whole Spinal Cord. Molecular Neurobiology. 53 (5), 3235-3248 (2016).
- Hastie, E., Samulski, R. J. Adeno-associated virus at 50: a golden anniversary of discovery, research, and gene therapy success--a personal perspective. Human Gene Therapy. 26 (5), 257-265 (2015).
- Hocquemiller, M., Giersch, L., Audrain, M., Parker, S., Cartier, N. Adeno-Associated Virus-Based Gene Therapy for CNS Diseases. Human Gene Therapy. 27 (7), 478-496 (2016).
- Tanguy, Y., et al. Systemic AAVrh10 provides higher transgene expression than AAV9 in the brain and the spinal cord of neonatal mice. Frontiers in Molecular Neuroscience. 8, 36(2015).
- Federic, T., et al. Robust spinal motor neuron transduction following intrathecal delivery of AAV9 in pigs. Gene Therapy. 19, 852-859 (2012).
- Ayers, J. I., et al. Widespread and efficient transduction of spinal cord and brain following neonatal AAV injection and potential disease modifying effect in ALS mice. Molecular Therapy. 23 (1), 53-62 (2015).
- Li, D., et al. Slow Intrathecal Injection of rAAVrh10 Enhances its Transduction of Spinal Cord and Therapeutic Efficacy in a Mutant SOD1 Model of ALS. Neuroscience. 365, 192-205 (2017).
- Borel, F., et al. Therapeutic rAAVrh10 Mediated SOD1 Silencing in Adult SOD1(G93A) Mice and Nonhuman Primates. Human Gene Therapy. 27 (1), 19-31 (2016).
- Fairbanks, C. A. Spinal delivery of analgesics in experimental models of pain and analgesia. Advanced Drug Delivery Reviews. 55 (8), 1007-1041 (2003).
- Hylden, J. L., Wilcox, G. L. Intrathecal morphine in mice: a new technique. European Journal of Pharmacology. 67, 313-316 (1980).
- Wang, H., et al. Widespread spinal cord transduction by intrathecal injection of rAAV delivers efficacious RNAi therapy for amyotrophic lateral sclerosis. Human Molecular Genetics. 23 (3), 668-681 (2014).
- Wang, Y., et al. scAAV9-VEGF prolongs the survival of transgenic ALS mice by promoting activation of M2 microglia and PI3K/Akt pathway. Brain Research. 1648, Pt A 1-10 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유