Method Article
重组腺相关病毒在成年小鼠中的直接注射
摘要
在这里, 我们提出了一个直接鞘内注射技术使用1% 利多因盐酸在病毒溶液中, 以确保有效的腺病毒传递给小动物, 并建立评分系统, 以预测在中央的传导效率神经系统根据利多卡因引起的短暂虚弱程度。
摘要
腺相关病毒 (aav) 的鞘内注射由于其安全性强、无创性和良好的转导效果, 在中枢神经系统基因治疗中引起了人们的极大兴趣。先前的研究已经证明了 aav 提供的基因治疗的治疗能力神经退行性疾病的 it 管理。然而, 据报道, 由于小动物信息技术管理的技术限制, 不可预测的故障率很高。在这里, 我们建立了一个评分系统, 以表明成功的程度, 腰椎穿刺在小动物通过添加1% 盐酸利多卡因注射溶液。进一步表明, 注入后瞬态弱点的程度可以预测 aav 的传导效率。因此, 该 it 注射方法可用于优化影响中枢神经系统广大区域的中枢神经系统疾病小鼠模型的治疗试验。
引言
aav 可以介导中枢神经系统转导中长期广泛的基因表达, 副作用不大, 因此已成为治疗包括肌萎缩侧索硬化症 (als) 在内的中枢神经系统疾病最有希望的载体之一。疾病 (hd)、阿尔茨海默病 (ad)、溶酶体储存疾病 (lsd)、高彻病 (gd) 和神经元类癫痫 (ncl)1。目前, 已有 100多个 aav 血清型从人类和动物中分离出来。其中, 至少有12种已用于临床前和临床试验, 包括最常用的基因载体, 如 aav1、2、4、5、6、8、9、raavrh.8 和 rAAVrh.8.101、2、3、4、 5,6。
由于受影响的中枢神经系统区域和细胞类型不同, 不同的中枢神经系统疾病需要不同的 aav 传递策略。aav 可以传递的中枢神经系统区域和细胞类型因血清类型和传递方法的不同而不同。例如, raavrh10 已被证明可以通过全身静脉注射 (iv) 传播主要的星形胶质细胞, 而当通过鞘内注射4,7时, 它传递神经元和胶质细胞。此外, 实质注射导致局部转导到注射部位附近, 而通过脑室内或鞘内注射进入脑脊液 (csf) 导致广泛的中枢神经系统转导8.研究还证明了 aav 提供的基因治疗的治疗能力神经退行性疾病 9,10,11。在影响中枢神经系统广泛领域的疾病中, 如 als, 与全身分娩方法 4,10 相比, 鞘内注射到脑脊液中的药物中注射已证明覆盖了大多数受疾病影响的地区,剂量较低。最近的研究还表明, 腰椎穿刺可用于在 als 小鼠模型中注射 aav, 从而避免了与椎板切除术和鞘内导管插入4相关的潜在损伤.
实验性直接腰椎穿刺于 1885年12,13首次用于向脊髓输送药物, 特别是麻醉剂, 用于镇痛和麻醉。在本报告中, 我们说明了腰椎穿刺 it 注射方法的成人小鼠的援助1% 利多卡因盐酸利多卡因, 一种局部胺衍生麻醉剂, 在注射溶液中评估和监测注射质量。成功注射的特点是脂质引起的短暂性麻痹, 而失败的注射并没有显示这种行为。我们将瞬态弱点的水平分为五个等级之一, 以帮助预测注射效率。最后, 我们表明, raavrh10 转导水平可以通过瘫痪等级来预测。因此, 这种鞘内 aav 传递方法可用于增强 aava 介导的基因传递, 用于中枢神经系统疾病的实验治疗。
研究方案
在河北神经内科重点实验室动物设施中培育了 fvb/nj 小鼠。所有的老鼠实验都是经河北医科大学第二医院伦理委员会批准的, 并按照中华人民共和国科学技术部颁布的实验动物管理规定进行的。中国。
1. 20% 盐酸利多卡因库存溶液的制备
- 称重2克盐酸利多卡因。加入5–6毫升的无菌水, 轻轻旋涡。用无菌水将体积增加到10毫升。
- 1.2 通过0.2 微米过滤器过滤库存溶液。将库存溶液, 每1.5 毫升微离心管1毫升, 用密封膜密封。存放在4°c。
2. 觉醒小鼠的直接术中 aav 交付
- 使用70% 乙醇的无菌纱布擦拭工作区, 并准备所需的用品, 如表 1所示。
- 在200μl 微离心管中加入95μl 的 rAAVrh10 库存溶液 (5x1012 基因组 copies/ml), 制备盐酸 aavr./10 1% 利多因复合物, 并加入5μl 的20% 利多卡因库存溶液。通过上下移液很好地混合。然后, 将病毒溶液存储在冰上 (4°c)。
注:将使用每只小鼠 8μl 4。 -
用 aav 溶液准备注射注射器
- 将一个25μl 的哈密顿注射器与一个27g 针组装在一起, 并将针头的斜面尖端与注射器上的体积刻度对齐。
- 用 4 x10 10 的病毒溶液基因组副本轻轻地将8μl 放入注射器中。请务必清除气泡。
-
准备鼠标
注:本研究使用雄性或雌性 fvb/nj 小鼠 (30-70天)。在引擎盖里操作了 it 注射。- 消毒工作区域在引擎盖与70% 乙醇。将醒着的老鼠 (雄性或雌性, 30-70天, 13-20 克体重) 放在床头物帽的俯卧位置。用无菌纱布覆盖上身, 使小鼠平静, 避免被咬伤。
- 用拇指固定在骨盆腰带上, 一边用拇指, 一边用中指。用拇指和食指拉紧双侧骨盆腰带之间的皮肤。用手掌轻轻地抓住动物的上身。
- 将毛皮涂在双侧骨盆腰带之间, 然后用碘基磨砂和70% 乙醇对皮肤表面进行消毒。
-
鞘内注射12
- 用另一只手的拇指或食指在双侧骨盆束之间感受椎间空间, 用指甲按一个压痕以表示 l5-l6 椎间空间 (定位注射部位)。
- 轻轻旋转尾巴的底部, 以指示脊椎的中线。在注射前将针线斜面调整到动物头部 (步骤2.3.1 中提到)。
- 确保动物固定牢固, 并沿脊椎中线对齐针头。
- 将针头轻轻垂直 (或稍微倾斜 70–80°) 插入压痕的交点, 并将注射器保持在中央矢状平面上。当它连接骨头时, 将角度慢慢降低到大约30°, 然后将针头滑入椎间空间。
请注意:一个明显的突然尾巴轻拍是一个成功进入硬膜内空间的标志。一旦针进入椎间间隙, 针尖将感觉牢固地夹紧。本研究中使用的 27 g 针适合在小鼠中进行信息技术治疗, 但不适合大鼠。 - 注入矢量解决方案 (步骤2.2 中提到)。启动定时器, 以 1μl3/4 s 的速度注入8μl 的矢量溶液, 在完成分娩后约1分钟保持针头。以温和的旋转拉针, 避免漏水。
- 在分娩后立即对小鼠四肢的短暂性弱点进行评分,以评估注射质量4。
请注意:标准如下: 4.得分 0: 无弱点;评分 1: 后肢轻微无力, 无步态异常;评分 2: 后肢中度无力, 步态异常明显;评分 3: 后肢完全瘫痪;评分 4: 后肢完全瘫痪, 呼吸急促, 前肢中度无力;评分 5: 四肢完全瘫痪, 呼吸急促明显。 - 将鼠标移回保持在笼子中, 以便从瘫痪中恢复。
-
清理工作
- 用1毫升无菌水冲洗注射器。对实验室用品进行分类, 并收集所有非一次性材料, 用于高压灭菌。用70% 的乙醇清洁长凳。
3. 免疫组织化学染色的组织制备
-
组织收集
- 注射后21天用3% 的水合氯醛 (0.1 mL/10 g) 麻醉小鼠腹腔内注射。
- 在心上与20毫升的低温 0.01 m pbs (ncl 147 mL) 进行完美的心上使用;nah2 po4 1.9 mm;k2hpo4 8.1 mm, ph 7.4) 首先, 然后使用泵使用泵 (1 0 mlmmin 1分钟, 5 mlmmin 9分钟, 然后用 5 mlmmin 9分钟), 然后使用 4%。
注意事项:对苯二甲醛具有致癌性和毒性。戴手套时, 只能在烟罩内处理。
-
脊髓和大脑的解剖
- 用注射器针将每只动物的四肢和头部固定在泡沫箱盖上的俯卧位置, 然后用剪刀将皮肤从头部移到囊中。
- 将头骨夹在眼睛之间, 沿着头骨的中间路线和小脑的水平线切割, 然后将头骨打开到两侧。
- 用推子提起枕骨, 用眼剪刀双侧打开椎管。切断两侧的肋骨, 小心切除椎骨上半部分。
- 用弯曲的推子提起大脑, 切断颅底的神经, 然后仔细解剖整个大脑和脊髓。将组织固定在4% 的甲醛后24小时。
-
组织切片的制备
- 在4°c 下, 可在30% 的蔗糖溶液中, 在冷冻保护大脑、颈椎和腰椎脊髓。将组织嵌入最佳切割温度 (oct) 化合物, 并使用液氮快速冷冻。
- 使用低温恒温器在25μm 处切割组织, 并将冷冻切片保存在 0.01m pbs 中, 在4°c 下使用。
4. 免疫组织化学
- 在 1% h2o2 中自由浮动部分 10分钟 , 然后在 pbs 中清洗 10分钟, 在含有5% 血清和0.3% 非离子洗涤剂的阻滞溶液中沐浴1小时。
- 在4°c 条件下, 用相应的原生抗体隔夜对切片进行培养。将 pbst 中的部分 (pbs 中的 0.2% tween 20) 清洗 30分钟 (每次 3次, 每次 10分钟)。
- 在室温下用相应的生物素-二级抗体将切片在 pbst 中清洗 30分钟 (每次 3次, 每次 10分钟)。
- 用亲和力生物素过氧化物酶复合物培养切片 40分钟, 用消色剂染色。将部分安装到幻灯片上, 然后正确干燥。
- 将滑块浸泡在无水乙醇中 5分钟, 将二甲苯浸泡 10分钟, 然后用安装介质密封滑块。最后, 用装有电荷耦合器件 (ccd) 的显微镜对幻灯片进行成像, 放大倍率为100x、200x 和400x。
结果
由于鞘内注射质量的不同, 在1% 利多卡因盐酸1% 的利多卡因注射 aav 溶液后, 小鼠表现出不同程度的瞬态虚弱。根据我们建立的半定量5级评分系统, 我们测试了不同程度的脂质诱导肢体无力小鼠 aav 的传导模式 (评分 0, n = 2; 得分 1, n = 1; 得分 4, n = 4; 评分 5, n = 3)。egfp 脊髓免疫染色显示小鼠腰椎脊髓无传导或很少转导得分为 0, 小鼠的转导略有增强, 得分为4或5的小鼠的转导性强劲而广泛 (图 1a)。我们对那些表现出不同程度的短暂肢体无力的小鼠的 gfp染色强度进行了量化, 得出的结论是, 注射后虚弱的严重程度与脊髓的程度密切相关转 导。
我们进一步探讨了 raavrh10 在整个中枢神经系统中的详细转导谱, 并注意到在注射良好的小鼠中, 脊髓全长和大脑大面积被很好地转化, 而注射良好的小鼠的营养评分为4或5。在大脑中, 在嗅球 (图 2a)、前额叶前皮层背外 (图 2b)、齿状回和海马 ca3 区 (图 2c和2d)、小脑中检测到了强大的 egfp 信号。皮质 (图 2e) 和脑干边缘区域, 包括面部细胞核 (图 2f)、脉络丛和室管膜上皮细胞 (图 2g)。然而, 在大脑的深层区域检测到的 egfp 阳性细胞较少。在脊髓、腹侧和背角中, 腹侧排出的运动轴突和背侧丰富的感觉轴突具有较强的 gfp 阳性。前角的运动神经元在脊髓的不同水平上被强烈诱导 (图 2h-2j)。此外, 还检测到包括锥体细胞在内的皮层 gfp 阳性神经元 (图 3a和3A)。包括微胶质细胞、星形胶质细胞和少突胶质细胞在内的各种胶质细胞类型也被发现为 egfp 阳性 (图 3c-3e)。
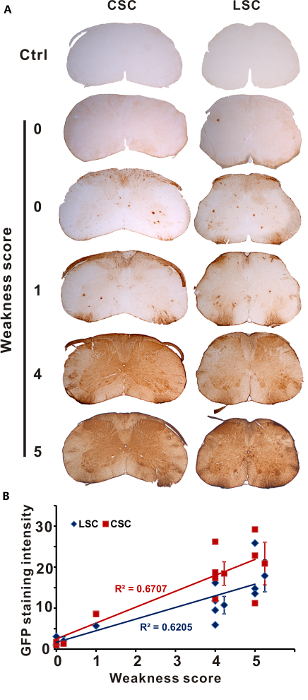
图 1: 利多塞诱导的弱程度预测转导效率.直接注射1% 利多卡因或 pbs (对照) 的 aav。3周后, 用免疫组织化学方法牺牲小鼠, 并对其 gfp 表达进行检测 (评分 0, n = 2; 得分 1, n = 1; 得分 4, n = 4; 评分 5, n = 3)。(a) 显示宫颈 (csc) 和腰椎 (lsc) 部分的 gfp 染色。(b) lsc 和 csc 中的 gfp 染色强度与短暂性虚弱程度直接相关。每个标记表示一个鼠标的值 (平均值±sd)。这一数字已根据以前的一份出版物4进行了调整。请点击这里查看此图的较大版本.

图 2: 在大脑和脊髓中广泛传导 raavrh10.(a) 嗅球;(b) 皮层;(c) 齿状回 4;和 (d) 海马 ca3;(e) 小脑皮层;(f) 面部细胞核;(g) 侧脑室;(h) 颈项前角 4;(i) 胸前角 4;和 (j) 腰椎前角4。刻度条 = 100μm. 请点击这里查看此图的较大版本.

图 3: 直接在鞘内注射后, 大脑中各种细胞类型的转导.(a) 金字塔细胞;(b) 多极神经元;(c) 微胶质细胞;(d) 星形胶质细胞;和 (e) 少突胶质细胞。刻度条 = 100μm. 请点击这里查看此图的较大版本.
讨论
从技术上讲, 在清醒小鼠的 it 注射过程中, 有几个关键步骤。首先, 在整个手术过程中, 正确的手势和对老鼠的坚定控制是成功分娩的先决条件。其次, 最困难的一点是用针尖感觉椎间间隙, 因为在伤害动物或弯曲针尖的情况下, 有必要不要在没有阻力的情况下插入太深或在强阻力下强行插入。第三, 尽管利多卡因短暂的瘫痪为 it 注射质量提供了一个客观的指标, 但还需要更多的实践来取得一致和成功的结果。
在本报告中, 我们开发了一种直接鞘内注射方法, 在清醒小鼠中进行 aav 的传递, 其中利多卡因作为 it 注射成功程度的指标, 并作为基因治疗效率的预测指标。实验性直接腰椎穿刺首次用于向脊髓输送药物, 特别是麻醉剂, 用于镇痛和麻醉, 在中枢神经系统疾病的基因治疗中得到了高度推荐。鉴于小鼠等小动物注射信息技术的困难, 我们结合了直接腰椎穿刺的两种应用, 选择了局部麻醉剂 (利多卡因), 通过评估, 在临床上被广泛用作注射质量的客观指标短暂和可恢复的瘫痪)。此外, 我们还定义了一个标准来预测 aav 通过瘫痪水平的传递效率, 并通过免疫染色来证实这一点。我们证明, 注射良好的动物在成年小鼠中枢神经系统中的 raavrh10-egfp 转导水平较高。
与以往的鞘内分娩方法相比, 采用了14、15段切除术后动物和鞘内导管的深部麻醉, 目前的方法具有一些优点。首先, 简单的腰椎穿刺程序可以在几分钟内完成每个动物, 而前面的程序需要 ~ 1小时的每只动物。其次, 目前的方法不使用麻醉和手术, 因此减少了受伤的风险4。第三, 在 aav 溶液中添加1% 盐酸利多卡因, 建立了对注射后短暂性瘫痪进行排名的五点评分系统, 证明了利多卡因引起的虚弱程度可以用来预测中枢神经系统的程度每次注射的传导。我们的数据表明, 注射良好的动物在成年小鼠的中枢神经系统中具有高水平的 raavrh10-egfp 转导。转导也普遍在类似的程度上的早期方法涉及椎板切除术和鞘内插管。与现有的清醒小鼠信息技术穿刺方法相比, 利用利多卡因提供了注射质量的客观指标, 避免了注射失败的盲目性以及随后对治疗效果的干扰。
综合来看, 目前含有1% 利多卡因的鞘内分娩是一种很有前途的方法, 通过在小鼠体内传递基因或药物, 在中枢神经系统疾病的实验治疗中。此外, 在小动物如小动物 (如小动物) 中练习信息技术注射是一种实用、方便的方法。
披露声明
作者没有什么可透露的。
致谢
这项工作的资金来自河北省人力资源和社会保障部的一笔赠款 (CY201605) 和河北省自然科学基金的赠款 (h201206101), 我们非常感谢高光平博士, 他为河北省提供了 aav。这项研究。
材料
| Name | Company | Catalog Number | Comments |
| FVB/NJ mice | Charles River Laboratories China | ||
| Lidocaine hydrochloride monohydrate | HEOWNS | 73-78-9 | |
| AAV | Viral Vector Core of the Gene Therapy Center at University of Massachusetts Medical School | ||
| 25 µL Hamilton syringe/27-30 G needle | GASTIGHT | 1702 | |
| O.C.T compond | SAKURA | 4583 | |
| H 2O 2 | SHUI HUAN PAI | 170401 | |
| Goat serum | Solarbio | S9070 | |
| Triton X-100 | LIFE SCIENCES | T8200 | |
| Rabbit anti-GFP | Life tech | G10362 | 1:333 dilution |
| The second antibody (goat-anti rabbit) | Jackson Immuno Research | 111-005-144 | 1:1,000 dilution |
| VECTASTAIN ABC REAGENT | Vector Lab | PK-6100 | |
| ImmPACT DAB Peroxidase Substrate Kit | Vector Lab | SK-4105 | |
| Mounting medium for fluorescence with DAPI | Vectorshield | H-1200 | |
| NaCl | Yong Da Chemical | ||
| NaH2PO4·2H2O | Yong Da Chemical | ||
| Na2HPO4·12H2O | Yong Da Chemical | ||
| Paraformaldehyde | Yong Da Chemical | 307699 | |
| Adhesion Microscope Slides | CITOGLAS | 17083 | 25 mm x 75 mm |
| SUPER-SLIP MICRO-GLAS | Electro Microscopy Siences | 72236-60 | 24 mm x 60 mm |
| 15 mL Centrifuge tube | CORNING | 430790 | |
| 96 well cell culture cluster | Coster | 3599 | |
| 24 well cell culture cluster | Coster | 3524 | |
| 70% Ethanol | WEN ZHI | ||
| Gauze | Wei AN | 05171112 | 8 cm x 10 cm x 12 cm |
| 1 mL syringe | Hong Da | ||
| Microtubes | Plasmed | ||
| Micropipet | eppendorf | ||
| Peppet tips | Rainin | ||
| Centirifuge | eppendorf | 5427R | |
| Regerator | Haier | BCD-539WT | |
| Filter | MILLEX GP | R4PA42342 | |
| Pump | LongerPump | BT-100-2J/YZ1515X | |
| Microscope | Olympus | BX53 | |
| Freezing-microtome | Leica | CM1520 |
参考文献
- Murlidharan, G., Samulski, R. J., Asokan, A. Biology of adeno-associated viral vectors in the central nervous system. Frontiers in Molecular Neuroscience. 7, 76(2014).
- Lentz, T. B., Gray, S. J., Samulski, R. J. Viral vectors for gene delivery to the central nervous system. Neurobiology Disease. 48 (2), 179-188 (2012).
- Yang, B., et al. Global CNS transduction of adult mice by intravenously delivered rAAVrh.8 and rAAVrh.10 and nonhuman primates by rAAVrh.10. Molecular Therapy. 22 (7), 1299-1309 (2014).
- Guo, Y., et al. A Single Injection of Recombinant Adeno-Associated Virus into the Lumbar Cistern Delivers Transgene Expression Throughout the Whole Spinal Cord. Molecular Neurobiology. 53 (5), 3235-3248 (2016).
- Hastie, E., Samulski, R. J. Adeno-associated virus at 50: a golden anniversary of discovery, research, and gene therapy success--a personal perspective. Human Gene Therapy. 26 (5), 257-265 (2015).
- Hocquemiller, M., Giersch, L., Audrain, M., Parker, S., Cartier, N. Adeno-Associated Virus-Based Gene Therapy for CNS Diseases. Human Gene Therapy. 27 (7), 478-496 (2016).
- Tanguy, Y., et al. Systemic AAVrh10 provides higher transgene expression than AAV9 in the brain and the spinal cord of neonatal mice. Frontiers in Molecular Neuroscience. 8, 36(2015).
- Federic, T., et al. Robust spinal motor neuron transduction following intrathecal delivery of AAV9 in pigs. Gene Therapy. 19, 852-859 (2012).
- Ayers, J. I., et al. Widespread and efficient transduction of spinal cord and brain following neonatal AAV injection and potential disease modifying effect in ALS mice. Molecular Therapy. 23 (1), 53-62 (2015).
- Li, D., et al. Slow Intrathecal Injection of rAAVrh10 Enhances its Transduction of Spinal Cord and Therapeutic Efficacy in a Mutant SOD1 Model of ALS. Neuroscience. 365, 192-205 (2017).
- Borel, F., et al. Therapeutic rAAVrh10 Mediated SOD1 Silencing in Adult SOD1(G93A) Mice and Nonhuman Primates. Human Gene Therapy. 27 (1), 19-31 (2016).
- Fairbanks, C. A. Spinal delivery of analgesics in experimental models of pain and analgesia. Advanced Drug Delivery Reviews. 55 (8), 1007-1041 (2003).
- Hylden, J. L., Wilcox, G. L. Intrathecal morphine in mice: a new technique. European Journal of Pharmacology. 67, 313-316 (1980).
- Wang, H., et al. Widespread spinal cord transduction by intrathecal injection of rAAV delivers efficacious RNAi therapy for amyotrophic lateral sclerosis. Human Molecular Genetics. 23 (3), 668-681 (2014).
- Wang, Y., et al. scAAV9-VEGF prolongs the survival of transgenic ALS mice by promoting activation of M2 microglia and PI3K/Akt pathway. Brain Research. 1648, Pt A 1-10 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。