Method Article
Direkte intrathekale Injektion von Recombinant Adeno-assoziierten Viren bei Erwachsenen Mäusen
In diesem Artikel
Zusammenfassung
Hier präsentieren wir Ihnen eine direkte intrathekale Injektionstechnik mit 1 % Lidocain Hydrochlorid in eine virale Lösung gewährleisten effizienten Adeno-assoziierten Viren Lieferung an Kleintieren und etablieren ein scoring-System zur Vorhersage der Transduktion Effizienz im zentralen Nervensystem nach dem Grad der vorübergehende Schwäche durch Lidocain induziert.
Zusammenfassung
Intrathekale (IT) Injektion von Adeno-assoziierte Virus (AAV) hat großes Interesse in der CNS Gentherapie aufgrund seiner Sicherheit, Noninvasiveness und ausgezeichnete Transduktion Wirksamkeit im ZNS gezogen. Frühere Studien zeigten die therapeutische Wirksamkeit der AAV geliefert Gentherapie bei neurodegenerativen Erkrankungen dadurch Verwaltung. Jedoch wurden hohe Raten von unvorhersehbaren Ausfall aufgrund der technischen Begrenzung der IT-Administration bei kleinen Tieren berichtet. Hier haben wir ein scoring-System um den Erfolg der Lumbalpunktion bei Kleintieren, inwieweit durch Zugabe von 1 % Lidocain Hydrochlorid in der Injektionslösung. Wir zeigen weiter, dass das Ausmaß der vorübergehende Schwäche nach der Injektion die Transduktion Effizienz der AAV vorhersagen kann. So kann dieser IT-Injektionsverfahren zur Therapiestudien in Mausmodellen der ZNS-Erkrankungen zu optimieren, die weite Bereiche des ZNS zu bedrängen.
Einleitung
AAV kann vermitteln langfristige und weit verbreitete Genexpression in der CNS-Transduktion mit wenigen Nebenwirkungen und daher eines der vielversprechendsten Fahrzeuge für Gen-Therapie zur Behandlung von ZNS-Erkrankungen wie Amyotrophe Lateralsklerose (ALS), Huntington es geworden Krankheit (HK), Alzheimer-Krankheit (AD), lysosomale Speicherkrankheiten (LSD), Gaucher-Krankheit (GD) und neuronale Ceroid Lipofuscinosis (NCL)1. Derzeit sind mehr als 100 AAV Serotypen von Mensch und Tier isoliert gewesen. Unter diesen sind mindestens 12 dienten in präklinischen und klinischen Studien, darunter die am häufigsten verwendeten gen Vektoren wie AAV1, 2, 4, 5, 6, 8, 9, rAAVrh.8 und rAAVrh.101,2,3,4, 5,6.
Andere ZNS-Erkrankungen erfordern unterschiedliche AAV Lieferung Strategien aufgrund der verschiedenen betroffenen CNS Regionen und Zelltypen. Die CNS Regionen und Zelle Arten, die AAV transduzieren kann variiert je nach der Serotyp sowie Versandart. Z. B. rAAVrh10 nachweislich überwiegend transduzieren Astrozyten im Auslieferungszustand durch systemische intravenöse Injektion (IV), während es Neuronen und Glia im Auslieferungszustand durch intrathekale Injektion4,7ausgestrahlt. Darüber hinaus führte Parenchym Injektion in lokalen Transduktion bis in die Nähe der Injektionsstelle, während Injektion in den Liquor cerebrospinalis (CSF) durch intraventrikuläre oder intrathekale Injektion führte zu weit verbreiteten CNS Transduktion8 . Studien haben auch therapeutische Potenz der AAV geliefert Gentherapie bei neurodegenerativen Erkrankungen dadurch Verwaltung9,10,11gezeigt. Bei Erkrankungen, die weite Bereiche des ZNS wie ALS betreffen, hat sich intrathekale Injektion in den Liquor gezeigt, die meisten Bereiche abzudecken, die durch die Krankheit mit einer niedrigeren Dosis, im Vergleich zu einer systemischen Lieferung Methode4,10befallen sind. Neuere Studien haben auch gezeigt, dass Lumbalpunktion AAV injizieren in Mausmodellen für ALS, die mögliche Verletzungen verbunden mit Laminektomie und intrathekale Katheterisierung4vermeidet einsetzbar.
Experimentelle direkte Lumbalpunktion wurde zuerst verwendet, das Rückenmark zur Analgesie und Anästhesie in 188512,13Agenten, vor allem Anästhetika, anzubieten. In diesem Bericht zeigen wir die lumbale Punktion IT Injektionsverfahren bei Erwachsenen Mäusen mit Hilfe von 1 % Lidocain Hydrochlorid, einem lokalen Amid abgeleitet Betäubungsmittel in die Injektionslösung zur Bewertung und Überwachung der Qualität der Injektion. Erfolgreiche Injektionen waren geprägt von Lidocain-induzierte vorübergehende Lähmung, während fehlerhafte Injektionen nicht dieses Verhalten zeigen. Wir klassifizieren die Höhe der vorübergehende Schwäche als einer der fünf Klassen, um die Effizienz der Injektion vorherzusagen. Schließlich zeigen wir, dass die rAAVrh10 Transduktion Ebene durch den Grad der Lähmung vorhergesagt werden kann. Daher kann diese intrathekale AAV Lieferung Methode verwendet werden, um AAV-vermittelten gen-Lieferung für experimentelle Therapie von ZNS-Erkrankungen zu verbessern.
Protokoll
FVB/NJ Mäuse wurden in der Tierstation Key Laboratory der Hebei Neurologie gezüchtet. Alle Maus-Experimente wurden von der zweiten Krankenhaus von Hebei medizinische Universität Ethikkommission genehmigt und durchgeführt nach den Vorschriften des Labor Tiermanagement unter Beachtung der vom Ministerium für Wissenschaft und Technologie der Volksrepublik China.
1. Vorbereitung von 20 % Lidocain Hydrochlorid-Stammlösung
- Wiegen Sie Lidocain Hydrochlorid 2 g. 5 – 6 mL sterilem Wasser und Wirbel sanft hinzugeben. Erhöhen Sie die Lautstärke auf insgesamt 10 mL mit sterilem Wasser.
- 1.2 filtern Sie der Stammlösung durch 0,2 µm-Filter. Aliquoten Stammlösung, 1 mL pro 1,5 mL Microcentrifuge Schlauch, und verschließen Sie diese mit einer Dichtfolie. Shop bei 4 ° C.
2. Direktlieferung intrathekale AAV in wach Mäuse
- Wischen Sie den Arbeitsbereich mit steriler Gaze mit 70 % Ethanol und bereiten Sie die erforderlichen Beistellungen, wie in Tabelle 1genannten.
- Bereiten Sie 100 µL der AAVrh.10/1% Lidocain Hydrochlorid komplexe durch Zugabe von 95 µL der Stammlösung rAAVrh10 (5 x 1012 Genom Kopien/mL) in einen sterilen 200 µL Microcentrifuge Schlauch vor, und fügen Sie 5 µL 20 % Lidocain Hydrochlorid-Stammlösung. Mischen Sie gut durch Pipettieren rauf und runter. Speichern Sie dann die Virenschutzlösung auf Eis (4 ° C).
Hinweis: es werden 8 µL pro Maus4 verwendet werden. -
Vorbereitung der Spritze mit AAV-Lösung zur Injektion
- Montieren Sie eine 25 µL Hamilton mit einem 27 G Nadel Spritze und richten Sie die abgeschrägte Spitze der Nadel mit der volumetrischen Skala auf der Spritze.
- Ziehen Sie sanft 8 µL mit 4 x 1010 Genom Kopien des Virus-Lösung in die Spritze. Achten Sie darauf, um Luftblasen zu entfernen.
-
Vorbereitung der Maus
Hinweis: männlich oder weiblich FVB/NJ Mäuse (30 – 70 Tage alt) wurden in dieser Studie verwendet. IT-Injektion wurde in der Haube betrieben.- Im Arbeitsbereich eine Kapuze mit 70 % Ethanol zu sterilisieren. Ein Bedpiece in Bauchlage in der Haube wachte Maus (männlich oder weiblich, 30 – 70 Tage alt, 13 – 20 g Gewicht) aufsetzen. Decken Sie den Oberkörper mit steriler Gaze, die Maus zu beruhigen und zu vermeiden, gebissen.
- Befestigen Sie das Tier durch packende angemessen und fest auf seinen Beckengürtel mit dem Daumen auf der einen Seite und Zeigefinger/Middle Finger auf der anderen Seite. Halten Sie die Haut zwischen bilateralen Bauchflossen Mieder straff mit Daumen und Zeigefinger. Halten Sie sanft auf den Oberkörper des Tieres mit der Handfläche.
- Rasieren Sie das Fell auf dem Rücken zwischen der bilateralen Bauchflossen Miederhosen zu, dann sterilisieren Sie die Hautoberfläche mit einem Jodid-Peeling und 70 % Ethanol aus.
-
Intrathekale Injektion12
- Fühle die Bandscheiben Raum entlang der Mittellinie zwischen den bilateralen Bauchflossen Mieder mit einem Daumen oder Zeigefinger der anderen Hand und drücken Sie eine Vertiefung mit einem Fingernagel an der Bandscheibe L5-L6-Raum (suchen Sie die Injektionsstelle).
- Drehen Sie die Schwanzwurzel, leicht und sanft an der Mittellinie der Wirbelsäule. Passen Sie die Abschrägung der Nadel in Richtung des Kopfes des Tieres vor der Injektion (in Schritt 2.3.1 erwähnt).
- Stellen Sie sicher, dass die Tiere fest sind und richten Sie die Nadel entlang der Mittellinie des Rückens.
- Stechen Sie die Nadel vorsichtig und senkrecht (oder neigen Sie leicht 70 – 80°) an der Kreuzung der "Einrückung" und halten Sie die Spritze in eine zentrale Sagittalebene. Reduzieren Sie den Winkel um ca. 30° langsam, wenn es die Knochen verbindet, dann schlüpfen Sie die Nadel in die Bandscheibe Raum.
Hinweis: Eine offensichtlich plötzliche Tail Flick ist ein Zeichen der erfolgreichen Einstieg in den intradurale Raum. Sobald die Nadel den Bandscheiben Raum betritt, fühlen die Nadelspitze fest eingespannt. Die in dieser Studie verwendete 27 G Nadel eignet sich für IT-Servicebereitstellung in Mäuse aber nicht Ratten. - Die Vektor-Lösung (in Schritt 2.2 genannten) zu injizieren. Der Timer gestartet und injizieren 8 µL der Vektor-Lösung mit einer Geschwindigkeit von 1 µL/4 s. Retain Nadel ca. 1 min nach Beendigung Lieferung. Ziehen Sie die Nadel mit sanften Drehung um auslaufen zu vermeiden.
- Gäste die vorübergehende Schwäche der Maus Gliedmaßen unmittelbar nach der Geburt, die Injektion Qualität4zu bewerten.
Hinweis: Der Standard lautet4. Ergebnis 0: keine Schwäche; Tor 1: kleinere Schwäche der hinteren Gliedmaßen ohne Gang Abnormität; 2 Punkte: moderate Schwäche der hinteren Gliedmaßen mit offensichtlichen Gangart Anomalie; 3 Punkte: komplette Lähmung der hinteren Gliedmaßen; Note 4: vollständige Lähmung der hinteren Gliedmaßen, Kurzatmigkeit und moderate Schwäche der vorderen Gliedmaßen; und 5 Punkte: vollständige Lähmung aller vier Gliedmaßen und offensichtlich Kurzatmigkeit. - Bewegen Sie die Maus zurück in den Käfig für die Wiederherstellung von Lähmung.
-
Aufräumarbeiten
- Spülen Sie die Spritze mit 1 mL sterilem Wasser. Sortieren Sie Laborbedarf zu und sammeln Sie alle nicht-Einweg-Materialien für autoklaviert Sterilisation. Reinigen Sie die Bank mit 70 % Ethanol.
(3) Gewebe Vorbereitung für immunhistochemische Färbung
-
Gewebe-Sammlung
- Mäuse auf 21 Tage nach der Injektion mit 3 % Chloral Hydrate (0,1 mL/10 g) tief durch intraperitoneale Injektion zu betäuben.
- Technologieprodukte Transcardially mit 20 mL eiskaltem PBS in 0,01 M (NaCl 147 mM; NaH2PO4 1,9 mM; K2HPO4 8,1 mM, pH 7,4) Erstens dann 4 % eiskaltem Paraformaldehyd (in 0,01 M PBS) mit Pumpe (10 mL/min für 1 min, dann 5 mL/min für 9 min).
Vorsicht: Paraformaldehyd ist giftig und krebserzeugend. Behandeln Sie es nur in der Dunstabzugshaube mit Handschuhen.
-
Dissektion des Rückenmarks und des Gehirns
- Befestigen Sie die Gliedmaßen und den Kopf eines jeden Tieres in Bauchlage auf einer Schaum-Kastenabdeckung mit Spritze Nadeln, dann Streifen Sie und entfernen Sie die Haut vom Kopf zum Kreuzbein mit einer Schere.
- Clip der Schädels zwischen Augen, neben der mittleren Strecke des Schädels und horizontale Linie auf das Kleinhirn schneiden, dann öffnen Sie den Schädel auf jeder Seite.
- Heben Sie das Hinterhauptsbein mit Pinzette und öffnen Sie den Spinalkanal bilateral mit ophthalmologischen Schere. Schneiden Sie die Rippen auf beiden Seiten und entfernen Sie vorsichtig die obere Hälfte der Wirbel.
- Heben Sie das Gehirn mit gebogenen Pinzette und trennen Sie die Nerven von der Schädelbasis, dann sezieren Sie vorsichtig heraus, das ganze Gehirn und Rückenmark zu. Nach dem Beheben der Gewebe in 4 % Paraformaldehyd für 24 h.
-
Vorbereitung des Gewebes Scheiben
- Cryoprotect das Gehirn und der Hals- und Lendenwirbelsäule Rückenmark in 30 % Saccharoselösung über Nacht bei 4 ° C. Das Gewebe in optimale Arbeitstemperatur (OCT) zusammengesetzte einbetten und schnell mit flüssigem Stickstoff eingefroren.
- Schneiden Sie das Gewebe bei 25 µm mit einem Kryostaten und speichern Sie die Gefrierschnitte mit 0,01 M-PBS-Puffer bei 4 ° C einsetzbar.
4. Immunhistochemie
- Freischwebende Abschnitte in 1 % H2O2 für 10 min vorbehandeln, dann waschen mit PBS-Puffer für 10 Minuten Inkubation in eine blockierende Lösung mit 5 % Serum und 0,3 % nicht-ionische Reinigungsmittel mit PBS-Puffer für 1 h.
- Inkubieren Sie die Scheiben mit entsprechenden Primärantikörper über Nacht bei 4 ° c Die Abschnitte in PBST waschen (0,2 % Tween 20 in PBS) für 30 min (3 Mal für 10 min).
- Inkubieren Sie die Scheiben mit entsprechenden Biotin-Sekundär-Antikörper bei Raumtemperatur 1 Stunde waschen in PBST für 30 min (3 Mal für 10 min).
- Die Abschnitte mit Affinität Biotin-Peroxidase-Komplex für 40 min inkubieren und Flecken mit Achromogenic-Agent. Montieren Sie die Abschnitte auf Folien und trocknen Sie richtig.
- Folien in wasserfreiem Ethanol für 5 min und Xylol für 10 min einweichen, dann die Folien mit einem Eindeckmittel zu versiegeln. Zu guter Letzt Bild Folien mit einem Mikroskop, ausgestattet mit einer Ladung – Coupled Vorrichtung (CCD) bei 100 X 200 X und 400 X Vergrößerungen.
Ergebnisse
Mäuse zeigten unterschiedliche Grade der vorübergehende Schwäche gleich nach es Injektion AAV Lösung in 1 % Lidocain Hydrochlorid aufgrund unterschiedlicher Qualität der intrathekale Injektion. Nach der semi-quantitative 5 Grade scoring-System haben wir eingerichtet, wir testeten die Transduktion Muster der AAV bei Mäusen mit unterschiedlichem Lidocain-induzierte Gliedmaßen Schwäche (score 0, n = 2; Tor 1, n = 1; Note 4, n = 4; 5, n Punkte = 3). EGFP Immunostaining von Rückenmark zeigte keine oder wenig Transduktion in der Lendenwirbelsäule Rückenmark von Mäusen erzielte 0, leicht erhöhte Transduktion in Mäusen scoring 1 und starke und weit verbreitete Transductions bei Mäusen scoring 4 oder 5 (Abb. 1A). Wir quantifiziert die GFP Färbung Intensität von diesen Mäusen Anzeigen von verschiedenen Graden der Transienten Gliedmaßen Schwäche (Abbildung 1B) und kam zu dem Schluss, dass die Schwere der Schwäche nach der Injektion eng korreliert mit dem Ausmaß des Rückenmarks Transduktion.
Wir weiter erforscht das detaillierte Transduktion Profil des rAAVrh10 im gesamten ZNS, und bemerkt, dass vollen Länge des Rückenmarks und weite Bereiche des Gehirns waren auch gut injizierten Mäusen die 4 oder 5 erzielte ausgestrahlt. Im Gehirn, robuste EGFP Signale erkannt wurden, in den Riechkolben (Abb. 2A), dorsolateralen präfrontalen Kortex (Abbildung 2B), dentate Gyrus und CA3 Zone des Hippocampus (Abbildungen 2 und 2D), zerebelläre Kortex (Abb. 2E) und Randgebieten der Hirnstamm einschließlich Gesichts Kern (Abbildung 2F), choroid Plexus und epithelialen Ependymzellen (Abbildung 2G). Jedoch wurden weniger EGFP-positiven Zellen in tiefen Regionen des Gehirns festgestellt. In das Rückenmark und ventralen und dorsalen Hörner waren die ventralen Abwasser motorischen Axone und dorsalen wohlhabenden sensorische Axone stark GFP-positiv. Motorischen Neuronen in den anterioren Hörnern waren stark in verschiedenen Ebenen des Rückenmarks (Abbildungen 2 H-2J) ausgestrahlt. Darüber hinaus GFP-positiven Neuronen im Kortex einschließlich Pyramidenzellen erkannt wurden (Abbildungen 3A und 3 b). Gliazelle verschiedene Mikroglia, Astrozyten und Oligodendrozyten, darunter auch erwiesen sich EGFP-positiv (zahlen 3 C-3E).
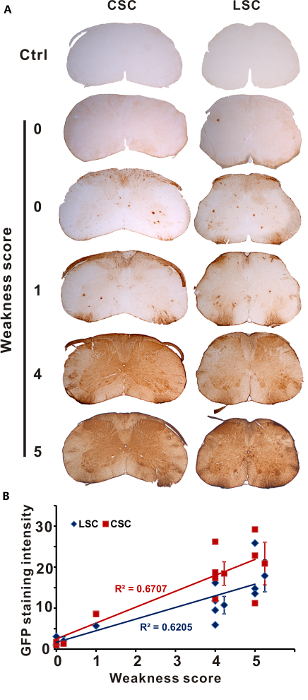
Abbildung 1 : Lidocain-induzierte Schwäche Umfang prognostiziert Transduktion Effizienz. AAV mit 1 % Lidocain oder PBS (Steuerung) wurde von IT-Direkteinspritzung injiziert. Mäuse wurden geopfert und untersucht für die GFP Expression von Immunohistochemistry 3 Wochen später (score 0, n = 2; Tor 1, n = 1; Note 4, n = 4; 5, n Punkte = 3). (A) GLP Färbung des zervikalen (CSC) und Lendenwirbelsäule Rückenmark (LSC) Abschnitten gezeigt wird. (B) GLP Färbung Intensität im LSC und CSC korrelierte direkt mit dem Grad der vorübergehende Schwäche. Jede Marke repräsentiert Werte (Mittelwert ± SD) von einer Maus. Diese Zahl wurde von einem früheren Publikation4angepasst. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 : Weit verbreitete Transduktion von rAAVrh10 im Gehirn und im Rückenmark. (A) Riechkolben; (B) Kortex; (C) dentate Gyrus4; und (D) CA3 des Hippocampus; Zerebelläre Kortex (E); (F) Gesichts Kern; (G) seitliche Ventrikel; (H) zervikale Vorderhornzellen4; (ich) Thorax Vorderhornzellen4; und (J) lumbale Vorderhornzellen4. Skalieren von Balken = 100 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3 : Transduktion von verschiedenen Zelltypen im Gehirn nach der direkten intrathekale rAAVrh10 Injektion. Pyramidenzellen (A); (B) multipolare Neuron; (C) Microglial Zelle; (D) Astrozyten; und (E) Oligodendrozyt. Skalieren von Balken = 100 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Technisch gibt es mehrere wichtige Schritte während der IT-Injektion bei Mäusen wach. Erste, richtige Geste und Firma Kontrolle der Mäuse während der gesamten Operation ist Voraussetzung für die erfolgreiche Zustellung. Zweitens ist der schwierigste Punkt den Bandscheiben Raum mit der Nadelspitze, Gefühl, wie es notwendig, nicht zu tief ohne Widerstand einfügen oder gewaltsam unter starken Widerstand ist bei verletzen die Tiere oder die Nadelspitze biegen einfügen. Drittens, obwohl die vorübergehende Lähmung durch Lidocain ein objektiver Indikator dafür Injektion Qualität bietet, ist mehr üben musste konsequente und erfolgreiche Ergebnisse zu erzielen.
In diesem Bericht haben wir eine direkte intrathekale Injektion Methode in wach Mäuse für die Lieferung von AAV, entwickelt, in denen Lidocain als Indikator für das Ausmaß der IT-Injektion-Erfolg und als Indikator für die Effizienz der Gentherapie dient. Experimentelle direkte Lumbalpunktion wurde zuerst verwendet, um Agenten, vor allem Anästhetika, des Rückenmarks zur Analgesie und Anästhesie zu liefern, und es wird dringend empfohlen, in der Gentherapie für ZNS-Erkrankungen. Angesichts der Schwierigkeit der IT Injektion in kleinere Tiere wie Mäuse wir kombiniert die beiden Anwendungen direkte Lumbalpunktion und wählte Lokalanästhetika (Lidocain, die in Kliniken häufig als ein objektiver Indikator für Injektion Qualität durch Auswertung verwendet worden ist transiente und wiederherstellbare Lähmung). Darüber hinaus haben wir definiert einen Standard, um Lieferung Effizienz der AAV durch Lähmung Levels vorherzusagen und bestätigt dies durch Immunostaining. Wir bewiesen, dass die gut injizierte Tiere höhere rAAVrh10-EGFP Signalweiterleitung im ZNS bei Erwachsenen Mäusen hatten.
Verglichen mit der vorherigen intrathekale Liefermethode mit tiefen Narkose Tier- und intrathekale Katheterisierung mit Laminektomie14,15, hat unsere aktuelle Methode mehrere Vorteile. Erstens kann das einfache Lumbalpunktion Verfahren innerhalb von ein paar Minuten für jedes Tier abgeschlossen werden, während die vorherige Prozedur ~ 1 h pro Tier dauert. Zweitens die aktuelle Methode ist nicht einsetzen, Anästhesie und Chirurgie, und reduziert somit das Risiko von Verletzungen4. Drittens: durch Zugabe von 1 % Lidocain Hydrochlorid der AAV-Lösung, wir ein fünf-Punkte-scoring-System zur Rang vorübergehende Lähmung nach der Injektion und bewiesen, dass der Grad der Schwäche induziert durch Lidocain verwendet werden, um vorherzusagen, das Ausmaß der CNS Transduktion von jeder Injektion. Unsere Daten zeigten, dass die gut injizierte Tiere hohe rAAVrh10-EGFP Signalweiterleitung im ZNS erwachsener Mäuse haben. Die Transduktion ist auch weit verbreitet in ähnlichem Umfang der früheren Methode mit Laminektomie und intrathekale Katheterisierung. Im Vergleich zu bestehenden IT-Punktion Methoden in wach Mäuse, wir bieten einen objektiveren Indikator für Injektion Qualität mit Lidocain und vermeiden die Blindheit zu fehlgeschlagenen Injektion und spätere Einmischung in die therapeutische Wirksamkeit.
Zusammengenommen, die aktuellen intrathekale Lieferung mit 1 % ist Lidocain eine vielversprechende Methode in experimentelle Therapien für ZNS-Erkrankungen durch die Bereitstellung von Gene oder Medikamente bei Mäusen. Darüber hinaus ist es eine praktische und bequeme Ansatz es Injektion bei Kleintieren wie Mäusen zu üben.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde durch einen Zuschuss von HEBEI Provinz Department of Human Resources und soziale Sicherheit (CY201605) und einen Zuschuss von Natural Science Foundation der Provinz Hebei (H2017206101) finanziert, und wir sind sehr dankbar, dass Dr. Guangping Gao, versorgte sie mit AAV für Diese Studie.
Materialien
| Name | Company | Catalog Number | Comments |
| FVB/NJ mice | Charles River Laboratories China | ||
| Lidocaine hydrochloride monohydrate | HEOWNS | 73-78-9 | |
| AAV | Viral Vector Core of the Gene Therapy Center at University of Massachusetts Medical School | ||
| 25 µL Hamilton syringe/27-30 G needle | GASTIGHT | 1702 | |
| O.C.T compond | SAKURA | 4583 | |
| H 2O 2 | SHUI HUAN PAI | 170401 | |
| Goat serum | Solarbio | S9070 | |
| Triton X-100 | LIFE SCIENCES | T8200 | |
| Rabbit anti-GFP | Life tech | G10362 | 1:333 dilution |
| The second antibody (goat-anti rabbit) | Jackson Immuno Research | 111-005-144 | 1:1,000 dilution |
| VECTASTAIN ABC REAGENT | Vector Lab | PK-6100 | |
| ImmPACT DAB Peroxidase Substrate Kit | Vector Lab | SK-4105 | |
| Mounting medium for fluorescence with DAPI | Vectorshield | H-1200 | |
| NaCl | Yong Da Chemical | ||
| NaH2PO4·2H2O | Yong Da Chemical | ||
| Na2HPO4·12H2O | Yong Da Chemical | ||
| Paraformaldehyde | Yong Da Chemical | 307699 | |
| Adhesion Microscope Slides | CITOGLAS | 17083 | 25 mm x 75 mm |
| SUPER-SLIP MICRO-GLAS | Electro Microscopy Siences | 72236-60 | 24 mm x 60 mm |
| 15 mL Centrifuge tube | CORNING | 430790 | |
| 96 well cell culture cluster | Coster | 3599 | |
| 24 well cell culture cluster | Coster | 3524 | |
| 70% Ethanol | WEN ZHI | ||
| Gauze | Wei AN | 05171112 | 8 cm x 10 cm x 12 cm |
| 1 mL syringe | Hong Da | ||
| Microtubes | Plasmed | ||
| Micropipet | eppendorf | ||
| Peppet tips | Rainin | ||
| Centirifuge | eppendorf | 5427R | |
| Regerator | Haier | BCD-539WT | |
| Filter | MILLEX GP | R4PA42342 | |
| Pump | LongerPump | BT-100-2J/YZ1515X | |
| Microscope | Olympus | BX53 | |
| Freezing-microtome | Leica | CM1520 |
Referenzen
- Murlidharan, G., Samulski, R. J., Asokan, A. Biology of adeno-associated viral vectors in the central nervous system. Frontiers in Molecular Neuroscience. 7, 76(2014).
- Lentz, T. B., Gray, S. J., Samulski, R. J. Viral vectors for gene delivery to the central nervous system. Neurobiology Disease. 48 (2), 179-188 (2012).
- Yang, B., et al. Global CNS transduction of adult mice by intravenously delivered rAAVrh.8 and rAAVrh.10 and nonhuman primates by rAAVrh.10. Molecular Therapy. 22 (7), 1299-1309 (2014).
- Guo, Y., et al. A Single Injection of Recombinant Adeno-Associated Virus into the Lumbar Cistern Delivers Transgene Expression Throughout the Whole Spinal Cord. Molecular Neurobiology. 53 (5), 3235-3248 (2016).
- Hastie, E., Samulski, R. J. Adeno-associated virus at 50: a golden anniversary of discovery, research, and gene therapy success--a personal perspective. Human Gene Therapy. 26 (5), 257-265 (2015).
- Hocquemiller, M., Giersch, L., Audrain, M., Parker, S., Cartier, N. Adeno-Associated Virus-Based Gene Therapy for CNS Diseases. Human Gene Therapy. 27 (7), 478-496 (2016).
- Tanguy, Y., et al. Systemic AAVrh10 provides higher transgene expression than AAV9 in the brain and the spinal cord of neonatal mice. Frontiers in Molecular Neuroscience. 8, 36(2015).
- Federic, T., et al. Robust spinal motor neuron transduction following intrathecal delivery of AAV9 in pigs. Gene Therapy. 19, 852-859 (2012).
- Ayers, J. I., et al. Widespread and efficient transduction of spinal cord and brain following neonatal AAV injection and potential disease modifying effect in ALS mice. Molecular Therapy. 23 (1), 53-62 (2015).
- Li, D., et al. Slow Intrathecal Injection of rAAVrh10 Enhances its Transduction of Spinal Cord and Therapeutic Efficacy in a Mutant SOD1 Model of ALS. Neuroscience. 365, 192-205 (2017).
- Borel, F., et al. Therapeutic rAAVrh10 Mediated SOD1 Silencing in Adult SOD1(G93A) Mice and Nonhuman Primates. Human Gene Therapy. 27 (1), 19-31 (2016).
- Fairbanks, C. A. Spinal delivery of analgesics in experimental models of pain and analgesia. Advanced Drug Delivery Reviews. 55 (8), 1007-1041 (2003).
- Hylden, J. L., Wilcox, G. L. Intrathecal morphine in mice: a new technique. European Journal of Pharmacology. 67, 313-316 (1980).
- Wang, H., et al. Widespread spinal cord transduction by intrathecal injection of rAAV delivers efficacious RNAi therapy for amyotrophic lateral sclerosis. Human Molecular Genetics. 23 (3), 668-681 (2014).
- Wang, Y., et al. scAAV9-VEGF prolongs the survival of transgenic ALS mice by promoting activation of M2 microglia and PI3K/Akt pathway. Brain Research. 1648, Pt A 1-10 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten