Method Article
Método autoradiográfico quantitativo para determinação das taxas regionais de síntese protéica cerebral in vivo
Neste Artigo
Resumo
A síntese proteica é um processo biológico crítico para as células. No cérebro, é necessário para mudanças adaptativas. A mensuração das taxas de síntese proteica no cérebro intacto requer considerações metodológicas cuidadosas. Aqui nós apresentamos o L-[1-14C]-método Bakersfield quantitativo da leucina para a determinação de taxas regionais da síntese da proteína cerebral in vivo.
Resumo
A síntese protéica é necessária para o desenvolvimento e manutenção da função neuronal e está envolvida em mudanças adaptativas no sistema nervoso. Além disso, pensa-se que o desregulação da síntese da proteína no sistema nervoso pode ser um phenotype do núcleo em algumas desordens desenvolventes. A medida exata das taxas da síntese da proteína cerebral em modelos animais é importante para compreender estas desordens. O método que desenvolvemos foi projetado para ser aplicado ao estudo de animais acordados e comportados. É um método autoradiográfico quantitativo, de modo que pode render taxas em todas as regiões do cérebro simultaneamente. O método é baseado no uso de um aminoácido traçador, L-[1-14C]-leucina, e um modelo cinético do comportamento da L-leucina no cérebro. Nós escolhemos L-[1-14C]-leucina como o Tracer porque não conduz aos produtos metabólicos etiquetados estranhos. É incorporado na proteína ou metabolizado ràpida para render 14co2 que é diluído em uma grande associação de co2 sem rótulo no cérebro. O método e o modelo também permitem a contribuição da leucina sem rótulo derivada da proteólise tecidual para a associação precursora do tecido para síntese proteica. O método tem a resolução espacial para determinar as taxas de síntese protéica em camadas de células e neurópilo, bem como núcleos hipotalâmicos e do nervo craniano. Para obter dados quantitativos confiáveis e reprodutíveis, é importante aderir aos detalhes processuais. Aqui apresentamos os procedimentos detalhados do método quantitativo autoradiográfico L-[1-14C]-leucina para a determinação das taxas regionais de síntese protéica in vivo.
Introdução
A síntese proteica é um importante processo biológico necessário para a mudança adaptativa de longo prazo no sistema nervoso1. A inibição da síntese proteica bloqueia o armazenamento de memória de longo prazo em invertebrados e vertebrados2. A síntese proteica é essencial para a manutenção das fases tardias de algumas formas de potenciação a longo prazo (LTP) e depressão a longo prazo (Ltd)3, sobrevivência neuronal durante o desenvolvimento4, e para a manutenção geral do neurônio e sua conexões sinápticas5. A mensuração das taxas de síntese de proteínas cerebrais pode ser uma ferramenta importante para o estudo de alterações adaptativas, bem como distúrbios do neurodesenvolvimento e distúrbios relacionados à aprendizagem e à memória.
Desenvolvemos um método para quantificar as taxas de síntese protéica cerebral in vivo em um animal acordado que oferece vantagens inerentes a outras técnicas que estimam taxas em preparações ex vivo ou in vitro de tecido cerebral6. Acima de tudo é a aplicabilidade para medições no cérebro intacto em um animal acordado. Esta é uma consideração chave porque permite medições com estrutura sináptica e função no lugar e sem preocupações sobre efeitos post mortem. Além disso, a abordagem autoradiográfica quantitativa que empregamos atinge um alto grau de localização espacial. Considerando que a energia de 14C é tal que não podemos localizar o traçador no nível subcelular ou celular, podemos medir as taxas em camadas celulares e pequenas regiões cerebrais, como núcleos hipotalâmicos, com aproximadamente uma resolução de 25 μm7.
Um desafio de medições in vivo com radiofármacos é garantir que o radiomarcar medido está no produto da reação de interesse, em vez de precursor rotulado não reagido ou outros produtos metabólicos rotulados estranhos6. Nós escolhemos L-[1-14C]-leucina como o aminoácido Tracer porque é incorporado na proteína ou metabolizado ràpida a 14co2, que é diluído na grande associação de co2 sem rótulo no cérebro resultando da taxa elevada de metabolismo energético8. Além disso, qualquer 14c não incorporado em proteínas existe principalmente como livre [14c]-leucina, que durante o período experimental de 60 min, é quase totalmente eliminada do tecido6. As proteínas são então fixadas ao tecido com formalina e posteriormente enxaguadas com darágua remover qualquer livre [14C]-leucina antes da autoradiografia.
Outra consideração importante é a questão da diluição da atividade específica da Associação de aminoácidos precursores por aminoácidos não rotulados derivados da proteólise tecidual. Nós mostramos que no rato e no rato adultos, aproximadamente 40% do pool da leucina do precursor para a síntese da proteína no cérebro vem dos ácidos aminados derivados da avaria6da proteína. Isso deve ser incluído no cálculo das taxas regionais de síntese de proteínas cerebrais (rCPS) e deve ser confirmado em estudos em que essa relação pode mudar. A base teórica e os pressupostos do método foram apresentados em detalhes em outros lugares6. Neste artigo, focamos as questões processuais da aplicação desta metodologia.
Este método tem sido empregado para a determinação de RCPS em esquilos terrestres9, ovinos10, macacos rhesus11, ratos12,13,14,15,16 , 17 anos de , 18 anos de , 19 anos de , 20 anos de , 21, um modelo do rato do complexo de esclerose tuberosa22, um modelo do rato da síndrome frágil de x23,24,25,26, ratos frágeis da pré-mutação de x27, e um modelo do rato do fenilcetonúria28. Neste manuscrito, apresentamos os procedimentos de mensuração de rCPS com o método in vivo autoradiográfico L-[1-14C]-leucina. Nós apresentamos rCPS em regiões do cérebro de um rato acordado do controle. Nós igualmente demonstramos que in vivo a administração do anisomycin, um inibidor da tradução, abole a síntese da proteína no cérebro.
Protocolo
Nota: todos os procedimentos animais foram aprovados pelo Instituto Nacional de saúde mental e Comitê de uso de animais e foram realizados de acordo com os institutos nacionais de diretrizes de saúde sobre o cuidado e uso de animais.
Uma visão geral do protocolo é apresentada na Figura 1.
1. implante cirurgicamente cateteres em veia femoral e artéria para administração do traçador e coleta de amostras de sangue arterial cronometradas, respectivamente. Termine a cirurgia pelo menos 22 h antes da administração do Tracer. A cirurgia requer cerca de 1 h para ser concluída.
- Reúna os materiais necessários: instrumentos cirúrgicos estéreis (tesouras cirúrgicas, Microtesouras, fórceps, três ganchos cirúrgicos da pele), equipamento para a anestesia do isoflurano (vaporizador do isoflurano, scavenger ativo do gás, câmara selada da anestesia, anestesia cone de nariz), estágio de cirurgia estéril, cortadores de pele, 70% etanol, betadine, gaze estéril, fita cirúrgica, aquecedores de mão comerciais, microscópio cirúrgico, estéril 0,9% cloreto de sódio (soro fisiológico), heparina estéril 100 USP unidades/mL em 0,9% cloreto de sódio (heparinizado salina), tiras estéreis de 5 20 cm de 6-0 sutura absorvível, costas estéreis de 25 cm de cateteres de polietileno PE-8 e PE-10 com uma extremidade cortada em 45o, seringas estéreis de 1 cc, agulhas estéreis de calibre 32, equipamento de cauterização, estéril 15-20 cm oco inox haste de aço (diâmetro interno de 2,5 milímetros, diâmetro exterior de 3 milímetros), anestésicos locais (pomada do Bupivacaine e do Lidocaine), e um cerco animal com instalação do apêndice do giro (Tether da mola de 30 cm com tecla, giro, montagem giratória e braço, 20 X 13 cm cilíndricos desobstruídos recipiente).
- Prepare o animal para a cirurgia.
- Assegure-se de que as técnicas assépticas e estéreis apropriadas estejam usadas como exigido por sua instituição.
- Pesar o animal. O animal deve ser pelo menos 25 g para a cirurgia bem sucedida.
- Coloc o animal dentro de uma câmara selada do plexiglass e conecte a câmara ao instrumento da anestesia do isoflurano. Ajuste a vazão para 2,5 L/min para machos e 3,0 L/min para fêmeas de 1,5% de isoflurano em O2. Após aproximadamente 2 minutos, assegure-se de que o rato esteja sedado apropriadamente pela falta de um reflexo da retirada com uma pitada do dedo do pé.
- Uma vez sedado, retire o mouse da câmara e coloque-o em uma posição prona com seu rosto dentro do cone do nariz da anestesia. Configurar o cone do nariz para receber gás do vaporizador e para devolver o gás ao limpador de gás. O limpador capturará isoflurano em um filtro de carvão.
- Use tosquiadeiras para raspar a pele entre as omoplatas. Certifique-se de esterilizar adequadamente a região raspada, alternando três vezes entre Betadine e etanol esfrega.
- Vire o mouse sobre em uma posição supina mantendo a face no cone do nariz. Tape para baixo a perna esquerda para o estágio de cirurgia e usar cortadores para raspar a pele da coxa esquerda interna para o abdômen superior esquerdo. Certifique-se de esterilizar adequadamente a região raspada, alternando três vezes entre Betadine e etanol esfrega.
- Deslize um handwarmer comercialmente disponível ativado, envolvido na gaze, o rato. Tape a perna direita para a fase cirúrgica.
- Insira o cateter na veia femoral esquerda.
- Com a ajuda de um microscópio cirúrgico, use tesouras cirúrgicas para fazer uma incisão de 1 cm da porção medial superior da coxa esquerda rostralmente para a linha média, revelando a artéria e a veia femoral.
- Retrair a pele solta com ganchos cirúrgicos da pele para expor mais as vesículas.
- Aplique o cloreto de sódio estéril de 0,9% à área exposta para manter a umidade adequada.
- Use fórceps para dissecar sem corte, separando o tecido conjuntivo em torno de uma pequena seção da artéria femoral e veia. Cuidadosamente, separe a artéria e a veia (Figura 2).
- Use fórceps para enfiar uma fita de sutura absorvível (vertente A) a veia femoral e a artéria no ponto mais lateral da incisão. Puxe a sutura até a metade para que as extremidades estejam quites.
- Em um ponto mais proximal à virilha, use o fórceps para rosqueie uma segunda sutura (vertente B) somente a veia femoral. Gentilmente amarrar um meio nó que será usado para restringir o fluxo sanguíneo.
- Em um ponto entre a vertente a e a vertente B, use o fórceps para rosqueie uma terceira sutura (Costa C) somente a veia femoral. Gentilmente amarrar um nó cheio que será usado para restringir o fluxo sanguíneo. Tenha cuidado para não rasgar a veia.
- Puxe suavemente a vertente B para restringir o fluxo sanguíneo. Use um hemostat para puxar suavemente a vertente B para manter o fluxo sanguíneo restrito.
- Corte um pequeno orifício na área restrita da veia femoral com Microtesoura e insira cuidadosamente a extremidade angular da tubagem PE-8 (previamente lavada com heparina salina) em direção a Strand B. Uma vez que introduzido, libere a tensão de Strand B e guie o cateter mais acima da veia. Aperte a vertente B à volta da veia que contém o cateter.
- Usando a vertente C, amarre um nó adicional em torno do cateter. Certifique-se de que este nó não Capture a artéria femoral.
- Puxe delicadamente para trás no tambor da seringa para encher parcialmente o tubo com sangue para assegurar-se de que o cateter estêve implantado corretamente.
- Seguindo o mesmo procedimento, insira um cateter PE-10 na artéria femoral esquerda.
- Procedimento cirúrgico completo.
- Uma vez que ambos os cateteres da veia femoral e da artéria foram fixados, amarre Strand A em um nó em torno de ambos os cateteres.
- Corte todas as suturas em excesso e retire os ganchos da pele. Lave o cateter arterial com soro fisiológico heparinizado para evitar a coagulação. Cauterize as extremidades de ambos os cateteres para criar um selo.
- Coloque o mouse na posição prona e faça uma pequena incisão na base do pescoço e aplique soro fisiológico na área exposta.
- Introduza a haste de metal oca subdérmica da incisão da garganta à incisão femoral. Cobra os cateteres através da haste oca e fora da incisão do pescoço. Retire a haste oca. Os cateteres de implante subdérmica impedirão que os ratos danifiquem os cateteres.
- Aplique bupivacaína nos lados da ferida. Fechar a incisão femoral com sutura. Adicione a pomada do Lidocaine sobre a ferida fechada, suturada.
- Cobra os cateteres através de um tubo oco flexível de 30 cm (mola Tether) e suturar o botão da mola Tether a pele. Aplique bupivacaína nos lados da ferida. Suturar o botão da mola Tether a pele. Adicione a pomada do Lidocaine sobre a ferida fechada, suturada.
- Mova o mouse para um recipiente cilíndrico claro (20 cm de altura, 13 cm de diâmetro) com uma montagem giratória e braço para abrigar o animal durante o período de recuperação. Coloque um aquecedor de mão o recipiente para manter o animal quente.
- Aparafuse a parte superior da corda da mola a um giro e fixe o giro ao braço giratório anexado ao recipiente cilíndrico. Certifique-se que o rato tem a gama completa de movimento e os cateteres podem ser acessados.
- Coloc uma tampa entalhado que não interfira com o mecanismo do giro sobre o cerco animal. Consulte a Figura 3 para a configuração completa.
- Permitir que o mouse para recuperar. Pelo menos 22 h é recomendado.
2. Prepare a solução injetável de L-[1-14C] leucina e a solução de dihidrato de ácido 5-sulfosalicílico (SSA) a 16% (p/v) para amostras de plasma de desproteinização. Na solução SSA, também incluem 0, 4 mM de norleucina e 1 μCi/mL [H3] leucina como padrões internos para análise de aminoácidos e análise da concentração de traçador nas frações plasmáticas solúveis em ácido, respectivamente. Armazene o SSA até dois meses a 4 ° c.
- Compra comercialmente disponível L-[1-14C] leucina (50-60 MCI/mmol), que é vendido como uma solução em 2% etanol ou 0,1 N HCl. seque uma atividade conhecida do traçador um fluxo suave de nitrogênio e reconstitua em uma solução de soro fisiológico normal estéril feito até uma concentração de 100 μCi/mL.
3. administrar L-[1-14C] leucina intravenosamente e coletar amostras de sangue arterial.
- Reúna os materiais necessários: 18 1,5 mL de microtubos para amostras de plasma de desproteinização (adicione 70 mL de água desionizada a cada tubo), 17 250mL de pastilhas de vidro (15 pastilhas para coleta de amostras de sangue arterial e 2 pastilhas para coleta de sangue no espaço morto para ser reinjetado. Para limitar a coleta de sangue extra e desnecessário, pequenas inserções de frascos de vidro fino com partes inferiores cônicas que permitem a pipetagem acessível do plasma sobrenadante é recomendada), 2 tubos microcapilares (32 X 0,8 mm, para medição do hematócrito), 1 heparina e tubo de microcentrífuga de fluoreto de lítio (para evitar a coagulação e a glicólise, respectivamente), hemostats (cubra as pontas com tubos de Tygon para que as braçadeiras não danifique a tubulação do PE), monitor da glicose sanguínea, transdutor da pressão sanguínea, 1 mL seringas estéreis (para solução de eutanásia disponível comercialmente (diluído 1:1 em água desionizada (para camundongos)).
- Assegure-se de que o animal esteja em estado fisiológico normal no início do experimento.
- Prenda a tubulação arterial aproximadamente 2 cm da extremidade e corte a ponta, criando uma abertura para que o sangue flua. Em seguida, desaperte o tubo e colete o sangue do espaço morto ((c. 30 mL) para coletar qualquer soro fisiológico residual e/ou sangue de empates anteriores) e, em um tubo separado, colete uma amostra de controle (aprox. 30 μL), amostras de hematócrito (cerca de metade do volume do tubo capilar) e uma glicose amostra (aprox. 20 μL).
- Meça o hematócrito obstruindo uma extremidade com putty e centrifugador do vedador por 1 minuto em 4500 x g. Meça a relação do volume de pilhas vermelhas ao volume de sangue total. Se um animal tiver um hematócrito abaixo de 30%, não continue o estudo.
- Use um monitor de glicose no sangue comercialmente disponível para medir o nível de glicose em uma gota de sangue.
- Centrífuga de controle de amostra para 2 min em 18.000 x g para separar o plasma. Desproteinize as amostras de plasma da seguinte forma: Adicionar 5 μL de plasma a 70 μL de água desionizada num microtubo de 1,5 mL, adicionar 25 μL da solução de 16% de SSA e Vortex. Coloque no gelo por 30 min antes de congelar em gelo seco.
- Retorne o sangue do espaço morto para o animal através da linha venosa, seguido por um soro fisiológico heparinizado para evitar o excesso de perda de sangue.
- Conecte a linha arterial a um transdutor de pressão arterial para medir a pressão arterial média.
- Depois de tomar as amostras certifique-se de re-Clamp a linha arterial e para nivelar a linha com um pequeno (50 mL) volume de soro fisiológico heparinizado.
- Administrar o traçador intravenosamente e coletar amostras de sangue arterial cronometradas.
- Use um conector em Y para anexar uma seringa com o traçador (100μCi/kg) e uma seringa com 50 mL de soro fisiológico estéril para liberar a linha venosa após a injeção do traçador. Conecte o conector Y à linha venosa.
- Inicie o estudo, iniciando simultaneamente um relógio de parada e injetando o traçador. Lave a linha venosa com soro fisiológico (c. 100mL) imediatamente após a injecção.
- Colete amostras de sangue 1-7 continuamente ao longo dos primeiros 2 min do experimento da mesma maneira. Após a coleta da 7ª amostra, colete 30 μL de sangue no espaço morto antes de cada amostra restante. As amostras 8-14 são coletadas em 3, 5, 10, 15, 30, 45 e 60 min, respectivamente.
- Amostras de sangue do processo imediatamente após a coleta, como foi descrito para a amostra de controle. Se houver um atraso, coloque as amostras no gelo. Reinjete cuidadosamente o sangue do espaço morto na artéria através do cateter arterial e lave com soro fisiológico de heparina.
- Em algum momento durante o experimento, processe três padrões internos adicionando 25 μL de 16% de SSA, 0, 4 mM de norleucina e 1 mCi/mL [3H] de leucina a 75 μL de água, vortex e coloque no gelo.
- Depois de coletar a 14ª amostra em 60 min, injetar aproximadamente 0,2 mL de B-eutanásia-D na linha venosa para eutanizar o animal. Registre a hora da morte.
- Desaparafuse o animal da montagem giratória e retire do invólucro animal. Remova com cuidado o cérebro, coloc na folha de alumínio, e congele no gelo seco. Não congelar cérebros com nitrogênio líquido como cérebros podem rachar. Armazene o cérebro, as amostras, e os padrões internos em-80 ° c até pronto para o processamento. O processamento pode ser realizado em qualquer ponto depois.
4. analisar as concentrações de leucina e L-[1-14C] leucina em amostras de plasma.
- Descongelar amostras e padrões internos no gelo, vortex, e centrifugar 18.000 x g por 5 min a 2 ° c. A fração sobrenadante conterá a leucina livre rotulada e sem rótulo.
- Transfira 40 μL do sobrenadante para um frasco de cintilação líquida e adicione um cocktail de cintilação. Quantificar as desintegrações por min (DPM) de 3h e 14c por meio de contagem de cintilação líquida e uma curva de saciar projetada para a contagem simultânea de dupla etiqueta (3h e 14c).
- Para quantificar as concentrações plasmáticas de leucina, utilizar um sistema de HPLC com uma coluna de troca catiónica de sódio e derivação pós-coluna com o-phthaldehyde e detecção fluorométrica.
- Ajuste a HPLC às seguintes especificações: excitação do fluorômetro de 330 nanômetro e emissão de 465 nanômetro. A fase móvel consiste em eluante de sódio, pH 7,40 e eluante de sódio + 5% de Sulfolano, pH 3,15. Ajuste a taxa de fluxo do amortecedor de 0,400 ml/min e a taxa de fluxo do instrumento do derivatização a 0,300 ml/min. Ajuste a temperatura da coluna a 48 ° c e à temperatura do reator a 45 ° c.
- Calibrar o sistema com uma gama de concentrações de aminoácidos (incluindo a norleucina) entre 30 e 500 pmol/10mL. A curva de calibração é linear. As concentrações de aminoácido das amostras de injeção testadas de 10 mL caem dentro das escalas desta curva de calibração.
5. Realize a autoradiografia quantitativa.
- Prepare seções do cérebro 20 μm na espessura para o autoradiography. Cérebro da seção por meio de um criostato em-20 ° c.
- Descongelar seções de série do cérebro da montagem em corrediças gelatina-revestidas. Ar seco.
- Lave as lâminas em cinco mudanças de formalina a 10% por 30 min por mudança, seguido por um fluxo contínuo de água deionizada para 1 h. Cubra as lâminas frouxamente com a folha para evitar a poeira e deixe secar por 24 h.
- Organize slides em um filme de raios-X (gavetas que cabem 20X25 cm filmes de mamografia são recomendados), juntamente com um conjunto de [14c] padrões de metilmetacrilato, que foram previamente calibrados contra o tecido de concentrações conhecidas de 14c como descrito em29. Os padrões podem ser comprados comercialmente mas asseguram-se de que cobrem uma escala de 2-300 mCi/g do tecido e são calibrados de encontro à espessura do tecido de 20 μm. safelight vermelho, coloque um pedaço de filme de mamografia, lado da emulsão para baixo, em cima das seções.
- Sele as gavetas e coloc em um saco em mudança preto e armazene-as em um armário por 40-45 dias.
- Desenvolva filmes de acordo com as direções do fabricante. Nota: o desenvolvimento automatizado da película não é recomendado porque o fundo pode ser desigual e pode afetar a quantificação.
6. analise imagens.
Nota: recomenda-se um programa comercialmente disponível para análise de imagem juntamente com uma câmera CCD e uma caixa de luz fluorescente com iluminação uniforme. As densidades ópticas relativas na película iluminada são detectadas pela câmera do CCD.
- Construa uma curva de calibração de densidade óptica (OD) v. concentração de 14C de tecido com base nos ODS do conjunto de padrões calibrados no filme. Ajuste esses dados (incluindo o espaço em branco ou plano de fundo) para uma equação polinomial. Ou uma equação polinomial de segundo ou terceiro grau se encaixa muito bem.
- Para analisar regiões cerebrais específicas, localize a região de interesse (ROI) em seis a oito seções em comparação com um Atlas cerebral. Registre os ODs dos pixels dentro de um ROI em todas as seções e, com base na curva de calibração, calcule a concentração de 14C de tecido em cada pixel. Calcule a concentração média do tecido 14C no ROI.
7. computação de rCPS. Computar rCPS em cada ROI por meio da seguinte equação:

Onde p * (t) é a concentração média ponderada do tecido de 14c no ROI, cp(t) e c*p(t) são as concentrações plasmáticas arteriais de leucina sem rótulo e rotulada no momento, t, t é o tempo que o animal morreu ( cerca de 60 min), e λ é a fração de leucina na piscina precursora do tecido que vem do plasma. A avaliação do λ é realizada em um experimento separado 6. λ foi avaliado nos camundongos WT, Fmr1 knockout, TSC+/-e PKU 6,22,25,28. Se um experimento envolver alterações genéticas ou farmacológicas que possam afetar as taxas de síntese protéica, degradação ou metabolismo da leucina, λ deve ser avaliado as novas condições.
Resultados
Aqui nós mostramos uma experiência representativa que demonstra os efeitos da administração prévia de um inibidor da síntese da proteína em rCPS. Anisomycin no soro fisiológico normal foi administrado a um rato selvagem-tipo masculino adulto de C57/BL6 por via subcutânea (100 MGS/quilograma) 30 minutos antes do início da determinação de RCPS. Os efeitos do tratamento com anisomicina em comparação com um animal de controle tratado pelo veículo mostram que o rCPS é quase indetectável no camundongo tratado com anisomicina (Figura 4). Estes dados representam uma validação que o método in vivo autoradiográfico L-[1-14C]-leucina mede as taxas de síntese protéica no cérebro.
Apresentamos uma figura de L-[1-14C]-autoradiogramas de leucina em quatro níveis do cérebro para demonstrar a resolução do método (Figura 5). Ilustradas são as camadas celulares no bulbo olfativo (Figura 5a e B), o hipocampo (Figura 5C) e o cerebelo (Figura 5g). Os núcleos no hipotálamo (Figura 5D), a ponte (Figura 5 e e F) e o tronco encefálico (Figura 5h) também são claramente observados nos autoradiogramas. Também mostramos as taxas regionais quantitativas de síntese protéica no córtex frontal (5,88 nmol/g/min) (Figura 6a) e hipocampo dorsal (5,35 nmol/g/min) (Figura 6B) de um animal de controle típico.

Figura 1: esquemático representando as etapas de todo o protocolo rCPS. Por favor clique aqui para ver uma versão maior desta figura.
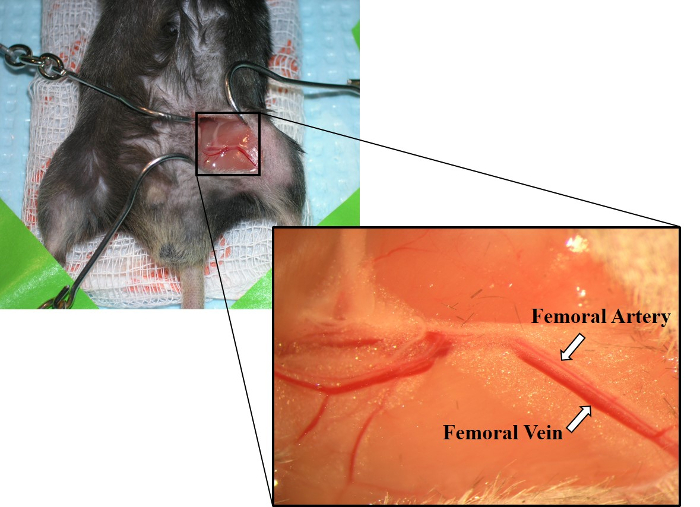
Figura 2: imagem da artéria femoral exposta e veia femoral. Estabelecendo-se paralelamente, a artéria femoral é mostrada acima da veia femoral. A veia femoral também tem uma cor vermelha mais profunda do que a artéria femoral. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3: imagem da estrutura animal recomendada para o experimento de rCPS. Utiliza um cerco animal cilíndrico desobstruído com o apêndice do giro conectado a um Tether da mola. Por favor clique aqui para ver uma versão maior desta figura.

Figura 4: imagens representativas de um animal tratado com um veículo (a) em comparação com um animal tratado com anisomicina (100 mg/kg, por via subcutânea) 30 min antes da administração do traçador (B). As taxas de síntese proteica são proporcionais ao nível de escuridão na imagem. Anisomycin reduz drasticamente as taxas de síntese de proteínas medidos, indicando a especificidade deste método. A barra de escala no canto superior direito de A representa 1 mm e se aplica a ambas as imagens. Por favor clique aqui para ver uma versão maior desta figura.

Figura 5: autoradiogramas digitalizados de um rato comportado acordado ao nível do bulbo olfativo (a, B), hipotálamo (C, D), Pons (e, F), cerebelo (g) e tronco encefálico (g, H). As regiões mais escuras têm maiores rCPS. A barra de escala no painel G aplica-se aos painéis a, C, e e G. Autoradiogramas à direita (B, D, F e H) são ampliadas imagens das áreas designadas nas imagens à esquerda e a barra de escala no painel H se aplica aos painéis B , D, F, e H. as abreviaturas são as seguintes: FrA, córtex de associação frontal; OB, bulbo olfatório; AO, núcleo olfatório anterior; GL, camada glomerular; EPl, camada plexiforme externa; BLA, amígdala basolateral; py, camada de células piramidais; dHi, hipocampo dorsal; DG, giro dentado; MHb, habenula medial; RT, núcleo reticular talâmico; VMH, núcleo hipotalâmico medial ventral; Arco, núcleo arcubado; EW, núcleo Edinger-Westphal; R, núcleo vermelho; PN, núcleo Pontina; ML, camada molecular; GL, camada granular; PC, camada da pilha de Purkinje; UC, núcleo Cuneate; AP, área postrema; 10, núcleo motor dorsal do vagus; 12, núcleo hipogloquial. Por favor clique aqui para ver uma versão maior desta figura.

Figura 6: autoradiogramas digitalizados de um rato de controle de comportamento acordado ao nível do córtex frontal (a) e do hipocampo dorsal (B). As taxas de síntese de proteínas cerebrais são codificadas por cores nas imagens de acordo com a barra de cores mostrada à direita. A barra de escala no canto inferior esquerdo de A representa 1 mm e se aplica a ambas as imagens. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Nós apresentamos um método quantitativo para a determinação de taxas regionais da síntese da proteína cerebral (rCPS) in vivo em animais experimentais. Este método tem vantagens consideráveis sobre os métodos existentes: 1. as medidas são feitas no animal de comportamento acordado, assim que refletem processos contínuos no cérebro de funcionamento. 2. as medições são feitas por meio de autoradiografia quantitativa, proporcionando a capacidade de determinar os rCPS em todas as regiões e sub-regiões do cérebro simultaneamente. 3. o modelo cinético do método leva em conta a possibilidade de reciclagem de aminoácidos não rotulados derivados da degradação protéica tecidual e seu efeito no pool precursor para síntese proteica6.
A principal limitação deste método é que ele é demorado e exigente. Considerando que é tentador empregar métodos de rendimento mais simples e mais elevados, as limitações dos dados obtidos devem ser reconhecidas.
Por causa da complexidade de medir rCPS em um rato intacto, os problemas com manutenção de um estado fisiológico normal, coletando amostras de sangue adequadas, e evitando possivelmente interferindo circunstâncias podem ser encontrados. O implante cirúrgico dos cateteres venoso e arterial é desafiador. Como em qualquer procedimento cirúrgico, especialmente com o manejo da vasculatura delicada, existe um risco inerente à mortalidade do animal. Para nós, é raro (cerca de 1%). Durante o período de recuperação de 22 h que se seguiu, ocasionalmente (cerca de 4%) um animal vai puxar um cateter para fora. Durante a mensuração, é importante que os cateteres sejam patentes e que os animais estejam em um estado fisiológico normal. Em nossa experiência recente, o sangue arterial não pode ser coletado em cerca de 2% dos animais e cerca de 1% dos animais apresentaram baixo hematócrito (< 40%) ou baixa pressão arterial (< 85 mm Hg), sugerindo perda de sangue durante a cirurgia e/ou recuperação.
Na preparação de seções cerebrais para autoradiografia, é importante garantir que a espessura da seção seja de 20 μm porque essa é a espessura da seção à qual os padrões de metilmetacrilato [14C] foram calibrados. Use o cuidado para assegurar as seções da boa qualidade, isto é, sem rasgos, dobras, ou bolhas porque estas imperfeições interferirão com a análise Bakersfield. Nós desenvolvemos películas Bakersfield à mão um pouco do que em um processador automatizado da película porque nós achamos que a densidade ótica do fundo pode ser desigual depois do processamento automatizado, e esta pode afetar a quantificação.
Na equação para rCPS, incluímos um fator, lambda (λ), que é a fração de leucina que vem do plasma arterial, o restante vem da reciclagem de aminoácidos derivados da degradação proteica do tecido6. Nós avaliamos λ em experimentos separados em camundongos WT e Fmr1 KO (modelo frágil X) C57Bl/6J e mostramos que seu valor é 0,603. O valor de λ pode variar dependendo da espécie, do fundo genético, ou da presença de uma mutação genética. Conseqüentemente, se projetando experimentos da síntese da proteína para outros modelos, um precisará de avaliar λ antes que uma medida exata possa ser obtida.
Nosso trabalho em modelos genéticos de camundongo de distúrbios do neurodesenvolvimento demonstra que essa metodologia revela mudanças na RCPS nesses modelos e, em alguns casos, as respostas aos tratamentos farmacológicos22,23,25 , 26. é igualmente concebível que a medida de RCPS pode igualmente monitorar mudanças degenerative no cérebro nas circunstâncias tais como os modelos da doença de Alzheimer, doença de Parkinson, síndrome frágil da ataxia do tremor de X, ferimento de cérebro traumático, etc. em Estes modelos, pôde ser possível controlar mudanças degenerative adiantadas e possivelmente também respostas às intervenções adiantadas. O método de rCPS pode ser usado junto com immunohistochemistry em seções paralelas para examinar mais mudanças específicas25do cérebro. Em síntese, o método quantitativo autoradiográfico L-[1-14C]-leucina é ideal para a determinação exata dos valores de RCPS in vivo. Oferece vantagens consideráveis em termos da exatidão e da aplicabilidade às condições in vivo sobre métodos existentes.
Divulgações
Os autores não têm conflitos de interesse para divulgar.
Agradecimentos
Os autores gostariam de reconhecer Zengyan Xia para a genotipagem dos camundongos, Tom Burlin para o processamento de aminoácidos e filmes, e Mei Qin para realizar alguns dos experimentos de rCPS. Esta pesquisa foi apoiada pelo programa de pesquisa intramural da NIMH, ZIA MH00889. RMS também foi apoiado por um autismo fala pós-doutorado Fellowship 8679 e uma FRAXA pós-doutorado Fellowship.
Materiais
| Name | Company | Catalog Number | Comments |
| Mice | The Jackson Laboratory | 003024 | Fmr1 knockout breeding pairs |
| Anisomycin | Tocris Bioscience | 1290 | |
| Microhematocrit Tubes | Drummond Scientific | 1-000-3200-H | capillary tubes |
| Critoseal Capillary Tube Sealant | Leica Microsystems | 39215003 | sealant putty |
| Glass vial inserts | Agilent | 5183-2089 | used to collect blood samples |
| Digi-Med Blood Pressure Analyzer | Micro-Med Inc. | BPA-400 | blood pressure analyzer |
| Bayer Breeze 2 Blood Glucose Monitoring System | Bayer Breeze | 9570A | glucose meter |
| Gastight syringe | Hamilton Co. | 1710 | tuberculin glass syringe |
| HeatMax HotHands-2 Hand Warmers | HeatMax | Model HH2 | warming pads |
| Heparin Lock Flush Solution | Fresenius Kabi USA, LLC | 504505 | heparin saline |
| Clear animal container | Instech | MTANK/W | animal enclosure |
| Spring tether | Instech | PS62 | catheter tube/rodent attachment |
| Swivel | Instech | 375/25 | hooks to spring tether |
| Swivel arm and mount | Instech | SMCLA | hooks to swivel and animal enclosure |
| Tether button | Instech | VAB62BS/22 | attaches to bottom of spring tether |
| Stainless steel tube | Made in-house | N/A | used to snake catheters through mouse |
| Matrx VIP 3000 | Matrx | 91305430 | isoflurane vaporizer |
| Isoflurane | Stoelting Co. | 50207 | isoflurane/halothane adsorber |
| Clippers | Oster Finisher | Model 59 | |
| Surgical skin hooks | Made in-house (??) | N/A (??) | |
| 0.9% Sodium Chloride Saline | APP Pharmaceuticals LLC | 918610 | |
| Forceps | Fine Science Tools | 11274-20 | |
| Surgical scissors | Fine Science Tools | 14058-11 | |
| Microscissors | Fine Science Tools | 15000-00 | |
| UNIFY silk surgical sutures | AD Surgical | #S-S618R13 | 6-0 USP, non-absorbable |
| PE-8 polyethylene tubing | SAI Infusion Technologies | PE-8-25 | |
| Syringe | Becton Dickinson and Co. | 309659 | 1cc/mL |
| PE-10 polyethylene tubing | Clay Adams | 427400 | |
| MCID Analysis | Imaging Research Inc. | Version 7.0 | optical density analysis |
| Gelatin-coated slides (75x25mm) | FD Neurotechnologies | PO101 | |
| Cryostat | Leica | CM1850 | |
| Super RX-N medical x-ray film | Fuji | 47410-19291 | |
| Hypercassettes (8x10 in) | Amersham Pharmacia Biotech | 11649 | |
| [1-14C]leucine | Moravek | MC404E | |
| Microcentrifuge tube | Sarstedt Aktiengesellschaft & Co. | 72.692.005 | used to deproteinize blood samples |
| Glass pasteur pipette | Wheaton | 357335 | |
| Glass wool | Sigma-Aldrich | 18421 | |
| Nitrogen | NIH Supply Center | 6830009737285 | |
| Scintillation fluid | CytoScint | 882453 | |
| Liquid scintilllation counter | Packard Tri-Carb | 2250CA | |
| Amino acid analyzer | Pickering Laboratories | Pinnacle PCX | |
| HPLC unit | Agilent Technologies | 1260 Infinity | include 1260 Bio-Inert Pump |
| Surgical microscope | Wild Heerbrugg | M650 | |
| Sulfosalicylic acid | Sigma-Aldrich | MKBS1634V | 5-sulfosalicylic acid dihydrate |
| Norleucine | Sigma | N8513 | |
| 1.0 N HCl | Sigma-Aldrich | H9892 | |
| [H3]leucine | Moraevk | MC672 | |
| Falcon tube | Thermo Scientific | 339652 | 50 mL conical centrifuge tubes |
| Stopwatch | Heuer Microsplit | Model 1000 | 1/100 min |
| Euthanasia Solution | Vet One | H6438 | |
| Northern Light Precision Illuminator | Imaging Research Inc. | Model B95 | fluorescent light box |
| Micro-NIKKOR 55mm f/2.8 | Nikon | 1442 | CDD camera |
Referências
- West, A. E., et al. Calcium regulation of neuronal gene expression. Proceedings of the National Academy of Sciences of the United States of America. 98, 11024-11031 (2001).
- Siegel, G., Agranoff, B., Albers, R. W., Fisher, S., Uhler, M. Basic Neurochemistry. , 6th ed, Lippincott-Raven. New York. (1999).
- Nguyen, P. V., Abel, T., Kandel, E. R. Requirement of a critical period of transcription for induction of a late phase of LTP. Science. 265, 1104-1107 (1994).
- Mao, Z., Bonni, A., Xia, F., Nadal-Vicens, M., Greenberg, M. E. Neuronal activity-dependent cell survival mediated by transcription factor MEF2. Science. 286, 785-790 (1999).
- Pfeiffer, B. E., Huber, K. M. Current advances in local protein synthesis and synaptic plasticity. The Journal of Neuroscience: the Official Journal of the Society for Neuroscience. 26, 7147-7150 (2006).
- Smith, C. B., Deibler, G. E., Eng, N., Schmidt, K., Sokoloff, L. Measurement of local cerebral protein synthesis in vivo: influence of recycling of amino acids derived from protein degradation. Proceedings of the National Academy of Sciences of the United States of America. 85, 9341-9345 (1988).
- Schmidt, K. C., Smith, C. B. Resolution, sensitivity and precision with autoradiography and small animal positron emission tomography: implications for functional brain imaging in animal research. Nuclear Medicine and Biology. 32, 719-725 (2005).
- Banker, G., Cotman, C. W. Characteristics of different amino acids as protein precursors in mouse brain: advantages of certain carboxyl-labeled amino acids. Archives of Biochemistry and Biophysics. 142, 565-573 (1971).
- Frerichs, K. U., et al. Suppression of protein synthesis in brain during hibernation involves inhibition of protein initiation and elongation. Proceedings of the National Academy of Sciences of the United States of America. 95, 14511-14516 (1998).
- Abrams, R. M., Burchfield, D. J., Sun, Y., Smith, C. B. Rates of local cerebral protein synthesis in fetal and neonatal sheep. The American Journal of Physiology. 272, R1235-R1244 (1997).
- Nakanishi, H., et al. Positive correlations between cerebral protein synthesis rates and deep sleep in Macaca mulatta. The European Journal of Neuroscience. 9, 271-279 (1997).
- Sun, Y., Deibler, G. E., Sokoloff, L., Smith, C. B. Determination of regional rates of cerebral protein synthesis adjusted for regional differences in recycling of leucine derived from protein degradation into the precursor pool in conscious adult rats. Journal of Neurochemistry. 59, 863-873 (1992).
- Scammell, T. E., Schwartz, W. J., Smith, C. B. No evidence for a circadian rhythm of protein synthesis in the rat suprachiasmatic nuclei. Brain Research. 494, 155-158 (1989).
- Smith, C. B., Eintrei, C., Kang, J., Sun, Y. Effects of thiopental anesthesia on local rates of cerebral protein synthesis in rats. The American Journal of Physiology. 274, E852-E859 (1998).
- Sun, Y., Deibler, G. E., Smith, C. B. Effects of axotomy on protein synthesis in the rat hypoglossal nucleus: examination of the influence of local recycling of leucine derived from protein degradation into the precursor pool. Journal of Cerebral Blood Flow and Metabolism: Official Journal of the International Society of Cerebral Blood Flow and Metabolism. 13, 1006-1012 (1993).
- Smith, C. B., Yu, W. H. Rates of protein synthesis in the regenerating hypoglossal nucleus: effects of testosterone treatment. Neurochemical Research. 19, 623-629 (1994).
- Orzi, F., Sun, Y., Pettigrew, K., Sokoloff, L., Smith, C. B. Effects of acute and delayed effects of prior chronic cocaine administration on regional rates of cerebral protein synthesis in rats. The Journal of Pharmacology and Experimental Therapeutics. 272, 892-900 (1995).
- Nadel, J., et al. Voluntary exercise regionally augments rates of cerebral protein synthesis. Brain Research. 1537, 125-131 (2013).
- Sun, Y., et al. Rates of local cerebral protein synthesis in the rat during normal postnatal development. The American Journal of Physiology. 268, R549-R561 (1995).
- Smith, C. B., Sun, Y., Sokoloff, L. Effects of aging on regional rates of cerebral protein synthesis in the Sprague-Dawley rat: examination of the influence of recycling of amino acids derived from protein degradation into the precursor pool. Neurochemistry International. 27, 407-416 (1995).
- Ingvar, M. C., Maeder, P., Sokoloff, L., Smith, C. B. The effects of aging on local rates of cerebral protein synthesis in rats. Monographs in Neural Sciences. 11, 47-50 (1984).
- Sare, R. M., Huang, T., Burlin, T., Loutaev, I., Smith, C. B. Decreased rates of cerebral protein synthesis measured in vivo in a mouse model of Tuberous Sclerosis Complex: unexpected consequences of reduced tuberin. Journal of Neurochemistry. 145, 417-425 (2018).
- Liu, Z. H., Huang, T., Smith, C. B. Lithium reverses increased rates of cerebral protein synthesis in a mouse model of fragile X syndrome. Neurobiology of Disease. 45, 1145-1152 (2012).
- Qin, M., et al. Altered cerebral protein synthesis in fragile X syndrome: studies in human subjects and knockout mice. Journal of Cerebral Blood Flow and Metabolism: Official Journal of the International Society of Cerebral Blood Flow and Metabolism. 33, 499-507 (2013).
- Qin, M., Kang, J., Burlin, T. V., Jiang, C., Smith, C. B. Postadolescent changes in regional cerebral protein synthesis: an in vivo study in the FMR1 null mouse. The Journal of Neuroscience: the Official Journal of the Society for Neuroscience. 25, 5087-5095 (2005).
- Qin, M., et al. R-Baclofen Reverses a Social Behavior Deficit and Elevated Protein Synthesis in a Mouse Model of Fragile X Syndrome. The International Journal of Neuropsychopharmacology. 18, pyv034(2015).
- Qin, M., et al. Cerebral protein synthesis in a knockin mouse model of the fragile X premutation. ASN Neuro. 6, (2014).
- Smith, C. B., Kang, J. Cerebral protein synthesis in a genetic mouse model of phenylketonuria. Proceedings of the National Academy of Sciences of the United States of America. 97, 11014-11019 (2000).
- Reivich, M., Jehle, J., Sokoloff, L., Kety, S. S. Measurement of regional cerebral blood flow with antipyrine-14C in awake cats. Journal of Applied Physiology. 27, 296-300 (1969).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados