Method Article
生体内における脳タンパク質合成の局所速度の決定のための定量的自動放射線法
要約
タンパク質合成は、細胞にとって重要な生物学的プロセスです。脳では、適応的な変化のために必要とされる。無傷の脳におけるタンパク質合成率の測定には、慎重な方法論的考慮が必要である。ここでは、生体内における脳タンパク質合成の局所速度を決定するためのL-[1-14 C]-ロイシン定量的自動放射線法を紹介する。
要約
タンパク質合成は、神経機能の発達と維持に必要であり、神経系の適応変化に関与しています。また、神経系におけるタンパク質合成の調節不全は、いくつかの発達障害においてコア表現型でありうって考えられている。動物モデルにおける脳タンパク質合成率の正確な測定は、これらの障害を理解するために重要である。我々が開発した方法は、目覚め、動物の振る舞いの研究に適用するように設計されました。これは定量的な自動放射線法なので、同時に脳のすべての領域で速度を得ることができます。この方法は、トレーサーアミノ酸、L-[1-14 C]-ロイシン、および脳内のL-ロイシンの挙動の運動モデルの使用に基づいている。無関係な標識代謝産物に結びつないため、トレーサーとしてL[1-14 C]-ロイシンを選びました。これは、タンパク質に組み込まれるか、または急速に代謝され、脳内の標識されていないCO2の大きなプールで希釈される14CO 2を得る。この方法およびモデルはまた、タンパク質合成のための組織前駆体プールへの組織タンパク質照症に由来する標識されていないロイシンの寄与を可能にする。この方法は、細胞および神経層におけるタンパク質合成速度、ならびに視床下部および頭蓋神経核を決定する空間分解能を有する。信頼性が高く再現可能な定量データを取得するには、手続き上の詳細に従うことが重要です。ここでは、生体内におけるタンパク質合成の局所速度を決定するための定量的自動放射線L-[1-14 C]-ロイシン法の詳細な手順を示す。
概要
タンパク質合成は、神経系1における長期適応変化に必要な重要な生物学的プロセスである。タンパク質合成を阻害することは、無脊椎動物と脊椎動物の両方における長期記憶貯蔵をブロックする2.タンパク質合成は、長期増強(LTP)および長期うつ病(LTD)3、開発時のニューロン生存、およびニューロンおよびその一般的な維持のために、いくつかの形態の後期段階の維持に不可欠である。シナプス接続5.脳タンパク質合成率の測定は、適応的変化だけでなく、神経発達障害や学習と記憶に関連する障害を研究するための重要なツールである可能性があります。
我々は、脳組織6のex vivoまたはインビトロ製剤の速度を推定する他の技術よりも固有の利点を提供する覚醒動物における生体内の脳タンパク質合成の速度を定量する方法を開発した。何よりも、目を覚ました動物の無傷の脳での測定への適用性です。これは、シナプス構造と機能を備えた測定を可能にし、死後の影響を気にすることなく、重要な考慮事項です。さらに、我々が採用する定量的な自動放射線アプローチは、高度な空間ローカリゼーションを達成する。14Cのエネルギーは、細胞レベルまたは細胞レベルでトレーサーを局在化できないほどですが、視床下部核などの細胞層や小脳領域の速度を測定することができ、約25μmの分解能7を持つ。
放射線トレーサーによる生体内測定の1つの課題は、測定された放射性標識が未反応標識前駆体または他の無関係標識代謝産物6ではなく、関心のある反応の産物であることを確実にすることである。トレーサーアミノ酸としてL-[1-14 C]-ロイシンを選んだのは、タンパク質に組み込まれるか、14CO2に急速に代謝され、高い割合から生じる脳内の標識されていないCO2の大きなプールで希釈されるからである。 エネルギー代謝8.さらに、タンパク質に組み込まれなかった任意の14Cは、主に自由[14C]-ロイシンとして存在し、60分の実験期間にわたって、組織6からほぼ完全にクリアされる。タンパク質は、ホルマリンで組織に固定され、その後、自己放射器の前に任意の自由[14C]-ロイシンを除去するために水ですすいでください。
もう一つの重要な考慮事項は、組織プロテオリシスに由来する標識のないアミノ酸による前駆体アミノ酸プールの特定活性の希釈の問題である。成体ラットおよびマウスにおいて、脳内のタンパク質合成のための前駆体ロイシンプールの約40%がタンパク質分解6に由来するアミノ酸に由来することを示した。これは、脳タンパク質合成(rCPS)の局所率の計算に含まれなければならず、この関係が変化する可能性のある研究で確認されなければならない。理論上の基礎と方法の仮定は、他の場所で詳細に提示されている6.本稿では,この方法論の応用の手続き上の問題点に焦点を当てる.
この方法は、地上リス9、羊10、ケサスサル11、ラット12、13、14、15、16におけるrCPSの決定のために用いられた,17歳,18歳,19歳,20歳,21、結節性硬化症複合体22のマウスモデル、脆弱X症候群23、24、25、26、脆弱X変異マウス27、およびフェニルケトン尿症28のマウスモデル。本原稿では、生体内自動放射線L-[1-14 C]-ロイシン法を用いてrCPSを測定する手順を提示する。覚醒コントロールマウスの脳領域にrCPSを提示する.また、翻訳の阻害剤であるアニソマイシンの生体内投与では、脳内のタンパク質合成を廃止することを実証する。
プロトコル
注:すべての動物の手順は、国立精神保健動物ケアおよび使用委員会によって承認され、動物のケアと使用に関する国立衛生ガイドラインに従って行われました。
プロトコルの概要を図 1に示します。
1. 大腿静脈および動脈にカテーテルを外科的に移植し、トレーサーの投与および時測定された動脈血液サンプルのコレクションをそれぞれ用する。トレーサーの投与前に少なくとも22時間の手術を完了する。手術は完了するために約1時間を必要とします。
- 必要な材料を集める:滅菌手術器具(外科用はさみ、マイクロハサミ、鉗子、3つの外科皮膚フック)、イソルラン麻酔のための装置(イソルラン気化器、活性ガススカベンジャー、密閉麻酔室、麻酔)鼻コーン)、滅菌手術段階、毛皮バリカン、70%エタノール、ベタジン、滅菌ガーゼ、外科テープ、市販のハンドウォーマー、外科顕微鏡、滅菌0.9%塩化ナトリウム(生理食塩)、滅菌ヘパリン100USP単位/mL(0.9%塩化ナトリウム生理食生)、6-0吸収性縫合糸の無菌5つの20cmのストリップ、PE-8およびPE-10のポリエチレンカテーテルの無菌25cmの鎖は45oで一方の端の切り取られた、無菌1 ccの注射器、滅菌32ゲージの針、焼灼装置、生殖器の装置スチールロッド(内径2.5mm、外径3mm)、局所麻酔薬(ブピバカインおよびリドカイン軟膏)、およびスイベル付録セットアップ付き動物筐体(ボタン付き30cmスプリングテザー、スイベル、スイベルマウントとアーム、20 X 13 cmクリア円筒形)コンテナ)。
- 手術のために動物を準備します。
- 適切な無菌および滅菌技術が、教育機関の必要に応じて使用されることを保証します。
- 動物の体重を量る。動物は、手術を成功させるには、少なくとも25gでなければなりません。
- 密封されたプレキシガラス室の中に動物を置き、イソファラン麻酔装置にチャンバーを接続します。流量を男性は2.5L/分、女性は3.0L/minに設定し、O2ではイソファルランを1.5%に設定します。約2分後、つま先のピンチで離脱反射の欠如によってマウスが適切に鎮静されていることを確認します。
- 鎮静剤を取り出したら、マウスをチャンバーから取り出し、鼻コーンの内側に顔を入れやすい位置に置きます。気化器からガスを受け取り、ガススカベンジャーにガスを戻すためにノーズコーンを設定します。スカベンジャーは、炭フィルターでイソファランを捕獲します。
- 肩甲骨の間に毛皮を剃るためにバリカンを使用してください。ベタジンとエタノールスクラブの間で3回交互に、剃った領域を適切に殺菌してください。
- マウスをひっくり返して、鼻コーンの顔を保つ上の位置にします。手術段階に左足をテープで留め、バリカンを使って左内側の大腿から左上腹部に毛皮を剃ります。ベタジンとエタノールスクラブの間で3回交互に、剃った領域を適切に殺菌してください。
- マウスの下でガーゼに包まれた、活性化された市販のハンドウォーマーをスライドさせます。手術の段階に右足をテープで留める。
- 左大腿静脈にカテーテルを挿入します。
- 外科顕微鏡の助けを借りて、外科はさみを使用して左大腿の上部中間部分から中線に向かって1cmの切開を行い、大腿動脈および静脈を明らかにする。
- さらに小胞を露出させるために外科皮膚フックで緩い皮膚を引き込む。
- 十分な水分を維持するために露出した領域に滅菌0.9%塩化ナトリウムを適用します。
- 鉗子を使用して解剖を行い、大腿動脈と静脈の小さな部分の周りに結合組織を分離します。慎重に、動脈と静脈を分離します(図2)。
- 鉗子を使用して、切開の最も横点で大腿静脈と動脈の両方の下に吸収性縫合糸(ストランドA)の1本の鎖を通します。縫合糸を途中で引っ張って、両端が均等になるようにします。
- 鼠径部に近位の点で、鉗子を使用して、大腿静脈の下に2番目の縫合糸(ストランドB)を通します。血流を制限するために使用される半分の結び目を穏やかに結ぶ。
- ストランド A とストランド B の間のポイントで、鉗子を使用して、大腿静脈の下に 3 番目の縫合糸 (ストランド C) を通します。血流を制限するために使用される完全な結び目を穏やかに結び付けます。静脈を引き裂かないように注意してください。
- ストランドBをゆっくりと引っ張って血流を制限します。止血を使用してストランドBを穏やかに引っ張り、血流を制限します。
- マイクロシサーで大腿静脈の制限区域に小さな穴を開け、PE-8チューブの斜めの端(以前はヘパリン生理食より洗い流した)をストランドBに向かって慎重に挿入します。一度挿入されたら、ストランドBの張力を解放し、さらに静脈を上にカテーテルを導く。カテーテルを含む静脈の周りにストランドBを締めます。
- ストランドCを使用して、カテーテルの周りに追加の結び目を結ぶ。この結び目が大腿動脈を捕捉しないことを確認してください。
- 注射器のバレルをゆっくりと引き戻し、チューブを血液で部分的に充填し、カテーテルが適切に埋め込まれたことを確認します。
- 同じ手順に従って、左大腿動脈にPE-10カテーテルを挿入する。
- 完全な外科処置。
- 大腿静脈と動脈カテーテルの両方が固定されたら、ストランドAを両方のカテーテルの周りの結び目に結び付けなさい。
- すべての余分な縫合糸をカットし、皮膚のフックを削除します。凝固を防ぐためにヘパリン化生理食で動脈カテーテルを洗い流します。シールを作成するために両方のカテーテルの端を焼きます。
- マウスを傾向のある位置に置き、首の付け根に小さな切開を行い、露出した領域に生理塩基を適用します。
- 首切開から大腿骨切開に中空金属棒を下に挿入します。中空の棒を通して、首の切開からカテーテルをヘビ。中空のロッドを取り外します。カテーテルを下皮に移植することは、マウスがカテーテルを損傷するのを防ぐ。
- 創傷の側面にブピバカインを塗布する。縫合糸で大腿骨切開を閉じます。閉鎖した縫合創傷の上にリドカインのointmentを加える。
- 30cmのフレキシブル中空管(スプリングテザー)を通してカテーテルを蛇行し、皮膚の下にスプリングテザーのボタンを縫合します。創傷の側面にブピバカインを塗布する。スプリングテザーのボタンを皮膚の下に縫合します。閉鎖した縫合創傷の上にリドカインのointmentを加える。
- 回復期間中に動物を収容するために、スイベルマウントとアームを使用して透明な円筒形の容器(高さ20cm、直径13cm)にマウスを移動します。容器の下に手温めを置き、動物を暖かく保ちます。
- スプリングテザーの上部を旋回装置にねじ込み、円筒形の容器に取り付けられた旋回装置アームに旋回装置を固定します。マウスに動きの完全な範囲があり、カテーテルにアクセスできることを確認します。
- 動物の囲いの上に旋回装置のメカニズムを妨げないスロット付き蓋を置きます。完全なセットアップについては、図 3を参照してください。
- マウスの回復を許可します。少なくとも 22 時間をお勧めします。
2. L-[1-14C]ロイシン溶液を注射用に、16%(w/v)5-スルホサリチル酸(SSA)の二水和液を調製し、血漿サンプルを脱タンパク化します。SSA溶液には、酸溶性血漿画分におけるトレーサー濃度のアミノ酸分析および分析のための内部基準として、0.04 mMノルロイシンおよび1μCi/mL[H3]ロイシンも含まれる。SSAを4°Cで2ヶ月まで保管してください。
- 市販のL[1-14C]ロイシン(50-60 mCi/mmol)を購入し、2%エタノールまたは0.1 N HClで溶液として販売され、窒素の穏やかな流れの下でトレーサーの既知の活性を吹き飛ばし、無菌の正常な生理生殖不能の溶液で再構成する100 μCi/mLの濃度まで。
3. L-[1-14C]ロイシンを静脈内投与し、動脈血サンプルを採取する。
- 必要な材料を収集する:血漿サンプルを脱タンパク化するための18 1.5 mLマイクロチューブ(各チューブに脱イオン水の70 mLを追加)、17 250mLガラスバイアルインサート(動脈血液サンプルの収集用15インサート、デッドスペース血液の収集用2インサート)再注入。余分で不必要な血液の収集を制限するために、小さくて薄いガラスバイアルインサートは、上清プラズマのアクセス可能なピペッティングを可能にするテーパーボトムを備えた、2つの微小キャピラリーチューブ(32 X 0.8mm、ヘマトクリット測定用)、1ヘパリンおよびリチウムフッ化物コーティングマイクロ遠心管(それぞれ凝固と糖質分解を防ぐために)、止血(クランプがPEチューブに損傷を与えないようにタイゴンチューブで先端を覆う)、血糖モニター、血圧トランスデューサ、1 mL滅菌注射器(用)生理生理理知フラッシュ)、及び市販の安楽死溶液(脱イオン水中で1:1希釈)を有する(マウス用)。
- 実験の最初に動物が正常な生理的状態であることを確認してください。
- 動脈チューブを端から約2cm締め付け、先端を切り取り、血液が流れる開口部を作ります。その後、デッドスペース血液((c.30 mL)を採取して、以前の引き出しから残留生理食生を採取し、別のチューブで、コントロールサンプル(約30μL)、ヘマトクリットサンプル(毛細管体積の約半分)、およびブドウ糖を収集します。サンプル(約20 μL)。
- シーラントパテと遠心分離機で一方の端を1分間差し込んでヘマトクリットを測定し、4500 x g. 赤血球の体積の総血液量に対する比を測定する。動物が30%未満のヘマトクリットを持っている場合は、研究を続行しないでください。
- 市販の血糖値モニターを使用して、一滴の血液中のグルコースレベルを測定します。
- プラズマを分離するために18,000 x gで2分間の遠心分離制御サンプル。血漿サンプルを次のように脱タンパク化:1.5 mLマイクロチューブで脱イオン水の70 μLに5μLのプラズマを加え、16%SSA溶液と渦の25μLを加えます。ドライアイスで凍結する前に30分間氷の上に置きます。
- 静脈ラインを通して動物に死空間の血液を返し、続いて過剰な失血を防ぐためにヘパリン化生理生理生理物のフラッシュを行う。
- 動脈線を血圧トランスデューサに接続して、平均動脈血圧を測定します。
- サンプルを採取した後、動脈線を再クランプし、ヘパリン化生理生理生理の小さな(50 mL)体積でラインを洗い流すようにしてください。
- トレーサーを静脈内に投与し、時を計った動脈血サンプルを採取する。
- Tレーサー(100μCi/kg)と50mLの無菌生理生理生殖器を持つ1つの注射器を取り付け、トレーサーの注入後に静脈ラインを洗い流すには、Yコネクタを使用します。Y コネクタを静脈線に接続します。
- ストップ ウォッチを同時に開始し、トレーサーを挿入してスタディを開始します。静脈ラインを注射直後に生理生理生(c.100mL)で洗い流します。
- 同様に実験の最初の2分を通して連続的に血液サンプル1〜7を収集します。7番目のサンプルを収集した後、残りの各サンプルの前に30 μLのデッドスペース血液を収集します。サンプル8-14は、それぞれ3、5、10、15、30、45、および60分で収集される。
- 回収直後に血液試料を処理し、対照試料について説明した。遅延がある場合は、氷の上にサンプルを置く。動脈カテーテルを介して動脈に死んだ空間の血液を慎重に再注入し、ヘパリン生理食レーヌで洗い流す。
- 実験中のある時点で、25 μL 16% SSA、0.04 mM ノルロイシン、および 1 mCi/mL[3H] ロイシンを 75 μL 水、渦、氷上に配置して、3 つの内部標準を処理します。
- 60分で14番目のサンプルを採取した後、約0.2mLのB-安楽死-Dを静脈ラインに注入し、動物を安楽死させる。死亡時刻を記録します。
- スイベルマウントから動物のネジを外し、動物の囲いから取り外します。慎重に脳を取り除き、アルミホイルの上に置き、ドライアイスの上で凍結します。脳が割れる可能性があるため、液体窒素で脳を凍結しないでください。処理の準備ができるまで、脳、サンプル、および内部標準を-80 °Cに保管してください。処理は、その後の任意の時点で実行できます。
4. 血漿サンプル中のロイシンおよびL-[1-14 C]ロイシンの濃度を分析する。
- 氷、渦、遠心分離機のサンプルと内部規格を2°Cで5分間解凍します。上清画分には、自由な標識とラベルなしのロイシンが含まれます。
- 上清の40μLを液体シンチレーションバイアルに移し、シンチレーションカクテルを加えます。液体シンチレーションカウントと同時ダブルラベル(3Hおよび14 C)カウント用に設計されたクエンチ曲線によって、3Hおよび14 Cの分数(DPM)あたりの崩壊を定量化します。
- 血漿ロイシン濃度を定量化するには、ナトリウム陽イオン交換カラムとo-フタルデヒドおよび蛍素検出によるポストカラム誘導体を有するHPLCシステムを使用します。
- HPLCを次の仕様に設定します:330nmのフルオロメーター励起と465nmの発光。移動相は、ナトリウム溶媒、pH 7.40、およびナトリウム溶媒+5%スルフォレーン、pH 3.15から構成される。0.400 mL/min の緩衝流量と誘導体の導出器の流量を 0.300 mL/min に設定し、カラム温度を 48 °C、原子炉温度を 45 °C に設定します。
- 30と500 pmol/10mLの間のアミノ酸濃度(ノロイシンを含む)の範囲でシステムを較正します。キャリブレーション曲線は線形です。試験された10 mL注入サンプルのアミノ酸濃度は、この較正曲線の範囲内に入る。
5. 定量的な自動撮影を行う。
- 自己電波撮影のために厚さ20μmの脳切片を準備します。-20 °C.のクライオスタットによるセクション脳。
- ゼラチンコーティングされたスライド上の連続脳セクションを解凍します。空気乾燥。
- 1回の変更で10%ホルマリンの5つの変化でスライドを洗い、その後1時間の脱イオン水の連続的な流れが続き、ほこりを避け、24時間乾燥させるためにホイルでスライドをゆるく覆います。
- X線フィルムカセット(20X25cmマンモグラフィーフィルムに収まるカセットが推奨)と[14 C]メチルメカクリレート基準のセットと一緒にスライドを配置し、以前に既知の14C濃度の組織に対して較正された説明29.標準は商業的に購入することができるが、それらはティッシュの2-300 mCi/gの範囲をカバーし、20 μmティッシュの厚さに対して校正されることを保障する。赤い安全な光の下で、マンモグラフィーフィルムの一部、エマルジョン側を下に、セクションの上に置きます。
- カセットを密封し、黒いバッグに入れ、キャビネットに40~45日間保管します。
- メーカーの指示に従ってフィルムを開発する。注: バックグラウンドが不均一であり、定量化に影響を与える可能性があるため、自動フィルム開発はお勧めしません。
6. 画像を分析します。
注:CCDカメラと照明付きの蛍光灯ボックスと組み合わせた画像解析用の市販プログラムをお勧めします。照らされたフィルムの相対的な光学密度はCCDカメラによって検出される。
- フィルム上の校正された標準のセットのODに基づいて、光学密度(OD)対組織14C濃度の較正曲線を構築する。これらのデータ (ブランクまたは背景を含む) を多項式に合わせてします。2 番目または 3 番目の多項式の方程式は非常によく適合します。
- 特定の脳領域を分析するには、脳アトラスと比較して、6~8つのセクションで対象領域(ROI)を見つけます。すべてのセクションでROI内のピクセルのODを記録し、キャリブレーション曲線に基づいて、各ピクセルの組織14C濃度を計算します。ROIにおける平均組織14C濃度を計算する。
7. rCPS の計算。次の式を使用して、各 ROI の rCPS を計算します。

ここでP*(T)は、ROIにおける14Cの加重平均組織濃度であり、Cp(t)およびC*p(t)は、時に標識されていない標識および標識されたロイシンの動脈血漿濃度であり、t、Tは動物が死亡した時点である( 約60分)とλは、血漿から来る組織前駆体プール中のロイシンの割合である。λの評価は、別の実験6で行う。λはWT、Fmr1ノックアウト、Tsc +/-、およびPKUマウス6、22、25、28で評価されている。 実験が、タンパク質合成、分解、またはロイシンの代謝の速度に影響を与える可能性のある遺伝的または薬理学的変化を伴う場合、λは新しい条件下で評価されるべきである。
結果
ここでは、タンパク質合成阻害剤のrCPSに対する以前の投与の効果を実証する代表的な実験を示す。正常生理中のアニソマイシンを、rCPS判定開始前に成人C57/BL6雄野生型マウス皮下(100mg/kg)30分に投与した。アニソマイシン治療の効果は、車両処理対照動物と比較して、rCPSがアニソマイシン処理マウスでほとんど検出不可能であることを示している(図4)。これらのデータは、インビボ自動放射線L-[1-14 C]-ロイシン法が脳内のタンパク質合成率を測定するという検証を表す。
脳の4つのレベルにおけるL-[1-14 C]-ロイシン自動ラジオグラムの図を提示し、方法の分解能を実証する(図5)。図示は、嗅球(図5A及びB)、海馬(図5C)、小脳(図5G)の細胞層である。視床下部の核(図5D)、ポン(図5E及びF)、および脳幹(図5H)もオートラジオグラムで明らかに見られる。また、代表的な対照動物の前頭皮質(5.88nmol/g/min)と背面海馬(5.35nmol/g/min)におけるタンパク質合成の定量的局所率を示す。

図 1: rCPS プロトコル全体のステップを表す回路図。この図のより大きなバージョンを表示するには、ここをクリックしてください。
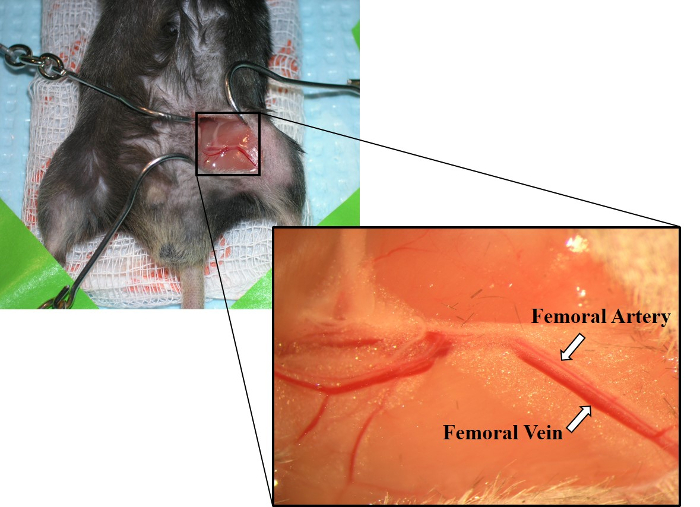
図2:露出した大腿動脈および大腿静脈の画像。互いに平行に敷設すると、大腿動脈は大腿静脈の上に示される。大腿静脈はまた、大腿動脈よりも深い赤色を有する。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図3:rCPS実験のための推奨動物用エンクロージャセットアップの画像。それはばねのテザーに接続される旋回装置の付録が付いている明確な円筒形の動物の囲いを利用する。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図4:車両処理動物(A)の代表画像を、トレーサー(B)の投与前にアニソマイシン(100mg/kg、皮下)で処理した動物と比較した。タンパク質合成の速度は、画像の暗闇のレベルに比例します。アニソマイシンは、この方法の特異性を示すタンパク質合成の測定速度を大幅に低下させます。A の右上にあるスケール バーは 1 mm を表し、両方のイメージに適用されます。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図5:嗅球(A,B)、視床下部(C,D)、ポン(E,F)、小脳(G)、および脳幹(G,H)のレベルで起床振る舞うマウスからのデジタル化された自動ラジオグラム。暗い領域の rCPS が高くなります。パネルGのスケールバーは、右側のパネルA、C、E、およびG.オートラジオグラム(B、D、F、H)に適用され、左側の画像に指定された領域から画像が拡大され、パネルHのスケールバーがパネルBに適用されます。, D, F, H. 略語は以下の通りです: FrA, 前頭部関連皮質;OB, 嗅球;AO, 前嗅核;Gl, 糸状層;EPl、外部プレキシフォーム層;BLA, バソラテラル扁桃体;py, ピラミッド型細胞層;dHi, 後部海馬;DG, 歯を食いしながします;MHb, 中間ハベヌラ;Rt, タラミック網状核;VMH, 腹部中間視床下部核;アーク、アーク核;EW, エディングガー・ウェストファール核;R, 赤い核;PN, ポンチン核;ML, 分子層;GL, 粒状層;Pc, プルキンジェ細胞層;Cu, クニート核;AP,エリアポストレマ;10、迷走の後部運動核;12、低光沢核。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図6:前頭皮質(A)および背面海馬(B)のレベルで、覚醒行動制御マウスからのデジタル化された自動ラジオグラム。脳タンパク質合成の速度は、右側に示すカラーバーに従って画像に色分けされています。A の左下にあるスケール バーは 1 mm を表し、両方のイメージに適用されます。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
実験動物における生体内における脳タンパク質合成(rCPS)の局所的率の測定方法を提示する.この方法は、既存の方法に対してかなりの利点があります:1.測定は、目覚めの振る舞い動物で行われるので、それらは機能する脳の進行中のプロセスを反映します。2.測定は、同時に脳のすべての領域とサブ領域でrCPSを決定する能力を与える定量的な自動無線撮影によって行われます。3. この方法の運動モデルは、組織タンパク質分解に由来する標識されていないアミノ酸のリサイクルの可能性と、タンパク質合成用前駆体プールへの影響を考慮に入れる6.
この方法の主な制限は、時間と要求が高いことです。より単純で高いスループット方法を採用することは魅力的ですが、取得したデータの制限を認識する必要があります。
無傷のマウスでrCPSを測定する複雑さのために、正常な生理的状態の維持、十分な血液サンプルの収集、および干渉条件の回避に問題が発生する可能性があります。静脈および動脈カテーテルの外科的注入は挑戦的である。他の外科的処置と同様に、特に繊細な血管系の取り扱いと同様に、動物の死亡に固有のリスクがある。私たちにとって、それはまれです(約1%)。その後の22時間の回復期間中、時折(約4%)動物はカテーテルを引き抜くだろう。測定中、カテーテルが特許であり、動物が正常な生理的状態にあることが重要です。最近の経験では、動脈血は約2%の動物では採取できず、約1%の動物は低ヘマトクリット(< 40%)または低い動脈血圧(< 85 mm Hg)、手術および/または回復中の失血を示唆する。
自動無線撮影のための脳切片の調製では、[14 C]メチルメタクリレート規格が校正されているセクションの厚さであるため、断面の厚さが20μmであることを確認することが重要です。これらの欠陥は、自動放射線分析を妨げるので、涙、折り目、または気泡なしで、良好な品質のセクションを確保するために注意してください。自動処理後にバックグラウンド光学密度が不均一になり、定量化に影響を与える可能性があるため、自動フィルムプロセッサではなく手で自動放射線フィルムを開発しています。
rCPSの式では、因子、ラムダ(λ)、すなわち動脈血漿由来のロイシンの割合であり、残りは組織タンパク質分解6に由来するアミノ酸のリサイクルに由来する。WTおよびFmr1 KO(脆弱Xモデル)C57Bl/6Jマウスの別々の実験でλを評価し、その値が0.603であることを示した。λの値は、種、遺伝的背景、または遺伝的変異の存在によって異なる場合があります。したがって、他のモデルのタンパク質合成実験を設計する場合、正確な測定を得る前にλを評価する必要があります。
神経発達障害の遺伝的マウスモデルにおける我々の研究は、この方法論がこれらのモデルにおけるrCPSの変化を明らかにし、場合によっては薬理学的治療に対する応答22、23、25を示している,26.rCPS測定は、アルツハイマー病、パーキンソン病、脆弱X振戦失調症症候群、外傷性脳損傷などの状態で脳の変性変化を監視することも考えられる。これらのモデルは、早期の変性変化を追跡し、場合によっては早期介入に対する応答も可能である。rCPS法は、並列セクションで免疫組織化学と一緒に使用することができ、さらに特定の脳の変化25を調べることができる。要約すると、定量的自動無線L-[1-14 C]-ロイシン法は、生体内のrCPS値の正確な決定に最適です。それは既存の方法に対して生体内条件への正確さおよび適用性の点でかなりの利点を提供する。
開示事項
著者は、開示する利益相反を持っていません。
謝辞
著者らは、マウスのジェノタイピングについてZengyan Xia、アミノ酸とフィルムの処理のためのトム・バーリン、rCPS実験の一部を行うためのメイ・チンを認めたい。本研究は、NIMH(ZIA MH00889)の内部研究プログラムの支援を受けました。RMSはまた、自閉症スピークポストドクターフェローシップ8679とFRAXAポストドクターフェローシップによってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| Mice | The Jackson Laboratory | 003024 | Fmr1 knockout breeding pairs |
| Anisomycin | Tocris Bioscience | 1290 | |
| Microhematocrit Tubes | Drummond Scientific | 1-000-3200-H | capillary tubes |
| Critoseal Capillary Tube Sealant | Leica Microsystems | 39215003 | sealant putty |
| Glass vial inserts | Agilent | 5183-2089 | used to collect blood samples |
| Digi-Med Blood Pressure Analyzer | Micro-Med Inc. | BPA-400 | blood pressure analyzer |
| Bayer Breeze 2 Blood Glucose Monitoring System | Bayer Breeze | 9570A | glucose meter |
| Gastight syringe | Hamilton Co. | 1710 | tuberculin glass syringe |
| HeatMax HotHands-2 Hand Warmers | HeatMax | Model HH2 | warming pads |
| Heparin Lock Flush Solution | Fresenius Kabi USA, LLC | 504505 | heparin saline |
| Clear animal container | Instech | MTANK/W | animal enclosure |
| Spring tether | Instech | PS62 | catheter tube/rodent attachment |
| Swivel | Instech | 375/25 | hooks to spring tether |
| Swivel arm and mount | Instech | SMCLA | hooks to swivel and animal enclosure |
| Tether button | Instech | VAB62BS/22 | attaches to bottom of spring tether |
| Stainless steel tube | Made in-house | N/A | used to snake catheters through mouse |
| Matrx VIP 3000 | Matrx | 91305430 | isoflurane vaporizer |
| Isoflurane | Stoelting Co. | 50207 | isoflurane/halothane adsorber |
| Clippers | Oster Finisher | Model 59 | |
| Surgical skin hooks | Made in-house (??) | N/A (??) | |
| 0.9% Sodium Chloride Saline | APP Pharmaceuticals LLC | 918610 | |
| Forceps | Fine Science Tools | 11274-20 | |
| Surgical scissors | Fine Science Tools | 14058-11 | |
| Microscissors | Fine Science Tools | 15000-00 | |
| UNIFY silk surgical sutures | AD Surgical | #S-S618R13 | 6-0 USP, non-absorbable |
| PE-8 polyethylene tubing | SAI Infusion Technologies | PE-8-25 | |
| Syringe | Becton Dickinson and Co. | 309659 | 1cc/mL |
| PE-10 polyethylene tubing | Clay Adams | 427400 | |
| MCID Analysis | Imaging Research Inc. | Version 7.0 | optical density analysis |
| Gelatin-coated slides (75x25mm) | FD Neurotechnologies | PO101 | |
| Cryostat | Leica | CM1850 | |
| Super RX-N medical x-ray film | Fuji | 47410-19291 | |
| Hypercassettes (8x10 in) | Amersham Pharmacia Biotech | 11649 | |
| [1-14C]leucine | Moravek | MC404E | |
| Microcentrifuge tube | Sarstedt Aktiengesellschaft & Co. | 72.692.005 | used to deproteinize blood samples |
| Glass pasteur pipette | Wheaton | 357335 | |
| Glass wool | Sigma-Aldrich | 18421 | |
| Nitrogen | NIH Supply Center | 6830009737285 | |
| Scintillation fluid | CytoScint | 882453 | |
| Liquid scintilllation counter | Packard Tri-Carb | 2250CA | |
| Amino acid analyzer | Pickering Laboratories | Pinnacle PCX | |
| HPLC unit | Agilent Technologies | 1260 Infinity | include 1260 Bio-Inert Pump |
| Surgical microscope | Wild Heerbrugg | M650 | |
| Sulfosalicylic acid | Sigma-Aldrich | MKBS1634V | 5-sulfosalicylic acid dihydrate |
| Norleucine | Sigma | N8513 | |
| 1.0 N HCl | Sigma-Aldrich | H9892 | |
| [H3]leucine | Moraevk | MC672 | |
| Falcon tube | Thermo Scientific | 339652 | 50 mL conical centrifuge tubes |
| Stopwatch | Heuer Microsplit | Model 1000 | 1/100 min |
| Euthanasia Solution | Vet One | H6438 | |
| Northern Light Precision Illuminator | Imaging Research Inc. | Model B95 | fluorescent light box |
| Micro-NIKKOR 55mm f/2.8 | Nikon | 1442 | CDD camera |
参考文献
- West, A. E., et al. Calcium regulation of neuronal gene expression. Proceedings of the National Academy of Sciences of the United States of America. 98, 11024-11031 (2001).
- Siegel, G., Agranoff, B., Albers, R. W., Fisher, S., Uhler, M. Basic Neurochemistry. , 6th ed, Lippincott-Raven. New York. (1999).
- Nguyen, P. V., Abel, T., Kandel, E. R. Requirement of a critical period of transcription for induction of a late phase of LTP. Science. 265, 1104-1107 (1994).
- Mao, Z., Bonni, A., Xia, F., Nadal-Vicens, M., Greenberg, M. E. Neuronal activity-dependent cell survival mediated by transcription factor MEF2. Science. 286, 785-790 (1999).
- Pfeiffer, B. E., Huber, K. M. Current advances in local protein synthesis and synaptic plasticity. The Journal of Neuroscience: the Official Journal of the Society for Neuroscience. 26, 7147-7150 (2006).
- Smith, C. B., Deibler, G. E., Eng, N., Schmidt, K., Sokoloff, L. Measurement of local cerebral protein synthesis in vivo: influence of recycling of amino acids derived from protein degradation. Proceedings of the National Academy of Sciences of the United States of America. 85, 9341-9345 (1988).
- Schmidt, K. C., Smith, C. B. Resolution, sensitivity and precision with autoradiography and small animal positron emission tomography: implications for functional brain imaging in animal research. Nuclear Medicine and Biology. 32, 719-725 (2005).
- Banker, G., Cotman, C. W. Characteristics of different amino acids as protein precursors in mouse brain: advantages of certain carboxyl-labeled amino acids. Archives of Biochemistry and Biophysics. 142, 565-573 (1971).
- Frerichs, K. U., et al. Suppression of protein synthesis in brain during hibernation involves inhibition of protein initiation and elongation. Proceedings of the National Academy of Sciences of the United States of America. 95, 14511-14516 (1998).
- Abrams, R. M., Burchfield, D. J., Sun, Y., Smith, C. B. Rates of local cerebral protein synthesis in fetal and neonatal sheep. The American Journal of Physiology. 272, R1235-R1244 (1997).
- Nakanishi, H., et al. Positive correlations between cerebral protein synthesis rates and deep sleep in Macaca mulatta. The European Journal of Neuroscience. 9, 271-279 (1997).
- Sun, Y., Deibler, G. E., Sokoloff, L., Smith, C. B. Determination of regional rates of cerebral protein synthesis adjusted for regional differences in recycling of leucine derived from protein degradation into the precursor pool in conscious adult rats. Journal of Neurochemistry. 59, 863-873 (1992).
- Scammell, T. E., Schwartz, W. J., Smith, C. B. No evidence for a circadian rhythm of protein synthesis in the rat suprachiasmatic nuclei. Brain Research. 494, 155-158 (1989).
- Smith, C. B., Eintrei, C., Kang, J., Sun, Y. Effects of thiopental anesthesia on local rates of cerebral protein synthesis in rats. The American Journal of Physiology. 274, E852-E859 (1998).
- Sun, Y., Deibler, G. E., Smith, C. B. Effects of axotomy on protein synthesis in the rat hypoglossal nucleus: examination of the influence of local recycling of leucine derived from protein degradation into the precursor pool. Journal of Cerebral Blood Flow and Metabolism: Official Journal of the International Society of Cerebral Blood Flow and Metabolism. 13, 1006-1012 (1993).
- Smith, C. B., Yu, W. H. Rates of protein synthesis in the regenerating hypoglossal nucleus: effects of testosterone treatment. Neurochemical Research. 19, 623-629 (1994).
- Orzi, F., Sun, Y., Pettigrew, K., Sokoloff, L., Smith, C. B. Effects of acute and delayed effects of prior chronic cocaine administration on regional rates of cerebral protein synthesis in rats. The Journal of Pharmacology and Experimental Therapeutics. 272, 892-900 (1995).
- Nadel, J., et al. Voluntary exercise regionally augments rates of cerebral protein synthesis. Brain Research. 1537, 125-131 (2013).
- Sun, Y., et al. Rates of local cerebral protein synthesis in the rat during normal postnatal development. The American Journal of Physiology. 268, R549-R561 (1995).
- Smith, C. B., Sun, Y., Sokoloff, L. Effects of aging on regional rates of cerebral protein synthesis in the Sprague-Dawley rat: examination of the influence of recycling of amino acids derived from protein degradation into the precursor pool. Neurochemistry International. 27, 407-416 (1995).
- Ingvar, M. C., Maeder, P., Sokoloff, L., Smith, C. B. The effects of aging on local rates of cerebral protein synthesis in rats. Monographs in Neural Sciences. 11, 47-50 (1984).
- Sare, R. M., Huang, T., Burlin, T., Loutaev, I., Smith, C. B. Decreased rates of cerebral protein synthesis measured in vivo in a mouse model of Tuberous Sclerosis Complex: unexpected consequences of reduced tuberin. Journal of Neurochemistry. 145, 417-425 (2018).
- Liu, Z. H., Huang, T., Smith, C. B. Lithium reverses increased rates of cerebral protein synthesis in a mouse model of fragile X syndrome. Neurobiology of Disease. 45, 1145-1152 (2012).
- Qin, M., et al. Altered cerebral protein synthesis in fragile X syndrome: studies in human subjects and knockout mice. Journal of Cerebral Blood Flow and Metabolism: Official Journal of the International Society of Cerebral Blood Flow and Metabolism. 33, 499-507 (2013).
- Qin, M., Kang, J., Burlin, T. V., Jiang, C., Smith, C. B. Postadolescent changes in regional cerebral protein synthesis: an in vivo study in the FMR1 null mouse. The Journal of Neuroscience: the Official Journal of the Society for Neuroscience. 25, 5087-5095 (2005).
- Qin, M., et al. R-Baclofen Reverses a Social Behavior Deficit and Elevated Protein Synthesis in a Mouse Model of Fragile X Syndrome. The International Journal of Neuropsychopharmacology. 18, pyv034(2015).
- Qin, M., et al. Cerebral protein synthesis in a knockin mouse model of the fragile X premutation. ASN Neuro. 6, (2014).
- Smith, C. B., Kang, J. Cerebral protein synthesis in a genetic mouse model of phenylketonuria. Proceedings of the National Academy of Sciences of the United States of America. 97, 11014-11019 (2000).
- Reivich, M., Jehle, J., Sokoloff, L., Kety, S. S. Measurement of regional cerebral blood flow with antipyrine-14C in awake cats. Journal of Applied Physiology. 27, 296-300 (1969).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved