Method Article
Metodo autoradiografico quantitativo per la determinazione dei tassi regionali di sintesi proteica cerebrale in vivo
In questo articolo
Riepilogo
La sintesi proteica è un processo biologico critico per le cellule. Nel cervello, è necessario per le modifiche adattive. La misurazione dei tassi di sintesi proteica nel cervello intatto richiede un'attenta considerazione metodologica. Qui presentiamo il metodo autoradiografico quantitativo L-[1-14C]-leucina per la determinazione dei tassi regionali di sintesi delle proteine cerebrali in vivo.
Abstract
La sintesi proteica è necessaria per lo sviluppo e il mantenimento della funzione neuronale ed è coinvolta nei cambiamenti adattivi nel sistema nervoso. Inoltre, si pensa che la disregolazione della sintesi proteica nel sistema nervoso possa essere un fenotipo fondamentale in alcuni disturbi dello sviluppo. La misurazione accurata dei tassi di sintesi delle proteine cerebrali nei modelli animali è importante per comprendere questi disturbi. Il metodo che abbiamo sviluppato è stato progettato per essere applicato allo studio degli animali svegli e che si comportano. È un metodo autoradiografico quantitativo, quindi può produrre tassi in tutte le regioni del cervello contemporaneamente. Il metodo si basa sull'uso di un aminoacido tracciante, L-[1-14C]-leucina, e un modello cinetico del comportamento della L-leucina nel cervello. Abbiamo scelto L-[1-14C]-leucina come tracciante perché non porta a prodotti metabolici etichettati estranei. È incorporato nella proteina o rapidamente metabolizzato per produrre 14CO2 che viene diluito in un grande pool di CO2 senza etichetta nel cervello. Il metodo e il modello consentono anche il contributo della leucina non etichettata derivata dalla proteolisi tissutale alla pool precursore del tessuto per la sintesi proteica. Il metodo ha la risoluzione spaziale per determinare i tassi di sintesi delle proteine negli strati cellulari e neuropil, così come i nuclei ipotalici e nervosi cranici. Per ottenere dati quantitativi affidabili e riproducibili, è importante rispettare i dettagli procedurali. Qui presentiamo le procedure dettagliate del metodo quantitativo autoradiografico L-[1-14C]-leucina per la determinazione dei tassi regionali di sintesi proteica in vivo.
Introduzione
La sintesi proteica è un importante processo biologico necessario per il cambiamento adattivo a lungo termine nel sistema nervoso1. L'inibizione della sintesi proteica blocca l'immagazzinamento di memoria a lungo termine sia negli invertebrati che nei vertebrati2. La sintesi proteica è essenziale per il mantenimento delle fasi tardive di alcune forme di potenziamento a lungo termine (LTP) e depressione a lungo termine (LTD)3, sopravvivenza neuronale durante lo sviluppo4, e per il mantenimento generale del neurone e della sua connessioni sinaptiche5. La misurazione dei tassi di sintesi delle proteine cerebrali può essere uno strumento importante con cui studiare i cambiamenti adattivi, nonché i disturbi e i disturbi del neurosviluppo legati all'apprendimento e alla memoria.
Abbiamo sviluppato un metodo per quantificare i tassi di sintesi proteica cerebrale in vivo in un animale sveglio che offre vantaggi intrinseci rispetto ad altre tecniche che stimano i tassi in ex vivo o in vitro preparati del tessuto cerebrale6. In primo luogo è l'applicabilità alle misurazioni nel cervello intatto in un animale sveglio. Questa è una considerazione chiave perché permette misurazioni con struttura sinaptica e funzione in atto e senza preoccupazioni circa gli effetti post mortem. Inoltre, l'approccio quantitativo autoradiografico che impieghiamo raggiunge un alto grado di localizzazione spaziale. Mentre l'energia di 14C è tale che non possiamo localizzare il tracciante a livello subcellulare o cellulare, possiamo misurare i tassi negli strati cellulari e nelle piccole regioni cerebrali come i nuclei ipotalelli, con circa 25 m risoluzione7.
Una sfida delle misurazioni in vivo con i radiotracciatori consiste nell'assicurare che il radiolabel misurato sia nel prodotto della reazione di interesse piuttosto che di precursore etichettato non reagito o di altri prodotti metabolici etichettati estranei6. Abbiamo scelto L-[1-14C]-leucina come aminoacido tracciante perché è incorporato nella proteina o rapidamente metabolizzato a 14CO2, che viene diluito nel grande pool di CO2 senza etichetta nel cervello derivante dall'alto tasso di metabolismo energetico8. Inoltre, qualsiasi 14C non incorporato nella proteina esiste principalmente come libero [14C]-leucina, che nel periodo sperimentale di 60 min, è quasi interamente eliminato dal tessuto6. Le proteine vengono quindi fissate al tessuto con formalina e successivamente sciacquate con acqua per rimuovere qualsiasi leucina libera [14C] -leucina prima dell'autoradiografia.
Un'altra considerazione importante è la questione della diluizione dell'attività specifica del pool di amminoacidi precursori da aminoacidi non etichettati derivati dalla proteolisi tissutale. Abbiamo dimostrato che nel ratto e nel topo adulti, circa il 40% del pool di leucina precursore per la sintesi proteica nel cervello proviene da amminoacidi derivati dalla ripartizione delle proteine6. Questo deve essere incluso nel calcolo dei tassi regionali di sintesi delle proteine cerebrali (rCPS) e deve essere confermato negli studi in cui questa relazione può cambiare. La base teorica e le ipotesi del metodo sono state presentate in dettaglio altrove6. In questo documento, ci concentriamo sulle questioni procedurali dell'applicazione di questa metodologia.
Questo metodo è stato impiegato per la determinazione di rCPS in scoiattoli terrestri9, pecore10, rhesus scimmie11, ratti12,13,14,15,16 , 17 mi lato , 18 mi lato , 19 del 12 , 20 anni , 21, un modello murino del complesso Tuberoso sclerosi22, un modello murino di sindrome fragile X23,24,25,26, fragili topi X premutation27, e un modello murino di fenylketonuria28. In questo manoscritto, presentiamo le procedure per la misurazione di rCPS con il metodo leucina autoradiografico in vivo L-[1-14C]-leucina. Vi presentiamo rCPS nelle regioni cerebrali di un topo di controllo sveglio. Dimostriamo anche che la somministrazione in vivo dell'anisomicina, un inibitore della traduzione, abolisce la sintesi proteica nel cervello.
Protocollo
Nota: tutte le procedure sugli animali sono state approvate dal National Institute of Mental Health Animal Care and Use Committee e sono state eseguite secondo i National Institutes of Health Guidelines on the Care and Use of Animals.
Una panoramica del protocollo è presentata nella Figura 1.
1. Impiantare chirurgicamente cateteri in una vena femorale e arteria per la somministrazione del tracciante e la raccolta di campioni di sangue arterioso a tempo, rispettivamente. Completare l'intervento almeno 22 h prima della somministrazione del tracciante. L'intervento chirurgico richiede circa 1 h per completare.
- Raccogliere i materiali necessari: strumenti chirurgici sterili (forbici chirurgiche, microforbici, pinze, tre ganci chirurgici della pelle), attrezzature per l'anestesia isoflurano (vaporizzatore isoflurane, scavenger a gas attivo, camera di anestesia sigillata, anestesia, anestesia cono del naso), fase di chirurgia sterile, tagliapelliccia, 70% etanolo, betadine, garza sterile, nastro chirurgico, scaldamani commerciali, microscopio chirurgico, sterile 0,9% di cloruro di sodio (salina), eparina sterile 100 unità USP/mL in 0,9% cloruro di sodio (eparinizzato salina), sterile cinque strisce da 20 cm di 6-0 sutura assorbibile, fili sterili da 25 cm di pE-8 e PE-10 cateteri in polietilene con un taglio finale a 45o, sterile 1 cc siringhe sterili, aghi calibro 32, attrezzature cautery, sterile 15-20 cm vuoto vuoto inossidabile asta di acciaio (2,5 mm all'interno del diametro, 3 mm di diametro esterno), anestetici locali (unguento di bupivaine e lidocaine) e un recinto per animali con spessore di appendiconti gireggiante (30 cm di legatura a molla con bottone, supporto girelle, montaggio girelle e braccio, 20 X 13 cm di contenitore).
- Preparare l'animale per l'intervento chirurgico.
- Assicurarsi che vengano utilizzate tecniche asettiche e sterili adeguate, come richiesto dall'istituto.
- Pesare l'animale. L'animale deve avere almeno 25 g per un intervento chirurgico di successo.
- Posizionare l'animale all'interno di una camera in plexiglass sigillata e collegare la camera all'apparato di anestesia dell'isoflurano. Impostare la portata a 2,5 L/min per i maschi e 3,0 L/min per le femmine dell'1,5% dell'isoflurane in O2. Dopo circa 2 min, assicurarsi che il topo sia opportunamente sedato dalla mancanza di un riflesso di ritiro con un pizzico di punta.
- Una volta sedato, rimuovere il mouse dalla camera e deporlo in posizione prona con il viso all'interno del cono naso di anestesia. Impostare il cono naso per ricevere gas dal vaporizzatore e per restituire il gas al gas scavenger. Lo spazzino catturerà l'isoflurane in un filtro a carbone.
- Utilizzare i clipper per radere la pelliccia tra le scapole. Assicurarsi di sterilizzare correttamente la regione rasata, alternando tre volte tra scrub betadine ed etanolo.
- Capovolgere il mouse in una posizione supina mantenendo il viso nel cono naso. Nastro lungo la gamba sinistra sulla fase chirurgica e utilizzare clipper per radere la pelliccia dalla coscia interna sinistra all'addome superiore sinistro. Assicurarsi di sterilizzare correttamente la regione rasata, alternando tre volte tra scrub betadine ed etanolo.
- Far scorrere un riscaldatore disponibile in commercio attivato, avvolto in garza, sotto il mouse. Nastro lungo la gamba destra sulla fase chirurgica.
- Inserire il catetere nella vena femorale sinistra.
- Con l'aiuto di un microscopio chirurgico, utilizzare forbici chirurgiche per fare un'incisione di 1 cm dalla porzione mediale superiore della coscia sinistra rotrally verso la linea mediana, rivelando l'arteria femorale e la vena.
- Ritrarre la pelle sciolta con ganci chirurgici della pelle per esporre ulteriormente le vesciche.
- Applicare il cloruro sterile dello 0,9% sull'area esposta per mantenere un'umidità adeguata.
- Utilizzare pinze per dissetare smussato, separando il tessuto connettivo intorno a una piccola sezione dell'arteria femorale e vena. Con attenzione, separare l'arteria e la vena (Figura 2).
- Utilizzare le pinze per infilare un filo di sutura assorbibile (Strand A) sotto la vena femorale e l'arteria nel punto più laterale dell'incisione. Tirare la sutura a metà strada in modo che le estremità siano pari.
- In un punto più prossimale all'inguine, utilizzare le pinze per infilare una seconda sutura (Strand B) sotto solo la vena femorale. Legare delicatamente un mezzo nodo che verrà utilizzato per limitare il flusso sanguigno.
- A un certo punto tra Strand A e Strand B, usate le pinze per infilare una terza sutura (Strand C) sotto solo la vena femorale. Legare delicatamente un nodo pieno che verrà utilizzato per limitare il flusso sanguigno. Fare attenzione a non strappare la vena.
- Tirare delicatamente su Strand B per limitare il flusso sanguigno. Utilizzare un emotoma per tirare delicatamente Strand B per mantenere il flusso sanguigno limitato.
- Tagliare un piccolo foro nell'area ristretta della vena femorale con microscissors e inserire con attenzione l'estremità angolata del tubo PE-8 (precedentemente lavato con eparina salina) verso Strand B. Una volta inserito, rilasciare la tensione dello Strand B e guidare il catetere più in alto nella vena. Stringere lo Strand B intorno alla vena contenente il catetere.
- Utilizzando Strand C, legare un nodo aggiuntivo intorno al catetere. Assicurarsi che questo nodo non catturi l'arteria femorale.
- Tirare delicatamente indietro sulla canna della siringa per riempire parzialmente il tubo con il sangue per garantire che il catetere sia stato impiantato correttamente.
- Seguendo la stessa procedura, inserire un catetere PE-10 nell'arteria femorale sinistra.
- Chirurgia chirurgica completa.
- Una volta che sia la vena femorale che i cateteri dell'arteria sono stati fissati, legare lo Strand A in un nodo intorno a entrambi i cateteri.
- Tagliare tutte le suture in eccesso e rimuovere i ganci della pelle. Sciacquare il catetere arterioso con una salina eparana eparinizzata per evitare la coagulazione. Cauterizzare le estremità di entrambi i cateteri per creare un sigillo.
- Posizionare il mouse in posizione prona e fare una piccola incisione alla base del collo e applicare salina all'area esposta.
- Inserire l'asta metallica cava subdermalmente dall'incisione del collo all'incisione femorale. Serpeggiare i cateteri attraverso l'asta cava e fuori dall'incisione del collo. Rimuovere l'asta cava. L'impianto di cateteri subdermicamente impedirà ai topi di danneggiare i cateteri.
- Applicare bupivacaina ai lati della ferita. Chiudere l'incisione femorale con sutura. Aggiungere unguento lidocaine su ferita chiusa e suturata.
- Serpeggiare i cateteri attraverso un tubo cavo flessibile di 30 cm (tether a molla) e suturare il pulsante del cavo a molla sotto la pelle. Applicare bupivacaina ai lati della ferita. Suturare il pulsante del letaggio a molla sotto la pelle. Aggiungere unguento lidocaine su ferita chiusa e suturata.
- Spostare il mouse in un contenitore cilindrico trasparente (20 cm di altezza, 13 cm di diametro) con un supporto girelare e braccio per ospitare l'animale durante il periodo di recupero. Posizionare un riscaldatore a mano sotto il contenitore per mantenere l'animale caldo.
- Avvitare la parte superiore del filo a molla in una girella e fissare il girello al braccio girelle attaccato al contenitore cilindrico. Assicurarsi che il mouse abbia una gamma completa di movimento e che sia possibile accedere ai cateteri.
- Posizionare un coperchio scanalato che non interferisca con il meccanismo girevole sopra il recinto dell'animale. Fare riferimento a Figura 3 per l'installazione completa.
- Consentire al mouse di recuperare. Si consigliano almeno 22 h.
2. Preparare la soluzione didisidratale L-[1-14C]per l'iniezione e la soluzione di disidratata SSA (16% – acido solforale) a 5 zolsalicizi (SSA) per la deproteinezzazione dei campioni di plasma. Nella soluzione SSA, includere anche 0,04 m di norleucina e1 "Ci/mL"[H 3]leucina come standard interni per l'analisi degli amminoacidi e l'analisi della concentrazione del tracciante nelle frazioni plasmatiche solubili dagli acidi, rispettivamente. Conservare la SSA fino a due mesi a 4 gradi centigradi.
- Acquista la leucina l-[1-14C]leucina disponibile in commercio (50-60 mCi/mmol), che viene venduta come soluzione in 2% di etanolo o 0,1 N HCl. Soffiare asciugare un'attività nota del tracciante sotto un flusso delicato di azoto e ricostituire in una soluzione di salina normale sterile fatta fino a una concentrazione di 100 c./mL.
3. Somministrare l-[1-14C]leucina per via endovenosa e raccogliere campioni di sangue arterioso.
- Raccogliere i materiali necessari: 18 microtubi da 1,5 mL per la deproteinezzazione dei campioni di plasma (aggiungere 70 mL di acqua diionizzata ad ogni tubo), 17 inserti di fiala di vetro da 250 ml (15 inserti per la raccolta di campioni di sangue arterioso e 2 inserti per la raccolta di sangue spazio morto da reiniettato. Per limitare la raccolta di sangue extra e non necessario, piccoli inserti di fiala di vetro sottile con fondi affusolati che consentono una pipettatura accessibile di plasma supernatante, 2 tubi microcapillari (32 X 0,8 mm, per la misurazione dell'ematocrito), 1 eparina e tubo di microcentrifuga rivestito di litio al fluoro (per prevenire rispettivamente la coagulazione e la glicolisi), gli hemostati (coprire le punte con tubi di stilitazione in modo che i morsetti non danneggino i tubi di PE), il monitoraggio del glucosio nel sangue, il trasduttore della pressione sanguigna, le siringhe sterili da 1 mL (per e soluzione di eutanasia disponibile in commercio (diluita 1:1 in acqua deionizzata (per topi)).
- Assicurarsi che l'animale si trova in uno stato fisiologico normale all'inizio dell'esperimento.
- Bloccare il tubo arterioso a circa 2 cm dall'estremità e tagliare la punta, creando un'apertura per il flusso di sangue. Poi sblocco tubi e raccogliere il sangue spazio morto ((c. 30 mL) per raccogliere qualsiasi salina residua e / o sangue da estrazioni precedenti), e, in un tubo separato, raccogliere un campione di controllo (circa 30 l), campioni di ematocrito (circa la metà del volume del tubo capillare), e un glucosio campione (circa 20 l).
- Misurare l'ematocrito tramite un'estremità con stucco di sigillante e centrifuga per 1 min a 4500 x g. Misurare il rapporto tra il volume dei globuli rossi e il volume totale del sangue. Se un animale ha un ematocrito inferiore al 30%, non continuare lo studio.
- Utilizzare un monitor della glicemia disponibile in commercio per misurare il livello di glucosio in una goccia di sangue.
- Campione di controllo della centrifuga per 2 min a 18.000 x g per separare il plasma. Deproteinezzai i campioni di plasma nel modo seguente: aggiungi 5 l una l di plasma a 70 gradi di acqua deionizzata in un microtubo da 1,5 mL, aggiungi 25 l della soluzione SSA e del vortice del 16%. Mettere sul ghiaccio per 30 min prima di congelare sul ghiaccio secco.
- Restituire il sangue morto spazio all'animale attraverso la linea venosa, seguita da un colore salina eparinizzato per evitare la perdita di sangue in eccesso.
- Collegare la linea arteriosa a un trasduttore di pressione sanguigna per misurare la pressione sanguigna arteriosa media.
- Dopo aver preso i campioni assicurarsi di ri-bloccare la linea arteriale e di lavare la linea con un piccolo volume (50 mL) di salina eparinizzata.
- Somministrare per via endovenosa e raccogliere campioni di sangue arterioso a tempo.
- Utilizzare un connettore Y per collegare una siringa con il tracciante (100-Ci/kg) e una siringa con 50 mL di salina sterile per lavare la linea venosa dopo l'iniezione del tracciante. Collegare il connettore Y alla linea venosa.
- Avviare lo studio avviando contemporaneamente un orologio di arresto e iniettando il tracciante. Sciacquare la linea venosa con la salina (c. 100mL) immediatamente dopo l'iniezione.
- Raccogliere campioni di sangue 1-7 in modo continuo durante i primi 2 min dell'esperimento nello stesso modo. Dopo aver raccolto il settimo campione, raccogliere 30 , sangue di spazio morto prima di ogni campione rimanente. I campioni 8-14 vengono raccolti rispettivamente a 3, 5, 10, 15, 30, 45 e 60 min.
- Elaborare i campioni di sangue immediatamente dopo la raccolta, come descritto per il campione di controllo. Se c'è un ritardo, posizionare i campioni sul ghiaccio. Reiniettare con attenzione il sangue spaziale morto nell'arteria attraverso il catetere arterioso e sciacquare con l'eparina.
- Ad un certo punto durante l'esperimento, elaborare tre standard interni aggiungendo 25 SSA 16% , neleuci di 0,04 m e 1 mCi/mL [3H]leucina a 75 acqua, vortice e posto sul ghiaccio.
- Dopo aver raccolto il quattordicesimo campione a 60 min, iniettare circa 0,2 mL di B-eutanasia-D nella linea venosa per eutanasia l'animale. Registrare l'ora del decesso.
- Svitare l'animale dal supporto girelare e rimuovere dal recinto dell'animale. Rimuovere con attenzione il cervello, posizionare su un foglio di alluminio e congelare sul ghiaccio secco. Non congelare il cervello con azoto liquido come cervelli possono rompersi. Conservare il cervello, i campioni e gli standard interni a -80 gradi centigradi fino a quando non sono pronti per l'elaborazione. L'elaborazione può essere eseguita in qualsiasi momento in seguito.
4. Analizzare le concentrazioni di leucina e l-[1-14C]leucina in campioni di plasma.
- Scongelare i campioni e gli standard interni su ghiaccio, vortice e centrifugare 18.000 x g per 5 min a 2 gradi centigradi. La frazione sovrinnatante conterrà la leucina libera etichettata e senza etichetta.
- Trasferire 40 l del supernatante in una fiala scintillata liquida e aggiungere cocktail scintillazione. Quantificare le disintegrazioni al min (DPM) di 3H e 14C mediante il conteggio della liquidazione e una curva di spegnimento progettata per il conteggio simultaneo di doppia etichetta (3H e 14C).
- Per quantificare le concentrazioni di leucina plasmatica, utilizzare un sistema HPLC con una colonna di scambio di sodio e derivazione post-colonna con o-phthaldedeide e rilevamento fluorometrico.
- Impostare HPLC sulle seguenti specifiche: eccitazione fluorometrica di 330 nm ed emissione di 465 nm. La fase mobile è composta da eluant di sodio, pH 7,40, e sodio eluente - 5% sulfolano, pH 3,15. Impostare la velocità di flusso del buffer di 0,400 mL/min e la velocità di flusso dello strumento di derivazione su 0,300 mL/min. Impostare la temperatura della colonna su 48 gradi centigradi e la temperatura del reattore a 45 gradi centigradi.
- Calibrare il sistema con una gamma di concentrazioni di aminoacidi (compresa la norleucina) tra 30 e 500 pmol/10mL. La curva di calibrazione è lineare. Le concentrazioni di amminoacidi dei campioni di iniezione testati da 10 mL rientrano negli intervalli di questa curva di calibrazione.
5. Eseguire l'autoradiografia quantitativa.
- Preparare le sezioni cerebrali di 20 m di spessore per l'autoradiografia. Cervello di sezione per mezzo di un criostato a -20 gradi centigradi.
- Scongelare le sezioni cerebrali seriali su vetrini rivestiti di gelatina. Aria asciutta.
- Lavare i vetrini in cinque cambi di formalina del 10% per 30 minuti per cambio, seguiti da un flusso continuo di acqua deionizzata per 1 h. Coprire i vetrini liberamente con un foglio per evitare la polvere e lasciare asciugare per 24 h.
- Disporre le diapositive in una cassetta a raggi X (si raccomandano le cassette che si adattano a pellicole mammoografiche da 20X25 cm) insieme a una serie di standard[14C] methylmethacrylate, precedentemente calibrati contro tessuto di concentrazioni note di 14C come descritto29. Gli standard possono essere acquistati commercialmente, ma assicurano che coprano una gamma di 2-300 mCi/g di tessuto e siano calibrati rispetto allo spessore di 20 m. Sotto la luce rossa, posizionare un pezzo di pellicola mammografica, emulsione lato verso il basso, sulla parte superiore delle sezioni.
- Sigillare le cassette e metterle in una borsa nera e conservarle in un armadio per 40-45 giorni.
- Sviluppare pellicole secondo le indicazioni del produttore. Nota: lo sviluppo automatico della pellicola non è consigliato perché lo sfondo potrebbe non essere uniforme e può influire sulla quantificazione.
6. Analizzare le immagini.
Nota: si consiglia un programma disponibile in commercio per l'analisi delle immagini abbinato a una telecamera CCD e a una scatola luminosa fluorescente con illuminazione uniforme. Le densità ottiche relative nella pellicola illuminata vengono rilevate dalla telecamera CCD.
- Costruire una curva di calibrazione di densità ottica (OD) v. tessuto 14C concentrazione basata sugli OD del set di standard calibrati sulla pellicola. Adattare questi dati (incluso lo sfondo o lo sfondo) a un'equazione polinomiale. Un'equazione polinomiale di secondo o terzo grado si adatta molto bene.
- Per analizzare specifiche regioni cerebrali, individuare la regione di interesse (ROI) in sei-otto sezioni rispetto a un atlante cerebrale. Registrare gli OD dei pixel all'interno di un ROI in tutte le sezioni e, in base alla curva di calibrazione, calcolare la concentrazione del tessuto 14C in ogni pixel. Calcolare la concentrazione media di 14C nel ROI.
7. Calcolo di rCPS. Calcolare rCPS in ogni ROI per mezzo della seguente equazione:

Dove la P (T) è la concentrazione media di tessuto ponderata di 14C nel ROI, Cp(t) e C-p(t) sono le concentrazioni di plasma arterioso di leucina non etichettata ed etichettata al momento, t, T è il momento in cui l'animale è morto ( circa 60 min), e il valore è la frazione di leucina nella pozza precursore dei tessuti che proviene dal plasma. La valutazione della z viene effettuata in un esperimento separato 6. È stato valutato in WT, Fmr1 knockout, Tsc- ePKU topi 6,22,25,28. Se un esperimento comporta modifiche genetiche o farmacologiche che potrebbero influenzare i tassi di sintesi proteica, degradazione o metabolismo della leucina, il valore di z dovrebbe essere valutato nelle nuove condizioni.
Risultati
Qui mostriamo un esperimento rappresentativo che dimostra gli effetti della somministrazione preventiva di un inibitore della sintesi proteica su rCPS. L'anisomicina nella normale salina è stata somministrata a un topo selvatico di tipo c57/BL6 adulto sottocutaneo (100 mg/kg) 30 minuti prima dell'avvio della determinazione di rCPS. Gli effetti del trattamento con anisomicina rispetto a un animale di controllo trattato con veicolo mostrano che la rCPS è quasi inosservabile nel topo trattato con anisomicina (Figura 4). Questi dati rappresentano una convalida che il metodo autoradiografico in vivo L-[1-14C]-leucina misura i tassi di sintesi proteica nel cervello.
Vi presentiamo una figura di Autoradiogrammi L-[1-14C]-leucia a quattro livelli del cervello per dimostrare la risoluzione del metodo (Figura 5). Sono illustrati gli strati cellulari nel bulbo olfattivo (Figura 5A e B), l'ippocampo (Figura 5C) e il cervelletto (Figura 5G). Nuclei nell'ipotalamo (Figura 5D), i pons (Figura 5E e F), e il tronco encefalico (Figura 5H) sono chiaramente visti anche negli autoradiogrammi. Mostriamo anche i tassi quantitativi regionali di sintesi proteica nella corteccia frontale (5,88 nmol/g/min) (Figura 6A) e ippocampo dorsale (5,35 nmol/g/min) (Figura 6B) di un tipico animale di controllo.

Figura 1: Schema che rappresenta i passaggi dell'intero protocollo rCPS. Fare clic qui per visualizzare una versione più grande di questa figura.
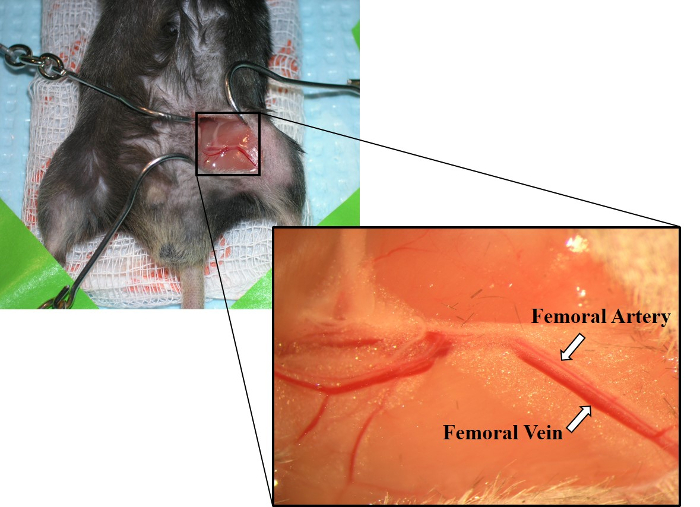
Figura 2: Immagine dell'arteria femorale e della vena femorale. Posa parallela l'una all'altra, l'arteria femorale è mostrata sopra la vena femorale. La vena femorale ha anche un colore rosso più profondo dell'arteria femorale. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Immagine dell'impostazione raccomandata dell'involucro animale per l'esperimento rCPS. Utilizza una custodia per animali cilindrica chiara con appendice gireggiata collegata a un tether a molla. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Immagini rappresentative di un animale trattato con veicolo (A) rispetto a un animale trattato con anisomicina (100 mg/kg, sottocutaneamente) 30 minuti prima della somministrazione del tracciante (B). I tassi di sintesi proteica sono proporzionali al livello di oscurità nell'immagine. L'anisomicina riduce drasticamente i tassi misurati di sintesi proteica che indica la specificità di questo metodo. La barra della scala in alto a destra di A rappresenta 1 mm e si applica a entrambe le immagini. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: autoradiogrammi digitalizzati da un topo sveglio che si comporta a livello del bulbo olfattivo (A, B), ipotalamo (C, D), pons (E, F), cervelletto (G) e tronco encefalico (G, H). Le regioni più scure hanno rCPS più alto. La barra della scala nel pannello G si applica ai pannelli A, C, E e G. Gli autoradiogrammi a destra (B, D, F e H) sono immagini ingrandite dalle aree designate sulle immagini a sinistra e la barra di scala nel pannello H si applica ai pannelli B , D, F e H. Le abbreviazioni sono le seguenti: FrA, corteccia di associazione frontale; OB, lampadina olfattiva; AO, nucleo olfattivo anteriore; Gl, strato glomerare; EPl, strato plexiforme esterno; BLA, amigdala basolaterale; py, strato di cellule piramidali; dHi, ippocampo; DG, giro dentato; MHb, habenula mediale; Rt, nucleo reticolare talamico; VMH, nucleo ipotalamico mediale ventrale; Arco, nucleo arcuato; EW, nucleo Edinger-Westphal; R, nucleo rosso; PN, nucleo pontino; ML, strato molecolare; GL, strato granulare; Pc, strato di cellule Purkinje; Cu, nucleo cuneate; AP, postrema di zona; 10, nucleo motorio dorsale del vago; 12, nucleo ipoglossale. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: Autoradiogrammi digitalizzati da un topo di controllo del comportamento sveglio a livello della corteccia frontale (A) e dell'ippocampo dorsale (B). I tassi di sintesi delle proteine cerebrali sono codificati in base al colore nelle immagini in base alla barra dei colori mostrata a destra. La barra della scala in basso a sinistra di A rappresenta 1 mm e si applica a entrambe le immagini. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Presentiamo un metodo quantitativo per la determinazione dei tassi regionali di sintesi delle proteine cerebrali (rCPS) in vivo negli animali sperimentali. Questo metodo ha notevoli vantaggi rispetto ai metodi esistenti: 1. Le misurazioni vengono effettuate nell'animale che si comporta in tutto il risveglio, quindi riflettono i processi in corso nel cervello funzionante. 2. Le misurazioni sono effettuate mediante autoradiografia quantitativa che offre la capacità di determinare la rCPS in tutte le regioni e sottoregioni del cervello contemporaneamente. 3. Il modello cinetico del metodo tiene conto della possibilità di riciclaggio di aminoacidi non etichettati derivati dalla degradazione delle proteine tissutali e del suo effetto sul pool precursore per la sintesi proteica6.
La limitazione principale di questo metodo è che è dispendioso in termini di tempo ed esigente. Mentre si è tentati di utilizzare metodi di velocità effettiva più semplici e superiori, le limitazioni dei dati ottenuti devono essere riconosciute.
A causa della complessità della misurazione di rCPS in un topo intatto, possono verificarsi problemi con il mantenimento di uno stato fisiologico normale, la raccolta di campioni di sangue adeguati ed evitare condizioni eventualmente interferenti. L'impianto chirurgico dei cateteri venosi e arteriosi è impegnativo. Come con qualsiasi procedura chirurgica, soprattutto con la manipolazione di vascolarizzazione delicata, c'è un rischio intrinseco per la mortalità dell'animale. Per noi, è raro (circa l'1%). Durante il successivo periodo di recupero di 22 h, occasionalmente (circa il 4%) un animale tirerà fuori un catetere. Durante la misurazione, è importante che i cateteri siano brevettati e che gli animali siano in uno stato fisiologico normale. Nella nostra recente esperienza, il sangue arterioso non può essere raccolto in circa il 2% degli animali e circa l'1% degli animali aveva un basso ematocrito (< 40%) o bassa pressione arteriosa (< 85 mm Hg), suggerendo perdita di sangue durante l'intervento chirurgico e/o il recupero.
Nella preparazione di sezioni cerebrali per l'autoradiodiografia, è importante assicurarsi che lo spessore della sezione sia di 20 m perché è lo spessore della sezione a cui sono stati calibrati gli standard di metilmethacritato [14C] methylmethacrlate. Prestare attenzione per garantire sezioni di buona qualità, cioè senza strappi, pieghe o bolle in quanto queste imperfezioni interferiranno con l'analisi autoradiografica. Sviluppiamo pellicole autoradiografiche a mano piuttosto che in un processore di pellicola automatizzato perché scopriamo che la densità ottica di fondo può essere irregolare dopo l'elaborazione automatizzata, e questo può influenzare la quantificazione.
Nell'equazione per rCPS, includiamo un fattore, lambda (z), che è la frazione di leucina che proviene dal plasma arterioso, il resto proviene dal riciclo di aminoacidi derivati dalla degradazione della proteina tissutale6. Abbiamo valutato i due esperimenti su WT e Fmr1 KO (fragile X model) C57Bl/6J e abbiamo dimostrato che il suo valore è 0,603. Il valore della z può variare a seconda della specie, del background genetico o della presenza di una mutazione genetica. Pertanto, se si progettano esperimenti di sintesi proteica per altri modelli, è necessario valutare il valore di una misurazione accurata.
Il nostro lavoro in modelli murini genetici di disturbi neurosviluppo dimostra che questa metodologia rivela cambiamenti nella rCPS in questi modelli e in alcuni casi risposte ai trattamenti farmacologici22,23,25 , 26. È anche concepibile che la misurazione della rCPS possa anche monitorare i cambiamenti degenerativi nel cervello in condizioni come modelli di malattia di Alzheimer, morbo di Parkinson, sindrome fragile del tremore atassia X, lesioni cerebrali traumatiche, ecc. In questi modelli, potrebbe essere possibile tenere traccia dei primi cambiamenti degenerativi e possibilmente anche le risposte agli interventi precoci. Il metodo rCPS può essere utilizzato insieme all'immunohistochimica in sezioni parallele per esaminare ulteriormente specifici cambiamenti cerebrali25. In sintesi, il metodo quantitativo autoradiografico L-[1-14C]-leucina è ideale per una determinazione accurata dei valori rCPS in vivo. Offre notevoli vantaggi in termini di precisione e applicabilità alle condizioni in vivo rispetto ai metodi esistenti.
Divulgazioni
Gli autori non hanno conflitti di interesse da divulgare.
Riconoscimenti
Gli autori vorrebbero riconoscere xia zengyan per la genotipizzazione dei topi, Tom Burlin per la lavorazione di aminoacidi e film, e Mei Qin per l'esecuzione di alcuni degli esperimenti rCPS. Questa ricerca è stata sostenuta dal Programma di Ricerca Intramurale del NIMH, EI MH00889. RMS è stata anche sostenuta da una borsa di studio per il post-dottorato 8679 per l'autismo e da una borsa di studio FRAXA Postdoctoral Fellowship.
Materiali
| Name | Company | Catalog Number | Comments |
| Mice | The Jackson Laboratory | 003024 | Fmr1 knockout breeding pairs |
| Anisomycin | Tocris Bioscience | 1290 | |
| Microhematocrit Tubes | Drummond Scientific | 1-000-3200-H | capillary tubes |
| Critoseal Capillary Tube Sealant | Leica Microsystems | 39215003 | sealant putty |
| Glass vial inserts | Agilent | 5183-2089 | used to collect blood samples |
| Digi-Med Blood Pressure Analyzer | Micro-Med Inc. | BPA-400 | blood pressure analyzer |
| Bayer Breeze 2 Blood Glucose Monitoring System | Bayer Breeze | 9570A | glucose meter |
| Gastight syringe | Hamilton Co. | 1710 | tuberculin glass syringe |
| HeatMax HotHands-2 Hand Warmers | HeatMax | Model HH2 | warming pads |
| Heparin Lock Flush Solution | Fresenius Kabi USA, LLC | 504505 | heparin saline |
| Clear animal container | Instech | MTANK/W | animal enclosure |
| Spring tether | Instech | PS62 | catheter tube/rodent attachment |
| Swivel | Instech | 375/25 | hooks to spring tether |
| Swivel arm and mount | Instech | SMCLA | hooks to swivel and animal enclosure |
| Tether button | Instech | VAB62BS/22 | attaches to bottom of spring tether |
| Stainless steel tube | Made in-house | N/A | used to snake catheters through mouse |
| Matrx VIP 3000 | Matrx | 91305430 | isoflurane vaporizer |
| Isoflurane | Stoelting Co. | 50207 | isoflurane/halothane adsorber |
| Clippers | Oster Finisher | Model 59 | |
| Surgical skin hooks | Made in-house (??) | N/A (??) | |
| 0.9% Sodium Chloride Saline | APP Pharmaceuticals LLC | 918610 | |
| Forceps | Fine Science Tools | 11274-20 | |
| Surgical scissors | Fine Science Tools | 14058-11 | |
| Microscissors | Fine Science Tools | 15000-00 | |
| UNIFY silk surgical sutures | AD Surgical | #S-S618R13 | 6-0 USP, non-absorbable |
| PE-8 polyethylene tubing | SAI Infusion Technologies | PE-8-25 | |
| Syringe | Becton Dickinson and Co. | 309659 | 1cc/mL |
| PE-10 polyethylene tubing | Clay Adams | 427400 | |
| MCID Analysis | Imaging Research Inc. | Version 7.0 | optical density analysis |
| Gelatin-coated slides (75x25mm) | FD Neurotechnologies | PO101 | |
| Cryostat | Leica | CM1850 | |
| Super RX-N medical x-ray film | Fuji | 47410-19291 | |
| Hypercassettes (8x10 in) | Amersham Pharmacia Biotech | 11649 | |
| [1-14C]leucine | Moravek | MC404E | |
| Microcentrifuge tube | Sarstedt Aktiengesellschaft & Co. | 72.692.005 | used to deproteinize blood samples |
| Glass pasteur pipette | Wheaton | 357335 | |
| Glass wool | Sigma-Aldrich | 18421 | |
| Nitrogen | NIH Supply Center | 6830009737285 | |
| Scintillation fluid | CytoScint | 882453 | |
| Liquid scintilllation counter | Packard Tri-Carb | 2250CA | |
| Amino acid analyzer | Pickering Laboratories | Pinnacle PCX | |
| HPLC unit | Agilent Technologies | 1260 Infinity | include 1260 Bio-Inert Pump |
| Surgical microscope | Wild Heerbrugg | M650 | |
| Sulfosalicylic acid | Sigma-Aldrich | MKBS1634V | 5-sulfosalicylic acid dihydrate |
| Norleucine | Sigma | N8513 | |
| 1.0 N HCl | Sigma-Aldrich | H9892 | |
| [H3]leucine | Moraevk | MC672 | |
| Falcon tube | Thermo Scientific | 339652 | 50 mL conical centrifuge tubes |
| Stopwatch | Heuer Microsplit | Model 1000 | 1/100 min |
| Euthanasia Solution | Vet One | H6438 | |
| Northern Light Precision Illuminator | Imaging Research Inc. | Model B95 | fluorescent light box |
| Micro-NIKKOR 55mm f/2.8 | Nikon | 1442 | CDD camera |
Riferimenti
- West, A. E., et al. Calcium regulation of neuronal gene expression. Proceedings of the National Academy of Sciences of the United States of America. 98, 11024-11031 (2001).
- Siegel, G., Agranoff, B., Albers, R. W., Fisher, S., Uhler, M. Basic Neurochemistry. , 6th ed, Lippincott-Raven. New York. (1999).
- Nguyen, P. V., Abel, T., Kandel, E. R. Requirement of a critical period of transcription for induction of a late phase of LTP. Science. 265, 1104-1107 (1994).
- Mao, Z., Bonni, A., Xia, F., Nadal-Vicens, M., Greenberg, M. E. Neuronal activity-dependent cell survival mediated by transcription factor MEF2. Science. 286, 785-790 (1999).
- Pfeiffer, B. E., Huber, K. M. Current advances in local protein synthesis and synaptic plasticity. The Journal of Neuroscience: the Official Journal of the Society for Neuroscience. 26, 7147-7150 (2006).
- Smith, C. B., Deibler, G. E., Eng, N., Schmidt, K., Sokoloff, L. Measurement of local cerebral protein synthesis in vivo: influence of recycling of amino acids derived from protein degradation. Proceedings of the National Academy of Sciences of the United States of America. 85, 9341-9345 (1988).
- Schmidt, K. C., Smith, C. B. Resolution, sensitivity and precision with autoradiography and small animal positron emission tomography: implications for functional brain imaging in animal research. Nuclear Medicine and Biology. 32, 719-725 (2005).
- Banker, G., Cotman, C. W. Characteristics of different amino acids as protein precursors in mouse brain: advantages of certain carboxyl-labeled amino acids. Archives of Biochemistry and Biophysics. 142, 565-573 (1971).
- Frerichs, K. U., et al. Suppression of protein synthesis in brain during hibernation involves inhibition of protein initiation and elongation. Proceedings of the National Academy of Sciences of the United States of America. 95, 14511-14516 (1998).
- Abrams, R. M., Burchfield, D. J., Sun, Y., Smith, C. B. Rates of local cerebral protein synthesis in fetal and neonatal sheep. The American Journal of Physiology. 272, R1235-R1244 (1997).
- Nakanishi, H., et al. Positive correlations between cerebral protein synthesis rates and deep sleep in Macaca mulatta. The European Journal of Neuroscience. 9, 271-279 (1997).
- Sun, Y., Deibler, G. E., Sokoloff, L., Smith, C. B. Determination of regional rates of cerebral protein synthesis adjusted for regional differences in recycling of leucine derived from protein degradation into the precursor pool in conscious adult rats. Journal of Neurochemistry. 59, 863-873 (1992).
- Scammell, T. E., Schwartz, W. J., Smith, C. B. No evidence for a circadian rhythm of protein synthesis in the rat suprachiasmatic nuclei. Brain Research. 494, 155-158 (1989).
- Smith, C. B., Eintrei, C., Kang, J., Sun, Y. Effects of thiopental anesthesia on local rates of cerebral protein synthesis in rats. The American Journal of Physiology. 274, E852-E859 (1998).
- Sun, Y., Deibler, G. E., Smith, C. B. Effects of axotomy on protein synthesis in the rat hypoglossal nucleus: examination of the influence of local recycling of leucine derived from protein degradation into the precursor pool. Journal of Cerebral Blood Flow and Metabolism: Official Journal of the International Society of Cerebral Blood Flow and Metabolism. 13, 1006-1012 (1993).
- Smith, C. B., Yu, W. H. Rates of protein synthesis in the regenerating hypoglossal nucleus: effects of testosterone treatment. Neurochemical Research. 19, 623-629 (1994).
- Orzi, F., Sun, Y., Pettigrew, K., Sokoloff, L., Smith, C. B. Effects of acute and delayed effects of prior chronic cocaine administration on regional rates of cerebral protein synthesis in rats. The Journal of Pharmacology and Experimental Therapeutics. 272, 892-900 (1995).
- Nadel, J., et al. Voluntary exercise regionally augments rates of cerebral protein synthesis. Brain Research. 1537, 125-131 (2013).
- Sun, Y., et al. Rates of local cerebral protein synthesis in the rat during normal postnatal development. The American Journal of Physiology. 268, R549-R561 (1995).
- Smith, C. B., Sun, Y., Sokoloff, L. Effects of aging on regional rates of cerebral protein synthesis in the Sprague-Dawley rat: examination of the influence of recycling of amino acids derived from protein degradation into the precursor pool. Neurochemistry International. 27, 407-416 (1995).
- Ingvar, M. C., Maeder, P., Sokoloff, L., Smith, C. B. The effects of aging on local rates of cerebral protein synthesis in rats. Monographs in Neural Sciences. 11, 47-50 (1984).
- Sare, R. M., Huang, T., Burlin, T., Loutaev, I., Smith, C. B. Decreased rates of cerebral protein synthesis measured in vivo in a mouse model of Tuberous Sclerosis Complex: unexpected consequences of reduced tuberin. Journal of Neurochemistry. 145, 417-425 (2018).
- Liu, Z. H., Huang, T., Smith, C. B. Lithium reverses increased rates of cerebral protein synthesis in a mouse model of fragile X syndrome. Neurobiology of Disease. 45, 1145-1152 (2012).
- Qin, M., et al. Altered cerebral protein synthesis in fragile X syndrome: studies in human subjects and knockout mice. Journal of Cerebral Blood Flow and Metabolism: Official Journal of the International Society of Cerebral Blood Flow and Metabolism. 33, 499-507 (2013).
- Qin, M., Kang, J., Burlin, T. V., Jiang, C., Smith, C. B. Postadolescent changes in regional cerebral protein synthesis: an in vivo study in the FMR1 null mouse. The Journal of Neuroscience: the Official Journal of the Society for Neuroscience. 25, 5087-5095 (2005).
- Qin, M., et al. R-Baclofen Reverses a Social Behavior Deficit and Elevated Protein Synthesis in a Mouse Model of Fragile X Syndrome. The International Journal of Neuropsychopharmacology. 18, pyv034(2015).
- Qin, M., et al. Cerebral protein synthesis in a knockin mouse model of the fragile X premutation. ASN Neuro. 6, (2014).
- Smith, C. B., Kang, J. Cerebral protein synthesis in a genetic mouse model of phenylketonuria. Proceedings of the National Academy of Sciences of the United States of America. 97, 11014-11019 (2000).
- Reivich, M., Jehle, J., Sokoloff, L., Kety, S. S. Measurement of regional cerebral blood flow with antipyrine-14C in awake cats. Journal of Applied Physiology. 27, 296-300 (1969).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon