Method Article
Um método de nanopartículas prata para atenuar a síndrome de Atresia biliar em ratos
Neste Artigo
Resumo
Este artigo descreve detalhadamente um método baseado em nanopartículas de prata para atenuar a síndrome de atresia biliar em um modelo do rato de atresia biliar experimental. Uma sólida compreensão do processo de preparação de reagente e a técnica de injeção de rato neonatal ajudará a familiarizar os pesquisadores com o método utilizado em estudos de modelo de rato neonatal.
Resumo
Atresia biliar (BA) é um tipo grave de colangite, com alta mortalidade em crianças do que a etiologia é ainda não totalmente compreendida. Infecções virais podem ser uma causa possível. O típico modelo animal para estudar BA é estabelecido por inocular um rato neonatal com um rotavírus rhesus. Nanopartículas de prata foram mostradas para exercer efeitos antibacterianos e antivirais; sua função no modelo do rato de BA é avaliada neste estudo. Atualmente, em experiências com animais BA, os métodos utilizados para melhorar os sintomas dos ratos BA são tratamentos geralmente sintomáticos dada através de alimentos ou outras drogas. O objetivo deste estudo é demonstrar um novo método para atenuar a síndrome de BA em ratos pela injeção intraperitoneal de nanopartículas de prata e para fornecer métodos detalhados para preparar a formulação de gel de nanopartículas de prata. Este método é simples e amplamente aplicável e pode ser usado para pesquisar o mecanismo de BA, bem como em tratamentos clínicos. Baseia-se no modelo do rato de BA, quando os ratos exibem icterícia, o gel de nanopartículas de prata preparado é injetado intraperitonealmente à superfície do fígado inferior. Observa-se o status de sobrevivência, e indicadores bioquímicos e histopatologia hepática são examinados. Este método permite uma compreensão mais intuitiva de ambos o estabelecimento dos novos tratamentos de BA e modelo BA.
Introdução
BA é uma forma de colestase caracterizada por icterícia persistente e tem alta mortalidade na ausência de transplante hepático. Infecções virais estão intimamente associadas com a patogênese da BA. O citomegalovírus, reovírus e rotavírus têm sido sugeridos como patógenos na BA1,2,3. Durante o período neonatal, a resposta do sistema imunológico imaturo para uma infecção viral resulta em alteração no sistema imunológica contra ductos biliares intra e extra, levando à apoptose de células epiteliais biliar, infiltração de células inflamatórias no portal área, obstrução biliar intra-hepática e extra-hepática e finalmente, fibrose hepática,4,5,6.
O modelo animal comumente utilizado para estudos de BA envolve a inoculação de um rato neonatal com o rotavírus rhesus (RRV). O mouse normalmente desenvolve icterícia após 5-6 dias, apresentando um peso de corpo baixo e fezes acholic. O papel da resposta imune no processo de doença é crítico, especialmente para as células killer naturais (NK); o esgotamento dessas células com anticorpo anti-NKG2D reduz dano induzido por BA7. Além disso, outras células, incluindo CD4+ T células CD8+ T células, as células dendríticas e pilhas de T reguladoras, todos foram mostradas para desempenhar funções na doença8,9,10,11. Todos os dados sugerem a natureza indispensável do sistema imunológico, no decurso de BA.
Nanopartículas de prata (AgNPs) tem sido demonstradas para ter efeitos benéficos contra algumas doenças infecciosas, incluindo infecções bacterianas12 e infecções virais13,14,15. No entanto, além de uso dermatológico, poucos estudos têm usado AgNPs em um tratamento clínico, principalmente por causa da sua toxicidade potencial. Em experimentos com animais, os investigadores estudaram-se geralmente a eficácia de AgNPs administrado via oral16 ou intravenosa métodos17. No entanto, não há outros pesquisadores estudaram a eficácia de AgNPs administrado através de uma injeção intraperitoneal (i.p.) em rato neonatal de experiências, que é um método simples e rápido levando a um efeito mais direto sobre o fígado e ductos biliares, enquanto reduzir a toxicidade de outros sistemas, como o sistema imunológico. AgNPs foram mostrados para afetar a atividade de células NK18; Portanto, nós testamos os efeitos terapêuticos da AgNPs administrado através de injeção i.p. no modelo do rato de BA.
Protocolo
Todos os protocolos experimentais animais foram aprovados pelo Comitê de uso do Sun Yat-Sen University laboratório Animal Center (#IACUC-DB-16-0602) e institucionais Cuidado Animal.
1. estabelecer o modelo de Mouse de Atresia biliar
- Manter grávidos camundongos BALB/c em um ambiente livre de patógeno específico sob um ciclo claro/escuro de 12 h a 25 ° C, com acesso a comida esterilizada ad libitum.
- Para preparar a estirpe RRV MMU 18006, amplificar o vírus nas células MA104 e medir a concentração viral por uma placa de ensaio19.
Nota: Células MA104 são cultivadas em meio da águia modificados de Dulbecco (DMEM), com 10% soro bovino fetal (FBS) em uma incubadora, com um ambiente umidificado contendo 5% de CO2. As etapas de amplificação são brevemente descritas abaixo.- Infectar células MA104 (1,5 x 107) num frasco de cultura2 150cm com tripsina activada RRV [1,5 x 106 deformação unidades (PFU)] em 30 mL de meio livre de soro. Incube as células infectadas por 3 dias numa incubadora umidificado a 37 ° C com 5% de CO2.
- Lisar as células infectadas no frasco de cultura por três ciclos de congelamento e descongelamento, com 20 min em um freezer-80 ° C para cada congelar fase e, em seguida, descongelar as células de volta à temperatura ambiente; a partícula do vírus associado a célula irá lançar para o sobrenadante. Em seguida, coletar e transferir o lisado celular e cultura sobrenadante para um tubo cônico de 15 mL.
- Remova restos celulares grandes o lisado por centrifugação de baixa velocidade (300 x g a 4 ° C por 3 min). Em seguida, transferi o sobrenadante contendo o vírus (cerca de 6 mL) para um novo tubo cônico de 15 mL para experiências em animais.
Nota: O RRV está pronto para ser titulada, aliquotadas e armazenados ou usados para rodadas adicionais de amplificação. A exposição prolongada a temperatura irá reduzir a capacidade de infecção viral; o vírus deve ser colocado no gelo e armazenado a-80 ° C ou em nitrogênio líquido.
- Carga a RRV em uma insulina de pequeno volume (1ml) seringa com uma agulha de 29 G para a injeção de rato neonatal.
Nota: As grossas agulhas de seringas volumétricas facilmente levam à fuga de drogas. - Dentro de 24 horas de nascimento, administrar a cada µ de neonato 20 l de 1,2 x 105 RRV PFU/mL através da rota de i.p.; Use o mesmo volume de solução salina como o controle.
Nota: A seringa usada neste experimento é uma seringa de insulina 1 mL. Ratos infectados que não foram alimentados por suas mães morridas dentro dos primeiros 2 dias devido a outras razões não foram incluídos na análise. - Observar de perto todos os mouses Neonatais e pesá-los diariamente. Normalmente, no sexto dia após a inoculação do RRV, icterícia aparece nas orelhas e pele nua, as fezes torna-se cor de barro, e a pele se torna oleosa, sugerindo a criação do modelo BA; Verifique estes sintomas.
Nota: BA pode ser confirmada por um exame de seção de tecido hepático com H & E e imuno-histoquímica afirmando. Os ratos BA então estão prontos para o tratamento da AgNP.
Atenção: O protocolo apresentado é para uso com contemporânea animais e humanas RV cepas, que deve ser tratado em condições de biossegurança nível 2 (BSL-2).
2. síntese de nanopartículas de prata
- Preparar e caracterizar o AgNPs como descrito anteriormente,12,20.
Nota: Os detalhes de preparação e caracterizando o AgNPs têm sido descritos em publicações pela equipe do C. M. Che no departamento de química, Universidade de Hong Kong,12,20. A concentração final da solução foi de 1 mM. O diâmetro médio do AgNPs era 10 nm (variando de 5 a 15 nm) e confirmado por microscopia electrónica.
3. preparação da mistura prata Nanoparticle colágeno
Nota: A mistura de colágeno AgNP é preparada e caracteriza-se como descrito anteriormente a21 e armazenado a 4 ° C. Todos os procedimentos devem ser efectuados no gelo.
- Primeiro, para a preparação de colágeno, adicionar 490 µ l do tipo I de colágeno (4 mg/mL) para um tubo de 1,5 mL e colocá-lo no gelo.
- Adicione 100 µ l de tampão fosfato salino (PBS, 10x) para o colágeno e misturá-lo com uma pipeta.
- Para preparar 1 L de tampão de PBS x 10, combinar 80g de NaCl, 2 g de KCl e 35,8 g de Na2HPO4. 12H2O a 2,4 g de KH2PO4 e loja reserva em temperatura ambiente.
- Em seguida, adicione 10 µ l de NaOH (0,2 M) para a solução acima.
- Para preparar a 0,2 M de NaOH, adicione 8 g de NaOH em pó para 1 litro de água destilada.
- Finalmente, adicionar 400 µ l de AgNPs (1 mM) para o colágeno e misturá-los com uma pipeta.
Nota: Adicione o AgNPs último para uma mistura mesmo. A mistura de colágeno AgNP deve ser armazenada a 4 ° C; caso contrário, ela facilmente se solidifica à temperatura ambiente.
4. Mouse método de injeção
- Administrar os ratos infectados neonatais no grupo RRV tratado com uma injeção i.p. de 50 µ l da mistura de colágeno AgNP após o aparecimento de icterícia; Realize uma segunda injeção 3 d mais tarde.
Nota: Os ratos no grupo controle RRV (controle infectado) recebem o mesmo volume de solução salina, e os ratos do grupo controle normal não recebem nenhum tratamento. - No início da injeção, pressione a perna do mouse com o dedo anelar obliquamente sobre a coxa direita e introduzir a agulha lentamente em um ângulo de 15° (Figura 1). Ao atingir a superfície da borda inferior do fígado (Figura 2), cerca de 0,5 cm em, injetar a mistura de colágeno AgNP; em seguida, retire a agulha lentamente.
Nota: Tenha cuidado para não introduzir nenhum ar dentro da seringa como, então, o rato neonatal pode ser morto. Em camundongos neonatais, estômago e baço estão na parte esquerda do abdome, e o estômago está cheio de leite. Se a injeção é administrada por este lado, a agulha poderia facilmente entrar ou o estômago, causando o leite a fluir para a cavidade abdominal, ou o baço, causando sangramento.
Atenção: Preste atenção a agulha para evitar qualquer lesão do dedo e certifique-se de substituir a tampa da agulha, retire a agulha e colocá-lo em um recipiente de objectos cortantes. - Depois de todas as injeções, manter os ratos das gaiolas durante 10 minutos permitir a mistura de colágeno AgNP ao gel e para impedir que a mãe lamber o local da injeção. Em seguida, retorne os ratos de suas gaiolas.
- Observar e registrar as aparências físicas de todos os mouses diariamente, incluindo icterícia e peso corporal, bem como a taxa de sobrevivência.
5. sangue coleta da amostra
Nota: São colhidas amostras de sangue de aproximadamente 120 µ l inserindo a agulha no coração. Após a centrifugação, o soro é coletado (aproximadamente 70 µ l) para testes de função hepática. O método de coleta de sangue é a seguinte.
- Anestesiar os ratos no 9º e 12º dia após a inoculação de RRV (que é 3 dias após o tratamento da AgNP) usando 0.5-2.5% sevoflurano.
- Imobilizar os membros do mouse e esterilizar o abdômen superior e inferior com 75% de álcool.
- Expor o diafragma cortando o mouse pele, músculo e peritônio ao longo da linha mediana para o xifoide com tesoura; Use um cotonete estéril para remover o trato gastrointestinal para expor totalmente o músculo diafragma.
- Insira a agulha (com uma seringa de 1 mL insulina descarregado) no ventrículo esquerdo do coração e puxe lentamente o êmbolo da seringa para obter o volume máximo de sangue. Em seguida, transfira o sangue para um tubo de 1,5 mL.
- Deixe os tubos repousar durante 30 min à temperatura ambiente e centrifugue por 5 min a x 400 g. Em seguida, usando uma pipeta de transferência, recolher e guardar o soro para utilização posterior.
Nota: Evite danificar o diafragma, como diafragma defeitos facilmente levam a pneumotórax, morte e coagulação do sangue, evitando assim a coleta de amostra de sangue.
6. bioquímica detecção de
- Use o soro coletado na etapa 5.5 para uma detecção de parâmetro bioquímicos.
- Use um analisador bioquímico automatizado para detectar os seguintes parâmetros bioquímicos: alanina aminotransferase (ALT), aspartato aminotransferase (AST), fosfatase alcalina (FAL ou ALP), proteína total (TP), albumina (ALB), globulina (GLO), bilirrubina total (TBIL), bilirrubina direta (DBIL), bilirrubina indireta (IBIL) e ácidos biliares totais (TBA).
7. extra-hepática colangiografia para observar a desobstrução biliar extra-hepática
Nota: Execute todo o processo sob um microscópio de dissecação.
- Expor totalmente o fígado, vesícula e vias biliares extra-hepáticas com um cotonete.
- Observar e fotografar a aparência do fígado e ductos biliares sob um microscópio de dissecação.
- Use o fórceps oftálmico para pressione cuidadosamente a parte inferior da vesícula biliar.
- Carrega uma seringa de 1 mL com solução de azul de metileno (0.05 wt.% em H2O). Lentamente, introduza a agulha da seringa para a cavidade da vesícula biliar; Então, segure a agulha com a pinça de Oftalmologia e infundir lentamente 10 – 20 µ l de azul de metileno.
- Observar ao microscópio se a cor azul passa através dos ductos biliares extra-hepáticas para o jejuno e tirar uma fotografia.
8. coleta de amostras de fígado frescas de hematoxilina e eosina coloração
- Corrigi o mouse fresco fígados tecidos durante a noite em formol a 10%.
- Em seguida, incorporar os tecidos hepáticas fixos em parafina e seção-los.
- Dewax as seções, hidratá-los com uma série de etanol (como 100%, 95%, 80% e 70% de etanol em água destilada, cada um por 5 min), mancha as seções de tecido com hematoxilina, sujeitá-los a uma diferenciação de álcool de ácido clorídrico 1% e finalmente, manchar a seções com eosina.
- Finalmente, observe a Histopatologia do fígado sob um microscópio X 40.
9. coloração imuno-histoquímica da hematoxilina e eosina-manchado cortes histologicos
- Depois de desparafinagem e reidratar as seções, executar uma recuperação de antígeno por submergir as seções em tampão Tris-EDTA (base de Tris 10 mM, 1 mM EDTA solução; pH 9.0) e aquecimento no microondas durante 10 minutos a 95 ° C.
- Remova a peroxidase endógena, expondo as secções de tecido para 10 min para uma solução de peróxido de hidrogênio 3%.
- Trate as seções com 5% de soro de cabra, para bloquear a ligação inespecífica.
- Adicionar os anticorpos primários coelho-rato NKG2D (1: 100) para as seções e incube-os durante a noite a 4 ° C.
- Incube as secções com os anticorpos secundários apropriados (sistema de antipolímero coelho HRP-rotulados) por 30 min à temperatura ambiente.
- Visualize a coloração imuno-histoquímica utilizando 3, 3'-diaminobenzidine (DAB) como cromógeno.
- Observar as seções sob um microscópio X 40, adquirir imagens e prossiga para analisá-los conforme desejado.
10. fluxo Cytometric Analysis
- Delicadamente picar o tecido do fígado, passá-lo através de um filtro de célula de 70 µm e centrifugue-2 x a 270 x g a 4 ° C por 4 min.
- Ressuspender as células em meio RPMI 1640 e analisá-lo por imunofluorescência de duas cores usando anticorpos monoclonais.
- Realizar fenotipagem celular usando marcadores específicos da pilha-superfície, incluindo fluoresceína isotiocianato e ficoeritrina-conjugado anti-NKp46 (linfócitos NK; 1:1, 000) e anti-CD4 (subtipo de célula T; 1:1, 000), com um citômetro de fluxo e analisar os dados com software de análise dados de citometria de fluxo.
- Selecione as populações de células de acordo com a dispersão de frente/lateral, portão de acordo com os controles do isotipo para contabilizar qualquer fluorescência de fundo e submeter os dados para uma análise secundária baseada os sinais de fluorescência de anticorpos individuais.
Resultados
Baseado no modelo estabelecido BA rato, foram administrados os ratos infectados neonatais uma injeção i.p. da mistura preparada de colágeno AgNP 2 x depois exibindo icterícia. Sobrevivência do mouse foi verificada diariamente e efectuaram-se testes de função hepática, patologia hepática e citometria de fluxo. Em comparação com os ratos de BA de controle sem tratamento, os ratos tratados com AgNP mostraram redução da icterícia e mantiveram seu peso normal (Figura 3). Os níveis de metabolismo da bilirrubina e transaminase hepática caiu para valores de controle normal, sugerindo que o AgNPs melhorado a função do fígado (tabela 1). Colangiografia extra-hepáticas (Figura 4), com coloração de azul de metileno confirmou a patência do ducto biliar após o tratamento da AgNP. H & E mancha (Figura 5) mostrou uma infiltração de células inflamatórias diminuiu significativamente na área de portal hepática de ratos tratados com AgNPs, em comparação com o controle de ratos. Os resultados de citometria de fluxo mostraram significativamente menos células NK em fígados após tratamentos a AgNP (ambos nos dias 9 e 12) do que os ratos RRV (Figura 6). Coloração imuno-histoquímica revelou um substancialmente reduzida expressão do marcador de célula NK NKG2D (Figura 7) na tríade portal dos ratos tratados com AgNP, em comparação com os ratos do RRV.

Figura 1: posição de penetração inicial seringa. A linha pontilhada vermelha indica a linha paralela no abdômen do rato neonatal P6; a seta amarela indica o ponto da agulha; a seta vermelha indica o ângulo da agulha. Clique aqui para ver uma versão maior desta figura.

Figura 2: agulha atingindo a superfície da borda inferior do fígado. Linha amarela pontilhada indica a borda inferior de um fígado de rato; a seta vermelha indica a posição da agulha durante a injeção. Clique aqui para ver uma versão maior desta figura.

Figura 3: efeito da AgNPs na síndrome de BA em um modelo experimental de rato BA. (A), este painel mostra a aparência dos ratos neonatais nos dias 9 e 12, após uma injeção com RRV sozinho e dias 3 e 6 dias após uma injeção com AgNPs (RRV + AgNPs). (B), este painel mostra o peso dos ratos em cada grupo de pontos de tempo diferentes; o x-eixo indica o número de dias depois que nasceu o mouse e o y-eixo indica a dobra-mudança no peso corporal. P < 0,01 com Student t-teste comparando a RRV + AgNp grupo ao grupo controle RRV; n = 16 no grupo controle, n = 18 no grupo RRV e n = 17 no RRV + AgNP grupo. (C), este painel mostra a taxa de sobrevivência dos ratos em cada grupo. Esta figura foi modificada de Zhang et al . 18. clique aqui para ver uma versão maior desta figura.
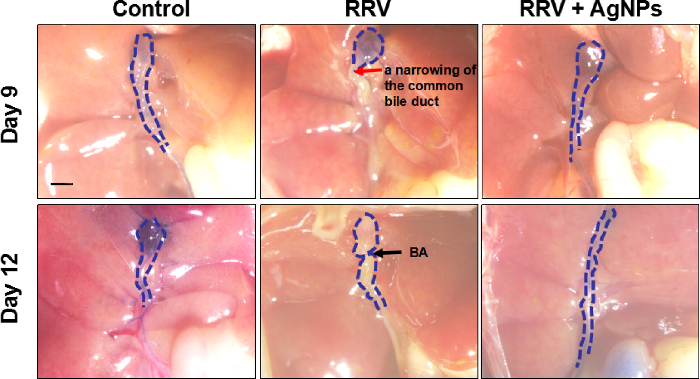
Figura 4: colangiografia extra-hepáticas. Utilizou-se um agente de contraste para detectar a permeabilidade dos ductos biliares extra-hepáticas e capturar imagens. A linha pontilhada azul indica a direção do ducto biliar extra-hepática; a seta vermelha indica um estreitamento do ducto biliar comum; a seta preta indica BA. Barra de escala = 1 mm. clique aqui para ver uma versão maior desta figura.

Figura 5: coloração H & E. Tecidos fígados dos ratos em cada grupo, nos dias 9 e 12 foram coletados, fixo, seccionados e corados com H & E. abreviaturas: PV = veia porta, BD = ducto biliar. Barra de escala = 50 µm. Esta figura foi modificada de Zhang et al . 18. clique aqui para ver uma versão maior desta figura.
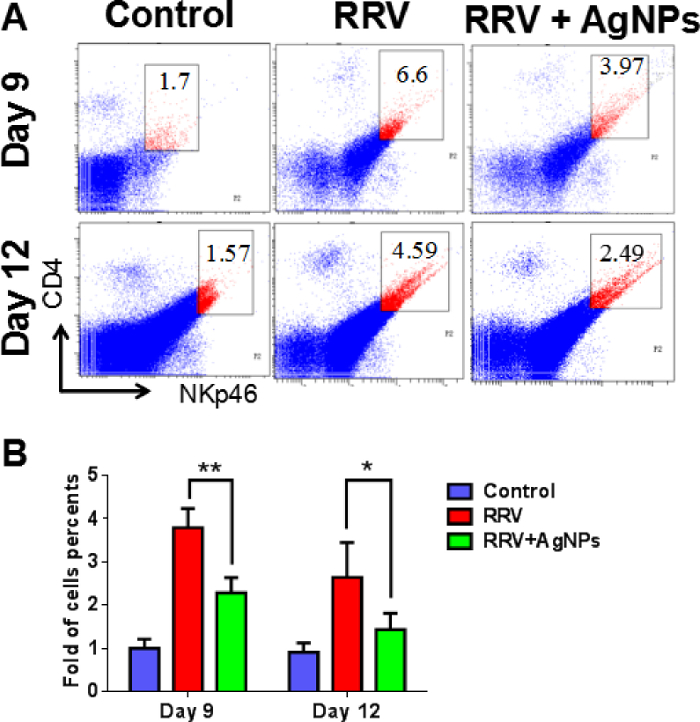
Figura 6: percentagem de NK células no tecido hepático. (A) de fígados de ratos foram transformados em suspensões celulares nos dias 9 e 12, e a proporção das células NK foi detectada por citometria de fluxo. (B), este painel mostra a porcentagem de células NK (NKp46+CD4+) em cada grupo em pontos diferentes de tempo após a injeção da AgNP. O y-eixo indica a dobra-alteração da percentagem de células NK, que foi calculado em relação as porcentagens do grupo controle no dia 9 e dia 12.* *P < 0,01 e *P < 0.05, com Student t-teste comparando o RRV + AgNp grupo ao grupo de controle RRV, n = 10 em cada grupo. Esta figura foi modificada de Zhang et al . 18. clique aqui para ver uma versão maior desta figura.

Figura 7: coloração imuno-histoquímica para o marcador de célula NK NKG2D na área de portal dos ratos em cada grupo de tratamento. A expressão do marcador de célula NK NKG2D na área de portal dos ratos em cada grupo de tratamento foi detectada pela coloração imuno-histoquímica. As setas longas indicam canais biliares; as curtas setas indicam as células NK. Abreviaturas: PV: veia porta, BD: ducto biliar. Sscale bar = 50 µm. Esta figura foi modificada de Zhang et al . 18. clique aqui para ver uma versão maior desta figura.
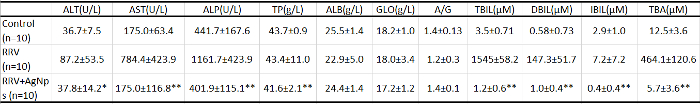
Tabela 1: exame de laboratório clínico dos níveis séricos de fígado relacionadas com função molécula. Sangue periférico foi usado para medir a função do fígado nos ratos em cada grupo. ALT: alanina aminotransferase, AST: aspartato aminotransferase, ALP: fosfatase alcalina, TP: total de proteína, ALB: albumina, GLO: globulina, TBIL: bilirrubina total, DBIL: bilirrubina direta, IBIL: bilirrubina indireta e TBA = total de ácidos biliares. P < 0,05 e * *P < 0,01, com Student t-teste para cada coorte, em comparação com o RRV grupo sozinho, n = 10 em cada grupo. Todos os dados do indicador bioquímicos são exibidos como a média ± DP. Todos os mouses dos três grupos foram 12 dias de idade. Esta tabela foi modificada de Zhang et al . 18. clique aqui para baixar este arquivo.
Discussão
AgNPs apresentam propriedades antibacterianas amplo espectro potentes e uma permeabilidade forte22; Além disso, eles são usados para produzir uma gama de produtos médicos antibacteriano23. No entanto, AgNPs pode levar um longo tempo para limpar uma vez que se acumulam em órgãos, e esta persistência pode levar a efeitos tóxicos24,25. Um estudo anterior analisou a toxicidade aguda e genotoxicidade de AgNPs após uma injeção intravenosa única em um experimento de rato, e os resultados mostraram que o AgNPs poderia causar hepática aguda e danos nos rins. AgNPs acumulados nos órgãos principais sistema imunológico, incluindo o Timo e o baço17. Neste modelo de BA rato, o tratamento com AgNPs amenizada síndrome de BA, que nossos dados sugerem que é parcialmente mediada pela inibição de células NK. No entanto, os efeitos a longo prazo de AgNPs exigem uma investigação mais aprofundada, para avaliar o potencial de toxicidade para o desenvolvimento do mouse e Regulamento imune.
Em termos de método, algumas notas adicionais para uma cirurgia bem sucedida são os seguintes: (i) o processo de preparar a mistura de colágeno AgNP deve ser efectuada no gelo porque, à temperatura ambiente, a AgNP mistura de colágeno vai se tornar rapidamente um gel semi-sólido, que Não pode ser usado para injeções. Após o preparo, a mistura de colágeno AgNP deve ser armazenada a 4 ° C. (ii) apenas seringas de insulina 1 mL devem ser usadas devido ao pequeno diâmetro, que reduz o escapamento da droga injetada. (iii) anteriores estudos geralmente têm examinado o efeito da AgNPs administrada por via oral16 ou através de de injeção intravenosa17. Em nossas experiências com animais, os assuntos experimentais são ratos Neonatais; assim, a injeção intravenosa é quase impossível, e usamos uma injeção i.p.. A injeção de AgNPs melhorou os sintomas de BA nos ratos. (iv) no início da injeção, inferiores do mouse são fixos com a mão para impedir que o mouse se movendo. Esse método garante que a quantidade certa do medicamento é injectada dentro da cavidade abdominal sem quaisquer fugas e garante ainda mais a eficácia do experimento. (v) em camundongos neonatais, estômago e baço estão na parte esquerda do abdome, e o estômago está cheio de leite. Para injetar a mistura AgNP à superfície da borda inferior do fígado, a agulha é inserida acima da coxa direita do mouse. Se a agulha é inserida do lado esquerdo, ela poderia facilmente perfurar ou o estômago, causando o leite a fluir para a cavidade abdominal, ou o baço, causando sangramento. (vi) porque a parede abdominal em ratos neonatais é fina, escapamento de drogas pode ser prevenido por diagonalmente, avançando a agulha em um ângulo de 15°, perto da parede abdominal para alcançar a borda inferior do fígado.
Temos observado o efeito encorajador do AgNPs neste rato induzida por RRV modelo BA. Em conjunto com estudos anteriores que usado AgNPs nos tratamentos de doenças e infecções de vírus diferentes, estes dados AgNP sugerem a possibilidade de um aplicativo no vivo em infecções de antivírus. A limitação desses experimentos é que a farmacocinética de AgNPs não é totalmente clara como devido à falta de métodos de medição para o AgNPs, o que dificulta o controle das dosagens da AgNP. Também é necessário para um estudo mais aprofundado para o destino intracelular do AgNPs, que nos ajudará a entender o mecanismo e reduzir os efeitos colaterais em tratamentos de doenças futuras.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os AgNPs usados aqui foi um presente do C. M. Che no departamento de química, Universidade de Hong Kong. Este trabalho foi financiado pela Fundação Nacional de ciências naturais da China (n. º 81600399) e ciência e tecnologia, projeto de Guangzhou (No.201707010014).
Materiais
| Name | Company | Catalog Number | Comments |
| BALB/c mouse | Guangdong Medical Experimental Animal Center | SYXK2017-0174 | Animal experiment |
| Rhesus rotavirus (RRV) | ATCC | ATCC VR-1739 | Establish biliary atresia mouse model |
| MA104 cells | ATCC | ATCC CRL-2378.1 | For laboratory use only |
| DMEM | Thermo Fisher | 10569010 | Mammalian Cell Culture |
| Fetal Bovine Serum | Thermo Fisher | 10099141 | Mammalian Cell Culture |
| collagen Type I | CORNING | 354236 | For research use only |
| PBS buffer | OXOID | BR0014G | For washing |
| NaOH | Sigma | 1310-73-2 | Adjust the PH value |
| AgNP | Antibacterial Note: The AgNps was a gift from Prof CM Che. in the Department of Chemistry, the University of Hong Kong. | ||
| Insulin syringe with integrated needle | BD | 9161635S | For medical use |
| 15 mL Centrifuge Tube | Corning | 430791 | For laboratory use only |
| 1.5 mL Microcentrifuge Tube | GEB | CT0200-B-N | For laboratory use only |
| Microscope | Nikon | ECLIPSE-Ci | For laboratory use |
| Dissecting/Intravital microscope | Nikon | SMZ 1000 | For laboratory use |
| anti-Mouse NKp46 FITC | eBioscience | 11-3351 | For research use only |
| anti-Mouse CD4 PE-Cyanine5 | eBioscience | 15-0041 | For research use only |
| Monoclonal Mouse Anti-Human CD4 | DAKO | 20001673 | For research use only |
| anti-NKG2D | RD | MAB1547 | For research use only |
| BD FACSCanto Flow Cytometer | BD Biosciences | FACS Canto Plus | For laboratory use only |
Referências
- Szavay, P. O., Leonhardt, J., Czechschmidt, G., Petersen, C. The role of reovirus type 3 infection in an established murine model for biliary atresia. European Journal of Pediatric Surgery. 12 (04), 248-250 (2002).
- Coots, A., et al. Rotavirus infection of human cholangiocytes parallels the murine model of biliary atresia. Journal of Surgical Research. 177 (2), 275-281 (2012).
- Shanmugam, N. P., Jayanthi, V. Biliary atresia with cytomegalovirus. Indian Pediatrics. 49 (2), 157(2012).
- Mack, C. L., Feldman, A. G., Sokol, R. J. Clues to the Etiology of Bile Duct Injuryin Biliary Atresia. Seminars in Liver Disease. 32, 307-316 (2012).
- Muraji, T., Suskind, D. L., Irie, N. Biliary atresia: a new immunological insight into etiopathogenesis. Expert Review of Gastroenterology & Hepatology. 3 (6), 599-606 (2009).
- Sokol, R. J., Mack, C. Etiopathogenesis of Biliary Artesia. Seminars in Liver Disease. 21, 517-524 (2001).
- Shivakumar, P., Sabla, G. E., Whitington, P., Chougnet, C. A., Bezerra, J. A. Neonatal NK cells target the mouse duct epithelium via Nkg2d and drive tissue-specific injury in experimental biliary atresia. Journal of Clinical Investigation. 119 (8), 2281-2290 (2009).
- Mack, C. L., et al. Oligoclonal expansions of CD4+ and CD8+ T-cells in the target organ of patients with biliary atresia. Gastroenterology. 133 (1), 278-287 (2007).
- Shivakumar, P., et al. Effector Role of Neonatal Hepatic CD8 + Lymphocytes in Epithelial Injury and Autoimmunity in Experimental Biliary Atresia. Gastroenterology. 133 (1), 268-277 (2007).
- Saxena, V., et al. Dendritic Cells Regulate Natural Killer Cell Activation and Epithelial Injury in Experimental Biliary Atresia. Science Translational Medicine. 3 (102), 102ra194 (2011).
- Miethke, A. G., et al. Post-natal paucity of regulatory T cells and control of NK cell activation in experimental biliary atresia. Journal of Hepatology. 52 (5), 718-726 (2010).
- Tian, J., et al. Topical delivery of silver nanoparticles promotes wound healing. ChemMedChem. 2 (1), 129-136 (2010).
- Lu, L., et al. Silver nanoparticles inhibit hepatitis B virus replication. Antiviral Therapy. 13 (2), 253-262 (2008).
- Xiang, D., et al. Inhibition of A/Human/Hubei/3/2005 (H3N2) influenza virus infection by silver nanoparticles in vitro and in vivo. International Journal of Nanomedicine. 8 (Issue 1), 4103-4114 (2013).
- Elechiguerra, J. L., et al. Interaction of silver nanoparticles with HIV-1. Journal of Nanobiotechnology. 3 (1), 1-10 (2005).
- Nallanthighal, S., et al. Differential effects of silver nanoparticles on DNA damage and DNA repair gene expression in Ogg1-deficient and wild type mice. Nanotoxicology. 11 (8), 1-16 (2017).
- Wen, H., et al. Acute toxicity and genotoxicity of silver nanoparticle in rats. PLoS One. 12 (9), e0185554(2017).
- Zhang, R., et al. Silver nanoparticle treatment ameliorates biliary atresia syndrome in rhesus rotavirus inoculated mice. Nanomedicine. 13 (3), 1041-1050 (2017).
- Arnold, M., Patton, J. T., McDonald, S. M. Culturing, Storage, and Quantification of Rotaviruses. Current Protocols in Microbiology. , Chapter 15 Unit 15C.13 (2009).
- Liu, X., et al. Silver nanoparticles mediate differential responses in keratinocytes and fibroblasts during skin wound healing. ChemMedChem. 5 (3), 468-475 (2010).
- Zhang, R., et al. Silver nanoparticles promote osteogenesis of mesenchymal stem cells and improve bone fracture healing in osteogenesis mechanism mouse model. Nanomedicine. 11 (8), 1949-1959 (2015).
- Wu, J., Hou, S., Ren, D., Mather, P. T. Antimicrobial properties of nanostructured hydrogel webs containing silver. Biomacromolecules. 10 (9), 2686-2693 (2009).
- Xu, L. Genotoxicity and molecular response of silver nanoparticle (NP)-based hydrogel. Journal of Nanobiotechnology. 10 (1), 16(2012).
- Dobrzyńska, M. M., et al. Genotoxicity of silver and titanium dioxide nanoparticles in bone marrow cells of rats in vivo. Toxicology. 315 (1), 86-91 (2014).
- Mohamed, H. R. H. Estimation of TiO 2 nanoparticle-induced genotoxicity persistence and possible chronic gastritis-induction in mice. Food & Chemical Toxicology. 83 (9), 76-83 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados