Method Article
Une méthode de nanoparticules argent pour améliorer le Syndrome de l’atrésie des voies biliaires chez les souris
Dans cet article
Résumé
Cet article décrit en détail une méthode basée sur les nanoparticules d’argent pour améliorer le syndrome de l’atrésie des voies biliaires dans un modèle de souris expérimentales atrésie des voies biliaires. Une solide compréhension de la préparation du réactif et la technique d’injection de souris néonatales permettra de familiariser les chercheurs avec la méthode utilisée dans les études de modèles de souris néonatales.
Résumé
Atrésie des voies biliaires (BA) sont une forme sévère de cholangite avec une mortalité élevée chez les enfants dont l’étiologie n’est pas encore pleinement compris. Les infections virales peuvent être une cause possible. Le modèle animal typique utilisé pour l’étude BA est établi en inoculant une souris néonatale avec un rotavirus rhésus. Nanoparticules d’argent auraient dû être divulgués exercent des effets antibactériens et antiviraux ; leur fonction dans le modèle de souris de BA est évaluée dans cette étude. Actuellement, lors des expérimentations animales BA, les méthodes utilisées pour améliorer les symptômes des souris BA sont généralement symptomatiques traitements administrés par l’intermédiaire de denrées alimentaires ou d’autres drogues. Le but de cette étude est de démontrer une nouvelle méthode pour améliorer le syndrome BA chez la souris par injection intrapéritonéale de nanoparticules d’argent et de fournir des méthodes détaillées pour la préparation de la formulation de gel argent NANOPARTICULAIRE. Cette méthode est simple et largement applicable et peut être utilisée pour le mécanisme de BA, ainsi que dans les traitements cliniques de recherche. Basé sur le modèle de souris de BA, quand les souris présentent un ictère, le gel de prêts argent nanoparticule est injecté par voie intrapéritonéale à la surface du foie plus bas. On observe l’état de survie, et on examine les indicateurs biochimiques et histopathologie du foie. Cette méthode permet une compréhension plus intuitive des deux la mise en place du modèle BA et les nouveaux traitements de BA.
Introduction
BA est une forme de cholestase caractérisée par un ictère persistant et a une mortalité élevée en l’absence d’une transplantation hépatique. Les infections virales sont étroitement associées à la pathogenèse de la BA. Le cytomégalovirus, le réovirus et antirotavirus ont été suggérés comme agents pathogènes en BA1,2,3. Au cours de la période néonatale, la réponse du système immunitaire immature à une infection virale provoque un dérèglement immunitaire contre les canaux biliaires extra - et intra-hépatique, conduisant à l’apoptose des cellules épithéliales biliaires, infiltration de cellules inflammatoires dans le portail Area, obstruction des canaux biliaires intrahépatiques et extra-hépatiques et enfin, une fibrose du foie4,5,6.
Le modèle animal couramment utilisé pour les études BA implique l’inoculation de souris néonatale avec le rotavirus rhésus (RRV). La souris développe généralement jaunisse après 5-6 jours, montrant un faible poids corporel et selles acholic. Le rôle de la réponse immunitaire dans le processus de la maladie est essentiel, surtout pour les cellules tueuses naturelles de (NK) ; l’épuisement de ces cellules avec un anticorps anti-NKG2D réduit considérablement les dommages causés par le BA7. En outre, des autres cellules, y compris les CD4+ T, des cellules CD8+ T cellules, cellules dendritiques et les cellules T régulatrices, ont tous démontrés que jouent un rôle dans la maladie8,9,10,11. Toutes les données indiquent la nature indispensable du système immunitaire dans le cadre de BA.
Nanoparticules d’argent (AgNPs) sont sont avérées pour avoir des effets bénéfiques contre certaines maladies infectieuses, y compris les infections bactériennes12 et infections virales13,14,15. Toutefois, sauf usage dermatologique, peu d’études ont utilisé AgNPs un traitement clinique, principalement en raison de leur toxicité potentielle. Dans l’expérimentation animale, les chercheurs ont généralement étudié l’efficacité de l’AgNPs administré via orale16 ou intraveineuse méthodes17. Toutefois, aucun d’autres chercheurs n’ont étudié l’efficacité de l’AgNPs administrés via une injection intrapéritonéale (i.p.) chez des souris néonatales d’expériences, qui est une méthode simple et rapide conduisant à une incidence plus directe sur le foie et les voies biliaires tout en réduire la toxicité d’autres systèmes, tels que le système immunitaire. AgNPs ont démontré qu’affectent les cellules NK activité18; par conséquent, nous avons testé les effets thérapeutiques de l’AgNPs administré par injection intrapéritonéale chez la souris BA.
Protocole
Tous les protocoles expérimentaux animaux ont été approuvés par le Comité de l’utilisation de la Sun Yat-Sen University Laboratory Animal Center (#IACUC-DB-16-0602) et d’institutionnels animalier.
1. établir le modèle de souris d’atrésie des voies biliaires
- Maintenir la souris BALB/c enceintes dans un environnement exempt d’agents pathogènes spécifique suivant un cycle de sombre/clair de 12 h à 25 ° C, avec accès à chow autoclavés ad libitum.
- Pour préparer la souche RRV MMU 18006, amplifier le virus dans les cellules MA104 et mesurer les titres viraux par un essai de plaque19.
Remarque : MA104 cellules sont cultivées dans le milieu de l’aigle modifié de Dulbecco (DMEM) avec 10 % de sérum bovin fœtal (SVF) dans un incubateur avec une atmosphère humidifiée contenant 5 % de CO2. Les étapes d’amplification sont brièvement décrites ci-dessous.- Infecter les cellules MA104 (1,5 x 107) dans un flacon de culture de2 150 cm avec la trypsine activée RRV [1.5 x 106 unités de formation de plaques (PFU)] dans 30 mL de milieu sans sérum. Incuber les cellules infectées pendant 3 jours dans un incubateur à 37 ° C, avec 5 % de CO2à humidifié.
- Lyse des cellules infectées dans le flacon de culture par trois cycles de gel-dégel, avec 20 min dans un congélateur à-80 ° C pour chacun geler phase et, ensuite, décongeler les cellules retour à température ambiante ; la particule de virus à la cellule va sortir dans le surnageant. Ensuite, recueillir et transférer le lysat cellulaire et le surnageant de culture dans un tube conique de 15 mL.
- Retirez les débris cellulaires le lysat par centrifugation à basse vitesse (300 x g à 4 ° C pendant 3 min). Ensuite, transvaser le surnageant contenant le virus (environ 6 mL) dans un nouveau tube conique 15 mL pour l’expérimentation animale.
Remarque : Le RRV est alors prêt à être titré, aliquotés et stockées ou utilisées pour des séances supplémentaires d’amplification. Une exposition prolongée à la température ambiante permettra de réduire la capacité de l’infection virale ; le virus doit être placé sur glace et stocké à-80 ° C ou dans l’azote liquide.
- Charge le RRV dans une insuline de petit volume (1 mL) seringue avec une aiguille de 29 G pour l’injection de souris néonatales.
Remarque : L’épaisseur aiguilles de seringues volumétriques facilement conduisent à une fuite de la drogue. - Dans les 24 h après la naissance, administrer à chaque µL de nouveau-né 20 de 1,2 x 105 UFP/mL RRV via la route i.p. ; Utilisez le même volume de solution saline dans le contrôle.
Remarque : La seringue utilisée dans cette expérience est une seringue d’insuline de 1 mL. Des souris infectées pas nourris par leur mère sont décédées dans les 2 premiers jours pour d’autres raisons n’étaient pas inclus dans l’analyse. - Observer de près toutes les souris néonatales et pesez-les tous les jours. En règle générale, le sixième jour après l’inoculation de RRV, ictère apparaît sur les oreilles et la peau nue, le tabouret devient couleur d’argile, et la fourrure devient huileuse, ce qui suggère la mise en place du modèle BA ; Recherchez ces symptômes.
NOTE : BA peut être confirmé par un examen de section de tissu hépatique avec H & E et immunohistochemical déclarant. Les souris de la BA sont alors prêts pour le traitement de l’AGP.
ATTENTION : Le protocole présenté doit être utilisé avec contemporain animales et humaines RV souches qui doivent être manipulés dans des conditions de biosécurité de niveau 2 (BSL-2).
2. la synthèse de nanoparticules d’argent
- Préparer et de caractériser l’AgNPs comme décrit précédemment12,20.
Remarque : Les détails de préparation et de caractériser l’AgNPs ont été décrits dans les publications par l’équipe du C. M. Che au département de chimie, de l’Université de Hong Kong12,20. La concentration finale de la solution a été de 1 mM. Le diamètre moyen de l’AgNPs était 10 nm (allant de 5 à 15 nm) et confirmé par microscopie électronique.
3. préparation du mélange collagène nanoparticules d’argent
Remarque : Le mélange de collagène AGP est préparé et caractérisé comme décrit précédemment21 et stockés à 4 ° C. Toutes les opérations doivent être exécutées sur la glace.
- Tout d’abord, pour la préparation de collagène, ajouter 490 µL de collagène (4 mg/mL) dans un tube de 1,5 mL de type I et placez-le sur la glace.
- Ajouter 100 µL d’une solution saline tamponnée au phosphate (PBS, x 10) dans le collagène et mélangez-le avec une pipette.
- Pour préparer 1 L de solution tampon PBS 10 x, mélanger 80 g de NaCl, 2 g de KCl et 35,8 g de Na2HPO4. 12H2O à 2,4 g de KH2PO4 et magasin de la mémoire tampon à la température ambiante.
- Ensuite, ajoutez 10 µL de NaOH (0,2 M) à la solution ci-dessus.
- Pour préparer les 0,2 M NaOH, ajouter 8 g de poudre de NaOH à 1 L d’eau distillée.
- Enfin, ajouter 400 µL de AgNPs (1 mM) dans le collagène et les mélanger avec une pipette.
NOTE : Ajouter l’AgNPs dernière pour un même mélange. Le mélange de collagène AGP doit être conservé à 4 ° C ; dans le cas contraire, elle se solidifie facilement à la température ambiante.
4. souris méthode d’Injection
- Administrer les souris infectées néonatales dans le groupe RRV traité avec une injection intrapéritonéale de 50 µL du mélange collagène AGP après l’apparition de l’ictère ; effectuer une deuxième injection 3 jours plus tard.
Remarque : Les souris du groupe témoin de (contrôle infectés) RRV reçoivent le même volume de solution saline et les souris du groupe témoin normal ne reçoivent pas un traitement. - Au début de l’injection, appuyez sur la patte de la souris avec le doigt d’anneau obliquement sur la cuisse droite et introduire l’aiguille lentement à un angle de 15° (Figure 1). En arrivant à la surface du bord inférieur du foie (Figure 2), environ 0,5 cm dans, injecter le mélange de collagène AGP ; Ensuite, retirer l’aiguille lentement.
Remarque : Veillez à ne pas à introduire de l’air dans la seringue comme donc la souris néonatale peuvent en mourir. Chez la souris néonatales, l’estomac et la rate sont dans l’abdomen gauche et l’estomac est plein de lait. Si l’injection est administrée de ce côté, l’aiguille pourrait facilement saisir soit l’estomac, provoquant le lait s’écouler dans la cavité abdominale, ou la rate, causant une hémorragie.
ATTENTION : Veiller à l’aiguille pour prévenir les blessures aux doigts et n’oubliez pas de replacer le capuchon de l’aiguille, retirer l’aiguille et placez-le dans un contenant pour objets tranchants. - Après toutes les injections, gardez les souris hors de leur cage pendant 10 min permettre le mélange de collagène AGP de gel et d’empêcher la mère de lécher le site d’injection. Ensuite, retourner les souris à leur cage.
- Observer et de consigner les apparences physiques de toutes les souris tous les jours, y compris l’ictère et du poids corporel, ainsi que le taux de survie.
5. sang échantillon Collection
Remarque : Les échantillons de sang d’environ 120 µL sont recueillies en insérant l’aiguille dans le cœur. Après centrifugation, le sérum est collecté (environ 70 µL) pour les tests de fonction hépatique. La méthode de collecte de sang est comme suit.
- Anesthésier les souris sur la 9e et 12e jour après l’inoculation de RRV (c'est-à-dire 3 jours après le traitement de l’APN) à l’aide de 0,5 à 2,5 % sévoflurane.
- Immobiliser les membres de la souris et stériliser l’abdomen supérieur et inférieur avec 75 % d’alcool.
- Exposer le diaphragme en coupant la souris, la peau, les muscles et le péritoine le long de la ligne médiane à la pointe avec des ciseaux ; Utilisez un coton-tige stériles pour enlever le tube digestif pour exposer entièrement le muscle diaphragme.
- Insérer l’aiguille (avec une seringue de 1 mL insuline déchargé) dans le ventricule gauche du cœur et ramener lentement le piston de la seringue pour obtenir le volume maximal de sang. Ensuite, transférer le sang dans un tube de 1,5 mL.
- Laisser le tube reposer pendant 30 min à température ambiante et il Centrifuger pendant 5 min à 400 g. Puis, à l’aide d’une pipette de transfert, recueillir et enregistrer le sérum pour une utilisation ultérieure.
Remarque : Ne pas endommager la membrane, comme diaphragme défauts facilement conduisent à un pneumothorax, la mort et la coagulation du sang, empêchant ainsi le prélèvement d’échantillons de sang.
6. biochimiques paramètre détection
- Utilisez le sérum recueilli à l’étape 5.5 pour une détection de paramètres biochimiques.
- Utiliser un analyseur automatisé biochimique pour détecter les paramètres biochimiques suivants : alanine aminotransférase (ALT), aspartate aminotransférase (AST), phosphatase alcaline (ALP), protéines totales (TP), albumine (ALB), globuline (GLO), bilirubine totale (TBIL), bilirubine directe (DBIL), taux de bilirubine indirecte (IBIL) et des acides biliaires totaux (TBA).
7. extrahépatique cholangiographie d’observer la perméabilité des canaux biliaires extrahépatiques
Remarque : Effectuer l’ensemble du processus sous un microscope à dissection.
- Entièrement exposer le foie, vésicule biliaire et voies biliaires extra-hépatiques avec un coton-tige.
- Observer et photographier l’apparence du foie et des voies biliaires sous un microscope à dissection.
- Ophtalmiques forceps permet de tenir doucement le fond de la vésicule biliaire.
- Charger une seringue de 1 mL avec la solution de bleu de méthylène (0,05 wt.% H2O). Introduire doucement l’aiguille de la seringue dans la cavité de la vésicule biliaire ; Ensuite, saisir l’aiguille avec la pince ophtalmique et lentement, laisser infuser 10 à 20 µL du bleu de méthylène.
- Observer au microscope si la couleur bleue passe à travers les canaux biliaires extrahépatiques du jéjunum et prendre une photo.
8. la collecte d’échantillons de foie frais à l’hématoxyline et éosine coloration
- Corriger la souris frais tissus hépatiques du jour au lendemain dans 10 % de formol.
- Puis, incorporer les tissus du foie fixes à la paraffine et leur section.
- Déparaffinage les sections, les réhydrater avec une série d’éthanol (tels que l’éthanol 100 %, 95 %, 80 % et 70 % dans l’eau distillée, chacun pendant 5 min), tacher les coupes de tissus avec l’hématoxyline, soumettent à une différenciation de l’alcool de l’acide chlorhydrique 1 % et enfin, tacher le sections avec l’éosine.
- Enfin, observer l’histopathologie du foie sous un microscope X 40.
9. Immunohistochemical souillant des Sections de tissus colorés à l’éosine et l’hématoxyline
- Après décirage et réhydrater les sections, effectuez une recherche d’antigène en submergeant les sections dans un tampon Tris-EDTA (10 mM Tris base, solution d’EDTA 1 mM ; pH 9,0) et en les chauffant au micro-ondes pendant 10 min à 95 ° C.
- Retirez la peroxydase endogène en exposant les coupes de tissus pendant 10 min à une solution de peroxyde d’hydrogène 3 %.
- Traiter les sections avec 5 % de sérum de chèvre, de bloquer la liaison non spécifique.
- Ajouter des anticorps primaires lapin-souris NKG2D (1/100) pour les sections et les incuber une nuit à 4 ° C.
- Incuber les sections avec les anticorps secondaires appropriés (système d’anti-lapin marqués au HRP polymère) pendant 30 min à température ambiante.
- Visualiser la coloration immunohistochimique à l’aide de 3, 3'-diaminobenzidine (DAB) comme chromogène.
- Observer les sections sous un microscope X 40, acquisition d’images et aller de l’avant de les analyser comme vous le souhaitez.
10. cytométrie
- Émincer le tissu hépatique doucement, passez-le à travers un tamis de cellule de 70 µm et centrifuger il 2 x 270 x g à 4 ° C pendant 4 min.
- Resuspendre le culot dans un milieu RPMI 1640 et à analyser par immunofluorescence de deux couleurs à l’aide d’anticorps monoclonaux.
- Effectuer la détermination du phénotype cellulaire à l’aide de marqueurs spécifiques de la surface cellulaire, y compris la fluorescéine isothiocyanate et phycoérythrine-conjugué anti-NKp46 (lymphocytes NK ; 1 / 1 000) et anti-CD4 (sous-type de lymphocytes T, 1 / 1 000), avec un cytomètre en flux et analyser les données avec le logiciel d’analyse de données cytométrie en flux.
- Sélectionnez des populations de cellules selon la diffusion vers l’avant/latérale, porte selon les contrôles de l’isotype à représentent une fluorescence de fond et soumettre les données à une analyse secondaire basée sur le signal de fluorescence des anticorps individuels.
Résultats
Basé sur le modèle de souris BA établi, les souris infectées néonatales ont été administrés une injection intrapéritonéale du mélange collagène préparé AGP 2 x après présentant un ictère. La survie de souris a été vérifiée pour tous les jours, et test de fonction hépatique, pathologie du foie et cytométrie en flux ont été effectuées. Par rapport aux souris témoins non traitées BA, les souris traitées AGP a montré jaunisse réduite et ont maintenu leur poids corporel normal (Figure 3). Les niveaux du métabolisme de la bilirubine et des transaminases hépatiques ont chuté aux valeurs contrôles normaux, ce qui suggère que l’AgNPs a grandement amélioré la fonction hépatique (tableau 1). Extrahépatique cholangiographie (Figure 4) avec coloration au bleu de méthylène a confirmé la perméabilité de la voie biliaire principale après le traitement de l’AGP. La coloration H & E (Figure 5) a montré une infiltration de cellules inflammatoires diminution importante dans la région hépatique portale de souris traitées avec l’AgNPs, par rapport aux souris contrôle. Les résultats de cytométrie de flux a montré nettement moins les cellules NK dans le foie après les traitements d’AGP (à la fois aux jours 9 et 12) que chez les souris RRV (Figure 6). Marquage immunohistochimique a révélé une expression sensiblement réduite du marqueur de cellules NK NKG2D (Figure 7) dans l’espace porte des souris traitées AGP, comparé aux souris RRV.

Figure 1 : position de pénétration initiale seringue. La ligne pointillée rouge indique la ligne parallèle à l’abdomen de la souris néonatale P6 ; la flèche jaune indique le point d’aiguille ; la flèche rouge indique l’angle de l’aiguille. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : aiguille pour atteindre la surface du bord inférieur du foie. La ligne pointillée jaune indique le bord inférieur d’un foie de souris ; la flèche rouge indique la position de l’aiguille pendant l’injection. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : effet de AgNPs syndrome de BA dans un modèle expérimental de souris BA. (A), ce panneau affiche l’apparence de souris néonatales 9 et 12 jours après une injection avec RRV seul et 3 jours et 6 jours après l’injection avec AgNPs (RRV + AgNPs). (B), ce panneau indique le poids des souris dans chaque groupe à des moments différents ; le x-axe indique le nombre de jours après la naissance de la souris et y-axe indique la pli-modification du poids corporel. P < 0,01 avec de Student t-essai comparant la RRV + AGP groupe au groupe témoin RRV ; n = 16 dans le groupe témoin, n = 18 dans le groupe RRV et n = 17 RRV + AGP groupe. (C), ce panneau affiche le taux de survie des souris dans chaque groupe. Ce chiffre a été modifié par Zhang et al. 18. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
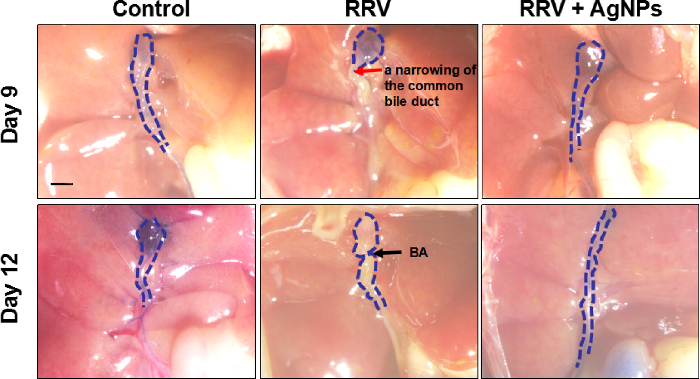
Figure 4 : cholangiographie extrahépatique. Un agent de contraste a été utilisé pour détecter la perméabilité des voies biliaires extrahépatiques et capturer des images. La ligne pointillée bleue indique la direction de la voie biliaire extrahépatique ; la flèche rouge indique un rétrécissement de la voie biliaire principale ; la flèche noire indique BA. Echelle = 1 mm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : la coloration H & E. Les tissus du foie des souris dans chaque groupe de 9 et 12 jours ont été recueillies, fixe, sectionnés et coloration H & E. Abréviations : PV = veine, BD = canal cholédoque. Echelle = 50 µm. Ce chiffre a été modifié par Zhang et al. 18. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
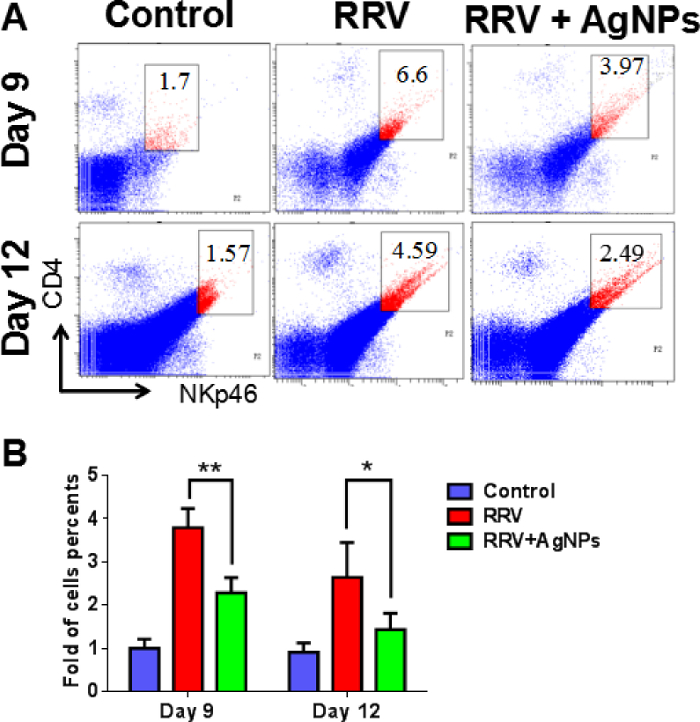
Figure 6 : pourcentage de NK les cellules dans le tissu hépatique. (A) le foie des souris ont été traité dans des suspensions cellulaires, 9 et 12 jours, et la proportion des cellules NK a été détectée par cytométrie en flux. (B), ce panneau indique le pourcentage des cellules NK (NKp46+CD4+) dans chaque groupe à des moments différents après l’injection de l’AGP. y-axe indique le pli-changement du pourcentage des cellules NK, qui a été calculé par rapport à des pourcentages du groupe témoin jour 9 ou jour 12.* *P < 0,01 et *P < 0,05, avec de Student t-essai comparant la RRV + AGP groupe au groupe témoin RRV, n = 10 dans chaque groupe. Ce chiffre a été modifié par Zhang et al. 18. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 7 : coloration immunohistochimique pour le marqueur de cellules NK NKG2D en matière de portail des souris dans chaque groupe de traitement. L’expression du marqueur de cellules NK NKG2D en matière de portail des souris dans chaque groupe de traitement a été détectée par coloration immunohistochimique. Les longues flèches indiquent les voies biliaires ; les flèches courtes indiquent les cellules NK. Abréviations : PV : veine porte, BD : canal cholédoque. Sscale barre = 50 µm. Ce chiffre a été modifié par Zhang et al. 18. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
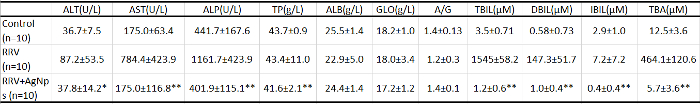
Tableau 1 : examen de laboratoire clinique des taux sériques de molécule d’axés sur la fonction hépatique. Sang périphérique a été utilisé pour mesurer la fonction du foie chez les souris de chaque groupe. ALT : alanine aminotransférase, AST : aspartate aminotransférase, ALP : phosphatase alcaline, TP : protéine, ALB totale : albumine, GLO : globuline, TBIL : bilirubine totale, DBIL : bilirubine directe, IBIL : taux de bilirubine indirecte et TBA = acides biliaires totaux. P < 0,05 et **P < 0,01, avec de Student t-test pour chaque cohorte par rapport à la RRV seul groupe, n = 10 dans chaque groupe. Toutes les données sur les indicateurs biochimiques sont affichées comme la moyenne ± SD Toutes les souris dans les trois groupes étaient âgés de 12 jours. Ce tableau a été modifié par Zhang et al. 18. s’il vous plaît cliquez ici pour télécharger ce fichier.
Discussion
AgNPs pièce puissantes propriétés antibactériennes à large spectre et une forte perméabilité22; en outre, ils sont utilisés pour produire une gamme de médicaments antibactériens23. Cependant, AgNPs peut prendre du temps pour effacer une fois qu’ils s’accumulent dans les organes, et cette persistance peut conduire à des effets toxiques24,25. Une précédente étude a examiné la toxicité aiguë et génotoxicité de l’AgNPs après une injection i.v. dans une expérience de rat, et les résultats ont montré que AgNPs pourrait provoquer des lésions aiguës hépatiques et rénales. AgNPs accumulés dans les organes principaux système immunitaire, y compris le thymus et la rate17. Dans ce modèle de BA de souris, le traitement avec l’AgNPs amélioré syndrome de BA, nos résultats suggèrent est partiellement médié par l’inhibition des cellules NK. Cependant, les effets à long terme de l’AgNPs exigent une enquête ultérieure, afin d’évaluer la toxicité potentielle pour le développement de la souris et de la régulation immunitaire.
En ce qui concerne la méthode, des notes complémentaires pour une chirurgie réussie sont les suivantes : (i) le processus de préparation du mélange de collagène APN dois effectuer sur glace parce que, à température ambiante, le mélange de collagène AGP deviendra rapidement un gel semi-solide, qui ne peut pas être utilisé pour les injections. Après la préparation, le mélange de collagène AGP doit être conservé à 4 ° C. (ii) 1 mL que les seringues à insuline doivent être utilisées en raison de la faible diamètre, ce qui réduit les fuites de la drogue injectée. (iii) précédente généralement étudié l’effet de l’AgNPs administré par voie orale16 ou par injection intraveineuse17. Dans notre expérimentation animale, les sujets expérimentaux sont souris néonatales ; ainsi, l’injection intraveineuse est presque impossible, et nous avons utilisé une injection intrapéritonéale. L’injection de AgNPs a amélioré les symptômes de BA chez les souris. (iv) au début de l’injection, les membres inférieurs de la souris ont été fixés à la main pour empêcher le mouvement de la souris. Cette méthode fait en sorte que la bonne quantité de médicament est injectée dans la cavité abdominale sans fuite et plus garantit l’efficacité de l’expérience. (v) chez la souris néonatales, l’estomac et la rate sont dans l’abdomen gauche et l’estomac est plein de lait. Pour injecter le mélange de l’APN à la surface du bord inférieur du foie, l’aiguille est insérée par le dessus de la cuisse droite de la souris. Si l’aiguille est insérée du côté gauche, il pourrait facilement percer soit l’estomac, provoquant le lait s’écouler dans la cavité abdominale, ou la rate, causant une hémorragie. (vi) parce que la paroi abdominale chez les souris néonatales est mince, fuite de drogue peut être évité en avançant en diagonale l’aiguille à un angle de 15° à proximité de la paroi abdominale pour atteindre le bord inférieur du foie.
Nous avons observé l’effet encourageant de l’AgNPs dans cette souris induite par RRV modèle BA. Ainsi que des études précédentes qui utilisé AgNPs dans les traitements de différentes infections et les maladies, ces données APN suggèrent la possibilité d’une application in vivo dans des infections de l’antivirus. La limitation de ces expériences est que la pharmacocinétique de l’AgNPs n’est pas totalement claire qu’en raison du manque de méthodes de mesure pour l’AgNPs, ce qui complique le contrôle des doses de l’AGP. Une étude plus approfondie est nécessaire aussi pour la cible intracellulaire de l’AgNPs, qui va nous aider à comprendre le mécanisme et de réduire les effets secondaires dans les traitements des maladies éventuelles.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
L’AgNPs utilisées ici ont été un cadeau de C. M. Che dans le département de chimie de l’Université de Hong Kong. Ce travail a été financé par la Fondation nationale des sciences naturelles de Chine (no 81600399) et de la Science et la technologie projet de Guangzhou (No.201707010014).
matériels
| Name | Company | Catalog Number | Comments |
| BALB/c mouse | Guangdong Medical Experimental Animal Center | SYXK2017-0174 | Animal experiment |
| Rhesus rotavirus (RRV) | ATCC | ATCC VR-1739 | Establish biliary atresia mouse model |
| MA104 cells | ATCC | ATCC CRL-2378.1 | For laboratory use only |
| DMEM | Thermo Fisher | 10569010 | Mammalian Cell Culture |
| Fetal Bovine Serum | Thermo Fisher | 10099141 | Mammalian Cell Culture |
| collagen Type I | CORNING | 354236 | For research use only |
| PBS buffer | OXOID | BR0014G | For washing |
| NaOH | Sigma | 1310-73-2 | Adjust the PH value |
| AgNP | Antibacterial Note: The AgNps was a gift from Prof CM Che. in the Department of Chemistry, the University of Hong Kong. | ||
| Insulin syringe with integrated needle | BD | 9161635S | For medical use |
| 15 mL Centrifuge Tube | Corning | 430791 | For laboratory use only |
| 1.5 mL Microcentrifuge Tube | GEB | CT0200-B-N | For laboratory use only |
| Microscope | Nikon | ECLIPSE-Ci | For laboratory use |
| Dissecting/Intravital microscope | Nikon | SMZ 1000 | For laboratory use |
| anti-Mouse NKp46 FITC | eBioscience | 11-3351 | For research use only |
| anti-Mouse CD4 PE-Cyanine5 | eBioscience | 15-0041 | For research use only |
| Monoclonal Mouse Anti-Human CD4 | DAKO | 20001673 | For research use only |
| anti-NKG2D | RD | MAB1547 | For research use only |
| BD FACSCanto Flow Cytometer | BD Biosciences | FACS Canto Plus | For laboratory use only |
Références
- Szavay, P. O., Leonhardt, J., Czechschmidt, G., Petersen, C. The role of reovirus type 3 infection in an established murine model for biliary atresia. European Journal of Pediatric Surgery. 12 (04), 248-250 (2002).
- Coots, A., et al. Rotavirus infection of human cholangiocytes parallels the murine model of biliary atresia. Journal of Surgical Research. 177 (2), 275-281 (2012).
- Shanmugam, N. P., Jayanthi, V. Biliary atresia with cytomegalovirus. Indian Pediatrics. 49 (2), 157(2012).
- Mack, C. L., Feldman, A. G., Sokol, R. J. Clues to the Etiology of Bile Duct Injuryin Biliary Atresia. Seminars in Liver Disease. 32, 307-316 (2012).
- Muraji, T., Suskind, D. L., Irie, N. Biliary atresia: a new immunological insight into etiopathogenesis. Expert Review of Gastroenterology & Hepatology. 3 (6), 599-606 (2009).
- Sokol, R. J., Mack, C. Etiopathogenesis of Biliary Artesia. Seminars in Liver Disease. 21, 517-524 (2001).
- Shivakumar, P., Sabla, G. E., Whitington, P., Chougnet, C. A., Bezerra, J. A. Neonatal NK cells target the mouse duct epithelium via Nkg2d and drive tissue-specific injury in experimental biliary atresia. Journal of Clinical Investigation. 119 (8), 2281-2290 (2009).
- Mack, C. L., et al. Oligoclonal expansions of CD4+ and CD8+ T-cells in the target organ of patients with biliary atresia. Gastroenterology. 133 (1), 278-287 (2007).
- Shivakumar, P., et al. Effector Role of Neonatal Hepatic CD8 + Lymphocytes in Epithelial Injury and Autoimmunity in Experimental Biliary Atresia. Gastroenterology. 133 (1), 268-277 (2007).
- Saxena, V., et al. Dendritic Cells Regulate Natural Killer Cell Activation and Epithelial Injury in Experimental Biliary Atresia. Science Translational Medicine. 3 (102), 102ra194 (2011).
- Miethke, A. G., et al. Post-natal paucity of regulatory T cells and control of NK cell activation in experimental biliary atresia. Journal of Hepatology. 52 (5), 718-726 (2010).
- Tian, J., et al. Topical delivery of silver nanoparticles promotes wound healing. ChemMedChem. 2 (1), 129-136 (2010).
- Lu, L., et al. Silver nanoparticles inhibit hepatitis B virus replication. Antiviral Therapy. 13 (2), 253-262 (2008).
- Xiang, D., et al. Inhibition of A/Human/Hubei/3/2005 (H3N2) influenza virus infection by silver nanoparticles in vitro and in vivo. International Journal of Nanomedicine. 8 (Issue 1), 4103-4114 (2013).
- Elechiguerra, J. L., et al. Interaction of silver nanoparticles with HIV-1. Journal of Nanobiotechnology. 3 (1), 1-10 (2005).
- Nallanthighal, S., et al. Differential effects of silver nanoparticles on DNA damage and DNA repair gene expression in Ogg1-deficient and wild type mice. Nanotoxicology. 11 (8), 1-16 (2017).
- Wen, H., et al. Acute toxicity and genotoxicity of silver nanoparticle in rats. PLoS One. 12 (9), e0185554(2017).
- Zhang, R., et al. Silver nanoparticle treatment ameliorates biliary atresia syndrome in rhesus rotavirus inoculated mice. Nanomedicine. 13 (3), 1041-1050 (2017).
- Arnold, M., Patton, J. T., McDonald, S. M. Culturing, Storage, and Quantification of Rotaviruses. Current Protocols in Microbiology. , Chapter 15 Unit 15C.13 (2009).
- Liu, X., et al. Silver nanoparticles mediate differential responses in keratinocytes and fibroblasts during skin wound healing. ChemMedChem. 5 (3), 468-475 (2010).
- Zhang, R., et al. Silver nanoparticles promote osteogenesis of mesenchymal stem cells and improve bone fracture healing in osteogenesis mechanism mouse model. Nanomedicine. 11 (8), 1949-1959 (2015).
- Wu, J., Hou, S., Ren, D., Mather, P. T. Antimicrobial properties of nanostructured hydrogel webs containing silver. Biomacromolecules. 10 (9), 2686-2693 (2009).
- Xu, L. Genotoxicity and molecular response of silver nanoparticle (NP)-based hydrogel. Journal of Nanobiotechnology. 10 (1), 16(2012).
- Dobrzyńska, M. M., et al. Genotoxicity of silver and titanium dioxide nanoparticles in bone marrow cells of rats in vivo. Toxicology. 315 (1), 86-91 (2014).
- Mohamed, H. R. H. Estimation of TiO 2 nanoparticle-induced genotoxicity persistence and possible chronic gastritis-induction in mice. Food & Chemical Toxicology. 83 (9), 76-83 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon