Method Article
Ex Vivo Imagem de cálcio para visualizar as respostas do cérebro a sinalização endócrina em Drosophila
Neste Artigo
Resumo
Este artigo descreve um protocolo para a ex vivo cálcio imagem latente do cérebro drosófila . Neste método, compostos naturais ou sintéticos podem ser aplicados para o buffer para testar sua capacidade de ativar neurônios particulares do cérebro.
Resumo
Órgão-órgão-a comunicação por sinalização endócrina, por exemplo, da periferia para o cérebro, é essencial para manter a homeostase. Como um animal de modelo para a investigação do sistema endócrino, Drosophila melanogaster, que tem sofisticadas ferramentas genéticas e informação do genoma, está sendo usado cada vez mais. Este artigo descreve um método para o tratamento de imagens de cálcio de explantes de cérebro de Drosophila . Esse método permite a detecção da sinalização direta de um hormônio no cérebro. É sabido que muitos Hormônios peptídicos agem através de receptores G-proteína-acoplados (GPCRs), cuja ativação causa um aumento na concentração Ca2 +intracelular. Ativação neural também eleva intracelular Ca2 + níveis, do influxo de Ca2 + e a liberação de Ca2 + armazenados no retículo endoplasmático (ER). Um sensor de cálcio, GCaMP, pode monitorar essas mudanças de Ca2 + . Neste método, o GCaMP é expresso nos neurônios de interesse, e o cérebro larval GCaMP-expressando é dissecado e culta ex vivo. O teste de peptídeo é então aplicado ao explante cérebro, e as alterações fluorescentes em GCaMP são detectadas usando um microscópio confocal de fiação disco equipado com uma câmera CCD. Usando este método, qualquer molécula solúvel em água pode ser testada, e diversos eventos celulares associados a ativação neural podem ser fotografados usando os indicadores fluorescentes apropriados. Além disso, modificando a imagem da câmara, este método pode ser usado para a imagem de outros órgãos de drosófila ou os órgãos de outros animais.
Introdução
Órgão-órgão-a comunicação é uma estratégia evolutivamente conservada para manter a homeostase para lidar com as mudanças ambientais. Em humanos, uma variedade de arereleased de hormônios das glândulas endócrinas na circulação. Muitos desses hormônios como alvo o hipotálamo do cérebro, que regula os processos metabólicos e comportamentos fundamentais tais como alimentação1,2. Muitos hormônios foram descobertos usando modelos de mamíferos. No entanto, os mecanismos de sua ação, especialmente as redes interorgan, em que participem, permanecem em grande parte obscuro.
Drosophila melanogaster emergiu como um modelo útil para estudar órgão-para-órgão comunicação. Em insetos, muitos processos fisiológicos são controlados pelos hormônios. Primeiros estudos centrada no crescimento e metamorfose usado grandes insetos. Nesses estudos, a remoção ou transplante de órgãos específicos previu a existência de moléculas sinalizadoras órgãos inter; mais tarde, hormônio juvenil (JH), hormônio Prothoracicotropic (PTTH) e isoinokosterone foram bioquimicamente purificada3,4,5. Uma grande família de peptídeos de sinalização intercelulares é pensada para ser envolvido em vários eventos fisiológicos durante o ciclo de vida de inseto6,7. A maioria destes peptídeos atuam sobre G-receptores (GPCRs), embora os GPCRs específicos foram inicialmente difícil identificar abordagens convencionais. A publicação do genoma de Drosophila sequência8 foi a descoberta que permitiu a identificação de peptídeos bioativos de Drosophila baseada sua homologia aos encontrados em outros insetos. Além disso, identificaram-se os receptores para vários péptidos de GPCRs previstos no genoma usando ensaios de ligação GPCR-ligante cell-cultura-based. Em seguida, as análises de expressão previram os caminhos de órgão-para-órgão eliciados estes peptídeos e receptores. Notavelmente, muitos dos receptores de peptídeos putativos são expressos no cérebro, sugerindo que o cérebro é um alvo principal do peptídeo hormônios9. Além disso, as ferramentas avançadas de genéticas em Drosophila têm contribuído para a identificação de funções fisiológicas das combinações de peptídeo-GPCR. Por exemplo, a GAL4 e LexA-baseado sistemas binários transcriptional permitem knockdown do gene ou superexpressão de forma controlada espacial e temporalmente. GAL4, um fator de transcrição identificado no fermento, vincula-se a uma sequência de cis-regulamentação específica denominada sequência de ativação Upstream (UAS). No sistema GAL4/UAS, linha excitador fornece tecido-específica ou expressão de GAL4 estágio específico e a linha de respondente carrega UAS montante do gene de interesse ou a construção, a expressão de shRNA de unidade. LexA/LexAop sistema é baseado em um mecanismo semelhante. Análise fenotípica de animais de GPCR-nocaute de peptídeo-knockdown e tecido-específica de tecido-específica pode revelar informações sobre modo do peptídeo-GPCR sinalização e local de ação. No entanto, as conclusões que podem ser alcançadas apenas por dados genéticos são limitadas. Por outro lado, uma vez que o alvo putativo de um hormônio peptídeo específico é reduzido a um tipo de tecido ou célula, cálcio ex vivo de imagem em explantes de órgão pode ser usado para elucidar a órgão-para-órgão comunicação mediada por sinalização de peptídeo-GPCR. Após a ativação de um GPCR Gq-acoplado, a concentração intracelular de Ca2 + é aumentada devido à liberação de Ca2 + do ER10. No cérebro, ativação neural também eleva os níveis intracelulares de Ca2 + . Tais aumentos de Ca2 + podem ser detectados por um sensor de cálcio, GCaMP, que sofre mudanças conformacionais na presença de Ca2 + resultando em emissão de fluorescência11.
Neste artigo, é descrito um método de imagem usando o cérebro de Drosophila explants de cálcio. Para testar a capacidade de um peptídeo para ativar os neurônios específicos, um peptídeo de teste é aplicado para o explante cérebro GCaMP-expressando, e mudanças de fluorescência são monitoradas pela microscopia confocal. O envolvimento do GPCR é então confirmado, realizando o mesmo ensaio usando um cérebro mutante falta GPCR. Esta combinação de genética e de imagem fornece informações precisas sobre o órgão-para-órgão de comunicação por peptídeos-GPCRs. possíveis modificações e aplicações do presente protocolo são também discutidas.
Protocolo
1. preparação do cérebro Larval explantes
- Fazer uma câmara de imagens.
Nota: A gravação estável requer que os explantes de cérebro estar amarrados. Aqui, uma câmara de imagem de baixo custo, feito à mão é usada no Ca2 + sistema de imagem.- Usando fórceps, arranhe o fundo centro de um prato de cultura plástico (35 x 10 mm) para criar um dente para o gânglio ventral do cérebro larval tornando a montagem mais fácil (etapa 1.3, Figura 1).
- Com um palito de dente, coloque uma pequena gota de cola em ambos os lados do dent e anexar uma vareta de tungstênio (0,125 mm de diâmetro, 6 a 7 mm de comprimento) para a colagem.
- Usando um pequeno pedaço de massa-como adesivo reutilizável, fazer uma parede circular (10 mm de diâmetro e 3 mm de altura) ao redor do dente (Figura 1).
Nota: O espaço dentro da parede será posteriormente preenchido com solução salina tamponada fosfato (PBS; 0,14 M NaCl, 0,0027 M KCl, 0,01 M PO4-3, pH 7,4 ± 0,05 a 25 ° C).
- Preparação de animais
Nota: Para a imagem latente de cálcio, um indicador de cálcio, GCaMP6s, é expressa no tipo de célula de interesse, que é comumente alcançado usando combinações de tecido-específica GAL4 e UAS-GCaMP6s. Para garantir que o sinal é mediado pelo receptor de candidato, GCaMP6s também é expresso em um mutante com defeito no receptor.- Quando comparações experimentais para genótipos diferentes tais como o tipo selvagem e mutantes são necessárias, larvas de teste de partida de idade para evitar GCaMP6 expressão nível de variações e diferenças fisiológicas devido aos estádios de desenvolvimento.
- Espantar moscas parentais (30 moscas para cada sexo) em um frasco de cultura contendo o padrão alimentar voar para 8 h permitir que a postura de ovos na superfície do alimento. Larvas de cultura de massa, sob um ciclo claro-escuro de 12-h em 25 ° C e 60-70% de umidade relativa.
- Dissecação do cérebro larval
- A 90-120 h após (AEL) de postura de ovos, coletar larvas e lavá-los pelo menos 3 vezes com água destilada para remover os resíduos de comida aderentes.
- Lugar uma larva em um vidro de relógio quadrado 1,5 polegadas cheio de gelo frio PBS.
Nota: Nas duas próximas etapas são realizadas neste vidro de relógio sob o microscópio de dissecação. - Use pinças para agarrar delicadamente o parte do meio da larva. Use outra pinça para agarrar os ganchos da boca e puxar os ganchos de boca suavemente para separar a parte anterior da larva que contém o cérebro do resto do corpo.
Nota: Como alternativa, uma tesoura cirúrgica pode ser usada. - Segure a ponta anterior por fórceps e virar do avesso a larva. Remova tecido externos conectado ao cérebro, como discos imaginária, corpos de gordura e glândula de anel. Suavemente separa o aparelho bucal do cérebro.
- Aplicam-se 200 µ l de PBS no interior do anel feito de massa de vidraceiro, como adesivo reutilizável na câmara de imagens. Chupar suavemente o cérebro dissecado com PBS para uma pipeta Pasteur e então transferi-lo para a câmara de imagem.
- Configuração do cérebro para a câmara de imagem
- Use a pinça para pegar fibras musculares, estendendo-se desde os gânglios ventrais. O cérebro suavemente Insira o dente debaixo do fio de tungstênio.
- Usando outra pinça, puxe o fio de tungstênio ligeiramente até colocar o cérebro na posição correta para a imagem (Figura 1).
2. aquisição de imagens de fluorescência do Ca2 +
Nota: Explantes cérebro imergidos em PBS são fotografadas usando um microscópio de fluorescência, equipado com uma lente objetiva de imersão de água de 20x (N.A. = 0,5). PBS não ativa as células do cérebro. Se forem necessárias imagens do eixo z, a lente objetiva é montada com um motor de lente piezoelétrico ativado. Uma cabeça confocal de disco giratório é usada para aumentar o tempo de resolução. Para a imagem latente de pouca luz, um elétron multiplicando o dispositivo de carga acoplada câmera é montado no microscópio. A imagem latente de fluorescência GCaMP6s (excitação/emissão: 488/509 nm) requer um laser de 488 nm para a excitação com um divisor de feixe dicroicas e um filtro de emissão (ex., 528 filtro de passa-banda de banda ± 38 nm).
- Coloque a câmara de imagem que contém o cérebro explante sob o microscópio.
- Baixe a lente objetiva até que toca a PBS. Sob a iluminação de campo claro, posicione o cérebro e trazê-lo em foco. Interruptor de luz fluorescente e ajustar o foco sobre as células GCaMP6s-rotulados.
Nota: A fluorescência verde basal do GCaMP6s deve ser visível. - Iniciar a aquisição de 250 ms/moldura em uma resolução de 512 × 512 pixels no modo Water-cooled, usando o software de aquisição apropriado (ex., µManager). Ajuste o tempo de exposição para obter valores de fluorescência dentro do intervalo dinâmico da câmera CCD, mas não inferior a 1000 (unidades arbitrárias), com imagens de 16 bits (0-65.535 de gama dinâmica).
Nota: Um tempo de exposição baixo deve ser usado para minimizar a foto-branqueamento do GCaMP6s. Tempo de exposição deve ser otimizado em cada experimento, pois depende dos níveis de expressão de GCaMP6 e a sensibilidade do sistema de detecção. Foi a 100 ms em nosso experimento usando dilp2 > GCaMP6s. Quando z-seções são necessárias para uma determinada profundidade de imagem, várias imagens de z-seção podem ser adquiridas dependendo os intervalos de tempo e quadro de exposição. Se a câmera tem suficiente resolução espacial, o tamanho binning (número de registros no chip que vai ser guardado em um pixel digital) deve ser aumentado para reduzir o tempo de exposição. - Uma vez que os parâmetros de imagem são determinados, com imagens para 1 min antes da administração de peptídeo para detectar intensidades de sinal de linha de base (F0).
- Aplicar o teste de peptídeo; para isso, dissolver 100 µ l de solução de peptídeo em PBS e pipetar isso diretamente para o banho larval para produzir uma concentração ideal.
Nota: A solução de peptídeo deve ser injetada lentamente (por exemplo, fluxo taxa 20 µ l/s) para a solução de banho com uma pipeta. Independente peptídeo sintético dissolvido em PBS é usado como um controle negativo. - Registro da emissão de GCaMP6s por alguns minutos.
3. análise de dados
Nota: Dados de imagem são analisados off-line com o ImageJ. Durante a lapso de tempo de imagem, pipetagem faz com que o cérebro larval mover. Portanto, aberrações posicionais das imagens seriais devem ser corrigidas antes da análise. A correção pode ser realizada usando um ImageJ plug-in, TurboReg da seguinte maneira.
- Abra o software de análise e usar o primeiro quadro (antes da aplicação do peptide) como uma imagem de referência.
- Selecione Plugins | Registo | TurboReg.
- Escolha o arquivo de imagem serial como a fonte e a imagem de referência como o alvo.
- Verifique Corpo rígido (paralelo deslocamento e rotação de imagens) e precisos ("Rápido" é grosseiro mas rápida análise em vez disso) para o método de processamento e qualidade, respectivamente.
- Clique em lotes para iniciar o processamento de imagem.
- Selecione várias regiões de interesse (ROIs) usando Analyze | Ferramentas | Gerente de ROI no ImageJ.
- Medir a intensidade do pixel clicando mais | Medida de multi | Okey na janela Gerenciador de ROI.
- Calcular ΔF/F0 = (F - F0) f0, onde F é a intensidade ROI no momento do estímulo, e F0 é a intensidade em uma janela de tempo imediatamente antes de um evento experimental particular (por exemplo, 30 frames precedendo o aparecimento de estímulo).
- Repita a experiência usando várias amostras de cérebro, realizando o tratamento estatístico para obter a média e o erro padrão da média (SEM) em cada ponto de tempo.
Resultados
Usando este protocolo, a ativação do cérebro células produtoras de insulina (IPCs) pelo hormônio peptídeo, CCHa2, foi examinada. IPCs do selvagem-tipo cérebro foram rotulados com GCaMP6s usando uma combinação de dilp2 -GAL412 (um presente do Dr. Rulifson) e UAS-GCaMP6s13 (um presente do Dr. Kim). Larval cérebro explantes foram tratados com um peptídeo sintético de CCHa2, e a fluorescência de GCaMP6s foi gravada em tempo real. Neste experimento, imagens foram obtidas a partir de um único plano focal. Cada cluster IPC contém cerca de 14 células14, e detectou sinais de 3 a 6 células. A intensidade do sinal de GCaMP6s foi aumentada dramaticamente após a administração de CCHa2 (Figura 2A, 1 filme). O cérebro do selvagem-tipo não mostrou uma resposta óbvia para Ghrelin ou Nociceptin (Movie 2 e 3, respectivamente), que são hormonas peptídicas mamíferos sem um homólogo de Drosophila . Estes resultados indicam que a ativação observada de IPCs por CCHa2 é uma resposta específica para CCHa2. Para esclarecer se CCHa2 atua através de CCHa2-R, a mesma análise foi feita utilizando cérebros mutantes CCHa2-R. Sem tal aumento da intensidade de sinal foi observado após a administração de CCHa2 nos cérebros mutantes (filme 4). A análise estatística mostrou que a diferença de intensidade do sinal entre o selvagem-tipo e cérebros mutantes CCHa2-R tornou-se significativo dentro de 2 min após a aplicação de CCHa2 e foi mantida pelo menos 7 min (Figura 2B). Estes resultados indicam que os IPCs especificamente são ativados por CCHa2 até CCHa2-R. Todos os peptídeos utilizados neste estudo foram diluídos pela PBS para produzir uma concentração final de 10-9 M.
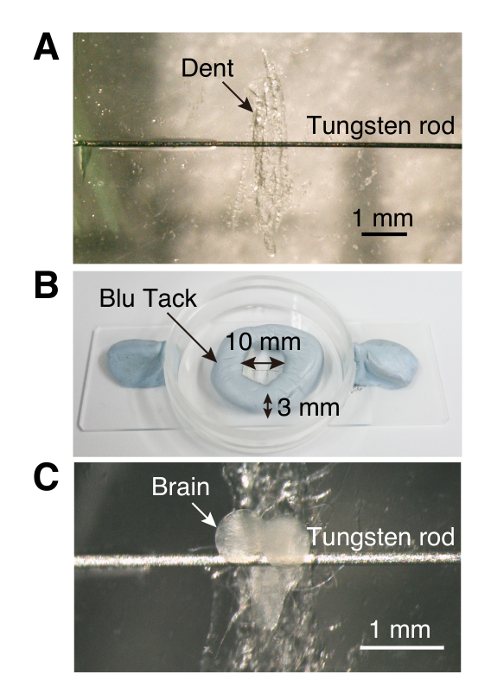
Figura 1 . Câmara de imagem
(A) cultura de prato (35 x 10 mm) com uma pequena amolgadela e amarrar a vara. (B) parede em forma de anel feita de massa de vidraceiro, como adesivos reutilizáveis. (C) um explante de cérebro larval inserido na câmara de imagens. Clique aqui para ver uma versão maior desta figura.
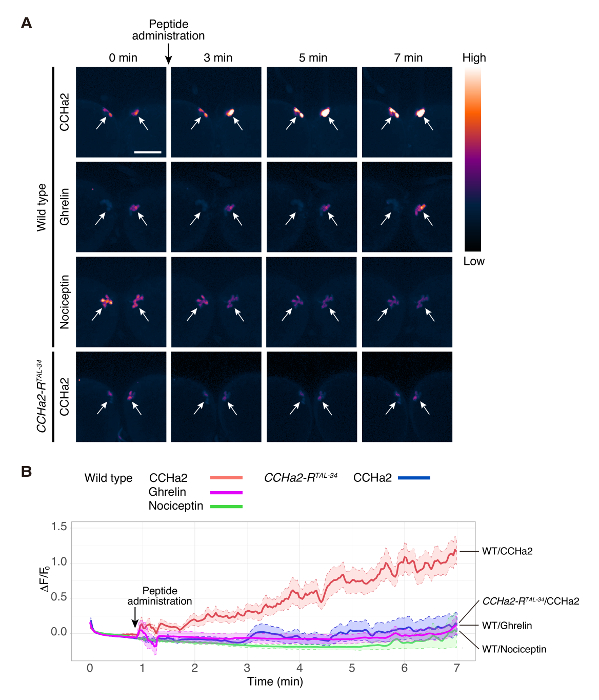
Figura 2 . Imagem de cálcio de explant o cérebro larval
Cérebro de selvagem-tipo (dilp2-Gal4/UAS-GCaMP6s) foi exposto a grelina, CCHa2 e Nociceptin. CCHa2-R mutante (dilp2-Gal4, CCHa2-RTAL-34/UAS-GCaMP6s, CCHa2-RTAL-34) cérebro estava exposto a CCHa2. GCaMP6s sinais no IPCs foram detectados por microscopia confocal no ms 250/quadro. Ainda imagens de pontos de tempo selecionado são mostradas em (A). As imagens foram pseudocolored para visualizar melhor a intensidades de sinal diferente. ΔF/F0 em cada ponto de tempo foi plotada em (B). ΔF/F0 foi calculado a partir de 5 para 10 diferentes preparações. ROIs estabeleceram-se em corpos celulares que foram detectados em um mesmo plano focal. As linhas sólidas indicam a média de 5 a 10 amostras e as linhas pontilhadas marcam limites superior e inferior do erro padrão da média. As áreas sombreadas indicam a variação dos sinais nos experimentos. Barra de escala indica 50 µm. A figura é uma adaptação de Sano et al . 15. clique aqui para ver uma versão maior desta figura.

Filme de 1. IPCs selvagem-tipo expostos a CCHa215 , por favor, clique aqui para ver este vídeo. (Botão direito do mouse para fazer o download.)

Filme 2. IPCs selvagem-tipo expostos a grelina15 , por favor, clique aqui para ver este vídeo. (Botão direito do mouse para fazer o download.)
Filme de 3. IPCs selvagem-tipo expostos a Nociceptin15 , por favor, clique aqui para ver este vídeo. (Botão direito do mouse para fazer o download.)

Filme 4. CCHa2-R mutante IPCs exposto a CCHa2 15 , por favor, clique aqui para ver este vídeo. (Botão direito do mouse para fazer o download.)
Discussão
O Ca2 + imagem método descrito aqui é um sistema útil para testar o funcionamento dos hormônios no cérebro. In vivo, o cérebro recebe hormônios de vários órgãos do sistema endócrino. Além disso, o cérebro constantemente vê crescente de informações sensoriais, que provoca a ativação neuronal espontânea. Este sistema ex vivo elimina tal ruído e produz uma relação sinal/ruído melhor do que na vivo de imagem. Neste sistema, as moléculas podem ser testadas isoladamente ou em combinação. Além de hormônios peptídicos, qualquer moléculas solúveis em água, incluindo compostos naturais ou sintéticos, podem ser aplicadas para o explante de cérebro.
Para imagens de Ca2 + , explantes cérebro precisam estar amarrados. Para este efeito, uma matriz de gel de agarose de ponto baixo ponto de fusão ou fibrina tem sido usado anteriormente16,17. Estas matrizes de gel podem segurar a amostra estàvel, no entanto, os tecidos são aquecidos em acima de 30 ° C. Esta temperatura provoca uma resposta de choque do calor em animais poiquilotérmicos como insetos. Para evitar o stress de calor, o cérebro poderia estar amarrado fisicamente. O cérebro ligado a cutícula são prendidos com insetos pinos18. Nosso método, usando um fio de tungstênio fornece simples e estável segurando da amostra. Este sistema é fácil de preparar e reutilizáveis e permite estimulantes para alcançar as células alvo mais facilmente em comparação com o método de incorporação de gel. Assim, isto será útil para o rastreio de ligante.
A escolha do indicador fluorescente depende do tipo de neurônios de destino, o tipo de receptores expressado em neurônio e as perguntas biológicas a ser tratadas. Uma série de variantes GCaMP6 otimizado para detectar vários temporal Ca2 + dinâmica tem sido gerado13. Em particular, GCaMP6 variantes diferem em sua cinética da resposta: GCaMP6s (lento), GCaMP6m (médio) e GCaMP6f (rápido). Os tempos de decaimento do GCaMP6s e 6m são relativamente lentos (i. e., τ1/2 após 10 potenciais de ação em uma preparação de fatias hippocampal) enquanto que para GCaMP6f é rápida (1/2 τ após 1 potencial de ação). Outros tipos de indicadores fluorescentes disponíveis para a atividade neural incluem arco voltaico (potencial de membrana)19,20,21, Synapto-pHluorin (liberação sináptica) e EPAC-acampamento (acampamento). Estes indicadores fluorescentes geneticamente codificados podem ser expressa em tipos de células específicas. Assim, o ex vivo sistema de imagem pode detectar várias respostas em neurônios desejados.
Existem várias etapas críticas neste protocolo. Tecidos em primeiro lugar, estranhos devem ser removidos do cérebro para obter uma imagem clara. O uso de Pinças afiadas e tesoura cirúrgica facilita o trabalho delicado. Em segundo lugar, o cérebro dissecado deve ser fixado em posição. Ocasionalmente, a amostra de cérebro ligeiramente move de pipetagem (o intervalo de aproximadamente 5 µm). Para evitar que o cérebro se mova, a altura do fio de tungstênio na câmara de imagens deve ser ajustada para o tamanho da amostra do cérebro. Alternativamente, pode ser instalado um sistema de alimentação de gravidade perfusão para estimulação delicada. Em terceiro lugar, os resultados das imagens do cérebro devem ser interpretados com cautela. O ligante aplicado ao cérebro pode estimular neurônios inesperados, que por sua vez, poderiam ativar os neurônios de alvo. Para detectar o efeito directo de um hormônio em neurônios específicos, o receptor deve ser batido para baixo no targetneurons. Neste caso, a expressão do indicador fluorescente pode ser combinada com o do receptor utilizando o sistema de Gal4/UAS de RNAi.
Uma limitação menor do presente protocolo é que a duração da imagem é limitada devido ao eventual dano da amostra do cérebro. Em nossas mãos, o cérebro de Drosophila pode ser fotografado para até aproximadamente 60 min usando este protocolo. Solução de hemolinfa-like, como HL3.1 salina22e intensidades do laser poderia permitir imagem a longo prazo. Além disso, a atual configuração de imagem não é adequada para estimulação repetitiva da mesma amostra. Para tais experiências, um banho de perfusão pode ser usado.
Finalmente, o presente protocolo tem várias aplicações. Modificando a imagem da câmara, o cérebro de um adulto e outros tecidos de drosófila ou os tecidos de outros animais podem ser fotografados. Em organismos não-modelo, a falta de ferramentas genéticas tornou difícil introduzir indicadores fluorescentes no genoma. No entanto, recentemente desenvolvidas técnicas de edição do genoma do CRISPR/Cas9 tem aberto a porta para a engenharia genética nestes animais. Assim, este protocolo pode ser usado para estudar a sinalização de órgão inter em uma grande variedade de animais.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi apoiado pelo Grants-in-Aid para pesquisa científica (15K 07147, 17K 07419) de JSPS (para Hiroshi Ishimoto, Hiroko Sano), uma bolsa de investigação Inamori Foundation (para HI) e o programa de centro de uso/pesquisa conjunta para medicina do desenvolvimento, em o Instituto de embriologia Molecular e genética, Universidade de Kumamoto (para HS). Agradecemos o Dr. Azusa Kamikouchi e Sr. Daichi Yamada por sua ajuda na utilização do sistema de imagem.
Materiais
| Name | Company | Catalog Number | Comments |
| Tungsten rod | A-M systems, Sequim, WA, USA | 717000 | |
| Blu Tack | Bostik, Paris, France | 3049100 | putty-like reusable adhesives |
| Watch glass, square, 1 5/8 in | Carolina Biological Supply Company, Burlington, NC, USA | 742300 | |
| PBS | TAKARA Bio Inc., Kusatsu, Shiga, Japan | T900 | Phosphated buffered salts |
| CCHa2 | SCRUM Inc., Tokyo, Japan | Custum-synthesized peptide | |
| Ghrerin | Peptide institute Inc., Osaka, Japan | 4372-s | |
| Nociceptin | Peptide institute Inc., Osaka, Japan | 4313-v | |
| Axio Imager A2 | Carl Zeiss, Oberkochen, Germany | Axio Imager A2 | fluorescence microscope |
| Objective W N-Achroplan 20x/0.5 M27 | Carl Zeiss, Oberkochen, Germany | 420957-9900-000 | water-immersion objective lens |
| P-725 PIFOC objective scanner with long travel range | Physik Instrumente GmbH & Co. KG, Karlsruhe, Germany | N/A | piezoelectric-activated lens mover |
| Confocal Scanner Unit CSU-W1 | Yokogawa Electric Corporation, Tokyo, Japan | CSU-W1 | spinning disc confocal head |
| ImagEM C9100-13 | Hamamatsu Photonics, Sizuoka, Japan | C9100-13 | EM-CCD camera |
| OBIS 488 nm LS 60 mW | Coherent, Santa Clara, CA, USA | 1178770 | 488-nm laser |
| 488/568/647 nm Yokogawa dichroic beamsplitter | Semrock, Rochester, NY, USA | Di01-T405/488/568/647-13x15x0.5 | dichroic beam splitter |
| 528/38 nm BrightLine single-band bandpass filter | Semrock, Rochester, NY, USA | FF01-528/38-25 | emission filter |
| µManager | Open Imaging, Inc. | N/A | https://micro-manager.org |
| ImageJ | U. S. National Institutes of Health | N/A | https://imagej.nih.gov/ij/ |
| TurboReg | Philippe Thévenaz, Biomediccal Imaging Group, Swiss Federal Institute of Technology Lausanne | N/A | http://bigwww.epfl.ch/thevenaz/turboreg/ |
Referências
- Morton, G. J., Schwartz, M. W. Leptin and the central nervous system control of glucose metabolism. Physiological Reviews. 91 (2), 389-411 (2011).
- Stanley, S., Wynne, K., McGowan, B., Bloom, S. Hormonal regulation of food intake. Physiological Reviews. 85 (4), 1131-1158 (2005).
- Goodman, W. G., Cusson, M. The juvenile hormones. Insect Endocrinology. Gilbert, L. I. , Academic Press. 310-365 (2012).
- Lafont, R., Dauphin-Villemant, C., Warren, J. T., Rees, H. Ecdysteroid chemistry and biochemistry. Insect Endocrinology. Gilbert, L. I. , Academic Press. 106-176 (2012).
- Smith, W., Rybczynski, R. Protothoracicotropic hormone. Insect Endocrinology. Gilbert, L. I. , Academic Press. 1-62 (2012).
- Claeys, I., et al. Insect neuropeptide and peptide hormone receptors: current knowledge and future directions. Vitamins and Hormones. 73, 217-282 (2005).
- Gade, G., Goldsworthy, G. J. Insect peptide hormones: a selective review of their physiology and potential application for pest control. Pest Management Science. 59 (10), 1063-1075 (2003).
- Adams, M. D., et al. The genome sequence of Drosophila melanogaster. Science. 287 (5461), 2185-2195 (2000).
- Park, D., Veenstra, J. A., Park, J. H., Taghert, P. H. Mapping peptidergic cells in Drosophila: where DIMM fits in. PLoS One. 3 (3), 1896(2008).
- Berridge, M. J. Inositol trisphosphate and calcium signalling. Nature. 361 (6410), 315-325 (1993).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nature Biotechnology. 19 (2), 137-141 (2001).
- Rulifson, E. J., Kim, S. K., Nusse, R. Ablation of insulin-producing neurons in flies: growth and diabetic phenotypes. Science. 296 (5570), 1118-1120 (2002).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Nassel, D. R., Kubrak, O. I., Liu, Y., Luo, J., Lushchak, O. V. Factors that regulate insulin producing cells and their output in Drosophila. Frontiers in Physiology. 4, 252(2013).
- Sano, H., et al. The Nutrient-Responsive Hormone CCHamide-2 Controls Growth by Regulating Insulin-like Peptides in the Brain of Drosophila melanogaster. PLoS Genetics. 11 (5), 1005209(2015).
- Tsao, C. K., Ku, H. Y., Lee, Y. M., Huang, Y. F., Sun, Y. H. Long Term Ex Vivo Culture and Live Imaging of Drosophila Larval Imaginal Discs. PLoS One. 11 (9), 0163744(2016).
- Sabado, V. aN., Nagoshi, E. Single-cell Resolution Fluorescence Live Imaging of Drosophila Circadian Clocks in Larval Brain Culture. Journal of Visualized Experiments. 131, e57015(2018).
- Apostolopoulou, A. A., et al. Caffeine Taste Signaling in Drosophila Larvae. Frontiers in Cellular Neuroscience. 10, 193(2016).
- Cao, G., et al. Genetically targeted optical electrophysiology in intact neural circuits. Cell. 154 (4), 904-913 (2013).
- Nikolaev, V. O., Bunemann, M., Hein, L., Hannawacker, A., Lohse, M. J. Novel single chain cAMP sensors for receptor-induced signal propagation. Journal of Biological Chemistry. 279 (36), 37215-37218 (2004).
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The use of pHluorins for optical measurements of presynaptic activity. Biophysical Journal. 79 (4), 2199-2208 (2000).
- Feng, Y., Ueda, A., Wu, C. F. A modified minimal hemolymph-like solution, HL3.1, for physiological recordings at the neuromuscular junctions of normal and mutant Drosophila larvae. Journal of Neurogenetics. 18 (2), 377-402 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados