Method Article
Ex Vivo Proyección de imagen de calcio para la visualización de las respuestas cerebrales a la señalización endocrina en Drosophila
En este artículo
Resumen
Este papel describe un protocolo para ex vivo calcio la proyección de imagen del cerebro de Drosophila . En este método, compuestos naturales o sintéticos pueden aplicarse en el búfer para poner a prueba su capacidad para activar las neuronas particular en el cerebro.
Resumen
Comunicación de órgano a órgano por la señalización endocrina, por ejemplo, de la periferia al cerebro, es esencial para mantener la homeostasis. Como un animal modelo para la investigación endocrina, Drosophila melanogaster, que cuenta con sofisticadas herramientas de genéticas y genoma información, se está utilizando cada vez más. Este artículo describe un método para la proyección de imagen de calcio de los explantes del cerebro de Drosophila . Este método permite la detección de la señalización directa de una hormona en el cerebro. Es bien sabido que muchas de las hormonas peptídicas actúan a través de G proteína-juntó los receptores (GPCRs), cuya activación provoca un aumento en la concentración de Ca2 +intracelular. Activación neural también eleva el Ca2 + los niveles intracelulares, de Ca2 + afluencia y la liberación de Ca2 + en el retículo endoplásmico (ER). Un sensor de calcio, GCaMP, puede controlar estos cambios de Ca2 + . En este método, GCaMP se expresa en las neuronas de interés, y el cerebro larvas GCaMP expresando es disecado y cultivado ex vivo. El péptido de la prueba se aplica a la explantación de cerebro, y los cambios fluorescentes en GCaMP se detectan utilizando un microscopio confocal de disco giratorio equipado con una cámara CCD. Usando este método, cualquier molécula soluble en agua puede ser probada, y varios eventos celulares asociados con la activación neural pueden ser reflejados mediante los indicadores fluorescentes apropiados. Por otra parte, mediante la modificación de la cámara de proyección de imagen, este método puede utilizarse para otros órganos de Drosophila o los órganos de otros animales de la imagen.
Introducción
Órgano de órgano de comunicación es una estrategia evolutivamente conservada para mantener la homeostasis para hacer frente a cambios ambientales. En los seres humanos, una variedad de arereleased de las hormonas de las glándulas endocrinas en la circulación. Muchas de estas hormonas objetivo el hipotálamo del cerebro, que regula los procesos metabólicos y conductas fundamentales como alimentación1,2. Se han descubierto muchas hormonas utilizando modelos de mamíferos. Sin embargo, los mecanismos de su acción, especialmente las redes interorgan en el que participan, siendo en gran parte confusos.
Drosophila melanogaster ha emergido como un modelo útil para estudiar la comunicación de órgano a órgano. En insectos, muchos procesos fisiológicos son controlados por hormonas. Los primeros estudios centrándose en el crecimiento y metamorfosis utilizan grandes insectos. En estos estudios, la extirpación o trasplante de órganos específicos predijo la existencia de moléculas de señalización entre órganos; más tarde, la ecdisona, la hormona juvenil (JH) y Prothoracicotropic hormona (PTTH) fueron purificada bioquímicamente3,4,5. Una gran familia de péptidos de señalización intercelulares se piensa para estar implicado en varios eventos fisiológicos durante el ciclo de vida de insectos6,7. La mayoría de estos péptidos actúa sobre G-proteína-juntó los receptores (GPCRs), aunque los GPCRs específicos fueron inicialmente difíciles de identificar utilizando métodos convencionales. La publicación de la Drosophila genoma secuencia8 fue el gran avance que permitió la identificación de péptidos bioactivos de Drosophila basado en su homología a las encontradas en otros insectos. Además, se identificaron los receptores para varios péptidos de GPCRs previstos en el genoma usando análisis de unión de ligando GPCR basada en cultivo celular. A continuación, análisis de expresión predijeron las vías de órgano a órgano sacadas por estos péptidos y receptores. En particular, muchos de los receptores de péptido putativo se expresan en el cerebro, lo que sugiere que el cerebro es un blanco importante de péptidos hormonas9. Por otra parte, las herramientas avanzadas de genéticas en Drosophila han contribuido a la identificación de roles fisiológicos de combinaciones de péptido GPCR. Por ejemplo, el GAL4 y sistemas binarios transcripcionales de LexA permiten knockdown de genes o sobreexpresión de forma espacial y temporal controlada. GAL4, un factor de la transcripción en levadura, se une a una secuencia específica de cis-regulador llamada secuencia de activación ascendente (UAS). En el sistema de GAL4/UAS, la línea del controlador proporciona tejidos específicos o expresión de GAL4 etapa-específica y la línea de respuesta lleva UAS corriente arriba del gen de interés o de la construcción en expresión de shRNAs en coche. LexA/LexAop sistema se basa en un mecanismo similar. Análisis fenotípicos de los animales de tejidos específicos péptido-caída y tejidos específicos GPCR-caída pueden revelar información sobre modo del GPCR péptido de señalización y sitio de acción. Sin embargo, las conclusiones que se pueden llegar únicamente por datos genéticos son limitadas. Por otra parte, una vez que el supuesto objetivo de una hormona peptídica particular es limitado a un tipo de tejido o célula, puede utilizarse para aclarar la comunicación de órgano a órgano mediada por péptidos GPCR signaling ex vivo calcio en explantes de órgano. La activación de un GPCR acoplado a Gq, se incrementa la concentración de Ca2 + intracelular debido a la liberación de Ca2 + de la ER10. En el cerebro, la activación neural también eleva los niveles de Ca2 + intracelulares. Tal Ca2 + aumenta puede detectarse mediante un sensor de calcio, GCaMP, que sufre cambios conformacionales en presencia de Ca2 + en fluorescencia emisión11.
En este artículo, se describe un calcio explantes método proyección de imagen del cerebro de Drosophila . Para probar la capacidad de un péptido para activar las neuronas específicas, un péptido de prueba se aplica al explante expresando su GCaMP cerebro, y cambios de fluorescencia son monitoreados mediante microscopía confocal. La participación de lo GPCR es confirmada luego por realizar el mismo análisis utilizando un cerebro mutante que carece el GPCR. Esta combinación de imágenes y genética proporciona información precisa acerca de órgano a órgano comunicación por péptidos-GPCRs. posibles modificaciones y aplicaciones de este protocolo también se discuten.
Protocolo
1. preparación de los explantes de cerebro larvas
- Hacer una cámara de proyección de imagen.
Nota: Grabación estable requiere que los explantes de cerebro ser atado. Aquí, se utiliza una cámara de bajo costo, hechas a mano en el Ca2 + sistema de imagen.- Con unas pinzas, rayar el centro inferior de una placa de cultivo de plástico (35 x 10 mm) para crear un hueco para el ganglio ventral del cerebro larvas que hace más fácil montaje (paso 1.3, figura 1).
- Con un palillo de dientes, coloque una pequeña gota de pegamento en cada lado de la abolladura y coloque una varilla de tungsteno (0,125 mm de diámetro, 6 a 7 mm de longitud) en el pegamento.
- Usando un pequeño pedazo de adhesivo reutilizable como masilla, hacer una pared circular (10 mm de diámetro y 3 mm de alto) alrededor de la abolladura (figura 1).
Nota: El espacio dentro de la pared se posteriormente llenará con tampón fosfato salino (PBS; 0,14 M de NaCl, KCl, de 0,0027 M 0.01 M PO43 -, pH 7,4 ± 0.05 a 25 ° C).
- Preparación de animales
Nota: Imagen de calcio, un indicador de calcio, GCaMP6s, se expresa en el tipo de la célula de interés, que normalmente se consigue mediante combinaciones de tejidos específicos GAL4 y UAS-GCaMP6s. Para asegurar que la señal está mediada por el receptor del candidato, GCaMP6s también se expresa en un mutante defectuoso en el receptor.- Cuando se requieren comparaciones experimentales para diferentes genotipos de tipo salvaje y mutantes, edad partido prueba de larvas para evitar variaciones de nivel de expresión GCaMP6 y diferencias fisiológicas debido a etapas de desarrollo.
- Mantener los padres moscas (30 moscas para cada sexo) en un frasco de cultivo que contienen alimentos mosca de 8 h permitir la puesta de huevos en la superficie de los alimentos. Larvas de cultura en masa bajo un ciclo de luz-oscuridad de 12 h a 25 ° C y 60-70% de humedad relativa.
- Disección del cerebro larvas
- En 90-120 h después de la postura (AEL), recoger las larvas y lavar por lo menos 3 veces con agua destilada para eliminar restos de alimentos adherentes.
- Lugar una larva en un vidrio de reloj de 1,5 pulgadas cuadrado lleno de PBS frío hielo.
Nota: Los dos pasos siguientes se realizan en este vidrio de reloj con el microscopio de disección. - Utilice pinzas para agarrar suavemente la parte media de la larva. Utilice otra pinza para agarrar los ganchos de la boca y tirar de los ganchos de la boca suavemente para separar la parte anterior de la larva que contiene el cerebro del resto del cuerpo.
Nota: Alternativamente, tijeras quirúrgicas pueden ser utilizados. - Sostenga la punta anterior por pinzas y vuelva la larva. Remover el tejido extraño conectado al cerebro, como los discos imaginales, cuerpos grasos y glándula del anillo. Separe suavemente el cerebro de las piezas bucales.
- Aplique 200 μL de PBS en el interior del anillo del masilla-como adhesivo reutilizable en la sala de proyección de imagen. Chupar suavemente el cerebro disecado con PBS en una pipeta Pasteur y transferirlo luego a la cámara de proyección de imagen.
- Configuración del cerebro en la cámara de imágenes
- Utilice pinzas para agarrar las fibras musculares que se extienden desde los ganglios ventrales. Inserte suavemente el cerebro en la abolladura debajo del alambre de tungsteno.
- Con otro fórceps, tire el alambre de tungsteno ligeramente hasta colocar el cerebro en la posición correcta para la proyección de imagen (figura 1).
2. adquisición de imágenes de fluorescencia de Ca2 +
Nota: Explantes cerebro inmersos en PBS son imágenes utilizando un microscopio de fluorescencia equipado con 20 X objetivo de inmersión en agua (N.A. = 0,5). PBS no activa las células en el cerebro. Si se necesitan imágenes de eje z, el objetivo está montado con un motor piezoeléctrico activado lente. Una cabeza confocal de disco giratorio se utiliza para mejorar el tiempo de resolución. Para la proyección de imagen con poca luz, un electrón multiplicando dispositivo acoplado de carga cámara se monta en el microscopio. La proyección de imagen de GCaMP6s fluorescencia (excitación/emisión: 488/509 nm) requiere un láser de 488 nm para la excitación con un divisor de haz dicroicos y un filtro de emisión (e.g., 528 filtro de paso de banda en banda ± 38 nm).
- Coloque la cámara imágenes que contiene el explante del cerebro bajo el microscopio.
- Bajar el objetivo hasta que toque el PBS. Bajo iluminación de campo claro, coloque el cerebro y ponerlo en foco. Interruptor para la luz fluorescente y ajuste el enfoque en las células GCaMP6s-labeled.
Nota: La fluorescencia verde basal de la GCaMP6s debe ser visible. - Iniciar adquisición en 250 ms/marco con una resolución de 512 × 512 píxeles en modo refrigerado por agua, utilizando el software de adquisición apropiados (por ej., µManager). Ajustar el tiempo de exposición para obtener los valores de fluorescencia dentro de la gama dinámica de la cámara, pero no inferior a 1000 (unidades arbitrarias), con imágenes de 16 bits (rango dinámico de 0-65.535).
Nota: Puede usarse un tiempo de exposición bajo para minimizar la foto-blanqueo de la GCaMP6s. Tiempo de exposición debe ser optimizado en cada experimento ya que depende de los niveles de expresión de GCaMP6 y la sensibilidad del sistema detector. Fue de 100 ms en nuestro experimento usando dilp2 > GCaMP6s. Cuando se requieren para una determinada profundidad imágenes z-secciones, varias imágenes de la sección de z pueden ser adquiridos según los intervalos de tiempo y el marco de la exposición. Si la cámara tiene suficiente resolución espacial, debe aumentarse el tamaño de binning (número de registros en el chip que se clasifica en un píxel digital) para reducir el tiempo de exposición. - Una vez que se determinan los parámetros de proyección de imagen, tomar imágenes durante 1 min antes de la administración del péptido para detectar intensidades de la señal de referencia (F0).
- Aplicar el prueba de péptido; para ello, disolver 100 μl de solución de péptido en PBS y pipetear directamente en el baño de larvas para dar una concentración óptima.
Nota: La solución del péptido debe inyectarse lentamente (p. ej., flujo tasa 20 μl/s) en la solución de baño mediante una pipeta. Péptido sintético sin relación disuelta en PBS se utiliza como control negativo. - Registro de la emisión de GCaMP6s por unos minutos.
3. Análisis de los datos
Nota: Proyección de imagen de datos es analizada sin conexión con el ImageJ. Durante la proyección de imagen de Time-lapse, pipeteo hace que el cerebro larvas para moverse. Por lo tanto, se deben corregir aberraciones posicionales de las serie imágenes antes del análisis. La corrección se puede realizar utilizando un plug-in, ImageJ TurboReg como sigue.
- Abra el software de análisis y utilizar el primer fotograma (antes de la aplicación de péptidos) como una imagen de referencia.
- Seleccione Plugins | Registro | TurboReg.
- Elija el archivo de imagen serial como la fuente y la imagen de referencia como destino.
- Compruebe, Cuerpo rígido (paralelo desplazamiento y rotación de imágenes) y precisa ("Rápido" es grueso pero un análisis rápido en lugar de otro) para el método de proceso y calidad, respectivamente.
- Haga clic en lote para iniciar el proceso de imagen.
- Seleccionar varias regiones de interés (ROIs) mediante analizar | Herramientas | ROI Manager en ImageJ.
- Medir la intensidad de los píxeles haciendo clic más | Multi medida | OK en la ventana Administrador de ROI.
- Calcular ΔF/F0 = (F - F0) / f0, donde F es la intensidad de retorno de la inversión en el momento del estímulo, y F0 es la intensidad en una ventana del tiempo inmediatamente antes de un evento experimental en particular (por ejemplo, 30 marcos anteriores a la Inicio del estímulo).
- Repetir el experimento utilizando múltiples muestras de cerebro, realizando procesamiento estadístico para obtener la media y error estándar de la media (SEM) en cada momento.
Resultados
Mediante este protocolo, la activación de la insulina produciendo las células del cerebro (IPCs) de la hormona del peptide, CCHa2, fue examinada. IPCs del cerebro de tipo salvaje fueron etiquetadas con GCaMP6s usando una combinación de dilp2 -GAL412 (un regalo del Dr. Rulifson) y UAS-GCaMP6s13 (un regalo del Dr. Kim). Explantes de cerebro larvas fueron tratados con un péptido sintético de CCHa2, y la fluorescencia de GCaMP6s fue grabada en tiempo real. En este experimento, se obtuvieron imágenes de un solo plano focal. Cada grupo IPC contiene alrededor de 14 células14, y se detectaron señales de 3 a 6 células. La intensidad de la señal de GCaMP6s fue aumentada con la administración de CCHa2 (figura 2A, 1 película). El cerebro de tipo salvaje no mostraron una respuesta obvia a la ghrelina o Nociceptin (películas 2 y 3, respectivamente), que son las hormonas peptídicas mamíferos sin un homólogo de Drosophila . Estos resultados indican que la activación observada del IPCs por CCHa2 es una respuesta específica a CCHa2. Para aclarar si CCHa2 actúa a través de CCHa2-R, el mismo análisis se realizó con cerebros mutantes CCHa2-R. No hay tal incremento en la intensidad de la señal fue observada después de la administración de CCHa2 en el cerebro mutante (Movie 4). El análisis estadístico demostró que la diferencia en intensidad de la señal entre el tipo salvaje y cerebros mutantes CCHa2-R se convirtió en significativa dentro de 2 minutos después de la aplicación de CCHa2 y se mantuvo por al menos 7 min (figura 2B). Estos resultados indican que IPCs son activados específicamente por CCHa2 por CCHa2-R. Todos los péptidos utilizados en este estudio se diluyeron por PBS para obtener una concentración final de 10-9 M.
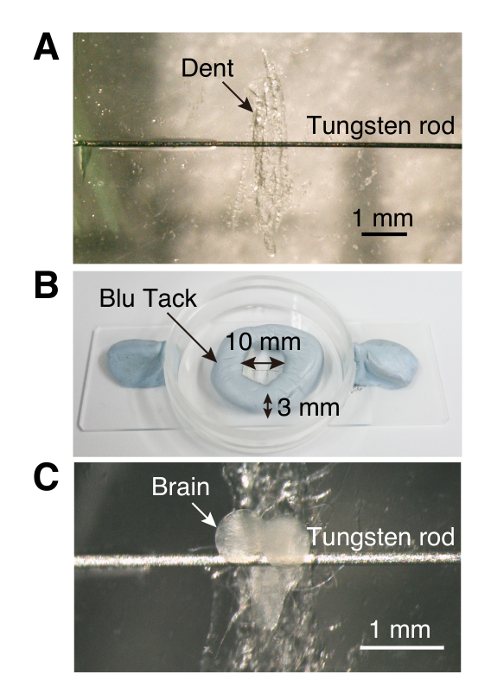
Figura 1 . Proyección de imagen de cámara
(A) la cultura plato (35 x 10 mm) con una pequeña abolladura y barra de tethering. (B) en forma de anillo pared hecha de masilla-como adhesivos reutilizables. (C) A explante de cerebro larvas insertada en la cámara de proyección de imagen. Haga clic aquí para ver una versión más grande de esta figura.
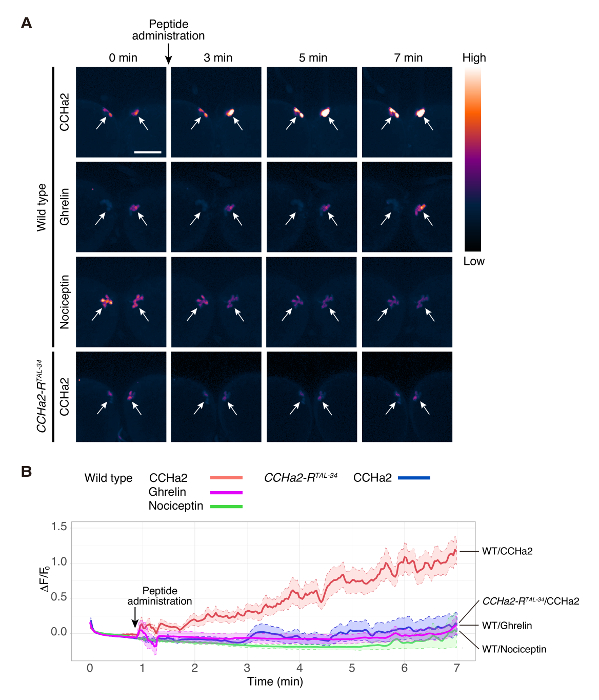
Figura 2 . Proyección de imagen de calcio de explante cerebro larvas
Cerebro de tipo salvaje (dilp2-Gal4/UAS-GCaMP6s) fue expuesto a Nociceptin, CCHa2 y ghrelina. CCHa2-R mutante (dilp2-Gal4, CCHa2-RTAL-34/UAS-GCaMP6s, CCHa2-RTAL-34) cerebro fue expuesto a CCHa2. GCaMP6s señales en IPCs fueron detectadas mediante microscopía confocal en el marco de ms de 250. Todavía imágenes de puntos de tiempo seleccionado se muestran en (A). Las imágenes fueron pseudocolored para visualizar mejor la intensidad de la señal. ΔF/F0 en cada momento fue trazada en (B). ΔF/F0 se calculó a partir 5 a 10 preparaciones diferentes. ROIs fueron fijados en los cuerpos celulares que fueron detectados en un mismo plano focal. Las líneas sólidas indican la media de 5 a 10 muestras, y las líneas punteadas marcan los límites superior e inferior del error estándar de la media. Las áreas sombreadas indican la variación de las señales en los experimentos. Barra de escala indica 50 μm. La figura es una adaptación de Sano et al. 15. haga clic aquí para ver una versión más grande de esta figura.

Película de 1. Tipo salvaje IPCs expuestos a CCHa215 por favor haga clic aquí para ver este video. (Clic derecho para descargar)

Película de 2. Tipo salvaje IPCs expuestos a ghrelina15 por favor haga clic aquí para ver este video. (Clic derecho para descargar)
Pelicula de 3. Tipo salvaje IPCs expuestos a Nociceptin15 por favor haga clic aquí para ver este video. (Clic derecho para descargar)

Movie 4. CCHa2-R mutante IPCs expuestos a CCHa2 15 por favor haga clic aquí para ver este video. (Clic derecho para descargar)
Discusión
El Ca2 + imagen método descrito aquí es un sistema útil para probar la función de las hormonas en el cerebro. En vivo, el cerebro recibe las hormonas de diferentes órganos endocrinos. Además, el cerebro percibe constantemente ascendente la información sensorial, que provoca la activación neuronal espontánea. Este sistema ex vivo elimina dichos sonidos y produce una mejor relación señal/ruido que en vivo la proyección de imagen. En este sistema, las moléculas pueden analizarse por separado o en combinación. Además de las hormonas peptídicas, cualquier moléculas solubles en agua, incluyendo compuestos naturales o sintéticos, se pueden aplicar al explante del cerebro.
De Ca2 + proyección de imagen, explantes cerebro deban estar atado. Para ello, una matriz de gel de agarosa de punto de bajo punto de fusión o de fibrina ha sido utilizado previamente16,17. Estas matrices de gel pueden contener la muestra estable, sin embargo, los tejidos se calientan en encima de 30 ° C. Esta temperatura provoca una respuesta de shock térmico en poiquilotérmicas animales como insectos. Para evitar el estrés por calor, el cerebro podría ser atado físicamente. El cerebro a la cutícula se sujetan con pernos insectos18. Nuestro método usando un alambre de tungsteno ofrece simple y estable de la muestra. Este sistema es reutilizable y fácil de preparar y permite estimulantes llegar a las células blanco más fácilmente en comparación con el gel de incrustación método. Por lo tanto, esto será útil para la detección del ligando.
La elección del indicador fluorescente depende del tipo de neuronas de destino, el tipo de receptores en la neurona y las preguntas biológicas están abordadas. Una serie de variantes de GCaMP6 optimizado para la detección de varios temporal Ca2 + dinámica ha sido generado13. En particular, GCaMP6 las variantes difieren en su cinética de la respuesta: GCaMP6s (lento), GCaMP6m (medio) y GCaMP6f (rápido). Los tiempos de decaimiento de GCaMP6s y 6m son relativamente lentos (es decir., τ1/2 después de 10 potenciales de acción en una preparación de hippocampal rebanada) mientras que para GCaMP6f es rápido (τ1/2 después de 1 potencial de acción). Otros tipos de indicadores fluorescentes disponibles para la actividad de los nervios son EPAC-campamento (cAMP), Synapto-pHluorin (liberación sináptica) y ArcLight (potencial de membrana)19,20,21. Estos indicadores fluorescentes genéticamente codificados se pueden expresar en tipos celulares específicos. Por lo tanto, el ex vivo sistema de imagen puede detectar varias respuestas en las neuronas deseadas.
Hay varios pasos críticos en este protocolo. Primeros, extraños tejidos deben quitarse el cerebro para obtener una imagen clara. El uso de pinzas afiladas y tijeras quirúrgicas facilita el trabajo delicado. En segundo lugar, el cerebro disecado se fijarán en su posición. En ocasiones, la muestra de cerebro se mueve ligeramente de pipeteo (la gama aproximadamente 5 μm). Para evitar que el cerebro se mueva, debe ajustarse la altura del alambre de tungsteno en la sala de proyección de imagen para el tamaño de la muestra de cerebro. Alternativamente, se podría instalar un sistema de perfusión de gravedad para la estimulación suave. En tercer lugar, los resultados de la proyección de imagen del cerebro deben ser interpretados con precaución. El ligando aplicado al cerebro podría estimular neuronas inesperadas, que a su vez pueden activar las neuronas de destino. Para detectar el efecto directo de una hormona en neuronas específicas, el receptor debe ser derribado en el targetneurons. En este caso, la expresión del indicador fluorescente puede combinarse con la del receptor de la RNAi usando el sistema de Gal4/UAS.
Una limitación menor de este protocolo es que la duración de la proyección de imagen es limitada debido a los daños de la muestra de cerebro. En nuestras manos, el cerebro de Drosophila puede ser reflejado para hasta aproximadamente 60 min utilizando este protocolo. Hemolinfa-como solución, como HL3.1 salina22intensidades láser podría permitir la proyección de imagen a largo plazo. Además, la configuración actual de la proyección de imagen no es adecuada para la estimulación repetitiva de la misma muestra. Para tales experimentos, podría utilizarse un baño de perfusión.
Por último, este protocolo tiene varios usos. Mediante la modificación de la cámara de proyección de imagen, el cerebro adulto y otros tejidos de Drosophila o los tejidos de otros animales podrían ser reflejados. En organismos no-modelo, la carencia de herramientas genéticas ha hecho difícil introducir indicadores fluorescentes en el genoma. Sin embargo, recientemente desarrollado CRISPR/Cas9 genoma edición técnicas han abierto la puerta a la ingeniería genética en estos animales. Así, este protocolo podría ser utilizado para estudiar entre órganos de señalización en una amplia gama de animales.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por subvenciones para la investigación científica (15 07147 K, 17K 07419) de JSP (a Hiroshi Ishimoto, Hiroko Sano), una beca de investigación Fundación de Inamori (para HI) y el programa del centro de investigación uso común para la medicina del desarrollo, en el Instituto de embriología Molecular y genética, Universidad de Kumamoto (en HS). Agradecemos Dr. Azusa Kamikouchi y Sr. Daichi Yamada su ayuda para usar el sistema de proyección de imagen.
Materiales
| Name | Company | Catalog Number | Comments |
| Tungsten rod | A-M systems, Sequim, WA, USA | 717000 | |
| Blu Tack | Bostik, Paris, France | 3049100 | putty-like reusable adhesives |
| Watch glass, square, 1 5/8 in | Carolina Biological Supply Company, Burlington, NC, USA | 742300 | |
| PBS | TAKARA Bio Inc., Kusatsu, Shiga, Japan | T900 | Phosphated buffered salts |
| CCHa2 | SCRUM Inc., Tokyo, Japan | Custum-synthesized peptide | |
| Ghrerin | Peptide institute Inc., Osaka, Japan | 4372-s | |
| Nociceptin | Peptide institute Inc., Osaka, Japan | 4313-v | |
| Axio Imager A2 | Carl Zeiss, Oberkochen, Germany | Axio Imager A2 | fluorescence microscope |
| Objective W N-Achroplan 20x/0.5 M27 | Carl Zeiss, Oberkochen, Germany | 420957-9900-000 | water-immersion objective lens |
| P-725 PIFOC objective scanner with long travel range | Physik Instrumente GmbH & Co. KG, Karlsruhe, Germany | N/A | piezoelectric-activated lens mover |
| Confocal Scanner Unit CSU-W1 | Yokogawa Electric Corporation, Tokyo, Japan | CSU-W1 | spinning disc confocal head |
| ImagEM C9100-13 | Hamamatsu Photonics, Sizuoka, Japan | C9100-13 | EM-CCD camera |
| OBIS 488 nm LS 60 mW | Coherent, Santa Clara, CA, USA | 1178770 | 488-nm laser |
| 488/568/647 nm Yokogawa dichroic beamsplitter | Semrock, Rochester, NY, USA | Di01-T405/488/568/647-13x15x0.5 | dichroic beam splitter |
| 528/38 nm BrightLine single-band bandpass filter | Semrock, Rochester, NY, USA | FF01-528/38-25 | emission filter |
| µManager | Open Imaging, Inc. | N/A | https://micro-manager.org |
| ImageJ | U. S. National Institutes of Health | N/A | https://imagej.nih.gov/ij/ |
| TurboReg | Philippe Thévenaz, Biomediccal Imaging Group, Swiss Federal Institute of Technology Lausanne | N/A | http://bigwww.epfl.ch/thevenaz/turboreg/ |
Referencias
- Morton, G. J., Schwartz, M. W. Leptin and the central nervous system control of glucose metabolism. Physiological Reviews. 91 (2), 389-411 (2011).
- Stanley, S., Wynne, K., McGowan, B., Bloom, S. Hormonal regulation of food intake. Physiological Reviews. 85 (4), 1131-1158 (2005).
- Goodman, W. G., Cusson, M. The juvenile hormones. Insect Endocrinology. Gilbert, L. I. , Academic Press. 310-365 (2012).
- Lafont, R., Dauphin-Villemant, C., Warren, J. T., Rees, H. Ecdysteroid chemistry and biochemistry. Insect Endocrinology. Gilbert, L. I. , Academic Press. 106-176 (2012).
- Smith, W., Rybczynski, R. Protothoracicotropic hormone. Insect Endocrinology. Gilbert, L. I. , Academic Press. 1-62 (2012).
- Claeys, I., et al. Insect neuropeptide and peptide hormone receptors: current knowledge and future directions. Vitamins and Hormones. 73, 217-282 (2005).
- Gade, G., Goldsworthy, G. J. Insect peptide hormones: a selective review of their physiology and potential application for pest control. Pest Management Science. 59 (10), 1063-1075 (2003).
- Adams, M. D., et al. The genome sequence of Drosophila melanogaster. Science. 287 (5461), 2185-2195 (2000).
- Park, D., Veenstra, J. A., Park, J. H., Taghert, P. H. Mapping peptidergic cells in Drosophila: where DIMM fits in. PLoS One. 3 (3), 1896(2008).
- Berridge, M. J. Inositol trisphosphate and calcium signalling. Nature. 361 (6410), 315-325 (1993).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nature Biotechnology. 19 (2), 137-141 (2001).
- Rulifson, E. J., Kim, S. K., Nusse, R. Ablation of insulin-producing neurons in flies: growth and diabetic phenotypes. Science. 296 (5570), 1118-1120 (2002).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Nassel, D. R., Kubrak, O. I., Liu, Y., Luo, J., Lushchak, O. V. Factors that regulate insulin producing cells and their output in Drosophila. Frontiers in Physiology. 4, 252(2013).
- Sano, H., et al. The Nutrient-Responsive Hormone CCHamide-2 Controls Growth by Regulating Insulin-like Peptides in the Brain of Drosophila melanogaster. PLoS Genetics. 11 (5), 1005209(2015).
- Tsao, C. K., Ku, H. Y., Lee, Y. M., Huang, Y. F., Sun, Y. H. Long Term Ex Vivo Culture and Live Imaging of Drosophila Larval Imaginal Discs. PLoS One. 11 (9), 0163744(2016).
- Sabado, V. aN., Nagoshi, E. Single-cell Resolution Fluorescence Live Imaging of Drosophila Circadian Clocks in Larval Brain Culture. Journal of Visualized Experiments. 131, e57015(2018).
- Apostolopoulou, A. A., et al. Caffeine Taste Signaling in Drosophila Larvae. Frontiers in Cellular Neuroscience. 10, 193(2016).
- Cao, G., et al. Genetically targeted optical electrophysiology in intact neural circuits. Cell. 154 (4), 904-913 (2013).
- Nikolaev, V. O., Bunemann, M., Hein, L., Hannawacker, A., Lohse, M. J. Novel single chain cAMP sensors for receptor-induced signal propagation. Journal of Biological Chemistry. 279 (36), 37215-37218 (2004).
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The use of pHluorins for optical measurements of presynaptic activity. Biophysical Journal. 79 (4), 2199-2208 (2000).
- Feng, Y., Ueda, A., Wu, C. F. A modified minimal hemolymph-like solution, HL3.1, for physiological recordings at the neuromuscular junctions of normal and mutant Drosophila larvae. Journal of Neurogenetics. 18 (2), 377-402 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados