Method Article
السابقين فيفو تصوير الكالسيوم لتصور استجابات الدماغ للإشارات الغدد الصماء في المورفولوجية
In This Article
Summary
وتصف هذه الورقة وضع بروتوكول السابقين فيفو تصوير الكالسيوم الدماغ المورفولوجية . باستخدام هذا الأسلوب، يمكن تطبيق المركبات الطبيعية أو الاصطناعية إلى المخزن المؤقت لاختبار قدرتها على تنشيط معينة من الخلايا العصبية في الدماغ.
Abstract
الجهاز على الجهاز الاتصال بالإشارات الغدد الصماء، على سبيل المثال، من العالم الخارجي إلى الدماغ، ضروري للحفاظ على التوازن. كحيوان نموذج لأبحاث الغدد الصماء، يتزايد استخدام melanogaster المورفولوجية، الذي قد متطورة أدوات الجينية ومعلومات الجينوم،. توضح هذه المقالة طريقة لتصوير الكالسيوم explants الدماغ المورفولوجية . هذا الأسلوب يتيح الكشف عن الإشارات المباشرة هرمون في الدماغ. فمن المعروف جيدا أن العديد من الببتيد الهرمونات تعمل عن طريق مستقبلات إلى جانب البروتين G (جبكرس)، التنشيط الذي يؤدي إلى زيادة تركيز Ca2 +داخل الخلايا. كما يرفع التنشيط العصبية داخل الخلايا Ca2 + مستويات، من Ca2 + تدفق وإصدار Ca2 + مخزنة في هيولى (ER). جهاز استشعار كالسيوم، جكامب، ويمكن رصد هذه Ca2 + التغييرات. في هذا الأسلوب، يتم التعبير عن جكامب في الخلايا العصبية للفائدة، وتشريح الدماغ اليرقات الإعراب عن جكامب ومثقف السابقين فيفو. ثم يتم تطبيق اختبار الببتيد ل explant الدماغ، وتم الكشف عن التغييرات الفلورسنت في جكامب استخدام مجهر [كنفوكل] قرص غزل مزودة بكاميرا CCD. باستخدام هذا الأسلوب، يمكن أن يكون اختبار أي جزيء للذوبان في الماء، ومختلف الأحداث الخلوية المرتبطة بالتنشيط العصبية يمكن تصويرها باستخدام المؤشرات المناسبة الفلورسنت. وعلاوة على ذلك، عن طريق تعديل قاعة التصوير، يمكن استخدام هذا الأسلوب الصورة المورفولوجية الأجهزة الأخرى أو أجهزة الحيوانات الأخرى.
Introduction
الاتصالات الجهاز للجهاز استراتيجية تقحم مصانة للحفاظ على التوازن التأقلم مع التغيرات البيئية. في البشر، ومجموعة متنوعة من أريريلياسيد الهرمونات من الغدد الصماء إلى الدورة الدموية. العديد من هذه الهرمونات المستهدفة تحت المهاد الدماغ، والذي ينظم عمليات الأيض والسلوكيات الأساسية مثل التغذية1،2. تم اكتشاف العديد من الهرمونات باستخدام نماذج الثدييات. ومع ذلك، آليات عملها، لا سيما شبكات إينتيرورجان التي تشارك فيها، لا تزال غير واضحة إلى حد كبير.
وبرز melanogaster المورفولوجية نموذجا مفيداً لدراسة الاتصالات الجهاز إلى الجهاز. في الحشرات، يتم التحكم في العديد من العمليات الفسيولوجية بالهرمونات. أوائل الدراسات التي تركز على النمو والتحول تستخدم الحشرات الكبيرة. في هذه الدراسات، لإزالة أو زرع الأعضاء محددة وتوقع وجود جزيئات إشارات الجهاز بين الوكالات؛ في وقت لاحق، كانت الأحداث هرمون (جون) وهرمون بروثوراسيكوتروبيك (بتث) و Ecdysone المتحلل المنقي3،،من45. ويعتقد عائلة كبيرة من الببتيدات إرسال الإشارات بين الخلايا للمشاركة في مختلف الأحداث الفسيولوجية أثناء دورة حياة الحشرات6،7. معظم هذه الببتيدات قانون إلى جانب البروتين ز مستقبلات (جبكرس)، على الرغم من أن جبكرس محددة كانت صعبة في البداية لتحديد استخدام النهج التقليدية. وكان المنشور المورفولوجية لتسلسل الجينوم كله8 الانطلاقة التي مكنت من تحديد هوية الببتيدات النشطة بيولوجيا المورفولوجية استناداً على التماثل لتلك الموجودة في غيرها من الحشرات. وبالإضافة إلى ذلك، تم تحديد المستقبلات لعدة الببتيدات من جبكرس وتوقع في الجينوم باستخدام فحوصات ملزمة GPCR-يجند خلية-المستندة إلى الثقافة. المقبل، وتعبير تحاليل توقع مسارات الجهاز إلى الجهاز وأثارت هذه الببتيدات والمستقبلات. جدير بالذكر أن العديد من مستقبلات الببتيد المفترضة مبينة في الدماغ، مما يدل على أن الدماغ هدفا رئيسيا ل الهرمونات الببتيد9. وعلاوة على ذلك، أسهمت الأدوات الوراثية المتقدمة في المورفولوجية لتحديد الأدوار الفيزيولوجية لتركيبات GPCR الببتيد. على سبيل المثال، GAL4، ونظم النسخي ثنائي المستندة إلى ليزا تمكين الجينات ضربة قاضية أو overexpression بطريقة منضبطة مكانياً وزمنياً. GAL4، عامل نسخ المحددة في الخميرة، ربط تسلسل رابطة الدول المستقلة-تنظيمية محددة تسمى التسلسل التنشيط المنبع (UAS). في النظام GAL4/UAS، يوفر سطر برنامج التشغيل الخاصة بالانسجة أو الخاصة بمرحلة GAL4 التعبير والخط المستجيب يحمل UAS المنبع من الجينات من الفائدة أو البناء على محرك الأقراص شرنا التعبير. ويستند نظام ليزا/ليكساوب إليه مماثلة. تحليلات المظهرية الخاصة بالانسجة الببتيد-ضربة قاضية والأنسجة على حدة ضربة قاضية GPCR الحيوانات يمكن أن تكشف عن معلومات حول وضع إشارات GPCR الببتيد وموقع العمل. ومع ذلك، تقتصر الاستنتاجات التي يمكن الوصول إليها فقط عن طريق البيانات الوراثية. من ناحية أخرى، مرة واحدة هو تضييق نطاق الهدف المفترضة لهرمون الببتيد خاصة لنوع النسيج أو الخلية، يمكن استخدام السابقين فيفو الكالسيوم التصوير في اكسبلانتس الجهاز لتوضيح الاتصالات الجهاز إلى الجهاز بإشارة هضميد-GPCR وساطة. عند التنشيط هذه العملية إلى جانب Gq، هو زيادة Ca2 + تركيز داخل الخلايا نتيجة إطلاق Ca2 + من أية10. في الدماغ، ويرفع التنشيط العصبية أيضا Ca2 + مستويات داخل الخلايا. ويمكن الكشف عن هذه Ca2 + الزيادات بجهاز استشعار كالسيوم، جكامب، الذي يخضع لتغيرات conformational حضور Ca2 + الناتج في الأسفار الانبعاثات11.
في هذه المقالة، يتم وصف كالسيوم طريقة التصوير باستخدام الدماغ المورفولوجية explants. لاختبار قدرة الببتيد لتنشيط الخلايا العصبية المحددة، يتم تطبيق ببتيد اختبار explant الدماغ معربا عن جكامب، والأسفار التغييرات تتم مراقبتها بواسطة الفحص المجهري [كنفوكل]. وتؤكد مشاركة هذه العملية ثم إجراء المقايسة نفس دماغ المسخ التي تفتقر إلى هذه العملية استخدام. هذا المزيج من التصوير وعلم الوراثة يوفر معلومات دقيقة عن الجهاز لجهاز الاتصالات من الببتيدات-جبكرس-إمكانية إجراء تعديلات وتطبيقات لهذا البروتوكول وتناقش أيضا.
Protocol
1-إعداد Explants الدماغ اليرقات
- جعل دائرة لتصوير.
ملاحظة: تسجيل مستقر يتطلب أن تكون مربوطة اكسبلانتس الدماغ. هنا، يستخدم دائرة تصوير منخفضة التكلفة ويدوية الصنع Ca2 + نظام التصوير.- استخدام الملقط، خدش أسفل وسط صحن الثقافة البلاستيكية (35 مم × 10 مم) لإنشاء دنت للعقدة البطني للدماغ اليرقات مما يجعل تركيب أسهل (الخطوة 1-3، الشكل 1).
- مع مسواك، ضع قطره صغيرة من superglue على جانبي دنت وإرفاق قضيب تنغستن (0.125 مم، وطول 6 إلى 7 ملم) الغراء.
- باستخدام قطعة صغيرة من المعجون مثل لاصقة قابلة لإعادة الاستخدام، جعل جدار دائري (10 ملم وقطرها 3 مم ارتفاع) المحيطة دنت (الشكل 1).
ملاحظة: المساحة داخل الجدار ستكون في وقت لاحق مليئة الفوسفات مخزنة المالحة (برنامج تلفزيوني؛ 0.14 "م كلوريد الصوديوم"، 0.0027 م بوكل، 0.01 M PO43-, درجة الحموضة 7.4 ± 0.05 عند 25 درجة مئوية).
- إعداد الحيوانات
ملاحظة: لتصوير الكالسيوم، أعرب مؤشر كالسيوم، GCaMP6s، في الخلية نوع من الفائدة، الذي يتحقق عادة باستخدام تركيبات من GAL4 و UAS GCaMP6sالخاصة بالانسجة. للتأكد من أن الإشارة هي وساطة عن طريق مستقبلات المرشح، هو أعرب أيضا عن GCaMP6s في متحولة معيبة في المستقبلات.- عندما يتطلب الأمر المقارنات التجريبية للأنماط الجينية المختلفة مثل نوع البرية وطفرات، اليرقات اختبار مباراة العمر لتجنب التعبير GCaMP6 مستوى التباينات والاختلافات الفسيولوجية نتيجة لمراحل النمو.
- يبقى الذباب الأبوية (الذباب 30 لكل جنس من الجنسين) في قنينة ثقافة التي تحتوي على الأغذية يطير القياسية من أجل ح 8 للسماح بوضع البيض على سطح الطعام. الثقافة اليرقات في كتلة تحت دائرة الضوء الظلام 12-ح في 25 درجة مئوية و 60-70% رطوبة نسبية.
- تشريح الدماغ اليرقات
- 90-120 ح بعد بيضة زرع (AEL)، جمع اليرقات وغسلها على الأقل 3 مرات بالماء المقطر لإزالة بقايا الطعام ملتصقة.
- مكان يرقة على زجاج يشاهد 1.5 بوصة مربعة مليئة بالجليد الباردة برنامج تلفزيوني.
ملاحظة: تنفذ الخطوات التالية اثنين في هذا الزجاج يشاهد تحت مجهر تشريح. - استخدام الملقط بلطف الاستيلاء على الجزء الأوسط من اليرقة. استخدام الملقط آخر لانتزاع هوكس الفم وسحب خطاطيف الفم بلطف لفصل الجزء الأمامي من اليرقة التي تحتوي على الدماغ من بقية الجسم.
ملاحظة: بدلاً من ذلك، المقص الجراحي يمكن استخدامها. - اضغط الحافة الأمامية بالملقط وتتحول اليرقة الداخل إلى الخارج. إزالة أنسجة دخيلة يعلق على الدماغ، مثل أقراص إيماجينال والهيئات الدهون والغدة الدائري. بلطف منفصلاً في الدماغ فمها.
- تطبيق 200 ميليلتر من برنامج تلفزيوني إلى داخل الحلبة من مثل المعجون لاصقة قابلة لإعادة الاستخدام في قاعة التصوير. تمتص بلطف تشريح الدماغ مع برنامج تلفزيوني في ماصة باستور، وثم نقلها إلى غرفة التصوير.
- وضع الدماغ في غرفة التصوير
- استخدام الملقط للاستيلاء على ألياف العضلات التي تمتد من ganglia البطني. إدراج الدماغ بلطف إلى دنت تحت سلك التنغستن.
- استخدام الملقط آخر، مكان سحب سلك التنغستن طفيفة تصل إلى الدماغ في الموضع الصحيح للتصوير (الشكل 1).
2-الحصول على صور Ca2 + الأسفار
ملاحظة: explants الدماغ منغمسين في برنامج تلفزيوني يتم تصويرها باستخدام مجهر الأسفار مجهزة من 20 X عدسة الهدف غمر المياه (N.A. = 0.5). برنامج تلفزيوني لم بتنشيط الخلايا في الدماغ. إذا كانت هناك حاجة إلى محور ع الصور، هي التي شنت عدسة الهدف مع محرك كهرضغطية المنشط عدسة. رأس [كنفوكل] قرص غزل يستخدم لتعزيز القرار الوقت. للتصوير بالإضاءة المنخفضة، شنت إلكترون ضرب جهاز الكاميرا على المجهر. تصوير GCaMP6s الفلورية (الإثارة/الانبعاثات: 488/509 نانومتر) يتطلب ليزر 488 نانومتر للإثارة مع مقسم شعاع مزدوج اللون وعامل تصفية انبعاثات (مثلاً.، 528 ± 38 نانومتر باند ممر الموجه مرشح).
- المكان قاعة التصوير التي تحتوي على explant الدماغ تحت المجهر.
- أقل عدسة الهدف حتى أنه يمس برنامج تلفزيوني. تحت إضاءة ساطعة الميدانية، ضع الدماغ ووضعها موضع التركيز. قم بالتبديل إلى ضوء الفلورسنت وضبط التركيز على الخلايا المسماة GCaMP6s.
ملاحظة: يجب أن تكون مرئية الفلورية الخضراء القاعدية GCaMP6s. - بدء الحصول على 250 ms/الإطار بدقة 512 × 512 بكسل في وضع المياه المبردة باستخدام البرمجيات المناسبة اقتناء (مثلاً., µManager). ضبط وقت التعرض الحصول على قيم الأسفار داخل النطاق الديناميكي للكاميرا CCD، ولكن ليس أقل من 1000 (وحدات التعسفي)، مع الصور 16-بت (النطاق الديناميكي 0-65,535).
ملاحظة: يجب استخدام وقت تعرض منخفضة للتقليل من تبييض الصورة من GCaMP6s. ينبغي أن يكون الأمثل وقت التعرض في كل التجربة كما أنه يعتمد على مستويات التعبير GCaMP6 وحساسية نظام الكشف. كان 100 مللي ثانية في لنا التجربة باستخدام dilp2 > GCaMP6s- عندما يتطلب الأمر لعمق تصوير معطى z-المقاطع، يمكن الحصول على عدة z-قسم الصور اعتماداً على الفواصل الزمنية والإطار التعرض. إذا كانت الكاميرا قد يكفي القرار المكانية، ينبغي زيادة حجم بينينج (عدد السجلات على الرقاقة التي سيتم إهمال في واحد بكسل الرقمية) لتقليل زمن التعرض. - حالما يتم تحديد معلمات التصوير، تلتقط صوراً لمدة 1 دقيقة قبل الإدارة الببتيد للكشف عن كثافة إشارة خط الأساس (و0).
- تطبيق الببتيد الاختبار؛ لهذا، حل 100 ميليلتر من الببتيد الحل في برنامج تلفزيوني و "الماصة؛" فإنه مباشرة في حمام اليرقات تؤتي بتركيز أمثل.
ملاحظة: ينبغي حقن محلول الببتيد ببطء (مثلاً، تدفق معدل 20 ميليلتر/s) في حمام الحل باستخدام ماصة. الببتيد الاصطناعية لا علاقة لها حل في برنامج تلفزيوني كعنصر سلبي. - سجل انبعاث GCaMP6s لبضع دقائق.
3-بيانات التحليل
ملاحظة: يتم تحليل بيانات التصوير بدون اتصال مع إيماجيج. خلال الوقت الفاصل بين التصوير، يسبب بيبيتينج الدماغ اليرقات للتحرك. ولذلك، ينبغي تصحيح الانحرافات الموضعية للصور المسلسل قبل التحليل. يمكن إجراء التصحيح باستخدام المكونات الإضافية، إيماجيج توربوريج كما يلي.
- فتح برنامج تحليل واستخدام الإطار الأول (قبل تطبيق الببتيد) كصورة مرجعية.
- حدد الإضافات | التسجيل | توربوريج.
- اختر ملف الصورة المسلسل مصدر ومرجع الصورة هدف.
- تحقق هيئة جامدة (التشريد موازية وتناوب الصور) و دقيقة ("سريع" وخشن لكن تحليل سريع بدلاً من ذلك) على أسلوب المعالجة ونوعيتها، على التوالي.
- انقر فوق دفعة البدء في معالجة الصور.
- حدد مناطق متعددة للفائدة (رويس) باستخدام تحليل | أدوات | مدير دوروا في إيماجيج.
- قياس كثافة بكسل بواسطة النقر فوق أكثر | مقياس متعدد | موافق في إطار إدارة العائد على الاستثمار.
- حساب ΔF/و0 = (F-و0)/F0، و هو شدة دوروا في وقت التحفيز، حيث و0 هو الكثافة في إطار زمني فورا قبل حدث تجريبي معين (مثلاً 30 الإطارات السابقة بداية التحفيز).
- كرر التجربة باستخدام عينات متعددة في الدماغ، وإجراء المعالجة الإحصائية للحصول على متوسط والخطأ المعياري للوسط (SEM) عند كل نقطة في الوقت.
النتائج
باستخدام هذا البروتوكول، تم بحث تفعيل المنتجة للأنسولين من خلايا المخ (IPCs) من هرمون الببتيد، CCHa2،. تم تسمية IPCs الدماغ البرية من نوع مع GCaMP6s باستخدام مزيج من dilp2-GAL412 (هدية من الدكتور روليفسون) و UAS GCaMP6s13 (هدية من الدكتور كيم). Explants الدماغ اليرقات تعامل مع ببتيد CCHa2 اصطناعية، وتم تسجيلها في الأسفار من GCaMP6s في الوقت الحقيقي. في هذه التجربة، تم الحصول على الصور من المستوى البؤري واحد. كل مجموعة التصنيف يحتوي على خلايا حوالي 1414، وتم الكشف عن إشارات من 3 إلى 6 خلايا. تم زيادة كثافة إشارة GCaMP6s هائلة عند الإدارة CCHa2 (الشكل 2، 1 فيلم). أدمغة البرية من نوع لم تظهر استجابة واضحة جريلين أو نوسيسيبتين (فيلم 2 و 3، على التوالي)، التي هي الهرمونات الببتيد الثدييات دون المناظرة المورفولوجية . تشير هذه النتائج إلى أن تفعيل الملاحظ IPCs ب CCHa2 استجابة محددة إلى CCHa2. لتوضيح ما إذا كانت أفعال CCHa2 عن طريق CCHa2-R، أجرى تحليل نفس استخدام العقول متحولة CCHa2-R. لا توجد هذه الزيادة في كثافة إشارة لوحظ بعد الإدارة CCHa2 في أدمغة المسخ (4 فيلم). وأظهر التحليل الإحصائي أن الفرق في كثافة الإشارات بين البرية من نوع والعقول متحولة CCHa2-R أصبح كبيرا داخل 2 دقيقة بعد التطبيق CCHa2، واستمر لمدة 7 دقائق على الأقل (الشكل 2ب). تشير هذه النتائج إلى أن IPCs تنشط على وجه التحديد من CCHa2 عن طريق CCHa2-r. كانت تضعف جميع الببتيدات المستخدمة في هذه الدراسة ببرنامج تلفزيوني تسفر عن تركيز نهائي 10-9 م.
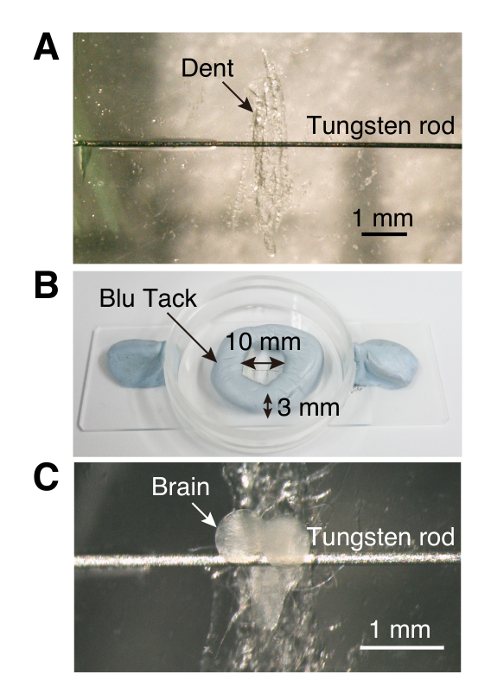
الشكل 1 . دائرة التصوير
(أ) الثقافة الطبق (35 مم × 10 مم) مع دنت الصغيرة وقضيب الربط. (ب) على شكل خاتم الجدار مصنوعة من المواد اللاصقة القابلة لإعادة الاستخدام مثل المعجون. (ج) المخ اليرقات explant إدراجها في قاعة التصوير. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
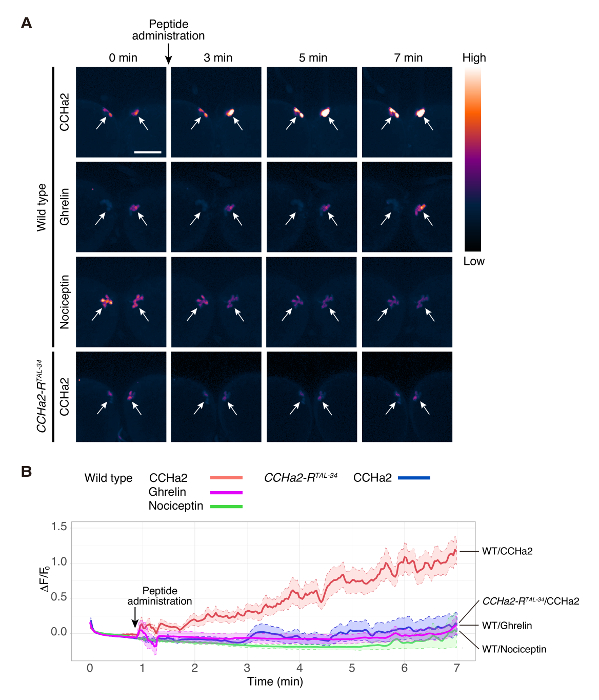
الشكل 2 . تصوير الكالسيوم من explant الدماغ اليرقات
الدماغ البرية من نوع (dilp2-Gal4/UAS-GCaMP6s) تعرضت إلى CCHa2 وجريلين ونوسيسيبتين. المسخ CCHa2-R (dilp2-Gal4، CCHa2-Rتل-34/UAS-GCaMP6s، CCHa2-Rتل-34) تعرض الدماغ ل CCHa2. تم الكشف عن إشارات GCaMP6s في IPCs بالفحص المجهري [كنفوكل] في 250 مللي/الإطار. لا تزال تظهر صور نقاط في الوقت المحدد في (أ). وكانت الصور بسيودوكولوريد لأفضل تصور كثافات مختلفة إشارة. وكان رسم ΔF/و0 عند كل نقطة في الوقت في (ب). وحسبت ΔF/و0 من 5 إلى 10 الاستعدادات المختلفة. تم تعيين رويس على الهيئات الخلية التي تم الكشف عنها في المستوى البؤري نفسه. الخطوط الصلبة تشير إلى المتوسط من 5 إلى 10 عينات، وخطوط منقطة علامة الحدود العليا والسفلي للخطأ المعياري للوسط. المناطق المظللة تبين اختلاف الإشارات في التجارب. شريط مقياس يشير إلى 50 ميكرومتر. هذا الرقم مقتبس من سانو et al. 15- الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

فيلم 1. IPCs البرية من نوع يتعرض إلى CCHa215 الرجاء انقر هنا لمشاهدة هذا الفيديو. (انقر بالزر الأيمن التحميل.)

فيلم 2. IPCs البرية من نوع يتعرض إلى جريلين15 الرجاء انقر هنا لمشاهدة هذا الفيديو. (انقر بالزر الأيمن التحميل.)
فيلم 3. IPCs البرية من نوع يتعرض إلى نوسيسيبتين15 الرجاء انقر هنا لمشاهدة هذا الفيديو. (انقر بالزر الأيمن التحميل.)

الفيلم 4- CCHa2-R المسخ IPCs يتعرض إلى CCHa2 15 الرجاء انقر هنا لمشاهدة هذا الفيديو. (انقر بالزر الأيمن التحميل.)
Discussion
Ca2 + التصوير الأسلوب الموصوفة هنا نظام مفيد لاختبار وظيفة الهرمونات في الدماغ. ويتلقى المجراة، الدماغ الهرمونات من مختلف أجهزة الغدد الصماء. وبالإضافة إلى ذلك، يدرك الدماغ باستمرار تصاعدي المعلومات الحسية، مما يسبب تنشيط الخلايا العصبية التلقائية. هذا النظام السابقين فيفو يلغي هذه الضوضاء وتعطي نسبة إشارات/ضجيج أفضل من التصوير في فيفو . وفي هذا النظام، يمكن اختبار جزيئات منفردة أو مجتمعة. بالإضافة إلى هرمونات الببتيد، أي جزيئات للذوبان في الماء، بما في ذلك المركبات الطبيعية أو الاصطناعية، يمكن تطبيقها على explant الدماغ.
ل Ca2 + التصوير, يلزم explants الدماغ تكون مربوطة. ولهذا الغرض، مصفوفة هلام مصنوعة من [اغروس] نقطة انصهار منخفضة أو قد فيبرينوجين المستخدمة سابقا16،17. يمكن أن تعقد هذه المصفوفات جل العينة ثابت، ومع ذلك، يتم تسخين الأنسجة في أعلاه 30 درجة مئوية. درجة الحرارة هذه الأسباب استجابة صدمة حرارة في بويكيلوثيرميك من الحيوانات مثل الحشرات. لتفادي الإجهاد الحراري، يمكن أن تكون مربوطة الدماغ جسديا. الدماغ يعلق على بشرة يتم تثبيتها مع دبابيس الحشرات18. يوفر لنا طريقة استخدام سلك تنغستن بسيط ومستقر عقد العينة. هذا النظام سهلة التحضير وقابلة لإعادة الاستخدام، ويسمح للمنشطات للوصول إلى الخلايا المستهدفة بسهولة أكبر بالمقارنة مع هلام أسلوب التضمين. وهكذا، سيكون هذا مفيداً ليجند الفرز.
اختيار مؤشر الفلورسنت يعتمد على النوع من الخلايا العصبية المستهدفة، نوع مستقبلات المعرب عنها في العصبية، وعلى الأسئلة البيولوجية التي يجري تناولها. كانت سلسلة من المتغيرات GCaMP6 الأمثل للكشف عن مختلف الزمني Ca2 + ديناميات ولدت13. على وجه الخصوص، تختلف المتغيرات GCaMP6 في حركية استجابة بهم: GCaMP6s (بطيء)، GCaMP6m (متوسطة)، و GCaMP6f (سريع). أوقات الاضمحلال GCaMP6s و 6 م بطيئة نسبيا (أي.، τ1/2 بعد 10 إمكانات العمل في تحضير شريحة هيبوكامبال) في حين أن GCaMP6f بسرعة (τ1/2 بعد إمكانات العمل 1). تشمل أنواع أخرى من المؤشرات الفلورسنت المتاحة للنشاط العصبي أباك-كامب (معسكر) وسينتو-فلورين (إطلاق سراح متشابك) أركلايت (غشاء المحتملة)19،،من2021. ويمكن التعبير عن هذه المؤشرات الفلورسنت وراثيا مرمزة في أنواع معينة من الخلايا. وهكذا، السابقين فيفو نظام التصوير يمكن الكشف عن استجابات مختلفة في الخلايا العصبية المطلوبة.
وهناك العديد من الخطوات الهامة في هذا البروتوكول. يجب إزالة الأنسجة أولاً، غريبة من الدماغ للحصول على صورة واضحة. استخدام الملقط شحذ والمقص الجراحي يخفف العمل الحساسة. ثانيا، ينبغي أن تكون ثابتة في تشريح الدماغ في الموقف. في بعض الأحيان، عينة الدماغ يتحرك قليلاً من بيبيتينج (في نطاق ما يقرب من 5 ميكرومتر). لمنع نقل الدماغ، ينبغي تعديل ارتفاع سلك التنغستن في قاعة التصوير إلى حجم العينة الدماغ. وبدلاً من ذلك، يمكن تثبيت نظام التروية الجاذبية-تغذية لتحفيز لطيف. وثالثاً، ينبغي تفسير نتائج تصوير الدماغ بحذر. قد حفز يجند المطبقة على الدماغ غير متوقع من الخلايا العصبية، التي بدورها يمكن أن تنشيط الخلايا العصبية المستهدفة. للكشف عن التأثير المباشر للهرمون على الخلايا العصبية المحددة، المستقبلات ينبغي أن تكون طرقت إلى أسفل في تارجيتنيورونس. وفي هذه الحالة، يمكن الجمع بين التعبير عن المؤشر الفلورسنت مع المستقبلات [رني] باستخدام نظام Gal4/UAS.
القيد طفيفة من هذا البروتوكول أن مدة تصوير محدودة بسبب الأضرار في نهاية المطاف من العينة الدماغ. في أيدينا، يمكن تصويرها في الدماغ المورفولوجية لتصل إلى ما يقرب من 60 دقيقة باستخدام هذا البروتوكول. يمكن تمكين الحل مثل هيموليمف، مثل HL3.1 المالحة22، وكثافة الليزر تصوير طويلة الأجل. وباﻹضافة إلى ذلك، الإعداد الحالي للتصوير ليست مناسبة للتحفيز المتكرر لنفس العينة. لمثل هذه التجارب، يمكن أن يستخدم حمام التروية.
وأخيراً، هذا البروتوكول له تطبيقات مختلفة. عن طريق تعديل قاعة التصوير، يمكن تصويرها الدماغ الكبار والأنسجة المورفولوجية الأخرى أو الأنسجة من الحيوانات الأخرى. في الكائنات غير النموذجية، والافتقار إلى الأدوات الوراثية جعلت من الصعب إدخال مؤشرات الفلورية إلى الجينوم. ومع ذلك، وضعت مؤخرا كريسبر/Cas9 الجينوم تقنيات التحرير قد فتحت الباب للهندسة الوراثية في هذه الحيوانات. وهكذا، يمكن استخدام هذا البروتوكول لدراسة الجهاز بين الإشارات في طائفة واسعة من الحيوانات.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
وكان هذا العمل تدعمها معونة للبحث العلمي (15 ك 07147، 17 ك 07419) من JSPS (إلى هيروشي ايشيموتو، سانو هيروكو)، اينامورى مؤسسة البحوث منحة (مرحبا)، وبرنامج مركز أبحاث/الاستخدام المشترك "الطب التنموي"، في معهد علم الأجنة الجزيئية وعلم الوراثة، جامعة كوماموتو (للنظام المنسق). ونحن نشكر الدكتور أزوسا كاميكوتشى والسيد يامادا دايتشي لمساعدتهم في استخدام نظام التصوير.
Materials
| Name | Company | Catalog Number | Comments |
| Tungsten rod | A-M systems, Sequim, WA, USA | 717000 | |
| Blu Tack | Bostik, Paris, France | 3049100 | putty-like reusable adhesives |
| Watch glass, square, 1 5/8 in | Carolina Biological Supply Company, Burlington, NC, USA | 742300 | |
| PBS | TAKARA Bio Inc., Kusatsu, Shiga, Japan | T900 | Phosphated buffered salts |
| CCHa2 | SCRUM Inc., Tokyo, Japan | Custum-synthesized peptide | |
| Ghrerin | Peptide institute Inc., Osaka, Japan | 4372-s | |
| Nociceptin | Peptide institute Inc., Osaka, Japan | 4313-v | |
| Axio Imager A2 | Carl Zeiss, Oberkochen, Germany | Axio Imager A2 | fluorescence microscope |
| Objective W N-Achroplan 20x/0.5 M27 | Carl Zeiss, Oberkochen, Germany | 420957-9900-000 | water-immersion objective lens |
| P-725 PIFOC objective scanner with long travel range | Physik Instrumente GmbH & Co. KG, Karlsruhe, Germany | N/A | piezoelectric-activated lens mover |
| Confocal Scanner Unit CSU-W1 | Yokogawa Electric Corporation, Tokyo, Japan | CSU-W1 | spinning disc confocal head |
| ImagEM C9100-13 | Hamamatsu Photonics, Sizuoka, Japan | C9100-13 | EM-CCD camera |
| OBIS 488 nm LS 60 mW | Coherent, Santa Clara, CA, USA | 1178770 | 488-nm laser |
| 488/568/647 nm Yokogawa dichroic beamsplitter | Semrock, Rochester, NY, USA | Di01-T405/488/568/647-13x15x0.5 | dichroic beam splitter |
| 528/38 nm BrightLine single-band bandpass filter | Semrock, Rochester, NY, USA | FF01-528/38-25 | emission filter |
| µManager | Open Imaging, Inc. | N/A | https://micro-manager.org |
| ImageJ | U. S. National Institutes of Health | N/A | https://imagej.nih.gov/ij/ |
| TurboReg | Philippe Thévenaz, Biomediccal Imaging Group, Swiss Federal Institute of Technology Lausanne | N/A | http://bigwww.epfl.ch/thevenaz/turboreg/ |
References
- Morton, G. J., Schwartz, M. W. Leptin and the central nervous system control of glucose metabolism. Physiological Reviews. 91 (2), 389-411 (2011).
- Stanley, S., Wynne, K., McGowan, B., Bloom, S. Hormonal regulation of food intake. Physiological Reviews. 85 (4), 1131-1158 (2005).
- Goodman, W. G., Cusson, M. The juvenile hormones. Insect Endocrinology. Gilbert, L. I. , Academic Press. 310-365 (2012).
- Lafont, R., Dauphin-Villemant, C., Warren, J. T., Rees, H. Ecdysteroid chemistry and biochemistry. Insect Endocrinology. Gilbert, L. I. , Academic Press. 106-176 (2012).
- Smith, W., Rybczynski, R. Protothoracicotropic hormone. Insect Endocrinology. Gilbert, L. I. , Academic Press. 1-62 (2012).
- Claeys, I., et al. Insect neuropeptide and peptide hormone receptors: current knowledge and future directions. Vitamins and Hormones. 73, 217-282 (2005).
- Gade, G., Goldsworthy, G. J. Insect peptide hormones: a selective review of their physiology and potential application for pest control. Pest Management Science. 59 (10), 1063-1075 (2003).
- Adams, M. D., et al. The genome sequence of Drosophila melanogaster. Science. 287 (5461), 2185-2195 (2000).
- Park, D., Veenstra, J. A., Park, J. H., Taghert, P. H. Mapping peptidergic cells in Drosophila: where DIMM fits in. PLoS One. 3 (3), 1896(2008).
- Berridge, M. J. Inositol trisphosphate and calcium signalling. Nature. 361 (6410), 315-325 (1993).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nature Biotechnology. 19 (2), 137-141 (2001).
- Rulifson, E. J., Kim, S. K., Nusse, R. Ablation of insulin-producing neurons in flies: growth and diabetic phenotypes. Science. 296 (5570), 1118-1120 (2002).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Nassel, D. R., Kubrak, O. I., Liu, Y., Luo, J., Lushchak, O. V. Factors that regulate insulin producing cells and their output in Drosophila. Frontiers in Physiology. 4, 252(2013).
- Sano, H., et al. The Nutrient-Responsive Hormone CCHamide-2 Controls Growth by Regulating Insulin-like Peptides in the Brain of Drosophila melanogaster. PLoS Genetics. 11 (5), 1005209(2015).
- Tsao, C. K., Ku, H. Y., Lee, Y. M., Huang, Y. F., Sun, Y. H. Long Term Ex Vivo Culture and Live Imaging of Drosophila Larval Imaginal Discs. PLoS One. 11 (9), 0163744(2016).
- Sabado, V. aN., Nagoshi, E. Single-cell Resolution Fluorescence Live Imaging of Drosophila Circadian Clocks in Larval Brain Culture. Journal of Visualized Experiments. 131, e57015(2018).
- Apostolopoulou, A. A., et al. Caffeine Taste Signaling in Drosophila Larvae. Frontiers in Cellular Neuroscience. 10, 193(2016).
- Cao, G., et al. Genetically targeted optical electrophysiology in intact neural circuits. Cell. 154 (4), 904-913 (2013).
- Nikolaev, V. O., Bunemann, M., Hein, L., Hannawacker, A., Lohse, M. J. Novel single chain cAMP sensors for receptor-induced signal propagation. Journal of Biological Chemistry. 279 (36), 37215-37218 (2004).
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The use of pHluorins for optical measurements of presynaptic activity. Biophysical Journal. 79 (4), 2199-2208 (2000).
- Feng, Y., Ueda, A., Wu, C. F. A modified minimal hemolymph-like solution, HL3.1, for physiological recordings at the neuromuscular junctions of normal and mutant Drosophila larvae. Journal of Neurogenetics. 18 (2), 377-402 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved