Method Article
O estabelecimento de um ensaio de colonização de pulmão para visualização de células de Tumor nos tecidos do pulmão de circulação
Neste Artigo
Resumo
Um modelo animal é necessário decifrar o papel de células tumorais (CTC) em promover a colonização de pulmão durante a metástase do cancro em circulação. Aqui, nós estabelecemos e realizou com sucesso um na vivo do ensaio para teste especificamente a exigência de assembly de fibronectina poliméricos (polyFN) na CTC para a colonização de pulmão.
Resumo
Metástase é a principal causa de morte por cancro. O papel da circulação de células tumorais (CTC) na promoção de metástases, em que colonização pulmonar por CTC criticamente contribui para primeiros processos de pulmão metastático, foi investigado vigorosamente. Como tal, os modelos animais são a única abordagem que capta o processo completo sistêmico de metástase. Dado que os problemas ocorrem em projetos experimentais anteriores para analisar as contribuições da CTC para extravasamento dos vasos sanguíneos, estabelecemos um ensaio de colonização de pulmão na vivo em que uma célula de longo-prazo-fluorescência-tracer, carboxyfluorescein succinimidil éster (CFSE), era usado para rotular células tumorais suspenso e perfusão pulmonar foi realizada para limpar não especìfica preso CTC antes da remoção do pulmão, imagem latente confocal e quantificação. Polimérica fibronectina (polyFN) montada em superfícies CTC foi encontrada para mediar a colonização de pulmão no estabelecimento final de tecidos de tumor metastático. Aqui, para testar especificamente o requisito de assembly polyFN no CTC para a colonização de pulmão e extravasamento, realizamos a curto prazo suspenso de ensaios de colonização pulmonar em que células de carcinoma de pulmão Lewis (LLCs) expressam estàvel FN-shRNA (shFN) ou scramble-shRNA (shScr) e pre-rotulado com 20 μM de CFSE por via intravenosa foram inoculadas em camundongos C57BL/6. Temos demonstrado com sucesso que as habilidades de shFN células LLC para colonizar os pulmões do mouse foram significativamente reduzidas em comparação com células de shScr LLC. Portanto, esta metodologia a curto prazo pode ser amplamente aplicada para demonstrar especificamente a capacidade do CTC dentro a circulação para colonizar os pulmões.
Introdução
Metástase é a principal causa de morte de câncer1,2. Células tumorais derivadas de tecidos primários entram a circulação em suspensão e sobrevivem vários desafios hematogênica, por exemplo, anoikis, imunes agressões e danos devido à tensão de cisalhamento de pressão arterial ou restrições geométricas, antes de serem capazes de colonizar órgãos distantes, um passo fundamental a ditar o sucesso de metástase3,4,5,6. Portanto, atualmente foram desenvolvidos esforços vigorosos na caracterização de células tumorais circulantes (CTC) e correlacionando estas características com a malignidade do tumor, metástase e as taxas de sobrevivência de câncer pacientes7,8 , 9. uma vez que o processo de metástase de câncer especificamente retrata um evento na vivo , modelos animais são a única abordagem que capta o processo completo sistêmico de metástase10,11,12 .
CTC-se tecidos de tumor metastático através de vários eventos celulares, incluindo a colonização de órgãos distantes1,2. No entanto, o mais comumente usado metástase ensaios13,14,15 não fornecem uma maneira de observar a colonização de CTC de órgãos distantes. Portanto, um projeto de ensaio na vivo para visualização de colonização do CTC é urgentemente necessária. Embora vários in vivo e ex vivo curto desvantagens, problemas e colonização de pulmão termo ensaios foram projetados permanecem. Por exemplo, enquanto a proteína fluorescência verde (GFP)-tumor superexpressão células têm sido utilizadas nestes ensaios22,23, leva tempo para estàvel transfect e clonar células tumorais com intensidade fluorescente GFP suficiente, sob o microscópio. Da mesma forma, embora transitória de coloração de células tumorais com o marcador de célula de longo prazo CFSE tem sido empregado para substituir as células do tumor-expressando GFP, continua a ser difícil julgar se as células do tumor CFSE-etiquetados são anexadas ou meramente presente dentro do vasculatura do extirpado órgãos distantes16,17.
Polimérica fibronectina (polyFN) montada em superfícies de CTC foi encontrada criticamente, contribuir para o estabelecimento de tumor metastático tecidos18,19,20,21,22 final . Aqui, realizamos a curto prazo pulmão ensaios de colonização na qual suspensos células de carcinoma de pulmão Lewis (LLCs) estàvel expressando FN-shRNA (shFN) ou scramble-shRNA (shScr) e pre-rotulado com CFSE por via intravenosa foram inoculados em camundongos C57BL/6. Após 2-3 dias, pulmões do mouse primeiro foram perfundidos com solução salina tamponada fosfato (PBS) para remover completamente o CTC solto dentro da vasculatura antes de serem submetidos a microscopia confocal e quantificação de pulmão-colonizar LLCs. Mostramos claramente que os números de pulmão-colonizar shFN LLCs e nódulos de tumor foram significativamente reduzidos em comparação com shScr LLCs, corroborando substancialmente o papel do assembly polyFN no CTC facilitar a colonização e crescimento do CTC na pulmões. Nosso estudo garante mais investigação para o papel de polyFN em metástase do cancro.
Protocolo
Todas as experiências em ratos foram realizadas de acordo com as orientações do nosso Instituto (guia de cuidados e uso de animais de laboratório, NCKU Medical College).
1. preparação dos instrumentos, meios de cultura e pratos
- Antes de iniciar os protocolos experimentais, obter suturas cirúrgicas estéril, seringas de 1 mL com agulha 26G/0,5 cm (para injeção de veia cauda), seringas de 3 mL com agulha de 24G/cm 3 (para perfusão do pulmão), modificado águia Media (DMEM de Dulbecco), solução do trypsin-EDTA (5 tripsina g/L e 0,53 mM), soro bovino fetal (FBS), 1X PBS (137 mM NaCl, 2,7 mM KCl, 10mm at2PHO4e 1,8 mM KH2PO4) e pratos de cultura de 6 cm.
2. preparação e recuperação de células tumorais em suspensão
- Prepare-se modificado águia Media (DMEM de estéril Dulbecco) contendo 10% ou 20% FBS e recentemente adicionar 2 mM L-glutamina, 1X PBS e 0,05% Trypsin-EDTA.
- Cultura de células em DMEM suplementado com 10% FBS a 37 ° C e cultivá-las até que haja uma confluência de 70-80% da placa de cultura.
- Retire os pratos, seguidos de duas lavagens com 2 mL de PBS estéril 1 x os meios de cultura (DMEM).
- Adicionar 1 mL de 0.05% Trypsin-EDTA para os pratos para cobrir completamente todas as células. Imediatamente remover 800 μL de solução e deixar apenas 200 μL nos pratos. Incubar os pratos a 37 ° C por 30 s a 1 min (dependendo do tipo de célula) e espere até que a maioria das células estão no estado suspenso.
- Adicionar 1 mL de DMEM fresco contendo 10% FBS directamente para os pratos de parar a atividade enzimática da tripsina e vigorosamente Pipetar a suspensão de células acima e para baixo com uma pipeta de 1000 µ l para preparar uma suspensão de célula única.
- As células de transferência do prato para um tubo de microcentrifugadora de 1,5 mL e spin para baixo as células à temperatura ambiente a 162 x g, durante 3 min.
- Aspirar o sobrenadante e ressuspender o tumor de células em 1,5 mL DMEM contendo 20% FBS e extremidade-sobre-extremidade girar as células em suspensão a 37 ° C por 2 h.
Nota: Se o meio fica amarelo durante a recuperação, trocar o antigo médio com meio fresco contendo 20% FBS.
3. fluorescência de coloração e a análise de células tumorais em suspensão com Carboxyfluorescein succinimidil éster (CFSE)
- Após a recuperação de células em suspensão, contar o número de células viáveis apropriado com Trypan azul em uma contagem câmara para titulada a fluorescência de coloração doses de Neubauer e cauda veia injeção.
- Gire para baixo as células a 162 x g em temperatura ambiente por 3 min e ressuspender esterilizados de peletizadas células em 1 mL de 1X PBS, seguido por centrifugação de temperatura a 162 x g, durante 3 min.
- Ressuspender as células peletizadas em 500 µ l de 1X PBS contendo 10% FBS e 0, 5, 10, 20 ou 40 µM CFSE para titulação de dose e incube a suspensão de célula 37 oC por 10 min no escuro.
- Gire para baixo as células a 162 x g, à temperatura ambiente por 3 min e ressuspender as células peletizadas com 4 mL de DMEM contendo 1% FBS. Repita essa etapa de lavagem mais três vezes. Ressuspender as células peletizadas com 4 mL de DMEM sozinho para a lavagem final.
- Submeter as células CFSE-etiquetadas a fluorescência-ativado da pilha classificação análise (FACS) para quantificar a intensidade de fluorescência de uma única célula, ou injeção de veia da cauda.
Nota: Manter as células no gelo antes de realizar as injeções de veia de FACS análise ou cauda.
4. pulmão colonização ensaio
- Preparar as células rotuladas com 20 µM CFSE (consulte 3.1 etapas através de 3.4).
Nota: Decidir a dose de trabalho de CFSE para rotulagem de células tumorais, baseadas nos resultados de titulação, a partir da análise de FACS (consulte a etapa 3.3). - Aquecer as caudas de 4-6 semana-velho macho C57BL/6 ratos (6 ratos) com uma lâmpada de iodetos durante 5-10 min em uma base por-do rato para dilatar as veias de cauda de rato.
- Homogeneizar bem e Aspire células tumorais CFSE-rotulado com uma seringa de 1 mL (26Gx1/2), evitando quaisquer bolhas na suspensão de célula (com uma densidade celular final de 5 x 106 células/mL).
- Cuidadosamente, injetar 1 x106 células de tumor CFSE-etiquetadas em 200 µ l de DMEM na veia de cauda de rato, que deve ser apresentada em uma retenção de rato.
Nota: Durante a injeção, se a agulha é colocada diretamente no lúmen da veia da cauda, células tumorais devem ser facilmente entregues na circulação sem a necessidade de dar o máximo na seringa. Se é difícil para as células do tumor através de empurrar, eles provavelmente foram injetados fora da veia da cauda, no espaço subcutâneo. - Dividir os ratos que receberam por via intravenosa as células do tumor CFSE-etiquetadas em dois grupos: um grupo passará por perfusão pulmonar, seguida por microscopia confocal e quantificação do ImageJ em ensaio de colonização o pulmão e o outro será deixada sozinho para 4-5 semanas na colonização de pulmão de longo prazo do ensaio.
- Em 20, 38 ou 45 h e com 1 x 106 células de tumor injetadas por via intravenosa durante uma titulação de curso e dose-dependente do tempo, anestesiamos tumor-rolamento ratos com 50-75 mg/kg zoletil 50, que é um bem aceita e adequada anesthetizer23.
Nota: Uso veterinário pomada olhos de ratos para evitar ressecamento enquanto sob anestesia. - Corte longitudinalmente a pele e subcutâneo do abdome para a região do peito com uma tesoura cirúrgica. Abra a cavidade pleural com tesoura cirúrgica e fórceps para expor totalmente o coração e os pulmões.
Nota: Tenha cuidado para evitar cortar os vasos sanguíneos. - Amarre a veia cava superior (SVC) e a veia cava inferior (VCI) com suturas cirúrgicas estéril para evitar o refluxo da solução de perfusão durante a perfusão pulmonar.
- Corte a parede do ventrículo esquerdo com uma tesoura cirúrgica para abrir uma fissura (cerca de 2-4 mm) para drenar a solução de perfusão dos pulmões.
- Injetar o ventrículo direito com uma seringa de 3 mL 1X PBS e remover a solução drenada com sucção constante durante a perfusão pulmonar até aos pulmões recorrer de uma cor avermelhada completamente pálido.
5. confocal imagem microscópica e a análise de células tumorais de pulmão-colonizado
- Remover os pulmões agora-pálido da cavidade pleural e separar os cinco lóbulos cortando os ligamentos da traqueia e do tecido conjuntivo com de tesoura e pinça cirúrgica24.
- Prepare um suporte de maca-como pulmão como mostrado na Figura 3B enrolando uma sutura de nylon em torno de duas hastes de metal para produzir uma textura reticulada, com um espaço entre as duas hastes para a colocação dos lobos do pulmão. Defina o titular do pulmão em um prato de 6 cm.
Nota: O titular do pulmão será usado para estabilizar os lóbulos pulmonares debaixo da lente objetiva de um microscópio confocal. - Apresentar e fixar os lóbulos pulmonares na textura reticulada do titular do pulmão. Cubra e Umedeça os lóbulos pulmonares com 1X PBS.
- O prato de 6cm cultura, abrigando os lóbulos pulmonares no suporte do pulmão para microscopia confocal para capturar imagens de fluorescência gravando as células do tumor de pulmão-colonização de assunto.
- Para a imagem latente, usar lentes objetivas (5 X, MPLN, Nd: 0.1, WD: 20, ar).
- Gire a roda de filtro para NIBA (excitação/emissão; 470-495 nm/510-550 nm) e com 488 nm laser para excitar CFSE, claramente visualizar imagens de pontos de fluorescência dos lóbulos pulmonares.
- Gire a roda de filtro para R690 (para MaiTai HP DeepSee laser) para digitalizar com 2.0 µs/pixel digitalização acelerar e otimizar o HV, ganho e deslocamento níveis.
- Capturar imagens de fluorescência (512 x 512 pixels) usando o software de microscópio com um 10 µs/pixel, velocidade de digitalização.
- Quantificar e analisar estatisticamente as imagens microscópicas usando o ImageJ e GraphPad software como descrito anteriormente,21.
6. a longo prazo os ensaios de colonização do pulmão
Nota: Repita os passos 4.1 através de 4.5.
- Sacrificar os ratos após inoculação de células de tumor por 4-5 semanas e consertar seus pulmões com líquido de Bouin25 para 1 a 2 dias.
- Quantificar e analisar estatisticamente os nódulos de tumor dos pulmões de ratos com software21.
Resultados
Antes de realizar o ensaio de colonização de pulmão na vivo como ilustrado na figura 1A , para testar se polyFN em células tumorais suspenso Medeia colonização pulmonar e/ou extravasamento na facilitação de metástase, nós primeiro titulado diferentes concentrações de CFSE, um composto fluorescente que é a célula permeável e covalentemente conjuga intracelulares contendo amina moléculas26,27 em células tumorais suspenso e permanece nas células por um longo período de tempo. Encontramos o tumor de células foram efetivamente rotuladas com CFSE de forma dose-dependente, como ilustrado na figura 1B. O CFSE-rotulagem em 6 x10 LLC de5 células/mL quase alcançado um platô em 20 µM como ilustrado na Figura 1.
Devido o abundante estreitado capilar sistema que fisicamente pode impedir o fluxo do CTC dentro da vasculatura pulmonar, realizamos o pulmão células LLC CFSE-rotulado perfusão em camundongos rolamento injetada por via intravenosa para limpar não especìfica preso CTC, como ilustrado na figura 1A antes da remoção do pulmão em cada ponto de tempo, como ilustrado na Figura 4. Antes da perfusão, os pulmões foram claramente avermelhados devido a presença de sangue, conforme ilustrado na painel esquerdo da Figura 2. Os pulmões se tornou pálidos após perfusão com 10-15 mL de 1X PBS, conforme ilustrado no painel à direita da Figura 2.
Imediatamente após os pulmões de rato perfundido foram removidos do espaço pleural, os lóbulos pulmonares foram separados e montados no suporte do pulmão colocado em pratos, conforme ilustrado na Figura 3A com 1X PBS cobrindo completamente os lóbulos pulmonares. Os lóbulos pulmonares montados no suporte do pulmão, como ilustrado na Figura 3B foram submetidos à microscopia de fluorescência confocal, conforme ilustrado na Figura 3A. As células do tumor CFSE-rotulado colonizar os pulmões foram fotografadas como ilustrado na painel superior da Figura 3 e transformada em imagens em preto e branco, conforme ilustrado na painel inferior de Figura 3 para facilitar a quantificação de colonização pulmonar com software Image J.
Nós injetado por via intravenosa ou shScr ou shFN células LLC que foram rotuladas com 20 µM CFSE e esperou por um curso de tempo de 24-72 h antes de executar o perfusions de pulmão e imagem microscópica confocal. Quantificação do tumor pulmonar-colonizar as células em 6 ratos, conforme ilustrado na Figura 4A com software ImageJ revelaram que significativamente menos células LLC de shFN de shScr células LLC foram contadas no 38 h e pontos de tempo de 45 h, como ilustrado na Figura 4B . A razão por que os números do pulmão-colonizado shScr e células LLC shFN gradualmente diminuídas era muito provável devido a citotoxicidade contínua exercida pela imunidade a circulação mesmo contra as células LLC já colonizadas. No total, estes resultados sugerem que polyFN montado no CTC de fato é necessária em mediando a colonização do pulmão por células LLC, levando à completa metástase nos pulmões como revelado pelos resultados em que alguns ratos por via intravenosa, recebendo alíquotas do CFSE-rotulado shScr shFN LLC células e para os ensaios de colonização de pulmão como ilustrado na Figura 4 foram deixadas aloneuntil tumor de pulmão nódulos foram desenvolvidos no ensaio de metástase de tumor experimental, conforme ilustrado na Figura 5A e 5B.
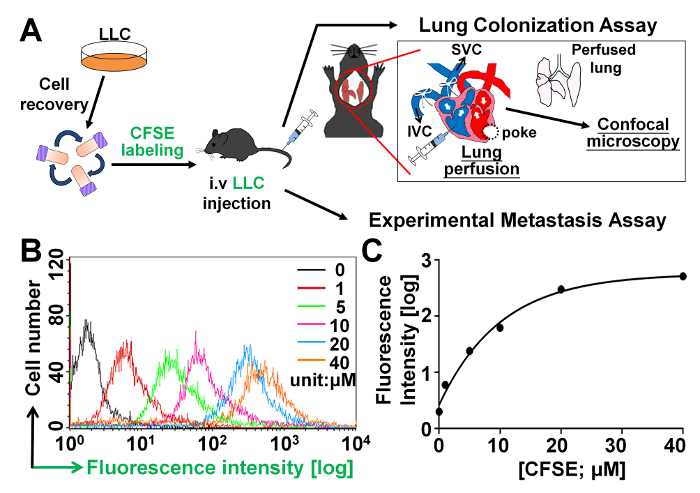
Figura 1: titulação das concentrações para a rotulagem de células tumorais no ensaio de colonização de pulmão CFSE. (A) ilustração esquemática dos procedimentos para o ensaio de colonização de pulmão e o ensaio experimental de metástase, conforme detalhado na seção protocolos. (B) análise de FACS para as intensidades de fluorescência CFSE das células LLC que foram manchadas com diferentes concentrações de CFSE. (C) as intensidades de fluorescência foram plotadas como funções de várias concentrações de CFSE. Clique aqui para ver uma versão maior desta figura.

Figura 2: pulmões antes e depois da perfusão. Imagens representativas dos pulmões antes (unperfused; Unperf.) e depois (perfundidos; Perf.) realizando a perfusão do pulmão. Estrela de ouro: coração. Seta branca: a gravata que fechado o IVC/SVC. Setas vermelhas: os pulmões do mouse mesmo antes e após a perfusão. Clique aqui para ver uma versão maior desta figura.

Figura 3: montagem dos lóbulos pulmão perfundido no suporte do pulmão para microscopia de fluorescência confocal. (A) esquema de montagem da pulmão no suporte do pulmão para a microscopia confocal. (B) uma imagem representativa dos 3 lobos do pulmão perfundido no suporte do pulmão. (C) imagens representativas de colonização de pulmão de células LLC com fluorescência CFSE para quantificação pelo software Image J. Painel superior: regular de imagem. Painel inferior: inverteu a imagem em preto e branco. Clique aqui para ver uma versão maior desta figura.
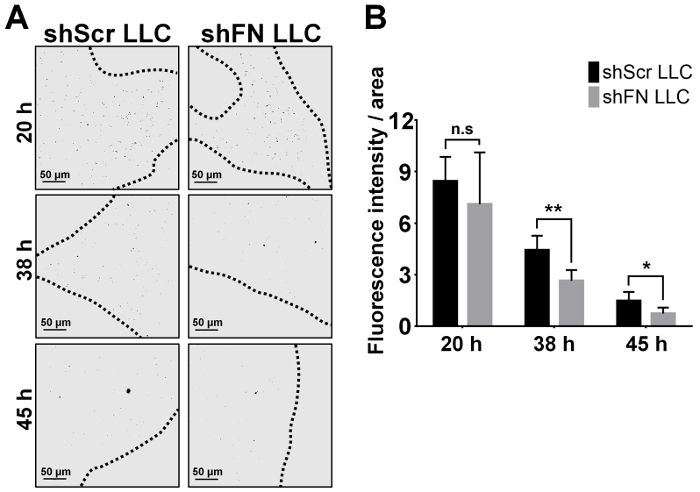
Figura 4: imagem de curso do tempo, quantificação e análise estatística para o pulmão colonizaram células LLC de shScr e shFN depois da perfusão pulmonar no ensaio de colonização pulmonar. (A) em preto e branco imagens representativas (convertido a partir de imagens de fluorescência) de células LLC de shScr e shFN que foram colonizados na vasculatura pulmonar em vários pontos de tempo como retratado após perfusão pulmonar extensa. Linhas pontilhadas denotam a borda das áreas de tecido de pulmão confocal em foco. (B) quantificação e análise estatística para as células LLC-colonização do pulmão como visualizado no (A) por uma média de 5 imagens de representante absoluto/pulmão lobo/rato. Nota: Cada barra indica a intensidade de fluorescência em média de cada área confocal em foco. Os dados foram estatisticamente analisados a partir de 6 ratos e relatados como média ± DP; n.s. significa nonsignificant; * significa p < 0,05; e * * significa p < 0,01; ANOVA de duas vias. Clique aqui para ver uma versão maior desta figura.
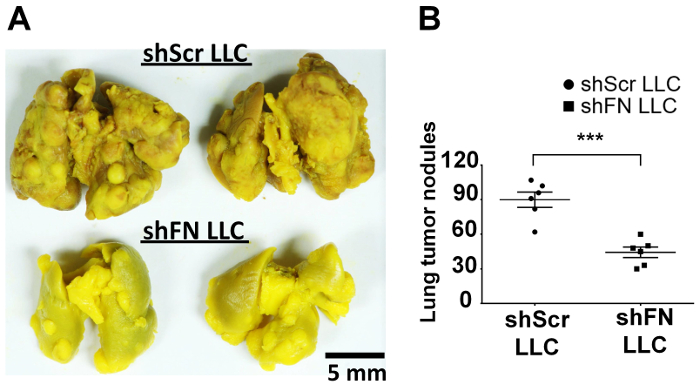
Figura 5: silenciar a expressão de FN em células LLC CFSE-rotulado diminui nódulos de tumor nos pulmões a longo prazo no ensaio de colonização vivo CTC. Pulmões de rato fluido-fixo do (A) Bouin tendo nódulos de tumor derivem CFSE-etiquetadas em células de shScr ou shFN LLC. (B) quantificação e análise estatística para os nódulos de tumor nos pulmões. Os dados são reportados como média ± DP; : p < 0,001; n = 6 por grupo; Teste-t não pareado. Clique aqui para ver uma versão maior desta figura.
Discussão
Juntamente com longo prazo pulmonar colonização ensaios, a curto prazo, metodologia que utilizamos aqui para avaliar na vivo pulmonar colonização por CTC em órgãos distantes claramente revelada e diferenciado o papel específico de polyFN montado no CTC da colonização os pulmões, que em seguida levaram o extravasamento e processos metastáticos18,19,20,21. Apesar de rotulagem células com rastreador de celular de longo prazo CFSE nos permitiu traçar a CTC injetada por via endovenosa por até três dias antes da perfusão do pulmão e reter fluorescência verde suficiente para fins quantitativos, era impossível determinar diretamente Se as pilhas do tumor eram localizadas dentro do lúmen do vaso ou já tinham extravasado dos vasos sanguíneos. Para resolver esta fluorescente problema, vermelho rodamina-conjugados dextrano, que é capaz de não especìfica bind para lectinas expressado na endothelia pode ser usado para rotular a vasculatura pulmonar durante pulmonar perfusão28,29, 30. apesar do fato de que CFSE é um rastreador de celular de longo prazo, sua intensidade de fluorescência é reduzida para metade cada divisão celular27, limitação da capacidade de usá-lo em técnicas de rotulagem. Para contornar este problema, deve comprovar-se que a rotulagem dosagem de CFSE é suficiente para as células que permanecem detectáveis por toda a duração do in vivo de experiências e que qualquer tratamento aplicado às células não tem efeito na célula proliferação. Porque a comparação e a quantificação do pulmão-colonizar shScr e shFN CTC foram feitos em ratos separados, pode-se argumentar que as diferenças entre os dois grupos foram devido à variação individual. Para excluir tal variação, uma mistura de dois tipos de tumor de células rotuladas com distintas fluorescem corantes (por exemplo, CFSE/CM-diI) ou estàvel transfected com GFP/dsRed pode ser concomitantemente por via intravenosa injetada o mesmo animal na colonização de pulmão ensaio de32,31,33. É interessante notar que clonagem efeitos resultantes da célula que é tentou resolver estàvel tecnologia de clonagem de células transfectadas-proteína fluorescente clones com fluorescência suficientemente forte34,35, 36 , 37 ... pode fazer as células clonadas não representativa para representar as populações inteiras heterogêneos38,39,40. Se um transfection estável de qualquer proteína fluorescente em células tumorais é desejado para os ensaios de colonização pulmonar, elevar a eficiência da transfecção de células do tumor como um todo deveria melhor preservar as características originais do que a célula de clonagem populações com suficiente fluorescência41,42.
A perfusão do pulmão passos na colonização de pulmão, os ensaios são necessários, em que algumas células de tumor injetado por via intravenosa, em vez de prender-se especificamente ao sistema capilar pulmonar, tendem a ser mecanicamente preso e presa nas redes de capilares do pulmão tecidos devido os mèdia maiores diâmetros do CTC do que a largura do pulmão lúmens capilar43,44. Quantificação das células de tumor pulmonar-colonizar sem perfusing os pulmões pode resultar em uma sobreavaliação contando por engano as células mecanicamente encravado45,46,47. Mesmo que os pulmões têm sido perfundidos, subsistem problemas adicionais. Por exemplo, é ainda difícil de diferenciar as células do tumor de pulmão-colonizar situam-se sobre o endothelia lumenal ou tem já extravasado dos vasos sanguíneos. Para resolver esse problema, os vasos sanguíneos com dextran rodamina-conjugados, como foi mencionado anteriormente pode ser útil30,,48,49. Alternativamente, se quantificação de extravasamento do tumor é desejada, cálcio-quelante EDTA/EGTA ou tripsina, uma protease específico, pode ser usada no buffer de perfusão para impedir cálcio-dependente e - independente de tumor celular adesão eventos50 , 51 , 52. assim, as células do tumor restante nos tecidos pulmonares podem ser consideradas como extravasado.
Para a quantificação das células de tumor de pulmão-colonizar, os pulmões perfundidos frequentemente são submetidos a microscopia confocal tradicional. No entanto, a possibilidade de mensuração da profundidade do tecido é limitada devido em parte ao tecido autofluorescência e efeitos de espalhamento de fluorescência, renderização mais profundo tecidos indetectável53,54. Um microscópio de dois fótons com maior sensibilidade do que um tradicional microscópio confocal é adequado para resolver tais problemas, em que a radiação infravermelha usada na excitação de dois fotões com significativamente menos absorção por espécimes biológicos que UV ou luz azul-verde torna a técnica mais apropriada para a imagem latente espécimes grosso55,56,57. Pulmão-colonizar as células do tumor são contadas por uma média de número de células de tumor em várias imagens confocal representante, que não incluem o número inteiro de pulmão-colonizar as células do tumor no pulmão inteiro de um animal individual. Para quantificar os pulmões todo em ensaios de colonização o pulmão, células tumorais estàvel transfectadas com luciferase poderiam ser empregadas e os pulmões perfundidos poderiam ser sujeito a IVIS imagem após inoculação intravenosa de células de tumor suspenso na presença de luciferina46,58,59. Alternativamente, os pulmões perfundidos poderiam ser picados em pedaços e submetidos a digestão enzimática com proteases, por exemplo, colagenase, liberando células únicas na suspensão60,61. O tumor de células com corantes de fluorescência ou estàvel transfected com fluorescência proteínas então poderiam ser quantificadas com fluorescência-ativado da pilha (FACS) análise56,62de classificação.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores desejam agradecer Dr. Chang Ming-Min e MS. Ya-Hsin Cheng pelo apoio técnico. Este trabalho foi financiado pelo Ministério da ciência e tecnologia de Taiwan (a maioria-103-2325-B-006-009, a maioria-104-2325-B-006-001, a maioria-105-2325-B-006-001 e MOST-106-2320-B-006-068-MY3) e o Ministério da saúde e bem-estar (MOHW106-TDU-B-211-144004). Agradecemos também o apoio do laboratório de pesquisa do núcleo da faculdade de medicina, Universidade Nacional de Cheng Kung, seu microscópio confocal multi fóton.
Materiais
| Name | Company | Catalog Number | Comments |
| Material | |||
| Bovine Serum Albumin (BSA) | Cyrusbioscience (Taipei, Taiwan) | 101-9048-46-8 | |
| Bouin's Fluid | MCC(medical chemical corporation)/POISON | 456-A-1GL | |
| CFSE Proliferation Dye | ebiosciences | 65-0850-85 | Full name: Carboxyfluorescein succinimidyl ester |
| Dulbecco's Modified Eagle Media (DMEM) | (Gibco)ThermoFisher Scientific | 12100-061 | |
| Ethylenediaminetetraacetic acid (EDTA) | Cyrusbioscience (Taipei, Taiwan) | 101-6381-92-6 | For prepared trypsin-EDTA solution( Final concentration: 0.53mM ) |
| Fetal bovine serum (FBS) | (Gibco)ThermoFisher Scientific | 10437-028 | |
| Lewis lung carcinoma (LLC) | ATCC, Manassas, VA, USA | CRL-1642 | |
| L-Glutamine, USP | (Gibco)ThermoFisher Scientific | 21051-024 | |
| Potassium chloride (KCl) | Cyrusbioscience (Taipei, Taiwan) | 101-7447-40-7 | For prepared 1X PBS ( Final concentration: 2.7mM ) |
| Potassium phosphate monobasic (KH2PO4) | Cyrusbioscience (Taipei, Taiwan) | 101-7778-77-0 | For prepared 1X PBS ( Final concentration: 1.8mM ) |
| Sodium chloride (NaCl) | Cyrusbioscience (Taipei, Taiwan) | 101-7647-14-5 | For prepared 1X PBS ( Final concentration: 137mM ) |
| Sodium phosphate dibasic (Na2HPO4) | Cyrusbioscience (Taipei, Taiwan) | 101-10039-32-4 | For prepared 1X PBS ( Final concentration: 10mM ) |
| Trypan Blue | Sigma Aldrich | T6146 | 0.5 g mix with 100 mL 1X PBS |
| Trypsin | Sigma Aldrich | T4799 | For prepared trypsin-EDTA solution ( Final concentration: 5g/L ) |
| Zoletil 50 | Virbac | To dilute with 1X PBS | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Compact Tabletop Centrifuge 2420 | KUBOTA Co. | 2420 | |
| Culture dish (6cm) | Wuxi NEST Biotechnology Co. | 705001 | |
| Disposable syringe (with needle) | Perfect Medical Industry Co. | 24G/3 cm;3 ml & 26G/0.5 cm;1 ml | |
| End over end mixer | C.T.I YOUNG CHENN | TS-20 | For suspended cells recovery |
| FACSCalibur (FACS) | BD biosciences | ||
| Forceps | Dimeda | 10.102.14 | |
| Forma Direct Heat CO2 incubator | Thermo Fisher Scientific Inc. | HEPA CLASS 100 | |
| Mouse restrainer (Cylindrical Restrainer 15-30 gm) | Stoelting | 51338 | |
| Multiphoton Confocal Microscope BX61WI | Olympus | FV1000MPE | |
| Neubauer counting chamber | Marienfeld-Superior | 640010 | |
| Surgical scissor | Dimeda | 08.370.11 | |
| Surgical sutures | UNIK SURGICAL SUTURES MFG. CO. | NO. 0034 | Black Braided silk; non-absorbable (25YD; U.S.P. 4/0) |
| 1.5 mL microcentrifuge tube | Wuxi NEST Biotechnology Co. | 615001 | |
| 15 mL Greiner tube | Greiner bio-one | 188271 |
Referências
- Massague, J., Obenauf, A. C. Metastatic colonization by circulating tumour cells. Nature. 529 (7586), 298-306 (2016).
- Lambert, A. W., Pattabiraman, D. R., Weinberg, R. A. Emerging Biological Principles of Metastasis. Cell. 168 (4), 670-691 (2017).
- Mohme, M., Riethdorf, S., Pantel, K. Circulating and disseminated tumour cells - mechanisms of immune surveillance and escape. Nat Rev Clin Oncol. 14 (3), 155-167 (2017).
- Steinert, G., et al. Immune escape and survival mechanisms in circulating tumor cells of colorectal cancer. Cancer Res. 74 (6), 1694-1704 (2014).
- Mahauad-Fernandez, W. D., Okeoma, C. M. Cysteine-linked dimerization of BST-2 confers anoikis resistance to breast cancer cells by negating proapoptotic activities to promote tumor cell survival and growth. Cell Death Dis. 8 (3), e2687(2017).
- Maheswaran, S., Haber, D. A. Circulating tumor cells: a window into cancer biology and metastasis. Curr Opin Genet Dev. 20 (1), 96-99 (2010).
- Yu, M., et al. RNA sequencing of pancreatic circulating tumour cells implicates WNT signalling in metastasis. Nature. 487 (7408), 510-513 (2012).
- Adams, D. L., et al. Mitosis in circulating tumor cells stratifies highly aggressive breast carcinomas. Breast Cancer Res. 18 (1), 44(2016).
- Baccelli, I., et al. Identification of a population of blood circulating tumor cells from breast cancer patients that initiates metastasis in a xenograft assay. Nat Biotechnol. 31 (6), 539-544 (2013).
- Malladi, S., et al. Metastatic Latency and Immune Evasion through Autocrine Inhibition of WNT. Cell. 165 (1), 45-60 (2016).
- Spiegel, A., et al. Neutrophils Suppress Intraluminal NK Cell-Mediated Tumor Cell Clearance and Enhance Extravasation of Disseminated Carcinoma Cells. Cancer Discov. 6 (6), 630-649 (2016).
- Pattabiraman, D. R., et al. Activation of PKA leads to mesenchymal-to-epithelial transition and loss of tumor-initiating ability. Science. 351 (6277), aad3680(2016).
- van der Weyden, L., et al. Genome-wide in vivo screen identifies novel host regulators of metastatic colonization. Nature. 541 (7636), 233-236 (2017).
- Obenauf, A. C., et al. Therapy-induced tumour secretomes promote resistance and tumour progression. Nature. 520 (7547), 368-372 (2015).
- Genovese, G., et al. Synthetic vulnerabilities of mesenchymal subpopulations in pancreatic cancer. Nature. 542 (7641), 362-366 (2017).
- von Horsten, S., et al. Stereological quantification of carboxyfluorescein-labeled rat lung metastasis: a new method for the assessment of natural killer cell activity and tumor adhesion in vivo and in situ. J Immunol Methods. 239 (1-2), 25-34 (2000).
- Reymond, N., et al. Cdc42 promotes transendothelial migration of cancer cells through beta1 integrin. J Cell Biol. 199 (4), 653-668 (2012).
- Cheng, H. C., Abdel-Ghany, M., Elble, R. C., Pauli, B. U. Lung endothelial dipeptidyl peptidase IV promotes adhesion and metastasis of rat breast cancer cells via tumor cell surface-associated fibronectin. J Biol Chem. 273 (37), 24207-24215 (1998).
- Huang, L., et al. Protein kinase Cepsilon mediates polymeric fibronectin assembly on the surface of blood-borne rat breast cancer cells to promote pulmonary metastasis. J Biol Chem. 283 (12), 7616-7627 (2008).
- Chang, Y. H., et al. Secretomic analysis identifies alpha-1 antitrypsin (A1AT) as a required protein in cancer cell migration, invasion, and pericellular fibronectin assembly for facilitating lung colonization of lung adenocarcinoma cells. Mol Cell Proteomics. 11 (11), 1320-1339 (2012).
- Wang, Y. J., et al. Pterostilbene prevents AKT-ERK axis-mediated polymerization of surface fibronectin on suspended lung cancer cells independently of apoptosis and suppresses metastasis. J Hematol Oncol. 10 (1), 72(2017).
- Cheng, H. C., Abdel-Ghany, M., Pauli, B. U. A novel consensus motif in fibronectin mediates dipeptidyl peptidase IV adhesion and metastasis. J Biol Chem. 278 (27), 24600-24607 (2003).
- Hsu, Y. Y., et al. Thrombomodulin is an ezrin-interacting protein that controls epithelial morphology and promotes collective cell migration. FASEB J. 26 (8), 3440-3452 (2012).
- Arlt, M. J., Born, W., Fuchs, B. Improved visualization of lung metastases at single cell resolution in mice by combined in-situ perfusion of lung tissue and X-Gal staining of lacZ-tagged tumor cells. J Vis Exp. (66), e4162(2012).
- Shi, Y., Parhar, R. S., Zou, M., Al-Mohanna, F. A., Paterson, M. C. Gene therapy of melanoma pulmonary metastasis by intramuscular injection of plasmid DNA encoding tissue inhibitor of metalloproteinases-1. Cancer Gene Ther. 9 (2), 126-132 (2002).
- Parish, C. R. Fluorescent dyes for lymphocyte migration and proliferation studies. Immunol Cell Biol. 77 (6), 499-508 (1999).
- Quah, B. J., Warren, H. S., Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat Protoc. 2 (9), 2049-2056 (2007).
- Migone, F. F., et al. In vivo imaging reveals an essential role of vasoconstriction in rupture of the ovarian follicle at ovulation. Proc Natl Acad Sci U S A. 113 (8), 2294-2299 (2016).
- Itkin, T., et al. Distinct bone marrow blood vessels differentially regulate haematopoiesis. Nature. 532 (7599), 323-328 (2016).
- Jiang, M., Qin, C., Han, M. Primary breast cancer induces pulmonary vascular hyperpermeability and promotes metastasis via the VEGF-PKC pathway. Mol Carcinog. 55 (6), 1087-1095 (2016).
- Aceto, N., et al. Circulating tumor cell clusters are oligoclonal precursors of breast cancer metastasis. Cell. 158 (5), 1110-1122 (2014).
- Zheng, Y., et al. Expression of beta-globin by cancer cells promotes cell survival during blood-borne dissemination. Nat Commun. 8, 14344(2017).
- Chen, X., et al. Retinoic acid facilitates inactivated transmissible gastroenteritis virus induction of CD8(+) T-cell migration to the porcine gut. Sci Rep. 6, 24152(2016).
- Saranchova, I., et al. Discovery of a Metastatic Immune Escape Mechanism Initiated by the Loss of Expression of the Tumour Biomarker Interleukin-33. Sci Rep. 6, 30555(2016).
- Ahmed, M., et al. An Osteopontin/CD44 Axis in RhoGDI2-Mediated Metastasis Suppression. Cancer Cell. 30 (3), 432-443 (2016).
- Hoffman, R. M. In vivo imaging of metastatic cancer with fluorescent proteins. Cell Death Differ. 9 (8), 786-789 (2002).
- Mendoza, A., et al. Modeling metastasis biology and therapy in real time in the mouse lung. J Clin Invest. 120 (8), 2979-2988 (2010).
- Meacham, C. E., Morrison, S. J. Tumour heterogeneity and cancer cell plasticity. Nature. 501 (7467), 328-337 (2013).
- Wagenblast, E., et al. A model of breast cancer heterogeneity reveals vascular mimicry as a driver of metastasis. Nature. 520 (7547), 358-362 (2015).
- Nguyen, D. X., Bos, P. D., Massague, J. Metastasis: from dissemination to organ-specific colonization. Nat Rev Cancer. 9 (4), 274-284 (2009).
- Ragelle, H., et al. Chitosan nanoparticles for siRNA delivery: optimizing formulation to increase stability and efficiency. J Control Release. 176, 54-63 (2014).
- Chu, V. T., et al. Increasing the efficiency of homology-directed repair for CRISPR-Cas9-induced precise gene editing in mammalian cells. Nat Biotechnol. 33 (5), 543-548 (2015).
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nat Rev Cancer. 11 (7), 512-522 (2011).
- Joyce, J. A., Pollard, J. W. Microenvironmental regulation of metastasis. Nat Rev Cancer. 9 (4), 239-252 (2009).
- Sanchez-Laorden, B., et al. BRAF inhibitors induce metastasis in RAS mutant or inhibitor-resistant melanoma cells by reactivating MEK and ERK signaling. Sci Signal. 7 (318), ra30(2014).
- Torchiaro, E., et al. Peritoneal and hematogenous metastases of ovarian cancer cells are both controlled by the p90RSK through a self-reinforcing cell autonomous mechanism. Oncotarget. 7 (1), 712-728 (2016).
- Wan, J., et al. Establishment of monoclonal HCC cell lines with organ site-specific tropisms. BMC Cancer. 15, 678(2015).
- Ye, Y., Liu, S., Wu, C., Sun, Z. TGFbeta modulates inflammatory cytokines and growth factors to create premetastatic microenvironment and stimulate lung metastasis. J Mol Histol. 46 (4-5), 365-375 (2015).
- Morales, M., et al. RARRES3 suppresses breast cancer lung metastasis by regulating adhesion and differentiation. EMBO Mol Med. 6 (7), 865-881 (2014).
- Stone, J. P., et al. Mechanical removal of dendritic cell-generating non-classical monocytes via ex vivo lung perfusion. J Heart Lung Transplant. 33 (8), 864-869 (2014).
- Vettorazzi, S., et al. Glucocorticoids limit acute lung inflammation in concert with inflammatory stimuli by induction of SphK1. Nat Commun. 6, 7796(2015).
- Urade, Y., Yoshida, R., Kitamura, H., Hayaishi, O. Induction of indoleamine 2,3-dioxygenase in alveolar interstitial cells of mouse lung by bacterial lipopolysaccharide. J Biol Chem. 258 (10), 6621-6627 (1983).
- Hong, G., et al. Through-skull fluorescence imaging of the brain in a new near-infrared window. Nat Photonics. 8 (9), 723-730 (2014).
- Liu, Q., Guo, B., Rao, Z., Zhang, B., Gong, J. R. Strong two-photon-induced fluorescence from photostable, biocompatible nitrogen-doped graphene quantum dots for cellular and deep-tissue imaging. Nano Lett. 13 (6), 2436-2441 (2013).
- Peti-Peterdi, J., Burford, J. L., Hackl, M. J. The first decade of using multiphoton microscopy for high-power kidney imaging. Am J Physiol Renal Physiol. 302 (2), F227-F233 (2012).
- Duda, D. G., et al. Malignant cells facilitate lung metastasis by bringing their own soil. Proc Natl Acad Sci U S A. 107 (50), 21677-21682 (2010).
- Gupta, G. P., et al. Mediators of vascular remodelling co-opted for sequential steps in lung metastasis. Nature. 446 (7137), 765-770 (2007).
- Kosaka, N., et al. Neutral sphingomyelinase 2 (nSMase2)-dependent exosomal transfer of angiogenic microRNAs regulate cancer cell metastasis. J Biol Chem. 288 (15), 10849-10859 (2013).
- Hoshino, A., et al. Tumour exosome integrins determine organotropic metastasis. Nature. 527 (7578), 329-335 (2015).
- Jaskelioff, M., et al. Telomerase deficiency and telomere dysfunction inhibit mammary tumors induced by polyomavirus middle T oncogene. Oncogene. 28 (48), 4225-4236 (2009).
- Si, L. L., Lv, L., Zhou, W. H., Hu, W. D. Establishment and identification of human primary lung cancer cell culture in vitro. Int J Clin Exp Pathol. 8 (6), 6540-6546 (2015).
- Weng, D., et al. Metastasis is an early event in mouse mammary carcinomas and is associated with cells bearing stem cell markers. Breast Cancer Res. 14 (1), R18(2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados