Method Article
El establecimiento de un ensayo de colonización pulmonar para la visualización de células tumorales en tejidos pulmonares de la circulación
En este artículo
Resumen
Un modelo animal es necesario para descifrar el papel de las células del tumor (CTC) en la promoción de la colonización durante la metástasis del cáncer de pulmón en circulación. Aquí, hemos establecido y realizado con éxito un en vivo ensayo a prueba específicamente el requisito de fibronectina poliméricos (polyFN) Asamblea CTC para la colonización del pulmón.
Resumen
La metástasis es la principal causa de muerte por cáncer. El papel de la circulación de las células del tumor (CTC) en la promoción de metástasis del cáncer, en el cual la colonización pulmonar por CTC críticamente contribuye a principios procesos metastásicos de pulmón, se ha investigado vigorosamente. Así, los modelos animales son el único enfoque que captura el proceso completo sistémico de metástasis. Teniendo en cuenta que tiene problemas en los diseños experimentales para examinar las contribuciones de CTC a la extravasación de los vasos sanguíneos, se estableció un ensayo de colonización en vivo pulmón en que a largo plazo la fluorescencia de la célula-tracer, carboxyfluorescein succinimidyl éster (CFSE), fue utilizado para identificar células tumorales suspendido y perfusión del pulmón fue realizada para claro no específicamente atrapado CTC antes de la extirpación de pulmón, proyección de imagen confocal y la cuantificación. Polimérico fibronectina (polyFN) montado en superficies CTC se ha encontrado para mediar la colonización del pulmón en el establecimiento final de los tejidos del tumor metastásico. Aquí, para probar específicamente el requisito de polyFN Asamblea CTC para la colonización del pulmón y la extravasación, se realiza a corto plazo ensayos de colonización pulmonar en el cual suspendieron Lewis lung carcinoma células (SRL) estable expresan FN-shRNA (shFN) o despegue en tiempo mínimo-shRNA (shScr) y previamente con 20 μM de CFSE fueron inoculados por vía intravenosa en ratones C57BL/6. Hemos demostrado con éxito que las capacidades de las células LLC shFN para colonizar los pulmones de ratón fueron disminuidas significativamente en comparación con las células LLC de shScr. Por lo tanto, esta metodología a corto plazo puede ser ampliamente aplicada para demostrar específicamente la capacidad de CTC dentro de la circulación para colonizar los pulmones.
Introducción
La metástasis es la principal causa de muerte de cáncer1,2. Las células tumorales derivadas de tejidos primarios entrar en la circulación en suspensión y sobreviven varios desafíos hematógenas, por ejemplo, anoikis, inmunes agresiones y daños debido a la tensión de esquileo de la tensión arterial o las limitaciones geométricas, antes de que se capaz de colonizar órganos distantes, un paso clave que dicta el éxito de metástasis3,4,5,6. Por lo tanto, actualmente se han hecho esfuerzos vigorosos en la caracterización de las células tumorales circulantes (CTC) y la correlación de estas características con la malignidad del tumor, metástasis y tasas de supervivencia de cáncer pacientes7,8 , 9. puesto que el proceso de metástasis del cáncer específicamente describe un evento en vivo , modelos animales son el único enfoque que captura el proceso completo sistémico de metástasis10,11,12 .
CTC se convierten en los tejidos del tumor metastásico a través de varios eventos celulares, incluyendo la colonización de órganos distantes1,2. Sin embargo, la metástasis más utilizados ensayos13,14,15 no proporcionan una manera de observar la colonización de CTC de órganos distantes. Por lo tanto, es urgente un diseño de ensayo en vivo para la visualización de colonización de CTC. Aunque varios in vivo y ex vivo corta desventajas, problemas y colonización de pulmón del término se han diseñado ensayos permanecen. Por ejemplo, mientras que la proteína de fluorescencia verde (GFP)-expresando tumor las células se han utilizado en estos ensayos de22,23, se necesita tiempo para transfectar estable y clon de células tumorales con suficiente intensidad fluorescente GFP bajo el microscopio. Del mismo modo, aunque la coloración transitoria de las células del tumor con el rastreador de celulares a largo plazo CFSE se ha empleado para reemplazar las células del tumor expresando GFP, sigue siendo difícil juzgar si las células tumorales marcados con CFSE se adjuntan o simplemente presentes dentro de la vasculatura del suprimido órganos distantes16,17.
Polimérico fibronectina (polyFN) montado en superficies de CTC se ha encontrado para contribuir críticamente al establecimiento final del tumor metastático tejidos18,19,20,21,22 . Aquí, se realizaron a corto plazo ensayos de colonización pulmonar en que células de carcinoma de pulmón Lewis suspendidos (SRL) estable expresando FN-shRNA (shFN) o scramble-shRNA (shScr) y previamente etiquetado con CFSE fueron inoculados por vía intravenosa en ratones C57BL/6. Después de 2-3 días, los pulmones de ratón fueron perfundidos primero con tampón fosfato salino (PBS) para eliminar completamente la CTC suelto dentro de la vasculatura antes de ser sometido a microscopia confocal y la cuantificación de colonización pulmonar limitada. Demostró claramente que los números de colonización pulmonar shFN sociedad de responsabilidad limitada y los nódulos del tumor se redujeron significativamente en comparación con el shScr sociedad de responsabilidad limitada, corroborando sustancialmente el papel de la Asamblea polyFN el CTC en la facilitación de la colonización y el crecimiento de CTC en la pulmones. Nuestro estudio requiere más investigación para el papel de polyFN en metástasis del cáncer.
Protocolo
Todos los experimentos en ratones fueron realizados según las directrices de nuestro Instituto (la guía para el cuidado y uso de animales de laboratorio, NCKU Medical College).
1. preparación de instrumentos, medios de cultivo y platos
- Antes de iniciar los protocolos experimentales, obtener suturas quirúrgicas estériles, jeringas de 1 mL con aguja de 26G/0,5 cm (para la cola inyección en la vena), jeringas de 3 mL con aguja 24G/3 cm (para el pulmón de la perfusión), modificado Eagle Media (DMEM de Dulbecco), solución de tripsina-EDTA (5 Contabilidad tripsina y 0,53 mM), suero bovino fetal (FBS), 1 x PBS (NaCl 137 mM, 2,7 mM KCl, 10 mM Na2PHO4y 1,8 mM KH2PO4) y 6 cm cultura platos.
2. preparación y recuperación de las células tumorales en suspensión
- Preparación estéril de Dulbecco modificado Eagle Media (DMEM) que contienen 10% o 20% FBS y recién agregar 2 mM L-glutamina, 1 x PBS y 0.05% tripsina-EDTA.
- Cultura de las células en DMEM suplementado con 10% SBF a 37 ° C y cultivarlas hasta que haya confluencia de 70-80% en la placa de cultivo.
- Retire los medios de cultivo (DMEM) de los platos, seguidos por dos lavados con 2 mL de PBS estéril 1 x.
- Añadir 1 mL de 0.05% tripsina-EDTA en los platos para cubrir completamente todas las células. Inmediatamente retire 800 μL de la solución y deje sólo 200 μL en los platos. Incubar las placas a 37 ° C durante 30 s a 1 minuto (dependiendo del tipo de célula) y espere hasta que la mayoría de las células está en estado suspendido.
- Añadir 1 mL de DMEM fresco que contiene 10% FBS directamente en los platos para detener la actividad enzimática de la tripsina y vigorosamente pipetear la suspensión hacia arriba y hacia abajo con una pipeta de 1000 μL para preparar una suspensión unicelular.
- Transferir las células desde el plato a un tubo de microcentrífuga de 1,5 mL y desactivación de las células a temperatura ambiente a 162 x g durante 3 minutos.
- Aspirar el sobrenadante y resuspender el tumor de células en 1,5 mL DMEM que contiene 20% FBS y por fin girar las células en suspensión a 37 ° C por 2 h.
Nota: Si el medio se vuelve amarillo durante la recuperación, intercambiar el viejo medio con medio fresco que contiene 20% FBS.
3. fluorescencia de tinción y análisis de las células tumorales en suspensión con Succinimidyl éster Carboxyfluorescein (CFSE)
- Después de la recuperación de células en suspensión, contar el número de células viables apropiadas con azul de tripano en un Neubauer recuento de cámara para valorar la dosis de tinción de fluorescencia y para cola de inyección de la vena.
- Desactivación de las células a 162 x g a temperatura ambiente durante 3 min y resuspender que las células concentradas en 1 mL de esterilización 1 x PBS, seguido de centrifugación temperatura 162 x g durante 3 minutos.
- Resuspender las células sedimentadas en 500 μl de PBS de X 1 que contiene 10% FBS y 0, 5, 10, 20 o 40 μm CFSE para titulación de la dosis y se incuba la suspensión de células a 37 oC por 10 min en la oscuridad.
- Desactivación de las células a 162 x g a temperatura ambiente durante 3 min y resuspender las células pildoradas con 4 mL de DMEM que contenía 1% FBS. Repetir este lavado tres veces más. Resuspender las células pildoradas con 4 mL de DMEM solo para el lavado final.
- Someter las células CFSE marcado a celular activado por fluorescencia clasificación análisis (FACS) para cuantificar la intensidad de fluorescencia de una sola célula, o inyección en la vena de la cola.
Nota: Mantenga las células en hielo antes de realizar las inyecciones de vena de análisis o cola de FACS.
4. ensayo de colonización pulmonar
- Preparar las células etiquetadas con 20 μm CFSE (véase pasos 3.1 a 3.4).
Nota: Decidir la dosis de trabajo de la CFSE para el etiquetado de las células del tumor, basadas en los resultados de la valoración del análisis FACS (consulte paso 3.3). - Calentamiento de las colas de los 4-6 semanas-viejo macho C57BL/6 ratones (6) con una lámpara de haluro para 5-10 minutos sobre una base de ratón por ratón para dilatar las venas de cola de ratón.
- Mezcle completamente y aspirar las células tumorales marcados con CFSE con una jeringa de 1 mL (26Gx1/2), evitando las burbujas en la suspensión de células (con una densidad celular final de 5 x 106 células/mL).
- Cuidadosamente inyecte 1 x106 células de tumor CFSE-etiquetados en 200 μL de DMEM en la vena de la cola de ratón, que debe presentarse en un limitador de ratón.
Nota: Durante la inyección, si la aguja se coloca directamente en el lumen de la vena de la cola, las células tumorales deben fácilmente enviar a la circulación sin necesidad de empujar duro en la jeringa. Si es difícil para las células del tumor a través de, han probablemente ha inyectado fuera de la vena de la cola, en el espacio subcutáneo. - Dividir los ratones que recibieron por vía intravenosa las células tumorales marcados con CFSE en dos grupos: un grupo será sometido a perfusión pulmonar seguida de microscopía confocal y cuantificación de ImageJ en el ensayo de colonización del pulmón y el otro quedará solo para 4-5 semanas en la colonización del pulmón a largo plazo del análisis.
- Con 20, 38 o 45 h y de 1 x 106 células del tumor inyectadas por vía intravenosa durante una titulación de curso - y dependiente de la dosis de tiempo, anestesiar a ratones con tumores con 50-75 mg/kg zoletil 50, que es un bien aceptado y adecuado anesthetizer23.
Nota: Uso veterinario el ungüento en los ojos de los ratones para evitar sequedad mientras esté bajo anestesia. - Corte longitudinalmente la piel y tejido subcutáneo del abdomen a la región del pecho con tijeras quirúrgicas. Abrir la cavidad pleural con tijeras quirúrgicas y pinzas para exponer completamente el corazón y los pulmones.
Nota: Tenga cuidado para evitar cortar los vasos sanguíneos. - Atar la vena cava superior (SVC) y vena cava inferior (IVC) con suturas quirúrgicas estériles para prevenir el reflujo de la solución de perfusión durante la perfusión pulmonar.
- Cortar la pared del ventrículo izquierdo con tijeras quirúrgicas para abrir una fisura (aproximadamente 2-4 mm) para drenar la solución de perfusión de los pulmones.
- Inyectar una jeringa de 3 mL 1 x PBS en el ventrículo derecho y quitar la solución de drenaje con aspiración constante durante la perfusión pulmonar hasta los pulmones de un color rojizo a totalmente claro.
5. confocal imagen microscópica y el análisis de las células tumorales de pulmón colonizado
- Retire los pulmones ahora pálido de la cavidad pleural y separe los cinco lóbulos por recortar las tráquea y el tejido conjuntivo ligamentos con tijera y pinzas quirúrgicas24.
- Preparar un soporte de la camilla como pulmón como se muestra en la figura 3B por una sutura de nylon de la bobina alrededor de dos barras de metal para producir una textura reticular con un espacio entre las dos barras para la colocación de los lóbulos del pulmón. Fijar el soporte del pulmón en un plato de 6 cm.
Nota: Se utilizará el soporte de pulmón para estabilizar los lóbulos del pulmón por debajo de la lente del objetivo de un microscopio confocal. - Lodge y fijar los lóbulos pulmonares sobre la textura reticular del titular del pulmón. Cubrir y humedezca los lóbulos del pulmón con 1 x PBS.
- La placa de cultivo de 6 cm que los lóbulos del pulmón en el soporte del pulmón a la microscopía confocal para capturar imágenes de fluorescencia, las células del tumor pulmonar colonizando la grabación del tema.
- Para la proyección de imagen, uso de lentes del objetivo (5 X, MPLN, NA: 0.1, WD: 20, aire).
- Gire la rueda de filtros a NIBA (excitación/emisión; 470-495 nm/510-550 nm) y a 488 nm láser para excitar la CFSE, claramente visualizar imágenes de puntos de fluorescencia en los lóbulos del pulmón.
- Gire la rueda de filtros a R690 (para el laser del MaiTai HP DeepSee) al escanear con el 2.0 μs/pixel exploración velocidad y optimizar los HV, ganancia y offset niveles.
- Captura de imágenes de fluorescencia (512 x 512 píxeles) usando el software del microscopio con un 10 μs/pixel velocidad de escaneado.
- Cuantificar y analizar estadísticamente las imágenes microscópicas utilizando el software ImageJ y GraphPad como se describió anteriormente21.
6. largo plazo ensayos de colonización pulmonar
Nota: Repita los pasos 4.1 a 4.5.
- Sacrificar a los ratones después de la inoculación de células del tumor para 4-5 semanas y se fijan sus pulmones con líquido de Bouin25 durante 1 a 2 días.
- Cuantificar y analizar estadísticamente los nódulos tumorales de los pulmones de ratones con software21.
Resultados
Antes de realizar el ensayo de colonización en vivo pulmón como se ilustra en la figura 1A para probar si polyFN en las células del tumor suspendido media colonización pulmonar o extravasación en la facilitación de metástasis, lo primero graduado diferentes concentraciones de CFSE, un compuesto fluorescente que es célula permeable y covalente conjuga intracelular que contiene amina moléculas26,27 en las células del tumor suspendido y permanece en las células durante un largo período de tiempo. Encontramos que el tumor células efectivamente fueron etiquetadas con CFSE en forma dosis dependiente, como ilustrado en figura 1B. CFSE-etiquetado en 6 x10 LLC de5 células/mL casi alcanzó una meseta en el μm 20 como se ilustra en la figura 1.
Debido a la abundante red capilar estrecha que físicamente podría impedir el flujo de CTC en la vasculatura pulmonar, realizamos la CFSE-labeled LLC las células del pulmón perfusión en ratones inyectada por vía intravenosa para borrar no específicamente atrapado CTC, como ilustrado en la figura 1A antes del retiro del pulmón en cada punto del tiempo como se muestra en la figura 4. Antes de la perfusión, los pulmones estaban claramente rojizos debido a la presencia de sangre, como se ilustra en la panel de la izquierda de la figura 2. Los pulmones se convirtió en claras después de perfusión con 10-15 mL de 1 x PBS, como se muestra en el panel de la derecha de la figura 2.
Inmediatamente después de que los pulmones de ratón perfundido fueron quitados del espacio pleural, los lóbulos del pulmón fueron separados y montados en el soporte del pulmón colocado en platos como se muestra en la Figura 3A con 1 PBS x fondo cubriendo los lóbulos del pulmón. Los lóbulos del pulmón montados en el soporte del pulmón tal como se ilustra en la figura 3B se sometieron a la microscopía de fluorescencia confocal como se ilustra en la Figura 3A. Las células del tumor marcado con CFSE colonizar los pulmones fueron reflejadas como se ilustra en la parte superior del panel de la figura 3 y convertido en imágenes en blanco y negro como se muestra en el inferior de figura 3 para facilitar la cuantificación de la colonización del pulmón con el software Image J.
Inyectan por vía intravenosa shScr o shFN LLC las células que fueron etiquetadas con 20 μm CFSE y esperadas para un curso de tiempo de 24-72 h antes de realizar las perfusiones de pulmón y proyección de imagen de microscopio confocal. Cuantificación del tumor pulmonar colonizando las células en 6 ratones como se ilustra en la Figura 4A con el software ImageJ revelaron que significativamente menos células LLC shFN que shScr las células LLC se contaron en las 38 h y 45 h tiempo, como ilustrado en Figura 4B . La razón por qué los números de shScr colonizado por el pulmón y las células de la LLC shFN disminuidas gradualmente fue muy probablemente debido a la continua citotoxicidad ejercida por el fuero de la circulación incluso contra las células LLC ya colonizadas. En conjunto, estos resultados sugieren que polyFN montado en el CTC de hecho es necesaria en la mediación de colonización del pulmón por las células de la LLC, llevando a mas metástasis en los pulmones, según lo revelado por los resultados en algunos ratones que recibieron por vía intravenosa alícuotas de la CFSE-labeled shScr shFN LLC las células y para los ensayos de colonización pulmonar como se ilustra en la figura 4 se quedaron aloneuntil tumor del pulmón nódulos fueron desarrollados en el ensayo de metástasis de tumor experimental como se muestra en la figura 5A y 5B.
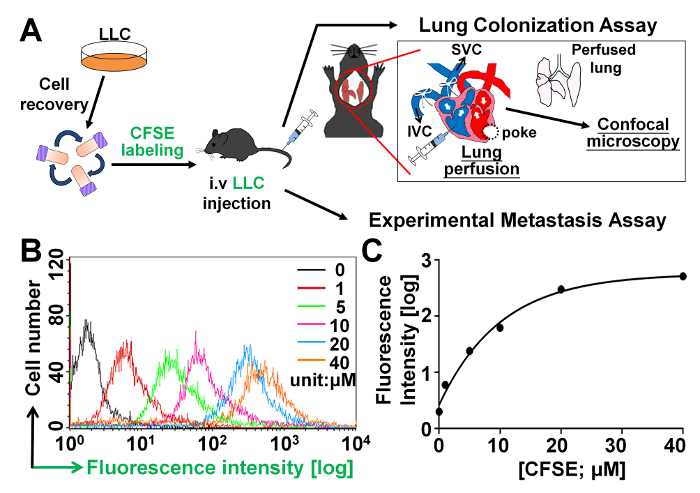
Figura 1: valoración de las concentraciones de la CFSE para el etiquetado de células tumorales en el ensayo de colonización pulmonar. (A) ilustración esquemática de los procedimientos para el ensayo de colonización del pulmón y el ensayo experimental de metástasis como se detalla en la sección de protocolos. (B) análisis FACS para las intensidades de fluorescencia de CFSE de células LLC que fueron manchadas con diferentes concentraciones de CFSE. (C) intensidades de fluorescencia se trazaron como funciones de diferentes concentraciones de CFSE. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: pulmones antes y después de la perfusión. Imágenes representativas de los pulmones antes de (unperfused; Unperf.) y después (perfusión; Perf.) realización de la perfusión pulmonar. Estrella de oro: corazón. Flecha blanca: el empate que cerró la IVC/SVC. Flechas rojas: los pulmones del ratón mismo antes y después de la perfusión. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: montaje de los lóbulos pulmonares perfundidos en el soporte del pulmón para microscopía confocal de fluorescencia. (A) esquema del pulmón-montaje del sostenedor del pulmón de la microscopía confocal. (B) una imagen representativa de 3 lóbulos pulmonares perfundidos en el soporte del pulmón. (C) imágenes representativas de la colonización pulmonar de las células LLC con la fluorescencia de la CFSE para la cuantificación por el software Image J. Panel superior: regular la proyección de imagen. Panel inferior: invierte la imagen en blanco y negro. Haga clic aquí para ver una versión más grande de esta figura.
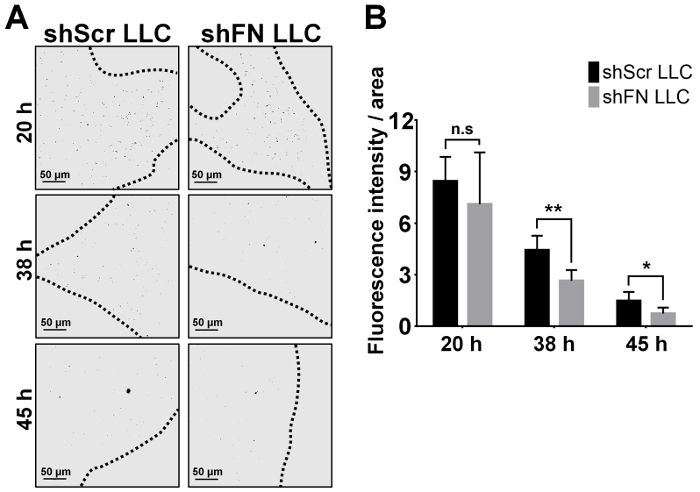
Figura 4: tiempo curso la proyección de imagen, cuantificación y análisis estadístico para el pulmón colonizaron las células LLC shScr y shFN después de la perfusión pulmonar en el ensayo de colonización pulmonar. (A) en blanco y negro imágenes representativas (convertidas de imágenes de fluorescencia) de las células LLC shScr y shFN que fueron colonizadas en la vasculatura pulmonar en diferentes puntos del tiempo, como se muestra después de la perfusión pulmonar extensa. Las líneas punteadas indican el borde de las áreas de tejido de pulmón confocal en foco. (B) cuantificación y análisis estadístico de las células LLC colonizando pulmón como visualizaron en (A) por un promedio de 5 imágenes representativas absoluta pulmón lóbulo/ratón. Nota: Cada barra indica la intensidad de fluorescencia promedio de cada área de foco confocal. Los datos estadísticamente analizados de 6 ratones y como media ± SD; n.s. significa no significativo; * medios p < 0.05; y ** significa p < 0.01; ANOVA de dos vías. Haga clic aquí para ver una versión más grande de esta figura.
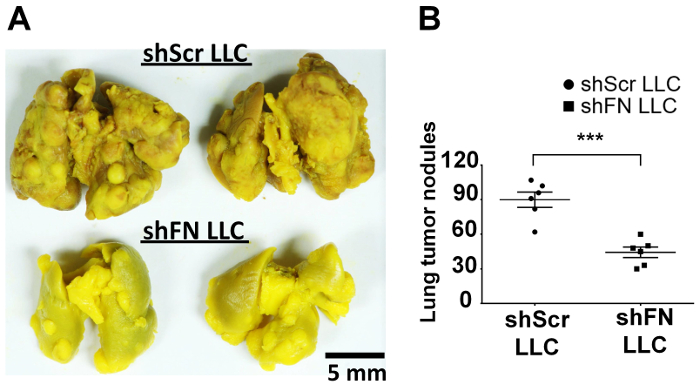
Figura 5: silenciar la expresión de FN en células LLC CFSE-labeled disminuye nódulos del tumor en los pulmones a largo plazo en ensayo de colonización CTC vivo. Los pulmones de ratón fijo en líquido de Bouin (A) con nódulos de tumor derivan de células LLC de shScr o shFN CFSE-labeled. (B) cuantificación y análisis estadístico para los nódulos de tumor en los pulmones. Datos se reportan como media ± SD; : p < 0.001; n = 6 por grupo; Prueba t no pareado. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Junto a largo plazo pulmonar colonización ensayos, corto plazo metodología empleamos aquí evaluar en vivo pulmón colonización por CTC en órganos distantes claramente dio a conocer y distingue el papel específico de polyFN montado en CTC en colonización los pulmones, que luego condujeron a la extravasación y procesos metastásicos18,19,20,21. Aunque etiquetado células con rastreador de celular a largo plazo CFSE nos permitida trazar la CTC inyectado por vía intravenosa durante tres días antes de la perfusión pulmonar y retener suficiente fluorescencia verde para fines cuantitativos, es imposible determinar directamente Si las células del tumor se encuentra dentro del lumen del vaso o tenían ya extravasada de los vasos sanguíneos. Para resolver este fluorescente problema, rojo rodamina conjugados dextrano que es capaz de atar no específicamente a lectinas expresadas en endothelia puede utilizarse para etiquetar la vasculatura pulmonar en el pulmón de la perfusión28,29, 30. a pesar del hecho de que la CFSE es un rastreador de celulares a largo plazo, su intensidad de fluorescencia es a la mitad cada división celular27, limitando el potencial de su uso en las técnicas. Para evitar este problema, debe determinarse que la dosificación Etiquetadora de CFSE es suficiente para que las células siguen siendo detectables para toda la duración de en vivo los experimentos y que cualquier tratamiento aplicado a las células no tiene efecto sobre la célula proliferación. Porque la comparación y la cuantificación de la colonización pulmonar shScr y shFN CTC se realizaron en ratones apartes, podría aducirse que las diferencias entre los dos grupos eran debido a la variación individual. Para excluir dicha variación, una mezcla de dos tipos de tumor células con distintos colorantes (por ejemplo, CM/CFSE-diI) de fluorescencia o estable transfectadas con GFP/dsRed se puede inyectar concomitante por vía intravenosa en el mismo animal en la colonización del pulmón ensayo31,32,33. Cabe destacar que clonación efectos derivados de la célula de tecnología que se intenta poner en orden estable de clonación clones de células transfectadas proteína fluorescente con fluorescencia suficientemente fuerte34,35, 36 , 37 puede hacer que las células clonadas no representativa para representar el entero poblaciones heterogéneas38,39,40. Si se desea una transfección estable de cualquier proteína fluorescente en células del tumor para los ensayos de colonización pulmonar, elevando la eficiencia de la transfección de las células del tumor en su totalidad mejor preservaran las características originales que la clonación de la célula poblaciones con suficiente fluorescencia41,42.
Los pasos de la perfusión pulmonar en la colonización del pulmón ensayos son necesarios en algunas células del tumor inyectado por vía intravenosa, en vez de arrestar a la red capilar pulmonar, específicamente tienden a ser atrapados mecánicamente y atorado en las redes capilares del pulmón tejidos debido a los diámetros medio de CTC que el ancho del pulmón lúmenes capilares43,44. Cuantificación de las células tumorales de pulmón colonizando sin inunda los pulmones puede resultar en una sobreestimación por error contando las células mecánicamente atascado45,46,47. Incluso si los pulmones han sido inundados, siendo problemas adicionales. Por ejemplo, es todavía difícil de distinguir de las células del tumor colonización pulmonar se encuentran en el endothelia lumenal o han ya extravasada de los vasos sanguíneos. Para resolver este problema, los vasos sanguíneos con rodamina-conjugados dextrano como ya mencionado la coloración puede ser útil30,48,49. Alternativamente, si se desea la cuantificación de la extravasación de tumor, quelante de calcio EDTA/EGTA o tripsina, una proteasa no específico, puede utilizarse en el búfer de perfusión para dependiente de calcio y - independiente tumor cell adhesión eventos50 , 51 , 52. así, las células del tumor en los tejidos pulmonares pueden considerarse extravasated.
Para la cuantificación de las células del tumor colonización pulmonar, los pulmones perfundidos a menudo son sometidos a tradicional microscopia confocal. Sin embargo, la mensurabilidad de tejido calado es limitada debido en parte a la autofluorescencia de los tejidos y efectos de dispersión de fluorescencia, representación más profunda los tejidos imperceptibles53,54. Un microscopio de dos fotones con mayor sensibilidad que un microscopio confocal tradicional es conveniente resolver los problemas en que la radiación infrarroja se utiliza en excitación de dos fotones con significativamente menos absorción por especímenes biológicos que la UV o luz azul-verde hace la técnica más adecuada para imágenes de especímenes gruesos55,56,57. Colonización pulmonar de las células del tumor son contadas por un promedio de número de células de tumor en varias imágenes confocales representativas, que no incluyen el número completo de la colonización pulmonar de las células del tumor en el pulmón entero de un animal individual. Para cuantificar los pulmones enteros en los ensayos de colonización pulmonar, podrían emplearse las células del tumor estable transfectadas con luciferasa y los pulmones perfundidos entonces podrían ser sometidos a IVIS imágenes después de la inoculación intravenosa de células del tumor suspendido en presencia de Luciferin46,58,59. Alternativamente, los pulmones perfundidos podrían picados en pedazos y sometidos a digestión enzimática con proteasas, p. ej., colagenasa, liberación de las células en suspensión60,61. El tumor de las células con colorantes de fluorescencia o estable transfected con fluorescencia de proteínas entonces podrían ser cuantificadas con celular activado por fluorescencia (FACS) análisis56,62de la clasificación.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer al Dr. Chang Ming-Min y Ya-Hsin contactar su soporte técnico. Este trabajo fue financiado por el Ministerio de ciencia y tecnología de Taiwán (la mayoría-103-2325-B-006-009, la mayoría-104-2325-B-006-001, la mayoría-105-2325-B-006-001 y MOST-106-2320-B-006-068-MY3) y el Ministerio de salud y bienestar (MOHW106-TDU-B-211-144004). Agradecemos también el apoyo del laboratorio de investigación central de la Facultad de medicina de la Universidad Nacional Cheng Kung, su microscopio confocal del multi-photon.
Materiales
| Name | Company | Catalog Number | Comments |
| Material | |||
| Bovine Serum Albumin (BSA) | Cyrusbioscience (Taipei, Taiwan) | 101-9048-46-8 | |
| Bouin's Fluid | MCC(medical chemical corporation)/POISON | 456-A-1GL | |
| CFSE Proliferation Dye | ebiosciences | 65-0850-85 | Full name: Carboxyfluorescein succinimidyl ester |
| Dulbecco's Modified Eagle Media (DMEM) | (Gibco)ThermoFisher Scientific | 12100-061 | |
| Ethylenediaminetetraacetic acid (EDTA) | Cyrusbioscience (Taipei, Taiwan) | 101-6381-92-6 | For prepared trypsin-EDTA solution( Final concentration: 0.53mM ) |
| Fetal bovine serum (FBS) | (Gibco)ThermoFisher Scientific | 10437-028 | |
| Lewis lung carcinoma (LLC) | ATCC, Manassas, VA, USA | CRL-1642 | |
| L-Glutamine, USP | (Gibco)ThermoFisher Scientific | 21051-024 | |
| Potassium chloride (KCl) | Cyrusbioscience (Taipei, Taiwan) | 101-7447-40-7 | For prepared 1X PBS ( Final concentration: 2.7mM ) |
| Potassium phosphate monobasic (KH2PO4) | Cyrusbioscience (Taipei, Taiwan) | 101-7778-77-0 | For prepared 1X PBS ( Final concentration: 1.8mM ) |
| Sodium chloride (NaCl) | Cyrusbioscience (Taipei, Taiwan) | 101-7647-14-5 | For prepared 1X PBS ( Final concentration: 137mM ) |
| Sodium phosphate dibasic (Na2HPO4) | Cyrusbioscience (Taipei, Taiwan) | 101-10039-32-4 | For prepared 1X PBS ( Final concentration: 10mM ) |
| Trypan Blue | Sigma Aldrich | T6146 | 0.5 g mix with 100 mL 1X PBS |
| Trypsin | Sigma Aldrich | T4799 | For prepared trypsin-EDTA solution ( Final concentration: 5g/L ) |
| Zoletil 50 | Virbac | To dilute with 1X PBS | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Compact Tabletop Centrifuge 2420 | KUBOTA Co. | 2420 | |
| Culture dish (6cm) | Wuxi NEST Biotechnology Co. | 705001 | |
| Disposable syringe (with needle) | Perfect Medical Industry Co. | 24G/3 cm;3 ml & 26G/0.5 cm;1 ml | |
| End over end mixer | C.T.I YOUNG CHENN | TS-20 | For suspended cells recovery |
| FACSCalibur (FACS) | BD biosciences | ||
| Forceps | Dimeda | 10.102.14 | |
| Forma Direct Heat CO2 incubator | Thermo Fisher Scientific Inc. | HEPA CLASS 100 | |
| Mouse restrainer (Cylindrical Restrainer 15-30 gm) | Stoelting | 51338 | |
| Multiphoton Confocal Microscope BX61WI | Olympus | FV1000MPE | |
| Neubauer counting chamber | Marienfeld-Superior | 640010 | |
| Surgical scissor | Dimeda | 08.370.11 | |
| Surgical sutures | UNIK SURGICAL SUTURES MFG. CO. | NO. 0034 | Black Braided silk; non-absorbable (25YD; U.S.P. 4/0) |
| 1.5 mL microcentrifuge tube | Wuxi NEST Biotechnology Co. | 615001 | |
| 15 mL Greiner tube | Greiner bio-one | 188271 |
Referencias
- Massague, J., Obenauf, A. C. Metastatic colonization by circulating tumour cells. Nature. 529 (7586), 298-306 (2016).
- Lambert, A. W., Pattabiraman, D. R., Weinberg, R. A. Emerging Biological Principles of Metastasis. Cell. 168 (4), 670-691 (2017).
- Mohme, M., Riethdorf, S., Pantel, K. Circulating and disseminated tumour cells - mechanisms of immune surveillance and escape. Nat Rev Clin Oncol. 14 (3), 155-167 (2017).
- Steinert, G., et al. Immune escape and survival mechanisms in circulating tumor cells of colorectal cancer. Cancer Res. 74 (6), 1694-1704 (2014).
- Mahauad-Fernandez, W. D., Okeoma, C. M. Cysteine-linked dimerization of BST-2 confers anoikis resistance to breast cancer cells by negating proapoptotic activities to promote tumor cell survival and growth. Cell Death Dis. 8 (3), e2687(2017).
- Maheswaran, S., Haber, D. A. Circulating tumor cells: a window into cancer biology and metastasis. Curr Opin Genet Dev. 20 (1), 96-99 (2010).
- Yu, M., et al. RNA sequencing of pancreatic circulating tumour cells implicates WNT signalling in metastasis. Nature. 487 (7408), 510-513 (2012).
- Adams, D. L., et al. Mitosis in circulating tumor cells stratifies highly aggressive breast carcinomas. Breast Cancer Res. 18 (1), 44(2016).
- Baccelli, I., et al. Identification of a population of blood circulating tumor cells from breast cancer patients that initiates metastasis in a xenograft assay. Nat Biotechnol. 31 (6), 539-544 (2013).
- Malladi, S., et al. Metastatic Latency and Immune Evasion through Autocrine Inhibition of WNT. Cell. 165 (1), 45-60 (2016).
- Spiegel, A., et al. Neutrophils Suppress Intraluminal NK Cell-Mediated Tumor Cell Clearance and Enhance Extravasation of Disseminated Carcinoma Cells. Cancer Discov. 6 (6), 630-649 (2016).
- Pattabiraman, D. R., et al. Activation of PKA leads to mesenchymal-to-epithelial transition and loss of tumor-initiating ability. Science. 351 (6277), aad3680(2016).
- van der Weyden, L., et al. Genome-wide in vivo screen identifies novel host regulators of metastatic colonization. Nature. 541 (7636), 233-236 (2017).
- Obenauf, A. C., et al. Therapy-induced tumour secretomes promote resistance and tumour progression. Nature. 520 (7547), 368-372 (2015).
- Genovese, G., et al. Synthetic vulnerabilities of mesenchymal subpopulations in pancreatic cancer. Nature. 542 (7641), 362-366 (2017).
- von Horsten, S., et al. Stereological quantification of carboxyfluorescein-labeled rat lung metastasis: a new method for the assessment of natural killer cell activity and tumor adhesion in vivo and in situ. J Immunol Methods. 239 (1-2), 25-34 (2000).
- Reymond, N., et al. Cdc42 promotes transendothelial migration of cancer cells through beta1 integrin. J Cell Biol. 199 (4), 653-668 (2012).
- Cheng, H. C., Abdel-Ghany, M., Elble, R. C., Pauli, B. U. Lung endothelial dipeptidyl peptidase IV promotes adhesion and metastasis of rat breast cancer cells via tumor cell surface-associated fibronectin. J Biol Chem. 273 (37), 24207-24215 (1998).
- Huang, L., et al. Protein kinase Cepsilon mediates polymeric fibronectin assembly on the surface of blood-borne rat breast cancer cells to promote pulmonary metastasis. J Biol Chem. 283 (12), 7616-7627 (2008).
- Chang, Y. H., et al. Secretomic analysis identifies alpha-1 antitrypsin (A1AT) as a required protein in cancer cell migration, invasion, and pericellular fibronectin assembly for facilitating lung colonization of lung adenocarcinoma cells. Mol Cell Proteomics. 11 (11), 1320-1339 (2012).
- Wang, Y. J., et al. Pterostilbene prevents AKT-ERK axis-mediated polymerization of surface fibronectin on suspended lung cancer cells independently of apoptosis and suppresses metastasis. J Hematol Oncol. 10 (1), 72(2017).
- Cheng, H. C., Abdel-Ghany, M., Pauli, B. U. A novel consensus motif in fibronectin mediates dipeptidyl peptidase IV adhesion and metastasis. J Biol Chem. 278 (27), 24600-24607 (2003).
- Hsu, Y. Y., et al. Thrombomodulin is an ezrin-interacting protein that controls epithelial morphology and promotes collective cell migration. FASEB J. 26 (8), 3440-3452 (2012).
- Arlt, M. J., Born, W., Fuchs, B. Improved visualization of lung metastases at single cell resolution in mice by combined in-situ perfusion of lung tissue and X-Gal staining of lacZ-tagged tumor cells. J Vis Exp. (66), e4162(2012).
- Shi, Y., Parhar, R. S., Zou, M., Al-Mohanna, F. A., Paterson, M. C. Gene therapy of melanoma pulmonary metastasis by intramuscular injection of plasmid DNA encoding tissue inhibitor of metalloproteinases-1. Cancer Gene Ther. 9 (2), 126-132 (2002).
- Parish, C. R. Fluorescent dyes for lymphocyte migration and proliferation studies. Immunol Cell Biol. 77 (6), 499-508 (1999).
- Quah, B. J., Warren, H. S., Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat Protoc. 2 (9), 2049-2056 (2007).
- Migone, F. F., et al. In vivo imaging reveals an essential role of vasoconstriction in rupture of the ovarian follicle at ovulation. Proc Natl Acad Sci U S A. 113 (8), 2294-2299 (2016).
- Itkin, T., et al. Distinct bone marrow blood vessels differentially regulate haematopoiesis. Nature. 532 (7599), 323-328 (2016).
- Jiang, M., Qin, C., Han, M. Primary breast cancer induces pulmonary vascular hyperpermeability and promotes metastasis via the VEGF-PKC pathway. Mol Carcinog. 55 (6), 1087-1095 (2016).
- Aceto, N., et al. Circulating tumor cell clusters are oligoclonal precursors of breast cancer metastasis. Cell. 158 (5), 1110-1122 (2014).
- Zheng, Y., et al. Expression of beta-globin by cancer cells promotes cell survival during blood-borne dissemination. Nat Commun. 8, 14344(2017).
- Chen, X., et al. Retinoic acid facilitates inactivated transmissible gastroenteritis virus induction of CD8(+) T-cell migration to the porcine gut. Sci Rep. 6, 24152(2016).
- Saranchova, I., et al. Discovery of a Metastatic Immune Escape Mechanism Initiated by the Loss of Expression of the Tumour Biomarker Interleukin-33. Sci Rep. 6, 30555(2016).
- Ahmed, M., et al. An Osteopontin/CD44 Axis in RhoGDI2-Mediated Metastasis Suppression. Cancer Cell. 30 (3), 432-443 (2016).
- Hoffman, R. M. In vivo imaging of metastatic cancer with fluorescent proteins. Cell Death Differ. 9 (8), 786-789 (2002).
- Mendoza, A., et al. Modeling metastasis biology and therapy in real time in the mouse lung. J Clin Invest. 120 (8), 2979-2988 (2010).
- Meacham, C. E., Morrison, S. J. Tumour heterogeneity and cancer cell plasticity. Nature. 501 (7467), 328-337 (2013).
- Wagenblast, E., et al. A model of breast cancer heterogeneity reveals vascular mimicry as a driver of metastasis. Nature. 520 (7547), 358-362 (2015).
- Nguyen, D. X., Bos, P. D., Massague, J. Metastasis: from dissemination to organ-specific colonization. Nat Rev Cancer. 9 (4), 274-284 (2009).
- Ragelle, H., et al. Chitosan nanoparticles for siRNA delivery: optimizing formulation to increase stability and efficiency. J Control Release. 176, 54-63 (2014).
- Chu, V. T., et al. Increasing the efficiency of homology-directed repair for CRISPR-Cas9-induced precise gene editing in mammalian cells. Nat Biotechnol. 33 (5), 543-548 (2015).
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nat Rev Cancer. 11 (7), 512-522 (2011).
- Joyce, J. A., Pollard, J. W. Microenvironmental regulation of metastasis. Nat Rev Cancer. 9 (4), 239-252 (2009).
- Sanchez-Laorden, B., et al. BRAF inhibitors induce metastasis in RAS mutant or inhibitor-resistant melanoma cells by reactivating MEK and ERK signaling. Sci Signal. 7 (318), ra30(2014).
- Torchiaro, E., et al. Peritoneal and hematogenous metastases of ovarian cancer cells are both controlled by the p90RSK through a self-reinforcing cell autonomous mechanism. Oncotarget. 7 (1), 712-728 (2016).
- Wan, J., et al. Establishment of monoclonal HCC cell lines with organ site-specific tropisms. BMC Cancer. 15, 678(2015).
- Ye, Y., Liu, S., Wu, C., Sun, Z. TGFbeta modulates inflammatory cytokines and growth factors to create premetastatic microenvironment and stimulate lung metastasis. J Mol Histol. 46 (4-5), 365-375 (2015).
- Morales, M., et al. RARRES3 suppresses breast cancer lung metastasis by regulating adhesion and differentiation. EMBO Mol Med. 6 (7), 865-881 (2014).
- Stone, J. P., et al. Mechanical removal of dendritic cell-generating non-classical monocytes via ex vivo lung perfusion. J Heart Lung Transplant. 33 (8), 864-869 (2014).
- Vettorazzi, S., et al. Glucocorticoids limit acute lung inflammation in concert with inflammatory stimuli by induction of SphK1. Nat Commun. 6, 7796(2015).
- Urade, Y., Yoshida, R., Kitamura, H., Hayaishi, O. Induction of indoleamine 2,3-dioxygenase in alveolar interstitial cells of mouse lung by bacterial lipopolysaccharide. J Biol Chem. 258 (10), 6621-6627 (1983).
- Hong, G., et al. Through-skull fluorescence imaging of the brain in a new near-infrared window. Nat Photonics. 8 (9), 723-730 (2014).
- Liu, Q., Guo, B., Rao, Z., Zhang, B., Gong, J. R. Strong two-photon-induced fluorescence from photostable, biocompatible nitrogen-doped graphene quantum dots for cellular and deep-tissue imaging. Nano Lett. 13 (6), 2436-2441 (2013).
- Peti-Peterdi, J., Burford, J. L., Hackl, M. J. The first decade of using multiphoton microscopy for high-power kidney imaging. Am J Physiol Renal Physiol. 302 (2), F227-F233 (2012).
- Duda, D. G., et al. Malignant cells facilitate lung metastasis by bringing their own soil. Proc Natl Acad Sci U S A. 107 (50), 21677-21682 (2010).
- Gupta, G. P., et al. Mediators of vascular remodelling co-opted for sequential steps in lung metastasis. Nature. 446 (7137), 765-770 (2007).
- Kosaka, N., et al. Neutral sphingomyelinase 2 (nSMase2)-dependent exosomal transfer of angiogenic microRNAs regulate cancer cell metastasis. J Biol Chem. 288 (15), 10849-10859 (2013).
- Hoshino, A., et al. Tumour exosome integrins determine organotropic metastasis. Nature. 527 (7578), 329-335 (2015).
- Jaskelioff, M., et al. Telomerase deficiency and telomere dysfunction inhibit mammary tumors induced by polyomavirus middle T oncogene. Oncogene. 28 (48), 4225-4236 (2009).
- Si, L. L., Lv, L., Zhou, W. H., Hu, W. D. Establishment and identification of human primary lung cancer cell culture in vitro. Int J Clin Exp Pathol. 8 (6), 6540-6546 (2015).
- Weng, D., et al. Metastasis is an early event in mouse mammary carcinomas and is associated with cells bearing stem cell markers. Breast Cancer Res. 14 (1), R18(2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados