Method Article
Die Einrichtung eines Lunge Kolonisation Assays für zirkulierenden Tumor Zelle Visualisierung im Lungengewebe
In diesem Artikel
Zusammenfassung
Einem Tiermodell wird benötigt, um die Rolle der zirkulierende Tumorzellen (CTC) bei der Förderung der Lunge Kolonisation in Krebsmetastasen zu entschlüsseln. Hier wir etabliert und erfolgreich durchgeführt eine in Vivo assay, speziell Test das Erfordernis der Polymeren Fibronektin (PolyFN) Montage auf CTCs zur Besiedlung der Lunge.
Zusammenfassung
Metastasierung ist die Hauptursache für Tod durch Krebs. Die Rolle der zirkulierende Tumorzellen (CTC) bei der Förderung der Krebsmetastasen in der Lunge Besiedlung durch CTCs kritisch zu frühen Lunge metastasierendem Prozesse, trägt ist kräftig untersucht worden. Als solche sind Tiermodelle der einzige Ansatz, der die vollständige systemischen Prozess der Metastasierung erfasst. Angesichts der Tatsache, dass Probleme in früheren experimentellen Designs für die Prüfung der Beiträge von CTCs, Blutgefäß Extravasation auftreten, wir etabliert einen in Vivo Lunge Kolonisation Assay in denen ein long-term-Fluoreszenz Zelle-Tracer, Carboxyfluorescein Succinimidyl Ester (CFSE-), wurde verwendet, um abgehängte Tumorzellen zu beschriften und Perfusion der Lunge wurde durchgeführt, um unspezifisch eingeschlossene CTCs vor der Lunge entfernen, konfokale Bildgebung und Quantifizierung zu löschen. Polymeren Fibronektin (PolyFN) montiert auf CTC Oberflächen hat sich herausgestellt, um Lunge Kolonisation in die endgültige Etablierung des metastasierten Tumorgewebe zu vermitteln. Hier, um die Anforderung der PolyFN Montage auf CTCs Lunge Kolonisation und Extravasation speziell zu testen, wir führten kurzfristig Lunge Kolonisation Assays in denen ausgesetzt Lewis Karzinom Lungenzellen (LLC) mit dem stabil Ausdruck FN-ShRNA (ShFN) oder Scramble-ShRNA (ShScr) und Pre-beschriftet mit 20 μM CFSE wurden intravenös in C57BL/6 Mäusen geimpft. Wir bewiesen erfolgreich, dass die Fähigkeiten von ShFN LLC Zellen der Maus-Lunge besiedeln im Vergleich zu ShScr LLC Zellen erheblich vermindert wurden. Daher kann diese kurzfristige Methode weit angewendet werden, um speziell die Fähigkeit der CTC innerhalb der Zirkulation um die Lunge zu kolonisieren zu demonstrieren.
Einleitung
Metastasierung ist die Hauptursache von Krebs Tod1,2. Abgeleitet von primären Gewebe Tumorzellen geben Sie die Zirkulation in der Schwebe und verschiedenen Hämatogene Herausforderungen, z. B.Anoikis, immun Angriffe und Schäden, die durch Scherbeanspruchung von Blutdruck oder geometrische Abhängigkeiten zu überleben, bevor sie sind in der Lage, entfernte Organe besiedeln ein Schlüsselschritt diktieren den Erfolg von Metastasen3,4,5,6. Daher wurden große Anstrengungen Unternehmen derzeit vorgenommen in Charakterisierung zirkulierende Tumorzellen (CTC) und korrelieren diese Eigenschaften mit malignen Tumor, Metastasen und Überlebensraten von Krebs Patienten7,8 , 9. da der Prozess der Krebsmetastasen speziell ein Ereignis in Vivo zeigt, Tiermodelle sind der einzige Ansatz, der die vollständige systemischen Prozess der Metastasierung10,11,12 erfasst .
CTC werden metastasiertem Tumorgewebe durch mehrere zelluläre Ereignisse, einschließlich der Besiedlung von entfernten Organen1,2. Jedoch bieten die am häufigsten verwendeten Metastasierung Assays13,14,15 keine Möglichkeit, CTC Besiedlung des entfernten Organen zu beobachten. Eine in-Vivo -Assay-Design für CTC Kolonisation Visualisierung ist daher dringend erforderlich. Obwohl mehrere in Vivo und ex Vivo kurze bleiben Begriff Lunge Kolonisation Assays wurden entwickelt, Probleme und Nachteile. Zum Beispiel zwar grüne Fluoreszenz-Protein (GFP)-überexprimierenden Zellen in diesen werden Tumor Proben22,23, es braucht Zeit, stabil transfizieren und Tumorzellen mit ausreichender GFP Fluoreszenz-Intensität unter Klonen Das Mikroskop. In ähnlicher Weise zwar vorübergehende Verfärbung von Tumorzellen mit dem langfristigen Zelle Tracer CFSE-beschäftigt war, die GFP exprimierenden Tumorzellen zu ersetzen, es bleibt schwer zu beurteilen, ob die mit der Bezeichnung von CFSE-Tumorzellen angebracht sind oder nur vorhanden in der Gefäßsystem der ausgeschnittenen entfernte Organe16,17.
Polymeren Fibronektin (PolyFN) montiert auf Oberflächen von CTCs wurde gefunden, um kritisch dazu beitragen, die endgültige Etablierung des metastasierten Tumor Gewebe18,19,20,21,22 . Hier führten wir kurzfristig Lunge Kolonisation Assays in die abgehängten Lewis Karzinom Lungenzellen (LLC) stabil FN-ShRNA (ShFN) oder Scramble-ShRNA (ShScr) zum Ausdruck bringen und vorher beschriftet mit CFSE intravenös in C57BL/6 Mäusen geimpft wurden. Nach 2-3 Tagen waren Maus Lungen zuerst mit Phosphat gepufferte Kochsalzlösung (PBS) völlig ungebunden CTCs in das Gefäßsystem entfernen, bevor ausgesetzt konfokalen Mikroskopie und Quantifizierung der Lunge besiedeln LLCs durchblutet. Wir zeigten deutlich, dass die Zahl der Lunge besiedeln ShFN LLC und Tumor Knötchen im Vergleich zu ShScr LLC, im Wesentlichen die Rolle der PolyFN Versammlung auf CTCs bei der Erleichterung der Kolonisation und des Wachstums von CTCs im erhärten deutlich reduziert wurden die lungen. Unsere Studie rechtfertigt weitere Untersuchung für die Rolle des PolyFN in Krebsmetastasen.
Protokoll
Alle Experimente an Mäusen wurden nach den Richtlinien unseres Instituts (das Handbuch für Pflege und Verwendung von Labortieren, NCKU Medical College) durchgeführt.
1. Vorbereitung der Instrumente, Kultur, Medien und Gerichte
- Vor dem Start der experimentelle Protokolle erhalten steriles chirurgisches Nahtmaterial, 1 mL Spritzen mit 26G/0,5 cm Nadel (Injektionslösung Schweif Vene), 3 mL Spritzen mit 24G/3 cm Nadel (für Lunge Perfusion), Dulbeccos geändert Eagle Media (DMEM), Trypsin-EDTA-Lösung (5 g/L Trypsin und 0,53 mM), fetale bovine Serum (FBS), 1 X PBS (137 mM NaCl, 2,7 mM KCl, 10 mM Na2PHO4und 1,8 mM KH2PO4) und 6 cm Kultur Gerichte.
2. Vorbereitung und Rückgewinnung von Tumorzellen in der Schwebe
- Bereiten Sie sterile Dulbecco geändert Eagle Media (DMEM) mit 10 % oder 20 % FBS und frisch fügen 2 mM L-Glutamin, 1 X PBS und 0,05 % Trypsin-EDTA.
- Kultur der Zellen in DMEM mit 10 % ergänzt FBS bei 37 ° C und sie wachsen, bis gibt es 70-80 % Zusammenfluss in der Kulturschale.
- Die Gerichte, gefolgt von zwei Wäschen mit 2 mL sterilen 1 X PBS entnehmen Sie Nährmedien (DMEM).
- Fügen Sie 1 mL 0,05 % Trypsin-EDTA in den Gerichten um die Zellen gründlich zu decken. Entfernen Sie 800 μl Lösung sofort und verlassen Sie nur 200 μL in den Gerichten. Inkubieren Sie die Gerichte bei 37 ° C für 30 s, 1 min (je nach Zelltyp) und warten Sie, bis der Großteil der Zellen im angehaltenen Zustand sind.
- Fügen Sie 1 mL frische DMEM mit 10 % FBS direkt in die Gerichte, die enzymatische Aktivität von Trypsin und energisch zu stoppen pipette die Zellsuspension nach oben und unten mit einer 1000 µL Pipette, einen einzigen Zellsuspension vorzubereiten.
- Übertragen Sie die Zellen aus der Schale zu einem 1,5 mL Microcentrifuge Schlauch und spin-down der Zellen bei Raumtemperatur bei 162 X g 3 Minuten lang.
- Aspirieren überstand und Aufschwemmen der Tumorzellen in 1,5 mL DMEM mit 20 % FBS und Endverbraucher über die Zellen in der Suspension bei 37 ° C für 2 h drehen.
Hinweis: Wenn das Medium während der Wiederherstellung gelb dargestellt wird, tauschen Sie das alte Medium mit frisches Medium mit 20 % FBS.
(3) Fluoreszenz-Färbung und Analyse von Tumorzellen in der Schwebe mit Carboxyfluorescein Succinimidyl Ester (CFSE-)
- Nach der Wiederherstellung der Zelle in der Schwebe zählen die entsprechenden lebensfähigen Zelle Zahlen mit Trypan blau in eine Kammer für die Fluoreszenz Färbung Dosen titrieren zählen Neubauer und für Tail Ader Injektion.
- Spin-down der Zellen bei 162 X g bei Raumtemperatur für 3 min und Aufschwemmen der gebeizte Zellen in 1 mL 1 X PBS, gefolgt von Raumtemperatur Zentrifugation bei 162 X g 3 min sterilisiert.
- Aufschwemmen gebeizte Zellen in 500 µL 1 X PBS mit 10 % FBS und 0, 5, 10, 20 oder 40 µM CFSE für dosistitration, und die Zellsuspension auf 37 oC für 10 Minuten im Dunkeln inkubieren.
- Spin-down der Zellen bei 162 X g bei Raumtemperatur 3 min und Aufschwemmen der gebeizte Zellen mit 4 mL DMEM mit 1 % FBS. Wiederholen Sie diese Waschschritt noch dreimal. Die gebeizte Zellen mit 4 mL DMEM allein für die letzte Wäsche aufzuwirbeln.
- CFSE--markierte Zellen zur Fluoreszenz-aktivierte Zelle Sortieren (FACS) Analyse zur Quantifizierung der Fluoreszenzintensität aus einer einzigen Zelle zu unterziehen, oder tail Vene Injektion.
Hinweis: Halten Sie die Zellen auf dem Eis vor der Durchführung der FACS Analyse oder Endstück Vene Spritzen.
(4) Lunge Kolonisation Assay
- Bereiten Sie die Zellen mit 20 µM CFSE beschriftet (siehe Schritte 3.1 bis 3.4).
Hinweis: Entscheiden die Arbeiten Dosis von CFSE-zur Kennzeichnung von Tumorzellen, basierend auf den Ergebnissen der Titration der FACS-Analyse (siehe Schritt 3.3). - Wärmen Sie den Schwänzen von 4-6 Wochen-alten männlichen C57BL/6 Mäusen (6 Mäuse) mit einer Halogenid-Lampe für ca. 5-10 min auf Basis von Maus zu Maus, Maus Schweif Venen erweitern.
- Gründlich mischen und mit der Bezeichnung von CFSE-Tumorzellen mit einer 1 mL (26Gx1/2)-Spritze, Vermeidung von Bläschen in der Zellsuspension (mit einer endgültigen Zelldichte von 5 x 106 Zellen/mL) Aspirieren.
- Sorgfältig zu injizieren 1 X106 CFSE--Label Tumorzellen in 200 µL DMEM in die Maus Schweif Vene, die in eine Maus Restrainer eingereicht werden sollte.
Hinweis: Während der Injektion, wenn die Nadel direkt in das Lumen der Schweif Vene befindet sollte Tumorzellen leicht in den Blutkreislauf geliefert werden ohne Druck auf die Spritze. Ist es schwer, die Tumorzellen durch drücken, haben sie höchstwahrscheinlich in den subkutanen Raum außerhalb der Schweif Vene injiziert. - Die Mäuse, die intravenös die CFSE-beschriftet Tumorzellen in zwei Gruppen erhalten unterteilen: eine Gruppe durchläuft Perfusion der Lunge gefolgt von konfokalen Mikroskopie und ImageJ Quantifizierung in der Lunge Kolonisation Assay und der andere bleibt allein für 4-5 Wochen in der langfristig Lunge Kolonisation assay.
- Betäuben Sie bei 20, 38 oder 45 h und 1 x 106 Tumorzellen intravenös injiziert, während einer Zeit Kurs und dosisabhängige Titration Tumor-tragenden Mäusen mit 50-75 mg/kg Zoletil 50, ist ein gut angenommen und ordnungsgemäße Anesthetizer23.
Hinweis: Verwendung Tierarzt Salbe auf die Mäuse Augen Trockenheit während der Narkose zu verhindern. - Längs geschnitten Sie der Haut und subkutanen Gewebe aus dem Bauch, der Brustbereich mit Chirurgische Schere. Öffnen Sie den pleuralen Raum mit chirurgische Scheren und Pinzetten, Herz und Lunge voll verfügbar zu machen.
Hinweis: Seien Sie vorsichtig Abschneiden Blutgefäße zu vermeiden. - Binden Sie die überlegene Vena Cava (SVC) und unteren Hohlvene (IVC) mit sterilem chirurgischem Nahtmaterial, den Rückfluss der Perfusion Lösung während der Perfusion der Lunge zu verhindern.
- Schneiden Sie die Wand des linken Ventrikels mit chirurgische Scheren, einen Riss (ca. 2-4 mm) um die Perfusion Lösung aus den Lungen entleeren zu öffnen.
- Injizieren Sie 1 X PBS in die Rechte Herzkammer mit einer 3 mL Spritze und entfernen Sie die Abgetropfte Lösung mit konstanter Absaugung während der Perfusion der Lunge zu, bis die Lunge von einem rötlichen Farbe völlig blass zuwenden.
5. konfokale mikroskopische Bildgebung und Analyse der Lunge kolonisiert Tumorzellen
- Entfernen Sie die Lunge jetzt blass aus der Pleurahöhle und trennen Sie die fünf Lappen durch die Luftröhre und Bindegewebe Bänder mit chirurgische Scheren und Pinzetten24wegschneiden.
- Bereiten Sie einen Keilrahmen-wie Lunge Halter wie in Abbildung 3 b dargestellt durch eine Nylon-Naht wickeln um zwei Metallstangen, netzartig Textur mit einem Leerzeichen zwischen den beiden Stangen für die Platzierung der Lungenlappen zu produzieren. Die Lunge-Halter in einer Petrischale 6 cm eingestellt.
Hinweis: Die Lunge Halter wird eingesetzt werden, die Lungenlappen unterhalb der Objektivlinse eines Konfokalen Mikroskops zu stabilisieren. - Einlegen Sie und fixieren Sie die Lungenlappen auf die netzartig Textur des Inhabers Lunge. Decken Sie und befeuchten Sie die Lungenlappen mit 1 X PBS.
- Thema der 6-cm-Kulturschale beherbergen die Lungenlappen auf die Lunge Inhaber konfokalen Mikroskopie Fluoreszenzbilder Aufnahme der Lunge besiedeln Tumorzellen zu erfassen.
- Verwenden Sie für die Bildgebung, Objektive (5 X, MPLN, NA: 0.1, WD: 20, Luft).
- Drehen Sie das Filterrad, NIBA (Anregung/Emission; 470-495 nm/510-550 nm) und mit 488 nm Laser um CFSE deutlich zu visualisieren, Bilder von Fluoreszenz-Punkte in die Lungenlappen zu begeistern.
- Drehen Sie das Filterrad, R690 (für MaiTai HP InterSystems Laser) mit 2.0 Scan µs/Pixel Scannen beschleunigen und optimieren die HV, Gain und Offset Ebenen.
- Fluoreszenzbilder (512 x 512 Pixel) zu erfassen, mithilfe der Mikroskop-Software mit einer 10 µs/Pixel Scan-Geschwindigkeit.
- Quantifizieren Sie und analysieren Sie statistisch die mikroskopischen Aufnahmen mit ImageJ und GraphPad Software als zuvor beschriebenen21.
(6) langfristig Lunge Kolonisation assays
Hinweis: Wiederholen Sie die Schritte 4.1 bis 4.5.
- Opfern Sie die Mäuse nach Tumor Zelle Inokulation für 4-5 Wochen zu und fixieren Sie ihre Lungen mit Bouins Fluid25 für 1 bis 2 Tage.
- Quantifizieren Sie und analysieren Sie statistisch die Knötchen Tumor aus der Lunge von Mäusen mit Software21.
Ergebnisse
Vor der Durchführung der in Vivo Lunge Kolonisation Assay titriert wie abgebildet in Figur 1A zu testen, ob PolyFN auf abgehängte Tumorzellen Lunge Kolonisation und/oder Paravasation bei der Erleichterung der Metastasierung, vermittelt wir zunächst verschiedene Konzentrationen von CFSE, eine fluoreszierende Substanz, die Zelle durchlässig ist und kovalent Konjugate intrazellulären Amin-haltige Moleküle26,27 in abgehängten Tumorzellen und bleibt in den Zellen für längere Zeit. Wir fanden diesen Tumor Zellen effektiv in einer Dosis-abhängigen Weise, wie in dargestellt Abbildung 1 bmit CFSE beschriftet wurden. Die CFSE--Kennzeichnung in 6 X105 LLC Zellen/mL fast ein Plateau bei 20 µM als erreicht in Abbildung 1dargestellt.
Aufgrund der reichlich verengten Kapillarsystem, welche physisch die CTCs in das Gefäßsystem der Lunge hemmen könnte, führten wir Perfusion bei Mäusen mit intravenös injiziert mit der Bezeichnung von CFSE-LLC Lungenzellen um unspezifisch eingeschlossene CTCs als löschen vor dem Entfernen der Lunge zu jedem Zeitpunkt wie in Abbildung 4dargestellt dargestellt in Abbildung 1A . Vor Perfusion, die Lungen waren deutlich rötlich aufgrund des Vorhandenseins von Blut, wie in der linken Abbildung 2. Die Lunge wurde blass nach Perfusion mit 10-15 mL 1 X PBS, wie in der rechten Abbildung 2dargestellt.
Unmittelbar nach der PERFUNDIERTEN Maus-Lunge aus der Pleuraraum entfernt wurden, waren die Lungenlappen getrennt und auf die Lunge Halter platziert in Gerichten wie in Abbildung 3A mit 1 X PBS gründlich über die Lungenlappen montiert. Die Lungenlappen, montiert auf der Lunge-Halter wie in Bild 3 b illustriert wurden konfokale Fluoreszenzmikroskopie wie in Abbildung 3Aunterzogen. Besiedeln die Lungen mit der Bezeichnung von CFSE-Tumorzellen wurden abgebildet, wie in der oberen Bereich der Abbildung 3 und verwandelte sich in schwarz-weiß-Bildern, wie in der unteren Bereich des Abbildung 3 , die Quantifizierung der Besiedlung der Lunge mit Bild J Software zu erleichtern.
Intravenös injiziert wir entweder ShScr oder ShFN LLC-Zellen, die mit 20 µM CFSE beschriftet waren und wartete auf einen zeitlichen Verlauf von 24-72 h vor Durchführung der Lunge Perfusionen und konfokale mikroskopische Bildgebung. Quantifizierung des Tumors Lunge besiedeln, die Zellen in 6 Mäuse wie abgebildet in Figur 4A mit ImageJ Software ergeben, dass deutlich weniger ShFN LLC Zellen als ShScr LLC Zellen an der 38 h und 45 h Zeitpunkten als gezählt wurden in illustriert Abbildung 4 b . Der Grund, warum die Zahl der Lunge-kolonisierten ShScr und ShFN LLC Zellen allmählich vermindert sehr wahrscheinlich wegen der kontinuierlichen Zytotoxizität durch die Zirkulation Immunität auch gegen die bereits kolonisierten LLC Zellen ausgeübt wurde. Insgesamt, diese Ergebnisse deuten darauf hin, PolyFN, montiert auf CTCs ist in der Tat erforderlich, in der Lunge Besiedlung durch LLC Zellen, führt zu kompletten Metastasen in der Lunge durch die Ergebnisse in welcher einige Mäuse intravenös erhalten Aliquote der Vermittlung der CFSE--mit der Bezeichnung ShScr und ShFN LLC Zellen für die Lunge Kolonisation Assays wie in Abbildung 4 dargestellt blieben Aloneuntil Lungentumor Knötchen in der experimentellen Tumor Metastasen Assay entwickelt wurden, wie in Abbildung 5A und 5 b.
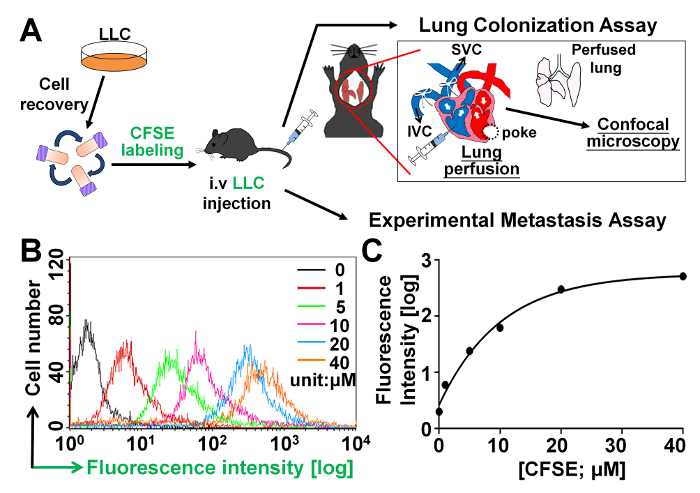
Abbildung 1: Titration von CFSE-Konzentrationen für die Kennzeichnung von Tumorzellen in die Lunge Kolonisation Assay. (A) schematische Darstellung der Verfahren für die Lunge Kolonisation Assay und der experimentelle Metastasierung Test wie beschrieben im Abschnitt Protokolle. (B) FACS-Analyse für die CFSE--Fluoreszenz-Intensitäten der LLC-Zellen, die befleckt wurden mit verschiedenen Konzentrationen von CFSE. (C) Fluoreszenz-Intensitäten wurden als Funktionen der verschiedenen CFSE-Konzentrationen aufgetragen. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Lunge vor und nach der Perfusion. Repräsentative Bilder der Lungen vor (unperfused; Unperf.) und nachher (durchblutet; Perf.) Perfusion der Lunge durchführen. Goldener Stern: Herz. Weißer Pfeil: das Band, das die IVC/SVC geschlossen. Rote Pfeile: die Lunge der gleichen Maus vor und nach der Perfusion. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: Montage der PERFUNDIERTEN Lungenlappen auf der Lunge-Halter für konfokale Fluoreszenzmikroskopie. (A) Regelung der Lunge-Montage auf der Lunge-Halter für die konfokale Mikroskopie. (B) ein repräsentatives Bild der 3 PERFUNDIERTEN Lungenlappen auf der Lunge-Halter. (C) repräsentative Bilder der Lunge besiedeln LLC Zellen mit CFSE-Fluoreszenz für die Quantifizierung von Bild J Software. Obere Leiste: regelmäßige Bildgebung. Untere Leiste: umgekehrt schwarz-weiß-Bildgebung. Bitte klicken Sie hier für eine größere Version dieser Figur.
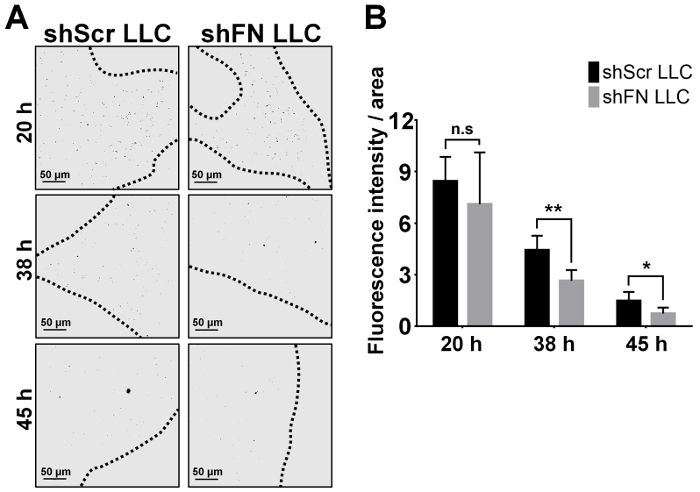
Abbildung 4: Zeit Kurs Bildgebung, Quantifizierung und statistische Auswertung für die Lunge kolonisiert ShScr und ShFN LLC-Zellen nach Perfusion der Lunge in die Lunge Kolonisation Assay. (A) repräsentative Schwarzweißbilder (umgerechnet aus Fluoreszenzbilder) von ShScr und ShFN LLC-Zellen, die in das Gefäßsystem der Lunge zu verschiedenen Zeitpunkten kolonisiert wurden, wie nach umfangreichen Lunge Perfusion dargestellt. Gestrichelten Linien kennzeichnen den Rand der Bereiche im Fokus konfokale Lunge Gewebe. (B) Quantifizierung und statistische Auswertung für die Lunge besiedeln LLC Zellen wie in (A) von durchschnittlich 5 absolute repräsentative Bilder/Lunge Lappen/Maus visualisiert. Hinweis: Jeder Balken zeigt die gemittelten Fluoreszenzintensität von jedem konfokale in-Focus-Bereich. Daten wurden statistisch analysiert aus 6 Mäuse und Fertigmeldung ± SD bedeuten; n.s. bedeutet unwichtigen; * bedeutet p < 0,05; und ** bedeutet p < 0,01; Zwei-Wege-ANOVA. Bitte klicken Sie hier für eine größere Version dieser Figur.
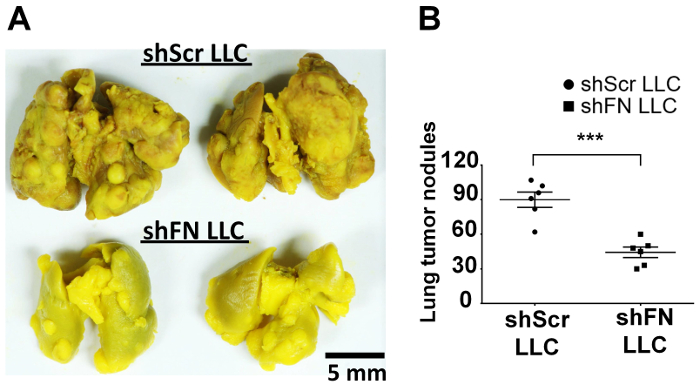
Abbildung 5: Silencing FN-Expression in Zellen mit der Bezeichnung von CFSE-LLC Tumor Knötchen in der Lunge verringert sich auf lange Sicht in Vivo CTC Kolonisation Assay. (A) Bouin Flüssigkeit-feste Maus Lungen mit Tumor Knötchen aus CFSE--mit der Bezeichnung ShScr oder ShFN LLC Zellen abgeleitet. (B) Quantifizierung und statistische Auswertung für die Tumor-Knötchen in der Lunge. Daten werden als ± SD bedeuten gemeldet; : p < 0,001; n = 6 pro Gruppe; Ungepaarten t-Test. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Zusammen mit lange Begriff Lunge Kolonisation Assays, die kurzfristig Methodik, die wir hier in Vivo Lunge Besiedlung durch CTCs in entfernten Organen auszuwertende beschäftigt klar enthüllt und differenziert die spezifische Rolle der PolyFN an der Kolonisierung auf CTCs montiert die Lunge, führte dann zu der Extravasation und metastatische Prozesse18,19,20,21. Obwohl Kennzeichnung Zellen mit langfristigen Zelle Tracker CFSE-konnten wir verfolgen die intravenös injizierten CTCs für bis zu drei Tage vor der Lunge Perfusion und ausreichend grün fluoreszieren quantitativen Zwecken zu behalten, war es unmöglich, direkt bestimmen ob die Tumorzellen vom Zentrum in das Gefäß Lumen oder bereits hatte dies aus den Blutgefäßen. Lösen Sie dieses Problem, rot fluoreszierende werden Rhodamin konjugiert Dextran, die unspezifisch binden an Lektine ausgedrückt auf gefäßendothelien kann verwendet, um beschriften Sie das Gefäßsystem der Lunge während der Lunge Perfusion28,29, 30. trotz der Tatsache, dass CFSE eine langfristige Zelle Tracker, seine Fluoreszenzintensität ist halbiert jede Zellteilung27, das Potenzial der Verwendung in Kennzeichnung Techniken zu begrenzen. Um dieses Problem zu umgehen, sollte sichergestellt werden, dass die Kennzeichnung Dosierung von CFSE ausreichend für Zellen nachweisbar bleiben ist, für die gesamte Dauer der in Vivo Experimente und, dass jede Behandlung auf die Zellen angewendet keine Auswirkung auf Zelle hat Verbreitung. Da der Vergleich und die Quantifizierung der Lunge besiedeln ShScr und ShFN CTC in separaten Mäusen durchgeführt wurden, kann es argumentiert werden, dass die Unterschiede zwischen den beiden Gruppen durch individuelle Variation. Um solche Schwankungen auszuschließen, kann eine Mischung aus zwei Arten von Tumor Zellen beschriftet mit ausgeprägten fluoreszierende Farbstoffe (z. B. CFSE-/CM-DiI) oder stabil transfizierten mit GFP/DsRed in das gleiche Tier in der Lunge Kolonisation damit auch intravenös injiziert werden Assay31,32,33. Es ist erwähnenswert, dass Klonen Effekte aus der Zelle Klonen Technologie, die versucht wird, um stabil zu klären fluoreszierende Protein-transfizierten Zellen mit ausreichend starke Fluoreszenz34,35, Klone 36 , 37 kann die geklonten Zellen nicht repräsentativ darzustellen die ganze heterogene Völker38,39,40machen. Wenn einer beständigen Transfection alle fluoreszierenden Proteins in Tumorzellen für die Lunge Kolonisation Assays gewünscht wird, sollten erhöhen die Effizienz der Transfektion der Tumorzellen als Ganzes besser die ursprünglichen Eigenschaften beibehalten, als das Klonen der Zelle Populationen mit ausreichend Fluoreszenz41,42.
Die Perfusion der Lunge tritt in die Lunge Besiedlung sind Tests notwendig, dass einige intravenös injizierten Tumorzellen anstelle von speziell auf die Lunge Kapillarsystem verhaften tendenziell mechanisch gefangen und gestaute innerhalb der Kapillare Netze der Lunge Geweben aufgrund der durchschnittlich größere Durchmesser des CTC als die Breite der Lunge Kapillaren Lumen43,44. Quantifizierung der Lunge besiedeln Tumorzellen ohne Vorrichtung der Lunge führen eine Überschätzung durch irrtümlich zählen die mechanisch verklemmt Zellen45,46,47. Auch wenn die Lungen durchströmt worden, noch zusätzliche Probleme. Beispielsweise ist es noch schwierig zu unterscheiden, ob die Lunge besiedeln Tumorzellen sich auf der lumenal gefäßendothelien befinden oder haben bereits aus den Blutgefäßen Bedarfs. Um dieses Problem zu beheben, kann die Färbung der Blutgefäße mit Rhodamin konjugiert Dextran als genannten nützlich,30,48,49. Alternativ ggf. Quantifizierung der Tumor Extravasation Kalzium-Chelator EDTA/EGTA oder Trypsin, eine nicht-spezifische Protease, kann verwendet werden in der Perfusion Puffer Kalzium-abhängige und -unabhängig zu behindern Tumor Zelle Adhäsion Veranstaltungen50 , 51 , 52. so können die Tumorzellen in das Lungengewebe verbleibenden betrachtet werden, wie dies.
Für die Quantifizierung der Lunge besiedeln Tumorzellen unterliegen der PERFUNDIERTEN Lunge oft traditionelle konfokalen Mikroskopie. Allerdings ist die Messbarkeit der Tiefe des Gewebes zum Teil auf Gewebe Autofluoreszenz und Fluoreszenz Streueffekte, Rendering tiefere Gewebe nicht nachweisbar53,54begrenzt. Ein zwei-Photonen-Mikroskop mit höhere Empfindlichkeit als eine traditionelle confocal Mikroskop ist geeignet, um solche Probleme zu beheben, dass die Nah-Infrarot-Strahlung in zwei-Photon Erregung mit deutlich weniger Absorption von biologischen Proben als UV verwendet oder blau-grünes Licht macht die Technik besser geeignet für dicke Proben55,56,57-Bildgebung. Lunge besiedeln Tumorzellen werden gezählt, durch Mittelung Tumor-Zell-Zahlen in mehreren repräsentativen konfokale Bilder, die nicht die gesamte Anzahl der Lunge besiedeln Tumorzellen in die ganze Lunge eines einzelnen Tieres beinhalten. Um die ganze Lunge in die Lunge Kolonisation Assays zu quantifizieren, Tumorzellen mit Luciferase stabil transfiziert eingesetzt werden könnte und der PERFUNDIERTEN Lunge könnte dann ausgesetzt IVIS imaging nach intravenöser Inokulation von suspendierten Tumorzellen in Anwesenheit von Luciferin46,58,59. Alternativ könnte der PERFUNDIERTEN Lunge in Stücke gehackt und enzymatische Verdauung mit Proteasen, z.B., Kollagenase, Freigabe einzelne Zellen in Suspension60,61unterzogen werden. Der Tumor-Zellen mit Fluoreszenz-Farbstoffen oder stabil transfizierten mit Fluoreszenz, die Proteine dann mit Fluoreszenz-aktivierte Zelle Sortieren (FACS) Analyse56,62quantifiziert werden konnte.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren möchte Dr. Ming-Min Chang und Frau Ya-Hsin Cheng für ihre technische Unterstützung danken. Diese Arbeit wurde unterstützt vom Ministerium für Wissenschaft und Technologie Taiwans (die meisten-103-2325-B-006-009, die meisten-104-2325-B-006-001, die meisten-105-2325-B-006-001 und MOST-106-2320-B-006-068-MY3) und das Ministerium für Gesundheit und Soziales (MOHW106-TDU-B-211-144004). Wir sind auch dankbar für die Unterstützung von Core Research Laboratory des College of Medicine, National Cheng Kung University, für ihre Multi-Photonen confocal Mikroskop.
Materialien
| Name | Company | Catalog Number | Comments |
| Material | |||
| Bovine Serum Albumin (BSA) | Cyrusbioscience (Taipei, Taiwan) | 101-9048-46-8 | |
| Bouin's Fluid | MCC(medical chemical corporation)/POISON | 456-A-1GL | |
| CFSE Proliferation Dye | ebiosciences | 65-0850-85 | Full name: Carboxyfluorescein succinimidyl ester |
| Dulbecco's Modified Eagle Media (DMEM) | (Gibco)ThermoFisher Scientific | 12100-061 | |
| Ethylenediaminetetraacetic acid (EDTA) | Cyrusbioscience (Taipei, Taiwan) | 101-6381-92-6 | For prepared trypsin-EDTA solution( Final concentration: 0.53mM ) |
| Fetal bovine serum (FBS) | (Gibco)ThermoFisher Scientific | 10437-028 | |
| Lewis lung carcinoma (LLC) | ATCC, Manassas, VA, USA | CRL-1642 | |
| L-Glutamine, USP | (Gibco)ThermoFisher Scientific | 21051-024 | |
| Potassium chloride (KCl) | Cyrusbioscience (Taipei, Taiwan) | 101-7447-40-7 | For prepared 1X PBS ( Final concentration: 2.7mM ) |
| Potassium phosphate monobasic (KH2PO4) | Cyrusbioscience (Taipei, Taiwan) | 101-7778-77-0 | For prepared 1X PBS ( Final concentration: 1.8mM ) |
| Sodium chloride (NaCl) | Cyrusbioscience (Taipei, Taiwan) | 101-7647-14-5 | For prepared 1X PBS ( Final concentration: 137mM ) |
| Sodium phosphate dibasic (Na2HPO4) | Cyrusbioscience (Taipei, Taiwan) | 101-10039-32-4 | For prepared 1X PBS ( Final concentration: 10mM ) |
| Trypan Blue | Sigma Aldrich | T6146 | 0.5 g mix with 100 mL 1X PBS |
| Trypsin | Sigma Aldrich | T4799 | For prepared trypsin-EDTA solution ( Final concentration: 5g/L ) |
| Zoletil 50 | Virbac | To dilute with 1X PBS | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Compact Tabletop Centrifuge 2420 | KUBOTA Co. | 2420 | |
| Culture dish (6cm) | Wuxi NEST Biotechnology Co. | 705001 | |
| Disposable syringe (with needle) | Perfect Medical Industry Co. | 24G/3 cm;3 ml & 26G/0.5 cm;1 ml | |
| End over end mixer | C.T.I YOUNG CHENN | TS-20 | For suspended cells recovery |
| FACSCalibur (FACS) | BD biosciences | ||
| Forceps | Dimeda | 10.102.14 | |
| Forma Direct Heat CO2 incubator | Thermo Fisher Scientific Inc. | HEPA CLASS 100 | |
| Mouse restrainer (Cylindrical Restrainer 15-30 gm) | Stoelting | 51338 | |
| Multiphoton Confocal Microscope BX61WI | Olympus | FV1000MPE | |
| Neubauer counting chamber | Marienfeld-Superior | 640010 | |
| Surgical scissor | Dimeda | 08.370.11 | |
| Surgical sutures | UNIK SURGICAL SUTURES MFG. CO. | NO. 0034 | Black Braided silk; non-absorbable (25YD; U.S.P. 4/0) |
| 1.5 mL microcentrifuge tube | Wuxi NEST Biotechnology Co. | 615001 | |
| 15 mL Greiner tube | Greiner bio-one | 188271 |
Referenzen
- Massague, J., Obenauf, A. C. Metastatic colonization by circulating tumour cells. Nature. 529 (7586), 298-306 (2016).
- Lambert, A. W., Pattabiraman, D. R., Weinberg, R. A. Emerging Biological Principles of Metastasis. Cell. 168 (4), 670-691 (2017).
- Mohme, M., Riethdorf, S., Pantel, K. Circulating and disseminated tumour cells - mechanisms of immune surveillance and escape. Nat Rev Clin Oncol. 14 (3), 155-167 (2017).
- Steinert, G., et al. Immune escape and survival mechanisms in circulating tumor cells of colorectal cancer. Cancer Res. 74 (6), 1694-1704 (2014).
- Mahauad-Fernandez, W. D., Okeoma, C. M. Cysteine-linked dimerization of BST-2 confers anoikis resistance to breast cancer cells by negating proapoptotic activities to promote tumor cell survival and growth. Cell Death Dis. 8 (3), e2687(2017).
- Maheswaran, S., Haber, D. A. Circulating tumor cells: a window into cancer biology and metastasis. Curr Opin Genet Dev. 20 (1), 96-99 (2010).
- Yu, M., et al. RNA sequencing of pancreatic circulating tumour cells implicates WNT signalling in metastasis. Nature. 487 (7408), 510-513 (2012).
- Adams, D. L., et al. Mitosis in circulating tumor cells stratifies highly aggressive breast carcinomas. Breast Cancer Res. 18 (1), 44(2016).
- Baccelli, I., et al. Identification of a population of blood circulating tumor cells from breast cancer patients that initiates metastasis in a xenograft assay. Nat Biotechnol. 31 (6), 539-544 (2013).
- Malladi, S., et al. Metastatic Latency and Immune Evasion through Autocrine Inhibition of WNT. Cell. 165 (1), 45-60 (2016).
- Spiegel, A., et al. Neutrophils Suppress Intraluminal NK Cell-Mediated Tumor Cell Clearance and Enhance Extravasation of Disseminated Carcinoma Cells. Cancer Discov. 6 (6), 630-649 (2016).
- Pattabiraman, D. R., et al. Activation of PKA leads to mesenchymal-to-epithelial transition and loss of tumor-initiating ability. Science. 351 (6277), aad3680(2016).
- van der Weyden, L., et al. Genome-wide in vivo screen identifies novel host regulators of metastatic colonization. Nature. 541 (7636), 233-236 (2017).
- Obenauf, A. C., et al. Therapy-induced tumour secretomes promote resistance and tumour progression. Nature. 520 (7547), 368-372 (2015).
- Genovese, G., et al. Synthetic vulnerabilities of mesenchymal subpopulations in pancreatic cancer. Nature. 542 (7641), 362-366 (2017).
- von Horsten, S., et al. Stereological quantification of carboxyfluorescein-labeled rat lung metastasis: a new method for the assessment of natural killer cell activity and tumor adhesion in vivo and in situ. J Immunol Methods. 239 (1-2), 25-34 (2000).
- Reymond, N., et al. Cdc42 promotes transendothelial migration of cancer cells through beta1 integrin. J Cell Biol. 199 (4), 653-668 (2012).
- Cheng, H. C., Abdel-Ghany, M., Elble, R. C., Pauli, B. U. Lung endothelial dipeptidyl peptidase IV promotes adhesion and metastasis of rat breast cancer cells via tumor cell surface-associated fibronectin. J Biol Chem. 273 (37), 24207-24215 (1998).
- Huang, L., et al. Protein kinase Cepsilon mediates polymeric fibronectin assembly on the surface of blood-borne rat breast cancer cells to promote pulmonary metastasis. J Biol Chem. 283 (12), 7616-7627 (2008).
- Chang, Y. H., et al. Secretomic analysis identifies alpha-1 antitrypsin (A1AT) as a required protein in cancer cell migration, invasion, and pericellular fibronectin assembly for facilitating lung colonization of lung adenocarcinoma cells. Mol Cell Proteomics. 11 (11), 1320-1339 (2012).
- Wang, Y. J., et al. Pterostilbene prevents AKT-ERK axis-mediated polymerization of surface fibronectin on suspended lung cancer cells independently of apoptosis and suppresses metastasis. J Hematol Oncol. 10 (1), 72(2017).
- Cheng, H. C., Abdel-Ghany, M., Pauli, B. U. A novel consensus motif in fibronectin mediates dipeptidyl peptidase IV adhesion and metastasis. J Biol Chem. 278 (27), 24600-24607 (2003).
- Hsu, Y. Y., et al. Thrombomodulin is an ezrin-interacting protein that controls epithelial morphology and promotes collective cell migration. FASEB J. 26 (8), 3440-3452 (2012).
- Arlt, M. J., Born, W., Fuchs, B. Improved visualization of lung metastases at single cell resolution in mice by combined in-situ perfusion of lung tissue and X-Gal staining of lacZ-tagged tumor cells. J Vis Exp. (66), e4162(2012).
- Shi, Y., Parhar, R. S., Zou, M., Al-Mohanna, F. A., Paterson, M. C. Gene therapy of melanoma pulmonary metastasis by intramuscular injection of plasmid DNA encoding tissue inhibitor of metalloproteinases-1. Cancer Gene Ther. 9 (2), 126-132 (2002).
- Parish, C. R. Fluorescent dyes for lymphocyte migration and proliferation studies. Immunol Cell Biol. 77 (6), 499-508 (1999).
- Quah, B. J., Warren, H. S., Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat Protoc. 2 (9), 2049-2056 (2007).
- Migone, F. F., et al. In vivo imaging reveals an essential role of vasoconstriction in rupture of the ovarian follicle at ovulation. Proc Natl Acad Sci U S A. 113 (8), 2294-2299 (2016).
- Itkin, T., et al. Distinct bone marrow blood vessels differentially regulate haematopoiesis. Nature. 532 (7599), 323-328 (2016).
- Jiang, M., Qin, C., Han, M. Primary breast cancer induces pulmonary vascular hyperpermeability and promotes metastasis via the VEGF-PKC pathway. Mol Carcinog. 55 (6), 1087-1095 (2016).
- Aceto, N., et al. Circulating tumor cell clusters are oligoclonal precursors of breast cancer metastasis. Cell. 158 (5), 1110-1122 (2014).
- Zheng, Y., et al. Expression of beta-globin by cancer cells promotes cell survival during blood-borne dissemination. Nat Commun. 8, 14344(2017).
- Chen, X., et al. Retinoic acid facilitates inactivated transmissible gastroenteritis virus induction of CD8(+) T-cell migration to the porcine gut. Sci Rep. 6, 24152(2016).
- Saranchova, I., et al. Discovery of a Metastatic Immune Escape Mechanism Initiated by the Loss of Expression of the Tumour Biomarker Interleukin-33. Sci Rep. 6, 30555(2016).
- Ahmed, M., et al. An Osteopontin/CD44 Axis in RhoGDI2-Mediated Metastasis Suppression. Cancer Cell. 30 (3), 432-443 (2016).
- Hoffman, R. M. In vivo imaging of metastatic cancer with fluorescent proteins. Cell Death Differ. 9 (8), 786-789 (2002).
- Mendoza, A., et al. Modeling metastasis biology and therapy in real time in the mouse lung. J Clin Invest. 120 (8), 2979-2988 (2010).
- Meacham, C. E., Morrison, S. J. Tumour heterogeneity and cancer cell plasticity. Nature. 501 (7467), 328-337 (2013).
- Wagenblast, E., et al. A model of breast cancer heterogeneity reveals vascular mimicry as a driver of metastasis. Nature. 520 (7547), 358-362 (2015).
- Nguyen, D. X., Bos, P. D., Massague, J. Metastasis: from dissemination to organ-specific colonization. Nat Rev Cancer. 9 (4), 274-284 (2009).
- Ragelle, H., et al. Chitosan nanoparticles for siRNA delivery: optimizing formulation to increase stability and efficiency. J Control Release. 176, 54-63 (2014).
- Chu, V. T., et al. Increasing the efficiency of homology-directed repair for CRISPR-Cas9-induced precise gene editing in mammalian cells. Nat Biotechnol. 33 (5), 543-548 (2015).
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nat Rev Cancer. 11 (7), 512-522 (2011).
- Joyce, J. A., Pollard, J. W. Microenvironmental regulation of metastasis. Nat Rev Cancer. 9 (4), 239-252 (2009).
- Sanchez-Laorden, B., et al. BRAF inhibitors induce metastasis in RAS mutant or inhibitor-resistant melanoma cells by reactivating MEK and ERK signaling. Sci Signal. 7 (318), ra30(2014).
- Torchiaro, E., et al. Peritoneal and hematogenous metastases of ovarian cancer cells are both controlled by the p90RSK through a self-reinforcing cell autonomous mechanism. Oncotarget. 7 (1), 712-728 (2016).
- Wan, J., et al. Establishment of monoclonal HCC cell lines with organ site-specific tropisms. BMC Cancer. 15, 678(2015).
- Ye, Y., Liu, S., Wu, C., Sun, Z. TGFbeta modulates inflammatory cytokines and growth factors to create premetastatic microenvironment and stimulate lung metastasis. J Mol Histol. 46 (4-5), 365-375 (2015).
- Morales, M., et al. RARRES3 suppresses breast cancer lung metastasis by regulating adhesion and differentiation. EMBO Mol Med. 6 (7), 865-881 (2014).
- Stone, J. P., et al. Mechanical removal of dendritic cell-generating non-classical monocytes via ex vivo lung perfusion. J Heart Lung Transplant. 33 (8), 864-869 (2014).
- Vettorazzi, S., et al. Glucocorticoids limit acute lung inflammation in concert with inflammatory stimuli by induction of SphK1. Nat Commun. 6, 7796(2015).
- Urade, Y., Yoshida, R., Kitamura, H., Hayaishi, O. Induction of indoleamine 2,3-dioxygenase in alveolar interstitial cells of mouse lung by bacterial lipopolysaccharide. J Biol Chem. 258 (10), 6621-6627 (1983).
- Hong, G., et al. Through-skull fluorescence imaging of the brain in a new near-infrared window. Nat Photonics. 8 (9), 723-730 (2014).
- Liu, Q., Guo, B., Rao, Z., Zhang, B., Gong, J. R. Strong two-photon-induced fluorescence from photostable, biocompatible nitrogen-doped graphene quantum dots for cellular and deep-tissue imaging. Nano Lett. 13 (6), 2436-2441 (2013).
- Peti-Peterdi, J., Burford, J. L., Hackl, M. J. The first decade of using multiphoton microscopy for high-power kidney imaging. Am J Physiol Renal Physiol. 302 (2), F227-F233 (2012).
- Duda, D. G., et al. Malignant cells facilitate lung metastasis by bringing their own soil. Proc Natl Acad Sci U S A. 107 (50), 21677-21682 (2010).
- Gupta, G. P., et al. Mediators of vascular remodelling co-opted for sequential steps in lung metastasis. Nature. 446 (7137), 765-770 (2007).
- Kosaka, N., et al. Neutral sphingomyelinase 2 (nSMase2)-dependent exosomal transfer of angiogenic microRNAs regulate cancer cell metastasis. J Biol Chem. 288 (15), 10849-10859 (2013).
- Hoshino, A., et al. Tumour exosome integrins determine organotropic metastasis. Nature. 527 (7578), 329-335 (2015).
- Jaskelioff, M., et al. Telomerase deficiency and telomere dysfunction inhibit mammary tumors induced by polyomavirus middle T oncogene. Oncogene. 28 (48), 4225-4236 (2009).
- Si, L. L., Lv, L., Zhou, W. H., Hu, W. D. Establishment and identification of human primary lung cancer cell culture in vitro. Int J Clin Exp Pathol. 8 (6), 6540-6546 (2015).
- Weng, D., et al. Metastasis is an early event in mouse mammary carcinomas and is associated with cells bearing stem cell markers. Breast Cancer Res. 14 (1), R18(2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten