Method Article
La mise en place d’un essai de colonisation poumon pour la visualisation de cellules de tumeur dans les tissus pulmonaires en circulation
Dans cet article
Résumé
Un modèle animal est nécessaire pour décrypter le rôle des cellules tumorales (CTC) dans la promotion de la colonisation lors de métastases du cancer pulmonaire en circulation. Ici, nous avons mis en place et a effectué avec succès une in vivo test d’essai spécifiquement l’exigence de la fibronectine polymériques (polyFN) Assemblée sur CTC pour la colonisation de poumon.
Résumé
Métastase est la principale cause de décès par cancer. Le rôle des cellules tumorales (CTC) dans la promotion des métastases cancéreuses, dans lequel la colonisation pulmonaire par CTC critique contribue à début processus métastatiques de poumon, de la circulation a été vigoureusement étudié. Ainsi, des modèles animaux sont la seule approche qui capture le processus systémique complète des métastases. Étant donné que les problèmes surviennent dans les modèles expérimentaux précédents pour examiner les contributions de PTC à l’extravasation des vaisseaux sanguins, nous avons établi un essai de colonisation en vivo poumon dans lequel un long-terme-fluorescence cellulaire-traceur, la carboxyfluorescéine succinimidyl ester (CFSE), a été utilisé pour étiqueter des cellules tumorales suspendu et la perfusion pulmonaire a été réalisée pour effacer non spécifiquement piégés CTC avant suppression pulmonaire, imagerie confocale et quantification. Fibronectine polymérique (polyFN) montée sur les surfaces de la CCT a été trouvée à la médiation de la colonisation dans l’établissement définitif des tissus de la tumeur métastatique pulmonaire. Ici, pour notamment tester l’exigence de l’Assemblée polyFN sur CTC pour la colonisation de poumon et extravasation, nous avons réalisé à court terme des essais de colonisation poumon dans lequel suspendu de cellules de carcinome de poumon Lewis (SARL) exprimant de manière stable FN-shARN (shFN) ou Scramble-shARN (shScr) et préalablement étiquetées avec 20 μM de CFSE inoculés par voie intraveineuse à des souris C57BL/6. Nous avons démontré avec succès que les capacités des cellules de shFN LLC à coloniser les poumons de souris ont été significativement diminuées par rapport aux cellules de shScr LLC. Par conséquent, cette méthodologie à court terme peut être largement appliquée pour démontrer précisément l’aptitude des PTC au sein de la circulation à coloniser les poumons.
Introduction
Métastase est la principale cause de cancer mort1,2. Les cellules tumorales dérivées de tissus primaires entrer dans la circulation en suspension et survivent à divers défis hématogène, par exemple, anoikis, agressions immunitaires et dommages dus à la contrainte de cisaillement de la pression artérielle ou des contraintes géométriques, avant qu’ils soient capable de coloniser des organes éloignés, une étape clé dicter le succès de la métastase3,4,5,6. Par conséquent, vigoureux s’est efforcé actuellement en caractérisant les cellules tumorales circulantes (CTC) et la corrélation de ces caractéristiques avec les taux de survie du cancer patients7,8 , métastases et malignité de la tumeur , 9. étant donné que le processus de métastases du cancer représente précisément un événement in vivo , des modèles animaux sont la seule approche qui capture le processus systémique complète des métastases10,11,12 .
CTC devenue des tissus de la tumeur métastatique à travers de multiples événements cellulaires, y compris la colonisation des organes éloignés1,2. Cependant, les métastases plus couramment utilisés essais13,14,15 ne fournissent pas un moyen d’observer la colonisation de la CCT des organes éloignés. Par conséquent, une conception de test in vivo pour la visualisation de la colonisation de la CCT est absolument nécessaire. Bien que plusieurs in vivo et ex vivo courte colonisation de poumon à terme des essais ont été conçus, les problèmes et les inconvénients restent. Par exemple, alors que protéine de fluorescence verte (GFP)-tumeurs surexprimant les cellules ont été utilisées dans ces essais22,23, cela prend du temps à transfecter stablement et de cloner des cellules tumorales avec suffisamment d’intensité fluorescente GFP sous le microscope. De même, bien que la coloration transitoire des cellules tumorales avec le traceur de cellule à long terme CFSE a été employée pour remplacer les cellules tumorales exprimant le GFP, il reste difficile de juger si les cellules tumorales CFSE marqués sont attachées ou simplement présents au sein de la vascularisation des organes éloignés excisés16,17.
Fibronectine polymérique (polyFN) montée sur les surfaces des PTC s’est avérée critique contribuent à la mise en place finale de tumeur métastatique tissus18,19,20,21,22 . Ici, nous avons réalisé à court terme poumon essais de colonisation dans laquelle Lewis suspension de cellules de carcinome pulmonaire (SARL) stablement exprimant FN-shARN (shFN) ou scramble-shARN (shScr) et préalablement marquées avec CFSE inoculés par voie intraveineuse à des souris C57BL/6. Après 2 ou 3 jours, poumons de souris ont été tout d’abord perfusés avec du sérum physiologique tamponné au phosphate (PBS), afin de supprimer complètement les seules CTC dans le système vasculaire avant d’être soumise à la microscopie confocale et quantification des SARL colonisant les poumons. Nous avons montré clairement que les numéros de colonisant les poumon shFN SARL et les nodules de tumeur ont été significativement réduits par rapport aux shScr SARL, corroborant considérablement le rôle de l’Assemblée polyFN sur CTC en facilitant la colonisation et la croissance des PTC dans le poumons. Notre étude garantit davantage enquête pour le rôle de polyFN dans les métastases du cancer.
Protocole
Toutes les expériences sur des souris ont été effectuées conformément aux lignes directrices de notre Institut (le Guide for Care and Use of Laboratory Animals, NCKU Medical College).
1. préparation des Instruments, les milieux de Culture et plats
- Avant de commencer les protocoles expérimentaux, obtenir les sutures chirurgicales stériles, seringues de 1 mL avec aiguille 26G/0,5 cm (pour queue injection dans la veine), seringues de 3 mL avec aiguille 24G/cm 3 (pour perfusion pulmonaire), modifié Eagle Media (DMEM de Dulbecco), solution de trypsine-EDTA (5 la trypsine g/L et 0,53 mM), sérum fœtal (SVF), 1 x PBS (137 mM NaCl, KCl 2,7 mM, 10 mM Na2PHO4et 1,8 mM KH2PO4) et récipients de culture de 6 cm.
2. la préparation et la récupération des cellules tumorales en Suspension
- Préparer stérile modifié Eagle Media (DMEM de Dulbecco) contenant 10 % ou 20 % FBS et fraîchement ajouter 0,05 %, solution 1 PBS x et 2 mM de L-glutamine la trypsine-EDTA.
- Les cellules de DMEM supplémenté de 10 % la culture FBS à 37 ° C et cultivez-les dans la boîte de Petri, il y a confluence de 70 à 80 %.
- Enlever les milieux de culture (DMEM) de la vaisselle, suivie de deux lavages avec 2 mL de PBS stérile 1 x.
- Ajouter 1 mL de 0.05 % trypsine-EDTA dans les plats pour couvrir complètement toutes les cellules. Retirer 800 μL de solution immédiatement et laissez seulement 200 μL dans les plats. Incuber les boîtes à 37 ° C pendant 30 s à 1 min (selon le type de cellule) et attendez jusqu'à ce que la plupart des cellules sont dans l’état suspendu.
- Ajouter 1 mL de frais DMEM contenant 10 % FBS directement dans les plats d’arrêter l’activité enzymatique de la trypsine et vigoureusement pipette de la suspension cellulaire haut et en bas avec une pipette de 1000 µL pour préparer une suspension monocellulaire.
- Les cellules de transfert de la capsule dans un tube de microtubes de 1,5 mL et tournez en bas les cellules à température ambiante à 162 x g pendant 3 min.
- Aspirer le surnageant et remettre les cellules de la tumeur dans 1,5 mL DMEM contenant 20 % de SVF et sur la fin tourner les cellules en suspension à 37 ° C pendant 2 h.
Remarque : Si le milieu devienne jaune lors de la reprise, échanger le milieu vieux avec un milieu frais contenant 20 % FBS.
3. fluorescence la coloration et l’analyse des cellules tumorales en Suspension avec carboxyfluorescéine Succinimidyl Ester (CFSE)
- Après la récupération de cellules en suspension, compter le nombre de cellules viables approprié avec le bleu Trypan dans un Neubauer comptant chambre pour la titration de la fluorescence des doses de coloration et de queue de la veine injection.
- Tournez en bas les cellules à 162 x g à température ambiante pendant 3 mn et remettre que les cellules boulettes dans 1 mL de stérilisé 1 x PBS, suivi par centrifugation à 162 x g pendant 3 min à température ambiante.
- Remettre en suspension les cellules granulés 500 µL de 1 X PBS contenant 10 % FBS et 0, 5, 10, 20 ou 40 µM CFSE pour la titration de dose et incuber à 37 oC pendant 10 min dans l’obscurité, la suspension de cellules.
- Tournez en bas les cellules à 162 x g à température ambiante pendant 3 mn et remettre en suspension les cellules granulés avec 4 mL de DMEM contenant 1 % FBS. Répétez cette étape de laver trois fois plus. Remettre en suspension les cellules granulés avec 4 mL de DMEM seul pendant le lavage final.
- Mais les cellules marquées CFSE au fluorescence-lancée de cellules tri analyse (FACS) afin de quantifier l’intensité de la fluorescence d’une seule cellule, ou injection dans la veine de queue.
Remarque : Conservez les cellules sur la glace avant d’effectuer les injections de veine FACS analyse ou de la queue.
4. poumon colonisation Assay
- Préparer les cellules marquées avec 20 µM CFSE (voir étapes 3.1 à 3.4).
NOTE : Décider de la dose de travail du CFSE pour le marquage des cellules tumorales, basés sur les résultats de titrage de l’analyse de FACS (voir étape 3.3). - Les queues de 4 à 6 semaines d’échauffement-vieilles souris C57BL/6 mâles (6 souris) avec une lampe à halogénures pendant 5-10 min sur une base de par-souris à dilater les veines de queue de souris.
- Bien mélanger et aspirer les cellules tumorales CFSE marqués avec une seringue de 1 mL (26Gx1/2), en évitant les bulles dans la suspension cellulaire (avec une densité finale de 5 x 106 cellules/mL).
- Soigneusement injecter 1 x106 cellules de tumeur CFSE marqués dans 200 µL de DMEM dans la veine de queue de souris, qui devrait être déposée dans une drisse de souris.
Remarque : Pendant l’injection, si l’aiguille est placée directement dans la lumière de la veine caudale, cellules tumorales doivent être facilement transmises dans la circulation sans avoir besoin de pousser fort sur la seringue. S’il est difficile de pousser les cellules tumorales par, ils ont très probablement été injectés en dehors de la veine caudale, dans l’espace sous-cutané. - Diviser les souris qui ont reçu par voie intraveineuse les cellules tumorales CFSE marqués en deux groupes : un groupe subira une perfusion pulmonaire suivie par microscopie confocale et quantification d’ImageJ dans l’essai de colonisation du poumon et l’autre sera laissée seul pendant 4-5 l’essai de semaines dans la colonisation de poumon à long terme.
- À 20, 38 ou 45 h et avec 1 x 106 cellules de tumeur injectés par voie intraveineuse pendant un titrage de cours - et dose-dépendante du temps, anesthésier avec tumeur de souris avec zoletil de 50 à 75 mg/kg 50, qui est un bien acceptée et bon anesthetizer23.
Remarque : Utilisation vétérinaire onguent sur les yeux de la souris pour prévenir le dessèchement tandis que sous anesthésie. - Couper longitudinalement la peau et les tissus sous-cutanés de l’abdomen dans la région de la poitrine avec les ciseaux chirurgicaux. Ouvrir la cavité pleurale avec ciseaux chirurgicaux et forceps pour exposer entièrement le cœur et les poumons.
Remarque : Veillez à éviter de couper les vaisseaux sanguins. - Lier la veine cave supérieure (SVC) et la veine cave inférieure (VCI) avec des sutures chirurgicales stériles pour empêcher le reflux de la solution de perfusion durant la perfusion pulmonaire.
- Couper la paroi du ventricule gauche avec des ciseaux chirurgicaux pour ouvrir une fissure (environ 2 à 4 mm) pour vidanger la solution de perfusion des poumons.
- Injecter la solution 1 PBS x dans le ventricule droit avec une seringue de 3 mL et éliminer la solution drainée avec aspiration constante durant la perfusion pulmonaire jusqu'à ce que les poumons tourner à partir d’une couleur rougeâtre à complètement pâle.
5. confocal Imagerie microscopique et l’analyse des cellules de tumeur poumon-colonisé
- Retirez les poumons maintenant-pale de la cavité pleurale et séparer les cinq lobes en coupant les trachée et du tissu conjonctif des ligaments avec ciseaux et pinces chirurgicales24.
- Préparer un support civière comme poumon comme illustré à la Figure 3 b par une suture en nylon d’enroulement autour de deux tiges de métal pour produire une texture réticulée avec un espace entre les deux tiges pour le placement des lobes du poumon. Définissez le titulaire du poumon dans un plat de 6 cm.
Remarque : Le titulaire du poumon servira à stabiliser les lobes pulmonaires sous la lentille d’un microscope confocal. - Introduire et fixer les lobes pulmonaires sur la texture réticulée du détenteur du poumon. Couvrir et humidifier les lobes pulmonaires avec 1 x PBS.
- Sous réserve de la boîte de Petri de 6 cm hébergeant les lobes du poumon sur le support de pulmonaire à microscopie confocale pour capturer des images de fluorescence enregistrant les cellules tumorales colonisant les poumons.
- Pour l’imagerie, utiliser les lentilles de l’objectif (5 X, MPLN, NA : 0.1, WD : 20, Air).
- Faire tourner la roue de filtre à NIBA (excitation/émission ; 470-495 nm/510-550 nm) et d’utiliser un laser à 488 nm pour exciter CFSE, de visualiser clairement les images de points de fluorescence dans les lobes pulmonaires.
- Faire tourner la roue de filtre à R690 (pour MaiTai HP DeepSee laser) pour balayer les 2,0 µs/pixel balayage vitesse et optimiser l’HV, Gain et offset niveaux.
- Capturer des images de fluorescence (512 x 512 pixels) en utilisant le logiciel de microscope avec un 10 µs/pixels vitesse de balayage.
- Quantifier et d’analyser statistiquement les images microscopiques à l’aide de logiciels ImageJ et GraphPad comme décrit précédemment21.
6. longue durée des essais de colonisation pulmonaire
Remarque : Répétez les étapes 4.1 à 4.5.
- Sacrifier les souris après l’inoculation de cellules de tumeur pendant 4-5 semaines et fixer leurs poumons avec liquide de Bouin25 pendant 1 à 2 jours.
- Quantifier et d’analyser statistiquement les nodules de tumeur des poumons de souris avec le logiciel21.
Résultats
Avant d’effectuer l’essai de colonisation en vivo poumon tel qu’illustré à la Figure 1 a afin de vérifier si polyFN sur les cellules tumorales suspension intervient dans la colonisation du poumon et/ou extravasation dans la facilitation des métastases, on titré tout d’abord différentes concentrations de CFSE, un composé fluorescent qui est cellule perméable et covalence conjugués intracellulaire contenant des amines molécules26,27 dans les cellules tumorales suspendu et reste dans les cellules pour une longue période de temps. Nous avons trouvé cette tumeur cellules sont effectivement marquées avec CFSE de manière dose-dépendante, comme illustré dans la Figure 1 b. Le CFSE-étiquetage en 6 x105 LLC cellules/mL a presque atteint un plateau à 20 µM comme illustré dans la Figure 1.
Grâce au système capillaire rétréci abondant qui peut physiquement font obstacle à l’écoulement des PTC dans le système vasculaire pulmonaire, nous avons effectué les cellules pulmonaires marqués au CFSE LLC perfusion chez des souris ayant injectée par voie intraveineuse pour effacer non spécifiquement piégés CTC, comme illustré à la Figure 1 a avant élimination de poumon à chaque instant, comme illustré à la Figure 4. Avant la perfusion, les poumons ont été clairement rougeâtres due à la présence de sang, comme illustré dans le panneau gauche de la Figure 2. Les poumons devient pâles après une perfusion de 10 à 15 mL de solution de 1 PBS x, tel qu’illustré dans le panneau de droite de la Figure 2.
Immédiatement après que les poumons de souris perfusé ont été retirés de la cavité pleurale, les lobes pulmonaires ont été séparés et montés sur le support du poumon placé dans les plats, comme illustré dans la Figure 3 a avec 1 x PBS, couvrant complètement les lobes pulmonaires. Les lobes du poumon montés sur le support du poumon comme illustré dans la Figure 3 b ont été soumis à la microscopie confocal fluorescence tel qu’illustré à la Figure 3 a. Cellules tumorales marquées CFSE colonisant les poumons ont été imagées comme illustré dans le panneau supérieur de la Figure 3 et transformé en images en noir et blanc, tel qu’illustré dans le panneau inférieur de Figure 3 pour faciliter la quantification de la colonisation de poumon avec le logiciel Image J.
Nous avons injecté par voie intraveineuse soit shScr soit shFN cellules LLC qui ont été marqués avec 20 µM CFSE et attendus pour une durée de 24 à 72 heures avant d’effectuer les perfusions de poumon et imagerie microscopique confocal. Quantification de la tumeur pulmonaire qui colonisent les cellules 6 souris comme illustré dans la Figure 4 a avec ImageJ logiciel a révélé que significativement moins shFN de cellules LLC que les cellules de shScr LLC ont été comptés à l’h 38 et les points de 45 h de temps, comme illustré dans la Figure 4 b . La raison pourquoi les numéros de shScr pulmonaire colonisées et les cellules de shFN LLC a diminué progressivement était très probablement due à la cytotoxicité continue exercée par l’immunité de la circulation même contre les cellules LLC déjà colonisés. Au total, ces résultats suggèrent que polyFN monté sur CTC est en effet nécessaire dans la médiation de colonisation pulmonaire par les cellules LLC, menant à complet métastases dans les poumons, telle que révélée par les résultats dans laquelle certaines souris recevant par voie intraveineuse des parties aliquotes de la CFSE marqué shScr et shFN LLC cellules pour les essais de colonisation du poumon tel qu’illustré à la Figure 4 sont restés aloneuntil tumeur de poumon nodules ont été développés dans le dosage de métastases de tumeurs expérimentales, comme illustré dans la Figure 5 a et 5 b.
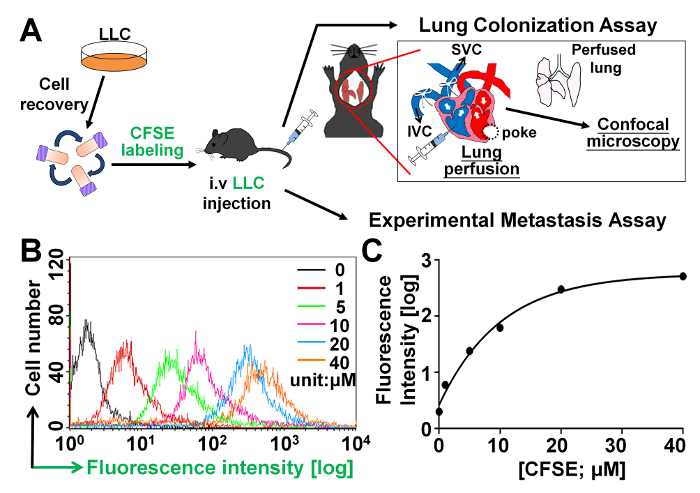
Figure 1 : titrage des concentrations pour l’étiquetage des cellules tumorales dans l’essai de colonisation du poumon CFSE. (A) illustration schématique des procédures de l’essai de colonisation du poumon et le dosage de métastase expérimentaux comme détaillé dans la section Protocols. (B) analyse des FACS pour les intensités de fluorescence CFSE des cellules LLC qui sont colorent avec différentes concentrations de CFSE. (C) les intensités de Fluorescence ont été tracées en fonction de différentes concentrations de CFSE. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : poumons avant et après la perfusion. Les images représentant des poumons avant (perfusé ; Unperf.) et après (perfusés ; Perf.) effectuer une perfusion pulmonaire. Étoile d’or : cœur. Flèche blanche : la cravate qui a fermé l’IVC/SVC. Flèches rouges : les poumons de la souris même avant et après la perfusion. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : montage des lobes du poumon perfusé sur le support du poumon pour la microscopie confocal fluorescence. (A) schéma du poumon-montage sur le support du poumon pour la microscopie confocale. (B) une image représentative de 3 lobes de poumon perfusé sur le support du poumon. (C) des images représentatives de colonisatrices de poumon de cellules LLC avec fluorescence CFSE pour la quantification par le logiciel Image J. Panneau supérieur : imagerie régulier. Panneau inférieur : inversé l’image en noir et blanc. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
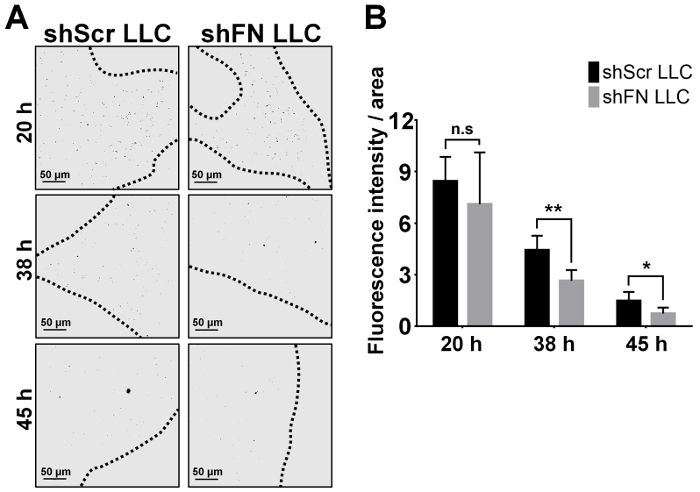
Figure 4 : temps cours imagerie, quantification et analyse statistique pour le poumon colonisèrent cellules LLC shScr et shFN après la perfusion pulmonaire lors de l’essai de colonisation poumon. (A) en noir et blanc images représentatives (convertis à partir des images de fluorescence) des cellules LLC shScr et shFN qui ont été colonisés dans les vaisseaux pulmonaires à divers moments, tel que représenté après la perfusion pulmonaire étendue. Pointillés indiquent le bord parmi les tissus pulmonaires confocal de mise au point. (B) la Quantification et l’analyse statistique pour les cellules LLC colonisant les poumons comme visualisées dans (A) en faisant la moyenne 5 absolue représentant images/poumon lobe/souris. Remarque : Chaque barre indique l’intensité de fluorescence en moyenne de chaque zone confocal de mise au point. Données ont été statistiquement analysées à partir de 6 souris et rapportées comme moyenne ± écart-type ; n.s. signifie non significative ; * signifie p < 0,05 ; et ** signifie p < 0,01 ; Analyse de la variance bidirectionnelle. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
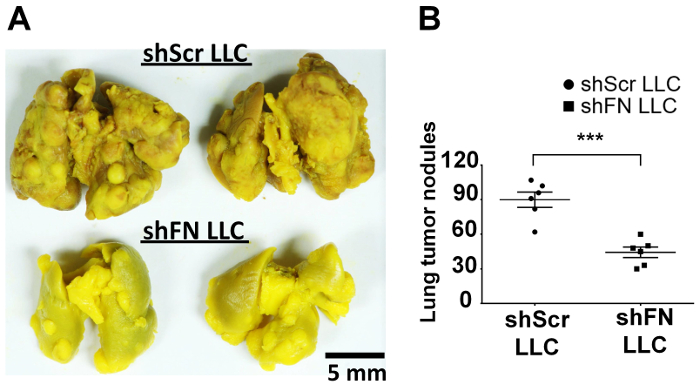
Figure 5 : Silencing expression FN dans les cellules marquées CFSE LLC diminue les nodules de tumeur dans les poumons à long terme dans essai de colonisation vivo CTC. Poumons de souris fluide-correction de Bouin (A) portant des nodules de tumeur dérivée de cellules de CFSE marqué shScr ou shFN LLC. (B) la Quantification et l’analyse statistique pour les nodules de tumeur dans les poumons. Les données sont communiquées comme moyenne ± écart-type ; : p < 0,001 ; n = 6 par groupe ; Test t non apparié. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Ainsi que de long terme poumon colonisation dosages, court terme méthodologie nous avons utilisé ici pour évaluer in vivo colonisation pulmonaire par PTC dans des organes éloignés clairement dévoilé et différencie le rôle spécifique de polyFN monté sur CTC en colonisant les poumons, qui a ensuite conduit à l’extravasation et les processus métastatiques18,19,20,21. Bien que le marquage des cellules avec le tracker de cellule à long terme CFSE nous a permis de retracer le sdcc injecté par voie intraveineuse pendant trois jours avant la perfusion pulmonaire et conserver une fluorescence verte suffisamment fins quantitatives, il était impossible de déterminer directement Si les cellules tumorales situaient trouvaient dans la lumière du vaisseau ou avaient déjà extravasé de vaisseaux sanguins. Pour résoudre cette fluorescence problème, rouge dextran rhodamine conjugué qui est capable de lier non spécifiquement lectines exprimées sur endothelia peut être utilisé pour étiqueter le système vasculaire pulmonaire au poumon perfusion28,29, 30. Malgré le fait que le CFSE est un tracker de cellule à long terme, son intensité de fluorescence est divisé par deux à chaque division cellulaire27, limitant la possibilité de l’utiliser dans l’étiquetage des techniques. Pour contourner ce problème, il convient de vérifier que la dose d’étiquetage de CFSE est suffisante pour rester détectable pour toute la durée du in vivo des expériences et que tout traitement appliqué aux cellules n’a aucun effet sur les cellules, les cellules prolifération. Parce que la comparaison et la quantification des shScr colonisant les poumons et CTC shFN ont été effectuées chez la souris distincts, on pourrait prétendre que les différences entre les deux groupes étaient en raison de la variation individuelle. Pour exclure une telle variation, un mélange de deux types de tumeur cellules marquées avec distinct réagissent en colorants (p. ex., CFSE/CM-diI) ou transfectées stablement avec GFP/dsRed peut être injecté en même temps que par voie intraveineuse dans le même animal à la colonisation de poumon l’essai de31,32,,33. Il est à noter que clonage des effets résultant de la cellule de clonage de technologie qui est tentée de démêler stablement fluorescent cellules transfectées protéine clone avec suffisamment forte fluorescence34,35, 36 , 37 peut rendre les cellules clonées non représentatif pour représenter les populations hétérogènes entières38,39,40. Si une transfection stable d’une protéine fluorescente en cellules tumorales est souhaitée pour les essais de colonisation du poumon, élévation de l’efficacité de la transfection des cellules tumorales dans son ensemble devrait mieux préserver les caractéristiques originales que le clonage de la cellule populations ayant suffisamment fluorescence41,42.
Les étapes de la perfusion pulmonaire dans la colonisation de poumon tests sont nécessaires, car certaines cellules tumorales injectée par voie intraveineuse, au lieu d’arrêter spécifiquement au système capillaire pulmonaire, ont tendance à être mécaniquement piégés et bloqués au sein des réseaux capillaires du poumon tissus en raison des moyennement grands diamètres des PTC à la largeur du poumon lumens capillaire43,44. Quantification des cellules tumorales colonisant les poumons sans perfusant les poumons peut entraîner une surestimation de comptage par erreur les cellules mécaniquement coincé45,46,47. Même si les poumons ont été perfusés, il reste des problèmes supplémentaires. Par exemple, il est encore difficile de différencier les cellules tumorales colonisant les poumons sont situés sur la lumière endothelia ou ont déjà extravasé de vaisseaux sanguins. Pour résoudre ce problème, les vaisseaux sanguins avec dextran Rhodamine conjugué comme évoqué précédemment la coloration peut être utile30,48,49. Si la quantification de l’extravasation de la tumeur est souhaitée, calcium-chélateur EDTA/EGTA ou la trypsine, une protéase non-spécifiques, montér dans le tampon de perfusion d’entraver calcium-dépendante et - independent tumeur cell adhesion événements50 , 51 , 52. ainsi, les cellules tumorales restantes dans les tissus des poumons peuvent être considérées comme extravasé.
Pour la quantification des cellules tumorales colonisant les poumons, les poumons perfusés subissent souvent traditionnelle microscopie confocale. Cependant, la mesurabilité de profondeur de tissu est limitée due en partie aux tissus autofluorescence et effets de diffusion de fluorescence, rendu plus profond tissus indétectable53,54. Un microscope de deux photons avec une sensibilité plus élevée qu’un microscope confocal traditionnel est apte à résoudre des problèmes tels que le rayonnement infrarouge utilisé en excitation biphotonique avec beaucoup moins d’absorption de spécimens biologiques que les UV ou lumière bleue-verte rend la technique plus appropriée pour l’imagerie des spécimens épaisseur55,56,,57. Colonisatrices de poumon de cellules de tumeur sont comptés en faisant la moyenne nombre de cellules tumorales dans plusieurs images confocales représentatives, qui n’incluent pas le nombre entier de colonisatrices de poumon de cellules tumorales dans les poumons entiers d’un animal individuel. Afin de quantifier les poumons entiers dans les essais de colonisation pulmonaires, les cellules tumorales stablement transfectés avec luciférase pourraient être employées et les poumons perfusés pourraient ensuite subir IVIS imagerie après inoculation par voie intraveineuse de cellules tumorales suspendu en présence de luciférine46,58,59. Sinon, les poumons perfusés pourraient être hachées en morceaux et soumis à une digestion enzymatique avec des protéases, par exemple, collagénase, libérant des cellules individuelles en suspension60,,61. La tumeur des cellules avec des teintures de fluorescence ou stablement transfected avec fluorescence protéines pourraient alors être quantifiées avec cellule activée par fluorescence (FACS) analyse56,62de tri.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs tiennent à remercier Dr. Chang Ming-Min et Mme Ya-Hsin Cheng pour leur support technique. Ce travail a été soutenu par le ministère de la Science et la technologie de Taiwan (la plupart-103-2325-B-006-009, plupart-104-2325-B-006-001, la plupart-105-2325-B-006-001 et MOST-106-2320-B-006-068-MY3) et le ministère de la santé et du bien-être social (MOHW106-SAB-B-211-144004). Nous sommes également reconnaissants pour le soutien du laboratoire de recherche de base de la College of Medicine, National Cheng Kung University, pour leur microscope confocal multiphotonique.
matériels
| Name | Company | Catalog Number | Comments |
| Material | |||
| Bovine Serum Albumin (BSA) | Cyrusbioscience (Taipei, Taiwan) | 101-9048-46-8 | |
| Bouin's Fluid | MCC(medical chemical corporation)/POISON | 456-A-1GL | |
| CFSE Proliferation Dye | ebiosciences | 65-0850-85 | Full name: Carboxyfluorescein succinimidyl ester |
| Dulbecco's Modified Eagle Media (DMEM) | (Gibco)ThermoFisher Scientific | 12100-061 | |
| Ethylenediaminetetraacetic acid (EDTA) | Cyrusbioscience (Taipei, Taiwan) | 101-6381-92-6 | For prepared trypsin-EDTA solution( Final concentration: 0.53mM ) |
| Fetal bovine serum (FBS) | (Gibco)ThermoFisher Scientific | 10437-028 | |
| Lewis lung carcinoma (LLC) | ATCC, Manassas, VA, USA | CRL-1642 | |
| L-Glutamine, USP | (Gibco)ThermoFisher Scientific | 21051-024 | |
| Potassium chloride (KCl) | Cyrusbioscience (Taipei, Taiwan) | 101-7447-40-7 | For prepared 1X PBS ( Final concentration: 2.7mM ) |
| Potassium phosphate monobasic (KH2PO4) | Cyrusbioscience (Taipei, Taiwan) | 101-7778-77-0 | For prepared 1X PBS ( Final concentration: 1.8mM ) |
| Sodium chloride (NaCl) | Cyrusbioscience (Taipei, Taiwan) | 101-7647-14-5 | For prepared 1X PBS ( Final concentration: 137mM ) |
| Sodium phosphate dibasic (Na2HPO4) | Cyrusbioscience (Taipei, Taiwan) | 101-10039-32-4 | For prepared 1X PBS ( Final concentration: 10mM ) |
| Trypan Blue | Sigma Aldrich | T6146 | 0.5 g mix with 100 mL 1X PBS |
| Trypsin | Sigma Aldrich | T4799 | For prepared trypsin-EDTA solution ( Final concentration: 5g/L ) |
| Zoletil 50 | Virbac | To dilute with 1X PBS | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Compact Tabletop Centrifuge 2420 | KUBOTA Co. | 2420 | |
| Culture dish (6cm) | Wuxi NEST Biotechnology Co. | 705001 | |
| Disposable syringe (with needle) | Perfect Medical Industry Co. | 24G/3 cm;3 ml & 26G/0.5 cm;1 ml | |
| End over end mixer | C.T.I YOUNG CHENN | TS-20 | For suspended cells recovery |
| FACSCalibur (FACS) | BD biosciences | ||
| Forceps | Dimeda | 10.102.14 | |
| Forma Direct Heat CO2 incubator | Thermo Fisher Scientific Inc. | HEPA CLASS 100 | |
| Mouse restrainer (Cylindrical Restrainer 15-30 gm) | Stoelting | 51338 | |
| Multiphoton Confocal Microscope BX61WI | Olympus | FV1000MPE | |
| Neubauer counting chamber | Marienfeld-Superior | 640010 | |
| Surgical scissor | Dimeda | 08.370.11 | |
| Surgical sutures | UNIK SURGICAL SUTURES MFG. CO. | NO. 0034 | Black Braided silk; non-absorbable (25YD; U.S.P. 4/0) |
| 1.5 mL microcentrifuge tube | Wuxi NEST Biotechnology Co. | 615001 | |
| 15 mL Greiner tube | Greiner bio-one | 188271 |
Références
- Massague, J., Obenauf, A. C. Metastatic colonization by circulating tumour cells. Nature. 529 (7586), 298-306 (2016).
- Lambert, A. W., Pattabiraman, D. R., Weinberg, R. A. Emerging Biological Principles of Metastasis. Cell. 168 (4), 670-691 (2017).
- Mohme, M., Riethdorf, S., Pantel, K. Circulating and disseminated tumour cells - mechanisms of immune surveillance and escape. Nat Rev Clin Oncol. 14 (3), 155-167 (2017).
- Steinert, G., et al. Immune escape and survival mechanisms in circulating tumor cells of colorectal cancer. Cancer Res. 74 (6), 1694-1704 (2014).
- Mahauad-Fernandez, W. D., Okeoma, C. M. Cysteine-linked dimerization of BST-2 confers anoikis resistance to breast cancer cells by negating proapoptotic activities to promote tumor cell survival and growth. Cell Death Dis. 8 (3), e2687(2017).
- Maheswaran, S., Haber, D. A. Circulating tumor cells: a window into cancer biology and metastasis. Curr Opin Genet Dev. 20 (1), 96-99 (2010).
- Yu, M., et al. RNA sequencing of pancreatic circulating tumour cells implicates WNT signalling in metastasis. Nature. 487 (7408), 510-513 (2012).
- Adams, D. L., et al. Mitosis in circulating tumor cells stratifies highly aggressive breast carcinomas. Breast Cancer Res. 18 (1), 44(2016).
- Baccelli, I., et al. Identification of a population of blood circulating tumor cells from breast cancer patients that initiates metastasis in a xenograft assay. Nat Biotechnol. 31 (6), 539-544 (2013).
- Malladi, S., et al. Metastatic Latency and Immune Evasion through Autocrine Inhibition of WNT. Cell. 165 (1), 45-60 (2016).
- Spiegel, A., et al. Neutrophils Suppress Intraluminal NK Cell-Mediated Tumor Cell Clearance and Enhance Extravasation of Disseminated Carcinoma Cells. Cancer Discov. 6 (6), 630-649 (2016).
- Pattabiraman, D. R., et al. Activation of PKA leads to mesenchymal-to-epithelial transition and loss of tumor-initiating ability. Science. 351 (6277), aad3680(2016).
- van der Weyden, L., et al. Genome-wide in vivo screen identifies novel host regulators of metastatic colonization. Nature. 541 (7636), 233-236 (2017).
- Obenauf, A. C., et al. Therapy-induced tumour secretomes promote resistance and tumour progression. Nature. 520 (7547), 368-372 (2015).
- Genovese, G., et al. Synthetic vulnerabilities of mesenchymal subpopulations in pancreatic cancer. Nature. 542 (7641), 362-366 (2017).
- von Horsten, S., et al. Stereological quantification of carboxyfluorescein-labeled rat lung metastasis: a new method for the assessment of natural killer cell activity and tumor adhesion in vivo and in situ. J Immunol Methods. 239 (1-2), 25-34 (2000).
- Reymond, N., et al. Cdc42 promotes transendothelial migration of cancer cells through beta1 integrin. J Cell Biol. 199 (4), 653-668 (2012).
- Cheng, H. C., Abdel-Ghany, M., Elble, R. C., Pauli, B. U. Lung endothelial dipeptidyl peptidase IV promotes adhesion and metastasis of rat breast cancer cells via tumor cell surface-associated fibronectin. J Biol Chem. 273 (37), 24207-24215 (1998).
- Huang, L., et al. Protein kinase Cepsilon mediates polymeric fibronectin assembly on the surface of blood-borne rat breast cancer cells to promote pulmonary metastasis. J Biol Chem. 283 (12), 7616-7627 (2008).
- Chang, Y. H., et al. Secretomic analysis identifies alpha-1 antitrypsin (A1AT) as a required protein in cancer cell migration, invasion, and pericellular fibronectin assembly for facilitating lung colonization of lung adenocarcinoma cells. Mol Cell Proteomics. 11 (11), 1320-1339 (2012).
- Wang, Y. J., et al. Pterostilbene prevents AKT-ERK axis-mediated polymerization of surface fibronectin on suspended lung cancer cells independently of apoptosis and suppresses metastasis. J Hematol Oncol. 10 (1), 72(2017).
- Cheng, H. C., Abdel-Ghany, M., Pauli, B. U. A novel consensus motif in fibronectin mediates dipeptidyl peptidase IV adhesion and metastasis. J Biol Chem. 278 (27), 24600-24607 (2003).
- Hsu, Y. Y., et al. Thrombomodulin is an ezrin-interacting protein that controls epithelial morphology and promotes collective cell migration. FASEB J. 26 (8), 3440-3452 (2012).
- Arlt, M. J., Born, W., Fuchs, B. Improved visualization of lung metastases at single cell resolution in mice by combined in-situ perfusion of lung tissue and X-Gal staining of lacZ-tagged tumor cells. J Vis Exp. (66), e4162(2012).
- Shi, Y., Parhar, R. S., Zou, M., Al-Mohanna, F. A., Paterson, M. C. Gene therapy of melanoma pulmonary metastasis by intramuscular injection of plasmid DNA encoding tissue inhibitor of metalloproteinases-1. Cancer Gene Ther. 9 (2), 126-132 (2002).
- Parish, C. R. Fluorescent dyes for lymphocyte migration and proliferation studies. Immunol Cell Biol. 77 (6), 499-508 (1999).
- Quah, B. J., Warren, H. S., Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat Protoc. 2 (9), 2049-2056 (2007).
- Migone, F. F., et al. In vivo imaging reveals an essential role of vasoconstriction in rupture of the ovarian follicle at ovulation. Proc Natl Acad Sci U S A. 113 (8), 2294-2299 (2016).
- Itkin, T., et al. Distinct bone marrow blood vessels differentially regulate haematopoiesis. Nature. 532 (7599), 323-328 (2016).
- Jiang, M., Qin, C., Han, M. Primary breast cancer induces pulmonary vascular hyperpermeability and promotes metastasis via the VEGF-PKC pathway. Mol Carcinog. 55 (6), 1087-1095 (2016).
- Aceto, N., et al. Circulating tumor cell clusters are oligoclonal precursors of breast cancer metastasis. Cell. 158 (5), 1110-1122 (2014).
- Zheng, Y., et al. Expression of beta-globin by cancer cells promotes cell survival during blood-borne dissemination. Nat Commun. 8, 14344(2017).
- Chen, X., et al. Retinoic acid facilitates inactivated transmissible gastroenteritis virus induction of CD8(+) T-cell migration to the porcine gut. Sci Rep. 6, 24152(2016).
- Saranchova, I., et al. Discovery of a Metastatic Immune Escape Mechanism Initiated by the Loss of Expression of the Tumour Biomarker Interleukin-33. Sci Rep. 6, 30555(2016).
- Ahmed, M., et al. An Osteopontin/CD44 Axis in RhoGDI2-Mediated Metastasis Suppression. Cancer Cell. 30 (3), 432-443 (2016).
- Hoffman, R. M. In vivo imaging of metastatic cancer with fluorescent proteins. Cell Death Differ. 9 (8), 786-789 (2002).
- Mendoza, A., et al. Modeling metastasis biology and therapy in real time in the mouse lung. J Clin Invest. 120 (8), 2979-2988 (2010).
- Meacham, C. E., Morrison, S. J. Tumour heterogeneity and cancer cell plasticity. Nature. 501 (7467), 328-337 (2013).
- Wagenblast, E., et al. A model of breast cancer heterogeneity reveals vascular mimicry as a driver of metastasis. Nature. 520 (7547), 358-362 (2015).
- Nguyen, D. X., Bos, P. D., Massague, J. Metastasis: from dissemination to organ-specific colonization. Nat Rev Cancer. 9 (4), 274-284 (2009).
- Ragelle, H., et al. Chitosan nanoparticles for siRNA delivery: optimizing formulation to increase stability and efficiency. J Control Release. 176, 54-63 (2014).
- Chu, V. T., et al. Increasing the efficiency of homology-directed repair for CRISPR-Cas9-induced precise gene editing in mammalian cells. Nat Biotechnol. 33 (5), 543-548 (2015).
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nat Rev Cancer. 11 (7), 512-522 (2011).
- Joyce, J. A., Pollard, J. W. Microenvironmental regulation of metastasis. Nat Rev Cancer. 9 (4), 239-252 (2009).
- Sanchez-Laorden, B., et al. BRAF inhibitors induce metastasis in RAS mutant or inhibitor-resistant melanoma cells by reactivating MEK and ERK signaling. Sci Signal. 7 (318), ra30(2014).
- Torchiaro, E., et al. Peritoneal and hematogenous metastases of ovarian cancer cells are both controlled by the p90RSK through a self-reinforcing cell autonomous mechanism. Oncotarget. 7 (1), 712-728 (2016).
- Wan, J., et al. Establishment of monoclonal HCC cell lines with organ site-specific tropisms. BMC Cancer. 15, 678(2015).
- Ye, Y., Liu, S., Wu, C., Sun, Z. TGFbeta modulates inflammatory cytokines and growth factors to create premetastatic microenvironment and stimulate lung metastasis. J Mol Histol. 46 (4-5), 365-375 (2015).
- Morales, M., et al. RARRES3 suppresses breast cancer lung metastasis by regulating adhesion and differentiation. EMBO Mol Med. 6 (7), 865-881 (2014).
- Stone, J. P., et al. Mechanical removal of dendritic cell-generating non-classical monocytes via ex vivo lung perfusion. J Heart Lung Transplant. 33 (8), 864-869 (2014).
- Vettorazzi, S., et al. Glucocorticoids limit acute lung inflammation in concert with inflammatory stimuli by induction of SphK1. Nat Commun. 6, 7796(2015).
- Urade, Y., Yoshida, R., Kitamura, H., Hayaishi, O. Induction of indoleamine 2,3-dioxygenase in alveolar interstitial cells of mouse lung by bacterial lipopolysaccharide. J Biol Chem. 258 (10), 6621-6627 (1983).
- Hong, G., et al. Through-skull fluorescence imaging of the brain in a new near-infrared window. Nat Photonics. 8 (9), 723-730 (2014).
- Liu, Q., Guo, B., Rao, Z., Zhang, B., Gong, J. R. Strong two-photon-induced fluorescence from photostable, biocompatible nitrogen-doped graphene quantum dots for cellular and deep-tissue imaging. Nano Lett. 13 (6), 2436-2441 (2013).
- Peti-Peterdi, J., Burford, J. L., Hackl, M. J. The first decade of using multiphoton microscopy for high-power kidney imaging. Am J Physiol Renal Physiol. 302 (2), F227-F233 (2012).
- Duda, D. G., et al. Malignant cells facilitate lung metastasis by bringing their own soil. Proc Natl Acad Sci U S A. 107 (50), 21677-21682 (2010).
- Gupta, G. P., et al. Mediators of vascular remodelling co-opted for sequential steps in lung metastasis. Nature. 446 (7137), 765-770 (2007).
- Kosaka, N., et al. Neutral sphingomyelinase 2 (nSMase2)-dependent exosomal transfer of angiogenic microRNAs regulate cancer cell metastasis. J Biol Chem. 288 (15), 10849-10859 (2013).
- Hoshino, A., et al. Tumour exosome integrins determine organotropic metastasis. Nature. 527 (7578), 329-335 (2015).
- Jaskelioff, M., et al. Telomerase deficiency and telomere dysfunction inhibit mammary tumors induced by polyomavirus middle T oncogene. Oncogene. 28 (48), 4225-4236 (2009).
- Si, L. L., Lv, L., Zhou, W. H., Hu, W. D. Establishment and identification of human primary lung cancer cell culture in vitro. Int J Clin Exp Pathol. 8 (6), 6540-6546 (2015).
- Weng, D., et al. Metastasis is an early event in mouse mammary carcinomas and is associated with cells bearing stem cell markers. Breast Cancer Res. 14 (1), R18(2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon