Method Article
In Vitro Ovule cultivo para viver-pilha de imagem do zigoto polarização e padronização do embrião em Arabidopsis thaliana
Neste Artigo
Resumo
Este manuscrito descreve um in vitro ovule cultivo método que permite que a imagem latente da viver-pilha de Arabidopsis zigotos e embriões. Este método é utilizado para visualizar a dinâmica intracelular durante a polarização de zigoto e a especificação do destino de célula no desenvolvimento de embriões.
Resumo
Na maioria das plantas de floração, o zigoto e embrião estão ocultos no fundo do tecido da mãe, e assim tem sido um mistério de como eles desenvolvem dinamicamente; por exemplo, como o zigoto polariza para estabelecer o eixo do corpo e como o embrião especifica vários destinos de celular durante a formação do órgão. Este manuscrito descreve um in vitro ovule cultura método para executar a imagem latente da viver-pilha de desenvolver zigotos e embriões de Arabidopsis thaliana. O meio de cultivo otimizado permite zigotos ou embriões adiantados para crescer em plantas férteis. Combinando-a com um dispositivo de matriz de micropillar de poly(dimethylsiloxane) (PDMS), o óvulo é realizado em meio líquido na mesma posição. Essa fixação é fundamental observar o óvulo mesmo sob um microscópio para vários dias da extinta Divisão para a fase tardia do embrião. A imagem latente da viver-pilha resultante pode ser usado para monitorar a dinâmica em tempo real de polarização de zigoto, tais como migração nuclear e rearranjo do citoesqueleto e também o momento da divisão celular e especificação de destino célula durante a padronização do embrião. Além disso, este sistema de cultivo do ovule pode ser combinado com tratamentos de inibidor para analisar os efeitos de vários fatores no desenvolvimento do embrião e com ópticas manipulações tais como interrupção do laser para examinar o papel da comunicação célula-célula.
Introdução
O plano básico do corpo de um organismo se desenvolve a partir de um zigoto unicelular. Na maioria das plantas de floração, extinta Divisão gera uma apical e uma célula basal, que se desenvolvem na raiz, respectivamente1e atirar. Portanto, é importante entender como o corpo da planta é formado durante a embriogênese, mas lá não tem sido uma ferramenta eficaz para observar diretamente a dinâmica da vida zigotos e embriões porque eles desenvolvem no fundo da flor. Em diversas espécies de plantas, como milho e arroz, um método de fertilização em vitro tem sido estabelecida2,3. Neste método, isolado de esperma e os óvulos são fundidos eletricamente ou quimicamente, e a célula gerada pode evoluir para uma planta fértil. No entanto, em plantas de dicot, não há nenhum in vitro método de fertilização que pode produzir embriões adequados, presumivelmente por causa do estado do ciclo de pilha não-sincronizadas de gâmetas masculinos e femininos4,5. Além disso, o tecido circundante de embrião (endosperma) tem um papel importante no desenvolvimento de embrião6.
Em uma espécie de modelo dicot, a. thaliana, um método de cultivo em vitro foi desenvolvido focando o ovule inteiro, que contém o embrião e o endosperma7. Este sistema foi usado com sucesso para analisar os efeitos de vários reagentes químicos na embriogênese, mas não é adequado para imagens lapso de tempo, porque tem uma taxa de sobrevivência de baixo. Portanto, foi desenvolvido um sistema de cultivo de ovule romance em vitro para começar tão cedo quanto o estágio de zigoto e produzir plantas férteis em uma alta proporção de8. Depois de vários testes, verificou-se esse meio de Nitsch e trealose melhorou significativamente a taxa de sobrevivência de óvulos8. Além disso, porque o óvulo se expande à medida que cresce e, portanto, frequentemente se move longe do campo de observação do microscópio, um dispositivo PDMS foi desenvolvido para corrigir o ovule na média9. O dispositivo PDMS habilitado a imagem a longo prazo para 3-4 dias, que é suficiente para traçar o desenvolvimento de um zigoto de um embrião de coração-estágio. Usando esse método, torna-se possível visualizar a dinâmica da polarização de zigoto e embrião de padronização, não só em condições normais, mas também na presença de inibidores químicos ou em vários contextos mutantes8,10 ,11.
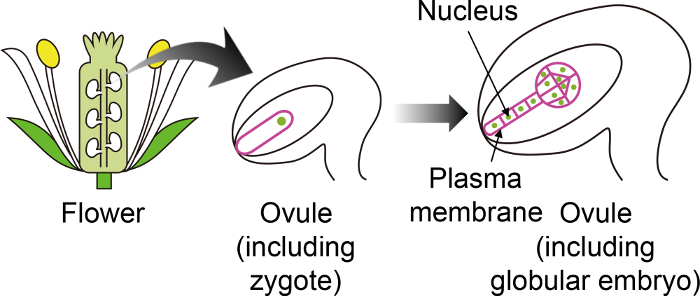
Figura 1: Diagrama esquemático dos marcadores fluorescentes específicos usados para visualizar zigotos e embriões através do Ovule.
O Arabidopsis zigoto se desenvolve em um embrião no óvulo, que é gerado no fundo da flor. Neste sistema cultivo em vitro , o zigoto e embrião são observados através do ovule e, portanto, é importante o uso de marcadores fluorescentes específicos que não são expressas em outros tecidos do óvulo. Por favor clique aqui para ver uma versão maior desta figura.
Protocolo
1. preparação do meio de cultura In Vitro Ovule
- fazer o meio líquido para o in-vitro cultura ovule (" N5T médio ") contendo 1 x Nitsch basal sal mistura, 5% (p/v) trealose dihidratado, 0.05 % (p/v) 2-(N-Morpholinos) ácido etanesulfónico (MES)-KOH (pH 5,8) e 1 x Gamborg ' solução de vitamina s.
- Ajustar o pH a 5.8 com KOH.
- Esterilizar o meio em autoclave (121 ° C, 20 min) ou filtragem através de um filtro de 0,22 µm.
Nota: O meio esterilizado pode ser armazenado a 4 ° C durante 2-3 meses.
2. Preparação do dispositivo matriz PDMS Micropillar
- corta o dispositivo de micropillar PDMS por uma faca, lâmina de barbear ou tesoura para se encaixar a parte de vidro (φ 14mm) de um prato de vidro-fundo de 35 mm.
Nota: O procedimento completo da construção do dispositivo PDMS é descrito em anterior papéis 8 , 9, e, portanto, os detalhes são omitidos aqui. Pratos de vidro-fundo com volumes menores, tais como placas 4-bem ou 96 poços, podem ser usados para a imagem latente a curto prazo, sem o dispositivo. - Esterilize o lado superior do dispositivo PDMS sob luz UV de 15 min.
- Rode o dispositivo de PDMS por usando uma pinça de ponta quadrada e mantê-lo sob UV luz por 15 min esterilizar fundo.
- Transferir o dispositivo PDMS esterilizado para uma placa de cultura de 35mm e adicionar o N5T médio até que o dispositivo é completamente embebido no meio (aproximadamente 5-7 mL).
- Colocar o prato em uma câmara de vácuo e reduzir a pressão para desgaseificar. Manter aspiração para 3h durante a noite até que o ar no dispositivo é substituído pelo meio.
Nota: O dispositivo pode ser desanexado por bolhas de ar sob um vácuo forte. - Leve o dispositivo do prato, segurando-o com uma pinça de ponta quadrada e colocá-lo em uma toalha de papel para remover o meio extra na parte lateral e inferior.
Nota: O meio na matriz de micropillar (superfície superior) não deve ser removido porque isso será usado para o cultivo do ovule. - Transferir o dispositivo para um vidro de slide 76 x 26 mm, garantindo para manter a parte de micropillar como o lado superior e cubra o dispositivo com tampa de prato de cultura de 35mm para evitar que o meio de secar durante a extração seguinte do ovule.
3. Síliqua dissecação e extração Ovule
- esterilizar uma agulha (0,40 mm G) e uma pinça bem esfregando com etanol a 70%. A agulha é facilmente manipulada, anexando-o a uma vara de madeira ou seringa.
- Verificar a inflorescência da planta e selecione os siliques adequados para o experimento. Os siliques mm aproximadamente 5 contêm zigotos, e os siliques de 8-10 mm incluem jovens embriões globulares.
- Excisar as siliques usando uma pinça e colocá-los em fita dupla-face em um vidro de slide 76 x 26 mm. Uma síliqua contém cerca de 40-60 óvulos e 3-4 siliques (ou seja, 120-240 óvulos) são suficientes para um dispositivo.
- Abrir a síliqua (parede do ovário) para ver os óvulos dentro usando a agulha esterilizada e pinça sob um estereomicroscópio. Corte apenas a parede do ovário, de forma que os óvulos não estão danificados.
- Transferir a síliqua abriu no meio de N5T no dispositivo de PDMS (preparado na etapa 2.7) e liberar os óvulos no meio de, com a agulha ou pinça.
- Colocar um vidro de tampa pequeno (18 x 18 mm) para o dispositivo PDMS para empurrar os óvulos para os espaços na matriz micropillar.
- Tirar o tampa de vidro, puxando-o na horizontal, usando pinças ou dedos para remover extra médio.
- Rode o dispositivo de PDMS de cabeça para baixo, coloque-o em um prato de vidro-fundo de 35mm e pressione ligeiramente o dispositivo pressionando usando as pinças de ponta quadrada para ficar grudado no vidro.
- Médio N5T Despeje delicadamente no vidro-fundo por decantação o frasco médio até que o dispositivo PDMS é completamente embebido no meio do prato e selar o prato com película de parafina.
Nota: O dispositivo PDMS pode ser reciclado, mas dispositivos que são muito velhos são facilmente destacados da parte inferior do vidro. Além disso, o dispositivo pode flutuar se isso não é totalmente desgaseificado na etapa 2.5 ou o meio é derramado demasiado rapidamente.
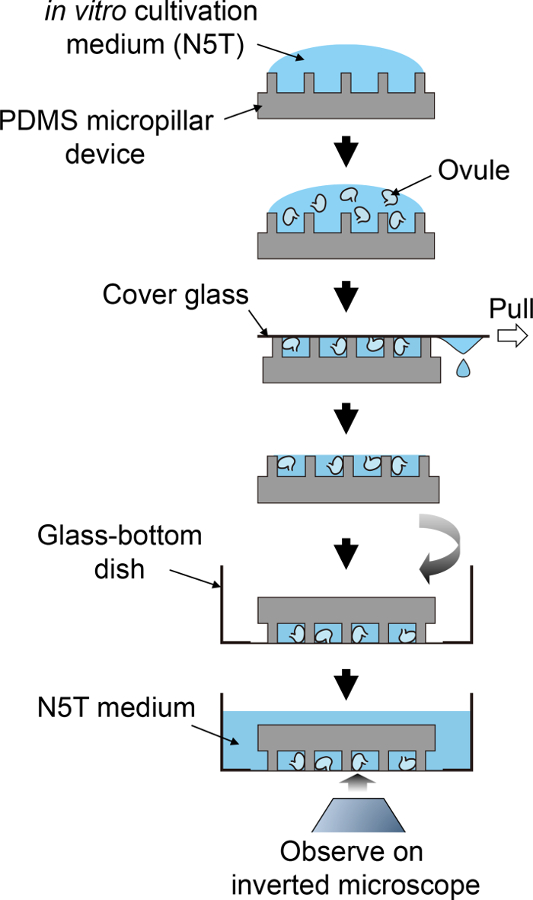
Figura 2: procedimento esquemático para preparação de amostras.
Este fluxo esquemático corresponde às etapas 3.5 para 4.1. clique aqui para ver uma versão maior desta figura.
4. tempo-lapso Imaging
- Coloque o prato de vidro de fundo que foi preparado no passo 3.9 em um microscópio invertido e selecione óvulos apropriados para se concentrar em.
Nota: Porque os óvulos variam em palco, posição e direção, óvulos apropriados devem ser encontrados, verificando sua fluorescência marcador. - Começar a viver de imagem de acordo com o fabricante ' instruções de s do sistema microscópio.
Nota: O equipamento do microscópio e os parâmetros são diversos, e, portanto, os usuários devem escolher as configurações corretas que cabem para o propósito do experimento. Como exemplo, as configurações usadas neste manuscrito estão listadas na tabela 1.
| Figura 3 (A) e suplementar vídeos 1 e 4 | Figura 3 (B) e 2 de vídeo suplementar | suplementar vídeo 3 | |
| microscópio | varredura a laser microscópio (A1R MP) invertido | - disco giratório do microscópio confocal invertido (CSU-W1) | caixa-tipo invertido sistema microscópio confocal com uma câmara de incubação estável (CV1000) |
| Laser | Ti:sapphire femtosecond laser de pulso | 488 nm e 561-nm laser LD | 488 nm e 561-nm laser LD |
| O BJECTIVO lente | 40 X lente objetiva de imersão de água (at = 1,15) com meio de imersão | 60 X silicone óleo lente objetiva de imersão (at = 1,30), montado em uma unidade de foco Piezo | 40 X da lente objetiva (at = 0,95) |
| detectar ou | externo não-descanned PMT GaAsP detector | câmera EMCCD | câmera EMCCD |
| espelho Dichroic | DM495 e DM560 | DM488/561 | DM400-410/488/561 |
| filtro | filtros passa-banda; 520/35 nm e 593/46 nm | filtros passa-banda; 520/50 nm e 617/73 nm | |
| fatia ao longo do eixo z | z 31 - pilhas com intervalos de 1 µm | 17 z-pilhas com 3 µm inter Vals | 7 z-pilhas com intervalos de 5 µm |
| intervalo de tempo | 20 min | 5 min | 10 min |
tabela 1: O Sistemas de microscópio e configurações usadas neste manuscrito.
Os microscópios e os parâmetros são diversos, e assim, cada usuário deve escolher o sistema adequado para o experimento.
- Verifique a sequência de imagem adquirida e convertê-lo para o formato geral do filme, como. avi ou. MOV para apresentação.
Nota: Se o software de microscópio não pode saída as imagens como um formato de filme, é possível salvar as imagens como. tif e então abri-los no ImageJ, um programa open source inspirado pela imagem do NIH, para alterar o tipo de arquivo. ImageJ é fornecido em: https://imagej.nih.gov/ij/. ImageJ também pode ser usado para fazer um Z-sDobre o filme, como a projeção de intensidade máxima, conforme descrito em: https://imagej.net/Z-functions.
Resultados
Usando este sistema de cultivo do ovule, esse método pode traçar a vida dinâmica de polarização de zigoto e padronização do embrião. Isto é uma conquista, porque anteriormente não havia nenhuma técnica para visualizar o comportamento em tempo real do zigoto e embrião, que estão escondidos no fundo do tecido da mãe. Figura 3A e 1 de vídeo suplementar mostram que os microtúbulos (MTs) no zigoto jovem acumulam como um anel transversal na região subapical10. Este anel de MT é mantido enquanto o zigoto se alonga na direção apical. Após a conclusão do zigoto alongamento e migração nuclear à região apical, o anel de MT desaparece e os MTs formam um eixo para separar o DNA. Figura 3B e 2 de vídeo suplementar mostram que células embrionárias coordenada se divide para formar uma forma globular valvas simétrica8. Este método é aplicável para experimentos farmacológicos. Por exemplo, após a aplicação de um inibidor da polimerização de actina (latrunculin B; B de lat) para o meio líquido os zigoto-contendo óvulos de cultivo, a migração polar nuclear foi inibida e, assim, o zigoto dividido de uma forma mais simétrica, indicando a função dos filamentos de actina sobre a polarização do zigoto (Supplemental vídeo 3 )10. Imagem de longo prazo do desenvolvimento embrionário permite o rastreamento da direção e sincronismo das divisões de célula individuais, o que significa que a duração da geometria e do ciclo celular pode ser analisado estatisticamente. De fato, mostramos anteriormente que a divisão de células da linhagem da célula apical é mais rápida do que o basocelular região8.
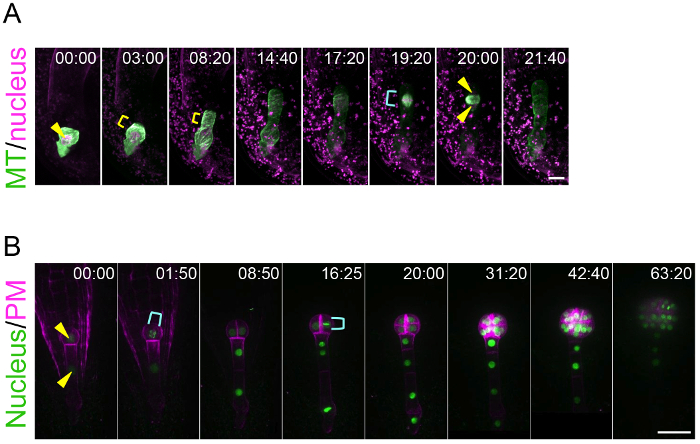
Figura 3: Ao vivo imagens de polarização de zigoto e embrião padronização.
(A) observação de lapso de tempo de um zigoto expressando marcadores específicos para o núcleo (2B-tdTomato de histona; magenta) e microtúbulos (MTs, trevo-TUA6; verde). As imagens foram adquiridas utilizando um microscópio invertido de varredura a laser (A1R MP). (B) observação de lapso de tempo de um embrião expressando marcadores para o núcleo (histona 2B-sGFP; verde) e a membrana plasmática (PM, tdTomato-LTI6b; magenta). As imagens foram adquiridas utilizando um disco giratório confocal microscópio invertido (CSU-W1). As imagens foram mostradas imagens de projeção de intensidade máxima, e os números indicam o tempo (h:min) a partir do primeiro quadro. Pontas de flechas e suportes amarelos mostram o núcleo e o anel transversal de MT, respectivamente. Ciano colchetes indicam o eixo (A) e núcleo de divisão (B). Barras de escala: 10 µm (A) e (B) de 30 µm. Clique aqui para ver uma versão maior desta figura.
Discussão
Este manuscrito introduz um simples em vitro ovule cultivo protocolo que é eficiente para uso na imagem ao vivo-célula de desenvolvimento de zigotos e embriões.
O design do aparelho PDMS pode precisar de otimização de acordo com a fase de embrião. O primeiro dispositivo desenvolvido era uma matriz de microcage para ajustar a orientação e para corrigir a posição dos óvulos9, e em seguida um dispositivo de micropillar foi construído para interceptar óvulos mais eficientemente8. Além disso, os micropillars são mais finos e macios do que um microcage e, portanto, não impedem a expansão do ovule durante a observação a longo prazo. Este dispositivo micropillar pode segurar um ovule durante vários dias, desde a fase zigóticos até o coração embrionário estágio8. Em última análise, no entanto, a altura do óvulo totalmente expandida excede a altura de micropillar, e assim, empurra o dispositivo fora. Portanto, a altura e o espaçamento do micropillars devem ser ajustadas se posteriormente embriões são o foco.
Porque o óvulo é posicionado no fundo do prato, deve ser usado um microscópio invertido. Um microscópio confocal é suficiente para monitorar o padrão de divisão celular, como mostrado na Figura 3B e suplementar vídeos 2 e 3de8,11, e um disco giratório de microscópio confocal é importante executar a longo prazo imagem sem danos celulares. Em contraste, uma microscopia de dois fotões de excitação, que é apropriada para a imagem latente profunda de viver organismos12, é necessário Visualizar a dinâmica intracelular do zigoto (Figura 3A e 1 de vídeo suplementar)10. Portanto, é fundamental a utilização do sistema de microscópio apropriado para os experimentos.
Conforme descrito na introdução e Resultados de representante, não havia nenhum método existente que pode monitorar a dinâmica da vida do zigoto e embrião desenvolver-se do ovule. Portanto, usando esse método de cultivo do ovule, detalhes de polarização de zigoto e padronização do embrião foram esclarecidos pela primeira vez.
Este método é aplicável para experimentos farmacológicos, como mostrado no vídeo suplementar 3. Além disso, este sistema da imagem latente foi utilizado para avaliar os efeitos dos compostos recentemente sintetizados na divisão de células embrionárias11. Foi combinado também com êxito com o rompimento do laser e, portanto, revelou que, quando a célula apical é prejudicada, os basocelular derivados mudam seu destino de célula para produzir uma nova célula apical8. Portanto, ainda mais a aplicação deste método para vários materiais e técnicas fornecerá ferramentas poderosas para compreender os mecanismos moleculares da embriogênese.
Para realizar a longo prazo de imagem com este método, a etapa crucial é preparar um marcador fluorescente específico e brilhante que rotula os tecidos-alvo e/ou estruturas. Porque o zigoto e embrião são observados através do ovule, conforme mostrado na Figura 1, sinais de fundo no endosperma e outros tecidos do óvulo podem mascarar o verdadeiro sinal no embrião (Figura 4). Além disso, para detectar um sinal fraco, o poder do laser do microscópio precisa ser aumentado, mas isso pode prejudicar o óvulo durante a observação a longo prazo. Suplementar Video 4 mostra que a potência do laser de alta aumentou autofluorescência no óvulo e finalmente encolheu o sac do embrião, em que o zigoto foi esmagado. Portanto, uma linha específica e brilhante marcador deve ser estabelecida antes de iniciar o experimento. Em relação ao brilho mais elevado, tdTomato e trevo são melhores do que o RFP e GFP, respectivamente.

Figura 4: Fundo sinal fluorescente no Ovule máscaras sinal embrionária.
Imagem do óvulo expressando os marcadores do núcleo embrionário (2B-tdTomato de histona; magenta) e o núcleo epidérmico (2B-trevo de histona; verde). Toda ovule e embrião excisado são mostrados na parte superior e inferior painéis, respectivamente. As setas apontam para a posição do embrião. O histona 2B-trevo é expressa não só no embrião, mas também no ovule inteira, e assim é difícil encontrar o sinal embrionário através do ovule. Barras de escala: (A) de 50 µm e 10 µm (B). Clique aqui para ver uma versão maior desta figura.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Microscopia neste trabalho foi realizada no Instituto de transformadora Bio-moléculas (WPI-ITbM) da Universidade de Nagoya e suportada pelo Japão avançado Plant Science Network. Este trabalho foi financiado por doações do Japão de ciência e tecnologia agência (projeto ERATO T.H. e Magal) e da sociedade do Japão para a promoção da ciência: um subsídio para a investigação científica em áreas inovadoras (n º s. JP24113514, JP26113710, JP15H05962 e JP15H05955 para Magal e n º s. JP16H06465, JP16H06464 e JP16K21727 para Silvia), um subsídio para jovens cientistas (B, n º s. JP24770045 e JP26840093 para Magal) e um subsídio para pesquisa exploratória desafiador (n. º JP16K14753 para Magal).
Materiais
| Name | Company | Catalog Number | Comments |
| Nitsch basal salt mixture | Duchefa | N0223 | |
| trehalose dihydrate | Wako Pure Chemical | 206-18455 | |
| MES | Dojindo | 345-01625 | |
| Gamborg’s vitamin solution | Sigma-Aldrich | G1019 | |
| 35-mm glass-bottom dish | Matsunami Glass | D111300 | |
| 35 mm culture dish | Corning | 430588 | |
| PDMS | Dow Corning Co. | Sylgard184 | |
| 76 × 26 mm slide glass | Matsunami Glass | S1225 | |
| 18 × 18 mm slide glass | Matsunami Glass | C018181 | |
| needle (gauge 0.40mm) | Terumo | NN-2719S | |
| Immersion medium Immersol W 2010 | Zeiss | 444969-0000-000 | |
| A1R MP | Nikon | A1RsiMP(1080) Ti-E-TIRF | |
| CSU-W1 | Yokogawa Electric | It is a customized equipment, and thus Catalog Number is not avairable. | |
| CV1000 | Yokogawa Electric | CV1000-SP84 |
Referências
- Natesh, S., Rau, M. A., Johri, B. M. . Embryology of Angiosperms. , 377-443 (1984).
- Kranz, E., Lorz, H. In vitro fertilisation of maize by single egg and sperm cell protoplast fusion mediated by high calcium and high pH. Zygote. 2 (2), 125-128 (1994).
- Uchiumi, T., Uemura, I., Okamoto, T. Establishment of an in vitro fertilization system in rice (Oryza sativa L.). Planta. 226 (3), 581-589 (2007).
- Sun, M. X., Moscatelli, A., Yang, H. Y., Cresti, M. In vitro double fertilization in Nicotiana tabacum (L.): the role of cell volume in cell fusion. Sex Plant Rep. 13 (4), 225-229 (2001).
- Tian, H. Q., Yuan, T., Russell, S. D. Relationship between double fertilization and the cell cycle in male and female gametes of tobacco. Sex Plant Rep. 17 (5), 243-252 (2004).
- Costa, L. M., et al. Central cell-derived peptides regulate early embryo patterning in flowering plants. Science. 344 (6180), 168-172 (2014).
- Sauer, M., Friml, J. In vitro culture of Arabidopsis embryos within their ovules. Plant J. 40 (5), 835-843 (2004).
- Gooh, K., et al. Live-cell imaging and optical manipulation of Arabidopsis early embryogenesis. Dev Cell. 34 (2), 242-251 (2015).
- Park, J., Kurihara, D., Higashiyama, T., Arata, H. Fabrication of microcage arrays to fix plant ovules for long-term live imaging and observation. Sens Act B-Chem. 191, 178-185 (2014).
- Kimata, Y., et al. Cytoskeleton dynamics control the first asymmetric cell division in Arabidopsis zygote. Proc Natl Acad Sci U S A. 113 (49), 14157-14162 (2016).
- Nambo, M., et al. Combination of Synthetic Chemistry and Live-Cell Imaging Identified a Rapid Cell Division Inhibitor in Tobacco and Arabidopsis thaliana. Plant Cell Physiol. 57 (11), 2255-2268 (2016).
- Mizuta, Y., Kurihara, D., Higashiyama, T. Two-photon imaging with longer wavelength excitation in intact Arabidopsis tissues. Protoplasma. 252 (5), 1231-1240 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados