Method Article
In Vitro Cultivo de óvulos para la proyección de imagen de cigoto polarización de Live-celular y patrones del embrión en Arabidopsis thaliana
En este artículo
Resumen
Este manuscrito describe una en vitro óvulo cultivo método que permite la proyección de imagen de células vivas de Arabidopsis cigotos y embriones. Este método se utiliza para visualizar la dinámica intracelular durante la polarización del cigoto y la especificación de destino celular en el desarrollo de embriones.
Resumen
En la mayoría de las plantas de la floración, el cigoto y el embrión se ocultan profundamente en el tejido de la madre, y así ha sido durante mucho tiempo un misterio de cómo se desarrollan dinámicamente; por ejemplo, cómo el zigoto se polariza para establecer el eje del cuerpo y cómo el embrión especifica diversos sinos de la célula durante la formación de órganos. Este manuscrito describe un en vitro óvulo método de cultivo para realizar la proyección de imagen de células vivas de desarrollo de cigotos y embriones de Arabidopsis thaliana. El medio de cultivo optimizado permite cigotos o embriones tempranos para crecer las plantas fértiles. Combinando con un dispositivo de arreglo microcolumnas de poly(dimethylsiloxane) (PDMS), el óvulo se lleva a cabo en el medio líquido en la misma posición. Esta fijación es crucial observar el óvulo mismo microscopio durante varios días de la división postcigótica para la última etapa de embrión. La proyección de imagen de células vivas resultante puede utilizarse para controlar la dinámica en tiempo real de la polarización del cigoto, como la migración nuclear y reordenamiento del citoesqueleto y también el momento de la división de célula y especificación de destino celular durante el dibujo de embrión. Además, este sistema de cultivo del óvulo puede combinarse con tratamientos de inhibidor para analizar los efectos de diversos factores en el desarrollo del embrión y con manipulaciones ópticas como interrupción del láser para examinar el papel de la comunicación de la célula.
Introducción
El plan básico del cuerpo de un organismo se desarrolla a partir de un cigoto unicelular. En la mayoría de las plantas de la floración, división postcigótica genera un apical y una célula basal, que se desarrollan en el brote y la raíz, respectivamente1. Por lo tanto, es importante entender cómo el cuerpo de la planta se forma durante la embriogénesis, pero no ha sido una herramienta efectiva para observar directamente la dinámica de vida cigotos y embriones porque se desarrollan profundamente en la flor. En varias especies de monocotiledóneas, como el maíz y arroz, un método de fertilización en vitro ha sido establecido2,3. En este método, aislada esperma y óvulos se fusionan químicamente o eléctricamente, y la célula generada puede convertirse en una planta fértil. Sin embargo, en las plantas dicotiledóneas, no existe ningún método en vitro fecundación que puede producir embriones adecuados, probablemente debido al estado del ciclo celular asíncrono de gametos masculinos y femeninos4,5. Además, el tejido que rodea el embrión (endospermo) juega un papel importante en el embrión de desarrollo6.
En una especie de dicotiledóneas de modelo, de a. thaliana, fue desarrollado un método de cultivo en vitro concentrándose en el óvulo todo, que contiene el embrión y el endospermo7. Este sistema fue utilizado con éxito para analizar los efectos de diversos reactivos químicos en embriogénesis, pero no es conveniente para Time-lapse de imágenes ya que tiene una baja tasa de supervivencia. Por lo tanto, se desarrolló un sistema de cultivo novedoso en vitro óvulo para iniciar tan pronto como la etapa de cigoto y producir plantas fértiles en un alto cociente8. Después de diversas pruebas, se encontró medio Nitsch y trehalosa mejoró significativamente la tasa de supervivencia de óvulos8. Además, porque el óvulo se expande a medida que crece y por lo tanto con frecuencia se mueve lejos del campo de observación del microscopio, se desarrolló un dispositivo PDMS para arreglar el óvulo en el medio9. El dispositivo PDMS permitió la proyección de imagen a largo plazo de 3-4 días, que es suficiente para trazar el desarrollo de un cigoto a un embrión de corazón-etapa. Usando este método, es posible visualizar la dinámica de la polarización del cigoto y embrión patrones, no sólo en condiciones normales, pero también en presencia de inhibidores químicos o en varios fondos mutante8,10 ,11.
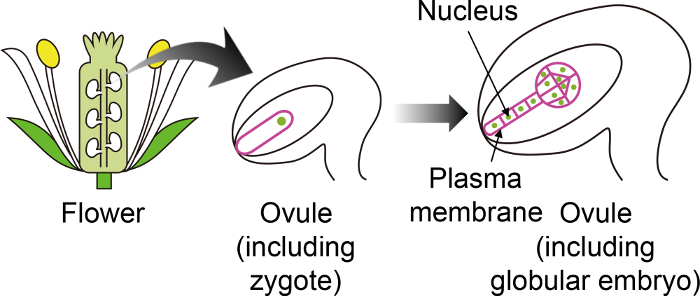
Figura 1: Diagrama esquemático de los marcadores fluorescentes específicos utilizado para visualizar cigotos y embriones a través del óvulo.
El zigoto de Arabidopsis se convierte en un embrión en el óvulo, que se genera en la flor. En este sistema de cultivo in vitro , el cigoto y el embrión se observan a través del óvulo, y por lo tanto es importante utilizar marcadores fluorescentes específicos que no se expresan en otros tejidos del óvulo. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
1. preparación de medio de cultivo In Vitro de óvulos
- hacer el medio líquido para el cultivo in vitro de óvulo (" N5T media ") que contiene 1 x Nitsch basal pasta de sal, 5% (p/v) trehalosa dihidrato, 0.05 % (w/v) 2-(N-morfolino) (n-2-hidroxietilpiperazina-N'-2-ácido ácido (MES)-KOH (pH 5.8) y 1 x Gamborg ' solución de vitamina s.
- Ajustar el pH a 5,8 con KOH.
- Esterilizar el medio en autoclave (121 ° C, 20 min) o filtrado por un filtro de 0,22 μm.
Nota: El medio esterilizado puede conservarse a 4 ° C durante 2-3 meses.
2. Preparación del dispositivo de matriz microcolumnas de PDMS
- corta el dispositivo microcolumnas PDMS por un cuchillo, navaja o tijeras para encajar en la parte de vidrio (φ 14 mm) de un plato de fondo de cristal de 35 mm.
Nota: El procedimiento completo de la construcción de dispositivo PDMS es descrito en anteriores trabajos 8 , 9, y así los detalles se omiten aquí. Platos de fondo de cristal con volúmenes más pequeños, tales como placas de 4 pozos o 96 pocillos, pueden ser utilizados para la proyección de imagen a corto plazo sin el dispositivo de. - Esterilizar la parte superior del dispositivo PDMS bajo luz UV de 15 min.
- Gire el PDMS por el uso de pinzas de punta cuadrada y mantenerla bajo UV luz durante 15 minutos esterilizar la base.
- Transferir el dispositivo esterilizado de PDMS en una placa de cultivo de 35 mm y añadir el medio N5T hasta que el dispositivo se sumerge completamente en el medio (aproximadamente 5-7 mL).
- Poner el plato en una cámara de vacío y reducir la presión de degas. Evitar aspirar durante 3 horas hasta toda la noche hasta que el aire en el dispositivo se sustituirá por medio.
Nota: El dispositivo puede ser separado por las burbujas de aire bajo un vacío fuerte. - Tomar el dispositivo de la fuente sujetando con las pinzas de punta cuadrada y poner sobre papel absorbente para eliminar el medio extra en el lado y fondo.
Nota: el medio en la matriz microcolumnas (superficie superior) no se debe retirar porque se utilizarán para el cultivo del óvulo. - El dispositivo en un vidrio portaobjetos 76 x 26 mm, asegurándose de mantener la parte microcolumnas como la parte superior, la transferencia y cubra el aparato con la tapa de plato de cultura de 35 mm para evitar que el medio de la desecación durante la siguiente extracción óvulo.
3. Silicua disección y extracción del óvulo
- esterilizar una aguja (0,40 mm G) y unas pinzas finas frotando con etanol al 70%. La aguja es fácilmente manejada atando a un palo jeringa o de madera.
- Marque la inflorescencia de la planta y seleccione las silicuas apropiados para el experimento. Las silicuas mm aproximadamente 5 contienen cigotos y las silicuas de 8-10 mm incluyen embriones globulares joven.
- Suprimir las silicuas utilizando pinzas y colocarlos en la cinta de doble cara en un cristal de portaobjetos 76 x 26 mm. Una silicua contiene sobre 40-60 óvulos y silicuas de 3-4 (es decir, óvulos de 120-240) son suficientes para un dispositivo.
- Abra la silicua (pared del ovario) para ver los óvulos dentro con la aguja esterilizada y pinzas bajo un estereomicroscopio. Cortar sólo la pared del ovario para que los óvulos están dañados no.
- Transferencia de la silicua abierto en el medio N5T en el dispositivo PDMS (preparado en el paso 2.7) y liberan los óvulos en el medio con la aguja o unas pinzas.
- Poner un vaso pequeño de la cubierta (18 mm x 18 mm) en el dispositivo PDMS para empujar los óvulos en los espacios de la matriz microcolumnas.
- Sacar el vidrio de cubierta tirando horizontalmente con pinzas o los dedos para quitar extra medio.
- Voltee hacia abajo el dispositivo PDMS, colóquelo en un plato de fondo de cristal de 35 mm y presione ligeramente el dispositivo empujando utilizando las pinzas de punta cuadrada para pegarlo al cristal.
- Medio de N5T vierta suavemente en el fondo de cristal por decantación la botella media hasta que el dispositivo PDMS se sumerge completamente en el medio del plato y selle el plato con la película de parafina.
Nota: El dispositivo PDMS puede ser reciclado, sino dispositivos que son demasiado viejos se desprende fácilmente el fondo de cristal. Además, el dispositivo puede flotar si no es totalmente desgasificado en el paso 2.5 o el medio se vierte demasiado rápido.
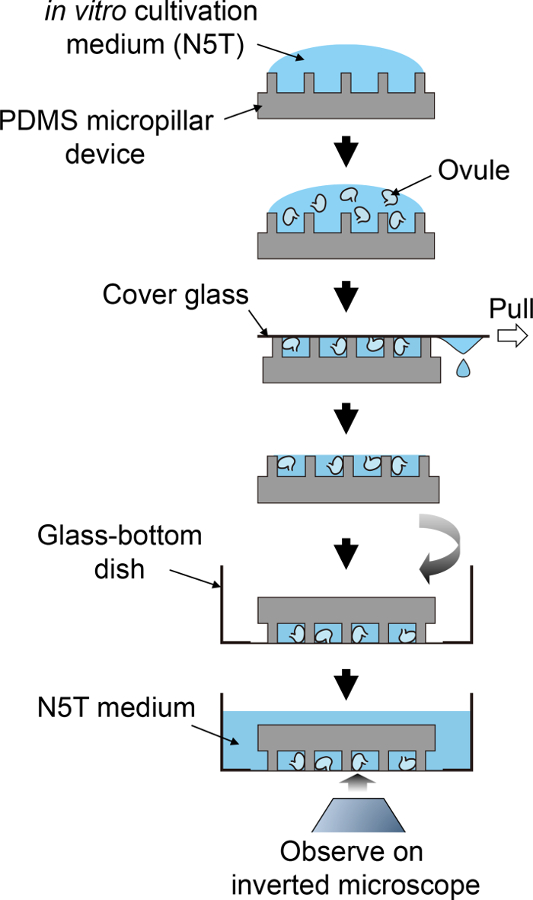
figura 2: esquema procedimiento para preparación de muestras.
Este flujo esquemático corresponde a pasos de 3.5 a 4.1. haga clic aquí para ver una versión más grande de esta figura.
4. time-lapse imágenes
- Coloque el plato de fondo de cristal que estaba preparado en el paso 3.9 en un microscopio invertido y seleccione óvulos adecuados para centrarse en.
Nota: Debido a que los óvulos varían en etapa, posición y dirección, óvulos adecuados deben encontrarse revisando su fluorescencia marcador. - Iniciar la imagen de vivir según el fabricante ' instrucciones del sistema microscopio.
Nota: El equipo de microscopio y parámetros son diversos, y así los usuarios deben elegir las configuraciones adecuadas que se ajusten a la finalidad del experimento. Por ejemplo, la configuración utilizada en este manuscrito se enumeran en la tabla 1.
| suplementario Videos 1, figura 3 (A) y 4 | Figura 3 (B) y 2 de Video suplementaria | suplementario Video 3 | |
| microscopio | microscopio (A1R MP) escaneo láser invertido | microscopio invertido confocal de disco giratorio (CSU-W1) | invertida de tipo caja sistema de microscopio confocal con una cámara de incubación estable (CV1000) |
| láser | láser de TI: zafiro femtosecond pulsos | láser de 488 nm y 561 nm LD | 488 nm y 561-nm láser LD |
| O Fijaremos la lente | 40 X objetivo de inmersión en agua (NA = 1.15) con medio de inmersión | 60 X lente de objetivo de inmersión de aceite de silicona (NA = 1.30), montado en una unidad de enfoque piezoeléctrico | 40 X objetivo (NA = 0.95) |
| detectar o | externo no descanned GaAsP PMT detector | cámara EMCCD | cámara EMCCD |
| Dichroic espejo | DM495 y DM560 | DM488/561 | DM400-410/488/561 |
| filtro | filtros band-pass, 520/35 nm y 593/46 nm | filtros band-pass; 520/50 nm y 617/73 nm | |
| rebanada a lo largo del eje z | z 31 - pilas con intervalos de 1-μm | inter 17 z-pilas con el μm 3 Vals | 7 z-pilas con intervalos de 5 μm |
| intervalo de tiempo | 20 min | 5 min | 10 min |
tabla 1: la Sistemas del microscopio y la configuración utilizada en este manuscrito.
Los microscopios y los parámetros son diversos, y por lo tanto cada usuario debe elegir el sistema adecuado para el experimento de.
- Compruebe la secuencia de imágenes adquiridas y convertirlo al formato general de la película, como .avi o .mov para su presentación.
Nota: Si el software del microscopio no emitir las imágenes en un formato de película, es posible guardar las imágenes como .tif y luego abrirlos en ImageJ, un programa de código abierto inspirado en la imagen de NIH, para cambiar el tipo de archivo. ImageJ está disponible en: https://imagej.nih.gov/ij/. ImageJ puede utilizarse también para hacer un Z-sTuck la película, como la proyección de máxima intensidad, como se describe en: https://imagej.net/Z-functions.
Resultados
Mediante el uso de este sistema de cultivo del óvulo, este método puede trazar la dinámica de vida de la polarización del cigoto y el embrión patrón. Esto es un logro porque anteriormente no había ninguna técnica para visualizar el comportamiento en tiempo real del cigoto y embrión, que se esconden profundamente en el tejido de la madre. Figura 3A y suplementario 1 de Video muestran que los microtúbulos (MTs) en el cigoto joven se acumulan como un anillo transversal en la región subapical10. Este anillo de MT se mantiene mientras que el cigoto se alarga en dirección apical. Después de la terminación del alargamiento del cigoto y migración nuclear a la región apical, el anillo MT desaparece y los metros que forman un huso para separar el ADN. Figura 3B y 2 de Video adicionales muestran que las células embrionarias se dividen coordinadamente para formar una forma globular radialmente simétrico de8. Este método es aplicable para los experimentos farmacológicos. Por ejemplo, después de la aplicación de un inhibidor de la polimerización de actina (latrunculin B; Lat B) en el medio líquido de cultivo los óvulos que contiene el cigoto, se inhibió la migración nuclear polar y así el cigoto dividido de forma más simétrica, indicando el papel del filamento de actina en la polarización del cigoto (3 Video suplementario )10. La proyección de imagen a largo plazo del desarrollo embrionario permite el rastreo de la dirección y fecha de las divisiones de célula individuales, lo que significa que la duración de la geometría y el ciclo celular puede analizarse estadísticamente. De hecho, previamente demostramos que la división de célula del linaje de la célula apical es más rápida que el de la células basales región8.
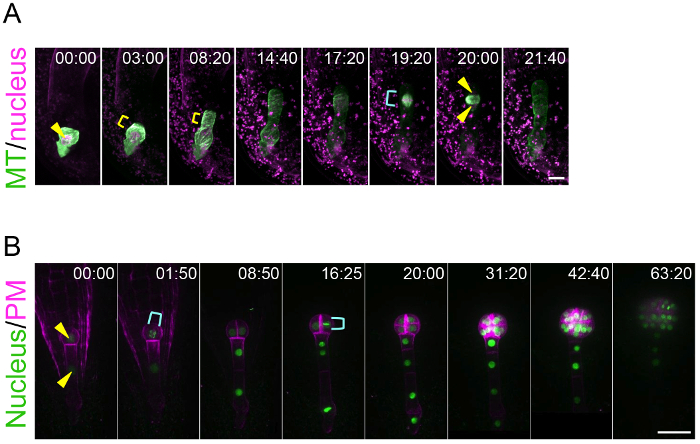
Figura 3: En vivo-proyección de imagen de polarización del cigoto y el embrión patrón.
(A) observación Time-lapse de un cigoto que expresan marcadores específicos para el núcleo (histona 2B-tdTomato; magenta) y los microtúbulos (MTs, trébol TUA6; verde). Las imágenes fueron adquiridas con un microscopio invertido de escaneo láser (A1R MP). (B) observación Time-lapse de un embrión expresan marcadores para el núcleo (histona 2B-sGFP; verde) y la membrana plasmática (PM, tdTomato-LTI6b; magenta). Las imágenes fueron adquiridas con un microscopio invertido confocal de disco giratorio (CSU-W1). Las imágenes se muestran como imágenes de proyección de máxima intensidad, y los números indican el tiempo (h:min) desde el primer fotograma. Puntas de flecha y soportes amarillo muestran el núcleo y el anillo transversal de MT, respectivamente. Soportes de cian indican el huso (A) y dividir el núcleo (B). Barras de escala: 10 μm (A) y 30 (B). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este manuscrito presenta un simple en vitro óvulo cultivo protocolo eficiente para el uso en la proyección de imagen de células vivas de desarrollo de cigotos y embriones.
El diseño del dispositivo PDMS puede necesitar optimización según la etapa de embrión. El primer dispositivo desarrollado era una matriz de microcage para ajustar la orientación y para fijar la posición de los óvulos9, y luego fue construido un dispositivo microcolumnas para atrapar óvulos más eficiente8. Además, las microcolumnas son más delgados y más suave que un microcage y por lo tanto no previenen la expansión del óvulo durante la observación a largo plazo. Este dispositivo microcolumnas puede sostener un óvulo durante varios días, desde la etapa cigóticos hasta el corazón embrionario etapa8. Sin embargo, en última instancia, la altura del óvulo completamente ampliado excede la altura microcolumnas y así empuja el dispositivo lejos. Por lo tanto, la altura y el espaciamiento de las microcolumnas deben ajustarse si los embriones de etapa posterior son el foco.
Porque el óvulo se coloca en la parte inferior del plato, debe utilizarse un microscopio invertido. Un microscopio confocal es suficiente para controlar el patrón de división celular, como se muestra en la figura 3B y 2 Videos adicionales y 38,11, y un microscopio confocal de disco giratorio es importante realizar a largo plazo proyección de imagen sin daño celular. En contraste, una microscopía de excitación de dos fotones, que es conveniente para la proyección de imagen profunda de la vida de organismos12, es necesario visualizar la dinámica intracelular del cigoto (Figura 3A y 1 Video suplementario)10. Por lo tanto, es crucial utilizar el sistema de microscopio adecuado para los experimentos.
Como se describe en la Introducción y el Representante de resultados, no había ningún método existente que puede monitorear la dinámica de la vida del cigoto y el embrión en desarrollo en el óvulo. Por lo tanto, mediante este método de cultivo del óvulo, se han aclarado los detalles de la polarización del cigoto y el embrión patrón por primera vez.
Este método es aplicable para los experimentos farmacológicos como se muestra en Video suplementario 3. Por otra parte, este sistema de proyección de imagen se utilizó para evaluar los efectos de compuestos recientemente sintetizados en la división de célula embrionaria11. Fue había combinado con éxito con la interrupción de láser y así reveló que cuando la célula apical es dañada, los derivados de células basales cambian su destino de la célula para producir una nueva célula apical8. Por lo tanto, mayor aplicación de este método para varios materiales y técnicas proporcionará herramientas poderosas para comprender los mecanismos moleculares de la embriogénesis.
Para realizar la proyección de imagen a largo plazo con este método, el paso crucial es preparar un marcador fluorescente específico y brillante que las etiquetas de los tejidos diana o estructuras. Porque el cigoto y el embrión se observan a través de los óvulos como se muestra en la figura 1, las señales de fondo en el endospermo y otros tejidos del óvulo pueden enmascarar la señal verdadera en el embrión (figura 4). Además, para detectar una señal débil, la energía del laser del microscopio debe aumentarse, pero esto puede dañar el óvulo durante la observación a largo plazo. Suplementario de Video de 4 muestra que la energía láser de alta creciente auto-fluorescencia en el óvulo y reducido finalmente el saco del embrión, en el cual el cigoto fue aplastado. Por lo tanto, debe establecerse una línea específica y brillante el marcador antes de comenzar el experimento. Con respecto a un mayor brillo, tdTomato y el trébol son mejores que el RFP y GFP, respectivamente.

Figura 4: Señal fluorescente de fondo en óvulo máscaras señal embrionaria.
Imagen del óvulo expresan marcadores del núcleo embrionario (histona 2B-tdTomato; magenta) y el núcleo epidérmico (histona 2B-trébol; verde). Todo óvulo y embrión suprimido se muestran en la parte superior y bajan paneles, respectivamente. Las flechas apuntan hacia la posición del embrión. El trébol-2B de las histonas se expresa no sólo en embriones, sino también en el óvulo todo, y así es difícil encontrar la señal embrionaria por óvulo. Barras de escala: 50 μm (A) y 10 (B). Haga clic aquí para ver una versión más grande de esta figura.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Microscopía en este trabajo se llevó a cabo en el Instituto de transformación biomoléculas (WPI-ITbM) de la Universidad de Nagoya y apoyado por la red de la ciencia de planta avanzada de Japón. Este trabajo fue apoyado por subvenciones de la Japón Agencia de ciencia y tecnología (proyecto ERATO T.H. y M.U.) y de la sociedad japonesa para la promoción de la ciencia: subvenciones para la investigación científica en áreas innovadoras (Nos. JP24113514, JP26113710, JP15H05962 y JP15H05955 para el M.U. y enmiendas. JP16H06465, JP16H06464 y JP16K21727 de T.H), subvenciones para jóvenes científicos (B, Nos. JP24770045 y JP26840093 para M.U.) y subvenciones para las investigaciones exploratorias desafiante (no. JP16K14753 para M.U.).
Materiales
| Name | Company | Catalog Number | Comments |
| Nitsch basal salt mixture | Duchefa | N0223 | |
| trehalose dihydrate | Wako Pure Chemical | 206-18455 | |
| MES | Dojindo | 345-01625 | |
| Gamborg’s vitamin solution | Sigma-Aldrich | G1019 | |
| 35-mm glass-bottom dish | Matsunami Glass | D111300 | |
| 35 mm culture dish | Corning | 430588 | |
| PDMS | Dow Corning Co. | Sylgard184 | |
| 76 × 26 mm slide glass | Matsunami Glass | S1225 | |
| 18 × 18 mm slide glass | Matsunami Glass | C018181 | |
| needle (gauge 0.40mm) | Terumo | NN-2719S | |
| Immersion medium Immersol W 2010 | Zeiss | 444969-0000-000 | |
| A1R MP | Nikon | A1RsiMP(1080) Ti-E-TIRF | |
| CSU-W1 | Yokogawa Electric | It is a customized equipment, and thus Catalog Number is not avairable. | |
| CV1000 | Yokogawa Electric | CV1000-SP84 |
Referencias
- Natesh, S., Rau, M. A., Johri, B. M. . Embryology of Angiosperms. , 377-443 (1984).
- Kranz, E., Lorz, H. In vitro fertilisation of maize by single egg and sperm cell protoplast fusion mediated by high calcium and high pH. Zygote. 2 (2), 125-128 (1994).
- Uchiumi, T., Uemura, I., Okamoto, T. Establishment of an in vitro fertilization system in rice (Oryza sativa L.). Planta. 226 (3), 581-589 (2007).
- Sun, M. X., Moscatelli, A., Yang, H. Y., Cresti, M. In vitro double fertilization in Nicotiana tabacum (L.): the role of cell volume in cell fusion. Sex Plant Rep. 13 (4), 225-229 (2001).
- Tian, H. Q., Yuan, T., Russell, S. D. Relationship between double fertilization and the cell cycle in male and female gametes of tobacco. Sex Plant Rep. 17 (5), 243-252 (2004).
- Costa, L. M., et al. Central cell-derived peptides regulate early embryo patterning in flowering plants. Science. 344 (6180), 168-172 (2014).
- Sauer, M., Friml, J. In vitro culture of Arabidopsis embryos within their ovules. Plant J. 40 (5), 835-843 (2004).
- Gooh, K., et al. Live-cell imaging and optical manipulation of Arabidopsis early embryogenesis. Dev Cell. 34 (2), 242-251 (2015).
- Park, J., Kurihara, D., Higashiyama, T., Arata, H. Fabrication of microcage arrays to fix plant ovules for long-term live imaging and observation. Sens Act B-Chem. 191, 178-185 (2014).
- Kimata, Y., et al. Cytoskeleton dynamics control the first asymmetric cell division in Arabidopsis zygote. Proc Natl Acad Sci U S A. 113 (49), 14157-14162 (2016).
- Nambo, M., et al. Combination of Synthetic Chemistry and Live-Cell Imaging Identified a Rapid Cell Division Inhibitor in Tobacco and Arabidopsis thaliana. Plant Cell Physiol. 57 (11), 2255-2268 (2016).
- Mizuta, Y., Kurihara, D., Higashiyama, T. Two-photon imaging with longer wavelength excitation in intact Arabidopsis tissues. Protoplasma. 252 (5), 1231-1240 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados