Method Article
במבחנה ביצית טיפוח עבור Live-תא הדמיה של הזיגוטה קיטוב והמתבנת העובר ב תודרנית לבנה
In This Article
Summary
כתב יד זה מתאר במבחנה ביצית טיפוח שיטה המאפשרת הדמיה לחיות תאים של תודרנית מופרות, העוברים. בשיטה זו הוא מנוצל כדי להמחיש את הדינמיקה תאיים במהלך זיגוטה קיטוב מפרט הגורל תא בפיתוח עוברי.
Abstract
רוב הצמחים פורחים, זיגוטה את ואת העובר מוסתרים עמוק בתוך רקמת אמא, ובכך כבר זמן רב המסתורין של איך הם מפתחים באופן דינאמי; לדוגמה, איך הזיגוטה קוטביות (ניגודים) להקים את ציר הגוף, איך העובר מציין הגורלות תא שונים במהלך היווצרות האיברים. כתב יד זה מתאר במבחנה ביצית תרבות שיטה לבצע הדמיה לחיות תאים של פיתוח מופרות, העוברים של תודרנית לבנה. המדיום טיפוח ממוטבת מאפשר מופרות או עוברי מוקדם כדי לגדול לתוך צמחים פורייה. על ידי שילוב זה עם מכשיר מערך של micropillar poly(dimethylsiloxane) (PDMS), ביצית מתקיים המדיום הנוזלי באותה תנוחה. הקיבעון הזה חיוני להתבונן באותה ביצית תחת מיקרוסקופ במשך מספר ימים ממחלקת zygotic לבמה העובר מאוחר. ההדמיה לחיות תאים וכתוצאה מכך ניתן לנטר את הדינמיקה בזמן אמת של קיטוב זיגוטה, כגון העברה גרעינית ו שחלוף שלד התא, וגם לעיתוי חלוקת התא תא מפרט הגורל במהלך העובר המתבנת. יתר על כן, שיטת הטיפוח הזאת ביצית יכול להיות משולב עם טיפולים מעכב כדי לנתח את השפעת גורמים שונים על התפתחות העובר, ועם מניפולציות אופטי כמו שיבוש לייזר כדי לבחון את תפקידה של תקשורת.
Introduction
התוכנית גוף בסיסי של אורגניזם מתפתח זיגוטה חד־תאיות. ברוב הצמחים פורחים, חטיבת zygotic מחוללת על הפסגה של התאים הבזליים, אשר לפתח לתוך לירות ואת שורש, בהתאמה1. לכן, חשוב להבין איך נוצר בגוף הצמח במהלך מופרה, אך לא היה כלי יעיל כדי לצפות ישירות את הדינמיקה של החיים מופרות, עוברי כי הם מפתחים עמוק בתוך הפרח. מספר מינים monocot, כגון תירס, אורז, שיטת הפריה במבחנה כבר הוקמה2,3. בשיטה זו, מבודד זרע ותאי ביצה הם התמזגו חשמלית או כימית, התא שנוצר יכול להתפתח צמח פורה. עם זאת, בצמחים dicot, יש אין במבחנה שיטת הדישון יכול לייצר עוברי תקין, ככל הנראה מפאת מצב בלתי-מסונכרנות מחזור התא של זכר ונקבה גמטות4,5. בנוסף, הרקמה שמסביב העובר (האנדוספרם) משחק תפקידים חשובים העובר פיתוח6.
במינים dicot מודל, לבנה א, שיטת טיפוח במבחנה פותחה על-ידי התמקדות כל ביצית, אשר מכיל העובר ואת האנדוספרם7. מערכת זו שימשה בהצלחה כדי לנתח את ההשפעות של ריאקטיבים כימיים שונים על מופרה, אבל היא לא מתאימה הדמיה בצילום מואץ כי יש לו סיכויי הישרדות נמוכה. לכן, הרומן במבחנה ביצית טיפוח מערכת פותחה על מנת להתחיל מוקדם ככל השלב זיגוטה ולייצר צמחים פורייה-יחס גבוה8. לאחר ניסויים שונים, זה היה למצוא אותה מדיום Nitsch, טרהלוז לשפר באופן משמעותי את שיעור ההישרדות של ovules8. בנוסף, כי שלייה מתרחב כפי שהוא גדל ולכן לעתים קרובות יוצא מהשדה תצפית במיקרוסקופ, מכשיר PDMS פותחה כדי לתקן את ביצית ב בינוני9. המכשיר PDMS איפשרה ההדמיה לטווח ארוך 3-4 ימים, וזה מספיק כדי לעקוב אחר ההתפתחות זיגוטה העובר בשלב הלב. באמצעות שיטה זו, הוא הופך להיות אפשר לדמיין את הדינמיקה של קיטוב זיגוטה, העובר תכנים, לא רק בתנאים רגילים, אבל גם בנוכחות מעכבי כימי או שונים רקעים מוטציה8,10 ,11.
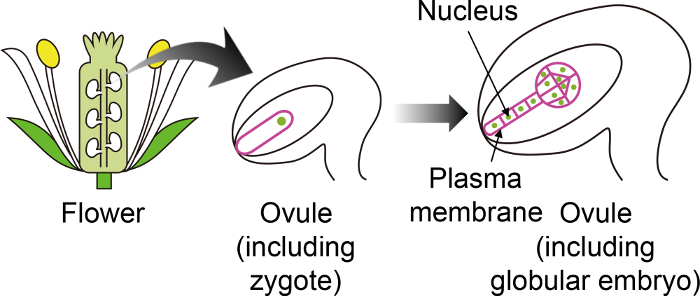
איור 1: תרשים סכמטי של הסמנים פלורסנט ספציפיים המשמשים מופרות באופן חזותי של עוברי דרך ביצית.
הזיגוטה תודרנית מתפתח העובר בתוך ביצית, אשר נוצר בתוך הפרח. ב במבחנה שיטת הטיפוח הזאת, זיגוטה את ואת העובר הם נצפו דרך להפרייה, ולכן חשוב להשתמש מסוים סמנים פלורסנט אינם מבוטאים ברקמות אחרות ביצית. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Protocol
1. הכנה של המדיום תרבות חוץ גופית של ביצית
- הופכים את המדיום הנוזלי לתרבות ביצית הפרייה (" N5T בינוני ") המכילה 1 x Nitsch הבזליים תערובת, 5% (w/v) טרהלוז וגופרית והרכבו 0.05 % (w/v) 2-(N-מורפולינו) ethanesulfonic חומצה (MES)-קו (pH 5.8), ו- 1 x Gamborg ' פתרון ויטמין s.
- להתאים את ה-pH ל 5.8 עם קו-
- לחטא המדיום מאת autoclaving זה (121 מעלות צלזיוס, 20 דקות) או סינון זה דרך מסנן 0.22-מיקרומטר.
הערה: המדיום סטיריליים שניתן לאחסן ב 4 מעלות צלזיוס למשך 2-3 חודשים.
2. הכנת המכשיר מערך Micropillar PDMS
- לחתוך את המכשיר micropillar PDMS על ידי סכין, גילוח או מספריים כדי להתאים לתוך החלק זכוכית (φ 14 מ מ) של צלחת זכוכית-התחתון 35 מ מ.
הערה: הנוהל המלא של הבנייה התקן PDMS מתואר ניירות הקודם 8 , 9, ולכן הפרטים מושמטים כאן. זכוכית-התחתון מנות עם אמצעי אחסון קטן יותר, כגון לוחות 4-ובכן או 96-ובכן, יכול לשמש עבור הדמיה לטווח קצר בלי המכשיר. - Sterilize בחלק העליון של המכשיר PDMS תחת אור UV במשך 15 דקות
- הפעל את ההתקן PDMS ליד באמצעות פינצטה קצה מרובע, תשאיר את זה מתחת UV אור למשך 15 דקות לחטא התחתון.
- להעביר את המכשיר PDMS סטיריליים לתוך תבשיל תרבות 35 מ מ ולהוסיף המדיום N5T עד המכשיר לחלוטין טבולים המדיום (כ 5-7 מ"ל).
- לשים את הצלחת לתוך תא ואקום, ולהפחית את הלחץ דגה. לשמור על שואב אבק עבור h 3 ללון עד האוויר במכשיר מוחלף על-ידי מדיום.
הערה: המכשיר יכול להיות מנותק על ידי בועות אוויר תחת ואקום חזק. - לקחת את המכשיר מתוך קערה על ידי החזקתה עם פינצטה קצה מרובע ושים אותו על מגבת נייר כדי להסיר את בינונית נוספת בצד ולמטה.
הערה: המדיום על המערך micropillar (משטח עליון) אין להסירו כי הוא ישמש לגידול ביצית. - להעביר את המכשיר על גבי זכוכית שקופית 76 מ"מ x 26 מ"מ, המבטיח לשמור את החלק micropillar כמו הצד העליון, ולכסות את ההתקן עם 35 מ מ תרבות מאכל המכסה כדי למנוע המדיום ממנו להתייבש במהלך החילוץ ביצית הבאה.
3. Silique ניתוח והפקת ביצית
- לחטא מחט (0.40 מ מ G) עם פינצטה בסדר על ידי מנגב עם 70% אתנול. המחט מתבצע בקלות על ידי הצמדתו מקל מזרק או עץ.
- לבדוק את התפרחת של הצמח ובחר את siliques המתאים לניסוי. Siliques כ 5 מ מ מכילים מופרות, siliques 8-10 מ מ כולל צעירים העוברים הכדוריים.
- לסלק את siliques באמצעות פינצטה, ומניחים אותם על סרט הדבקה דו-צדדי על כוס שקופית 76 x 26 מ מ. אחד silique מכיל על 40-60 ovules, 3-4 siliques (כלומר, ovules 120-240) מספיקים עבור התקן אחד.
- פתח את silique (קיר השחלה) כדי לראות את ovules בתוך באמצעות מחט סטיריליים פינצטה תחת stereomicroscope. לחתוך רק את הקיר השחלה כך ovules אינן פגומות.
- להעביר את silique נפתח אל המדיום N5T במכשיר PDMS (להכין בשלב 2.7), ולשחרר את ovules לתוך האמצעי עם מחט או פינצטה.
- שמה כוס כיסוי קטן (18 מ מ x 18 מ"מ) על גבי המכשיר PDMS כדי לדחוף את ovules לתוך השטחים במערך micropillar.
- תוריד את הזכוכית המכסה על-ידי משיכתו אופקית באמצעות פינצטה או האצבעות כדי להסיר בינונית נוספת.
- הפוך את ההתקן PDMS למקם אותו לתוך צלחת זכוכית-התחתון 35 מ מ, מעט הקש את המכשיר על ידי דחיפת באמצעות את הפינצטה מרובע עצה בשביל להקל הזכוכית.
- בינוני N5T שופכים בעדינות לתוך הזכוכית-התחתון צלחת על ידי decanting הבקבוק בינונית עד המכשיר PDMS לחלוטין טבולים המדיום, לאטום את המנה עם סרט פרפין.
הערה: המכשיר PDMS ניתן למחזר, אך התקנים ישנים מדי מנותקים בקלות מהחלק התחתון זכוכית. בנוסף, המכשיר יכול לעוף אם זה לא הוא לחלוטין degassed בשלב 2.5 או המדיום הוא שפך מהר מדי.
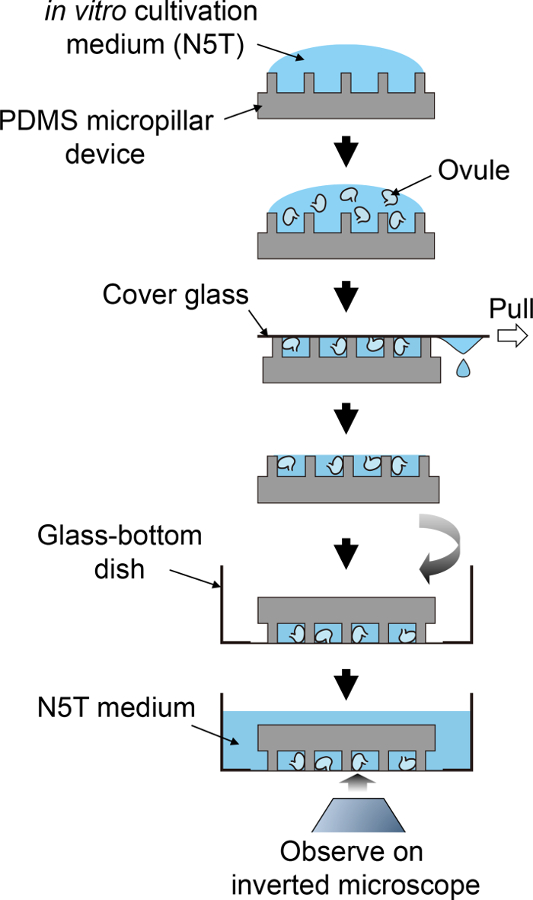
איור 2: סכימטי נוהל הכנת הדוגמא.
לזרימה סכמטית לשלבי 3.5 ל 4.1. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
4. time-lapse הדמיה
- למקם את המנה זכוכית-התחתון זה הוכן בשלב 3.9-מיקרוסקופ הפוכה, ובחר ovules מתאימים כדי להתמקד על.
הערה: כי ovules נבדלים הבמה, מיקום, כיוון, ovules מתאים צריך להימצא על-ידי בדיקת קרינה פלואורסצנטית שלהם סמן. - להתחיל לחיות-ההדמיה על פי היצרן ' s ההוראות של מערכת מיקרוסקופ.
הערה: פרמטרים וציוד מיקרוסקופ הן מגוונות, ובכך המשתמשים צריך לבחור את ההגדרות המתאימות מתאימים לצורך הניסוי. כדוגמה, ההגדרות המשמשות כתב יד זה מפורטים בטבלה 1-
| ציוד/הגדרת | איור 3 (א) ומשלימה קטעי וידאו 1 ו- 4 | איור 3 (ב) ו- 2 הסרטונים משלימה | משלימה 3 הסרטונים |
| סריקה בלייזר הפוכה מיקרוסקופ (A1R MP) | מיקרוסקופ | ספינינג-דיסק קונאפוקלית מיקרוסקופ הפוכה (CSU-W1) | תיבת סוג הפוכה מיקרוסקופ קונפוקלי המערכת עם תא הדגירה יציב (CV1000) |
| לייזר | לייזר הפמטו-שנייה Ti:sapphire | לייזרים LD 488 ננומטר, 561-ננומטר | לייזר LD 488 ננומטר, 561-nm |
| O עדשה bjective | 40 X עדשה המטרה טבילה במי (נה = 1.15) טבילה בינונית | 60 X עדשה המטרה של טבילה שמן סיליקון (NA = 1.30), רכוב על כונן המוקד Piezo | 40 X עדשה המטרה (NA = 0.95) |
| זיהוי או | חיצוניים שאינם descanned PMT חאספ גלאי | EMCCD מצלמה | מצלמה EMCCD |
| Dichroic מראה | DM495, DM560 | DM488/561 | DM400-410/488/561 |
| מסנן | הלהקה לעבור מסננים; 520/35 ננומטר, 593/46 ננומטר | הלהקה לעבור מסננים; 520/50 ננומטר, 617/73 nm | |
| פרוסה לאורך ציר z | z-במחסן 31 עם מרווחי 1-מיקרומטר | z-במחסן 17 עם 3-מיקרומטר אינטר vals | z-במחסן 7 עם 5-מיקרומטר מרווחי |
| מרווח הזמן | 20 דקות | 5 דקות | 10 דקות |
טבלה 1: מיקרוסקופים ומערכות ההגדרות המשמשות בכתב היד.
מיקרוסקופים והפרמטרים הן מגוונות, וכך כל משתמש צריך לבחור את המערכת המתאימים לניסוי.
- לבדוק את רצף תמונות נרכשות, ולהמיר אותו לתבנית סרט כלליות, כגון .avi או .mov למצגת.
הערה: אם התוכנה המיקרוסקופ לא פלט את התמונות כתבנית סרט, זה אפשרי לשמור את התמונות. tif ולאחר מכן לפתוח אותם ב- ImageJ, תוכנית קוד פתוח בהשראת התמונה NIH, כדי לשנות את סוג הקובץ. ImageJ הינה מסופקת במלון: https://imagej.nih.gov/ij/. ImageJ יכול לשמש גם כדי להפוך Z-sטאק הסרט, כגון התחזית בעוצמה מקסימלית, כפי שמתואר ב: https://imagej.net/Z-functions.
תוצאות
באמצעות שיטת הטיפוח הזאת ביצית, שיטה זו יכולים לעקוב אחר הדינמיקה החיים של קיטוב זיגוטה, העובר המתבנת. זה הישג כי בעבר היה שום טכניקה כדי להמחיש את אופן הפעולה בזמן אמת של הזיגוטה ואת העובר, אשר מוסתרים עמוק בתוך רקמת אמא. איור 3A ו- 1 וידאו משלימה להראות microtubules (MTs) ב- הזיגוטה הצעיר לצבור כמו טבעת רוחבי ב אזור subapical10. טבעת זו MT נשמר בזמן הזיגוטה מאריך לכיוון הפסגה. לאחר השלמת זיגוטה התארכות והעברה גרעיני באזור הפסגה, הטבעת MT נעלם והיא MTs טופס זה פלך כדי להפריד את ה-DNA. איור 3B ו- 2 הסרטונים משלימה מראים כי תאים עובריים coordinately לחלק כדי ליצור צורה מין radially סימטריות8. שיטה זו ישימה לניסויים תרופתי. לדוגמה, לאחר היישום של מעכב פלמור אקטין (latrunculin B; Lat B) לתוך המדיום הנוזלי culturing את ovules המכילים זיגוטה, ההעברה גרעיני קוטב היה עכבות, ובכך הזיגוטה מחולק באופן סימטרי יותר, המציין את התפקיד של אקטין הלהט ב קיטוב זיגוטה (3 הסרטונים משלימה )10. הדמיה לטווח ארוך של התפתחות העובר מאפשר העקיבה של הכיוון ושל תזמון של חלוקות תאים בודדים, כלומר משך הזמן גאומטריה ו מחזור התא ניתן לנתח מבחינה סטטיסטית. אכן, הראנו קודם לכן כי חלוקת התא השושלת תא הפסגה הוא מהיר יותר מזה של אזור8התאים הבזליים.
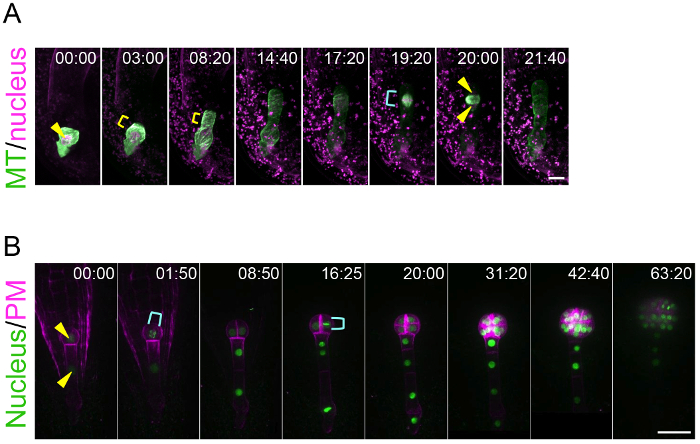
איור 3: חיים-הדמיה של קיטוב זיגוטה, העובר המתבנת.
(א) זמן לשגות התבוננות זיגוטה ביטוי מסוים סמנים עבור גרעין (היסטון 2B-tdTomato; מגנטה) ו- microtubules (MTs, תלתן-TUA6; ירוק). התמונות נרכשו באמצעות מיקרוסקופ הפוכה סריקה בלייזר (A1R MP). (B) התבוננות בצילום מואץ של העובר לבטא סמנים עבור גרעין (היסטון 2B-sGFP; ירוק) של קרום פלזמה (בצהריים, tdTomato-LTI6b; מגנטה). התמונות נרכשו באמצעות דיסק מסתובב הפוך מיקרוסקופ קונפוקלי (CSU-W1). התמונות הוצגו כתמונות הטלה בעוצמה מקסימלית, המספרים מציינים את הזמן (h:min) מן המסגרת הראשונה. ראשי חץ וסוגריים מרובעים צהוב עולה לגרעין, הטבעת MT רוחבי, בהתאמה. ציאן המרובעים מציינים את פלך (A) החלוקה גרעין (B). גודל ברים: 10 מיקרומטר (A) ו- 30 מיקרומטר (B). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
כתב יד זה מציג פשוט במבחנה ביצית טיפוח פרוטוקול זה יעיל לשימוש ההדמיה לחיות תאים של פיתוח מופרות עוברי.
העיצוב של המכשיר PDMS עשוי להזדקק אופטימיזציה לפי השלב העובר. המכשיר המפותח הראשון היה מערך microcage כדי להתאים את הכיוון וכדי לתקן את המיקום של ovules9ולאחר מכן התקן micropillar נבנה כדי ללכוד את ovules בצורה יעילה יותר8. יתר על כן, micropillars דק יותר, רך יותר microcage, ולכן אינם מונעים הרחבה ביצית במהלך התצפית לטווח ארוך. התקן micropillar זה יכול להחזיק ביצית של מספר ימים, החל משלב zygotic עד שלב8הלב העוברי. בסופו של דבר, עם זאת, הגובה של ביצית מורחבת במלואה עולה על גובה micropillar, ובכך הוא דוחף את המכשיר משם. לכן, הגובה ואת הריווח של micropillars צריך להיות מותאם אם העוברים בשלב מאוחר יותר הם המוקד.
כי שלייה ממוקמת בחלק התחתון של המנה, יש להשתמש במיקרוסקופ הפוכה. מיקרוסקופ קונפוקלי מספיקה לעקוב אחר התבנית חלוקת התא, כפי שמוצג באיור 3B , משלימה סרטונים 2 ו- 38,11, ועל מיקרוסקופ קונפוקלי ספינינג-דיסק חשוב לבצע לטווח ארוך הדמיה ללא נזק לתאים. לעומת זאת, מיקרוסקופ שני הפוטונים עירור, אשר מתאים הדמיה העמוק של חיים אורגניזמים12, יש צורך לדמיין את הדינמיקה תאיים של הזיגוטה (איור 3 א ומשלימה Video 1)10. לכן, חשוב להשתמש במערכת מיקרוסקופים מתאימים עבור הניסויים.
כפי שמתואר את המבוא ואת התוצאות נציג, היו שיטות קיימות לא יכול לפקח את הדינמיקה החיים של הזיגוטה, העובר המתפתח להפרייה. לכן, באמצעות שיטת הטיפוח הזאת ביצית, הפרטים של קיטוב זיגוטה, העובר המתבנת יש הובהרו בפעם הראשונה.
שיטה זו ישימה לניסויים תרופתי כמוצג 3 הסרטונים משלימה. יתר על כן, מערכת הדמיה זו נעשה שימוש כדי להעריך את ההשפעות של תרכובות לאחרונה מסונתז על חלוקת תאים עובריים11. זה היה גם בהצלחה בשילוב עם הפרעה לייזר, והוא לפיכך, נחשף כאשר התא הפסגה ייפגע, נגזרות התאים הבזליים לשנות גורלם תא לייצר תא הפסגה8חדשים. לכן, נוסף יישום של שיטה זו על חומרים שונים וטכניקות יספק כלים רבי-עוצמה כדי להבין את המנגנונים המולקולריים של מופרה.
כדי לבצע הדמיה לטווח ארוך באמצעות שיטה זו, צעד קריטי הוא להכין ספציפי ומוארים סמן פלורסנט שמתייג את היעד ברקמות ו/או מבנים. כי הזיגוטה ואת העובר נמצא ב"צורה דרך להפרייה כמוצג באיור1 רקע אותות ב האנדוספרם, רקמות אחרות ביצית מטשטשים את האות האמיתית של העובר (איור 4). בנוסף, כדי לזהות אות חלש, עוצמת הלייזר של המיקרוסקופ צריך להיות מוגברת, אבל זה יכול לפגוע ביצית במהלך התצפית לטווח ארוך. משלימה 4 וידאו מראה עוצמת הלייזר גבוהה גדל אוטומטית-זריחה בביצית, סוף סוף לכווץ את שק העובר, שבה נמחצה על הזיגוטה. לכן, יש להקים קו מסוים ומוארים סמן לפני תחילת הניסוי. ביחס בהירות גבוהה יותר, tdTomato, תלתן עדיפים RFP ו- GFP, בהתאמה.

איור 4: האות פלורסנט רקע ביצית מסכות אותות עובריים.
תמונה של ביצית לבטא את הסמנים של גרעין עובריים (היסטון 2B-tdTomato; מגנטה) לגרעין עוריות (היסטון 2B-תלתן; ירוק). כל ביצית העובר נכרת מוצגות באיור העליון, להוריד לוחות, בהתאמה. חצים הצבע על התנוחה של העובר. היסטון 2B-התלתן מתבטא לא רק העובר, אלא גם של כל ביצית, לכן קשה למצוא את האות עובריים באמצעות ביצית. גודל ברים: 50 מיקרומטר (A) ו- 10 מיקרומטר (B). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Disclosures
המחברים אין לחשוף.
Acknowledgements
מיקרוסקופ בעבודה זו נערך ב מכון של טרנספורמטיבי ביו-מולקולות (WPI-ITbM) של אוניברסיטת נאגויה ו נתמכת על ידי יפן מתקדמת צמח המדע רשת. עבודה זו נתמך על ידי מענקים של יפן ומדעי הטכנולוגיה סוכנות (ERATO פרוייקט תוצרת הארץ, M.U.) ומן החברה יפן הקידום של המדע: מענק הסיוע למחקר מדעי בתחומים חדשניים (Nos. JP24113514, JP26113710, JP15H05962 ו JP15H05955 M.U., Nos. JP16H06465, JP16H06464 ו JP16K21727 עבור T.H), מענק הסיוע מדענים ומפתחים צעירים (B, Nos. JP24770045 ו JP26840093 עבור M.U.), ואת מענק של הסיוע למחקר גישוש מאתגר (מס ' JP16K14753 על M.U.).
Materials
| Name | Company | Catalog Number | Comments |
| Nitsch basal salt mixture | Duchefa | N0223 | |
| trehalose dihydrate | Wako Pure Chemical | 206-18455 | |
| MES | Dojindo | 345-01625 | |
| Gamborg’s vitamin solution | Sigma-Aldrich | G1019 | |
| 35-mm glass-bottom dish | Matsunami Glass | D111300 | |
| 35 mm culture dish | Corning | 430588 | |
| PDMS | Dow Corning Co. | Sylgard184 | |
| 76 × 26 mm slide glass | Matsunami Glass | S1225 | |
| 18 × 18 mm slide glass | Matsunami Glass | C018181 | |
| needle (gauge 0.40mm) | Terumo | NN-2719S | |
| Immersion medium Immersol W 2010 | Zeiss | 444969-0000-000 | |
| A1R MP | Nikon | A1RsiMP(1080) Ti-E-TIRF | |
| CSU-W1 | Yokogawa Electric | It is a customized equipment, and thus Catalog Number is not avairable. | |
| CV1000 | Yokogawa Electric | CV1000-SP84 |
References
- Natesh, S., Rau, M. A., Johri, B. M. . Embryology of Angiosperms. , 377-443 (1984).
- Kranz, E., Lorz, H. In vitro fertilisation of maize by single egg and sperm cell protoplast fusion mediated by high calcium and high pH. Zygote. 2 (2), 125-128 (1994).
- Uchiumi, T., Uemura, I., Okamoto, T. Establishment of an in vitro fertilization system in rice (Oryza sativa L.). Planta. 226 (3), 581-589 (2007).
- Sun, M. X., Moscatelli, A., Yang, H. Y., Cresti, M. In vitro double fertilization in Nicotiana tabacum (L.): the role of cell volume in cell fusion. Sex Plant Rep. 13 (4), 225-229 (2001).
- Tian, H. Q., Yuan, T., Russell, S. D. Relationship between double fertilization and the cell cycle in male and female gametes of tobacco. Sex Plant Rep. 17 (5), 243-252 (2004).
- Costa, L. M., et al. Central cell-derived peptides regulate early embryo patterning in flowering plants. Science. 344 (6180), 168-172 (2014).
- Sauer, M., Friml, J. In vitro culture of Arabidopsis embryos within their ovules. Plant J. 40 (5), 835-843 (2004).
- Gooh, K., et al. Live-cell imaging and optical manipulation of Arabidopsis early embryogenesis. Dev Cell. 34 (2), 242-251 (2015).
- Park, J., Kurihara, D., Higashiyama, T., Arata, H. Fabrication of microcage arrays to fix plant ovules for long-term live imaging and observation. Sens Act B-Chem. 191, 178-185 (2014).
- Kimata, Y., et al. Cytoskeleton dynamics control the first asymmetric cell division in Arabidopsis zygote. Proc Natl Acad Sci U S A. 113 (49), 14157-14162 (2016).
- Nambo, M., et al. Combination of Synthetic Chemistry and Live-Cell Imaging Identified a Rapid Cell Division Inhibitor in Tobacco and Arabidopsis thaliana. Plant Cell Physiol. 57 (11), 2255-2268 (2016).
- Mizuta, Y., Kurihara, D., Higashiyama, T. Two-photon imaging with longer wavelength excitation in intact Arabidopsis tissues. Protoplasma. 252 (5), 1231-1240 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved