Method Article
في المختبر زراعة ovule للتصوير خلايا حية من الاستقطاب الزيجوت والزخرفة الجنين في التمويل نبات
In This Article
Summary
ويصف هذه المخطوطة في المختبر ovule زراعة أسلوب يتيح تصوير خلية يعيش نبات زيجوتيس والأجنة. ويستخدم هذا الأسلوب لتصور ديناميات داخل الخلايا أثناء الاستقطاب الزيجوت وتحديد مصير الخلية في وضع الأجنة.
Abstract
في معظم النباتات المزهرة، الزيجوت والجنين مخفية في أعماق نسيج الأم، وهكذا منذ فترة طويلة كان لغزا لكيف تتطور بشكل حيوي؛ على سبيل المثال، كيف اقحه نمطين لإنشاء محور الجسم وكيف يحدد الجنين مصائر خلية مختلفة أثناء تكوين الجهاز. ويصف هذه المخطوطة في المختبر ovule ثقافة أسلوب القيام بتصوير خلية يعيش وضع zygotes والأجنة من نبات التمويل. المتوسط زراعة محسنة يسمح zygotes أو الأجنة في وقت مبكر أن تنمو لتصبح نباتات خصبة. عن طريق الجمع بين ذلك مع جهاز صفيف ميكروبيلار poly(dimethylsiloxane) (PDMS)، يعقد في ovule في المتوسطة السائل في نفس الموضع. هذا التثبيت أمر حاسم لمراقبة ovule نفسه تحت مجهر لعدة أيام من شعبة زيجوتيك إلى أواخر مرحلة الجنين. يمكن استخدام التصوير تعيش الخلية الناتجة لرصد ديناميات الاستقطاب الزيجوت، مثل الهجرة النووية وإعادة ترتيب سيتوسكيليتون، وأيضا توقيت انقسام الخلايا ومواصفات مصير الخلية أثناء الزخرفة الجنين في الوقت الحقيقي. وعلاوة على ذلك، يمكن دمج هذا النظام زراعة ovule مع العلاجات مثبط لتحليل آثار العوامل المختلفة على وضع الجنين والتلاعبات البصرية مثل انقطاع الليزر لدراسة دور خلية خلية الاتصال.
Introduction
خطة الهيئة الأساسية للكائن الحي يتطور من اقحه أحادي الخلية. في معظم النباتات المزهرة، يولد شعبة زيجوتيك قمي وخلية القاعدية، التي تتطور إلى تبادل لإطلاق النار والجذر، على التوالي1. ولذلك، من المهم أن نفهم كيف يتم تشكيل هيئة النبات أثناء امبريوجينيسيس، ولكن لم يكن هناك أداة فعالة لمراقبة ديناميات zygotes الحية والأجنة مباشرة نظراً لتطورها في أعماق الزهرة. في العديد من أنواع مونوكوت، مثل الذرة والأرز، وأسلوب إخصاب في الأنابيب قد المنشأة2،3. في هذا الأسلوب، عزل الحيوانات المنوية والخلايا البيض تنصهر فيها كهربائياً أو كيميائيا، والخلية التي تم إنشاؤها يمكن أن تتطور إلى مصنع خصبة. ومع ذلك، في مصانع ديكت، يوجد أي في المختبر التسميد أسلوب التي يمكن إنتاج أجنة سليمة، يفترض أنه بسبب حالة عدم مزامنة دورة الخلية الأمشاج الذكور والإناث4،5. وبالإضافة إلى ذلك، يلعب الأنسجة المحيطة بالجنين (السويداء) أدواراً هامة في تنمية الجنين6.
في أنواع ديكت نموذجي، ألف-التمويل، وضعت طريقة زراعة في المختبر بالتركيز على أبل كله، الذي يتضمن كلا من الجنين والسويداء7. استخدمت هذا النظام بنجاح تحليل آثار مختلف الكواشف الكيميائية على امبريوجينيسيس، ولكن أنها ليست مناسبة للوقت الفاصل بين التصوير لأنه يحتوي على معدل منخفض البقاء على قيد الحياة. ولذلك، تم وضع نظام زراعة ovule رواية في المختبر بغية البدء في أقرب وقت مرحلة الزيجوت، وإنتاج النباتات الخصبة في ارتفاع نسبة8. بعد محاكمات مختلفة، أنه تم العثور على تلك الوسيلة نيتش وتريهالوسي تحسن كبير في معدل البقاء على قيد الحياة من البويضات8. وبالإضافة إلى ذلك، لأنه توسع ovule كما أنها تنمو وهكذا كثيرا ما يتحرك بعيداً عن ميدان المراقبة المجهر، وضعت جهاز PDMS لإصلاح في أبل في المتوسط9. تمكين الجهاز PDMS تصوير طويلة الأجل لمدة 3-4 أيام، وكافية لتتبع التنمية من الزيجوت إلى جنينا قلب-مرحلة. باستخدام هذه الطريقة، يصبح من الممكن تصور ديناميات الاستقطاب الزيجوت والجنين الزخرفة، ليس فقط في ظل الظروف العادية، ولكن أيضا حضور مثبطات الكيميائية أو في مختلف الخلفيات متحولة8،10 ،11.
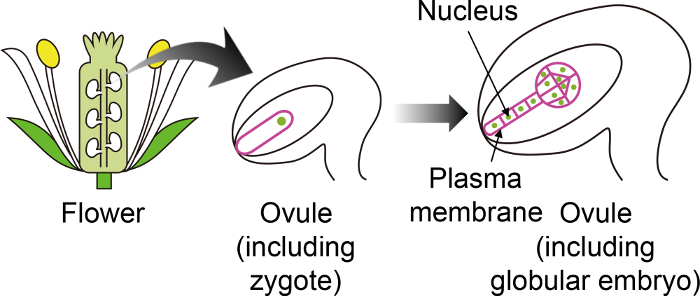
الشكل 1: رسم تخطيطي "علامات نيون المحددة" المستخدمة لتصور زيجوتيس والأجنة من خلال أوفولي.
اقحه نبات تتطور إلى جنين في أبل، التي يتم إنشاؤها داخل الزهرة. في هذا المختبر في زراعة النظام، لوحظت الزيجوت والجنين من خلال أبل، وبالتالي من المهم أن تستخدم علامات نيون المحددة التي لم يتم التعبير عن الأنسجة ovule الأخرى. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Protocol
1. إعداد من "مستنبت Ovule في المختبر"
- جعل الوسط السائل لثقافة أوفولي في المختبر (" المتوسطة N5T ") الذي يحتوي على 1 x Nitsch القاعدية الملح المخلوط، 5% (w/v) تريهالوسي ثنائي هيدرات، 0.05 % (w/v) 2-(ن-morpholino) حمض اثانيسولفونيك (مس)-كوه (5.8 درجة الحموضة)، و 1 x Gamborg ' حل فيتامين s-
- ضبط درجة الحموضة إلى 5.8 مع كوه.
- تعقيم المتوسطة بالتعقيم (121 درجة مئوية، 20 دقيقة)، أو التصفية فإنه من خلال عامل تصفية 0.22 ميكرومتر.
ملاحظة: يمكن تخزين متوسطة معقمة عند 4 درجة مئوية لمدة 2-3 أشهر.
2. إعداد الجهاز الصفيف ميكروبيلار PDMS
- قطع الجهاز ميكروبيلار PDMS سكين أو شفرة حلاقة أو مقص لتناسب الجزء الزجاج (14 مم φ) صحن أسفل الزجاج 35 مم-
ملاحظة: يرد وصف للإجراءات الكاملة لبناء جهاز PDMS في الورقات السابقة 8 ، 9، وهكذا يتم حذف التفاصيل هنا. أطباق الزجاج السفلي مع أحجام أصغر، مثل لوحات 4-جيدا أو 96-جيدا، يمكن أن تستخدم لتصوير قصيرة الأجل دون الجهاز. - تعقيم الجانب العلوي من الجهاز PDMS تحت ضوء الأشعة فوق البنفسجية على 15 دقيقة
- تشغيل الجهاز PDMS استولت عليها استخدام الملقط نصيحة مربعة، وإبقائه تحت الأشعة فوق البنفسجية الخفيفة لمدة 15 دقيقة لتعقيم الأسفل.
- نقل الجهاز PDMS معقمة في طبق ثقافة 35 ملم وإضافة المتوسطة N5T حتى الجهاز هو تماما غارقة في الأجل المتوسط (حوالي 5-7 مل)-
- وضع الطبق في فراغ غرفة، والحد من الضغط ديغا. تبقى كنس ل 3 (ح) بين عشية وضحاها حتى يتم استبدال الهواء في الجهاز بواسطة.
ملاحظة: يمكن فصل الجهاز بفقاعات الهواء تحت فراغ قوية. - تأخذ الجهاز من الطبق خلال عقد مع ملاقط نصيحة مربعة ووضعها على منشفة ورقية لإزالة وسيلة إضافية على الجانب السفلي-
ملاحظة: لا يجب إزالة المتوسطة في الصفيف ميكروبيلار (السطح العلوي) لأن هذا سوف تستخدم لزراعة أبل. - نقل الجهاز على زجاج شريحة 76 ملم × 26 مم، وضمان للحفاظ على جزء ميكروبيلار كالجانب العلوي، ويشمل الجهاز مع غطاء صحن الثقافة 35 ملم للحيلولة دون المتوسط من الجفاف أثناء استخراج ovule التالية.
3. تشريح خردلة واستخراج أوفولي
- تعقيم إبرة (0.40 مم ز) وملاقط غرامة بالمسح مع الإيثانول 70%. الإبرة هو التعامل معها بسهولة عن طريق إرفاق ذلك بعصا المحاقن أو الخشب.
- التحقق من نورات المصنع، وحدد سيليكويس السليم للتجربة. سيليكويس مم تقريبا 5 يتضمن zygotes، وسيليكويس 8-10 مم وتشمل الأجنة كروي الشباب-
- المكوس سيليكويس باستخدام الملقط، ووضعها على وجهي الشريط على زجاج شريحة 76 × 26 مم. يتضمن خردلة واحدة حول البويضات 40-60، و 3-4 سيليكويس (أي، البويضات 120-240) غير كافية لجهاز واحد.
- فتح خردلة (جدار المبيض) لرؤية البويضات داخل باستخدام إبرة معقمة وملاقط تحت ستيريوميكروسكوبي. قص الجدار المبيض فقط حتى أن لم تكن معطوبة البويضات.
- نقل خردلة تم فتحها في المتوسط N5T على الجهاز PDMS (أعد الخطوة 2.7)، وإطلاق سراح البويضات في المتوسط بإبرة أو بالملقط.
- وضع كوب غطاء صغيرة (18 ملم × 18 ملم) على الجهاز PDMS لدفع البويضات في المساحات في الصفيف ميكروبيلار.
- تقلع زجاج الغطاء عن طريق سحب أفقياً باستخدام الملقط أو الأصابع لإزالة متوسطة إضافية.
- اقلب الجهاز PDMS ووضعه في طبق زجاج-أسفل 35 ملم واضغط قليلاً الجهاز عن طريق دفع استخدام الملقط مربع تلميح إلى التمسك بها للزجاج-
- المتوسطة من أجل N5T برفق في الزجاج-الأسفل طبق بالصب زجاجة متوسطة حتى الجهاز PDMS هو تماما غارقة في الأجل المتوسط، وختم الطبق مع الفيلم البارافين.
ملاحظة: يمكن أن يكون الجهاز PDMS المعاد تدويره، ولكن يتم فصل الأجهزة التي قديمة جداً بسهولة من أسفل الزجاج. بالإضافة إلى ذلك، قد تطفو الجهاز إذا لم يطرد تماما في الخطوة 2، 5 أو المتوسطة يسكب بسرعة كبيرة جداً-
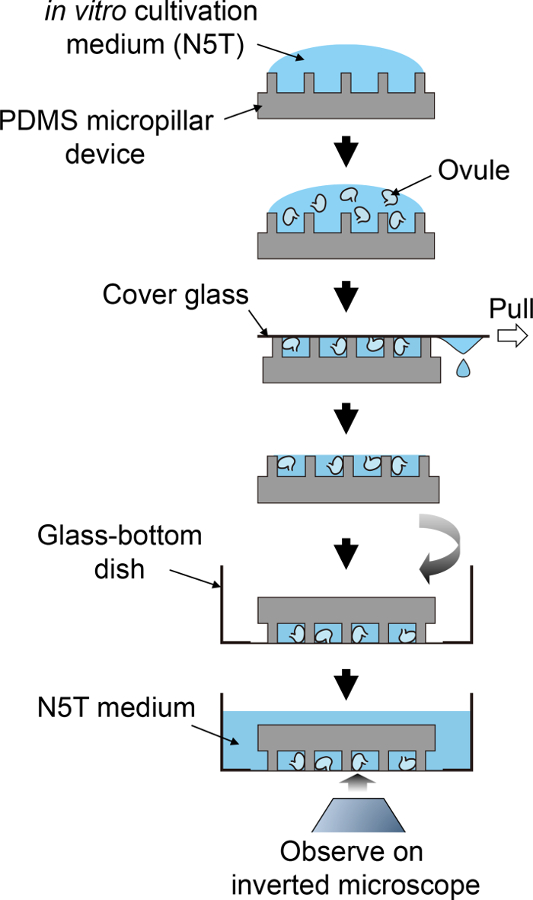
رقم 2: الإجراء التخطيطي لإعداد نموذج.
ويناظر هذا التدفق التخطيطي الخطوات 3.5 إلى 4.1. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
4-"الوقت الفاصل بين التصوير"
- مكان الطبق أسفل الزجاج الذي تم إعداده في الخطوة 3، 9 على مجهر مقلوب، وحدد البويضات المناسبة للتركيز على-
ملاحظة: نظراً لاختلاف البويضات في مرحلة والموقف والاتجاه، ينبغي إيجاد البويضات مناسب عن طريق فحص هذه الأسفار ماركر. - بدء تصوير العيش وفقا للشركة المصنعة ' s تعليمات نظام المجهر.
ملاحظة: المعدات مجهر والمعلمات متنوعة، وهكذا ينبغي أن المستخدمين اختيار الإعدادات المناسبة التي تلائم الغرض التجربة. على سبيل مثال، يتم سرد الإعدادات المستخدمة في هذه المخطوطة في الجدول 1-
| معدات/إعداد | الشكل 3 (أ) وتكميلية كليب 1 و 4 | الشكل 3 (ب) والتكميلي فيديو 2 | تكميلية الفيديو 3 |
| مجهر | مسح ليزر مقلوب المجهر (A1R MP) | القرص الغزل المجهر المقلوب [كنفوكل] (الاتحاد الاجتماعي المسيحي-W1) | نوع مربع مقلوب نظام المجهر [كنفوكل] مع غرفة حضانة ثابتة (CV1000) |
| ليزر | Ti:sapphire femtosecond نبض الليزر | الليزر LD 488-شمال البحر الأبيض المتوسط، وشمال البحر الأبيض المتوسط-561 | الليزر LD 488-شمال البحر الأبيض المتوسط، وشمال البحر الأبيض المتوسط-561 |
| س عدسة المرحلية | 40 × عدسة الهدف غمر المياه (NA = 1.15) مع الغمر المتوسطة | 60 × سيليكون النفط غمر عدسة الهدف (نا = 1.30)، شنت على محرك تركيز بيزو | عدسة الهدف X 40 (NA = 0.95) |
| كشف أو | الخارجية PMT جاسب غير ديسكانيد للكشف عن | الكاميرا امككد | كاميرا امككد |
| مرآة ديتشرويك | DM495 و DM560 | DM488/561 | DM400-410/488/561 |
| تصفية | مرشحات تمرير الفرقة؛ 520/35 نانومتر، و 593/46 نانومتر | مرشحات تمرير الفرقة؛ 520/50 نانومتر و 617/73 نانومتر | |
| الشريحة على طول محور ع | z 31-مداخن مع فواصل 1 ميكرومتر | مكدسات z 17 مع 3 ميكرومتر في جملة فاليه | مكدسات ض 7 مع فترات 5-ميكرومتر |
| الفاصل الزمني | دقيقة 20 | دقيقة 5 | دقيقة 10 |
الجدول 1: نظم مجهر والإعدادات المستخدمة في هذه المخطوطة.
المجاهر والمعلمات المتنوعة، وهكذا ينبغي أن يختار كل مستخدم نظام مناسب للتجربة-
- التحقق من تسلسل الصورة المكتسبة، وتحويله إلى تنسيق الفيلم عامة، مثل.avi أو موف للعرض التقديمي.
ملاحظة: إذا كان لا يمكن إخراج البرنامج مجهر الصور كتنسيق فيلم، من الممكن لحفظ الصور ك.tif ثم فتح لهم في إيماجيج، أحد برامج مصدر مفتوح مستوحاة من صورة المعاهد الوطنية للصحة، تغيير نوع الملف. إيماجيج يرد على: https://imagej.nih.gov/ij/. يمكن أيضا استخدام إيماجيج لجعل Z-sالثنية الفيلم، مثل إسقاط أقصى حدة، كما هو موضح في: https://imagej.net/Z-functions-
النتائج
باستخدام هذا النظام زراعة ovule، يمكن تتبع هذا الأسلوب المعيشة ديناميات الاستقطاب الزيجوت والزخرفة الجنين. وهذا يعد إنجازا لأنه كانت هناك لا تقنية لتصور في الوقت الحقيقي سلوك الزيجوت والأجنة، التي كانت مخبأة في عمق النسيج الأم. الشكل 3 ألف و التكميلي فيديو 1 تبين أن تتراكم microtubules (MTs) في اقحه الشباب كحلقة عرضية في منطقة سوبابيكال10. ويحتفظ هذا الخاتم مليون طن بينما اقحه الغضروفي في اتجاه قمي. بعد الانتهاء من استطالة الزيجوت والهجرة النووية إلى منطقة قمي، يختفي الحلبة طن متري والنظام التجاري المتعدد الأطراف تشكل مغزل لفصل الحمض النووي. الشكل 3B و 2 الفيديو تكميلية تبين أن انقسام الخلايا الجنينية كورديناتيلي لتشكيل شكل كروي متناظرة شعاعيا8. ينطبق هذا الأسلوب للتجارب الدوائية. على سبيل المثال، بعد تطبيق مثبطات بلمرة الأكتين (لاترونكولين ب؛ اللات ب) في المتوسط السائل استزراع البويضات المحتوية على الزيجوت، كان يحول دون هجرة النووية القطبية، وهكذا اقحه مقسمة على نحو متماثل أكثر، مما يشير إلى دور خيوط الأكتين على استقطاب الزيجوت (تكميلية الفيديو 3 )10. التصوير الطويلة الأجل للتنمية الجنين يمكن اقتفاء أثر الاتجاه وتوقيت انقسامات الخلية الفردية، مما يعني أن مدة دورة الخلية والهندسة يمكن تحليلها إحصائيا. وفي الواقع، أظهرنا سابقا أن انقسام الخلية من سلالة خلية قمي أسرع من منطقة الخلايا القاعدية8.
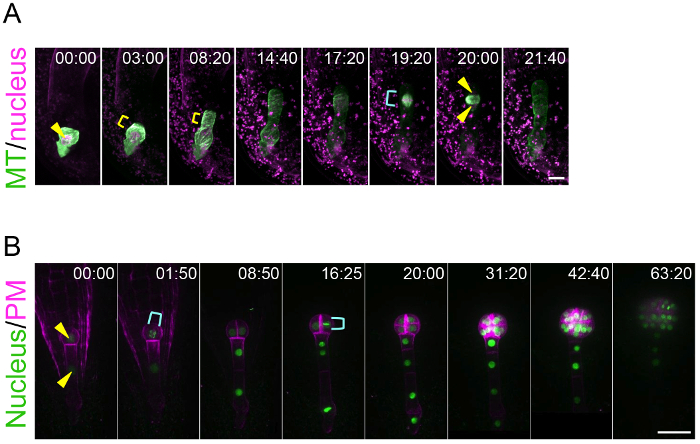
الشكل 3: العيش-التصوير بالاستقطاب الزيجوت والزخرفة الجنين.
(أ) مراقبة الوقت الفاصل بين الزيجوت الإعراب عن علامات محددة لنواة (هيستون 2B-تدتوماتو؛ أرجواني) وميكروتوبوليس (النظام التجاري المتعدد الأطراف، TUA6 البرسيم؛ الأخضر). الصور تم الحصول عليها باستخدام مجهر مقلوب المسح الضوئي الليزر (A1R MP). (ب) مراقبة الوقت الفاصل بين الجنين معربا عن علامات لنواة (هيستون 2B-سجفب؛ الأخضر) وغشاء البلازما (بعد الظهر، تدتوماتو-LTI6b؛ والأرجواني). الصور تم الحصول عليها باستخدام مجهر مقلوب [كنفوكل] الغزل-القرص (CSU-W1). وعرضت الصور كصور كحد أقصى-كثافة الإسقاط، والأرقام تشير إلى الوقت (h:min) من الإطار الأول. رؤوس الأسهم والأقواس الصفراء تظهر النواة والحلبة MT عرضية، على التوالي. تشير الأقواس السماوي إلى المغزل (A) ونواة الفاصل (ب). تغيير حجم أشرطة: 10 ميكرون (A) و 30 ميكرومتر (ب). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
ويدخل هذه المخطوطة بسيطة في المختبر ovule زراعة بروتوكول فعال للاستخدام في تصوير خلية يعيش وضع zygotes والأجنة.
قد تحتاج إلى تصميم الجهاز PDMS الأمثل وفقا لمرحلة الجنين. كان الجهاز المتقدمة أول مجموعة ميكروكاجي لضبط الاتجاه وتحديد الموقف من البويضات9، وثم تم بناء جهاز ميكروبيلار فخ البويضات أكثر كفاءة8. وعلاوة على ذلك، ميكروبيلارس أرق وأخف من ميكروكاجي، وبالتالي لا تمنع التوسع ovule أثناء المراقبة الطويلة الأجل. يمكن أن تعقد هذا الجهاز ميكروبيلار أبل لأيام عدة، بدءاً من مرحلة زيجوتيك حتى المرحلة الجنينية قلب8. في نهاية المطاف، بيد ذروة ovule تماما موسع يتجاوز ارتفاع ميكروبيلار، وهكذا فإنه يدفع الجهاز بعيداً. ولذلك، ينبغي تعديل الارتفاع والتباعد ميكروبيلارس إذا الأجنة مرحلة لاحقة يتم التركيز.
لأنه يتم وضع في أبل في الجزء السفلي من الطبق، يجب أن تستخدم مجهر مقلوب. مجهر [كنفوكل] كافية لرصد نمط انقسام الخلايا كما هو موضح في الشكل 3 (ب) و تكميلية أشرطة الفيديو 2 و 38،11، ومجهر [كنفوكل] القرص الغزل المهم أن تؤدي على المدى الطويل التصوير دون تلف الخلايا. وفي المقابل، الفحص المجهري إثارة اثنين-فوتون، ومناسبة لتصوير عميق للمعيشة12من الكائنات الحية، من الضروري تصور ديناميات الزيجوت (الشكل 3 ألف و تكميلية الفيديو 1)10داخل الخلايا. ولذلك، من الأهمية بمكان استخدام نظام المجهر مناسب للتجارب.
كما هو موضح في مقدمة و نتائج الممثل، كانت هناك لا الأساليب القائمة التي يمكن رصد ديناميات المعيشة الزيجوت والأجنة النامية في أبل. ولذلك، باستخدام هذا الأسلوب زراعة أبل، وتم توضيح تفاصيل الاستقطاب الزيجوت والزخرفة الجنين للمرة الأولى.
هذا الأسلوب المطبق للتجارب الدوائية كما هو موضح في تكميلية الفيديو 3. وعلاوة على ذلك، استخدم هذا نظام التصوير لتقييم آثار المركبات المركبة حديثا على انقسام الخلايا الجنينية11. كان أيضا بنجاح جنبا إلى جنب مع انقطاع الليزر، وهكذا كشفت أن عندما هو أذى الخلية قمي، مشتقات الخلية القاعدية تغيير مصيرهم الخلية لإنتاج جديدة خلية قمي8. ولذلك، مواصلة تطبيق هذا الأسلوب على مختلف المواد والتقنيات ستوفر أدوات قوية لفهم الآليات الجزيئية ل embryogenesis.
لإجراء التصوير بالمدى الطويل مع هذا الأسلوب، هو الخطوة الحاسمة لإعداد علامة نيون محددة ومشرق تسميات الأنسجة المستهدفة و/أو الهياكل. لأن الزيجوت والجنين لاحظ من خلال أوفولي كما هو مبين في الشكل 1، الخلفية إشارات في السويداء والأنسجة ovule الأخرى يمكن أن تحجب الإشارات الحقيقية في الجنين (الشكل 4). وبالإضافة إلى ذلك، للكشف عن إشارة ضعيفة، قوة الليزر المجهر يحتاج إلى زيادة، ولكن هذا يمكن أن يضر ovule أثناء المراقبة الطويلة الأجل. ويبين تكميلية الفيديو 4 أن ليزر عالية الطاقة زادت السيارات-الأسفار في أوفولي، وأخيراً تقلص الكيس الجنين، التي سحقت اقحه. ولذلك، ينبغي إنشاء خط علامة المحددة ومشرق قبل البدء التجربة. وفيما يتعلق بالسطوع العالي، تدتوماتو والبرسيم أفضل من طلب تقديم العروض والتجارة والنقل، على التوالي.

الشكل 4: أقنعة الإشارات الخلفية الفلورية في Ovule إشارة الجنينية.
صورة ovule معربا عن علامات نواة الجنينية (هيستون 2B-تدتوماتو؛ أرجواني) ونواة البشرة (هيستون 2B-البرسيم؛ الأخضر). Ovule كله والجنين قصت تظهر في الجزء العلوي والسفلي الأفرقة، على التوالي. الأسهم تشير إلى موضع الجنين. هو أعرب هيستون 2B-البرسيم ليس فقط في الجنين، ولكن أيضا في أبل كامل، وبالتالي من الصعب العثور على إشارة الجنينية عن طريق ovule. تغيير حجم أشرطة: 50 ميكرون (A) و 10 ميكرومتر (ب). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
أجريت في المعهد من تحويلي بيو-الجزيئات (WPI-إيتبم) من جامعة ناغويا مجهرية في هذا العمل وتدعمه "شبكة العلوم النباتية المتقدمة اليابان". هذا العمل كان تدعمها المنح من اليابان وكالة العلوم والتكنولوجيا (مشروع ايراتو T.H. وم) ومن "الجمعية اليابانية" "تعزيز العلوم": معونات "البحث العلمي" في "مجالات مبتكرة" (غ. JP24113514، JP26113710، JP15H05962، و JP15H05955 م، ونص. JP16H06465 و JP16H06464 و JP16K21727 ل T.H)، معونات للعلماء الشباب (ب، غ. JP24770045 و JP26840093 م)، ومعونات "البحوث الاستكشافية" الصعبة (رقم JP16K14753 عن م).
Materials
| Name | Company | Catalog Number | Comments |
| Nitsch basal salt mixture | Duchefa | N0223 | |
| trehalose dihydrate | Wako Pure Chemical | 206-18455 | |
| MES | Dojindo | 345-01625 | |
| Gamborg’s vitamin solution | Sigma-Aldrich | G1019 | |
| 35-mm glass-bottom dish | Matsunami Glass | D111300 | |
| 35 mm culture dish | Corning | 430588 | |
| PDMS | Dow Corning Co. | Sylgard184 | |
| 76 × 26 mm slide glass | Matsunami Glass | S1225 | |
| 18 × 18 mm slide glass | Matsunami Glass | C018181 | |
| needle (gauge 0.40mm) | Terumo | NN-2719S | |
| Immersion medium Immersol W 2010 | Zeiss | 444969-0000-000 | |
| A1R MP | Nikon | A1RsiMP(1080) Ti-E-TIRF | |
| CSU-W1 | Yokogawa Electric | It is a customized equipment, and thus Catalog Number is not avairable. | |
| CV1000 | Yokogawa Electric | CV1000-SP84 |
References
- Natesh, S., Rau, M. A., Johri, B. M. . Embryology of Angiosperms. , 377-443 (1984).
- Kranz, E., Lorz, H. In vitro fertilisation of maize by single egg and sperm cell protoplast fusion mediated by high calcium and high pH. Zygote. 2 (2), 125-128 (1994).
- Uchiumi, T., Uemura, I., Okamoto, T. Establishment of an in vitro fertilization system in rice (Oryza sativa L.). Planta. 226 (3), 581-589 (2007).
- Sun, M. X., Moscatelli, A., Yang, H. Y., Cresti, M. In vitro double fertilization in Nicotiana tabacum (L.): the role of cell volume in cell fusion. Sex Plant Rep. 13 (4), 225-229 (2001).
- Tian, H. Q., Yuan, T., Russell, S. D. Relationship between double fertilization and the cell cycle in male and female gametes of tobacco. Sex Plant Rep. 17 (5), 243-252 (2004).
- Costa, L. M., et al. Central cell-derived peptides regulate early embryo patterning in flowering plants. Science. 344 (6180), 168-172 (2014).
- Sauer, M., Friml, J. In vitro culture of Arabidopsis embryos within their ovules. Plant J. 40 (5), 835-843 (2004).
- Gooh, K., et al. Live-cell imaging and optical manipulation of Arabidopsis early embryogenesis. Dev Cell. 34 (2), 242-251 (2015).
- Park, J., Kurihara, D., Higashiyama, T., Arata, H. Fabrication of microcage arrays to fix plant ovules for long-term live imaging and observation. Sens Act B-Chem. 191, 178-185 (2014).
- Kimata, Y., et al. Cytoskeleton dynamics control the first asymmetric cell division in Arabidopsis zygote. Proc Natl Acad Sci U S A. 113 (49), 14157-14162 (2016).
- Nambo, M., et al. Combination of Synthetic Chemistry and Live-Cell Imaging Identified a Rapid Cell Division Inhibitor in Tobacco and Arabidopsis thaliana. Plant Cell Physiol. 57 (11), 2255-2268 (2016).
- Mizuta, Y., Kurihara, D., Higashiyama, T. Two-photon imaging with longer wavelength excitation in intact Arabidopsis tissues. Protoplasma. 252 (5), 1231-1240 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved