Method Article
Métodos Básicos para o Estudo da Ecologia Reprodutiva do Peixe em Aquário
Neste Artigo
Resumo
Uma série de métodos básicos para permitir o estudo da ecologia reprodutiva de peixes mantidos em aquários são descritos. Estes são protocolos úteis para a coleta de peixe usando SCUBA, transporte de peixes vivos e observação do comportamento reprodutivo de peixes selvagens capturados em aquários.
Resumo
As observações criativas são valiosas para revelar aspectos do comportamento dos peixes e da ecologia quando as investigações de campo contínuas são impossíveis. Aqui, uma série de técnicas básicas são descritas para permitir observações do comportamento reprodutivo de um peixe gobiid capturado na selva, como modelo, mantido em um aquário. O método se concentra em três etapas: coleta, transporte e observações de ecologia reprodutiva de um reprodutor de substratos. Os aspectos essenciais da coleta e transporte de peixes vivos são (1) evitando lesões nos peixes e (2) aclimatação cuidadosa ao aquário. Evitar danos causados por lesões, como arranhões ou uma mudança brusca de pressão da água, é imperativo ao coletar peixes vivos, pois qualquer dano físico provavelmente afetará negativamente a sobrevivência e o comportamento posterior do peixe. A aclimatação cuidadosa aos aquários diminui a incidência de morte e mitiga o choque do transporte. As observações durante a criação em cativeiro incluem (1) a identificação de indiviDuplo peixe e (2) monitoramento de ovos gerados sem efeitos negativos para o peixe ou os ovos, permitindo uma investigação detalhada da ecologia reprodutiva das espécies do estudo. A injeção subcutânea de uma etiqueta de elastômero de implante visível (VIE) é um método preciso para a identificação subseqüente de peixes individuais, e pode ser usado com uma grande variedade de peixes, com influência mínima em sua sobrevivência e comportamento. Se a espécie de estudo é um criador de substrato que deposita ovos adesivos, um local de nidificação artificial construído a partir de tubos de cloreto de polivinilo (PVC) com a adição de uma folha impermeável removível facilitará a contagem e monitoramento dos ovos, diminuindo a influência do investigador sobre a retenção do ninho E o comportamento de guarda dos ovos dos peixes. Embora este método básico implique técnicas que são raramente mencionadas em detalhes em artigos de pesquisa, são fundamentais para a realização de experimentos que exigem a criação em cativeiro de um peixe selvagem.
Introdução
A evolução adaptativa espetacular é evidente na morfologia, ecologia e comportamento dos peixes 1 . Especialmente, as características ecológicas relacionadas à reprodução são especialmente diversas, e a maioria delas pode ser diretamente influenciada pela condição física individual 2 . Para obter informações sobre as pressões seletivas que levaram à evolução de características únicas em diferentes espécies de peixes, a observação direta de comportamentos reprodutivos e sociais usando peixes vivos é muitas vezes benéfica para fundamentar hipóteses teóricas.
No entanto, as observações de campo contínuas de peixes podem exigir equipamento subaquático especializado e instalações difíceis de manter. Nestes casos, as observações de peixes criados pelo aquário capturados de forma selvagem podem ser úteis 3 , 4 , 5 . Além disso, observações eficientes de comportamentos de peixes que são raras ou difíceisO ult para observar sob condições naturais pode tornar-se possível através da manipulação de experimentos em aquários 6 , 7 , 8 . A criação de peixes em boas condições, minimizando o estresse artificial e o dano físico é fundamental para investigações ecológicas precisas.
O gafanhoto Trimma marinae atinge o comprimento total de 23-25 mm e é distribuído no Oceano Pacífico ocidental, onde é encontrado em baías abrigadas e silenciosas, a profundidades de 9-26 m 9 . Neste trabalho, T. marinae é usado como modelo para descrever uma série de técnicas básicas para a coleta de peixe usando o aparelho de respiração subaquática autônomo (SCUBA), transporte de peixe e eventual aclimatação do peixe para aquários para observação direta Do comportamento reprodutivo e da ecologia das espécies de estudo.
Protocolo
1. Coletando e Transportando Peixe Vivo
NOTA: Este protocolo descreve como coletar peixes que possuem uma bexiga de gás, de uma profundidade ≥ 15 m para a superfície. O transporte rápido para a superfície induzirá a expansão da veia do gás por uma mudança de pressão, que pode prejudicar ou matar os peixes. O cuidado é garantido, pois os danos causados aos peixes durante este primeiro passo afetarão negativamente a sua sobrevivência e comportamento posterior.
- Antes de mergulhar com SCUBA, junte os seguintes materiais: uma rede manual apropriada para capturar a espécie alvo debaixo d'água; Sacos duplos de polietileno que são grandes o suficiente para o peixe; Bandas de borracha (ø 80 mm x 6 mm); Um cilindro de oxigênio para inflar os sacos de coleta na superfície; O Elbagin, que é um antimicrobiano, compreende 10% de nifurstrirenato de sódio; Uma caixa de espuma de poliestireno para colocar os sacos de recolha; Pipetas; E, se necessário (consulte o passo 1.4), uma corda com um comprimentoEquivalente a profundidade máxima de mergulho, bem como um peso de pelo menos 2 kg.
- Recolher as espécies de peixes alvo com uma rede de mão enquanto mergulha; Enquanto ainda está subaquático, coloque o peixe capturado em uma bolsa de polietileno e prenda a boca do saco com uma fita de borracha. Se levará ≥ 1 dia para transportar o peixe para um aquário, também preservar a água do habitat natural em outros sacos, para ser usado para renovar a água que consome peixes.
NOTA: Para segurança, as tarefas subaquáticas devem ser trabalhadas por pelo menos duas pessoas. - Superfície do ponto de coleta com os sacos de peixe a uma velocidade não superior a 1 m / min: a uma profundidade de 10 m ou mais, pare de subir de 1 a 5 minutos a cada 2 m; E de uma profundidade de 10 m para a superfície, para 1 a 5 min a cada 1 m. Quando o peixe capturado é incapaz de manter a sua flutuabilidade no saco ( ou seja , se eles flutuam com uma vasilha de gás expandida enquanto ainda tentam nadar em direção ao fundo), mantenha a mesma profundidade por 1 a 5 min ouScend para 1 - 2 m mais profundo. Uma vez que os peixes parecem recuperar sua flutuabilidade, retome a ascensão para a superfície.
NOTA: Se houver a possibilidade de que o ar no tanque SCUBA se esgote enquanto suba, prenda uma corda no saco de polietileno e coloque um peso ≥ 2 kg; Depois que o operador subaquático subiu de forma segura, puxe isto para a superfície com as mesmas velocidades estipuladas acima. - Na praia ou no barco, dissolva 10 ppm de Elbagin na água de cada saco de polietileno após o revestimento.
NOTA: Embora alguns peixes possam não conseguir manter sua flutuabilidade logo após serem trazidos para a superfície, a maioria pode esperar recuperar em um dia. - Se a densidade de peixe em uma bolsa de coleta for alta, divida o peixe entre mais sacos para evitar que eles se danifiquem se esfregando um contra o outro durante o transporte. Se o peixe é uma espécie agressiva, divida-os individualmente entre os sacos.
- Inflar o saco de recolha com oxigénio e novamente selar a boca da bolsa utilizando rUbberbands. Ao introduzir o oxigênio no saco, abaixe o bico na água do saco para aumentar o teor de oxigênio dissolvido; O saco totalmente expandido deve ser 1/4 cheio com água.
- Mantenha as bolsas de recolha com peixe em uma caixa de espuma de poliestireno, para manter uma temperatura estável da água e diminuir o estresse do peixe em condições escuras.
- Se levará ≥ 1 dia para transportar o peixe para um aquário, uma vez por dia troque 1/4 a 1/3 da água em cada saco de manutenção de peixes, usando água retida do habitat ao qual foi adicionado 10 ppm Elbagin , E reembalar cada um com oxigênio. Todos os dias, retire os peixes mortos e as excretas no fundo pela rede manual ou pela pipeta.
NOTA: Se o transporte de avião estiver envolvido, espere pelo menos 1 dia para acalmar peixes à pressão do ar na superfície antes do transporte, porque a mudança de pressão de dois passos (de subaquática para superfície e superfície para ar superior) no curto prazo pode afetar negativamente A sobrevivência do peixe. I>
2. Aclimatando o peixe a um aquário
- Flutue a bolsa contendo peixes em um aquário por 30 minutos para igualar a temperatura da água.
- Durante um período de 10 min, troque gradualmente a água do saco com água do aquário, para evitar o choque causado por uma diferença repentina na química da água ( por exemplo , pH, salinidade).
NOTA: Um peixe que fica chocado com uma diferença muito grande na química da água pode exibir uma alteração anormal na cor e / ou no comportamento do corpo. Monitore isso com cuidado durante a aclimatação. - Dissolver 10 ppm de Elbagin na água do aquário.
- Posteriormente, uma vez ao dia durante 3 dias, renovar 1/3 da água do aquário, tendo adicionado 10 ppm de Elbagin à água de reposição.
- Finalmente, comece a eliminar o Elbagin trocando metade da água do aquário uma vez por dia, até que a cor fade.
3. Injetar uma etiqueta de elastômero de implante visível (VIE) para identificar peixes individuais
T "> NOTA: Neste trabalho, os peixes individuais são identificados usando etiquetas VIE, por exemplo, consulte Frederick 10 , Olsen e Vøllestad 11 e Leblanc e Noakes 12. Além disso, se a espécie do estudo for grande o suficiente para segurar uma mão , A tabela cirúrgica utilizada no passo 3.2 não será necessária.- Determine a posição da injeção e marque a cor para cada indivíduo. A opção mais segura é escolher um ponto de injeção na parte dorsal musculosa grossa ou caudal do corpo e evitar a injeção no abdômen onde os órgãos internos podem ser perfurados.
NOTA: Um sistema de numeração é descrito na Figura 1 : se a espécie do estudo for suficientemente grande para injeção em 8 posições possíveis, este sistema permitirá a identificação de 154 indivíduos usando uma única cor. Dez cores das etiquetas VIE estão disponíveis comercialmente. Escolha a cor distinguível com base na cor do corpo dos peixes. - Para peixes que são menores do que podem ser mantidos na mão, prepare uma tabela cirúrgica da seguinte maneira (consulte também Kinkel et al ., 13 ) ( Figura 2 ).
- Corte uma esponja macia que mede 5 cm L x 5 cm W e que seja pelo menos 5-10 mm inferior à altura de uma placa de Petri.
- Corte uma ranhura na esponja de aproximadamente 5 a 10 mm de profundidade e ajuste sua largura à da largura corporal aproximada do peixe. Corte a placa de cloreto de polivinilo (PVC) (0,3 mm de espessura) até 5 cm L x 5 cm W e dobre-a em uma dobra do vale (ou em forma de M).
- Coloque a placa de PVC ranhurada em cima da esponja ranhurada e, em seguida, coloque a esponja na placa Petri (ø 160 mm, 30 mm de profundidade). Use água do tanque de recuperação para encher a placa de Petri até que a placa de PVC esteja suavemente imersa.
- Prepare as etiquetas VIE de acordo com o manual de marcação VIE. Misture os materiais elastoméricos e adicione a mistura ao syri de 3 ml.Nge com agulha de calibre 29, conforme contida no kit.
- Prepare dois tanques de água para usar enquanto executa as injeções de etiquetas: uma para anestesia e outra para recuperação; Ajuste a temperatura e a concentração de salinidade destes para combinar a água no aquário de criação. Use uma bomba de ar com uma pedra de ar para circular levemente a água no tanque de recuperação.
- Prepare um líquido de anestesia misturando 2-metilquinolina com um volume igual de 99,5% de etanol; Adicione isso ao tanque de anestesia para atingir uma concentração de 18 ppm.
NOTA: A concentração ideal do líquido de anestesia dependerá da espécie e do tamanho corporal dos indivíduos. Portanto, examine a concentração ideal para as espécies de estudo com antecedência. - Transfira peixes individuais para o tanque de anestesia e deixe-os anestesiar: é esperar que os peixes não reajam a tocar ou a aquecer as vibrações quando o tanque é pressionado. À medida que a cor do corpo muda quando é anesthetiZed em muitos peixes, também monitorar cuidadosamente a cor do corpo e avaliar se o peixe é anestesiado a partir de suas mudanças. Porque há alguma possibilidade de que os peixes possam saltar do tanque de anestesia, mantê-lo coberto usando uma placa acrílica transparente, pelo menos até o peixe começar a se mover devagar.
NOTA: ajuste o tempo necessário para anestesiar e / ou ajustar a concentração de líquido de anestesia, dependendo das espécies do estudo e do seu tamanho corporal. Se o movimento do opérculo for interrompido pela anestesia, o peixe estará em alto risco de morte. - Como os peixes enfraquecerão se seu corpo estiver aquecido, mantenha os dedos na água relativamente fria enquanto anestesia o peixe.
- Levante um peixe do tanque de anestesia e avalie-o rapidamente ou registre os dados necessários (comprimento total, sexo, etc. ). Se um peixe parece recuperar durante a medição, transfira-o imediatamente para o tanque de anestesia.
- Transfira o peixe para uma mesa cirúrgica. Coloque o lado ventral do peixe para baixo em tO sulco do PVC. Se o tamanho do corpo é muito pequeno, use um microscópio binocular ao fazer a injeção. Se a espécie do estudo for grande o suficiente para segurar uma mão, injete a etiqueta VIE enquanto ela está sendo mantida.
- Posicione o lado chanfrado da agulha para o exterior e apontado para a cabeça do peixe. Insira a agulha subcutaneamente, mais ou menos paralelamente ao corpo, e tão perto quanto possível da pele. Ajuste a profundidade de inserção dependendo do tamanho do corpo do peixe e da facilidade para finalmente ver a etiqueta.
- Injete a etiqueta VIE enquanto retira a agulha e pare a injeção antes que o chanfro da agulha atinja o ponto de entrada da agulha (isso será fácil de discernir se injetar a etiqueta em uma área relativamente ampla).
- Ao completar a injeção de etiquetas, transfira imediatamente o peixe para o tanque de recuperação. Se a recuperação parecer muito lenta, circule suavemente a água manualmente.
- Após a recuperação, devolver o peixe ao aquário de criação e continuar a adicionar 10 ppm de ElBagin para a água por 3 dias.
NOTA: Em condições de baixa visibilidade para etiquetas VIE, a luz filtrada UVA facilitará o reconhecimento das tags.
4. Contando os ovos adesivos Demersal
- Para criar um ninho de criação artificial ao qual o peixe pode depositar ovos adesivos, corte um tubo de PVC opaco (ø 5 cm, 6 cm de comprimento) ao meio, perpendicular ao diâmetro.
NOTA: O tamanho do tubo acima é adequado para gerar o T. smally pequeno relativamente pequeno. Assim, ajuste o tamanho do tubo de PVC e forme, conforme apropriado para as espécies do estudo. - Imprima uma grade de 5 mm x 5 mm em uma folha impermeável e corte-a para caber na área interna do tubo de PVC.
- Corrija a chapa impermeável no interior do tubo de PVC usando uma fita de borracha.
NOTA: Se é difícil para as fêmeas colocar ovos na folha impermeável, e os ovos caem da folha, faça a folha texturizada com lixa. - Cubra o fundo do aquário com uma camada de areia, 1- 2 cm de espessura. Insira aproximadamente um terço do tubo de PVC obliquamente na areia, com o lado fixo da folha para baixo.
- Após o aparecimento do peixe, remova a folha com a massa de ovo do tubo de PVC e coloque-a em uma placa de Petri com água de aquário. Corrija uma nova folha dentro do tubo de PVC e coloque esta de volta no fundo do aquário. Finalmente, conte os ovos fotografando a massa de ovo.
- Alternativamente, se as observações do cuidado dos óleos parentais forem realizadas após a reprodução, tenha cuidado para não retirar os ovos da água. Em vez disso, use uma placa de Petri para colher os ovos e as folhas juntamente com a água do aquário, fotografar a massa de ovo rapidamente e, em seguida, reafirmar cuidadosamente a folha com a massa de ovo de volta para o mesmo tubo de PVC antes de retornar a sua posição original no Fundo do aquário. Finalmente, conte os ovos usando a imagem.
- Conte os ovos usando ImageJ ( Figura 3 ). Estes métodos de contagem celular automática e manual são explicados detalhadamente no seguinte: Contagem celular básica (The University of Chicago, Integrated Core Microscopy Core Facility, http://digital.bsd.uchicago.edu/image_j.php); Análise de partículas (http://imagej.net/Particle_Analysis); Contador de células (https://imagej.net/Cell_Counter).
- Caso contrário, se os ovos forem depositados densamente, avalie o número de ovos calculando a relação área-densidade: conte os ovos em uma grade impressa de 5 x 5 mm 2 para calcular a densidade do ovo, mede a área de superfície coberta por ovos por ImageJ, E estimar o número total de ovos acima da densidade por unidade e área de superfície. O método de medição da área de superfície acima por ImageJ é explicado no seguinte: Definir escala ... (Branch de Serviços de Pesquisa, https://imagej.nih.gov/ij/docs/menus/analyze.html); Explica como definir a escala espacial da imagem; Usando ImageJ para medir área de superfície (Keene State College, AcademicTecnologia, https://dept.keene.edu/at/2011/04/15/by-matthew-ragan/).
NOTA: Se os ovos são transparentes, a folha à prova de água preta é mais adequada para o método de contagem automática porque ImageJ pode reconhecer o contorno dos ovos individualmente.
- Caso contrário, se os ovos forem depositados densamente, avalie o número de ovos calculando a relação área-densidade: conte os ovos em uma grade impressa de 5 x 5 mm 2 para calcular a densidade do ovo, mede a área de superfície coberta por ovos por ImageJ, E estimar o número total de ovos acima da densidade por unidade e área de superfície. O método de medição da área de superfície acima por ImageJ é explicado no seguinte: Definir escala ... (Branch de Serviços de Pesquisa, https://imagej.nih.gov/ij/docs/menus/analyze.html); Explica como definir a escala espacial da imagem; Usando ImageJ para medir área de superfície (Keene State College, AcademicTecnologia, https://dept.keene.edu/at/2011/04/15/by-matthew-ragan/).
Resultados
Seguindo os métodos acima, 41, 15 e 96 indivíduos de T. marinae foram coletados em abril de 2014, 2015 e 2016, respectivamente, no exterior de Amami Oshima, Prefeitura de Kagoshima, Japão ( Tabela 1 ). Em cada caso, viviam 25 (61%), 14 (93%) e 91 (95%) até depositar ovos em um aquário. Conforme relatado em Fukuda et al . 3 , apenas um peixe morreu antes do final do período de observação em 2014, e a criação de peixes, de outra forma, parece ter início 7 dias após a captura, mostrando que os indivíduos estavam sendo criados em boas condições.
As tags VIE foram visíveis e permitiram a identificação dos indivíduos, mesmo neste peixe pequeno ( Figura 4A , 4B ). Uma fotografia de ovos depositados em uma folha impermeável é mostrada na Figura 4C , provando queEles eram visíveis o suficiente para serem contados. Depois que foi removido e fotografado, a folha foi devolvida ao seu antigo lugar no aquário, e o macho de nidificação continuou imediatamente com cuidados paternos ( Figura 4D ).
Juntas, essas técnicas podem ser empregadas em experimentos destinados a registrar as interações sociais e o sucesso reprodutivo de todos os peixes individuais criados. Especificamente, Fukuda et al. 3 investigaram a ecologia reprodutiva de T. marinae em aquários usando os métodos acima. Os resultados demonstraram uma correlação positiva entre a fecundidade feminina e o tamanho corporal feminino ( Figura 5 ), enquanto que nenhuma diferença no sucesso reprodutivo foi observada entre machos de tamanho diferente ( Figura 6 ). Além disso, T. marinae tendeu a estabelecer um par reprodutivo contínuo e a maioria das ocorrências ocorridas dentro dessesPares ( Tabela 2 ). Apenas observaram-se T. T. marinae masculino para realizar cuidados de ovos paternos. A interação agressiva entre indivíduos sugeriu que o sistema de acasalamento monogâmico pode resultar principalmente da proteção feminina feminina.
| Dia da coleta | Coleta de profundidade | Método de coleta | Número de indivíduos coletados | Duração da estadia | Dia do transporte | Número de indivíduos mortos | Taxa de sobrevivência | ||
| Superando | Transporte | Aclimatação | |||||||
| 15 APril 2014 | - 21 m | Superfície com peixe até a superfície. | 41 | Durante a noite | 16 de abril de 2014 | 16 | 0 | 0 | 61% |
| 23 de abril de 2015 | - 19 m | Superfície com peixe até 12 m de profundidade, puxar até a corda até a superfície. | 15 | 1 dia | 25 de abril de 2015 | 1 | 0 | 0 | 93% |
| 26 de abril de 2016 | - 21 m | Superfície com peixe até 15 m de profundidade, puxar até a corda até a superfície. | 96 | 1 dia | 28 de abril de 2016 | 4 | 1 | 0 | 95% |
Tabela 1: Condições de Cobrança e Taxa de Sobrevivência de Peixes. O número de indivíduos mortos indica quando e quantos peixes individuais morreram.

Tabela 2: Pares de descoberta durante a Experiência de Criação. M , identidade individual (ID) de machos; F , ID das fêmeas; ID sublinhada , uma fêmea gerada; ID delineado , uma fêmea que se acasalou com um macho, embora não estabelecessem um par contínuo. Estes resultados indicam que T. marinae tende a estabelecer um par reprodutivo contínuo como parte de um sistema de acoplamento monogâmico. Esta tabela foi modificada de Fukuda et al. 3 Clique aqui para baixar esta tabela.
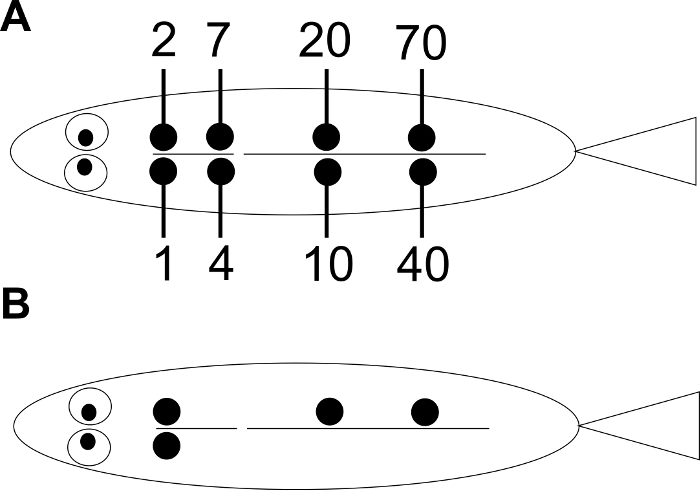
Figura 1: Arranjo das posições de marcação VIE. ( A ) Cada número mostra o nuCorrespondente à posição da injeção. O número de identidade de um peixe individual é determinado ao combinar a (s) posição (s) das tags. ( B ) Um exemplo do peixe individual n. ° 93.

Figura 2: Uma visão ilustrando a tabela cirúrgica. Clique aqui para ver uma versão maior dessa figura.

Figura 3: Contador de ovos manual e automático usando ImageJ. ( A ) Contagem manual usando o plugin do contador de células. Este plugin permite contar os ovos agrupados por alguma subdivisão. É um exemplo que ovoS subdivididos em quatro grupos e contados. ( B ) Contagem automática de ovos. ( C ) Imagem que foi mesclada a imagem automática de contagem de ovos e a imagem original. Clique aqui para ver uma versão maior dessa figura.

Figura 4: Identificação individual representativa por Injecting T. marinae com VIE Tags, e usando uma folha impermeável para contar ovos depositados no site de criação artificial. ( A ) Individual No. 1, identificado pela etiqueta VIE cor-de-rosa; Uma seta branca indica a etiqueta VIE injetada. ( B ) Individual No. 11, identificado pelas duas etiquetas VIE verdes; As setas brancas indicam oInjetou etiquetas VIE. ( C ) Ovos nascidos em uma folha impermeável. ( D ) O cuidado paterno retomado por um macho depois que a folha com os ovos foi removida e fotografada e depois colocada de volta no aquário. Clique aqui para ver uma versão maior dessa figura.

Figura 5. Relação entre o tamanho da embreagem e o tamanho do corpo feminino (comprimento total) em T. marinae . Curva sólida , fecundidade estimada em cada grupo de tamanho de fêmeas, obtida com um modelo linear generalizado de efeitos mistos. Estes resultados indicam que o sucesso reprodutivo feminino aumentou com o tamanho do corpo (correlação de Pearson, r = 0,56, P <0,05, n = 1 6). Esta figura foi modificada de Fukuda et al. 3 Clique aqui para ver uma versão maior dessa figura.
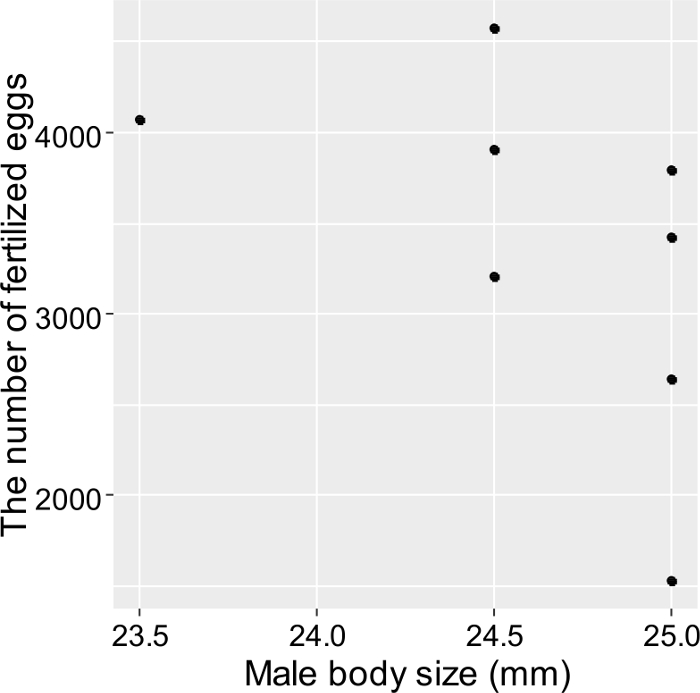
Figura 6. Relação entre o sucesso estimado do acasalamento e o tamanho do corpo masculino (comprimento total) em T. marinae . Cada item de dados foi estimado a partir da freqüência de reprodução dos machos e da fecundidade estimada das fêmeas. Esses resultados indicam que os machos foram reproduzidos com sucesso, independentemente do tamanho corporal (correlação de Pearson, r = ˗0,51, P > 0,05, n = 8). Esta figura foi modificada de Fukuda et al. 3_upload / 55964 / 55964fig6large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
Discussão
A ecologia reprodutiva de numerosos peixes foi frequentemente revelada através da criação experimental. Especialmente, mudança de sexo 6 , 8 , 14 , escolha do parceiro 15 , 16 e competição intraespecífica 7 , 17 foram tópicos freqüentes de investigações detalhadas usando peixes mantidos por aquário. Além disso, alguns resultados observados em aquários foram posteriormente confirmados no campo 8 , 18 . Esses resultados apóiam a utilidade e a credibilidade de criar experimentos com peixes selvagens capturados em aquários. Além disso, a manipulação através de experimentos de criação que simulam situações que podem ocorrer naturalmente, mas raramente em condições selvagens vale a pena como uma etapa preliminar para investigações de campo em larga escala.
O profissionalTocol descreve métodos adequados para um criador de substratos de pequeno porte que deposita ovos adesivos. Podem ser esperadas grandes variações nas condições ideais para peixes mantidos em aquário, o que garante ajustes em alguns pontos do protocolo. Em particular, cinco pontos do protocolo devem ser considerados para o ajuste após uma avaliação preliminar das espécies específicas do estudo: (1) o tempo gasto na superfície do peixe, no protocolo 1.4; (2) a concentração do líquido de anestesia e o tempo gasto na anestesia imediatamente antes de injetar a etiqueta VIE, nos protocolos 3.1.3 e 3.1.5, respectivamente; (3) a profundidade de inserção da agulha ao injetar a etiqueta VIE no peixe, no protocolo 3.1.8; (4) o tamanho e a forma do tubo de PVC utilizado como um local de nidificação artificial, no protocolo 3.2.1; E (5) usando corretamente métodos de contagem de ovos, no protocolo 4.6: contagem manual (preciso, mas leva tempo e esforço), contagem automática e estimativa da relação área-densidade (eficiente mas áspera). Quando thHá poucos ovos, ou quando a contagem agrupada por alguma subdivisão é necessária (como por exemplo, morte ou vida, classificação baseada em estágio de desenvolvimento e assim por diante), recomenda-se o método de contagem manual. Quando há um grande número de ovos, e o ImageJ pode distinguir individualmente cada ovo, o método de contagem automática pode ser adequado. A estimativa da relação área-densidade é eficaz quando há muitos e densamente ovos e o ImageJ não pode distinguir cada ovo individualmente.
Muitas espécies de peixes podem não manter sua flutuabilidade perfeitamente após serem trazidas para a superfície. No entanto, um revestimento cuidadoso de acordo com este protocolo pode permitir que a maioria dos peixes se recupere no prazo de um dia. Se os peixes forem encontrados flutuando de cabeça para baixo no saco de coleta logo após o surgimento, espere para determinar se o peixe está morto pelo menos um dia antes de removê-lo. Se os peixes morrem logo após serem trazidos para a superfície ou se eles precisam de mais de um dia para se recuperar, superfície mais devagar ou estender aIntervalo de tempo durante o surgimento no curso de esforços de coleta subsequentes.
Além das tags VIE, existem outros métodos para identificar peixes individuais: flipers de plástico externos coloridos, etiquetas de âncora de nylon, clipes de junção e tags de transponder integrado passivo (PIT), etc. No entanto, especialmente quando colecionamos peixes pequenos, algumas dessas técnicas podem aumentar a mortalidade, dificultar o crescimento ou não podem ser visíveis in situ. 10 Além disso, à medida que a maioria das etiquetas externas se sobressaem do corpo de peixe, uma etiqueta pode restringir alguns comportamentos de espécies que habitam matas, fendas estreitas ou camas de algas densas. Em contraste, muitos estudos de peixes pequenos descobriram que a marcação de VIE não teve efeitos negativos maiores sobre a mortalidade e o crescimento 10 , 11 . As tags VIE também podem afetar de forma insignificante o comportamento do peixe, uma vez que a etiqueta subcutânea não se projeta, por mais pequeno que seja o peixe, tornando-o especialmente adequadoMétodo de identificação para observações comportamentais de espécies de pequeno porte 10 . De acordo com alguns estudos anteriores, as tintas acrílicas também podem ser usadas da mesma forma que as etiquetas VIE 19 , 20 .
O ninho gerador artificial é geralmente utilizado para a investigação da reprodução de peixes que geram os ovos adesivos demersais. Estudos anteriores usaram ninhos artificiais, que são feitos de diferentes tipos de materiais, como o telhado de terracota 21 , a cerâmica 22 , a casca 23 , a caixa de PVC 24 , etc. Esses ninhos de criação artificial podem ser úteis para muitos criadores de substratos. Esses estudos sugerem que a disponibilidade do ninho artificial para peixes, como a forma e / ou tamanho, é mais importante do que é feito. Como o tubo de PVC é o material que é fácil de obter e processar,Este papel usou o tubo de PVC como o ninho de criação.
Os limites das informações ecológicas obtidas através de observações de criação cativa devem ser bem-vindos. Não surpreendentemente, a criação em aquários, em comparação com o ambiente natural de uma espécie, restringe várias condições ecológicas do habitat aquático ( por exemplo , características físicas e químicas da água, ecologia alimentar, oportunidades para interações intra e inter-específicas, extensão do habitat, E densidade populacional). Pode levar os indivíduos a apresentar comportamentos específicos que diferem dos seus naturais. Portanto, as investigações de campo devem complementar as observações de criação de modo a fornecer os melhores antecedentes para inferir a evolução adaptativa dos comportamentos reprodutivos dos peixes.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Agradecemos a S. Yokoyama pela assistência à coleta de peixe. Também agradecemos a W. Kawamura por conselhos úteis sobre os métodos de criação. Este estudo foi apoiado pela Sociedade Japonesa para a Promoção da Ciência (KAKENHI) através de subsídios (nº 24370006 e 16K07507) atribuídos a TS
Materiais
| Name | Company | Catalog Number | Comments |
| Hand net | Nisso | AQ-17 | Select for the target species size. |
| Polyethylene bag | San-U Fish Farm | 8194 | |
| Rubber band | ESCO Co. LTD. | 78-0420-64 | ø 80 mm x 6 mm |
| Oxygen cylinder | N/A | N/A | Oxgen cylinder for diving equipment suits. |
| Elbagin | Japan Pet Design Co. Ltd. | 75950 | Pafurazine F (provided from same company) is equivalent drug to Elbagin. |
| Polystyrene foam box | N/A | N/A | |
| Pipette | AS ONE | 1-8625-04 | |
| Rope | Mizukami Kinzoku Co. LTD. | 95301601 | |
| Weight | N/A | N/A | Weight for diving equipment suits. |
| Water tank | N/A | N/A | |
| Air pump | KOTOBUKI | 4972814 062115 | |
| Air stone | KOTOBUKI | 4972814 232204 | |
| 2-Methylquinoline | Wako | 170-00376 | |
| Ethanol (99.5) | Wako | 057-00456 | |
| Visible implant elastomer tag kit | Northwest Marine Technology | N/A | http://www.nmt.us/products/vie/vie.shtml |
| Soft sponge | N/A | N/A | |
| PVC board | N/A | N/A | 0.3 mm thickness is easy to use. |
| Petri dish | N/A | N/A | A large one, such as ø 160 mm and 30 mm depth, is convenient for the injection of the VIE tag. |
| Transparent acrylic board | N/A | N/A | |
| UVA filtered light | N/A | N/A | |
| PVC pipe | N/A | N/A | ø 5 cm |
| Waterproof sheet | SOMAR Corp. | 3EKW03 | The film for the plain copier. |
| Sand | N/A | N/A | |
| Stereo microscope | N/A | N/A | |
| Camera | N/A | N/A |
Referências
- Helfman, G., Collette, B. B., Facey, D. E., Bowen, B. W. The Diversity of Fishes: Biology, Evolution, and Ecology. , Wiley-Blackwell. Oxford. (2009).
- Davies, N. B., Krebs, J. R., West, S. A. An Introduction to Behavioural Ecology. , 4th ed, Wiley-Blackwell. Oxford. (2012).
- Fukuda, K., Manabe, H., Sakurai, M., Dewa, S., Shinomiya, A., Sunobe, T. Monogamous mating system and sexuality in the gobiid fish, Trimma marinae (Actinopterygii: Gobiidae). J Ethol. 35 (1), 121-130 (2017).
- Manabe, H., Matsuoka, M., Goto, K., Dewa, S., Shinomiya, A., Sakurai, M., Sunobe, T. Bi-directional sex change in the gobiid fish Trimma sp.: does size-advantage exist? Behaviour. 145 (1), 99-113 (2008).
- Sakurai, M., Nakakoji, S., Manabe, H., Dewa, S., Shinomiya, A., Sunobe, T. Bi-directional sex change and gonad structure in the gobiid fish Trimma yanagitai. Ichthyol Res. 56 (1), 82-86 (2009).
- Sunobe, T., Nakazono, A. Sex change in both directions by alteration of social dominance in Trimma okinawae (Pisces: Gobiidae). Ethology. 94 (4), 339-345 (1993).
- Wong, M. Y., Munday, P. L., Buston, P. M., Jones, G. P. Monogamy when there is potential for polygyny: tests of multiple hypotheses in a group-living fish. Behav Ecol. 19 (2), 353-361 (2008).
- Kuwamura, T., Suzuki, S., Tanaka, N., Ouchi, E., Karino, K., Nakashima, Y. Sex change of primary males in a diandric labrid Halichoeres trimaculatus: coexistence of protandry and protogyny within a species. J Fish Biol. 70 (6), 1898-1906 (2007).
- Winterbottom, R. Two new species of the Trimma tevegae species group from the Western Pacific (Percomorpha: Gobiidae). Aqua J Ichthyol Aquat Biol. 10, 29-38 (2005).
- Frederick, J. L. Evaluation of fluorescent elastomer injection as a method for marking small fish. Bull Mar Sci. 61 (2), 399-408 (1997).
- Olsen, E. M., Vøllestad, L. A. An evaluation of visible implant elastomer for marking age-0 brown trout. N Am J Fish Manag. 21 (4), 967-970 (2001).
- Leblanc, C. A., Noakes, D. L. Visible implant elastomer (VIE) tags for marking small rainbow trout. N Am J Fish Manag. 32 (4), 716-719 (2012).
- Kinkel, M. D., Eames, S. C., Philipson, L. H., Prince, V. E. Intraperitoneal injection into adult zebrafish. J Vis Exp. (42), e2126(2010).
- Reavis, R. H., Grober, M. S. An integrative approach to sex change: social, behavioural and neurochemical changes in Lythrypnus dalli (Pisces). Acta Ethol. 2 (1), 51-60 (1999).
- Milinski, M., Bakker, T. C. Female sticklebacks use male coloration in mate choice and hence avoid parasitized males. Nature. 344, 330-333 (1990).
- Basolo, A. L. Phylogenetic evidence for the role of a pre-existing bias in sexual selection. Proc R Soc Lond B Biol Sci. 259 (1356), 307-311 (1995).
- Milinski, M. Optimal forging: the influence of intraspecific competition on diet selection. Behav Ecol Sociobiol. 11 (2), 109-115 (1982).
- Manabe, H., Ishimura, M., Shinomiya, A., Sunobe, T. Field evidence for bidirectional sex change in the polygynous gobiid fish Trimma okinawae. J Fish Biol. 70 (2), 600-609 (2007).
- Stammler, K. L., Corkum, L. D. Assessment of fish size on shelter choice and intraspecific interactions by round gobies Neogobius melanostomus. Environ Biol Fishes. 73 (2), 117-123 (2005).
- Matsumoto, Y., Tawa, A., Takegaki, T. Female mate choice in a paternal brooding blenny: the process and benefits of mating with males tending young eggs. Ethology. 117 (3), 227-235 (2011).
- McCormick, M. I. Behaviorally induced maternal stress in a fish influences progeny quality by a hormonal mechanism. Ecology. 79 (6), 1873-1883 (1998).
- Knaepkens, G., Bruyndoncx, L., Coeck, J., Eens, M. Spawning habitat enhancement in the European bullhead (Cottus gobio), an endangered freshwater fish in degraded lowland rivers. Biodivers Conserv. 13 (13), 2443-2452 (2004).
- Shiogaki, M., Dotsu, Y. The life history of the gobiid fish, Zonogobius boreus. Bulletin of the Faculty of Fisheries, Nagasaki University. 37, 1-8 (1974).
- Meunier, B., Yavno, S., Ahmed, S., Corkum, L. D. First documentation of spawning and nest guarding in the laboratory by the invasive fish, the round goby (Neogobius melanostomus). J Great Lakes Res. 35 (4), 608-612 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados