Method Article
Méthodes fondamentales pour l'étude de l'écologie reproductive du poisson dans les aquariums
Dans cet article
Résumé
Une série de méthodes de base permettant d'étudier l'écologie reproductive des poissons conservés dans les aquariums sont décrites. Ce sont des protocoles utiles pour la collecte de poissons à l'aide de SCUBA, le transport de poissons vivants et l'observation du comportement reproducteur des poissons sauvages conservés dans les aquariums.
Résumé
Les observations d'élevage en captivité sont précieuses pour révéler des aspects du comportement du poisson et de l'écologie lorsque les recherches continues sur le terrain sont impossibles. Ici, une série de techniques de base sont décrites pour permettre l'observation du comportement reproductif d'un poisson gobiide capturé à l'état sauvage, en tant que modèle, conservé dans un aquarium. La méthode se concentre sur trois étapes: la collecte, le transport et les observations de l'écologie de la reproduction d'un générateur de substrat. Les aspects essentiels de la collecte et du transport de poissons vivants sont (1) la prévention des blessures au poisson, et (2) une acclimatation minutieuse de l'aquarium. Prévenir les dommages causés par des blessures telles que des rayures ou un changement soudain de la pression de l'eau est impératif lors de la collecte de poissons vivants, car tout dommage physique est susceptible d'affecter négativement la survie et le comportement ultérieur du poisson. Une acclimatation minutieuse des aquariums diminue l'incidence de la mort et atténue le choc des transports. Les observations pendant l'élevage en captivité comprennent (1) l'identification des individusDouble poisson et (2) la surveillance des œufs engendrés sans effets négatifs sur le poisson ou les œufs, permettant ainsi une étude détaillée de l'écologie de la reproduction de l'étude. L'injection sous-cutanée d'une étiquette d'élastomère d'implant visible (VIE) est une méthode précise pour l'identification ultérieure de poissons individuels, et elle peut être utilisée avec une large gamme de poissons, avec une influence minimale sur leur survie et leur comportement. Si l'espèce d'étude est un générateur de substrat qui dépose des oeufs adhésifs, un site de nidification artificiel construit à partir d'un tuyau de chlorure de polyvinyle (PVC) avec l'ajout d'une feuille étanche amovible facilitera le comptage et la surveillance des œufs, ce qui réduira l'influence de l'investigateur sur le nid Et le comportement de conservation des œufs du poisson. Bien que cette méthode de base comporte des techniques qui sont rarement mentionnées en détail dans les articles de recherche, elles sont fondamentales pour entreprendre des expériences nécessitant l'élevage captif d'un poisson sauvage.
Introduction
Une évolution adaptative spectaculaire est évidente dans la morphologie, l'écologie et le comportement des poissons 1 . En particulier, les caractéristiques écologiques relatives à la reproduction sont particulièrement diverses, et la plupart d'entre elles peuvent être directement influencées par la condition physique individuelle 2 . Pour mieux comprendre les pressions sélectives qui ont conduit à l'évolution des caractéristiques uniques dans différentes espèces de poissons, l'observation directe des comportements reproductifs et sociaux à l'aide de poissons vivants est souvent bénéfique pour étayer les hypothèses théoriques.
Cependant, les observations continues sur le terrain des poissons peuvent nécessiter un équipement sous-marin spécialisé et des installations difficiles à entretenir. Dans ces cas, les observations des poissons sauvages capturés par l'aquarium peuvent être utiles 3 , 4 , 5 . En outre, des observations efficaces sur les comportements de poissons qui sont autrement rares ou difficilesULT à observer dans des conditions naturelles peut devenir possible en manipulant des expériences dans les aquariums 6 , 7 , 8 . Élever du poisson dans de bonnes conditions en minimisant le stress artificiel et les dommages physiques est essentiel pour des recherches écologiques précises.
Le portique pygmée Trimma marinae atteint une longueur totale de 23 à 25 mm et est distribué dans l'océan Pacifique occidental, où il se trouve dans des baies abruptes et abritées, à des profondeurs de 9 à 26 m 9 . Dans ce travail, T. marinae est utilisé comme modèle pour décrire une série de techniques de base pour la collecte de poissons utilisant l'appareil respiratoire autonome sous-marin (SCUBA), le transport de poisson et l'éventuelle acclimatation des poissons aux aquariums pour une observation directe Du comportement reproducteur et de l'écologie des espèces étudiées.
Protocole
1. Collecte et transport de poissons vivants
REMARQUE: Ce protocole décrit comment recueillir des poissons qui possèdent une vessie gazeuse, d'une profondeur ≥ 15 m à la surface. Un transport rapide à la surface induit une expansion de la vessie par un changement de pression, ce qui peut nuire gravement ou tuer le poisson. La prudence est justifiée, car les dommages causés aux poissons au cours de cette première étape affecteront négativement leur survie et leur comportement ultérieur.
- Avant de plonger avec SCUBA, rassemblez les matériaux suivants: un filet adapté pour capturer les espèces visées sous l'eau; Double sac en polyéthylène assez grand pour les poissons; Bandes en caoutchouc (ø 80 mm x 6 mm); Un cylindre d'oxygène pour gonfler les sacs de collecte à la surface; L'Elbagin, qui est un antimicrobien, comprend 10% de nifurstyrénate de sodium; Une boîte en mousse de polystyrène pour placer les sacs de collecte; Pipettes; Et, si nécessaire (voir l'étape 1.4), une corde avec une longueurÉquivalent à la profondeur de plongée maximale, ainsi qu'un poids d'au moins 2 kg.
- Recueillir les espèces de poissons ciblées à l'aide d'un filet à main lors de la plongée Tout en restant sous l'eau, placez le poisson capturé dans un sac en polyéthylène et attachez la bouche du sac avec une bande de caoutchouc. S'il faudra ≥ 1 jour pour transporter le poisson vers un aquarium, conservez également l'eau de l'habitat naturel dans d'autres sacs, afin d'être utilisé pour renouveler l'eau de poisson.
REMARQUE: pour la sécurité, les tâches sous-marines doivent être travaillées par au moins deux personnes. - Surface du point de collecte avec les sacs de poisson à une vitesse ne dépassant pas 1 m / min: à une profondeur de 10 m ou plus, arrête de monter de 1 à 5 minutes tous les 2 m; Et d'une profondeur de 10 m à la surface, arrêtez pendant 1 à 5 minutes toutes les 1 m. Lorsque les poissons capturés sont incapables de maintenir leur flottabilité dans le sac ( c.-à - d. , S'ils flottent avec une vessie gazeuse dilatée tout en essayant de nager vers le bas), maintenez la même profondeur pendant 1 à 5 min ouScénarise à 1 - 2 m plus profond. Une fois que les poissons semblent récupérer leur flottabilité, reprendre l'ascension vers la surface.
REMARQUE: s'il existe une possibilité que l'air dans le réservoir SCUBA s'épuise en montant, fixez une corde au sac en polyéthylène et fixez un poids ≥ 2 kg; Une fois que l'opérateur sous-marin a monté en toute sécurité, tirez-le vers la surface aux mêmes vitesses stipulées ci-dessus. - À la plage ou au bateau, dissolvez 10 ppm d'Elbagin dans l'eau de chaque sac en polyéthylène après le revêtement.
REMARQUE: Bien que certains poissons puissent ne pas pouvoir maintenir leur dynamitage juste après avoir été amenés à la surface, on peut s'attendre à ce qu'ils récupèrent en une journée. - Si la densité du poisson dans un sac collecteur est élevée, divisez le poisson parmi plus de sacs pour éviter qu'ils ne se dégagent les uns les autres en se frottant les uns contre les autres lors du transport. Si le poisson est une espèce agressive, divisez-les individuellement entre les sacs.
- Gonflez le sac de collecte avec de l'oxygène et scellez encore la bouche du sac en utilisant rUbberbands. Lors de l'introduction de l'oxygène dans le sac, abaissez la buse dans l'eau du sac pour augmenter la teneur en oxygène dissous; Le sac entièrement expansé devrait être 1/4 plein avec de l'eau.
- Gardez les sacs de collecte avec du poisson dans une boîte en mousse de polystyrène, pour maintenir une température d'eau stable et diminuer le stress du poisson dans des conditions sombres.
- Si il faudra ≥ 1 jour pour transporter le poisson vers un aquarium, une fois par jour échangez 1/4 à 1/3 de l'eau dans chaque sac de maintien de poisson, en utilisant de l'eau retenue dans l'habitat auquel ont été ajoutés 10 ppm Elbagin , Et remballer chacun avec de l'oxygène. Chaque jour, retirez les poissons morts et les excréments sur le fond à la main ou à la pipette.
REMARQUE: Si le transport d'avion est impliqué, attendez au moins 1 jour pour activer la pression atmosphérique sur la surface avant le transport, car le changement de pression de deux étapes (de l'eau à la surface et de la surface à l'air supérieur) à court terme peut affecter négativement La survie du poisson. I>
2. Acclimant le poisson dans un aquarium
- Flotter le sac contenant du poisson dans un aquarium pendant 30 minutes pour égaliser la température de l'eau.
- Sur une période de 10 minutes, échangez progressivement l'eau du sac avec de l'eau d'aquarium, afin d'éviter les chocs causés par une différence soudaine dans la chimie de l'eau ( p . Ex . PH, salinité).
NOTE: Un poisson qui se choque par une trop grande différence dans la chimie de l'eau peut afficher un changement anormal de la couleur et / ou du comportement du corps. Surveillez-le attentivement pendant l'acclimatation. - Dissoudre 10 ppm d'Elbagin dans l'eau de l'aquarium.
- Par la suite, une fois par jour pendant 3 jours, renouvellez 1/3 de l'eau de l'aquarium, en ajoutant 10 ppm d'Elbagin à l'eau de remplacement.
- Enfin, commencez à éliminer l'Elbagin en échangeant la moitié de l'eau de l'aquarium une fois par jour, jusqu'à ce que la couleur disparaisse.
3. Injection d'une étiquette d'élastomère d'implant visible (VIE) pour identifier les poissons individuels
T "> NOTE: Dans ce travail, les poissons individuels sont identifiés à l'aide des étiquettes VIE, pour des exemples, se référer à Frederick 10 , Olsen et Vøllestad 11 et Leblanc et Noakes 12. En outre, si l'espèce d'étude est assez grande pour tenir la main , La table chirurgicale utilisée à l'étape 3.2 ne sera pas nécessaire.- Déterminer la position de l'injection et la couleur de l'étiquette pour chaque individu. L'option la plus sûre est de choisir un point d'injection dans la partie dorsale ou caudale épaisse du corps et d'éviter de l'injecter dans l'abdomen où les organes internes peuvent être percés.
REMARQUE: un système de numérotation est décrit dans la Figure 1 : si l'étude est suffisamment grande pour être injectée dans 8 positions possibles, ce système permettra d'identifier 154 individus utilisant une seule couleur. Dix couleurs des étiquettes VIE sont disponibles dans le commerce. Choisissez la couleur distincte en fonction de la couleur du corps des poissons. - Pour les poissons qui sont plus petits que ceux qui peuvent être maintenus à la main, préparez une table chirurgicale comme suit (voir également Kinkel et al ., 13 ) ( figure 2 ).
- Découpez une éponge douce mesurant 5 cm L x 5 cm W, et qui est au moins 5 à 10 mm inférieure à la hauteur d'une boîte à pétri.
- Couper une rainure dans l'éponge d'environ 5 à 10 mm de profondeur, et ajuster sa largeur à celle de la largeur de corps approximative du poisson. Couper la planche de chlorure de polyvinyle (PVC) (0,3 mm d'épaisseur) à 5 cm L x 5 cm W, et la plier dans un pli de vallée (ou en forme de M).
- Réglez la planche de PVC rainurée sur l'éponge rainurée, puis mettez l'éponge dans la boîte de Petri (ø 160 mm, profondeur de 30 mm). Utilisez l'eau du réservoir de récupération pour remplir la boîte de Petri jusqu'à ce que la planche en PVC soit suffisamment immergée.
- Préparez les étiquettes VIE selon le manuel de marquage VIE. Mélanger les matériaux élastomères et ajouter le mélange au syri de 3 mlNge avec une aiguille à calibre 29, comme indiqué dans le kit.
- Préparez deux réservoirs d'eau à utiliser lors de l'exécution des injections: une pour l'anesthésie et une pour la récupération; Ajustez la température et la concentration de salinité de ceux-ci pour faire correspondre l'eau dans l'aquarium d'élevage. Utilisez une pompe à air avec une pierre d'air pour faire circuler légèrement l'eau dans le réservoir de récupération.
- Préparer un liquide d'anesthésie en mélangeant 2-méthylquinoléines avec un volume égal de 99,5% d'éthanol; Ajoutez ceci au réservoir d'anesthésie pour atteindre une concentration de 18 ppm.
NOTE: La concentration optimale du liquide anesthésique dépend de l'espèce et de la taille corporelle des individus. Par conséquent, examiner la concentration optimale pour les espèces étudiées à l'avance. - Transférer des poissons individuels dans le réservoir d'anesthésie et leur permettre d'être anesthésiés: c'est-à-dire attendre que les poissons ne réagissent pas pour être touchés ou pour faire vibrer l'eau lorsque l'extérieur du réservoir est tapoté. Comme la couleur du corps change quand il s'agit d'anesthésieZed dans de nombreux poissons, surveillez également la couleur du corps et jugez si le poisson est anesthésié de ses changements. Parce qu'il existe une possibilité que les poissons puissent sortir du réservoir d'anesthésie, gardez-le couvert à l'aide d'un panneau acrylique transparent, au moins jusqu'à ce que les poissons commencent à se déplacer lentement.
REMARQUE: ajustez le temps nécessaire pour anesthésier et / ou ajustez la concentration d'anesthésie liquide selon les espèces étudiées et sa taille corporelle. Si le mouvement opérulaire est toujours arrêté par l'anesthésie, le poisson risque de mourir. - Comme les poissons s'affaibliront si leur corps est réchauffé, gardez les doigts dans l'eau relativement froide tout en anesthésiant le poisson.
- Soulever un poisson du réservoir d'anesthésie et le mesurer rapidement ou enregistrer les données nécessaires (longueur totale, sexe, etc. ). Si un poisson semble se remettre pendant la mesure, remettez-le immédiatement au réservoir d'anesthésie.
- Transférer le poisson sur une table chirurgicale. Réglez le côté ventral du poisson vers le bas dans tLe sommet en PVC. Si la taille du corps est très petite, utilisez un microscope binoculaire tout en effectuant l'injection. Si l'espèce d'étude est suffisamment grande pour se tenir en main, injectez la balise VIE pendant qu'elle est retenue.
- Positionner le côté biseauté de l'aiguille vers l'extérieur et pointé vers la tête du poisson. Insérez l'aiguille par voie sous-cutanée, plus ou moins parallèle au corps, et près de tout près de la peau possible. Réglez la profondeur d'insertion en fonction de la taille du poisson et de la facilité pour voir finalement la balise.
- Injecter la balise VIE tout en retirant l'aiguille et arrêter l'injection avant que le biseau de l'aiguille n'atteigne le point d'entrée de l'aiguille (cela sera facile à discerner si vous injectez l'étiquette dans une zone relativement large).
- En terminant l'injection d'étiquette, transférer immédiatement le poisson dans le réservoir de récupération. Si la récupération semble trop lente, faites circuler doucement l'eau à la main.
- Après la récupération, retournez le poisson dans l'aquarium d'élevage et continuez à ajouter 10 ppm à l'eau.Bagin à l'eau pendant 3 jours.
REMARQUE: Dans des conditions de faible visibilité pour les étiquettes VIE, la lumière filtrée par UVA facilitera la reconnaissance des balises.
4. Comptage des oeufs adhésifs démersaux
- Pour créer un nid de frai artificiel auquel les poissons peuvent déposer des oeufs adhésifs, couper un tube de PVC opaque (ø 5 cm, 6 cm de long) en deux, perpendiculaire au diamètre.
REMARQUE: La taille de tuyau ci-dessus est adaptée pour engendrer le petit T. T. marinae relativement petit. Ainsi, ajustez la taille du tuyau en PVC et formez-le comme il convient pour les espèces étudiées. - Imprimez une grille de 5 mm x 5 mm sur une feuille imperméable et découpée pour s'adapter à la zone intérieure du tuyau en PVC.
- Fixez la feuille étanche à l'intérieur du tuyau en PVC à l'aide d'une bande de caoutchouc.
REMARQUE: s'il est difficile pour les femelles d'attacher des œufs sur la feuille étanche et les oeufs tombent de la feuille, faites la feuille texturée avec du papier de verre. - Couvrez le fond de l'aquarium avec une couche de sable, 1- 2 cm d'épaisseur. Insérez environ un tiers du tube en PVC obliquement dans le sable, avec le côté fixe de la feuille vers le bas.
- Après avoir frayé avec succès le poisson, retirez la feuille avec la masse d'oeufs du tuyau en PVC et placez-la dans une boîte de Petri avec de l'eau d'aquarium. Fixez une nouvelle feuille à l'intérieur du tuyau en PVC et placez-la de nouveau sur le fond de l'aquarium. Enfin, comptez les oeufs en photographiant la masse d'oeufs.
- Sinon, si les observations des soins parentaux des œufs doivent être effectuées après la ponte, veillez à ne pas retirer les œufs de l'eau. Plutôt, utilisez une boîte de Petri pour récupérer les oeufs et la feuille avec de l'eau d'aquarium, photographiez la masse d'oeufs rapidement et rétablissez soigneusement la feuille avec la masse d'oeufs dans le même tuyau en PVC avant de la remettre à sa position d'origine sur le Fond de l'aquarium. Enfin, comptez les oeufs en utilisant la photo.
- Comptez les oeufs en utilisant ImageJ ( Figure 3 ). Ces méthodes de comptage de cellules automatiques et manuelles sont expliquées en détail dans ce qui suit: Comptage cellulaire de base (The University of Chicago, Integrated Core Microscopy Core Facility, http://digital.bsd.uchicago.edu/image_j.php); Analyse des particules (http://imagej.net/Particle_Analysis); Compteur de cellules (https://imagej.net/Cell_Counter).
- Dans le cas contraire, si les œufs sont déposés densément, estimer le nombre d'oeufs en calculant le taux de densité de surface: compter les oeufs dans une grille 5 x 5 mm 2 imprimée pour calculer la densité des oeufs, mesurer la surface recouverte d'oeufs par ImageJ, Et estimer le nombre total d'oeufs par rapport à la densité supérieure par unité et surface. La méthode de mesure de la surface spécifique de ImageJ est expliquée dans ce qui suit: Définir l'échelle ... (Direction des services de recherche, https://imagej.nih.gov/ij/docs/menus/analyze.html); Il explique comment définir l'échelle spatiale de l'image; Utilisation de ImageJ pour mesurer la surface (Keene State College, AcademicTechnologie, https://dept.keene.edu/at/2011/04/15/by-matthew-ragan/).
REMARQUE: si les oeufs sont transparents, la feuille imperméable à l'eau noire est plus adaptée à la méthode de comptage automatique car ImageJ peut reconnaître le contour des oeufs individuellement.
- Dans le cas contraire, si les œufs sont déposés densément, estimer le nombre d'oeufs en calculant le taux de densité de surface: compter les oeufs dans une grille 5 x 5 mm 2 imprimée pour calculer la densité des oeufs, mesurer la surface recouverte d'oeufs par ImageJ, Et estimer le nombre total d'oeufs par rapport à la densité supérieure par unité et surface. La méthode de mesure de la surface spécifique de ImageJ est expliquée dans ce qui suit: Définir l'échelle ... (Direction des services de recherche, https://imagej.nih.gov/ij/docs/menus/analyze.html); Il explique comment définir l'échelle spatiale de l'image; Utilisation de ImageJ pour mesurer la surface (Keene State College, AcademicTechnologie, https://dept.keene.edu/at/2011/04/15/by-matthew-ragan/).
Résultats
En suivant les méthodes ci-dessus, 41, 15 et 96 personnes de T. marinae ont été collectées en avril 2014, 2015 et 2016, respectivement, au large d'Amami Oshima, dans la préfecture de Kagoshima, au Japon ( tableau 1 ). Dans chaque cas, 25 (61%), 14 (93%) et 91 (95%) vivaient jusqu'à déposer des œufs dans un aquarium. Comme indiqué dans Fukuda et al . 3 , un seul poisson est mort avant la fin de la période d'observation en 2014, et la reproduction des poissons semble avoir commencé 7 jours après la capture, ce qui montre que les individus étaient élevés dans de bonnes conditions.
Les étiquettes VIE étaient visibles et permettaient d'identifier les individus, même dans ce poisson de petite taille ( figure 4A , 4B ). Une photographie d'oeufs déposés sur une feuille imperméable à l'eau est montrée à la figure 4C , prouvant queIls étaient assez visibles pour être comptés. Après avoir été enlevé et photographié, la feuille a été renvoyée dans son ancien endroit dans l'aquarium, et le mâle niche a continué immédiatement à prendre soin des paternels ( figure 4D ).
Ensemble, ces techniques peuvent être utilisées dans des expériences visant à enregistrer les interactions sociales et le succès reproductif de tous les poissons individuels élevés. Plus précisément, Fukuda et al. 3 ont étudié l'écologie reproductive de T. marinae dans les aquariums en utilisant les méthodes ci-dessus. Les résultats ont démontré une corrélation positive entre la fécondité féminine et la taille corporelle féminine ( Figure 5 ), alors qu'aucune différence dans le succès reproductif n'a été observée chez les hommes de taille différente ( figure 6 ). De plus, T. marinae a tendance à établir une paire de reproduction continue et la plupart des frayères se sont produites au sein de cesPaires ( tableau 2 ). Seuls les hommes de T. marinae ont été observés pour effectuer des soins des oeufs paternels. L'interaction agressive entre les individus a suggéré que le système d'accouplement monogame peut résulter principalement de la protection des mâles féminins.
| Jour de collecte | Profondeur de la collection | Méthode de collecte | Nombre d'individus collectés | Durée du séjour | Jour de transport | Nombre d'individus morts | Taux de survie | ||
| Surfaces | Transport | Acclimatation | |||||||
| 15 APril 2014 | - 21 m | Surface avec du poisson jusqu'à la surface. | 41 | pendant la nuit | 16 avril 2014 | 16 | 0 | 0 | 61% |
| 23 avril 2015 | - 19 m | Surface avec poissons jusqu'à 12 m de profondeur, tirer vers le haut par la corde jusqu'à la surface. | 15 | Un jour | 25 avril 2015 | 1 | 0 | 0 | 93% |
| 26 avril 2016 | - 21 m | Surface avec poissons jusqu'à 15 m de profondeur, tirez par corde jusqu'à la surface. | 96 | Un jour | 28 avril 2016 | 4 | 1 | 0 | 95% |
Tableau 1: Conditions de collecte et taux de survie des poissons. Le nombre d'individus morts indique quand et combien de poissons individuels sont morts.

Tableau 2: Paires de reproducteurs pendant l'expérience d'élevage. M , identité individuelle (ID) des hommes; F , identification des femelles; ID souligné , une femelle engendrée; ID décrite , une femelle qui s'accouplait avec un homme bien qu'elle n'ait pas établi une paire continue. Ces résultats indiquent que T. marinae a tendance à établir une paire de reproduction continue dans le cadre d'un système d'accouplement monogame. Ce tableau a été modifié à partir de Fukuda et al. 3 Cliquez ici pour télécharger ce tableau.
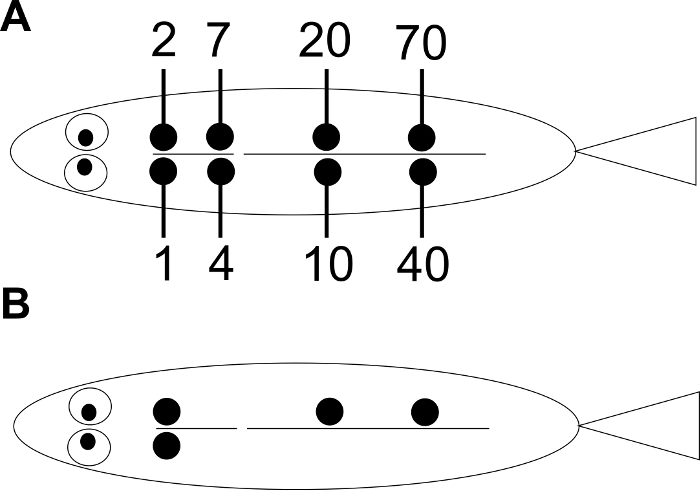
Figure 1: Arrangement des positions de marquage VIE. ( A ) Chaque chiffre montre le nuCorrespondant à la position de l'injection. Le numéro d'identité d'un poisson individuel est déterminé en faisant correspondre le (s) poste (s) des étiquettes. ( B ) Un exemple du poisson individuel n ° 93.

Figure 2: Une vue illustrant la table chirurgicale. Cliquez ici pour voir une version plus grande de ce chiffre.

Figure 3: Comptage manuel et automatique des oeufs à l'aide de ImageJ. ( A ) Comptage manuel à l'aide du plugin Cell Counter. Ce plugin permet de compter les œufs regroupés par une subdivision. C'est un exemple que l'oeufS ont été subdivisés en quatre groupes et comptés. ( B ) Comptage automatique des œufs. ( C ) Image qui a fusionné l'image automatique de comptage d'oeufs et l'image originale. Cliquez ici pour voir une version plus grande de ce chiffre.

Figure 4: Identification individuelle représentative en Injectant T. marinae avec VIE Tags, et en utilisant une feuille imperméable à l'eau pour compter les œufs déposés sur le site de reproducteur artificiel. ( A ) Individuel n ° 1, identifié par la marque VIE rose; Une flèche blanche indique la marque VIE injectée. ( B ) Individuel n ° 11, identifié par les deux étiquettes VIE vertes; Les flèches blanches indiquent leA injecté des étiquettes VIE. ( C ) Oeufs vendus sur une feuille imperméable à l'eau. ( D ) Les soins paternels ont été repris par un mâle après que la feuille a été enlevée et photographiée, puis elle a été replacée dans l'aquarium. Cliquez ici pour voir une version plus grande de ce chiffre.

Figure 5. Relation entre la taille de l'embrayage et la taille du corps féminin (longueur totale) chez T. marinae . Courbe solide , fécondité estimée dans chaque groupe de taille de femelles, obtenue avec un modèle à effets mixtes linéaires généralisés. Ces résultats indiquent que le succès reproducteur féminin a augmenté avec la taille du corps (la corrélation de Pearson, r = 0,56, P <0,05, n = 1 6). Ce chiffre a été modifié de Fukuda et al. 3 Cliquez ici pour voir une version plus grande de ce chiffre.
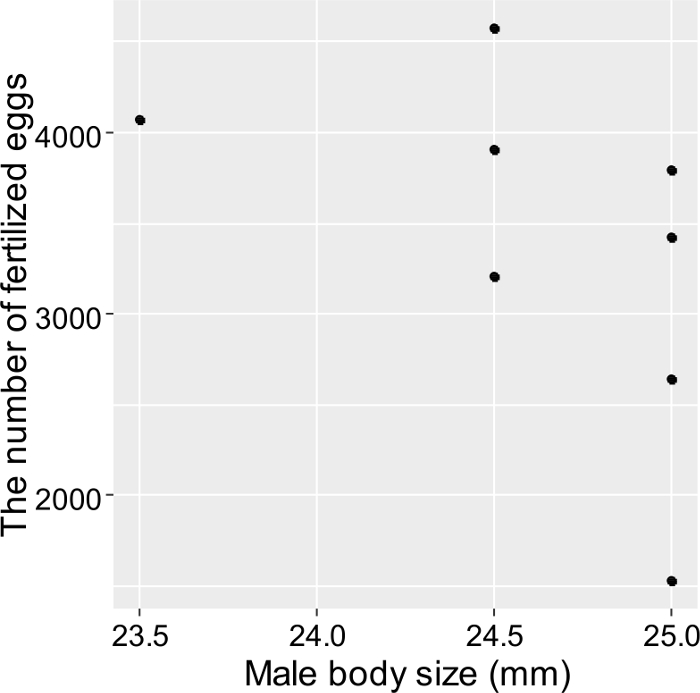
Figure 6. Relation entre le succès estimé de l'accouplement et la taille du corps masculin (longueur totale) chez T. marinae . Chaque élément de données a été estimé à partir de la fréquence de reproduction des mâles et de la fécondité estimée des femelles. Ces résultats indiquent que les hommes ont un succès reproducteur indépendamment de leur taille corporelle (corrélation de Pearson, r = ˗0,51, P > 0,05, n = 8). Ce chiffre a été modifié de Fukuda et al. 3_upload / 55964 / 55964fig6large.jpg "target =" _ blank "> Cliquez ici pour voir une version plus grande de cette figure.
Discussion
L'écologie de la reproduction de nombreux poissons a souvent été révélée par l'élevage expérimental. En particulier, les changements sexuels 6 , 8 , 14 , le choix du partenaire 15 , 16 et la compétition intraspécifique 7 , 17 ont été des sujets fréquents d'enquêtes détaillées utilisant des poissons gardés dans l'aquarium. En outre, certains résultats observés dans les aquariums ont été confirmés plus tard dans le domaine 8 , 18 . Ces résultats confirment l'utilité et la crédibilité des expériences d'élevage avec des poissons sauvages dans les aquariums. En outre, la manipulation à travers des expériences d'élevage qui simulent des situations qui peuvent survenir naturellement, mais rarement dans des conditions sauvages, est une étape préliminaire pour les enquêtes sur le terrain à plus grande échelle.
Le proTocol décrit des méthodes appropriées pour un générateur de substrat de petite taille qui dépose des oeufs adhésifs. De grandes variations dans les conditions optimales pour les poissons conservés dans l'aquarium peuvent être attendues entre les espèces, ce qui justifie des ajustements à certains points du protocole. En particulier, cinq points du protocole devraient être pris en considération pour l'ajustement après une évaluation préliminaire des espèces d'étude particulières: (1) le temps consacré à la surface du poisson, dans le protocole 1.4; (2) la concentration de l'anesthésie liquide et le temps passé dans l'anesthésie juste avant d'injecter l'étiquette VIE, dans les protocoles 3.1.3 et 3.1.5, respectivement; (3) la profondeur d'insertion de l'aiguille lors de l'injection de l'étiquette VIE dans le poisson, dans le protocole 3.1.8; (4) la taille et la forme du tuyau en PVC utilisé comme site de nidification artificiel, dans le protocole 3.2.1; Et (5) en utilisant trois méthodes de comptage d'oeufs correctement, dans le protocole 4.6: comptabilité manuelle (précision mais nécessite du temps et effort), compte automatique et estimation de la densité de surface (efficace mais rugueuse). Quand thIl y a peu d'œufs ou lorsque le comptage regroupé par une subdivision est nécessaire (par exemple, mort ou vivant, classification du stade de développement et ainsi de suite), la méthode de comptage manuel est recommandée. Lorsqu'il existe un grand nombre d'oeufs, l'ImageJ peut distinguer chaque oeuf individuellement, la méthode de comptage automatique peut convenir. L'estimation de la densité de surface est efficace lorsqu'il y a beaucoup d'oeufs denses et l'ImageJ ne peut pas distinguer chaque oeuf individuellement.
Beaucoup d'espèces de poissons peuvent ne pas maintenir parfaitement leur flottabilité après avoir été amenées à la surface. Cependant, un revêtement prudent selon ce protocole peut permettre à la plupart des poissons de récupérer dans un jour. Si le poisson se trouve flottant à l'envers dans le sac de collecte juste après le revêtement, attendez pour déterminer si le poisson est mort au moins un jour avant de l'enlever. Si les poissons meurent peu de temps après avoir été amenés à la surface ou s'ils ont besoin de plus d'un jour pour se rétablir, se lissent plus lentement ou s'étendentIntervalle de temps de ch sur le revêtement au cours des efforts de collecte ultérieurs.
En plus des étiquettes VIE, d'autres méthodes existent pour identifier les poissons individuels: flans en plastique extérieurs colorés, étiquettes d'ancrage en nylon, crochets d'ailettes et étiquettes PIT (passive integrated transponder), etc. Cependant, surtout lors de la collecte de petits poissons, certaines de ces techniques peuvent augmenter la mortalité, entraver la croissance ou ne pas être visible sur place. 10 De plus, comme la plupart des étiquettes externes dépassent du corps de poisson, une étiquette peut restreindre certains comportements d'espèces qui habitent des terriers, des crevasses étroites ou des lits d'algues denses. En revanche, de nombreuses études sur les petits poissons ont révélé que le marquage VIE n'avait aucun effet négatif majeur sur la mortalité et la croissance 10 , 11 . Les étiquettes VIE peuvent également influer de façon négligeable sur le comportement du poisson puisque l'étiquette sous-cutanée ne dépasse pas, même si le poisson est petit, ce qui le rend particulièrement appropriéMéthode d'identification pour les observations comportementales d'espèces de petite taille 10 . Selon certaines études précédentes, les peintures acryliques peuvent également être utilisées de la même manière que les étiquettes VIE 19 , 20 .
Le nid de frai artificiel est généralement utilisé pour l'étude de la reproduction des poissons qui génèrent les œufs adhésifs démersaux. Des études précédentes ont utilisé des nids artificiels, fabriqués à partir de différents types de matériaux, tels que le toit en terre cuite 21 , la céramique 22 , la coquille 23 , la boîte en PVC 24 , etc. Ces nids de frai artificiel peuvent être utiles pour de nombreux géniteurs de substrats. Ces études suggèrent que la disponibilité du nid artificiel pour les poissons, comme la forme et / ou la taille, est plus importante que ce qu'il est fabriqué. Comme le tuyau en PVC est le matériau facile à obtenir et à traiter,Ce papier a utilisé le tuyau de PVC comme nid de frai.
Les limites de l'information écologique obtenue grâce à des observations d'élevage en captivité devraient être bien appréciées. Sans surprise, l'élevage dans les aquariums, par rapport à l'environnement naturel d'une espèce, restreint diverses conditions écologiques de l'habitat aquatique ( par exemple , les caractéristiques physiques et chimiques de l'eau, l'écologie alimentaire, les possibilités d'interactions intra et inter-spécifiques, l'étendue de l'habitat, Et densité de population). Cela peut conduire les individus à présenter des comportements particuliers qui diffèrent de ceux de leur nature. Par conséquent, les enquêtes sur le terrain devraient compléter l'élevage des observations afin de fournir le meilleur moyen d'inférer l'évolution adaptative des comportements reproducteurs des poissons.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Nous remercions S. Yokoyama d'avoir assisté à la collecte de poissons. Nous remercions également W. Kawamura pour des conseils utiles sur les méthodes d'élevage. Cette étude a été soutenue par la Japan Society for the Promotion of Science (KAKENHI) par le biais de subventions (n ° 24370006 et 16K07507) attribuées à TS
matériels
| Name | Company | Catalog Number | Comments |
| Hand net | Nisso | AQ-17 | Select for the target species size. |
| Polyethylene bag | San-U Fish Farm | 8194 | |
| Rubber band | ESCO Co. LTD. | 78-0420-64 | ø 80 mm x 6 mm |
| Oxygen cylinder | N/A | N/A | Oxgen cylinder for diving equipment suits. |
| Elbagin | Japan Pet Design Co. Ltd. | 75950 | Pafurazine F (provided from same company) is equivalent drug to Elbagin. |
| Polystyrene foam box | N/A | N/A | |
| Pipette | AS ONE | 1-8625-04 | |
| Rope | Mizukami Kinzoku Co. LTD. | 95301601 | |
| Weight | N/A | N/A | Weight for diving equipment suits. |
| Water tank | N/A | N/A | |
| Air pump | KOTOBUKI | 4972814 062115 | |
| Air stone | KOTOBUKI | 4972814 232204 | |
| 2-Methylquinoline | Wako | 170-00376 | |
| Ethanol (99.5) | Wako | 057-00456 | |
| Visible implant elastomer tag kit | Northwest Marine Technology | N/A | http://www.nmt.us/products/vie/vie.shtml |
| Soft sponge | N/A | N/A | |
| PVC board | N/A | N/A | 0.3 mm thickness is easy to use. |
| Petri dish | N/A | N/A | A large one, such as ø 160 mm and 30 mm depth, is convenient for the injection of the VIE tag. |
| Transparent acrylic board | N/A | N/A | |
| UVA filtered light | N/A | N/A | |
| PVC pipe | N/A | N/A | ø 5 cm |
| Waterproof sheet | SOMAR Corp. | 3EKW03 | The film for the plain copier. |
| Sand | N/A | N/A | |
| Stereo microscope | N/A | N/A | |
| Camera | N/A | N/A |
Références
- Helfman, G., Collette, B. B., Facey, D. E., Bowen, B. W. The Diversity of Fishes: Biology, Evolution, and Ecology. , Wiley-Blackwell. Oxford. (2009).
- Davies, N. B., Krebs, J. R., West, S. A. An Introduction to Behavioural Ecology. , 4th ed, Wiley-Blackwell. Oxford. (2012).
- Fukuda, K., Manabe, H., Sakurai, M., Dewa, S., Shinomiya, A., Sunobe, T. Monogamous mating system and sexuality in the gobiid fish, Trimma marinae (Actinopterygii: Gobiidae). J Ethol. 35 (1), 121-130 (2017).
- Manabe, H., Matsuoka, M., Goto, K., Dewa, S., Shinomiya, A., Sakurai, M., Sunobe, T. Bi-directional sex change in the gobiid fish Trimma sp.: does size-advantage exist? Behaviour. 145 (1), 99-113 (2008).
- Sakurai, M., Nakakoji, S., Manabe, H., Dewa, S., Shinomiya, A., Sunobe, T. Bi-directional sex change and gonad structure in the gobiid fish Trimma yanagitai. Ichthyol Res. 56 (1), 82-86 (2009).
- Sunobe, T., Nakazono, A. Sex change in both directions by alteration of social dominance in Trimma okinawae (Pisces: Gobiidae). Ethology. 94 (4), 339-345 (1993).
- Wong, M. Y., Munday, P. L., Buston, P. M., Jones, G. P. Monogamy when there is potential for polygyny: tests of multiple hypotheses in a group-living fish. Behav Ecol. 19 (2), 353-361 (2008).
- Kuwamura, T., Suzuki, S., Tanaka, N., Ouchi, E., Karino, K., Nakashima, Y. Sex change of primary males in a diandric labrid Halichoeres trimaculatus: coexistence of protandry and protogyny within a species. J Fish Biol. 70 (6), 1898-1906 (2007).
- Winterbottom, R. Two new species of the Trimma tevegae species group from the Western Pacific (Percomorpha: Gobiidae). Aqua J Ichthyol Aquat Biol. 10, 29-38 (2005).
- Frederick, J. L. Evaluation of fluorescent elastomer injection as a method for marking small fish. Bull Mar Sci. 61 (2), 399-408 (1997).
- Olsen, E. M., Vøllestad, L. A. An evaluation of visible implant elastomer for marking age-0 brown trout. N Am J Fish Manag. 21 (4), 967-970 (2001).
- Leblanc, C. A., Noakes, D. L. Visible implant elastomer (VIE) tags for marking small rainbow trout. N Am J Fish Manag. 32 (4), 716-719 (2012).
- Kinkel, M. D., Eames, S. C., Philipson, L. H., Prince, V. E. Intraperitoneal injection into adult zebrafish. J Vis Exp. (42), e2126(2010).
- Reavis, R. H., Grober, M. S. An integrative approach to sex change: social, behavioural and neurochemical changes in Lythrypnus dalli (Pisces). Acta Ethol. 2 (1), 51-60 (1999).
- Milinski, M., Bakker, T. C. Female sticklebacks use male coloration in mate choice and hence avoid parasitized males. Nature. 344, 330-333 (1990).
- Basolo, A. L. Phylogenetic evidence for the role of a pre-existing bias in sexual selection. Proc R Soc Lond B Biol Sci. 259 (1356), 307-311 (1995).
- Milinski, M. Optimal forging: the influence of intraspecific competition on diet selection. Behav Ecol Sociobiol. 11 (2), 109-115 (1982).
- Manabe, H., Ishimura, M., Shinomiya, A., Sunobe, T. Field evidence for bidirectional sex change in the polygynous gobiid fish Trimma okinawae. J Fish Biol. 70 (2), 600-609 (2007).
- Stammler, K. L., Corkum, L. D. Assessment of fish size on shelter choice and intraspecific interactions by round gobies Neogobius melanostomus. Environ Biol Fishes. 73 (2), 117-123 (2005).
- Matsumoto, Y., Tawa, A., Takegaki, T. Female mate choice in a paternal brooding blenny: the process and benefits of mating with males tending young eggs. Ethology. 117 (3), 227-235 (2011).
- McCormick, M. I. Behaviorally induced maternal stress in a fish influences progeny quality by a hormonal mechanism. Ecology. 79 (6), 1873-1883 (1998).
- Knaepkens, G., Bruyndoncx, L., Coeck, J., Eens, M. Spawning habitat enhancement in the European bullhead (Cottus gobio), an endangered freshwater fish in degraded lowland rivers. Biodivers Conserv. 13 (13), 2443-2452 (2004).
- Shiogaki, M., Dotsu, Y. The life history of the gobiid fish, Zonogobius boreus. Bulletin of the Faculty of Fisheries, Nagasaki University. 37, 1-8 (1974).
- Meunier, B., Yavno, S., Ahmed, S., Corkum, L. D. First documentation of spawning and nest guarding in the laboratory by the invasive fish, the round goby (Neogobius melanostomus). J Great Lakes Res. 35 (4), 608-612 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon