Method Article
Grundlegende Methoden für die Untersuchung der Fortpflanzungsökologie von Fischen in Aquarien
In diesem Artikel
Zusammenfassung
Eine Reihe von grundlegenden Methoden, um das Studium der Fortpflanzungsökologie von Fisch, die in Aquarien gehalten werden, zu ermöglichen, werden beschrieben. Dies sind nützliche Protokolle für das Sammeln von Fischen mit SCUBA, den Transport von lebenden Fischen und die Beobachtung des Fortpflanzungsverhaltens von wild gefangenen Fischen, die in Aquarien gehalten werden.
Zusammenfassung
Captive-Aufzucht-Beobachtungen sind wertvoll für die Aufdeckung von Aspekten des Fischverhaltens und der Ökologie, wenn kontinuierliche Felduntersuchungen unmöglich sind. Hier wird eine Reihe von Grundtechniken beschrieben, um Beobachtungen des Fortpflanzungsverhaltens eines wild gefangenen gobiiden Fisches als Modell in einem Aquarium zu ermöglichen. Die Methode konzentriert sich auf drei Schritte: Sammlung, Transport und Beobachtungen der Fortpflanzungsökologie eines Substrat-Spawers. Wesentliche Aspekte der lebenden Fischsammlung und -transport sind (1) Verhinderung der Verletzung der Fische und (2) sorgfältige Akklimatisierung des Aquariums. Vermeidung von Schäden durch Verletzungen wie Kratzer oder eine plötzliche Änderung des Wasserdrucks ist zwingend erforderlich, wenn man lebende Fische sammelt, da jeder physische Schaden das Überleben und das spätere Verhalten des Fisches negativ beeinflussen kann. Sorgfältige Akklimatisierung der Aquarien verringert den Inzidenztod und lindert den Schock des Transports. Beobachtungen während der Zwangsaufzucht umfassen (1) die Identifizierung von indiviDualfisch und (2) Überwachung von Eiern ohne negative Auswirkungen auf die Fische oder Eier, wodurch eine detaillierte Untersuchung der Reproduktionsökologie der Studienart ermöglicht wird. Die subkutane Injektion eines sichtbaren Implantat-Elastomers (VIE) ist eine präzise Methode für die anschließende Identifizierung einzelner Fische und kann mit einem breiten Größenbereich von Fischen verwendet werden, mit minimalem Einfluss auf ihr Überleben und Verhalten. Wenn die Studie Spezies ein Substrat-Spawner ist, der Klebstoff-Eier abscheidet, wird eine künstliche Nest-Stelle aus Polyvinylchlorid (PVC) Rohr mit dem Zusatz einer abnehmbaren wasserdichten Platte erleichtern Zählen und Überwachen der Eier, wodurch der Einfluss des Ermittlers auf die Nest-Holding Und Eierschutzverhalten der Fische Obwohl diese Grundmethode Techniken mit sich bringt, die in Forschungsartikeln selten erwähnt werden, sind sie für die Durchführung von Experimenten, die die gefangene Aufzucht eines Wildfisches erfordern, von grundlegender Bedeutung.
Einleitung
Spektakuläre adaptive Evolution zeigt sich in der Morphologie, Ökologie und Verhalten der Fische 1 . Besonders die ökologischen Merkmale der Reproduktion sind besonders vielfältig, und die meisten davon können direkt von der individuellen Fitness beeinflusst werden 2 . Um einen Einblick in selektiven Druck zu gewinnen, der zur Entwicklung von einzigartigen Merkmalen bei verschiedenen Fischarten geführt hat, ist die direkte Beobachtung von reproduktiven und sozialen Verhaltensweisen, die lebende Fische verwenden, oftmals von Vorteil, um theoretische Hypothesen zu begründen.
Allerdings können kontinuierliche Feldbeobachtungen von Fischen spezialisierte Unterwasserausrüstung und Einrichtungen, die schwer zu pflegen sind, erfordern. In diesen Fällen können Beobachtungen von wild gefangenen Aquarium-aufgezogenen Fischen hilfreich sein 3 , 4 , 5 . Darüber hinaus sind effiziente Beobachtungen von Fischverhalten, die sonst selten oder diffus sindUltra unter natürlichen Bedingungen zu beobachten, kann durch Manipulation von Experimenten in Aquarien 6 , 7 , 8 möglich werden . Die Aufzucht von Fischen unter guten Bedingungen durch Minimierung von künstlichem Stress und körperlicher Schädigung ist entscheidend für genaue ökologische Untersuchungen.
Der pygmäische Goby Trimma marinae erreicht 23-25 mm Gesamtlänge und verteilt sich im westlichen Pazifischen Ozean, wo er in ruhigen, geschützten Buchten in Tiefen von 9-26 m 9 gefunden wird . In dieser Arbeit wird T. marinae als Modell verwendet, um eine Reihe von Grundtechniken für die Sammlung von Fischen mit dem in sich geschlossenen Unterwasseratemgerät (SCUBA), Fischtransport und eventuelle Akklimatisierung der Fische an Aquarien zur direkten Beobachtung zu beschreiben Der Studienart "Fortpflanzungsverhalten und Ökologie".
Protokoll
1. Sammeln und Transportieren von Live Fish
HINWEIS: Dieses Protokoll beschreibt, wie man Fische, die eine Gasblase besitzen, von einer Tiefe von ≥15 m zur Oberfläche sammeln kann. Schnelle Beförderung an die Oberfläche wird die Ausdehnung der Gasblase durch einen Druckwechsel bewirken, der den Fisch ernsthaft schädigen oder töten kann. Vorsicht ist gerechtfertigt, da Schäden, die den Fischen während dieses ersten Schrittes verursacht werden, ihr Überleben und späteres Verhalten negativ beeinflussen werden.
- Vor dem Tauchen mit SCUBA, sammeln Sie die folgenden Materialien: ein Hand-Netz geeignet für die Erfassung der gezielten Arten unter Wasser; Doppelte Polyethylen-Beutel, die groß genug für den Fisch sind; Gummibänder (ø 80 mm x 6 mm); Eine Sauerstoffzylinder zum Aufblasen der Sammelbeutel an der Oberfläche; Das Elbagin, das ein antimikrobielles Mittel ist, umfasst 10% Natriumnifurstyrenat; Eine Polystyrol-Schaumbox, in der die Sammelbeutel platziert werden können; Pipetten; Und ggf. (siehe Schritt 1.4) ein Seil mit einer LängeGleichbedeutend mit der maximalen Tauchtiefe sowie einem Gewicht von mindestens 2 kg.
- Sammeln Sie die gezielten Fischarten mit einem Handnetz beim Tauchen; Während noch unter Wasser, platzieren Sie den gefangenen Fisch in einem Polyethylen-Beutel und binden Sie den Mund des Beutels mit einem Gummiband. Wenn es ≥1 Tage dauert, um den Fisch zu einem Aquarium zu transportieren, auch Wasser aus dem natürlichen Lebensraum in anderen Beuteln zu bewahren, um für die Erneuerung des Fischfangwassers verwendet zu werden.
HINWEIS: Für die Sicherheit müssen die Unterwasseraufgaben von mindestens zwei Personen bearbeitet werden. - Oberfläche von der Sammelstelle mit den Beuteln von Fischen mit einer Geschwindigkeit von nicht mehr als 1 m / min: bei einer Tiefe von 10 m oder mehr, aufhören für 1 - 5 min alle 2 m; Und von einer Tiefe von 10 m bis zur oberflächlichen Haltestelle für 1 - 5 min alle 1 m. Wenn die gefangenen Fische nicht in der Lage sind, ihren Auftrieb in der Tasche aufrechtzuerhalten ( dh wenn sie mit einer ausgedehnten Gasblase schwimmen, während sie immer noch versuchen, nach unten zu schwimmen), beibehalten sie dieselbe Tiefe für 1 - 5 min oder deAuf 1 - 2 m tiefer schauen. Sobald die Fische ihren Auftrieb wiederherstellen, den Aufstieg auf die Oberfläche wieder aufnehmen.
HINWEIS: Wenn es eine Möglichkeit gibt, dass die Luft im SCUBA-Tank während des Aufstiegs ausläuft, befestigen Sie ein Seil an den Polyäthylenbeutel und befestigen Sie ein Gewicht von ≥2 kg; Nachdem der Unterwasser-Betreiber sicher aufgestiegen ist, ziehen Sie diesen an die Oberfläche mit den oben beschriebenen Geschwindigkeiten. - Am Strand oder Boot, lösen Sie 10 ppm Elbagin im Wasser jeder Polyethylen-Tasche nach dem Auftauchen.
HINWEIS: Obwohl einige Fische nicht in der Lage sind, ihren Auftrieb aufrechtzuerhalten, kurz nachdem sie an die Oberfläche gebracht worden sind, können die meisten erwartet werden, sich innerhalb eines Tages zu erholen. - Wenn die Dichte von Fischen in einem Sammelbeutel hoch ist, teilen Sie den Fisch unter den mehr Beuteln, um zu verhindern, dass sie sich gegenseitig beschädigen, indem sie während des Transports gegeneinander reiben. Wenn der Fisch eine aggressive Art ist, teilen sie sie einzeln zwischen den Taschen.
- Aufblasen Sie die Sammelbeutel mit Sauerstoff und versiegeln Sie den Mund der Tasche mit rUbberbands Beim Einführen des Sauerstoffs in den Beutel die Düse in das Wasser des Beutels senken, um den Gehalt an gelöstem Sauerstoff zu erhöhen; Die voll ausgedehnte Tasche sollte 1/4 voll mit Wasser sein.
- Halten Sie die Sammelbeutel mit Fischen in einer Polystyrol-Schaumbox, um eine stabile Wassertemperatur zu erhalten und den Stress des Fisches unter dunklen Bedingungen zu verringern.
- Wenn es ≥1 Tage dauert, um die Fische zu einem Aquarium zu transportieren, tauschen Sie einmal pro Tag 1/4 bis 1/3 des Wassers in jedem Fischbeutel aus, wobei Wasser aus dem Lebensraum, dem 10 ppm Elbagin hinzugefügt wurde, zurückgehalten wurde , Und verpacken jeweils mit Sauerstoff. Jeden Tag entfernen Sie tote Fische und Exkremente auf der Unterseite von Hand Netz oder Pipette.
HINWEIS: Wenn der Flugzeugtransport beteiligt ist, warten Sie mindestens 1 Tag, um den Luftdruck auf die Oberfläche vor dem Transport zu beschränken, da zwei Stufen Druckänderung (von Unterwasser zu Oberfläche und Oberfläche zur Oberluft) kurzfristig negativ beeinflussen kann Das Überleben der Fische. I>
2. Akklimatisierung der Fische zu einem Aquarium
- Schwimmen Sie die Tasche mit Fisch in einem Aquarium für 30 min, um die Wassertemperatur auszugleichen.
- Über einen Zeitraum von 10 min wechselt das Beutelwasser inkrementell mit Aquarienwasser, um Schock durch einen plötzlichen Unterschied in der Wasserchemie ( zB pH-Wert, Salzgehalt) zu vermeiden.
HINWEIS: Ein Fisch, der durch einen zu großen Unterschied in der Wasserchemie erschüttert wird, kann eine abnormale Veränderung der Körperfarbe und / oder des Verhaltens zeigen. Überwachen Sie diese sorgfältig während der Akklimatisierung. - 10 ppm Elbagin im Aquarienwasser auflösen.
- Danach, einmal am Tag für 3 Tage, erneuern 1/3 des Aquarien-Wasser, mit 10 ppm Elbagin auf das Ersatzwasser.
- Schließlich fängt an, die Elbagin zu beseitigen, indem ich die Hälfte des Aquariums Wasser einmal täglich tausche, bis die Farbe verblasst.
3. Injizieren eines sichtbaren Implantat-Elastomers (VIE), um einzelne Fische zu identifizieren
T> HINWEIS: In dieser Arbeit werden einzelne Fische mit VIE-Tags identifiziert, zum Beispiel beziehen sich auf Frederick 10 , Olsen und Vøllestad 11 und Leblanc und Noakes 12. Auch wenn die Studienart groß genug ist, um in der Hand zu halten , Ist der in Schritt 3.2 verwendete chirurgische Tisch nicht notwendig.- Bestimmen Sie die Einspritzposition und die Tag-Farbe für jede Person. Die sicherste Option ist, einen Einspritzpunkt im dicken muskulösen dorsalen oder kaudalen Teil des Körpers zu wählen und es zu vermeiden, ihn in den Bauch zu injizieren, wo innere Organe durchbohrt werden können.
HINWEIS: Ein Numerierungssystem ist in Abbildung 1 beschrieben : Wenn die Untersuchungsart groß genug für die Injektion in 8 mögliche Positionen ist, wird dieses System die Identifizierung von 154 Individuen mit einer einzigen Farbe ermöglichen. Zehn Farben von VIE-Tags sind im Handel erhältlich. Wählen Sie die unterscheidbare Farbe, die auf der Körperfarbe des Fisches basiert. - Für Fische, die kleiner sind als in der Hand gehalten werden können, bereite eine chirurgische Tabelle wie folgt vor (siehe auch Kinkel et al . 13 ) ( Abbildung 2 ).
- Schneiden Sie einen weichen Schwamm ab, der 5 cm L x 5 cm W misst und der mindestens 5 - 10 mm niedriger ist als die Höhe einer Petrischale.
- Schneiden Sie eine Nut in den Schwamm von ca. 5 - 10 mm Tiefe, und passen Sie die Breite an die der ungefähre Körperbreite des Fisches an. Die Polyvinylchlorid (PVC) -Platte (0,3 mm Dicke) auf 5 cm L x 5 cm W schneiden und in eine Tal-Falte (oder M-Form) biegen.
- Setzen Sie die gerillte PVC-Platte auf den gerillten Schwamm und setzen Sie dann den Schwamm in die Petrischale (ø 160 mm, 30 mm Tiefe). Verwenden Sie Wasser aus dem Rückgewinnungstank, um die Petrischale zu füllen, bis die PVC-Platte ausreichend eingetaucht ist.
- Bereiten Sie die VIE-Tags nach dem VIE-Tagging-Handbuch vor. Mischen Sie die Elastomermaterialien und fügen Sie die Mischung dem 3-ml-Syri hinzuNge mit 29-gauge-Nadel, wie im Kit enthalten.
- Bereiten Sie zwei Wassertanks vor, um während der Durchführung der Tag-Injektionen zu verwenden: eine für die Anästhesie und eine für die Erholung; Stellen Sie die Temperatur und die Salzgehalt-Konzentration von diesen an das Wasser im Aufzucht-Aquarium an. Verwenden Sie eine Luftpumpe mit einem Luftstein, um das Wasser im Rücklaufbehälter leicht zu zirkulieren.
- Vorbereitung einer Anästhesieflüssigkeit durch Mischen von 2-Methylchinolin mit einem gleichen Volumen von 99,5% Ethanol; Fügen Sie diese an den Anästhesie-Tank, um eine Konzentration von 18 ppm zu erreichen.
HINWEIS: Die optimale Konzentration der Anästhesieflüssigkeit hängt von der Art und Körpergröße der Individuen ab. Prüfen Sie daher die optimale Konzentration für die Studienarten im Voraus. - Übertragen Sie einzelne Fische in den Anästhesie-Tank und lassen Sie sie betäubt werden: das heißt, warten, bis Fisch nicht reagiert auf Berührung oder Wasser Vibrationen, wenn die Außenseite des Tanks geklopft wird. Wie die Körperfarbe ändert, wenn es Anästhesi istZed in vielen Fischen, überwachen auch die Körperfarbe sorgfältig und beurteilen, ob Fisch von seinen Veränderungen anästhesiert wird. Weil es irgendeine Möglichkeit gibt, dass Fische aus dem Anästhesie-Tank springen können, halten Sie es mit einem transparenten Acryl-Brett bedeckt, zumindest bis die Fische beginnen, sich langsam zu bewegen.
HINWEIS: Feinabstimmung der Zeit, die benötigt wird, um die Konzentration der Anästhesieflüssigkeit zu betäuben und / oder anzupassen, abhängig von der Studienart und ihrer Körpergröße. Wenn die Operculum-Bewegung jemals durch die Anästhesie gestoppt wird, wird der Fisch ein hohes Todesrisiko haben. - Wenn der Fisch schwächt, wenn ihr Körper erwärmt wird, halten Sie die Finger in dem kalten Wasser, während Sie den Fisch betäuben.
- Heben Sie einen Fisch aus dem Anästhesie-Tank und schnell messen oder notieren Sie die notwendigen Daten (Gesamtlänge, Geschlecht, etc. ). Wenn sich ein Fisch während der Messung erholt, sofort den Rücken zum Anästhesiebehälter zurückführen.
- Übertragen Sie den Fisch auf einen chirurgischen Tisch. Setzen Sie den Fisch ventral Seite nach unten in tEr PVC-Nut. Wenn die Körpergröße sehr klein ist, verwenden Sie ein binokulares Mikroskop, während Sie die Injektion machen. Wenn die Studie Spezies groß genug ist, um in einer Hand zu halten, injizieren Sie das VIE-Tag, während es gehalten wird.
- Positioniere die abgeschrägte Seite der Nadel nach außen und zeigte auf den Kopf des Fisches. Setzen Sie die Nadel subkutan, mehr oder weniger parallel zum Körper, und so nah wie möglich unter der Haut. Passen Sie die Einstecktiefe in Abhängigkeit von der Größe des Fischkörpers und der Leichtigkeit an, um den Tag zu sehen.
- Injizieren Sie das VIE-Etikett, während Sie die Nadel zurückziehen und die Einspritzung stoppen, bevor die Nadel-Fase den Nadeleintrittspunkt erreicht (dies ist leicht zu erkennen, wenn das Etikett in einem relativ großen Bereich injiziert wird).
- Nach Beendigung der Tag-Injektion sofort den Fisch in den Rückgewinnungsbehälter überführen. Wenn die Erholung zu langsam erscheint, zirkulieren Sie das Wasser vorsichtig von Hand.
- Nach der Erholung, die Fische an die Aufzucht Aquarium, und weiterhin 10 ppm El hinzufügenBagin zum Wasser für 3 Tage.
HINWEIS: Bei niedrigviskosen Bedingungen für VIE-Tags erleichtert UVA-gefiltertes Licht die Erkennung der Tags.
4. Zählen der Demersal Adhesive Eggs
- Um ein künstliches Laichnest zu schaffen, auf das der Fisch Klebeeier abgeben kann, schneide ein opakes PVC-Rohr (ø 5 cm, 6 cm lang) in der Hälfte, senkrecht zum Durchmesser.
HINWEIS: Die oben genannte Rohrgröße eignet sich zum Laichen des relativ kleinen Goby T. marinae . So passen Sie die PVC-Rohrgröße und -form an, wie es für die Studienarten geeignet ist. - Drucken Sie ein 5 mm x 5 mm Raster auf eine wasserdichte Platte und schneiden Sie es aus, um den Innenbereich des PVC-Rohres zu passen.
- Befestigen Sie die wasserdichte Folie an der Innenseite des PVC-Rohres mit einem Gummiband.
HINWEIS: Wenn es für Frauen schwierig ist, Eier auf dem wasserdichten Blatt zu befestigen, und Eier fallen aus dem Blatt, machen das Blatt mit Sandpapier strukturiert. - Decke den Aquarienboden mit einer Sandschicht ab, 1- 2 cm dick Setzen Sie etwa ein Drittel des PVC-Rohres schräg in den Sand ein, mit der blattfixierten Seite nach unten.
- Nach erfolgreichem Laichen durch den Fisch, entfernen Sie das Blatt mit der Eimasse aus dem PVC-Rohr und legen Sie es in eine Petrischale mit Aquarienwasser. Fix ein neues Blatt in der PVC-Rohr und legen Sie diese wieder auf den Boden des Aquariums. Schließlich zählen die Eier, indem sie die Eiermasse fotografieren.
- Alternativ, wenn nach dem Laichen Beobachtungen der elterlichen Eipflege durchgeführt werden müssen, achten Sie darauf, die Eier nicht aus dem Wasser zu bringen. Verwenden Sie stattdessen eine Petrischale, um die Eier und das Blatt zusammen mit Aquarienwasser zu schaufeln, die Eiermasse schnell zu fotografieren und dann das Blatt mit der Eimasse wieder in das gleiche PVC-Rohr zurückzukehren, bevor es alles wieder in seine ursprüngliche Position gebracht wird Unterseite des Aquariums. Schließlich zählen die Eier mit dem Bild.
- Zähle die Eier mit ImageJ ( Abb. 3 ). Diese automatischen und manuellen Zellzählmethoden werden im Folgenden näher erläutert: Grundlegende Zellzählung (Die Universität von Chicago, Integrated Light Microscopy Core Facility, http://digital.bsd.uchicago.edu/image_j.php); Partikelanalyse (http://imagej.net/Particle_Analyse); Zellzähler (https://imagej.net/Cell_Counter).
- Andernfalls, wenn Eier dicht abgeschieden werden, schätzen Sie die Anzahl der Eier durch die Berechnung der Fläche-Dichte-Verhältnis: zählen Eier in einem gedruckten 5 x 5 mm 2 Raster, um die Ei-Dichte zu berechnen, messen Sie die Oberfläche, die mit Eiern von ImageJ bedeckt ist, Und schätzen die Gesamtzahl der Eier von der obigen Dichte pro Einheit und Fläche. Die oben genannte Oberflächenbereichsmessmethode von ImageJ wird im Folgenden erläutert: Set scale ... (Research Services Branch, https://imagej.nih.gov/ij/docs/menus/analyze.html); Es erklärt, wie man die räumliche Skala des Bildes definiert; Verwenden von ImageJ zur Messung der Oberfläche (Keene State College, AcademicTechnologie, https://dept.keene.edu/at/2011/04/15/by-matthew-ragan/).
HINWEIS: Wenn Eier transparent sind, ist das schwarze wasserdichte Blatt für die automatische Zählmethode besser geeignet, da ImageJ den Umriß von Eiern individuell erkennen kann.
- Andernfalls, wenn Eier dicht abgeschieden werden, schätzen Sie die Anzahl der Eier durch die Berechnung der Fläche-Dichte-Verhältnis: zählen Eier in einem gedruckten 5 x 5 mm 2 Raster, um die Ei-Dichte zu berechnen, messen Sie die Oberfläche, die mit Eiern von ImageJ bedeckt ist, Und schätzen die Gesamtzahl der Eier von der obigen Dichte pro Einheit und Fläche. Die oben genannte Oberflächenbereichsmessmethode von ImageJ wird im Folgenden erläutert: Set scale ... (Research Services Branch, https://imagej.nih.gov/ij/docs/menus/analyze.html); Es erklärt, wie man die räumliche Skala des Bildes definiert; Verwenden von ImageJ zur Messung der Oberfläche (Keene State College, AcademicTechnologie, https://dept.keene.edu/at/2011/04/15/by-matthew-ragan/).
Ergebnisse
Nach den oben genannten Methoden wurden 41, 15 und 96 Personen von T. marinae im April 2014, 2015 und 2016, jeweils Offshore von Amami Oshima, Kagoshima-Präfektur, Japan ( Tabelle 1 ) gesammelt. In jedem Fall lebten 25 (61%), 14 (93%) und 91 (95%) Personen bis zur Hinterlegung von Eiern im Aquarium. Wie in Fukuda et al . 3 , nur ein Fisch starb vor dem Ende der Beobachtungsperiode im Jahr 2014, und Fisch Laichen sonst schien zu beginnen, 7 Tage nach der Gefangennahme, zeigt, dass die Einzelpersonen wurden unter guten Bedingungen aufgezogen.
Die VIE-Tags waren sichtbar und erlaubten die Identifizierung der Individuen auch in diesem kleinen Fisch ( Abbildung 4A , 4B ). Ein Foto von Eiern, die auf einem wasserdichten Blatt abgelegt sind, ist in Fig. 4C gezeigt , was beweist, daßSie waren sichtbar genug, um gezählt zu werden. Nachdem es entfernt und fotografiert worden war, wurde das Blatt zu seinem früheren Platz im Aquarium zurückgebracht, und der Nesting-Mann setzte sofort die väterliche Sorge fort ( Abbildung 4D ).
Gemeinsam können diese Techniken in Experimenten eingesetzt werden, die darauf abzielen, die sozialen Interaktionen und den Fortpflanzungserfolg aller einzelnen Fische aufzuzeichnen. Speziell haben Fukuda et al. 3 untersuchte die Fortpflanzungsökologie von T. marinae in Aquarien unter Verwendung der obigen Methoden. Die Ergebnisse zeigten eine positive Korrelation zwischen weiblicher Fruchtbarkeit und weiblicher Körpergröße ( Abbildung 5 ), während bei den unterschiedlich großen Männchen kein Unterschied im Fortpflanzungserfolg beobachtet wurde ( Abbildung 6 ). Auch T. marinae neigte dazu, ein kontinuierliches Fortpflanzungspaar zu etablieren und die meisten Laichen traten in diesen aufPaare ( Tabelle 2 ). Nur männliche T. marinae wurden beobachtet, um väterliche Eierpflege durchzuführen. Die aggressive Wechselwirkung zwischen Individuen schlug vor, dass das monogame Paarungssystem von vor allem weiblichen Mate-Bewachungen entstehen kann.
| Sammeltag | Einzugstiefe | Sammelmethode | Anzahl der gesammelten Personen | Dauer bleiben | Verkehrstag | Anzahl der toten Personen | Überlebensrate | ||
| Surfen | Transport | Akklimatisierung | |||||||
| 15 APril 2014 | - 21 m | Oberfläche mit Fisch bis Oberfläche. | 41 | Über Nacht | 16. April 2014 | 16 | 0 | 0 | 61% |
| 23. April 2015 | - 19 m | Oberfläche mit Fisch bis 12 m Tiefe, bis Seil bis zur Oberfläche hochziehen. | 15 | 1 Tag | 25. April 2015 | 1 | 0 | 0 | 93% |
| 26. April 2016 | - 21 m | Oberfläche mit Fisch bis 15 m Tiefe, ziehe bis Seil bis zur Oberfläche. | 96 | 1 Tag | 28. April 2016 | 4 | 1 | 0 | 95% |
Tabelle 1: Sammelbedingungen und Fischüberlebensrate. Die Anzahl der Toten zeigt an, wann und wie viele einzelne Fische gestorben sind.

Tabelle 2: Laichenpaare während des Aufzuchtversuchs. M , individuelle Identität (ID) von Männern; F , ID der Frauen; Unterstrichene ID , eine ausgebildete Frau; Umrissene ID , eine Frau, die mit einem Mann zusammenhing, obwohl sie nicht ein kontinuierliches Paar etablierten. Diese Ergebnisse zeigen, dass T. marinae dazu neigen, ein kontinuierliches Fortpflanzungspaar als Teil eines monogamen Paarungssystems zu etablieren. Diese Tabelle wurde von Fukuda et al. 3 Klicken Sie hier, um diese Tabelle herunterzuladen.
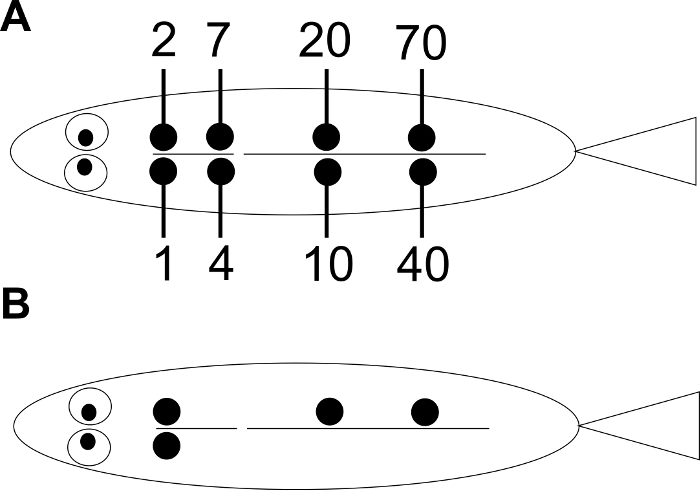
Abbildung 1: Anordnung der VIE-Tagging-Positionen. ( A ) Jede Ziffer zeigt die nuMber entsprechend der Position der Injektion. Die Identitätsnummer eines einzelnen Fisches wird durch Anpassen der Position (en) der Etiketten bestimmt. ( B ) Ein Beispiel für den einzelnen Fisch Nr. 93.

Abbildung 2: Eine Ansicht, die die chirurgische Tabelle darstellt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 3: Manuelle und automatische Eierzählung mit ImageJ. ( A ) Manuelles Zählen mit Cell Counter Plugin Dieses Plugin ermöglicht es, Eier zu zählen, die von einer Unterteilung gruppiert sind. Es ist ein Beispiel, welches EiS wurden in vier Gruppen unterteilt und gezählt. ( B ) Automatische Eierzählung. ( C ) Bild, das das automatische Eierzählbild und das Originalbild zusammengeführt wurde. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 4: Repräsentative individuelle Identifizierung durch Injizieren von T. marinae mit VIE-Tags und Verwendung eines wasserdichten Blattes für Zähl-Eier, die auf der künstlichen Laichstelle deponiert sind. ( A ) Individuelle Nr. 1, identifiziert durch das rosa VIE-Tag; Ein weißer Pfeil zeigt den eingegebenen VIE-Tag an. ( B ) Individuelle Nr. 11, identifiziert durch die beiden grünen VIE-Tags; Die weißen Pfeile zeigen dieInjizierte VIE-Tags. ( C ) Gebratene Eier auf einem wasserdichten Blatt. ( D ) Die väterliche Pflege, die von einem Mann wieder aufgenommen wurde, nachdem das Blatt mit Eiern entfernt und fotografiert worden war, und dann wieder in das Aquarium gebracht. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 5. Beziehung zwischen Kupplungsgröße und weiblicher Körpergröße (Gesamtlänge) in T. marinae . Solide Kurve , geschätzte Fruchtbarkeit in jeder Größe Gruppe von Frauen, die mit einem generalisierten linearen Mixed-Effects-Modell erhalten. Diese Ergebnisse zeigen, dass der weibliche Fortpflanzungserfolg mit der Körpergröße zunahm (Pearson-Korrelation, r = 0,56, P <0,05, n = 1 6). Diese Figur wurde von Fukuda et al. 3 Klicken Sie hier, um eine größere Version dieser Figur zu sehen.
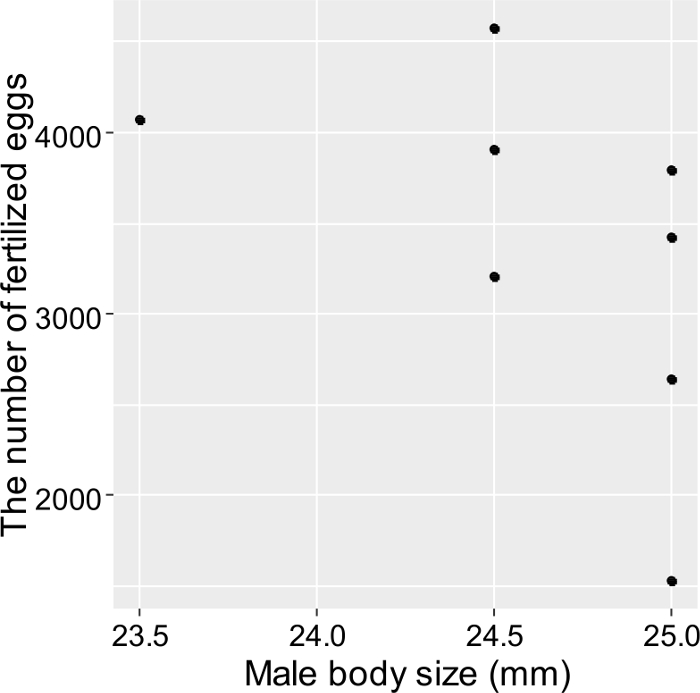
Abbildung 6. Beziehung zwischen geschätztem Paarungs-Erfolg und männlicher Körpergröße (Gesamtlänge) in T. marinae . Jedes Datenelement wurde aus der Reproduktionshäufigkeit von Männern und der geschätzten Fruchtbarkeit von Frauen geschätzt. Diese Ergebnisse zeigen, dass Männer unabhängig von ihrer Körpergröße reproduktiv erfolgreich waren (Pearsons Korrelation, r = ˗0,51, P > 0,05, n = 8). Diese Figur wurde von Fukuda et al. 3_upload / 55964 / 55964fig6large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Die Fortpflanzungsökologie zahlreicher Fische wurde oft durch experimentelle Aufzucht aufgedeckt. Vor allem, Geschlechtswechsel 6 , 8 , 14 , mate Wahl 15 , 16 und intraspezifische Konkurrenz 7 , 17 wurden häufig Themen der detaillierten Untersuchungen mit Aquarium gehaltenen Fisch. Darüber hinaus wurden einige Ergebnisse, die in Aquarien beobachtet wurden, später im Feld 8 , 18 bestätigt . Diese Ergebnisse unterstützen den Nutzen und die Glaubwürdigkeit der Aufzucht-Experimente mit wild gefangenen Fischen in Aquarien. Darüber hinaus lohnt sich die Manipulation durch Aufzuchtversuche, die Situationen simulieren, die natürlich, aber nur selten in wilden Zuständen auftreten können, als Vorstufe für größere Felduntersuchungen sinnvoll.
Der proTocol beschreibt Methoden, die für einen kleinen Substrat-Spawner geeignet sind, der Klebe-Eier ablegt. Große Unterschiede in den optimalen Bedingungen für Aquarium gehaltenen Fische können unter den Arten erwartet werden, so dass Anpassungen an einigen Punkten des Protokolls. Insbesondere sollten nach einer vorläufigen Beurteilung der jeweiligen Studienarten fünf Punkte des Protokolls für die Anpassung berücksichtigt werden: (1) die Zeit, die der Fisch aufgetreten ist, in Protokoll 1.4; (2) die Konzentration der Anästhesieflüssigkeit und die Zeit, die in der Anästhesie unmittelbar vor der Injektion des VIE-Tags in den Protokollen 3.1.3 bzw. 3.1.5 verbracht wurde; (3) die Einzugstiefe der Nadel bei der Injektion des VIE-Tags in den Fisch, in Protokoll 3.1.8; (4) die Größe und Form des PVC-Rohres, das als künstlicher Nistplatz verwendet wird, in Protokoll 3.2.1; Und (5) unter Verwendung von drei Eierzählverfahren richtig, in Protokoll 4.6: manuelle Zählung (genau aber braucht Zeit und Mühe), automatische Zählung und Flächen-Dichte-Verhältnis Schätzung (effizient, aber rau). Wenn thEre sind wenige Eier, oder wenn das Zählen, das durch eine Unterteilung gruppiert wird, benötigt wird (wie tot oder lebendig, entwicklungsbasierte Klassifikation und so weiter), wird die manuelle Zählmethode empfohlen. Wenn es eine große Anzahl von Eiern gibt und das ImageJ jedes Ei individuell unterscheiden kann, kann das automatische Zählverfahren geeignet sein. Die Schätzung der Flächen-Dichte-Verhältnis ist wirksam, wenn es viele und dichte Eier gibt und das ImageJ jedes Ei nicht einzeln unterscheiden kann.
Viele Fischarten können ihren Auftrieb nicht vollkommen beibehalten, nachdem sie an die Oberfläche gebracht wurden. Allerdings können sorgfältige Oberflächen nach diesem Protokoll können die meisten Fische innerhalb eines Tages zu erholen. Wenn Fische in der Sammelbeutel kurz nach dem Auftauchen auf den Kopf gestellt werden, warten Sie, um festzustellen, ob der Fisch mindestens einen Tag tot ist, bevor er ihn entfernt hat. Wenn Fische bald sterben, nachdem sie an die Oberfläche gebracht worden sind oder wenn sie mehr als einen Tag brauchen, um sich zu erholen, die Oberfläche langsamer oder verlängern eaCh Zeitintervall während des Auftauchens im Zuge der anschließenden Sammelanstrengungen
Zusätzlich zu den VIE-Tags gibt es noch andere Methoden zur Identifizierung von einzelnen Fischen: farbige externe Kunststoff-Streamer, Nylon-Anker-Tags, Flossen-Clipping und passive integrierte Transponder (PIT) -Tags, etc. Allerdings, vor allem beim Sammeln von kleinen Fischen, können einige dieser Techniken die Sterblichkeit erhöhen, das Wachstum behindern oder in situ nicht sichtbar sein . 10 Da die meisten äußeren Etiketten aus dem Fischkörper hervorstehen, kann ein Etikett einige Verhaltensweisen von Arten einschränken, die in Höhlen, schmalen Felsspalten oder dichten Algenbetten bewohnen. Im Gegensatz dazu fanden viele Studien von kleinen Fischen, dass VIE-Tagging keine größeren negativen Auswirkungen auf die Mortalität und das Wachstum 10 , 11 hatte . VIE-Tags können auch vernachlässigbar das Fischverhalten beeinflussen, da das subkutane Etikett nicht vorspringt, so klein der Fisch ist, was ihn besonders gut machtIdentifikationsmethode für Verhaltensbeobachtungen kleinerer Arten 10 . Nach einigen früheren Studien können die Acrylfarben auch in gleicher Weise wie die VIE-Tags 19 , 20 verwendet werden .
Künstliches Laichnest wird im Allgemeinen für die Untersuchung der Reproduktion von Fischen verwendet, die die demersalen Klebstoff-Eier hervorbringen. Frühere Studien verwendeten künstliche Nester, die aus verschiedenen Arten von Materialien hergestellt sind, wie die Terrakotta-Dachziegel 21 , die Keramikfliese 22 , die Schale 23 , die PVC-Box 24 usw. Diese künstlichen Laichnester können für viele Substrat-Spawner nützlich sein. Diese Studien deuten darauf hin, dass die Verfügbarkeit des künstlichen Nestes für Fische, wie die Form und / oder Größe, wichtiger ist als das, aus dem es gemacht wird. Da das PVC-Rohr das Material ist, das leicht zu erhalten und zu verarbeiten ist,Dieses Papier verwendete das PVC-Rohr als das Laichnest.
Die Grenzen der ökologischen Informationen, die durch gefangene Beobachtungen gewonnen wurden, sollten gut geschätzt werden. Überraschenderweise beschränkt die Aufzucht von Aquarien im Vergleich zu einer natürlichen Umwelt der Arten verschiedene ökologische Bedingungen des aquatischen Lebensraums ( z. B. physikalische und chemische Eigenschaften des Wassers, Lebensmittelökologie, Möglichkeiten für intra- und interspezifische Interaktionen, Lebensraumausmaß, Und Bevölkerungsdichte). Es kann dazu führen, dass Einzelpersonen bestimmte Verhaltensweisen aufweisen, die sich von ihren natürlichen unterscheiden. Daher sollten Felduntersuchungen die Aufzuchtbeobachtungen ergänzen, um so den besten Hintergrund zu schaffen, um die adaptive Entwicklung der Reproduktionsverhalten des Fisches zu schließen.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Wir danken S. Yokoyama für die Unterstützung beim Sammeln von Fischen. Wir sind auch dankbar für W. Kawamura für hilfreiche Beratung über Aufzucht Methoden. Diese Studie wurde von der Japanischen Gesellschaft für die Förderung der Wissenschaft (KAKENHI) durch Stipendien (Nr. 24370006 und 16K07507), die an TS vergeben wurden, unterstützt
Materialien
| Name | Company | Catalog Number | Comments |
| Hand net | Nisso | AQ-17 | Select for the target species size. |
| Polyethylene bag | San-U Fish Farm | 8194 | |
| Rubber band | ESCO Co. LTD. | 78-0420-64 | ø 80 mm x 6 mm |
| Oxygen cylinder | N/A | N/A | Oxgen cylinder for diving equipment suits. |
| Elbagin | Japan Pet Design Co. Ltd. | 75950 | Pafurazine F (provided from same company) is equivalent drug to Elbagin. |
| Polystyrene foam box | N/A | N/A | |
| Pipette | AS ONE | 1-8625-04 | |
| Rope | Mizukami Kinzoku Co. LTD. | 95301601 | |
| Weight | N/A | N/A | Weight for diving equipment suits. |
| Water tank | N/A | N/A | |
| Air pump | KOTOBUKI | 4972814 062115 | |
| Air stone | KOTOBUKI | 4972814 232204 | |
| 2-Methylquinoline | Wako | 170-00376 | |
| Ethanol (99.5) | Wako | 057-00456 | |
| Visible implant elastomer tag kit | Northwest Marine Technology | N/A | http://www.nmt.us/products/vie/vie.shtml |
| Soft sponge | N/A | N/A | |
| PVC board | N/A | N/A | 0.3 mm thickness is easy to use. |
| Petri dish | N/A | N/A | A large one, such as ø 160 mm and 30 mm depth, is convenient for the injection of the VIE tag. |
| Transparent acrylic board | N/A | N/A | |
| UVA filtered light | N/A | N/A | |
| PVC pipe | N/A | N/A | ø 5 cm |
| Waterproof sheet | SOMAR Corp. | 3EKW03 | The film for the plain copier. |
| Sand | N/A | N/A | |
| Stereo microscope | N/A | N/A | |
| Camera | N/A | N/A |
Referenzen
- Helfman, G., Collette, B. B., Facey, D. E., Bowen, B. W. The Diversity of Fishes: Biology, Evolution, and Ecology. , Wiley-Blackwell. Oxford. (2009).
- Davies, N. B., Krebs, J. R., West, S. A. An Introduction to Behavioural Ecology. , 4th ed, Wiley-Blackwell. Oxford. (2012).
- Fukuda, K., Manabe, H., Sakurai, M., Dewa, S., Shinomiya, A., Sunobe, T. Monogamous mating system and sexuality in the gobiid fish, Trimma marinae (Actinopterygii: Gobiidae). J Ethol. 35 (1), 121-130 (2017).
- Manabe, H., Matsuoka, M., Goto, K., Dewa, S., Shinomiya, A., Sakurai, M., Sunobe, T. Bi-directional sex change in the gobiid fish Trimma sp.: does size-advantage exist? Behaviour. 145 (1), 99-113 (2008).
- Sakurai, M., Nakakoji, S., Manabe, H., Dewa, S., Shinomiya, A., Sunobe, T. Bi-directional sex change and gonad structure in the gobiid fish Trimma yanagitai. Ichthyol Res. 56 (1), 82-86 (2009).
- Sunobe, T., Nakazono, A. Sex change in both directions by alteration of social dominance in Trimma okinawae (Pisces: Gobiidae). Ethology. 94 (4), 339-345 (1993).
- Wong, M. Y., Munday, P. L., Buston, P. M., Jones, G. P. Monogamy when there is potential for polygyny: tests of multiple hypotheses in a group-living fish. Behav Ecol. 19 (2), 353-361 (2008).
- Kuwamura, T., Suzuki, S., Tanaka, N., Ouchi, E., Karino, K., Nakashima, Y. Sex change of primary males in a diandric labrid Halichoeres trimaculatus: coexistence of protandry and protogyny within a species. J Fish Biol. 70 (6), 1898-1906 (2007).
- Winterbottom, R. Two new species of the Trimma tevegae species group from the Western Pacific (Percomorpha: Gobiidae). Aqua J Ichthyol Aquat Biol. 10, 29-38 (2005).
- Frederick, J. L. Evaluation of fluorescent elastomer injection as a method for marking small fish. Bull Mar Sci. 61 (2), 399-408 (1997).
- Olsen, E. M., Vøllestad, L. A. An evaluation of visible implant elastomer for marking age-0 brown trout. N Am J Fish Manag. 21 (4), 967-970 (2001).
- Leblanc, C. A., Noakes, D. L. Visible implant elastomer (VIE) tags for marking small rainbow trout. N Am J Fish Manag. 32 (4), 716-719 (2012).
- Kinkel, M. D., Eames, S. C., Philipson, L. H., Prince, V. E. Intraperitoneal injection into adult zebrafish. J Vis Exp. (42), e2126(2010).
- Reavis, R. H., Grober, M. S. An integrative approach to sex change: social, behavioural and neurochemical changes in Lythrypnus dalli (Pisces). Acta Ethol. 2 (1), 51-60 (1999).
- Milinski, M., Bakker, T. C. Female sticklebacks use male coloration in mate choice and hence avoid parasitized males. Nature. 344, 330-333 (1990).
- Basolo, A. L. Phylogenetic evidence for the role of a pre-existing bias in sexual selection. Proc R Soc Lond B Biol Sci. 259 (1356), 307-311 (1995).
- Milinski, M. Optimal forging: the influence of intraspecific competition on diet selection. Behav Ecol Sociobiol. 11 (2), 109-115 (1982).
- Manabe, H., Ishimura, M., Shinomiya, A., Sunobe, T. Field evidence for bidirectional sex change in the polygynous gobiid fish Trimma okinawae. J Fish Biol. 70 (2), 600-609 (2007).
- Stammler, K. L., Corkum, L. D. Assessment of fish size on shelter choice and intraspecific interactions by round gobies Neogobius melanostomus. Environ Biol Fishes. 73 (2), 117-123 (2005).
- Matsumoto, Y., Tawa, A., Takegaki, T. Female mate choice in a paternal brooding blenny: the process and benefits of mating with males tending young eggs. Ethology. 117 (3), 227-235 (2011).
- McCormick, M. I. Behaviorally induced maternal stress in a fish influences progeny quality by a hormonal mechanism. Ecology. 79 (6), 1873-1883 (1998).
- Knaepkens, G., Bruyndoncx, L., Coeck, J., Eens, M. Spawning habitat enhancement in the European bullhead (Cottus gobio), an endangered freshwater fish in degraded lowland rivers. Biodivers Conserv. 13 (13), 2443-2452 (2004).
- Shiogaki, M., Dotsu, Y. The life history of the gobiid fish, Zonogobius boreus. Bulletin of the Faculty of Fisheries, Nagasaki University. 37, 1-8 (1974).
- Meunier, B., Yavno, S., Ahmed, S., Corkum, L. D. First documentation of spawning and nest guarding in the laboratory by the invasive fish, the round goby (Neogobius melanostomus). J Great Lakes Res. 35 (4), 608-612 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten