Method Article
Um método para testar a eficácia do lavagem das mãos para a remoção de patógenos infecciosos emergentes
Neste Artigo
Resumo
O lavagem das mãos é amplamente recomendado para prevenir a transmissão de doenças infecciosas. No entanto, há pouca evidência sobre o qual os métodos de lavagem das mãos são mais eficazes na remoção de patógenos das doenças infecciosas. Desenvolvemos um método para avaliar a eficácia dos métodos de lavagem das mãos na remoção de microorganismos.
Resumo
O lavagem das mãos é amplamente recomendado para prevenir a transmissão de doenças infecciosas. No entanto, existem poucas evidências comparáveis sobre a eficácia dos métodos de lavagem das mãos em geral. Além disso, poucas evidências existem comparando os métodos de lavagem das mãos para determinar quais são os mais eficazes na remoção de agentes patogênicos infecciosos. A pesquisa é necessária para fornecer evidências para as diferentes abordagens para o lavagem das mãos que podem ser empregadas durante os surtos de doenças infecciosas. Aqui, descreve-se um método de laboratório para avaliar a eficácia dos métodos de lavagem das mãos na remoção de microorganismos nas mãos e sua persistência na água de enxágüe. As mãos dos voluntários são primeiro cravadas com o organismo de teste e depois lavadas com cada método de interesse para a lavagem das mãos. Geralmente, os microorganismos de substituição são usados para proteger seres humanos da doença. O número de organismos que permanecem nas mãos dos voluntários após a lavagem é testado usando um método modificado de "suco de luva": as mãos são colocadas em luvas com um eluE são lavados para suspender os microorganismos e torná-los disponíveis para análise por filtração por membrana (bactérias) ou teste de placa (vírus / bacteriófagos). O enxágüe produzido a partir do lavagem das mãos é coletado diretamente para análise. A eficácia da lavagem das mãos é quantificada comparando o valor de redução do log entre as amostras colhidas após o lavagem das mãos às amostras sem lavagem das mãos. A persistência da água de enxaguamento é quantificada comparando amostras de água de enxágüe de vários métodos de lavagem das mãos com amostras coletadas após o lavagem das mãos com apenas água. Embora este método seja limitado pela necessidade de usar organismos de substituição para preservar a segurança de voluntários humanos, ele captura aspectos do lavagem das mãos que são difíceis de replicar em um estudo in vitro e preenchem lacunas de pesquisa sobre a eficácia da lavagem das mãos e a persistência de organismos infecciosos no enxaguamento agua.
Introdução
O lavagem das mãos é amplamente recomendado para prevenir a propagação da doença, particularmente aquelas transmitidas pela via fecal-oral ou aérea, incluindo doenças diarréicas e respiratórias 1 . Surpreendentemente, há pouca evidência comparável sobre a eficácia dos métodos de lavagem das mãos, como o lavagem das mãos com água e sabão (HWWS) e com desinfetante para uso com base em álcool (ABHS), na remoção de organismos das mãos. Pesquisas iniciais descobriram que a ação mecânica do lavagem das mãos, em oposição ao método de lavagem das mãos, pode explicar a remoção do organismo 2 , 3 . Além disso, há pouca evidência comparativa sobre o qual o método de lavagem das mãos é mais eficaz. Em uma revisão informal da literatura, foram identificados 14 estudos que compararam a eficácia do sabão e desinfetante de mão na remoção de organismos. Destes estudos, cinco encontraram ABHS para ser mais eficaz 4 , 5 , 6 , 7 , 8 , sete encontraram HWWS para serem mais eficazes 9 , 10 , 11 , 12 , 13 , 14 , 15 e dois não encontraram diferença significativa entre os métodos 16 , 17 . Esses achados são inconsistentes e não abordam o risco contínuo de doença pela persistência de organismos na água de enxágue após o lavagem das mãos. Em geral, a evidência sobre a eficácia comparativa dos métodos de lavagem das mãos para a remoção de patógenos causadores de doenças infecciosas é limitada.
Esta evidência limitada levou à incerteza sobre quais métodos são mais apropriados nas configurações de surto. Por exemplo, Durante o surto da doença do vírus Ebola (EVD) na África Ocidental de 2013 a 2016, vários grandes respondentes internacionais forneceram recomendações contraditórias para HWWS, ABHS ou 0,05% de soluções de cloro. Médicos Sem Fronteiras (MSF) recomenda o uso de solução de cloro 0,05% para o lavagem das mãos, enquanto a Organização Mundial de Saúde (OMS) recomenda HWWS ou ABHS (se as mãos não estiverem visivelmente sujas). A OMS chega a afirmar que o cloro não deve ser utilizado a menos que haja outras opções disponíveis, pois é menos eficaz do que outros métodos devido à demanda de cloro exercida pela pele 18 , 19 , 20 , 21 , 22 . Além disso, as soluções de cloro são comumente produzidas a partir de quatro compostos de cloro diferentes, incluindo hipoclorito de alto teste (HTH), hipoclorito de sódio estabilizado e estabilizado (NaOCl) e sodIum dicloroisocianurato (NaDCC). Uma revisão sistemática encomendada pela OMS em resposta ao surto EVD na África Ocidental recentemente encontrou apenas quatro estudos que investigaram a eficácia comparativa do lavagem das mãos com cloro 23 . Esses estudos também produziram resultados contraditórios, e nenhum desses estudos usou a concentração recomendada de cloro de 0,05% para lavagem das mãos ou microorganismos investigados semelhantes ao vírus Ebola 10 , 24 , 25 , 26 , 27 . Assim, as recomendações não foram encontradas baseadas em evidências, e não ficou claro quais recomendações foram mais eficazes.
É necessária uma pesquisa adicional para comparar as abordagens de lavagem das mãos para prevenir a propagação de agentes patogênicos infecciosos, pois as intervenções de lavagem das mãos são uma ferramenta importante para prevenir a transmissão da doença epidêmica. Estes hAs recomendações de lavagem devem ser baseadas em evidências. Assim, um método para testar a eficácia da lavagem das mãos e a persistência da água de enxaguamento, realizada com substitutos ou patógenos não infecciosos, foi desenvolvido 2 , 28 , 29 . Os resultados das amostras, utilizando Phi6 como substituto do vírus Ebola e utilizando Escherichia coli como organismo indicador comum, são apresentados aqui. Neste protocolo, são apresentados os testes de resistência à lavagem das mãos e de enxaguamento de água.
Protocolo
Declaração de ética: o estudo descrito aqui (em Phi6 e E. coli como substitutos para Ebola) foi aprovado pelo Conselho de Revisão Institucional no Tufts Medical Center e Tufts University Health Sciences Campus (# 12018); A Universidade de Harvard cedeu uma revisão ao Tutts Institutional Review Board.
NOTA: Antes de iniciar este protocolo, duas etapas devem ser concluídas. Em primeiro lugar, deve ser identificada e selecionada uma versão de substituição de nível de biossegurança 1 (BSL-1) ou não infecciosa do patógeno a ser estudado que é seguro para uso em seres humanos. Um patógeno substituto BSL-1 ou não infeccioso é necessário para este protocolo, pois o organismo será usado para inocular as mãos de voluntários humanos. Em segundo lugar, a aprovação do Conselho de Revisão Institucional local para realizar pesquisas com sujeitos humanos deve ser obtida antes de recrutar voluntários ou iniciar o experimento. Muitos aspectos deste protocolo podem ser ajustados para atender aE necessidades específicas das questões de interesse de interesse.
1. Recrutar assuntos humanos elegíveis
- Recupere voluntários publicando folhetos em painéis publicitários e enviando e-mails para grupos com membros que possam estar interessados em participar. Esses anúncios devem incluir o objetivo do estudo, informações de contato e critérios de elegibilidade.
- Conheça os voluntários para avaliar a elegibilidade. Confirme que os voluntários são saudáveis, com idades compreendidas entre os 18 e os 65 anos, e não estão atualmente grávidas ou estão tomando antibióticos e que não apresentam dano / distúrbios cutâneos, alergias conhecidas aos agentes de lavagem das mãos ou história de problemas de saúde mental relacionados à higiene.
- Tenha voluntários elegíveis para ler os formulários de consentimento. Responda a qualquer pergunta que eles colocam e peça ao voluntário e ao investigador que assinem duas cópias do formulário. Mantenha um formulário e forneça um ao voluntário.
- Administrar uma pesquisa de linha de base, incluindo perguntas sobre informações demográficas, pessoaHistória de condições de pele e informações sobre o comportamento recente de lavagem das mãos. Examine as mãos para sinais de dermatite, lesões cutâneas ou anormalidades cutâneas iniciais 31 .
- Agende os voluntários para duas sessões de teste para cada organismo de interesse (um para teste com carga de solo e outro para teste sem). Instrua os voluntários para evitar produtos antimicrobianos durante um período de lavagem de sete dias antes do teste para evitar confusão com o uso pessoal do produto.
- Forneça voluntários com produtos antimicrobianos (shampoo, condicionador e sabão) para usar no lugar de seus produtos usuais. Forneça luvas de vinil pesadas e instrua os sujeitos a usá-los ao usar produtos como produtos de limpeza de casas.
2. Prepare soluções de lavagem de mãos comumente usadas em resposta de emergência (sabão, ABHS, 0,05% HTH, NaDCC e NaOCl Solutions)
NOTA: soluções de cloro podem ser preparadas Até 12 h antes do experimento, mas irá degradar se armazenado> 12 h.
- Escolha e compre um sabão relevante para o contexto para o qual o teste está sendo realizado.
NOTA: Na maioria dos casos, para emergências de doenças infecciosas no mundo em desenvolvimento, esta será uma barra de sabão. - Escolha e compre uma solução ABHS relevante para o contexto para o qual o teste está sendo realizado.
NOTA: O ABHS escolhido deve ter um contexto de álcool etílico maior ou igual a 70% para garantir a eficácia. - Prepare uma solução de hipoclorito de cálcio (Ca (ClO) 2 ) a 0,05%, adicionando pó granular de Ca (ClO) 2 a água ultrapura. Determine a quantidade de solução necessária com base no número de assuntos a serem testados.
- Usando a seguinte equação, determine a quantidade de pó necessária para preparar a quantidade desejada de solução em um determinado volume de água usando uma porcentagem dada de cloro disponível:
/files/ftp_upload/55604/55604eq1.jpg "/>
NOTA: O pó de Ca (ClO) 2 tem tipicamente 60 a 80% de cloro disponível.
- Usando a seguinte equação, determine a quantidade de pó necessária para preparar a quantidade desejada de solução em um determinado volume de água usando uma porcentagem dada de cloro disponível:
- Prepare uma solução de dicloroisocianurato de sódio a 0,05% (NaDCC), adicionando um pó granulado de NaDCC a água ultrapura.
- Usando a seguinte equação, determine a quantidade de pó necessária para preparar a quantidade desejada de solução em um determinado volume de água usando uma porcentagem dada de cloro disponível:
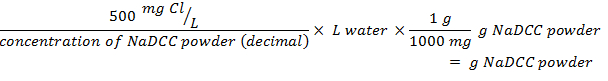
NOTA: O pó de NaDCC tipicamente possui cerca de 50% de cloro disponível.
- Usando a seguinte equação, determine a quantidade de pó necessária para preparar a quantidade desejada de solução em um determinado volume de água usando uma porcentagem dada de cloro disponível:
- Prepare uma solução estabilizada de NaOCl a 0,05% adicionando solução de hipoclorito de sódio a água ultrapura.
- Confirme a concentração da solução de reserva de NaOCl (provavelmente 5-8%) usando um método de avaliação de titulação de acordo com as instruções do fabricante ( por exemplo, titulação iodométrica, veja a Lista de Materiais para o SuKit gestiado).
- Usando os resultados do método de teste, calcule a quantidade de solução para adicionar à água usando a seguinte equação:

- Prepare uma solução estabilizada de NaOCl a 0,05%, adicionando solução de hipoclorito de sódio produzida usando um eletroclorador, água ultrapura e cloreto de sódio de laboratório (NaCl) para água ultrapura.
- Prepare uma solução de cloro a 1% com água ultrapura e NaCl, usando um eletroclorador de acordo com as instruções do fabricante.
- Use um método de teste de titulação ( por exemplo, titulação iodométrica) para confirmar a concentração da solução de reserva de NaOCL 32 .
- Usando os resultados do teste, calcule a quantidade de solução para adicionar à água usando a seguinte equação:

- Confirme o cOncentração de cada uma das soluções de cloro para lavagem das mãos usando um método de titulação ( por exemplo, titulação iodométrica) e ajuste as soluções adicionando água ou pó de fonte de cloro / solução até que estejam dentro de um erro de 10% da concentração alvo (0,045-0,055%).
3. Prepare Organismos e Carga do Solo e Combine para Produzir o Inoculado
NOTA: Nas seguintes sub-seções, E. coli e Phi6 são usadas como amostra de organismos bacterianos e virais para a descrição dos métodos.
- Prepare o organismo a ser utilizado para testar em uma concentração superior a 10 x 10 8 CFU / mL para bactérias e maior que 10 x 10 7 PFU / mL para vírus.
- Para preparar E. coli , trace uma estirpe não-patogénica de E. coli em placas de agar Luria-Bertani (LB) e incuba a 37 ° C durante 24 h para obter colónias individuais. Armazenar a 4 ° C.
NOTA: isso pode ser feito separarDias antes da experimentação.- Um dia antes do início do experimento, coloque uma única colônia da placa e inocule 10 mL de caldo LB usando um loop estéril. Incubar durante a noite a 37 ° C com agitação.
- Na manhã do experimento, comece uma cultura fresca, adicionando 1 mL da cultura durante a noite a 20 mL de caldo LB fresco. Incubar durante aproximadamente 2,5 h para atingir uma densidade celular superior a 10 8 CFU / mL.
- Use um espectrofotômetro para estimar a concentração da cultura.
NOTA: use um fator de conversão previamente estabelecido de uma curva de padrões para a estirpe de E. coli utilizada, garantindo uma concentração superior a 10 8 CFU / mL 33 . Se a densidade celular não for alta o suficiente, devolver a cultura à incubadora e testar novamente até estar pronta.
- Confirme a concentração usando filtragem de membrana 34 .
NOTA: Execute diluições em série oF a cultura em solução salina tamponada com fosfato (PBS) para que a solução filtrada produza um número contável de colônias na placa (o número exato dependerá do meio utilizado).- Configure uma chama e um colector de filtração com funis de filtração estéril e uma conexão a vácuo. Estirolize fórceps incendiando-os com etanol. Use-os para colocar um filtro de 0,45 μm no colector de filtração, com a grade voltada para cima. Molhar o filtro com uma pequena quantidade de PBS estéril.
- Coloque o funil na base e adicione a solução de amostra a ser processada por pipetagem ou derramando diretamente sobre o filtro. Engage o vácuo até que toda a amostra tenha passado pela membrana. Enxaguar os lados do funil com PBS estéril e engatar novamente o aspirador.
NOTA: As amostras devem ter pelo menos 100 μL e até 100 mL. Se uma amostra for inferior a 10 mL, adicione aproximadamente 20 mL de PBS ao funil de filtração antes da filtragem para garantir a filtração uniforme do sampLe. - Remova o funil, esterilize a chama e coloque o filtro na base. Coloque o filtro suavemente no agar LB em uma placa de Petri, com a grade voltada para cima, garantindo que o filtro fique nivelado contra a superfície. Inverta as placas e incube durante 24 h a 37 ° C.
- Após 24 h, retire as placas da incubadora e conte as colônias de E. coli . Use estes dados e o conhecido fator de diluição e volume da solução para calcular a concentração da solução filtrada em CFU / mL.
- Propagar Phi6 no hospedeiro Pseudomonas syringae usando o método de sobreposição de agar dupla 35 .
- Adicione 100 μL de suspensão de estoque de Phi6 e 100 μL de proteína de P. syringae durante a noite diretamente a 6 mL de agar macio Nutrient Broth Yeast (NBY) (0,3%). Deite-o sobre placas com agar duro NBY (1,5%) e incube durante a noite a 26 ° C. Prepare placas suficientes para produzir suficiente inoculo para a experiênciaEstimando um rendimento de aproximadamente 4 mL de suspensão viral por placa.
- No dia seguinte, adicione 5 mL de PBS em cima da camada de agar macio. Deixe-o à temperatura ambiente durante 4 h, recupere-o com uma pipeta e filtre-o usando um filtro de 0,45 μm. Armazenar a 4 ° C.
NOTA: Esta solução servirá como inoculação viral.
- Use um ensaio de placa para confirmar que a concentração é superior a 10 7 PFU / mL 35 . Execute diluições em série da suspensão viral em PBS, de modo que 100 μL produzem um número contável de placas na placa.
- Pipetar 100 μL de uma amostra diluída apropriada e 100 μL de cultura hospedeira durante a noite diretamente em um tubo contendo 6 mL de agar suave NBY. Despeje o ágar macio sobre agar duro NBY e incuba a 26 ° C durante 24 h.
- No dia seguinte, remova as placas das incubadoras e conte o número de placas por placa. Use esses dados e a diluição conhecida faCtor e volume da solução para calcular a concentração da solução filtrada em PFU / mL.
- Para preparar E. coli , trace uma estirpe não-patogénica de E. coli em placas de agar Luria-Bertani (LB) e incuba a 37 ° C durante 24 h para obter colónias individuais. Armazenar a 4 ° C.
- Prepare a carga do solo tripartite, destinada a imitar o soro humano.
- Combine 7.80 mg / mL de albumina de soro bovino, 10.92 mg / mL de triptona e 2,52 mg / mL de mucina bovina para produzir o volume necessário de carga do solo. Depois de misturar a carga do solo, filtre-a através de um filtro de 0,22 μm para esterilizar. Armazene-o a 4 ° C até o uso. Não aquecer a esterilização, pois as proteínas se desnatam.
- Prepare uma solução de NaCl a 0,9% para misturar o inoculado para condições sem carga do solo.
- Imediatamente antes do teste, prepare um inoculo composto por 68% de suspensão bacteriana ou viral e 32% de carga no solo. Por exemplo, use 1,02 mL de suspensão bacteriana ou viral a partir das etapas 3.1.1.2 ou 3.1.3.2 e 0,48 mL de carga de solo (passo 3.2.1) ou solução de NaCl a 0,9% (passo 3.3). Remova ou vorteie suavemente para misturar.
NOTA: 1,5 mL desteO inoculo será usado para cada voluntário sob cada condição, de modo a garantir que o volume total do inóculo preparado seja suficiente para a quantidade pretendida de testes.
4. Preparando Voluntários para a Experiência
NOTA: Determine a condição de carga do organismo e do solo a ser testada nesse dia. Os mesmos voluntários podem ser usados para testar múltiplas condições, mas cada voluntário só deve ser submetido a uma rodada de testes dentro de um período de 48 h.
- Antes de iniciar o teste, confirme que os voluntários permanecem elegíveis ao verificar verbalmente que aderiram ao período de lavagem antimicrobiana de 7 dias e confirmando visualmente que não desenvolveram quebras ou anormalidades na pele.
- Usando um gerador de números aleatórios, atribua a cada voluntário para usar a mão direita ou esquerda para amostragem neste dia do teste. Atribua um pedido no qual as condições de lavagem das mãos serão realizadas.
NOTA: ParaPor exemplo, a ABHS pode ser atribuída no número 3 e será realizada em terceiro lugar. - Execute uma "lavagem de limpeza" uma vez no início do teste para retirar a pele de sujeira e óleos, de modo que cada teste subsequente seja conduzido em condições equivalentes.
- Para fazer uma lavagem de limpeza, percorra cada passo do experimento (seção 5, abaixo), usando um inoculado em branco (caldo LB ou PBS somente) e tomando uma amostra sem lavagem das mãos.
5. Procedimento Experimental
- Para testar o pH da pele de cada voluntário (para controlar a variação), coloque uma sonda de pH de pele plana na pele da superfície palmar e o espaço da web entre o ponteiro e os dedos do meio. Certifique-se de que o eletrodo é plano contra a pele. Grave a leitura do pH.
- Spike as mãos.
- Peça aos voluntários que tomem as duas mãos juntas. Spike as mãos com 1,5 mL de inoculação, cuidadosamente pipeteando 750 μL lentamente em cada palma.
- Peça aos voluntários que esfregue suavemente as mãos juntas até que todas as superfícies da mão estejam revestidas com a inoculação enquanto submetem as mãos ao mínimo fricção possível.
- Peça aos voluntários que ainda mantenham suas mãos afastadas do corpo por mais 30 s para que o inoculado seque. O inoculado pode não secar completamente.
- Lave as mãos.
- Para todos os passos de lavagem seguintes, capture o enxágüe das mãos em uma grande bolsa de recolha de amostras. Adicione 4,5 mL de uma solução de tiossulfato de sódio a 12% no saco para neutralizar o cloro no contato e processar dentro de 2 h.
NOTA: O tiossulfato de sódio deve ser adicionado a todas as amostras (mesmo aqueles sem cloro) para controlar qualquer impacto que possa ter sobre o organismo. - Após a inoculação (seção 5.2), lave as mãos com o próximo método na ordem designada.
- Para o Controle A, não execute um passo de lavagem das mãos e vá diretamente para o passo5.5.
- Para o Controle B, lave as mãos com apenas água ultrapura à temperatura ambiente (aproximadamente 21 ° C) através de um funil com um caudal conhecido.
NOTA: Aqui, utilizou-se uma taxa de fluxo de 1,5 L / m e 500 mL de água. - Para lavar as mãos com sabão, molhe as mãos com 10 mL de água ultrapura. Faça com que os voluntários espelhem as mãos com sabão e, em seguida, esfregue as mãos juntas por mais 20 s. Enxágüe as mãos derramando 500 mL de água ultrapura à temperatura ambiente através de um funil com um caudal de 1,5 L / m.
- Para todas as soluções de cloro ( p. Ex., ABHS, HTH, NaDCC e NaOCl), despeje 200 ml de solução de cloro através de um funil com um caudal de 1,5 L / m e faça com que o voluntário esfregue bem as mãos.
- Para todos os passos de lavagem seguintes, capture o enxágüe das mãos em uma grande bolsa de recolha de amostras. Adicione 4,5 mL de uma solução de tiossulfato de sódio a 12% no saco para neutralizar o cloro no contato e processar dentro de 2 h.
- Lavagem manual com um procedimento de suco de luva modificado.
- Após o lavagem das mãos, coloque imediatamente a mão de cada voluntário ( ou seja, a mão (direita ou esquerda) selecionada para testiNg no passo 4.2) em um saco de amostra contendo 75 mL de eluente ( por exemplo, PBS) até o pulso. Segure a parte superior da bolsa firmemente ao redor do pulso.
NOTA: Use um eluente para amostragem que contenha tiossulfato de sódio suficiente para neutralizar qualquer cloro usado para lavagem das mãos. O PBS é um eluente de uso comum que é apropriado para muitos organismos. - Peça aos voluntários que esfregue suavemente a mão na solução por 30 s, tomando cuidado para alcançar entre os dedos e embaixo das unhas. Massageie a mão do lado de fora da bolsa suavemente durante 30 s para garantir que toda a mão seja enxaguada completamente no eluente, até o pulso.
- Selar o saco e processá-lo de acordo com o ensaio apropriado, descrito na seção 6, dentro de 2 h.
- Após o lavagem das mãos, coloque imediatamente a mão de cada voluntário ( ou seja, a mão (direita ou esquerda) selecionada para testiNg no passo 4.2) em um saco de amostra contendo 75 mL de eluente ( por exemplo, PBS) até o pulso. Segure a parte superior da bolsa firmemente ao redor do pulso.
- Descontaminação.
- Antes de repetir o processo com cada método de lavagem das mãos, peça aos voluntários que lavem as mãos cuidadosamente em uma pia com sabão e água morna. Pulverizar o voluntárioAs mãos do rs com 70% de etanol até serem revestidas em ambos os lados. Deixe-os secar.
- Repita todas as etapas na seção 5 para cada condição de lavagem das mãos, usando apenas a mão selecionada aleatoriamente no passo 4.2 ( Figura 1 ).
6. Quantificação
- Execute ensaios apropriados para o organismo de escolha ( por exemplo, filtração de membrana para bactérias ou ensaio de placa para vírus, descrito acima nas seções 3.1.2 e 3.1.4, respectivamente).
- Depois de contar as placas, registre a UFC estimada / mL ou PFU / mL para cada teste para as análises (seções 3.1.2 e 3.1.4).
7. Análise
- Usando os resultados do passo 6.2, calcule o valor de redução logarítmica dos organismos nas mãos, para cada estado de carga do organismo e do solo e para cada assunto e método de lavagem das mãos.
- Para a eficácia da lavagem das mãos, compare a concentração de bactérias / vírus em cada Amostra de lavagem das mãos para controlar A (sem lavagem das mãos). Para a persistência da água de enxágüe, compare cada amostra de água de enxaguamento para controlar B (apenas com água). Use a seguinte fórmula padrão:
Redução de logs (lavagem das mãos ) =

Redução do registro (água de enxágüe ) =

NOTA: A redução do registro também pode ser expressa como log 10 (sem lavagem das mãos) - log 10 (com lavagem das mãos)
- Para a eficácia da lavagem das mãos, compare a concentração de bactérias / vírus em cada Amostra de lavagem das mãos para controlar A (sem lavagem das mãos). Para a persistência da água de enxágüe, compare cada amostra de água de enxaguamento para controlar B (apenas com água). Use a seguinte fórmula padrão:
- Use uma análise de variância de medidas repetidas de sentido único (ANOVA) para avaliar as diferenças significativas nos valores calculados de redução de log entre os métodos de lavagem das mãos e o teste HSD de Tukey pós-hoc para modelos significativos para avaliar em pares diferenças significativas (p <0,05)Ef 36 ".
- Antes de executar a ANOVA, avalie cada conjunto de dados para esfericidade ( por exemplo, usando o teste de Bartlett). Aplique uma correção ( por exemplo, a correção do efeito Estufa-Geisser) quando o teste indicar que a esfericidade foi violada 37 .
Resultados
Aqui, o protocolo ( Figura 1 ) foi completado com 18 voluntários, que foram testados usando E. coli e Phi6. Diferenças significativas foram encontradas entre os resultados de lavagem das mãos com E. coli com e sem carga do solo e Phi6 com carga do solo ( Figura 2 e Figura 3 ). Para E. coli sem carga de solo, o lavagem das mãos com HTH, NaDCC e NaOCl estabilizado resultou em reduções de log significativamente maiores do que o lavagem das mãos somente com água (F (6,102) = 2,72, p = 0,034). Com a carga do solo, HTH resultou em uma redução logarimática significativamente maior de E. coli do que apenas água, HWWS e ABHS (F (6,102) = 3,94, p <0,001). Não houve diferença significativa entre os métodos de Phi6 sem carga do solo (F (6,66) = 2,04, p = 0,073). No entanto, para Phi6 com carga de solo (F (6,102) = 7,01, p <0,001), a água sozinha resultou em um greRedução do log de aterramento do que ABHS ou NaOCl estabilizado e HWWS em uma maior redução logarítmica do que ABHS, NaOCl estabilizado e NaOCl gerado. HTH também teve uma maior redução logarítmica do que ABHS e NaOCl estabilizado, e NaDCC resultou em uma maior redução logarítmica do que o NaOCl estabilizado e a ABHS. Enquanto a HTH funcionou de forma mais consistente em todas as condições, cautela contra a interpretação excessiva de resultados significativos, pois muitos intervalos de confiança eram grandes, variando de menos de 0,5 log a mais de 1,5 log de redução em muitos casos.
Na água de enxágüe, o cloro resultou em uma redução logarítmica significativamente maior de E. coli persistente na água de enxaguamento do que HWWS (sem carga do solo, F (4,68) = 331,7, p <0,001; com carga do solo, F (4,68 ) = 162,44, p <0,001) ( Figura 4 ). Este mesmo padrão foi encontrado em Phi6 sem carga do solo ((F (4,43) = 8,95, P <0,001), com todas as soluções de cloro resultando emRedução significativamente significativa de Phi6 na água de enxaguamento do que HWWS. Não houve diferenças significativas na persistência na água de enxágüe com Phi6 e carga do solo ((F (4,67) = 3,35, p = 0,071) ( Figura 5 ).

Figura 1: Visão geral da experiência. Os cinco passos realizados para cada rodada de lavagem das mãos incluem: 1) teste de pH, 2) inoculação das mãos, 3) lavagem das mãos, 4) enxaguamento das mãos e 5) descontaminação das mãos para cada uma das oito condições testadas. Clique aqui para ver uma versão maior desta figura.
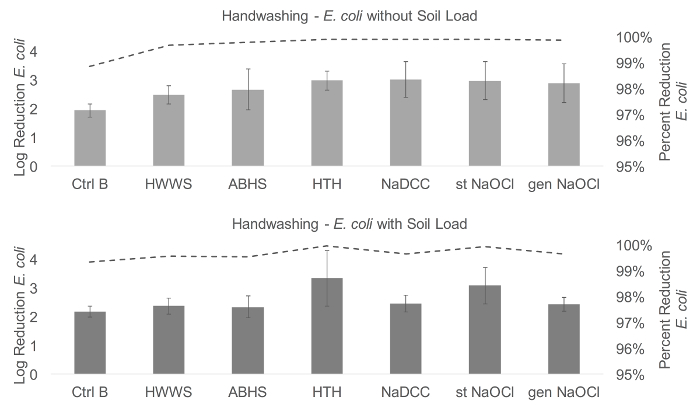
Figura 2: Resíduos de E. coli res Ults. Em comparação com o lavagem das mãos, os métodos de lavagem das mãos testados resultaram em uma redução média do log em E. coli de 1.94-3.01 sem carga do solo e 2.18-3.34 com carga do solo. O lavagem das mãos com água demonstrou a menor redução em E. coli em ambas as condições (1.94 e 2.18 log). O lavagem das mãos com NaDCC resultou na maior redução sem carga do solo (3.01) e HTH resultou na maior redução com a carga do solo (3.34). Nos gráficos, a linha representa a redução percentual em organismos, e as barras de erro representam o erro padrão de redução log. Ctrl B, controle B; HWWS, lavagem das mãos com sabão; ABHS, desinfetante de mão à base de álcool; HTH, hipoclorito de alto teste; NaDCC, dicloroisocianurato de sódio; St NaOCl, hipoclorito de sódio estabilizado; Gen NaOCl, gerou hipoclorito de sódio. Clique aqui para ver uma versão maior desta figura.

Figura 3: resultados de lavagem das mãos Phi6. Em comparação com o lavagem das mãos, os métodos de lavagem das mãos testados resultaram em uma redução média do log em Phi6 de 2,44-3,06 sem carga do solo e 2,71-3,69 com carga do solo. O lavagem das mãos com sabão demonstrou a menor redução no Phi6 sem carga do solo (2,44) e o lavagem das mãos com NaOCl estabilizado resultou na menor redução com carga do solo (2,71). O lavagem das mãos com NaOCl gerado resultou na maior redução sem carga do solo (3,06), e o lavagem das mãos com sabão resultou na maior redução com a carga do solo (3,69). Nos gráficos, a linha representa a redução percentual em organismos, e as barras de erro representam o erro padrão de redução log. Ctrl B, controle B; HWWS, lavagem das mãos com sabão; ABHS, desinfetante de mão à base de álcool; HTH, hipoclorito de alto teste; NaDCC, dicloroisocianurato de sódio;St NaOCl, hipoclorito de sódio estabilizado; Gen NaOCl, gerou hipoclorito de sódio. Clique aqui para ver uma versão maior desta figura.
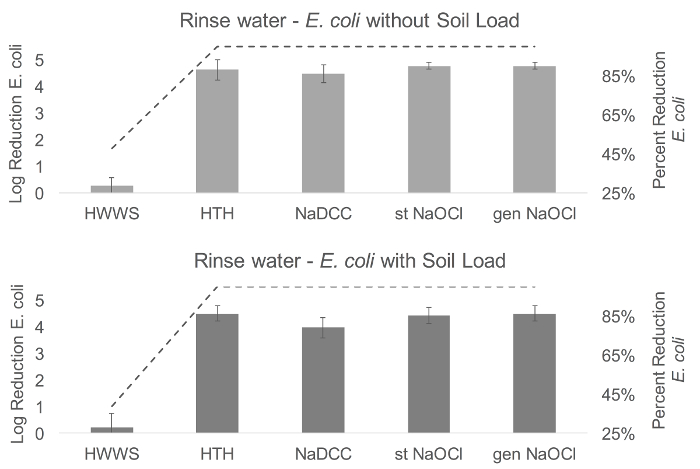
Figura 4: resultados de enxágüe de E. coli . Comparado com a lavagem das mãos somente com água, a redução média do registro de E. coli na água de enxaguamento foi de 0,28-4,77 sem carga do solo e 0,21-4,49 com carga do solo. Tanto com e sem carga de solo, a menor redução foi encontrada no lavagem das mãos com sabão (0,28 e 0,21). As maiores reduções foram observadas com NaOCl estabilizado e gerado sem carga do solo (ambos 4,77) e com HTH e NaOCl gerado com carga do solo. Nos gráficos, a linha representa a redução percentual em organismos, e as barras de erro representam a sErro em tandard da redução log. HWWS, lavagem das mãos com sabão; ABHS, desinfetante de mão à base de álcool; HTH, hipoclorito de alto teste; NaDCC, dicloroisocianurato de sódio; St NaOCl, hipoclorito de sódio estabilizado; Gen NaOCl, gerou hipoclorito de sódio. Clique aqui para ver uma versão maior desta figura.

Figura 5: resultados de enxágüe de Phi6. Em comparação com a lavagem das mãos apenas com água, a redução média do log de Phi6 restante na água de enxaguamento foi de 1,26-2,02 sem carga do solo e 1,30-2,20 com carga do solo. Com a carga do solo, a menor redução foi encontrada no lavagem das mãos com sabão (1.26). Sem carga de solo, HTH resultou na menor redução (2,02). As maiores reduções foram observadas com e sem carga de solo com NaDCC(2.02 e 2.20). Nos gráficos, a linha representa a redução percentual em organismos, e as barras de erro representam o erro padrão de redução log. HWWS, lavagem das mãos com sabão; ABHS, desinfetante de mão à base de álcool; HTH, hipoclorito de alto teste; NaDCC, dicloroisocianurato de sódio; St NaOCl, hipoclorito de sódio estabilizado; Gen NaOCl, gerou hipoclorito de sódio. Clique aqui para ver uma versão maior desta figura.
Discussão
The method described here provides an approach for testing handwashing efficacy in a controlled laboratory setting. This method highlights the use of human volunteers and surrogate, non-infectious organisms. Using the method, it was possible to demonstrate differences in: 1) the efficacy of handwashing methods and 2) organism persistence in rinse water. The purpose of presenting this protocol is to provide a general framework that can be adapted to test a wide range of surrogate organisms and handwashing methods relevant to infectious disease.
During the use of the method, two key data quality recommendations were noted as important. First, the inoculate must be applied both as similarly as possible across the rounds of testing and in a manner, that minimizes loss. This is to ensure that sufficient inoculate is applied to the hands to allow for statistically significant results. Second, be sure to complete the "cleansing wash" step, in which the protocol is performed without handwashing prior to testing, as previous work has shown that there are likely to be significant differences between a first wash and subsequent washes, but not between subsequent washes performed after a cleansing round29. Additionally, this step clears residual hand contamination, which would interfere with results.
The main limitation of this protocol is that it can be uncomfortable for volunteers. During each round of testing, which lasted about 2 h, volunteers' hands became cold. Some volunteers reported mild pain from their hands being constantly wet. Additionally, after a few rounds of testing, volunteers' hands became supersaturated, no longer fully drying between rounds. Although the randomization of the order of handwashing methods for each volunteer accounted for supersaturation, it is possible that the supersaturation could act as a confounding or modifying factor in this type of testing. To address this limitation, it is recommended that volunteers are appraised of this risk during consent disclosures and are reminded of their right to drop out of the study at any time. Volunteers should not undergo testing for more than 2 h per day to allow time for the hands to return to a baseline state and to minimize discomfort. A second limitation is the need to use a surrogate organism or non-infectious variant of a pathogenic organism to protect the health of volunteers. This might cause concern about the generalizability of results. However, for some pathogenic organisms (such as the Ebola virus), this limitation cannot be ethically overcome. Care must be taken during surrogate organism selection. Lastly, this is a laboratory study on efficacy. Results may only translate to effective disease prevention in real-word contexts where handwashing methods are made accessible to those in need and are used properly and consistently.
This protocol draws on previous work on handwashing efficacy but attempts to streamline methods and emphasizes the use of human hands (rather than surrogate surfaces) for testing. Additionally, rinse water is a transmission risk that had previously not been assessed. Existing studies on handwashing efficacy vary in methodology, leading to non-comparable data. We hope that standardized protocols for conducting handwashing method comparisons will encourage comparable and replicable results. Previous work has demonstrated that in vitro testing on surrogate surfaces such as pig skin, where, for example, the actual Ebola virus could be used, produced results that do not match those found after testing on human hands38. Therefore, a method using human hands and surrogate or non-infectious organisms is currently the best available approach to estimate handwashing efficacy and rinse water persistence for infectious microorganisms.
Handwashing is critical to prevent disease transmission. However, there is a lack of evidence on the comparative efficacy of handwashing methods that are commonly recommended. This protocol can be used to generate evidence about handwashing efficacy and rinse water persistence. This is especially important for infectious diseases with the potential to cause large outbreaks, such as the Ebola virus. We hope that other researchers will find this protocol useful to generate much-needed additional evidence on handwashing method efficacy and rinse water persistence that will assist in developing recommendations to reduce the transmission of infectious diseases.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Este trabalho foi apoiado pela Agência dos Estados Unidos para o Desenvolvimento Internacional, Office of Foreign Disaster Assistance (AID-OFDA-A-15-00026). Marlene Wolfe foi apoiada pela National Science Foundation (concessão 0966093).
Materiais
| Name | Company | Catalog Number | Comments |
| Soap bar | Dove | White Beauty Bar soap | |
| Alcohol-based hand sanitizer | Purell | Advanced Instant Hand Sanitizer with 70% Ethyl Alcohol | |
| HTH Powder | Acros Organics | 300340010 | |
| NaDCC Powder | Medentech | Klorsept granules | |
| NaOCl Solution | Acros Organics | 419550010 | |
| Electrochlorinator | AquaChlor | ||
| Iodometric titrator | Hach | 1690001 | |
| Bovine serum albumin | MP Biomedicals | NC0117242 | |
| Tryptone | Fisher | BP1421-100 | |
| Bovine Mucin | EMD Milipore | 49-964-3500MG | |
| 0.22 µm Filter | EMD Milipore | GVWP04700 | |
| NaCl | Fisher | BP358-1 | |
| Skin pH probe | Hanna Instruments | H199181 | |
| Large Whirlpak Sample Bag | Nasco | B01447WA | |
| Small Whirlpak Sample Bag | Nasco | B01323WA | |
| Funnel bottle | Thermo Scientific | 3120850001 | You may drill an appropriately sized hole in the lid of a bottle to form a funnel that will dispense water at the appropriate flow rate |
| Ethanol | ThermoScientific | 615090010 | Mix with water to produce 70% ethanol |
| Spray bottle | Qorpak | PLC06934 | |
| E. coli | ATCC | 25922 | |
| LB Broth | Fisher BioReagents | BP1426-2 | |
| LB Agar | Fisher BioReagents | BP1425-500 | |
| Sterile loop | Globe Scientific | 22-170-204 | |
| Phi6 | HER | 102 | |
| Nutrient broth | BD Difco | BD 247110 | |
| GeneQuant 100 Spectrophotometer | General Electric | 28-9182-04 | |
| Sodium thiosulfate | Fisher Chemical | S445-3 | |
| Membrane filter (47 mm, 0.45 µm) | EMD Millipore | HAWP04700 | |
| m-ColiBlue24 broth media | EMD Millipore | M00PMCB24 | |
| Petri dish with pad (47 mm) | Fisherbrand | 09-720-500 | |
| Vacuum Manifold | Thermo Scientific/Nalgene | 09-752-5 | |
| Filter funnels | Thermo Scientific/Nalgene | 09-747 | |
| Pseudomonas syringae | HER | 1102 | |
| Phosphate Buffered Saline | Thermo Scientific | 10010031 | Solution may also be mixed from source compounds according to any basic recipe |
Referências
- Kampf, G., Kramer, A. Epidemiologic Background of Hand Hygiene and Evaluation of the Most Important Agents for Scrubs and Rubs. Clin Microbiol Rev. 17 (4), 863-893 (2004).
- Miller, T., Patrick, D., Ormrod, D. Hand decontamination: influence of common variables on hand-washing efficiency. Healthc Infect. 16 (1), 18 (2013).
- Jensen, D. A., Danyluk, M. D., Harris, L. J., Schaffner, D. W. Quantifying the effect of hand wash duration, soap use, ground beef debris, and drying methods on the removal of Enterobacter aerogenes on hands. J Food Prot. 78 (4), 685-690 (2015).
- Girou, E., Loyeau, S., Legrand, P., Oppein, F., Brun-Buisson, C. Efficacy of handrubbing with alcohol based solution versus standard handwashing with antiseptic soap: randomised clinical trial. BMJ. 325 (7360), 362 (2002).
- Kac, G., Podglajen, I., Gueneret, M., Vaupré, S., Bissery, A., Meyer, G. Microbiological evaluation of two hand hygiene procedures achieved by healthcare workers during routine patient care: a randomized study. J Hosp Infect. 60 (1), 32-39 (2005).
- Lages, S. L. S., Ramakrishnan, M. A., Goyal, S. M. In-vivo efficacy of hand sanitisers against feline calicivirus: a surrogate for norovirus. J Hosp Infect. 68 (2), 159-163 (2008).
- Holton, R. H., Huber, M. A., Terezhalmy, G. T. Antimicrobial efficacy of soap and water hand washing versus an alcohol-based hand cleanser. Tex Dent J. 126 (12), 1175-1180 (2009).
- Salmon, S., Truong, A. T., Nguyen, V. H., Pittet, D., McLaws, M. -. L. Health care workers' hand contamination levels and antibacterial efficacy of different hand hygiene methods used in a Vietnamese hospital. Am J Infect Control. 42 (2), 178-181 (2014).
- Steinmann, J., Nehrkorn, R., Meyer, A., Becker, K. Two in-vivo protocols for testing virucidal efficacy of handwashing and hand disinfection. Int J Hyg Environ Health. 196 (5), 425-436 (1995).
- Weber, D. J., Sickbert-Bennett, E., Gergen, M. F., Rutala, W. A. Efficacy of selected hand hygiene agents used to remove Bacillus atrophaeus (a surrogate of Bacillus anthracis) from contaminated hands. JAMA. 289 (10), 1274-1277 (2003).
- Grayson, M. L., Melvani, S., et al. Efficacy of Soap and Water and Alcohol-Based Hand-Rub Preparations against Live H1N1 Influenza Virus on the Hands of Human Volunteers. Clin Infect Dis. 48 (3), 285-291 (2009).
- Oughton, M. T., Loo, V. G., Dendukuri, N., Fenn, S., Libman, M. D. Hand hygiene with soap and water is superior to alcohol rub and antiseptic wipes for removal of Clostridium difficile. Infect Control Hosp Epidemiol. 30 (10), 939-944 (2009).
- Liu, P., Yuen, Y., Hsiao, H. -. M., Jaykus, L. -. A., Moe, C. Effectiveness of liquid soap and hand sanitizer against Norwalk virus on contaminated hands. Appl Environ Micro. 76 (2), 394-399 (2010).
- Savolainen-Kopra, C., Korpela, T., et al. Single treatment with ethanol hand rub is ineffective against human rhinovirus--hand washing with soap and water removes the virus efficiently. J Med Virol. 84 (3), 543-547 (2012).
- Tuladhar, E., Hazeleger, W. C., Koopmans, M., Zwietering, M. H., Duizer, E., Beumer, R. R. Reducing viral contamination from finger pads: handwashing is more effective than alcohol-based hand disinfectants. J Hosp Infect. 90 (3), 226-234 (2015).
- Steinmann, J., Paulmann, D., Becker, B., Bischoff, B., Steinmann, E., Steinmann, J. Comparison of virucidal activity of alcohol-based hand sanitizers versus antimicrobial hand soaps in vitro and in vivo. J Hosp Infect. 82 (4), 277-280 (2012).
- de Aceituno, A. F., Bartz, F. E., et al. Ability of Hand Hygiene Interventions Using Alcohol-Based Hand Sanitizers and Soap To Reduce Microbial Load on Farmworker Hands Soiled during Harvest. J Food Protect. 78 (11), 2024-2032 (2015).
- Boyce, J. M., Pittet, D. Guideline for Hand Hygiene in Health-Care Settings Recommendations of the Healthcare Infection Control Practices Advisory Committee and the HICPAC/SHEA/APIC/IDSA Hand Hygiene Task Force. Infect Control Hosp Epidemiol. 23 (12 Suppl), S3-S40 (2002).
- . UNDP Medical Waste Experts Assessment and Recommendations Regarding Management of Ebola-Contaminated Waste Available from: https://noharm-global.org/sites/default/files/documents-files/3127/Report%20to%20WHO%20WASH%20and%20Geneva%20on%20Ebola%20final.pdf (2015)
- Hopman, J., Kubilay, Z., Allen, T., Edrees, H., Pittet, D., Allegranzi, B. Efficacy of chlorine solutions used for hand hygiene and gloves disinfection in Ebola settings: a systematic review. Antimicrob Resist Infect Control. 4 (1), 1 (2015).
- Lowbury, E. J. L., Lilly, H. A., Bull, J. P. Disinfection of hands: removal of transient organisms. BMJ. 2 (5403), 230-233 (1964).
- Edmonds, S. L., Zapka, C., et al. Effectiveness of Hand Hygiene for Removal of Clostridium difficile Spores from Hands. Infect Control Hosp Epidemiol. 34 (3), 302-305 (2013).
- Rotter, M. L. 150 years of hand disinfection-Semmelweis' heritage. Hyg Med. (22), 332-339 (1997).
- Hitomi, S., Baba, S., Yano, H., Morisawa, Y., Kimura, S. Antimicrobial effects of electrolytic products of sodium chloride--comparative evaluation with sodium hypochlorite solution and efficacy in handwashing. Kansenshōgaku Zasshi. 72 (11), 1176-1181 (1998).
- . Standard E1174-13. Standard Test Method for Evaluation of the Effectiveness of Health Care Personnel Handwash Formulations Available from: https://www.astm.org/ (2013)
- Casanova, L. M., Weaver, S. R. Evaluation of eluents for the recovery of an enveloped virus from hands by whole-hand sampling. J Appl Microbiol. 118 (5), 1210-1216 (2015).
- Sinclair, R. G., Rose, J. B., Hashsham, S. A., Gerba, C. P., Haas, C. N. Criteria for Selection of Surrogates Used To Study the Fate and Control of Pathogens in the Environment. Appl Environ Microbiol. 78 (6), 1969-1977 (2012).
- Held, E., Skoet, R., Johansen, J. D., Agner, T. The hand eczema severity index (HECSI): A scoring system for clinical assessment of hand eczema. A study of inter- and intraobserver reliability. Br J Dermatol. 152 (2), 302-307 (2005).
- . Method 1604: Total Coliforms and Escherichia coli in Water by Membrane Filtration Using a Simultaneous Detection Technique (MI Medium) Available from: https://www.epa.gov/sites/production/files/2015-08/documents/method_1604_2002.pdf (2002)
- Adams, M. H., Anderson, E. S. . Bacteriophages. , (1959).
- Kao, L. S., Green, C. E. Analysis of Variance: Is There a Difference in Means and What Does It Mean?. The Journal of surgical research. 144 (1), 158-170 (2008).
- Schutz, R. W., Gessaroli, M. E. The Analysis of Repeated Measures Designs Involving Multiple Dependent Variables. Research Quarterly for Exercise and Sport. 58 (2), 132-149 (1987).
- Woolwine, J. D., Gerberding, J. L. Effect of testing method on apparent activities of antiviral disinfectants and antiseptics. Antimicrob Agents Chemother. 39 (4), 921-923 (1995).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados