Method Article
Une méthode pour tester l'efficacité du lavage des mains pour l'élimination des pathogènes infectieux émergents
Dans cet article
Résumé
Le lavage des mains est largement recommandé pour prévenir la transmission des maladies infectieuses. Cependant, il existe peu de preuves sur lesquelles les méthodes de lavage des mains sont les plus efficaces pour éliminer les agents pathogènes des maladies infectieuses. Nous avons développé une méthode pour évaluer l'efficacité des méthodes de lavage des mains lors de l'élimination des microorganismes.
Résumé
Le lavage des mains est largement recommandé pour prévenir la transmission des maladies infectieuses. Cependant, il existe peu de preuves comparables sur l'efficacité des méthodes de lavage des mains en général. En outre, peu de preuves existent en comparant les méthodes de lavage des mains pour déterminer celles qui sont les plus efficaces pour éliminer les agents pathogènes infectieux. Des recherches sont nécessaires pour fournir des preuves des différentes approches du lavage des mains qui peuvent être utilisées pendant les épidémies de maladies infectieuses. Ici, une méthode de laboratoire pour évaluer l'efficacité des méthodes de lavage des mains à l'élimination des microorganismes des mains et leur persistance dans l'eau de rinçage est décrite. Les mains des bénévoles sont d'abord enrichies avec l'organisme d'essai et ensuite lavées avec chaque méthode d'intérêt pour la lavage des mains. Généralement, les microorganismes de substitution sont utilisés pour protéger les sujets humains contre la maladie. Le nombre d'organismes restant sur les mains des volontaires après le lavage est testé à l'aide d'une méthode modifiée de «jus de gant»: les mains sont placées dans des gants avec un éluEt sont nettoyés pour suspendre les microorganismes et les rendre disponibles pour analyse par filtration sur membrane (bactéries) ou en test de plaque (virus / bactériophages). L'eau de rinçage produite à partir du lavage des mains est directement collectée pour analyse. L'efficacité de la lavage des mains est quantifiée en comparant la valeur de réduction logarithmique entre les échantillons prélevés après le lavage des mains aux échantillons sans lavage des mains. La persistance de l'eau de rinçage est quantifiée en comparant les échantillons d'eau de rinçage de différentes méthodes de lavage des mains aux échantillons prélevés après le lavage des mains avec de l'eau juste. Bien que cette méthode soit limitée par la nécessité d'utiliser des organismes de substitution pour préserver la sécurité des volontaires humains, elle capture des aspects du lavage des mains qui sont difficiles à reproduire dans une étude in vitro et remplit les lacunes de recherche sur l'efficacité du lavage des mains et la persistance des organismes infectieux au rinçage eau.
Introduction
Le lavage des mains est largement recommandé pour prévenir la propagation de la maladie, en particulier celles transmises par voie fécale-orale ou aérienne, y compris les maladies diarrhéiques et respiratoires 1 . De manière surprenante, il existe peu de preuves comparables sur l'efficacité des méthodes de lavage des mains, telles que le lavage des mains avec du savon et de l'eau (HWWS) et un désinfectant pour les mains à base d'alcool (ABHS), sur l'élimination des organismes des mains. La recherche initiale a révélé que l'action mécanique du lavage des mains, par opposition à la méthode de lavage des mains, peut être responsable de la suppression de l'organisme 2 , 3 . En outre, il existe peu de preuves comparatives sur lesquelles la méthode de lavage des mains est la plus efficace. Dans une revue de la littérature informelle, 14 études qui ont comparé l'efficacité du savon et du désinfectant pour les mains sur l'élimination des organismes ont été identifiées. Parmi ces études, cinq ont révélé que l'ABHS était plus efficace 4 , 5 , 6 , 7 , 8 , sept ont révélé que le HWWS était plus efficace 9 , 10 , 11 , 12 , 13 , 14 , 15 et deux ne trouvaient aucune différence significative entre les méthodes 16 , 17 . Ces résultats sont incohérents et ne traitent pas du risque continu de maladie de la persistance d'organismes dans l'eau de rinçage après le lavage des mains. Dans l'ensemble, les données probantes sur l'efficacité comparative des méthodes de lavage des mains pour l'élimination des agents pathogènes pathogènes infectieux sont limitées.
Cette preuve limitée a conduit à l'incertitude quant aux méthodes les plus appropriées dans les paramètres de l'épidémie. Par exemple, Lors de l'épidémie de maladie du virus de l'Ebola (EVD) en Afrique de l'Ouest de 2013 à 2016, plusieurs grands intervenants internationaux ont fourni des recommandations contradictoires pour HWWS, ABHS ou 0,05% de solutions de chlore. Médecins Sans Frontières (MSF) recommande l'utilisation de solution de chlore à 0,05% pour le lavage des mains, tandis que l'Organisation mondiale de la santé (OMS) recommande HWWS ou ABHS (si les mains ne sont pas visiblement souillées). L'OMS va jusqu'à affirmer que le chlore ne doit pas être utilisé à moins d'autres options disponibles, car il est moins efficace que d'autres méthodes en raison de la demande de chlore exercée par la peau 18 , 19 , 20 , 21 , 22 . De plus, les solutions de chlore sont généralement produites à partir de quatre composés de chlore différents, y compris l'hypochlorite à haute teneur (HTH), l'hypochlorite de sodium stabilisé (NaOCl) localisé et stabilisé et le gazonIum dichloroisocyanurate (NaDCC). Un examen systématique commandé par l'OMS en réponse à l'épidémie EVD en Afrique de l'Ouest n'a trouvé que quatre études portant sur l'efficacité comparative du lavage des mains au chlore 23 . Ces études ont également produit des résultats contradictoires, et aucune de ces études n'a utilisé la concentration recommandée de chlore de 0,05% pour le lavage des mains ou les microorganismes étudiés similaires au virus Ebola 10 , 24 , 25 , 26 , 27 . Ainsi, les recommandations n'étaient pas fondées sur des données probantes, et il n'était pas clair quelles recommandations étaient les plus efficaces.
Des recherches supplémentaires sont nécessaires pour comparer les méthodes de lavage des mains pour prévenir la propagation des agents pathogènes infectieux, car les interventions de lavage des mains constituent un outil important pour prévenir la transmission des maladies épidémiques. Ces hLes recommandations sur le lavage doivent être fondées sur des preuves. Ainsi, une méthode pour tester l'efficacité de la lavage des mains et la persistance de l'eau de rinçage, réalisée avec des substituts ou des agents pathogènes non infectieux, a été développée 2 , 28 , 29 . Les résultats de l'échantillon, en utilisant Phi6 comme substitut du virus Ebola et en utilisant Escherichia coli comme organisme témoin commun, sont présentés ici. Dans ce protocole, l'efficacité de la lavage des mains et les tests de persistance de l'eau de rinçage sont présentés.
Protocole
Déclaration d'éthique: L'étude décrite ici (sur Phi6 et E. coli en tant que substitut à Ebola) a été approuvée par le Conseil d'examen institutionnel du Tufts Medical Center et du campus des sciences de la santé de Tufts (no 12018); L'Université de Harvard a cédé son avis au Conseil d'examen institutionnel de Tufts.
REMARQUE: Avant de commencer ce protocole, deux étapes doivent être complétées. Tout d'abord, une version de substitution de niveau de biosécurité 1 (BSL-1) ou non infectieuse du pathogène à étudier qui est sûr d'utiliser sur des sujets humains doit être identifiée et sélectionnée 30 . Un agent pathogène de substitution BSL-1 ou non infectieux est nécessaire pour ce protocole, car l'organisme sera utilisé pour inoculer les mains nues des volontaires humains. Deuxièmement, l'approbation du Conseil d'examen institutionnel local pour mener des recherches avec des sujets humains doit être obtenue avant de recruter des bénévoles ou de commencer l'expérience. De nombreux aspects de ce protocole peuvent être ajustés pour répondreE besoins spécifiques des questions de recherche d'intérêt.
1. Recruter des sujets humains éligibles
- Recruter des bénévoles en affichant des dépliants papier sur les panneaux d'affichage publics et en envoyant des courriels à des groupes avec des membres qui pourraient être intéressés à participer. Ces annonces devraient inclure le but de l'étude, les coordonnées et les critères d'éligibilité.
- Rencontrez les bénévoles pour évaluer l'admissibilité. Confirmez que les volontaires sont en bonne santé, âgés de 18 à 65 ans, et qu'ils ne sont pas enceintes ou prennent des antibiotiques et qu'ils n'ont pas de dommages / troubles cutanés, des allergies connues aux agents de lavage des mains ou des antécédents de santé mentale liés à l'hygiène.
- Demandez aux volontaires admissibles de lire les formulaires de consentement. Répondez à toutes les questions qu'ils posent et demandez au bénévole et à l'enquêteur de signer deux copies du formulaire. Conserver un formulaire et en fournir un au bénévole.
- Administrer une enquête de base, y compris des questions sur l'information démographique, la personneToute l'histoire des conditions cutanées et des informations sur le comportement de laver les mains récemment. Examiner les signes de dermatite, les lésions cutanées ou les anomalies cutanées initiales 31 .
- Planifiez les bénévoles pour deux séances d'essai pour chaque organisme d'intérêt (un pour le test avec la charge du sol et un pour le test sans). Demandez aux bénévoles d'éviter les produits antimicrobiens pendant une période de lavage de sept jours avant le test afin d'éviter de se confondre avec l'utilisation personnelle du produit.
- Fournir aux bénévoles des produits antimicrobiens (shampooing, conditionneur et savon) à utiliser à la place de leurs produits habituels. Fournissez des gants en vinyle résistants et demandez aux sujets de les porter lors de l'utilisation de produits tels que des produits de nettoyage de maisons.
2. Préparez les solutions de lavage des mains utilisées couramment dans les interventions d'urgence (Savon, ABHS, 0.05% HTH, NaDCC et NaOCl Solutions)
REMARQUE: les solutions de chlore peuvent être préparées Jusqu'à 12 h avant l'expérience, mais se dégradera si stocké> 12 h.
- Choisissez et achetez un savon pertinent pour le contexte pour lequel des tests sont effectués.
NOTE: Dans la plupart des cas, pour les urgences de maladies infectieuses dans le monde en développement, ce sera une barre de savon. - Choisissez et achetez une solution ABHS pertinente pour le contexte pour lequel des tests sont effectués.
NOTE: L'ABHS choisi devrait avoir un contexte d'alcool éthylique supérieur ou égal à 70% pour assurer l'efficacité. - Préparez une solution d'hypochlorite de calcium (Ca (ClO) 2 ) à 0,05% en ajoutant de la poudre de Ca (ClO) 2 granulaire à de l'eau ultrapure. Déterminer la quantité de solution nécessaire en fonction du nombre de sujets à tester.
- En utilisant l'équation suivante, déterminer la quantité de poudre requise pour préparer la quantité désirée de solution dans un volume d'eau donné en utilisant un pourcentage donné de chlore disponible:
/files/ftp_upload/55604/55604eq1.jpg "/>
REMARQUE: la poudre de Ca (ClO) 2 contient généralement 60 à 80% de chlore disponible.
- En utilisant l'équation suivante, déterminer la quantité de poudre requise pour préparer la quantité désirée de solution dans un volume d'eau donné en utilisant un pourcentage donné de chlore disponible:
- Préparez une solution de dichloroisocyanurate de sodium à 0,05% (NaDCC) en ajoutant une poudre granulée de NaDCC à de l'eau ultrapure.
- En utilisant l'équation suivante, déterminer la quantité de poudre requise pour préparer la quantité désirée de solution dans un volume d'eau donné en utilisant un pourcentage donné de chlore disponible:
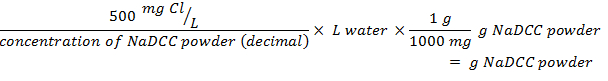
NOTE: La poudre de NaDCC contient typiquement environ 50% de chlore disponible.
- En utilisant l'équation suivante, déterminer la quantité de poudre requise pour préparer la quantité désirée de solution dans un volume d'eau donné en utilisant un pourcentage donné de chlore disponible:
- Préparer une solution stabilisée de 0,05% de NaOCl en ajoutant une solution d'hypochlorite de sodium stock à l'eau ultrapure.
- Confirmer la concentration de la solution stock de NaOCl (probablement 5-8%) en utilisant une méthode d'essai de titrage conformément aux instructions du fabricant ( par exemple, le titrage iodométrique, voir la Liste des matériaux pour le suKit gressé).
- En utilisant les résultats de la méthode d'essai, calculez la quantité de solution à ajouter à l'eau en utilisant l'équation suivante:

- Préparer une solution stabilisée de 0,05% de NaOCl en ajoutant une solution d'hypochlorite de sodium produite à l'aide d'un électrochlorateur, d'une eau ultrapure et d'un chlorure de sodium de laboratoire (NaCl) à de l'eau ultrapure.
- Préparez une solution de chlore à 1% avec de l'eau ultrapure et du NaCl, en utilisant un électrochlorateur selon les instructions du fabricant.
- Utiliser une méthode de test de titrage ( p. Ex. Titrage iodométrique) pour confirmer la concentration de la solution mère NaOCl 32 .
- En utilisant les résultats du test, calculez la quantité de solution à ajouter à l'eau en utilisant l'équation suivante:

- Confirmez le cOncentration de chacune des solutions de chlorinage à la main à l'aide d'une méthode de titrage ( p. Ex., Titrage iodométrique) et ajustez les solutions en ajoutant de l'eau ou de la poudre / solution de source de chlore jusqu'à ce qu'ils soient dans une erreur de 10% de la concentration cible (0,045-0,055%).
3. Préparez les organismes et la charge et le mélange du sol pour produire l'inoculation
REMARQUE: Dans les sous-sections suivantes, E. coli et Phi6 sont utilisés comme exemples d'organismes bactériens et viraux pour la description des méthodes.
- Préparez l'organisme à utiliser pour tester à une concentration supérieure à 10 x 10 8 CFU / mL pour les bactéries et plus de 10 x 10 7 PFU / mL pour les virus.
- Pour préparer E. coli , étaler une souche non-pathogène de E. coli sur des plaques d'agar Luria-Bertani (LB) et incuber à 37 ° C pendant 24 h pour obtenir des colonies individuelles. Conserver à 4 ° C.
REMARQUE: cela peut se faire séparerJours avant l'expérimentation.- Un jour avant le début de l'expérience, choisissez une seule colonie de la plaque et inoculez 10 mL de bouillon LB en utilisant une boucle stérile. Incuber toute la nuit à 37 ° C sous agitation.
- Le matin de l'expérience, commencez une culture fraîche en ajoutant 1 ml de la culture de nuit à 20 ml de bouillon LB frais. Incuber pendant environ 2,5 h pour obtenir une densité cellulaire supérieure à 10 8 UFC / mL.
- Utilisez un spectrophotomètre pour estimer la concentration de la culture.
REMARQUE: Utiliser un facteur de conversion préalablement établi à partir d'une courbe de normes pour la souche E. coli utilisée, assurant une concentration supérieure à 10 8 UFC / mL 33 . Si la densité de la cellule n'est pas suffisamment élevée, renvoyer la culture à l'incubateur et tester à nouveau jusqu'à ce qu'elle soit prête.
- Confirmer la concentration en utilisant une filtration à la membrane 34 .
REMARQUE: effectuer des dilutions série oF la culture dans la solution saline tamponnée au phosphate (PBS) afin que la solution filtrée produise un nombre dénombrable de colonies sur la plaque (le nombre exact dépend du moyen utilisé).- Mettre en place une flamme et un collecteur de filtration avec des entonnoirs de filtration stériles et une connexion sous vide. Stérilisez les pinces en les faisant flamber avec de l'éthanol. Utilisez-les pour placer un filtre de 0,45 μm sur le collecteur de filtration, avec la grille orientée vers le haut. Mouiller le filtre avec une petite quantité de PBS stérile.
- Placez l'entonnoir sur la base et ajoutez la solution d'échantillon à traiter en pipettant ou en versant directement sur le filtre. Engager le vide jusqu'à ce que l'échantillon entier ait traversé la membrane. Rincer les côtés de l'entonnoir avec du PBS stérile et rallumer le vide.
REMARQUE: les échantillons doivent être d'au moins 100 μL et jusqu'à 100 mL. Si un échantillon est inférieur à 10 ml, ajouter environ 20 ml de PBS à l'entonnoir de filtration avant le filtrage afin d'assurer une filtration uniforme du sampLe. - Retirez l'entonnoir, stérilisez la pince et éloignez le filtre de la base. Placez le filtre doucement sur la gélose LB dans une boîte de Petri, avec la grille orientée vers le haut, en veillant à ce que le filtre passe à la surface. Inverser les plaques et incuber pendant 24 h à 37 ° C.
- Après 24 heures, retirer les plaques de l'incubateur et compter les colonies de E. coli . Utilisez ces données et le facteur de dilution connu et le volume de la solution pour calculer la concentration de la solution filtrée dans CFU / mL.
- Propagate Phi6 dans l'hôte Pseudomonas syringae en utilisant la méthode double couche d'agar 35 .
- Ajouter 100 μL de suspension de stock de Phi6 et 100 μL de culture de P. syringae durant la nuit directement à 6 ml d'agar mou de Nutrient Broth Yewe (NBY) (0,3%). Versez-le sur des plaques avec de l'agar rigide NBY (1,5%) et incuberez pendant une nuit à 26 ° C. Préparez suffisamment de plaques pour produire suffisamment d'inoculum pour l'expérienceEn estimant un rendement d'environ 4 ml de suspension virale par plaque.
- Le lendemain, ajouter 5 ml de PBS sur la couche de gélose molle. Laissez-le à la température ambiante pendant 4 h, récupérez-le avec une pipette et filtrez-le en utilisant un filtre de 0,45 μm. Conserver à 4 ° C.
NOTE: Cette solution servira d'inoculation virale.
- Utilisez un dosage en plaque pour confirmer que la concentration est supérieure à 10 7 PFU / mL 35 . Effectuer des dilutions en série de la suspension virale dans le PBS de sorte que 100 μL produit un nombre de plaques comptable sur la plaque.
- Pipetter 100 μL d'un échantillon dilué approprié et 100 μL de culture d'hôte pendant la nuit directement dans un tube contenant 6 mL d'agar mou de NBY. Verser de l'agar doux sur la gélose dure NBY et incuber à 26 ° C pendant 24 h.
- Le lendemain, retirez les plaques des incubateurs et comptez le nombre de plaques par plaque. Utilisez ces données et la dilution connue faCtor et le volume de la solution pour calculer la concentration de la solution filtrée dans PFU / mL.
- Pour préparer E. coli , étaler une souche non-pathogène de E. coli sur des plaques d'agar Luria-Bertani (LB) et incuber à 37 ° C pendant 24 h pour obtenir des colonies individuelles. Conserver à 4 ° C.
- Préparer la charge tripartite du sol, destinée à imiter le sérum humain.
- Combiner 7,80 mg / ml d'albumine de sérum bovin, 10,92 mg / ml de tryptone et 2,52 mg / mL de mucine bovine pour produire le volume requis de charge du sol. Après avoir mélangé la charge du sol, filtrez-le à travers un filtre de 0,22 μm pour la stériliser. Conservez-le à 4 ° C jusqu'à l'utilisation. Ne pas chauffer la stérilisation, car les protéines disparaîtront.
- Préparez une solution de NaCl à 0,9% pour mélanger l'inoculation pour des conditions sans charge du sol.
- Immédiatement avant le test, préparer un inoculum composé de 68% de suspension bactérienne ou virale et 32% de charge du sol. Par exemple, utiliser 1,02 ml de suspension bactérienne ou virale à partir des étapes 3.1.1.2 ou 3.1.3.2 et 0,48 mL de la charge du sol (étape 3.2.1) ou de la solution de NaCl à 0,9% (étape 3.3). Faire un tourbillon ou un vortex doucement pour mélanger.
REMARQUE: 1,5 ml de ceL'inoculum sera utilisé pour chaque volontaire sous chaque condition, afin de s'assurer que le volume total de l'inoculum préparé est suffisant pour le nombre d'essais prévu.
4. Préparation des bénévoles pour l'expérience
REMARQUE: Déterminez la condition de charge de l'organisme et du sol à tester ce jour-là. Les mêmes volontaires peuvent être utilisés pour tester de multiples conditions, mais chaque volontaire ne doit être soumis qu'à une série de tests dans une période de 48 heures.
- Avant de commencer le test, confirmez que les bénévoles restent admissibles en vérifiant verbalement qu'ils ont adhéré à la période de lavage antimicrobien de 7 jours et en confirmant visuellement qu'ils n'ont pas développé de casse ou d'anomalies sur leur peau.
- À l'aide d'un générateur de nombres aléatoires, attribuez à chaque volontaire pour utiliser son droit ou sa main gauche pour l'échantillonnage ce jour de test. Affectez une commande dans laquelle les conditions de lavage des mains seront effectuées.
REMARQUE: pourPar exemple, ABHS peut être affecté au n ° 3 et sera exécuté en troisième. - Effectuer un "lavage nettoyant" une fois au début de l'essai pour enlever la peau des saletés et des huiles afin que chaque essai ultérieur soit effectué dans des conditions équivalentes.
- Pour faire un lavage nettoyant, parcourez chaque étape de l'expérience (section 5 ci-dessous), en utilisant une inoculation vierge (bouillon LB ou PBS uniquement) et en prenant un échantillon sans lavage des mains.
5. Procédure expérimentale
- Pour tester le pH de la peau de chaque volontaire (pour contrôler la variation), placez une sonde de pH de peau à tête plate sur la peau de surface palmaire et l'espace web entre le pointeur et les doigts du milieu. Assurez-vous que l'électrode est plate contre la peau. Enregistrez la lecture du pH.
- Spike les mains.
- Demandez aux bénévoles de prendre les deux mains ensemble. Spike les mains avec 1,5 mL de l'inoculation en pipetant soigneusement 750 μL lentement dans chaque paume.
- Demandez aux bénévoles de frotter doucement leurs mains jusqu'à ce que toutes les surfaces de la main soient revêtues d'inoculation tout en soumettant les mains au moins de friction possible.
- Demandez aux volontaires de tenir les mains encore et loin de leur corps pendant 30 s supplémentaires pour permettre à l'inoculation de sécher. L'inoculation peut ne pas sécher complètement.
- Lavez-vous les mains.
- Pour toutes les étapes de lavage suivantes, capturer l'eau de rinçage des mains dans un grand sac de collecte d'échantillon. Ajouter 4,5 ml d'une solution de thiosulfate de sodium à 12% dans le sac pour neutraliser le chlore au contact et traiter dans les 2 h.
REMARQUE: Le thiosulfate de sodium doit être ajouté à tous les échantillons (même ceux qui ne contiennent pas de chlore) pour contrôler tout impact qu'il pourrait avoir sur l'organisme. - Après l'inoculation (section 5.2), lavez les mains avec la méthode suivante dans l'ordre désigné.
- Pour le contrôle A, n'effectuez pas de lavage des mains et passez directement à l'étape5.5.
- Pour le contrôle B, lavez les mains avec seulement de l'eau ultrapure à température ambiante (environ 21 ° C) à travers un entonnoir avec un débit connu.
NOTE: Ici, on a utilisé un débit de 1,5 L / m et 500 ml d'eau. - Pour le lavage des mains avec du savon, mouillez les mains avec 10 ml d'eau ultrapure. Demandez aux bénévoles de mousser les mains avec du savon, puis de les frotter les mains pendant 20 s supplémentaires. Rincer les mains en versant 500 ml d'eau ultrapure à température ambiante à travers un entonnoir à un débit de 1,5 L / m.
- Pour toutes les solutions de chlore ( p. Ex., ABHS, HTH, NaDCC et NaOCl), versez 200 ml de solution de chlore dans un entonnoir à un débit de 1,5 L / m et faites en sorte que le volontaire frotte soigneusement ses mains.
- Pour toutes les étapes de lavage suivantes, capturer l'eau de rinçage des mains dans un grand sac de collecte d'échantillon. Ajouter 4,5 ml d'une solution de thiosulfate de sodium à 12% dans le sac pour neutraliser le chlore au contact et traiter dans les 2 h.
- Rincer à la main à l'aide d'une procédure de jus de gants modifiée.
- Après le lavage des mains, placez immédiatement la main de chaque volontaire ( c.-à-d. La main (droite ou gauche) choisie pour témoignerNg à l'étape 4.2) dans un sac d'échantillon contenant 75 ml d'éluant ( par exemple, PBS) jusqu'au poignet. Tenir le haut du sac bien autour du poignet.
REMARQUE: utiliser un éluant pour l'échantillonnage qui contient suffisamment de thiosulfate de sodium pour neutraliser tout chlore utilisé pour le lavage des mains. Le PBS est un éluant couramment utilisé qui convient à de nombreux organismes. - Demandez aux bénévoles de frotter délicatement leur main dans la solution pendant 30 s, en prenant soin de passer entre les doigts et sous les ongles. Masser la main de l'extérieur du sac doucement pendant 30 s pour s'assurer que la main entière soit bien rinçée dans l'éluant, tout au long du poignet.
- Sceller le sac et le traiter selon l'essai approprié, décrit à la section 6, dans les 2 h.
- Après le lavage des mains, placez immédiatement la main de chaque volontaire ( c.-à-d. La main (droite ou gauche) choisie pour témoignerNg à l'étape 4.2) dans un sac d'échantillon contenant 75 ml d'éluant ( par exemple, PBS) jusqu'au poignet. Tenir le haut du sac bien autour du poignet.
- Décontamination.
- Avant de répéter le processus avec chaque méthode de lavage des mains, demandez aux bénévaires de se laver les mains dans un évier avec du savon et de l'eau chaude. Pulvériser le volontaireRs avec 70% d'éthanol jusqu'à ce qu'elles soient recouvertes des deux côtés. Laissez-les sécher.
- Répétez toutes les étapes de la section 5 pour chaque condition de lavage des mains, en utilisant uniquement la main sélectionnée au hasard à l'étape 4.2 ( Figure 1 ).
6. Quantification
- Effectuer des analyses appropriées pour l'organisme choisi ( par exemple, la filtration sur membrane pour des bactéries ou un test de plaque pour les virus décrits ci-dessus aux sections 3.1.2 et 3.1.4, respectivement).
- Après avoir compté les plaques, enregistrez les UFC / mL ou PFU / mL estimés pour chaque essai pour les analyses (sections 3.1.2 et 3.1.4).
7. Analyse
- En utilisant les résultats de l'étape 6.2, calculez la valeur de réduction logarithmique des organismes sur les mains, pour chaque état d'activité de l'organisme et du sol et pour chaque sujet et la méthode de lavage des mains.
- Pour l'efficacité de la lavage des mains, comparez la concentration de bactéries / virus dans chaque Essai de lavage des mains pour contrôler A (pas de lavage des mains). Pour la persistance de l'eau de rinçage, comparez chaque échantillon d'eau de rinçage pour contrôler B (lavage avec de l'eau uniquement). Utilisez la formule standard suivante:
Réduction du journal (lavage des mains ) =

Réduction du journal (eau de rinçage ) =

REMARQUE: La réduction du journal peut également être exprimée en log 10 (sans lavage des mains) - log 10 (avec lavage des mains)
- Pour l'efficacité de la lavage des mains, comparez la concentration de bactéries / virus dans chaque Essai de lavage des mains pour contrôler A (pas de lavage des mains). Pour la persistance de l'eau de rinçage, comparez chaque échantillon d'eau de rinçage pour contrôler B (lavage avec de l'eau uniquement). Utilisez la formule standard suivante:
- Utilisez une analyse de variance à sens unique (ANOVA) pour évaluer les différences significatives dans les valeurs de réduction de logarithme calculées entre les méthodes de lavage des mains et le test HSD Tukey post-hoc pour des modèles significatifs afin d'évaluer les différences significatives (p <0,05)Ef "> 36.
- Avant d'exécuter l'ANOVA, évaluer chaque jeu de données pour sphericity ( par exemple, en utilisant le test de Bartlett). Appliquer une correction ( par exemple, la correction de Greenhouse-Geisser) lorsque le test indique que la sphéricité a été violée 37 .
Résultats
Ici, le protocole ( Figure 1 ) a été complété avec 18 volontaires, qui ont chacun été testés en utilisant à la fois E. coli et Phi6. Des différences importantes ont été trouvées entre les résultats de lavage des mains avec E. coli avec et sans charge de sol et Phi6 avec la charge du sol ( Figure 2 et Figure 3 ). Pour E. coli sans charge du sol, le lavage des mains avec HTH, NaDCC et NaOCl stabilisé a entraîné des réductions logarithmiques significativement plus élevées que le lavage des mains avec de l'eau uniquement (F (6,102) = 2,72, p = 0,034). Avec la charge du sol, HTH a entraîné une réduction significativement plus élevée du nombre de E. coli que l'eau seulement, HWWS et ABHS (F (6,102) = 3,94, p <0,001). Il n'y avait aucune différence significative entre les méthodes de Phi6 sans charge du sol (F (6,66) = 2,04, p = 0,073). Cependant, pour Phi6 avec la charge du sol (F (6,102) = 7,01, p <0,001), l'eau seule a entraîné une greffeLa réduction logarithmique de l'eau que l'ABHS ou le NaOCl stabilisé et le HWWS dans une réduction logarithmique plus importante que l'ABHS, le NaOCl stabilisé et le NaOCl généré. HTH a également eu une réduction logarithmique plus importante que l'ABHS et le NaOCl stabilisé, et la NaDCC a entraîné une réduction logarithmique plus élevée que le NaOCl stabilisé et l'ABHS. Bien que HTH ait fonctionné de manière cohérente dans toutes les conditions, nous mettrons en garde contre la sur-interprétation de résultats significatifs, car de nombreux intervalles de confiance étaient importants, allant de moins de 0,5 log à plus de 1,5 log de réduction dans de nombreux cas.
Dans l'eau de rinçage, le chlore a entraîné une réduction significativement plus importante du nombre de E. coli persistant dans l'eau de rinçage que le HWWS (sans charge du sol, F (4,68) = 331,7, p <0,001; avec la charge du sol, F (4,68 ) = 162,44, p <0,001) ( Figure 4 ). Ce même modèle a été trouvé dans Phi6 sans charge du sol ((F (4,43) = 8,95, P <0,001), toutes les solutions de chlore ayant pour résultatUne réduction significativement plus importante de Phi6 dans l'eau de rinçage que le HWWS. Il n'y avait pas de différence significative dans la persistance dans l'eau de rinçage avec Phi6 et la charge du sol ((F (4,67) = 3,35, p = 0,071) ( Figure 5 ).

Figure 1: Aperçu de l'expérience. Les cinq étapes entreprises pour chaque cycle de lavage des mains comprennent: 1) le test du pH, 2) l'inoculation des mains, 3) le lavage des mains, 4) le rinçage des mains et 5) la décontamination des mains pour chacune des huit conditions testées. Cliquez ici pour voir une version plus grande de ce chiffre.
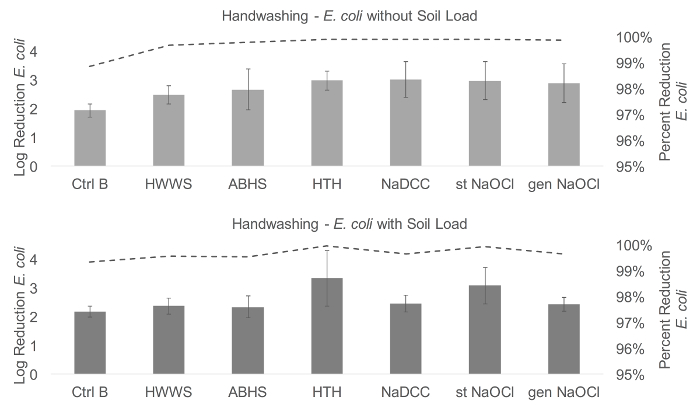
Figure 2: résistant aux mains de E. coli Ults. Par rapport au lavage des mains, les méthodes de lavage des mains testées ont entraîné une réduction moyenne logarithmique dans E. coli de 1,94-3,01 sans charge du sol et 2,18-3,34 avec la charge du sol. Le lavage des mains avec de l'eau a démontré la moindre réduction dans E. coli dans les deux conditions (1.94 et 2.18 log). Le lavage des mains avec NaDCC a entraîné la plus grande réduction sans charge du sol (3,01), et HTH a entraîné la plus grande réduction avec la charge du sol (3,34). Dans les tableaux, la ligne représente la réduction en pourcentage des organismes, et les barres d'erreur représentent l'erreur standard de la réduction du journal. Ctrl B, contrôle B; HWWS, lavage de mains avec du savon; ABHS, désinfectant pour les mains à base d'alcool; HTH, hypochlorite de test élevé; NaDCC, dichloroisocyanurate de sodium; St NaOCl, hypochlorite de sodium stabilisé; Gen NaOCl, hypochlorite de sodium généré. Cliquez ici pour voir une version plus grande de ce chiffre.

Figure 3: résultats de lavage des mains Phi6. Par rapport au lavage des mains, les méthodes de lavage des mains testées ont abouti à une réduction logarithmique moyenne de Phi6 de 2.44-3.06 sans charge du sol et 2.71-3.69 avec la charge du sol. Le lavage des mains avec du savon a démontré la moindre réduction de Phi6 sans charge du sol (2,44), et le lavage des mains avec du NaOCl stabilisé a entraîné la plus faible réduction avec la charge du sol (2,71). Le lavage des mains avec NaOCl généré a entraîné la plus grande réduction sans charge du sol (3,06), et le lavage des mains avec du savon a entraîné une réduction maximale avec la charge du sol (3,69). Dans les tableaux, la ligne représente la réduction en pourcentage des organismes, et les barres d'erreur représentent l'erreur standard de la réduction du journal. Ctrl B, contrôle B; HWWS, lavage de mains avec du savon; ABHS, désinfectant pour les mains à base d'alcool; HTH, hypochlorite de test élevé; NaDCC, dichloroisocyanurate de sodium;St NaOCl, hypochlorite de sodium stabilisé; Gen NaOCl, hypochlorite de sodium généré. Cliquez ici pour voir une version plus grande de ce chiffre.
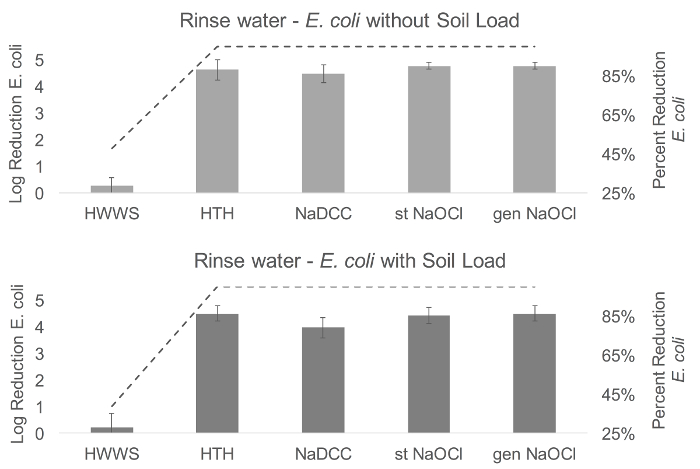
Figure 4: résultats de rinçage à la main de E. coli . Par rapport au lavage des mains avec de l'eau seulement, la réduction moyenne logarithmique de E. coli restant dans l'eau de rinçage était de 0,28-4,77 sans charge du sol et de 0,21 à 4,49 avec la charge du sol. À la fois avec et sans charge du sol, la plus petite réduction a été observée dans le lavage des mains avec du savon (0,28 et 0,21). Les plus fortes réductions ont été observées avec NaOCl stabilisé et généré sans charge du sol (4,77) et avec HTH et NaOCl généré avec la charge du sol. Dans les tableaux, la ligne représente le pourcentage de réduction des organismes, et les barres d'erreur représentent les sErreur tandard de réduction du journal. HWWS, lavage de mains avec du savon; ABHS, désinfectant pour les mains à base d'alcool; HTH, hypochlorite de test élevé; NaDCC, dichloroisocyanurate de sodium; St NaOCl, hypochlorite de sodium stabilisé; Gen NaOCl, hypochlorite de sodium généré. Cliquez ici pour voir une version plus grande de ce chiffre.

Figure 5: résultats de rinçage à la main Phi6. Par rapport au lavage des mains avec de l'eau seulement, la réduction moyenne du nombre de Phi6 restant dans l'eau de rinçage était de 1,26-2,02 sans charge du sol et de 1,30 à 2,20 avec la charge du sol. Avec la charge du sol, la plus petite réduction a été observée dans le lavage des mains avec du savon (1.26). Sans charge de sol, HTH a entraîné la plus faible réduction (2,02). Les plus fortes réductions ont été observées à la fois avec et sans charge de sol avec NaDCC(2,02 et 2,20). Dans les tableaux, la ligne représente la réduction en pourcentage des organismes, et les barres d'erreur représentent l'erreur standard de la réduction du journal. HWWS, lavage de mains avec du savon; ABHS, désinfectant pour les mains à base d'alcool; HTH, hypochlorite de test élevé; NaDCC, dichloroisocyanurate de sodium; St NaOCl, hypochlorite de sodium stabilisé; Gen NaOCl, hypochlorite de sodium généré. Cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
The method described here provides an approach for testing handwashing efficacy in a controlled laboratory setting. This method highlights the use of human volunteers and surrogate, non-infectious organisms. Using the method, it was possible to demonstrate differences in: 1) the efficacy of handwashing methods and 2) organism persistence in rinse water. The purpose of presenting this protocol is to provide a general framework that can be adapted to test a wide range of surrogate organisms and handwashing methods relevant to infectious disease.
During the use of the method, two key data quality recommendations were noted as important. First, the inoculate must be applied both as similarly as possible across the rounds of testing and in a manner, that minimizes loss. This is to ensure that sufficient inoculate is applied to the hands to allow for statistically significant results. Second, be sure to complete the "cleansing wash" step, in which the protocol is performed without handwashing prior to testing, as previous work has shown that there are likely to be significant differences between a first wash and subsequent washes, but not between subsequent washes performed after a cleansing round29. Additionally, this step clears residual hand contamination, which would interfere with results.
The main limitation of this protocol is that it can be uncomfortable for volunteers. During each round of testing, which lasted about 2 h, volunteers' hands became cold. Some volunteers reported mild pain from their hands being constantly wet. Additionally, after a few rounds of testing, volunteers' hands became supersaturated, no longer fully drying between rounds. Although the randomization of the order of handwashing methods for each volunteer accounted for supersaturation, it is possible that the supersaturation could act as a confounding or modifying factor in this type of testing. To address this limitation, it is recommended that volunteers are appraised of this risk during consent disclosures and are reminded of their right to drop out of the study at any time. Volunteers should not undergo testing for more than 2 h per day to allow time for the hands to return to a baseline state and to minimize discomfort. A second limitation is the need to use a surrogate organism or non-infectious variant of a pathogenic organism to protect the health of volunteers. This might cause concern about the generalizability of results. However, for some pathogenic organisms (such as the Ebola virus), this limitation cannot be ethically overcome. Care must be taken during surrogate organism selection. Lastly, this is a laboratory study on efficacy. Results may only translate to effective disease prevention in real-word contexts where handwashing methods are made accessible to those in need and are used properly and consistently.
This protocol draws on previous work on handwashing efficacy but attempts to streamline methods and emphasizes the use of human hands (rather than surrogate surfaces) for testing. Additionally, rinse water is a transmission risk that had previously not been assessed. Existing studies on handwashing efficacy vary in methodology, leading to non-comparable data. We hope that standardized protocols for conducting handwashing method comparisons will encourage comparable and replicable results. Previous work has demonstrated that in vitro testing on surrogate surfaces such as pig skin, where, for example, the actual Ebola virus could be used, produced results that do not match those found after testing on human hands38. Therefore, a method using human hands and surrogate or non-infectious organisms is currently the best available approach to estimate handwashing efficacy and rinse water persistence for infectious microorganisms.
Handwashing is critical to prevent disease transmission. However, there is a lack of evidence on the comparative efficacy of handwashing methods that are commonly recommended. This protocol can be used to generate evidence about handwashing efficacy and rinse water persistence. This is especially important for infectious diseases with the potential to cause large outbreaks, such as the Ebola virus. We hope that other researchers will find this protocol useful to generate much-needed additional evidence on handwashing method efficacy and rinse water persistence that will assist in developing recommendations to reduce the transmission of infectious diseases.
Déclarations de divulgation
Les auteurs déclarent qu'ils n'ont pas d'intérêts financiers concurrents.
Remerciements
Ce travail a été soutenu par l'Agence des États-Unis pour le développement international, Office of Foreign Disaster Assistance (AID-OFDA-A-15-00026). Marlene Wolfe a été soutenue par la National Science Foundation (subvention 0966093).
matériels
| Name | Company | Catalog Number | Comments |
| Soap bar | Dove | White Beauty Bar soap | |
| Alcohol-based hand sanitizer | Purell | Advanced Instant Hand Sanitizer with 70% Ethyl Alcohol | |
| HTH Powder | Acros Organics | 300340010 | |
| NaDCC Powder | Medentech | Klorsept granules | |
| NaOCl Solution | Acros Organics | 419550010 | |
| Electrochlorinator | AquaChlor | ||
| Iodometric titrator | Hach | 1690001 | |
| Bovine serum albumin | MP Biomedicals | NC0117242 | |
| Tryptone | Fisher | BP1421-100 | |
| Bovine Mucin | EMD Milipore | 49-964-3500MG | |
| 0.22 µm Filter | EMD Milipore | GVWP04700 | |
| NaCl | Fisher | BP358-1 | |
| Skin pH probe | Hanna Instruments | H199181 | |
| Large Whirlpak Sample Bag | Nasco | B01447WA | |
| Small Whirlpak Sample Bag | Nasco | B01323WA | |
| Funnel bottle | Thermo Scientific | 3120850001 | You may drill an appropriately sized hole in the lid of a bottle to form a funnel that will dispense water at the appropriate flow rate |
| Ethanol | ThermoScientific | 615090010 | Mix with water to produce 70% ethanol |
| Spray bottle | Qorpak | PLC06934 | |
| E. coli | ATCC | 25922 | |
| LB Broth | Fisher BioReagents | BP1426-2 | |
| LB Agar | Fisher BioReagents | BP1425-500 | |
| Sterile loop | Globe Scientific | 22-170-204 | |
| Phi6 | HER | 102 | |
| Nutrient broth | BD Difco | BD 247110 | |
| GeneQuant 100 Spectrophotometer | General Electric | 28-9182-04 | |
| Sodium thiosulfate | Fisher Chemical | S445-3 | |
| Membrane filter (47 mm, 0.45 µm) | EMD Millipore | HAWP04700 | |
| m-ColiBlue24 broth media | EMD Millipore | M00PMCB24 | |
| Petri dish with pad (47 mm) | Fisherbrand | 09-720-500 | |
| Vacuum Manifold | Thermo Scientific/Nalgene | 09-752-5 | |
| Filter funnels | Thermo Scientific/Nalgene | 09-747 | |
| Pseudomonas syringae | HER | 1102 | |
| Phosphate Buffered Saline | Thermo Scientific | 10010031 | Solution may also be mixed from source compounds according to any basic recipe |
Références
- Kampf, G., Kramer, A. Epidemiologic Background of Hand Hygiene and Evaluation of the Most Important Agents for Scrubs and Rubs. Clin Microbiol Rev. 17 (4), 863-893 (2004).
- Miller, T., Patrick, D., Ormrod, D. Hand decontamination: influence of common variables on hand-washing efficiency. Healthc Infect. 16 (1), 18 (2013).
- Jensen, D. A., Danyluk, M. D., Harris, L. J., Schaffner, D. W. Quantifying the effect of hand wash duration, soap use, ground beef debris, and drying methods on the removal of Enterobacter aerogenes on hands. J Food Prot. 78 (4), 685-690 (2015).
- Girou, E., Loyeau, S., Legrand, P., Oppein, F., Brun-Buisson, C. Efficacy of handrubbing with alcohol based solution versus standard handwashing with antiseptic soap: randomised clinical trial. BMJ. 325 (7360), 362 (2002).
- Kac, G., Podglajen, I., Gueneret, M., Vaupré, S., Bissery, A., Meyer, G. Microbiological evaluation of two hand hygiene procedures achieved by healthcare workers during routine patient care: a randomized study. J Hosp Infect. 60 (1), 32-39 (2005).
- Lages, S. L. S., Ramakrishnan, M. A., Goyal, S. M. In-vivo efficacy of hand sanitisers against feline calicivirus: a surrogate for norovirus. J Hosp Infect. 68 (2), 159-163 (2008).
- Holton, R. H., Huber, M. A., Terezhalmy, G. T. Antimicrobial efficacy of soap and water hand washing versus an alcohol-based hand cleanser. Tex Dent J. 126 (12), 1175-1180 (2009).
- Salmon, S., Truong, A. T., Nguyen, V. H., Pittet, D., McLaws, M. -. L. Health care workers' hand contamination levels and antibacterial efficacy of different hand hygiene methods used in a Vietnamese hospital. Am J Infect Control. 42 (2), 178-181 (2014).
- Steinmann, J., Nehrkorn, R., Meyer, A., Becker, K. Two in-vivo protocols for testing virucidal efficacy of handwashing and hand disinfection. Int J Hyg Environ Health. 196 (5), 425-436 (1995).
- Weber, D. J., Sickbert-Bennett, E., Gergen, M. F., Rutala, W. A. Efficacy of selected hand hygiene agents used to remove Bacillus atrophaeus (a surrogate of Bacillus anthracis) from contaminated hands. JAMA. 289 (10), 1274-1277 (2003).
- Grayson, M. L., Melvani, S., et al. Efficacy of Soap and Water and Alcohol-Based Hand-Rub Preparations against Live H1N1 Influenza Virus on the Hands of Human Volunteers. Clin Infect Dis. 48 (3), 285-291 (2009).
- Oughton, M. T., Loo, V. G., Dendukuri, N., Fenn, S., Libman, M. D. Hand hygiene with soap and water is superior to alcohol rub and antiseptic wipes for removal of Clostridium difficile. Infect Control Hosp Epidemiol. 30 (10), 939-944 (2009).
- Liu, P., Yuen, Y., Hsiao, H. -. M., Jaykus, L. -. A., Moe, C. Effectiveness of liquid soap and hand sanitizer against Norwalk virus on contaminated hands. Appl Environ Micro. 76 (2), 394-399 (2010).
- Savolainen-Kopra, C., Korpela, T., et al. Single treatment with ethanol hand rub is ineffective against human rhinovirus--hand washing with soap and water removes the virus efficiently. J Med Virol. 84 (3), 543-547 (2012).
- Tuladhar, E., Hazeleger, W. C., Koopmans, M., Zwietering, M. H., Duizer, E., Beumer, R. R. Reducing viral contamination from finger pads: handwashing is more effective than alcohol-based hand disinfectants. J Hosp Infect. 90 (3), 226-234 (2015).
- Steinmann, J., Paulmann, D., Becker, B., Bischoff, B., Steinmann, E., Steinmann, J. Comparison of virucidal activity of alcohol-based hand sanitizers versus antimicrobial hand soaps in vitro and in vivo. J Hosp Infect. 82 (4), 277-280 (2012).
- de Aceituno, A. F., Bartz, F. E., et al. Ability of Hand Hygiene Interventions Using Alcohol-Based Hand Sanitizers and Soap To Reduce Microbial Load on Farmworker Hands Soiled during Harvest. J Food Protect. 78 (11), 2024-2032 (2015).
- Boyce, J. M., Pittet, D. Guideline for Hand Hygiene in Health-Care Settings Recommendations of the Healthcare Infection Control Practices Advisory Committee and the HICPAC/SHEA/APIC/IDSA Hand Hygiene Task Force. Infect Control Hosp Epidemiol. 23 (12 Suppl), S3-S40 (2002).
- . UNDP Medical Waste Experts Assessment and Recommendations Regarding Management of Ebola-Contaminated Waste Available from: https://noharm-global.org/sites/default/files/documents-files/3127/Report%20to%20WHO%20WASH%20and%20Geneva%20on%20Ebola%20final.pdf (2015)
- Hopman, J., Kubilay, Z., Allen, T., Edrees, H., Pittet, D., Allegranzi, B. Efficacy of chlorine solutions used for hand hygiene and gloves disinfection in Ebola settings: a systematic review. Antimicrob Resist Infect Control. 4 (1), 1 (2015).
- Lowbury, E. J. L., Lilly, H. A., Bull, J. P. Disinfection of hands: removal of transient organisms. BMJ. 2 (5403), 230-233 (1964).
- Edmonds, S. L., Zapka, C., et al. Effectiveness of Hand Hygiene for Removal of Clostridium difficile Spores from Hands. Infect Control Hosp Epidemiol. 34 (3), 302-305 (2013).
- Rotter, M. L. 150 years of hand disinfection-Semmelweis' heritage. Hyg Med. (22), 332-339 (1997).
- Hitomi, S., Baba, S., Yano, H., Morisawa, Y., Kimura, S. Antimicrobial effects of electrolytic products of sodium chloride--comparative evaluation with sodium hypochlorite solution and efficacy in handwashing. Kansenshōgaku Zasshi. 72 (11), 1176-1181 (1998).
- . Standard E1174-13. Standard Test Method for Evaluation of the Effectiveness of Health Care Personnel Handwash Formulations Available from: https://www.astm.org/ (2013)
- Casanova, L. M., Weaver, S. R. Evaluation of eluents for the recovery of an enveloped virus from hands by whole-hand sampling. J Appl Microbiol. 118 (5), 1210-1216 (2015).
- Sinclair, R. G., Rose, J. B., Hashsham, S. A., Gerba, C. P., Haas, C. N. Criteria for Selection of Surrogates Used To Study the Fate and Control of Pathogens in the Environment. Appl Environ Microbiol. 78 (6), 1969-1977 (2012).
- Held, E., Skoet, R., Johansen, J. D., Agner, T. The hand eczema severity index (HECSI): A scoring system for clinical assessment of hand eczema. A study of inter- and intraobserver reliability. Br J Dermatol. 152 (2), 302-307 (2005).
- . Method 1604: Total Coliforms and Escherichia coli in Water by Membrane Filtration Using a Simultaneous Detection Technique (MI Medium) Available from: https://www.epa.gov/sites/production/files/2015-08/documents/method_1604_2002.pdf (2002)
- Adams, M. H., Anderson, E. S. . Bacteriophages. , (1959).
- Kao, L. S., Green, C. E. Analysis of Variance: Is There a Difference in Means and What Does It Mean?. The Journal of surgical research. 144 (1), 158-170 (2008).
- Schutz, R. W., Gessaroli, M. E. The Analysis of Repeated Measures Designs Involving Multiple Dependent Variables. Research Quarterly for Exercise and Sport. 58 (2), 132-149 (1987).
- Woolwine, J. D., Gerberding, J. L. Effect of testing method on apparent activities of antiviral disinfectants and antiseptics. Antimicrob Agents Chemother. 39 (4), 921-923 (1995).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon