Method Article
Hybrid-Cut: Um Método Seccionamento melhorado para amostras de tecidos de plantas recalcitrante
Neste Artigo
Resumo
This protocol describes a simple Hybrid-Cut tissue sectioning method that is useful for recalcitrant plant tissues. Good quality tissue sections enable anatomical studies and other biological studies including in situ hybridization (ISH).
Resumo
Manter a integridade seção planta é essencial para estudar estruturas anatômicas detalhadas no celular, tecido ou até mesmo nível do órgão. No entanto, algumas células de plantas têm paredes celulares rígidas, fibras duras e cristais (oxalato de cálcio, sílica, etc), e elevado teor de água que muitas vezes perturbar a integridade do tecido durante o corte do tecido da planta.
Este estudo estabelece um método de corte de tecido Cut-híbrido simples. Este protocolo modifica uma técnica de corte à base de parafina e melhora a integridade das secções de tecido a partir de plantas diferentes. tecidos de plantas foram embebidos em parafina antes de seccionamento num crióstato a -16 ° C. Seccionamento sob a baixa temperatura endurecido os blocos de parafina, reduzida lacrimejamento e coçar, e melhorou a integridade do tecido de forma significativa. Este protocolo foi aplicado com sucesso em tecidos ricos em oxalato de cálcio Phalaenopsis orquídeas, bem como tecidos recalcitrantes, como orga reprodutivaNS e folhas de arroz, milho e trigo. Além disso, a elevada qualidade de secções de tecido a partir de híbrido-corte pode ser utilizado em combinação com a hibridização in situ (ISH) para proporcionar os padrões de expressão espaciais dos genes de interesse. Em conclusão, este protocolo é particularmente útil para tecido vegetal recalcitrante contendo alta cristal ou teor de sílica. Bons cortes de tecidos de qualidade permitir estudos biológicos morfológicas e outros.
Introdução
O método de corte à base de parafina é uma técnica amplamente utilizada para estudos anatómicos. Preservação da anatomia tecido intacto é importante para estudos morfológicos e biológicos. A técnica de corte em parafina é vantajosa porque a parafina incorporação retém a morfologia celular e do tecido. Além disso, os blocos de parafina pode ser convenientemente armazenado por longos períodos de tempo. No entanto, o seccionamento embebido em parafina não é adequado para tecidos de plantas contendo cristais intracelulares. Cristais dentro das células, muitas vezes rasgar fitas de parafina e integridade do tecido danos durante o corte.
Ao contrário de seccionamento de parafina, cryosectioning é relativamente rápido e secções pode ser obtido sem a fixação, a desidratação de série ou a incorporação de um meio de infiltração. Criocortes são compatíveis com muitas aplicações, tais como imuno-histoquímica, hibridação in situ, e histoquímica enzima. A outra vantagem de cryosectioning éque este método não passam por um potencial de processos de desnaturação tais como temperaturas elevadas e tratamentos químicos, moléculas tão celulares são bem preservada dentro das secções de tecido 2. Cryosectioning é geralmente preferida em relação com base em parafina para seccionamento estudos em tecidos animais. No entanto, cryosectioning não é a primeira escolha em plantas, porque temperatura de congelamento, por vezes, provoca a formação de cristais de gelo que afetam a qualidade da integridade seção. Embora osmoregulação tais como soluções de sacarose, polietileno glicol (PEG), ou glicerol-3 têm sido relatados para reduzir a formação de cristal de gelo sob condições de congelamento, a melhoria é menos do que óptima.
Para se adaptar a diferentes ambientes, plantas diferentes têm muitas vezes células textura do tecido e vegetais distintas evoluíram para formar paredes rígidas celulares, fibras duras, e cristais de 4,5. Por exemplo, insolúveis cristais de oxalato de cálcio e corpos de sílica são bastante comuns naplantas 6. Corpos de silicato / cristais foram relatados para ajudar a manter a arquitectura da planta, verticalidade, e prevenir a doença ou de pragas em plantas de cereais 7-9.
As orquídeas em vasos e mercado de orquídea de flores de corte é florescente e é uma indústria crescente. Aphrodite de Phalaenopsis (orquídea de traça) é um dos mais importantes de exportação de plantas ornamentais em Taiwan. Esforços significativos têm sido feitos para entender as mudanças morfológicas e fisiológicas dos processos de florescência no orquídeas Phalaenopsis. Hastes florais de orquídeas Phalaenopsis são iniciadas a partir de gemas axilares na base da folha. Após um período de temperatura ambiente fresco (cerca de um mês e meio), gemas axilares ampliar, quebra de dormência, e se projetam a partir da base da folha de evoluir para jovens hastes florais. Para entender a fisiológica, celular e processos moleculares de iniciação pico, é essencial para desenvolver uma técnica anatômica robusta para Visuatecidos ou marcadores Lize em tempo hábil. No entanto, a presença de cristais onipresentes em tecidos de orquídeas, particularmente em gemas axilares, torna o trabalho anatômica difícil.
Aqui procuramos melhorar a integridade seção de tecidos de plantas recalcitrantes que até agora têm sido consideradas tecnicamente desafiador. Aqui nós mostramos um protocolo melhorado chamado Hybrid-Cut. É um método de corte à base de parafina, que é realizado utilizando um criostato. inclusão em parafina resolve alto teor de água no tecido vegetal. Seccionamento sob a baixa temperatura endurece o bloco de parafina, reduz cristal rasgando problema, e melhora a integridade do tecido de forma significativa. Este protocolo melhora significativamente a integridade do tecido de amostras de plantas recalcitrantes.
Protocolo
1. Fixação and Embedding
- preparação de reagentes
- 10x solução salina tamponada com fosfato (PBS)
- Adicionar 80 g de NaCl, 2 g de KCl, 14,4 g de Na 2 HPO 4, e 2,4 g de KH 2 PO 4 em 800 ml de água bidestilada (ddH2O) e ajustar o pH para 7,4 com HCl. Adicionar ddH2O para um volume total de 1 L, em seguida, adicionar 1,000 mL pirocarbonato de dietilo (DEPC) e agitar vigorosamente. Loja PBS durante a noite à temperatura ambiente e autoclave a 121 ° C durante 20 min no dia seguinte.
- 1x PBS
- Dilui-se a 10x estoque PBS a razão 1:10 em ddH2O para obter uma concentração final de 0,01 M de Na 2 HPO 4, 0,002 M de KH 2 PO 4, 0,003 M de KCl, e 0,13 M de NaCl.
- Paraformaldeído (PFA) fixador
Cuidado: O paraformaldeído é tóxico. Prepare-lo sob uma coifa. Use luvas.- Para preparar 250 mL de PFA fixador, aquecer 100ml de 1x PBS para 70 - 80 ° C e adicionar 1,750 mL de NaOH. Em seguida, adicione 10 g de paraformaldeído e misture bem até dissolver. Colocar a solução em gelo e em seguida ajustar o pH a 7,2 com H 2 SO 4 (260 - 270 ul para 100 ml) após o arrefecimento.
- Ajustar o volume até 250 ml com PBS 1x, adicionar 625 uL de glutaraldeido a uma concentração final de 0,25%. Adicionar 250 uL de Triton X-100 e 250 ul de Tween 20 para facilitar a infiltração do fixador.
NOTA: O fixador PFA podem ser armazenadas a 4 ° C durante um mês, sem perder a sua capacidade de fixação.
- Prepare a diferentes concentrações de etanol (30%, 50%, 70%, 85%, e 95%), com água tratada com DEPC.
- 10x solução salina tamponada com fosfato (PBS)
- coleta de amostras de plantas
- gemas axilares
- Use plantas de orquídeas Phalaenopsis maduros na fase de quatro folhas. Retire cuidadosamente as folhas rasgando a folha após a nervura central usando as mãos.
- Use um bisturi afiada para Carefully remover rebentos axilares a partir da base da terceira ou quarta folha na haste monopodial.
- amostra de sementes
- Colher vagens de sementes de orquídeas maduros aos 4 meses após a polinização. Corte vagens de sementes longitudinalmente com um bisturi. Agite o vagem da semente de abertura cuidadosamente e soltar as sementes secas em papel de filtro.
- protocórmios
- Semear as sementes de orquídea maduras em meio Murashige e Skoog placa de agar de 1 / 2x, e crescer num ambiente de cultura de tecido em um período de luz de 12 h e uma temperatura constante de 25 ° C. Amostra protocórmios verde em 7 semanas após a semeadura.
- corpos protocórmios-like (PLB)
- Cresça PLBs orquídea no T2 regenerar placas de agar como descrito anteriormente 10 e coloca-se sob as mesmas condições de crescimento tal como no passo 1.2.3.1. Recolha 10 PLB a uma altura de 5 - 8 mm.
- amostra de folha
- Recolha de tecido foliar de uma planta madura orquídea Phalaenopsis tal como descrito no passo1.2.1.1.
- Usar um bisturi afiado para cortar um pedaço de tecido de folha (7 mm Largura Comprimento x 5 mm) a partir da segunda folha recém desenvolvido.
- amostra de raiz
- Usando a mesma planta descrito no passo 1.2.1.1, dissecar um centímetro de comprimento do tecido ponta de raiz utilizando um bisturi afiado.
- espiga jovem
- Usar um bisturi afiado para cortar o tecido novo pico a partir da porção de ponta do pedúnculo 10 cm de comprimento.
- Botão de flor
- Extirpar um pequeno botão de flor de 5 mm de diâmetro de caule flor da orquídea. Cortar parte do tecido flor em botão longitudinalmente (3 mm de espessura).
- tecidos foliares e tecidos Spikelet de culturas de cereais
- Cortar o tecido lâmina de folha comprimento de 1 cm do primeiras folhas recém-desenvolvidos a partir de plantas de arroz, trigo e milho.
- Colete 10 espiguetas de plantas (arroz, trigo e milho) um dia antes da antese.
- gemas axilares
- Fixação
- Fix amostras de plantas imediatamente, transferindo-os para um frasco de cintilação de vidro contendo 15 ml de gelo-frio fixador PFA.
- Aplicar um vácuo (~ 720 milímetros de Hg) para amostras de plantas em um 4 ° C sala fria. Segure a vácuo durante 15 - 20 min (pequenas bolhas deve ser liberado a partir das amostras). Repita este passo até que a maioria dos tecidos afundar após a liberação do vácuo. Segurar a vácuo durante a noite e libertar o vácuo lentamente no dia seguinte.
- Desidratação
NOTA: Use o mesmo frasco da fixação através dos passos de infiltração. Pour ou usar uma pipeta para drenar a solução no passo anterior e substituir por 15 ml de solução de novo para dentro do frasco. Dependendo da textura dos tecidos, o tratamento de tecidos duros tais como gema axilar orquídea, sementes, protocormos, e PLB, e espiguetas de arroz, trigo, milho e durante um tempo mais longo; tratamento de tecidos mais suaves, como a orquídea flor em botão, jovem espiga, folhas e raízes, ea folha de arroz, trigo e milho por um tempo mais curto.- Após a fixação, mergulhar a amostra em 15 ml de 1x PBS durante 10 min em gelo.
- Desidratar amostras em séries de etanol de 15 ml à temperatura ambiente como se segue: 30% de etanol durante 30 min, 50% de etanol durante 30 min, 70% de etanol durante 1 h, 85% de etanol para 54 min para os tecidos duros e 30 min para os tecidos mais macios, 95% de etanol para 54 min para os tecidos duros e 30 min para os tecidos mais macios, e 100% de etanol duas vezes para 54 min para os tecidos duros e 30 min para os tecidos mais macios.
NOTA: As amostras de plantas podem ser armazenadas em 70% de etanol a 4 ° C durante vários meses.
- Desidratar amostras em séries de etanol de 15 ml à temperatura ambiente como se segue: 30% de etanol durante 30 min, 50% de etanol durante 30 min, 70% de etanol durante 1 h, 85% de etanol para 54 min para os tecidos duros e 30 min para os tecidos mais macios, 95% de etanol para 54 min para os tecidos duros e 30 min para os tecidos mais macios, e 100% de etanol duas vezes para 54 min para os tecidos duros e 30 min para os tecidos mais macios.
- Após a fixação, mergulhar a amostra em 15 ml de 1x PBS durante 10 min em gelo.
- infiltração de parafina
- Se infiltrar as amostras com 15 ml de etanol e xileno mistura substituto para 54 min cada para os tecidos duros e 30 min para os tecidos mais macios, à temperatura ambiente como se segue: substituto de etanol / xileno (2: 1, v / v), etanol / substituto de xileno (1 : 1, v / v), etanol substituto / xileno (1: 2, v / v), e duas vezes substituto xileno puro. Cuidado: xileno é tóxico. Faça este passo na coifa.
- Se infiltrar amostra no frasco com 15 ml de substituto de xileno e a mistura de parafina num forno a 60 ° C, durante a noite no caso dos tecidos mais duras, e durante 60 min para os tecidos mais macios, como: xileno substituto / parafina (2: 1, v / v), xileno substituto / parafina (1: 1, v / v), e xileno substituto / parafina (1: 2, v / v).
- Se infiltrar amostra com 15 ml de parafina puro duas vezes por dia e incubar a 60 ° C num forno.
- Repita o passo 1.5.3 do dia seguinte.
- incorporação de tecidos
- Ligue a alimentação do centro de tecidos incorporando 1 hora de antecedência para derreter a cera no reservatório de parafina antes da incorporação de tecidos em um bloco de parafina.
- Aquecer os moldes de metal (tamanho de base de 3,3 centímetros de comprimento x 2 cm de largura) sobre a bandeja de aquecimento a 62 ° C, e despeje cerca de 13 ml de cera fundida para a base do molde.
- Transferir uma amostra de tecido de secção 1.5.4 para dentro do molde com uma pinça aquecido e orientá-la para a posição desejada.
- Mova o moldesobre a placa fria com cuidado e deixe até que a cera é solidificado.
2. Tissue Seccionamento
- método de corte de parafina
- Adicione uma base de cera, colocando uma cassete de incorporação no topo de um molde (o mesmo tamanho na secção 1.6.2), preencher com cera fundida e remover o molde após a cera é solidificado.
NOTA: A cassete de incorporação irão formar uma base de cera para fixar o bloco de amostras de parafina. - Apare o bloco de parafina em uma forma e tamanho adequado, e colocar algumas peças de cera em uma espátula plana. Aqueça as peças de cera usando um queimador de álcool até que os derrete a cera e, em seguida, colocar a cera derretida sobre a base de cera no ponto 2.1.1 para aderir o bloco. Apertá-lo no micrótomo.
- Coloque uma lâmina nova para o micrótomo, e ajustar o ângulo de 5 graus para facilitar o seccionamento no micrótomo.
- Cortar o bloco de parafina da amostra em fatias finas (10 uM), como descrito anteriormente 11.
- Corte-Hybrid método de seccionamento
- Aparar o bloco de parafina da amostra a partir do passo 1.6.4 para uma coluna com uma superfície trapezoidal na parte superior para um tamanho apropriado utilizando uma lâmina de barbear.
- Adicione um pouco de composto corte temperatura ideal (OCT) para o centro do palco criostato. Anexar o bloco de parafina à fase de criostato e, em seguida, rapidamente orientar o bloco de tecido para a posição desejada.
- Transferir a parafina bloco / palco para uma câmara de criostato. Permitir outubro para solidificar na barra de resfriamento rápido a -42 ° C durante 10 min. Não mova o bloco durante a solidificação de outubro (Figura 2C).
- Permitir que o adaptador de criostato e a temperatura da câmara a arrefecer até -20 ° C e -16 ° C, respectivamente, antes de fixar o bloco de parafina / fase para o adaptador de criostato. Secção tecidos a 10 um de espessura.
- Escolha secções de tecido com uma pinça. Flutuar as seções sobre 800 mL de água tratada com DEPC num Poly - L - lisina coaTed corrediça e Transferir as lâminas para uma placa quente a 42 ° C.
- Permitir que as secções para achatar em água tratada com DEPC a 42 ° C. Use papel de filtro para drenar a água a partir da borda.
- tecido Mount no slide, colocando o slide em uma placa quente a 42 ° C durante a noite.
3. Tissue Coloração
- desparafinização
- Recolha os slides da placa quente e colocá-los em um rack de coloração. Adicione 150 ml de xileno em uma tina de coloração no exaustor e mergulhar o rack em xileno durante 5 min.
- Reidratação
- Preparar soluções de diferentes concentrações de etanol (100%, 95%, 70%, 50%, e 30%) em água tratada com DEPC e preencher 150 ml de solução em frascos de coloração distintas, respectivamente.
- Re-hidratar as amostras através de uma série de concentrações decrescentes de etanol, a cada passo, durante 3 minutos à temperatura ambiente. Transferir as lâminas na coloração rack de um frasco para outro frasco contendo dAs concentrações de etanol IFERENTES: 100% de etanol, 95% de etanol, 70% de etanol, 50% de etanol, e 30% de etanol.
- Após a reidratação, mergulhar os espécimes em ddH2O por 3 min.
- coloração com hematoxilina
- amostras de tecido de manchas por imersão slides de tecidos em solução de hematoxilina durante 1,5 min.
- Lavar brevemente em ddH2O contendo 1 - 2 gotas de ácido clorídrico 12 N (HCl) durante alguns segundos e, em seguida lavar brevemente em ddH 2 O.
- Desidratação
- Desidratar as amostras através de uma série de concentrações crescentes de etanol durante 3 minutos à temperatura ambiente: 30% de etanol, 50% de etanol, 70% de etanol, 95% de etanol, e 100% de etanol. Limpar os espécimes com xileno na coifa por 5 min.
- Montagem
- Gota apropriadamente 600 mL de meio de montagem à base de xileno no slide. Com cuidado, coloque uma lamela sobre o espécime. Evitar bolhas de ar formando para obter imagens de boa qualidade.
- Permitir que as lâminas para o ar seco durante a noite. Observar a amostra sob um microscópio no dia seguinte.
Nota: As imagens foram capturadas a 25X de ampliação 400X, dependendo do tamanho das amostras.
4. Hibridização In Situ
- síntese de sonda
- Sequência de codificação usando primers Clone Phalaenopsis afrodite gene da actina específicas 5'-GGCAGAGTATGATGAATCTGGTCC-3 'e 5'AGGACAGAAGTTCGGCTGGC -3' (para obter 242 bp amplicon PCR) e CyclinB1; sequência específica de codificação 1 gene utilizando os iniciadores 5'-TCGTAGCAAGGTTGCTTGTG-3 ' e 5'-ATGAGCATGGCGCTAATACC-3 '(para obter 327 pb fragmento amplificado pela PCR) como descrito 12.
- Ligar as sequências de codificação específicas em vectores (por exemplo, pGEMT) de acordo com o protocolo do fabricante.
- Gerar digoxigenina (DIG) marcado sondas sentido e anti-usando SP6 kit rotulagem / T7 DIG RNA de acordo com as instruções do fabricantes.
- A hibridação in situ
- Corte os 2 º e 3 º fatias de tecido de gemas axilares (10 mm de espessura) gerados usando o método híbrido-Cut, e montar fatias em slides revestido.
- Desparafinar secções de tecido em xileno (ver 3.1.1), re-hidratados em concentrações decrescentes de etanol (ver 3.2.2), e digest com 2 mg / ml de proteinase K a 37 ° C durante 30 min.
- Realiza-se em hibridização in situ de acordo com o protocolo anteriormente descrito, com algumas modificações 11,13, ou seja, com a temperatura de hibridização para a actina como 59 ° C e 60 ° C durante CyclinB1;. 1 A hibridização corrediça com 40 ng de sonda marcada com DIG RNA.
- Use 5-bromo-4-cloro-3-indolil fosfato (NBT / BCIP) / solução de nitroazul de tetrazólio para detectar sinais de hibridação tal como descrito 11.
- Adicione uma base de cera, colocando uma cassete de incorporação no topo de um molde (o mesmo tamanho na secção 1.6.2), preencher com cera fundida e remover o molde após a cera é solidificado.
Resultados
Hybrid-Cut melhora a integridade dos cortes de tecidos
Conhecimento da anatomia da estrutura floral reprodutiva é importante para investigar o mecanismo subjacente de iniciação flor em orquídeas. No entanto, o acúmulo de cristais de oxalato de cálcio intracelular em orquídeas Phalaenopsis faz tais estudos uma tarefa desafiadora. Para contornar os problemas associados com lacrimejamento causado por cristais durante o processo de corte (Figura 1), foi desenvolvido um sistema que chamado Hybrid-Cut. Este protocolo combina técnicas de inclusão em parafina e criocorte tradicionais. Nós testado pela primeira vez em gemas axilares de Phalaenopsis, porque eles são notórios por rigidez dos tecidos eo conteúdo cristal de alta Corte-Hybrid. tecido gema axilar foi fixado em 4% PFA (ver protocolo, passo 1.3). Após a desidratação de etanol de série e parafina infiltration, a gema axilar foi incorporado em um bloco de parafina. O bloco foi cortado para um tamanho adequado antes de seccionamento (Figura 2A). Uma pequena quantidade de outubro foi então aplicada no centro da fase de criostato (Figura 2B). O bloco de parafina foi então feita aderir à fase através de outubro O estágio foi incubado num criostato para 10 min para permitir a solidificação completa de outubro antes do corte (Figura 2C) e, em seguida, criocorte foi realizada num -16 Câmara ° C (Figura 2D).
A título de comparação, um bloco de parafina contendo uma gema axilar de Phalaenopsis foi submetido a corte micrótomo regular. Como mostrado na Figura 1A, foi observada grave ruptura das fitas de parafina depois de seccionamento micrótomo. A integridade dos tecidos e estrutura celular também foi comprometido (Figura 1B). Híbrido-corte, por outro lado,secções dos tecidos produzidos intactas (Figura 3A) com integridade estrutural conservada (Figura 3B).
Aplicação de Hybrid-Corta para vários tecidos do P. Afrodita
Para testar ainda mais a receptividade de Hybrid-Cut, testamos diferentes tecidos de orquídeas Phalaenopsis. Muitas vezes é difícil para obtenção de cortes de sementes com boa integridade do tecido por causa das tegumento endurecido. Usando este protocolo, as estruturas pormenorizadas de sementes foram preservadas após seccionamento (Figura 4A). Como mostrado na Figura 4A, os corpos de proteína, os produtos de armazenagem comum 14, podendo ser claramente identificado. Híbrido-Cut também funcionou com sucesso e mostrou as estruturas pormenorizadas do meristema apical do rebento de um mês de idade protocormos (a estrutura germinadas a partir de uma semente) (Figura 4B) eprotocórmios-como-corpos (PLB, Figura 4C). Os cristais intracelulares foram observados em seções de orquídeas PLB. Phalaenopsis têm as folhas grossas e suculentas e eles executam o metabolismo do ácido crassuláceo (CAM) -tipo fotossíntese 15. A secção transversal da lâmina foliar mostrou grandes células do mesofilo e feixes vasculares contendo xilema e floema (Figura 4D). Poucas aberturas estomáticas foram observadas na face inferior da folha durante o dia (Figura 4D). Na verdade, as plantas CAM evoluiu para maximizar o ganho de carbono, mas minimizar simultaneamente a perda de água através da abertura de seus estômatos na noite sob condições áridas 15,16. O meristema apical da raiz de P. afrodite é mostrado na Figura 4E. As células ponta da raiz parecia conter um número significativo de cristais, que foram muito bem conservadas após seccionamento (Figura 4E). cortes longitudinais de jovens hastes florais fornecida informatíon sobre a arquitetura do primordiais florais jovens (Figura 4F). Além disso, sépalas, pétalas, labelo e pollinia poderia ser claramente identificados a partir da seção longitudinal de botões florais jovens que completaram a diferenciação neste botão de flor 5 mm (Figura 4G). Observe que os cristais foram acumulados nas sépalas de jovens botões florais. Em suma, este protocolo funciona de forma consistente para manter a integridade dos tecidos e produz morfologia intacta permitindo estudos celulares anatômicas e possíveis.
Hybrid-Cut Preserva a integridade dos tecidos em culturas de cereais
Nós também testado em culturas de cereais, como arroz, trigo e milho que contêm alto teor de sílica 17,18 Cut-Hybrid. Como mostrado na Figura 5, a integridade do tecido de secções transversais de arroz, trigo, milho e folhas foram significativamente melhorados pelo Hybrid-Cut método. células do xilema, floema, células do mesofilo, estomas e buliformes que controlam rolamento do limbo para evitar a perda de água foram claramente identificados a partir de seções de folhas de arroz. A anatomia Kranz, células do mesofilo e feixes vasculares da folha de milho 19,20 foram claramente identificadas. Foi intrigante descobrir uma alta densidade de estômatos em ambos os lados adaxial e abaxial de folhas de milho (Figura 5). A proporção de estômatos adaxial e abaxial de 0,7 em milho tem sido relatado previamente 21. Além disso, este protocolo também funcionou com sucesso para proporcionar a morfologia celular detalhada de espiguetas de arroz, trigo e milho (Figura 6). Spikelets são conhecidos por conter abundante de sílica 9. Normalmente, que provoca dificuldade na realização de corte de tecido.
Hibridização In Situ
Genômica e abordagens transcriptomic são comumente usado para anotar as funções dos genes. Que proporciona a distribuição espacial dos transcritos dos genes de interesse em contextos de desenvolvimento ou ambientais é importante para adicionar uma nova visão sobre as possíveis funções dos genes. Hibridização in-situ (ISH) foi desenvolvido para localizar os padrões de expressão de genes ao nível do tecido 11, 22-25. Além disso, pode fornecer ISH celular, e em alguns casos, sub-celular, a resolução da distribuição de ARNm em organismos multicelulares 26. Durante ISH, RNA e integridade do tecido é essencial para a obtenção de informações espaciais confiáveis sobre a transcrição selecionado. Testamos ISH usando o protocolo Hybrid-Cut gene da actina (PATC157348) foi clonado utilizando os iniciadores 5'-GGCAGAGTATGATGAATCTGGTCC-3 'e 5'AGGACAGAAGTTCGGCTGGC -3' para obter 242 bp PCR amplicon ciclina B1:.. 1 (PATC146999) gene específico sequência de codificação, utilizando os iniciadores 5'-TCGTAGCAAGGTTGCTTGTG-3 'E 5'-ATGAGCATGGCGCTAATACC-3' para obter 327 pb fragmento amplificado pela PCR. Depois de ISH, actina e ciclina B1: 1 expressão gênica foi monitorada em jovens e maduras gemas axilares (Figura 7). Ambos os genes foram expressos em células meristemáticas de 2 ND 3 e gomos axilares Rd, com sinais mais fortes detectada em 3 gemas axilares Rd. Estes resultados demonstraram que Hybrid-Cut reter boa anatomia e fornecer padrão de expressão gênica espacial.

Figura 1: Seção de parafina tradicional causa lacrimejamento grave de Tissue Um bloco de parafina contendo uma gema axilar de orquídea Phalaenopsis foi submetido a corte micrótomo regular.. Observou-se rasgar severa das fitas de parafina após corte micrótomo tradicional (A) . A integridade dos tecidos e estrutura celular também foi comprometida (B). As setas mostram a grave rasgamento da fatia de tecido. A seta mostra os corpos de cristal. Barra de escala de 100 m. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2:. Hybrid-Cut Método Seccionamento Um tecido de gemas axilares foi fixado em PFA e os tecidos foram desidratados, infiltrado com parafina e incorporado em um bloco de parafina. O bloco de parafina foi cortada para um tamanho apropriado (A). Óptima composto de corte de temperatura (OCT) foi aplicada no centro do criostato fase (B). O bloco de parafina foi anexado aos PTU no palco criostato. Sob baixa temperatura, o bloco de parafina foi aderida à fase criostato através de outubro (C). Fatias de tecido foram seccionados na câmara de criostato a -16 ° C (D). Barras de escala representam 0,5 cm (A), e 1 cm (BD). Por favor clique aqui para ver uma versão maior desta figura.
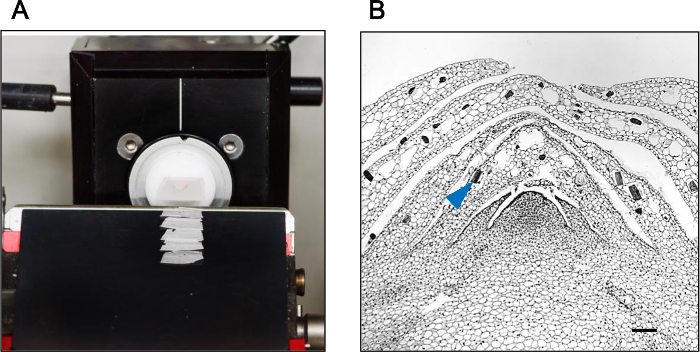
Figura 3: Hybrid-Cut Melhora a Seção de Integridade Um bloco de parafina contendo uma gema axilar de orquídea Phalaenopsis foi submetido a Hybrid-Cut seccionamento (A) eo método híbrido-Cut seções com excelente integridade do tecido (B) produzido.. A seta mostra os corpos de cristal endógenos embutidos no tecido de gemas axilares. A barra de escala 100? M.rget = "_ blank"> Clique aqui para ver uma versão maior desta figura.

Figura 4: Aplicação de a várias secções de tecido de orquídea Phalaenopsis Corte-Hybrid orquídea diferente. os tecidos foram seccionados utilizando o método híbrido-corte, tal como a secção longitudinal de sementes de orquídea durante a fase madura (A), em corte longitudinal de protocormos (B), em corte longitudinal de corpos protocormos-like (PLB) (C), a secção transversal de lâmina de folha (D), seção longitudinal da raiz (e), seção longitudinal do jovem flor pico (F), e secção longitudinal de botões florais jovens (G). As secções de tecido foram coradas pela hematoxilina. SC, revestimento de semente; PB, o corpo de proteínas; H,meristema; MP, mãe PLB; DP, filha PLB; Ad, face inferior das folhas; Ab, face inferior da folha; St, estômatos; MC, célula mesofilo; VB, feixe vascular; RC, coifa; fb, botão de flor; Se, sepal; Pe, pétala; La, labelo; Po, pollinia; Ro, rostellum; Ca, calo. Pontas de setas mostram cristais. Barras de escala representam 20 mm (AE) e 200 mm (FG). Por favor clique aqui para ver uma versão maior desta figura.

Figura 5:. Hybrid-Cut Preserva Folha integridade do tecido em diversas culturas de cereais Comparação de tecido foliar usando o método tradicional de parafina (painel da esquerda) ea técnica de Hybrid-Cut desenvolvido neste estudo (painel da direita). Imagens mostram secções transversais da folha de arroz, trigo, milho e. MC, célula mesofilo; Ph, floema; St, estômatos; BC, bu celular lliform. As setas mostram o rasgamento da fatia de tecido. Pontas de flechas mostram corpos de sílica. Os azuis tracejadas círculos indicam anatomia Kranz no milho C4. Escala de barras 20 um. Por favor clique aqui para ver uma versão maior desta figura.

Figura 6:. Hybrid-Cut Preserva Spikelet Tissue Integrity em diversas culturas de cereais Comparação de integridade do tecido de secções Spikelet entre os métodos de parafina e Hybrid-corte tradicional. As setas mostram o rasgamento da fatia de tecido. As setas indicam corpos de sílica. Barras de escala de 20 mm (arroz) e 200 mm (trigo e milho). Por favor clique aqui para ver uma versão maior desta figura.

Figura 7: Hibridização In Situ de actina e CyclinB1; 1 padrões de expressão na axilar Bud da orquídea Phalaenopsis fatias de tecido do rd de gemas axilares 2º gemas axilares e 3 foram preparadas utilizando o método híbrido-Cut.. Um total de 40 ng de actina e CyclinB1; 1 sonda marcada com dig foram utilizados para hibridização. A sonda de sentido directo foi utilizado como um controlo negativo. As setas indicam o meristema reprodutiva da gema axilar. Escala de barras 100 mm. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
As células vegetais têm paredes rígidas celulares, fibras duras, cristais e elevado teor de água que causam problemas rasgar o tecido durante o corte de tecidos vegetais. Apesar de corte à base de parafina é frequentemente utilizado para tecidos de plantas, muitas vezes os cristais endógenos dilacerar o tecido da planta durante o corte (Figura 1). Devido ao teor de água elevado inerentemente dentro das células da planta, corte com base em criostato muitas vezes faz com que as células quebradas e secções de tecido rachadas.
No presente estudo, um protocolo de parafina-incorporação e criocorte combinado chamado Hybrid-Cut foi desenvolvido e bons cortes de tecidos de qualidade foram obtidos. Este protocolo resolve o problema associado com elevado teor de água através da introdução de inclusão em parafina, e reduz o efeito de arrancamento por endurecimento da cera de parafina sob baixa temperatura durante o corte (Figura 3). Portanto, este protocolo modificado é vantajoso sobre qualquer sectio à base de parafinaning ou cryosectioning para preservar a integridade do tecido da planta.
Este manuscrito demonstra que o método híbrido-Cut preserva a integridade do tecido, em muitos tecidos de Phalaenopsis tais como gema axilar, sementes, e PLB, etc, que contêm níveis elevados de cristais (Figuras 3-4). Além disso, este protocolo é passível de colheitas de cereais tais como órgãos reprodutores e folhas de arroz, milho e trigo, que contêm elevado teor de sílica (Figuras 5-6). Presumivelmente, este protocolo pode ser aplicado a plantas lenhosas que contêm alto teor de fibras.
Em geral, o tecido completamente fixação é muito importante para o Híbrido-Cut. Descobrimos que fixador ácido-álcool formaldeído-ácido (FAA) é melhor do que o PFA para preservar a integridade do tecido de alguns tecidos tais como botões recalcitrantes axialmente, raízes, etc. No entanto, PFA funciona melhor do que FAA na preservação da integridade do RNA. Portanto PFA é recomendado para corrigiramostra para hibridação in situ trabalho (ISH). O protocolo aqui descrito é projetada para a experiência RNA ISH. Por isso, foram preparados todos os reagentes para evitar a degradação do RNA, eliminando a contaminação RNase por tratamento DEPC. Se secção Hybrid-Cut é para estudos anatômicos, osmose reversa água normal (RO) e seu tampão ou reagentes derivados são aceitáveis.
Reduzindo o tamanho da amostra e a espessura inferior a 3 mm é útil para a infiltração. Além disso, aumentando o tempo de imersão para a desidratação e infiltração são necessárias para tecidos de textura dura. Limitação deste protocolo pode devido a problemas causados pela fixação inadequada, desidratação e infiltração de amostra. Portanto, o ajuste de tempo de processamento para cada etapa é fundamental para a produção de blocos de parafina de boa qualidade. Normalmente, o tecido mais precisa de mais tempo de processamento do que o tecido mais macio.
Além disso, mostramos que a Hybrid-Cut trabalhado com sucesso em combinação with ISH para proporcionar uma distribuição espacial dos transcritos seleccionados (figura 7). Em resumo, este protocolo é útil para o estudo da anatomia da planta e fornece um mapa de ARN específico do tecido dos genes seleccionados. Além disso, pode ser aplicado a outros estudos moleculares, tais como ensaio de transferase terminal de desoxinucleotidilo marcação terminal dUTP nick (TUNEL), hibridação in situ fluorescente (FISH), e técnicas de imunocoloração. Em conclusão, este melhorada protocolo de seccionamento de tecidos é útil e útil para pesquisadores em comunidades de plantas.
Divulgações
No conflicts of interest declared.
Agradecimentos
We are grateful to the technical support from Ms. Hong Xian Hsing, Mr. Min Jeng Li, and Mr. Eric C. P. Wu. We express our appreciation to Miranda Loney for English editing.
Materiais
| Name | Company | Catalog Number | Comments |
| Embedding Center model EC780-1 | CSA | ||
| Microtome model RM2255 | Leica | ||
| Cryostat model CM 1950 | Leica | ||
| Axio Scope A1 microscope | Zeiss | ||
| Murashige & Skoog medium including vitamins | Duchefa Biochemia | M0222.0050 | |
| RNase free surface decontaminant | Apex | 10-228 | |
| Diethyl pyrocarbonate (DEPC) | Bio Basic Inc. | D801154 | |
| Sodium chloride (NaCl) | MDBio, Inc. | 101-7647-14-5 | |
| Potassium chloride, crystal (KCl) | J.T. Baker | 7447-40-7 | |
| Sodium phosphate dibasic (Na2HPO4) | Sigma-Aldrich | 7558-79-4 | |
| Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | 7778-77-0 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 16005 | |
| Sodium hydroxide (NaOH) | Showa | 19430160 | |
| Sulfuric acid (H2SO4) | Sigma-Aldrich | 7664-93-9 | |
| Glutaraldehyde solution | Sigma-Aldrich | 111-30-8 | |
| Polyoxyethylene 20 sorbitan monolaurate (Tween 20) | J.T. Baker | 9005-64-5 | |
| Octyl Phenol Ethoxylate (Triton X100) | J.T. Baker | 9002-93-1 | |
| Glass scintillation vials | Newastar | DG60805-00020 | |
| Desiccator vacuum | Violet Bioscience Inc. | TS-402030 | |
| Rotary vane pump RZ2.5 | Vacuubrand | 36149406 | |
| Ethanol | J.T. Baker | 64-17-5 | |
| Sub-X | Leica Surgipath | 3803670 | Xylene substitute |
| Paraplast Plus | Leica Surgipath | 39602004 | Tissue embedding paraffin |
| SUPERFROST micro slide glass | Matsunami | S7441 | |
| FSC 22 Clear | Leica Surgipath | 3801480 | Optimal Cutting Temperature compound (OCT) |
| Xylenes, Purified | Leica Surgipath | 3803665 | |
| Hematoxylin | Merck | HX305311 | |
| Hydrochloric acid (HCl) | Sigma-Aldrich | 7647-01-0 | |
| Micromount | Leica Surgipath | 3801731 | Mounting medium |
| pGEM T-easy vector | Promega | A1360 | |
| Proteinase K | Roche | 3115879001 | |
| SP6/T7 DIG RNA Labeling Kit | Roche | 11175025910 | |
| NBT/BCIP stock solution | Roche | 11681451001 |
Referências
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Cryosectioning tissues. Cold Spring Harb Protoc. 3, 1-2 (2008).
- Knox, R. B. Freeze-sectioning of plant tissues. Stain Technol. 45, 265-272 (1970).
- Ruan, J. L., et al. An improved cryosection method for polyethylene glycol hydrogels used in tissue engineering. Tissue Eng.: Part C Methods. 19, 794-801 (2013).
- Prychid, C. J., Rudall, P. J. Calcium oxalate crystals in monocotyledons: A review of their structure and systematics. Ann Bot. 84, 725-739 (1999).
- Prychid, C. J., Rudall, P. J., Gregory, M. Systematics and biology of silica bodies in monocotyledons. Bot. Rev. 69 (4), 377-440 (2004).
- Arnott, H. J., Pautard, F. G. E., Steinfink, H. Structure of calcium oxalate monohydrate. Nature. 208, 1197-1198 (1965).
- Mitani, N., Yamaji, N., Ma, J. F. Identification of maize silicon influx transporters. Plant Cell Physiol. 50, 5-12 (2009).
- Hayasaka, T., Fujii, H., Ishiguro, K. The role of silicon in preventing appressorial penetration by the rice blast fungus. Phytopathology. 98, 1038-1044 (2008).
- Ma, J. F., Yamaji, N. Silicon uptake and accumulation in higher plants. Trends Plant Sci. 11, 392-397 (2006).
- Chen, W., Tang, C., YL, K. Ploidy doubling by in vitro culture of excised protocorms or protocorm-like bodies in Phalaenopsis species. Plant Cell Tiss Org. 98, 229-239 (2009).
- Javelle, M., Marco, C. F., Timmermans, M. In Situ Hybridization for the Precise Localization of Transcripts in Plants. J. Vis. Exp. (57), e3328(2011).
- Park, D. J. E. PCR Protocols. Methods in Molecular Biology. 687, (2011).
- Lin, H. Y., et al. Genome-wide annotation, expression profiling, and protein interaction studies of the core cell-cycle genes in Phalaenopsis aphrodite. Plant Mol Biol. 84, 203-226 (2014).
- Lee, Y. -I., Yeung, E. C., Lee, N., Chung, M. -C. Embryology of Phalaenopsis amabilis var. formosa: embryo development. Bot Stud. 49, 139-146 (2008).
- Endo, M., Ikusima, I. Diurnal rhythm and characteristics of photosynthesis and respiration in the leaf and root of a Phalaenopsis plant. Plant Cell Physiol. 30, 43-47 (1989).
- Guo, W. J., Lee, N. Effect of leaf and plant age, and day/night temperature on net CO2 uptake in Phalaenopsis amabilis var. formosa. J. Amer. Soc. Hort. Sci. 131, 320-326 (2006).
- Lewin, J., Reimann, B. Silicon and plant growth. Ann. Rev. of Plant Physiol. 20, 289-304 (1969).
- Kaufman, P. B., et al. Silica in shoots of higher plants. Silicon and siliceous structures in biological systems. Simpson, T. L., Valcani, B. E. , Springer-Verlag. 409-449 (1981).
- Lundgren, M. R., Osborne, C. P., Christin, P. A. Deconstructing Kranz anatomy to understand C4 evolution. J Exp Bot. 65, 3357-3369 (2014).
- Liu, W. Y., et al. Anatomical and transcriptional dynamics of maize embryonic leaves during seed germination. Proc Natl Acad Sci U S A. 110, 3979-3984 (2013).
- Driscoll, S. P., Prins, A., Olmos, E., Kunert, K. J., Foyer, C. H. Specification of adaxial and abaxial stomata, epidermal structure and photosynthesis to CO2 enrichment in maize leaves. J Exp Bot. 57, 381-390 (2006).
- Karlgren, A., Carlsson, J., Gyllenstrand, N., Lagercrantz, U., Sundström, J. F. Non-radioactive in situ Hybridization Protocol Applicable for Norway Spruce and a Range of Plant Species. J. Vis. Exp. (26), (2009).
- Hejatko, J., et al. In situ hybridization technique for mRNA detection in whole mount Arabidopsis samples. Nat Protoc. 1, 1939-1946 (2006).
- Javelle, M., Timmermans, M. C. In situ localization of small RNAs in plants by using LNA probes. Nat Protoc. 7, 533-541 (2012).
- Drea, S., et al. In situ analysis of gene expression in plants. Methods Mol Biol. 513, 229-242 (2009).
- Drea, S., et al. A streamlined method for systematic, high resolution in situ analysis of mRNA distribution in plants. Plant Methods. 1, 8(2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados