Method Article
الهجين قطع: طريقة محسنة باجتزاء لعينات الأنسجة النباتية المتمردة
In This Article
Summary
This protocol describes a simple Hybrid-Cut tissue sectioning method that is useful for recalcitrant plant tissues. Good quality tissue sections enable anatomical studies and other biological studies including in situ hybridization (ISH).
Abstract
الحفاظ على قسم النبات سلامة الضروري لدراسة الهياكل التشريحية مفصلة في الخلوية والأنسجة، أو حتى على مستوى الأعضاء. ومع ذلك، فإن بعض الخلايا النباتية لها جدران الخلايا صلبة، الألياف صعبة وبلورات (أكسالات الكالسيوم، والسليكا، وما إلى ذلك)، ونسبة عالية من المياه التي غالبا ما يعطل سلامة الأنسجة خلال باجتزاء الأنسجة النباتية.
وتحدد هذه الدراسة الأنسجة قطع الهجين طريقة بسيطة باجتزاء. هذا البروتوكول بتعديل أسلوب باجتزاء القائم على البرافين ويحسن سلامة أقسام الأنسجة من النباتات المختلفة. كانت جزءا لا يتجزأ من الأنسجة النباتية في البارافين قبل باجتزاء في ناظم البرد في -16 درجة مئوية. باجتزاء تحت درجة حرارة منخفضة تصلب كتل البارافين، وانخفاض تمزيق والخدش، وتحسين سلامة الأنسجة بشكل كبير. تم تطبيق هذا البروتوكول بنجاح إلى الكالسيوم الأنسجة فالاينوبسيس السحلبية-أكسالات الغنية وكذلك الأنسجة المتمردة مثل ORGA الإنجابنانوثانية وأوراق الأرز، والذرة، والقمح. وبالإضافة إلى ذلك، ونوعية عالية من أقسام الأنسجة من الهجين قص يمكن استخدامها في تركيبة مع التهجين في الموقع (ISH) لتوفير أنماط التعبير المكانية للجينات الفائدة. وفي الختام، وهذا البروتوكول هو مفيد بشكل خاص للالأنسجة النباتية المتمردة التي تحتوي على الكريستال عالية أو محتوى السيليكا. تمكن أقسام الأنسجة ذات نوعية جيدة الدراسات البيولوجية المورفولوجية وغيرها.
Introduction
طريقة باجتزاء القائم على البرافين هو أسلوب يستخدم على نطاق واسع للدراسات تشريحية. الحفاظ على تشريح الأنسجة سليمة مهم للدراسات المورفولوجية والبيولوجية. تقنية باجتزاء جزءا لا يتجزأ من البارافين هو مفيد لالبارافين التضمين يحتفظ الخلايا والأنسجة التشكل. وبالإضافة إلى ذلك، وكتل البارافين ويمكن تخزين مريح لفترات طويلة من الزمن. ومع ذلك، باجتزاء جزءا لا يتجزأ من البارافين ليست مناسبة للأنسجة النباتات التي تحتوي على بلورات داخل الخلايا. بلورات داخل الخلايا في كثير من الأحيان المسيل للدموع وأشرطة البارافين وسلامة الأنسجة الضرر أثناء باجتزاء.
على عكس باجتزاء البارافين، cryosectioning سريع نسبيا ويمكن الحصول على المقاطع دون تثبيت، والجفاف تسلسلي أو تضمين تسلل المتوسط 1. Cryosections متوافقة مع العديد من التطبيقات مثل المناعية والتهجين في الموقع، والكيمياء النسيجية الانزيم. ميزة أخرى من cryosectioning هيأن هذا الأسلوب لا تذهب من خلال عمليات تمسخ المحتملة مثل ارتفاع درجة الحرارة والعلاجات الكيميائية، والجزيئات الخلوية بحيث يتم الاحتفاظ بشكل جيد داخل أقسام الأنسجة 2. ويفضل Cryosectioning عموما على القائم على البرافين باجتزاء للدراسات في الأنسجة الحيوانية. ومع ذلك، cryosectioning ليس هو الخيار الأول في النباتات لدرجة حرارة التجمد يسبب في بعض الأحيان تكوين بلورات الثلج التي تؤثر على نوعية من قسم السلامة. على الرغم من أن التنظيم الاسموزي مثل حلول السكروز، البولي ايثيلين جلايكول (PEG)، أو الجلسرين 3 تم الإبلاغ للحد من تكون الجليد الكريستال في ظل ظروف التجميد، وتحسين أقل من المستوى الأمثل.
على التكيف مع بيئات مختلفة، وغالبا ما يكون نباتات مختلفة تطورت متميزة خلايا نسيج نسيج ومصنع لتشكيل الجدران الصلبة المحمولة، والألياف صعبة، وبلورات 4،5. على سبيل المثال، غير قابلة للذوبان بلورات أكسالات الكالسيوم والهيئات السيليكا شائعة إلى حد ما فيمصانع 6. / تم الإبلاغ الهيئات سيليكات بلورات للمساعدة في الحفاظ على بنية النبات، الإنتصاب، والوقاية من الأمراض أو الآفات في نباتات الحبوب 7-9.
بساتين الفاكهة بوعاء وقطع زهرة السحلبية سوق مزدهرة وأنه هو الصناعة المتنامية. فالاينوبسيس أفروديت (العثة السحلية) هو واحد من نباتات الزينة التصدير الأكثر أهمية في تايوان. وقد بذلت جهود كبيرة لفهم التغيرات المورفولوجية والفسيولوجية للعمليات المزهرة في بساتين الفاكهة فالاينوبسيس. وبدأت المسامير الزهور من بساتين الفاكهة فالاينوبسيس من البراعم الإبطية في قاعدة ورقة. بعد فترة من درجة الحرارة المحيطة باردة (ما يقرب من شهر ونصف)، براعم الإبطين تكبير، وكسر السكون، وتبرز من قاعدة ورقة على التطور إلى ارتفاع الأزهار الصغيرة. لفهم الفسيولوجية والخلوية، والعمليات الجزيئية للبدء السنبلة، لا بد من تطوير تقنية التشريحية قوية لvisuaالأنسجة ليز أو علامات في الوقت المناسب. ومع ذلك، فإن وجود بلورات في كل مكان في أنسجة السحلية، لا سيما في البراعم الإبطية، ويجعل العمل التشريحية صعوبة.
نحن هنا سعت إلى تحسين قسم سلامة الأنسجة النباتية المتمردة التي تعتبر حتى الآن تحديا من الناحية التقنية. نحن هنا تظهر تحسن بروتوكول اسمه الهجين قص. وهي طريقة باجتزاء القائم على البرافين التي يتم تنفيذها باستخدام ناظم البرد. تضمين البارافين يحل نسبة عالية من المياه في الأنسجة النباتية. باجتزاء تحت درجة حرارة منخفضة يصلب كتلة البارافين، ويقلل من وضوح الشمس تمزيق المشكلة، ويحسن سلامة الأنسجة بشكل كبير. هذا البروتوكول بشكل كبير على تحسين سلامة الأنسجة للعينات النباتية المتمردة.
Protocol
1. التثبيت وتضمينها
- إعداد الكاشف
- مخزنة الفوسفات-10X المالحة (PBS)
- إضافة 80 جم كلوريد الصوديوم، 2 غرام بوكل، 14.4 غ نا 2 هبو 4، و 2.4 ز KH 2 PO 4 في 800 مل من الماء المقطر المزدوج ([ده 2 O) وضبط درجة الحموضة إلى 7.4 مع حمض الهيدروكلوريك. إضافة ده 2 O إلى إجمالي حجم 1 لتر، ثم إضافة 1000 ميكرولتر اثيل pyrocarbonate (DEPC) ويهز بقوة. متجر PBS بين عشية وضحاها في درجة حرارة الغرفة والأوتوكلاف على 121 درجة مئوية لمدة 20 دقيقة في اليوم التالي.
- برنامج تلفزيوني 1X
- تمييع 10X الأسهم برنامج تلفزيوني في 1:10 النسبة في ده 2 O للحصول على تركيز النهائي من 0.01 م نا 2 هبو 4، 0.002 M KH 2 PO 4، 0.003 م بوكل، و 0.13 م كلوريد الصوديوم.
- بارافورمالدهيد (PFA) مثبت
تحذير: لامتصاص العرق هي سامة. إعداده تحت غطاء الدخان. البس القفازات.- لإعداد 250 مل PFA تثبيتي، حرارة 100مل برنامج تلفزيوني 1X إلى 70 - 80 درجة مئوية وإضافة 1750 ميكرولتر من هيدروكسيد الصوديوم. ثم إضافة 10 غرام من امتصاص العرق وتخلط جيدا حتى يذوب. وضع الحل على الجليد ثم ضبط درجة الحموضة إلى 7.2 مع H 2 SO 4 (260-270 ميكرولتر 100 مل) بعد التبريد.
- ضبط مستوى الصوت إلى 250 مل مع برنامج تلفزيوني 1X، إضافة 625 ميكرولتر غلوتارالدهيد إلى تركيز النهائي من 0.25٪. إضافة 250 ميكرولتر تريتون X-100 و 250 ميكرولتر توين 20 لتسهيل تسلل تثبيتي.
ملاحظة: يمكن تخزين تثبيتي PFA في 4 درجة مئوية لمدة شهر واحد دون أن تفقد القدرة تثبيت لها.
- إعداد تركيزات مختلفة من الإيثانول (30٪، 50٪، 70٪، 85٪، و 95٪) مع المياه المعالجة DEPC.
- مخزنة الفوسفات-10X المالحة (PBS)
- جمع العينات النباتية
- البراعم الإبطية
- استخدام النباتات فالاينوبسيس السحلبية ناضجة في مرحلة أربع أوراق. بعناية إزالة الأوراق من تمزق ورقة التالية الضلع الأوسط باستخدام اليدين.
- استخدام مشرط حاد مع carefully إزالة البراعم الإبطية من قاعدة ورقة ثالثة أو رابعة على الجذع أحاد القدم.
- عينة البذور
- حصاد البذرة السحلية الناضجة في 4 أشهر بعد التلقيح. قطع البذرة طوليا مع مشرط. يهز جراب البذور افتتاح بلطف والافراج عن البذور الجافة على ورق الترشيح.
- Protocorm
- زرع بذور الأوركيد ناضجة في 1 / 2X Murashige وسكوغ لوحة أجار، وتنمو في غرفة زراعة الأنسجة في فترة ضوء 12 ساعة ودرجة حرارة ثابتة من 25 درجة مئوية. عينة protocorm الأخضر في 7 أسابيع بعد البذر.
- هيئات مثل Protocorm (PLBs)
- تنمو PLBs السحلية على T2 تجديد لوحات أجار كما هو موضح سابقا 10 ومكان تحت ظروف النمو نفسها كما في الخطوة 1.2.3.1. جمع 10 PLBs على ارتفاع 5-8 ملم.
- عينة ورقة
- جمع الأنسجة ورقة من نبات السحلبية فالاينوبسيس ناضجة كما هو موضح في الخطوة1.2.1.1.
- استخدام مشرط حاد لقطع قطعة صغيرة من الأنسجة ورقة (7 مم عرض × طول 5 ملم) من الثانية ورقة وضعت حديثا.
- عينة الجذر
- باستخدام نفس النبات هو موضح في الخطوة 1.2.1.1، تشريح 1 سم طول من النسيج قمة الجذر باستخدام مشرط حاد.
- ارتفاع الشباب
- استخدام مشرط حاد لقطع الأنسجة ارتفاع الشباب من الجزء غيض من زهرة ساق 10 سم في الطول.
- برعم زهرة
- استئصال برعم زهرة صغيرة من 5 ملم وقطرها من ساق زهرة السحلبية. قطع جزء من نسيج برعم زهرة طوليا (3 مم في السمك).
- الأنسجة ورقة والأنسجة السنبيلة محاصيل الحبوب
- قطع 1 سم ورقة طول الأنسجة شفرة من أول الأوراق التي تم تطويرها حديثا من نباتات الأرز والقمح والذرة.
- جمع 10 السنبيلات من النباتات (الأرز والقمح والذرة) قبل يوم واحد anthesis.
- البراعم الإبطية
- تثبيت
- إصلاح عينات النبات على الفور من قبل نقلها إلى قارورة زجاجية التلألؤ تحتوي على 15 مل الجليد الباردة PFA تثبيتي.
- تطبيق فراغ (~ 720 ملم زئبق) للعينات النباتية في غرفة 4 ° C بارد. عقد فراغ ل15-20 دقيقة (ينبغي الإفراج عن فقاعات صغيرة من العينات). كرر هذه الخطوة حتى معظم الأنسجة تغرق بعد الافراج عن فراغ. عقد فراغ بين عشية وضحاها والافراج عن فراغ ببطء في اليوم التالي.
- جفاف
ملاحظة: استخدم نفس القارورة من التثبيت من خلال الخطوات تسلل. صب أو استخدام ماصة لتصريف الحل في الخطوة السابقة واستبدالها مع 15 مل من محلول جديد في قارورة. اعتمادا على نسيج من أنسجة الجسم، علاج الأنسجة أصعب مثل برعم إبطي السحلية، والبذور، protocorm، وPLB، والسنبيلة من الأرز والقمح والذرة لفترة أطول. علاج الأنسجة ليونة مثل السحلية برعم زهرة، ارتفاع الشباب، ورقة وجذر، ورقة من الأرز والقمح والذرة لفترة أقصر. - بعد التثبيت، وتزج العينة في 15 مل برنامج تلفزيوني 1X لمدة 10 دقيقة على الجليد.
- يذوى العينات في 15 مل سلسلة الايثانول في درجة حرارة الغرفة على النحو التالي: 30٪ من الإيثانول لمدة 30 دقيقة، 50٪ من الإيثانول لمدة 30 دقيقة، و 70٪ من الإيثانول لمدة 1 ساعة، 85٪ من الإيثانول لمدة 54 دقيقة لأنسجة أصعب و 30 دقيقة للأنسجة ليونة، 95٪ من الإيثانول لمدة 54 دقيقة لأنسجة أصعب و 30 دقيقة للأنسجة ليونة، و 100٪ من الإيثانول مرتين لمدة 54 دقيقة لأنسجة أصعب و 30 دقيقة للأنسجة ليونة.
ملاحظة: عينات نباتية يمكن تخزينها في الايثانول 70٪ في 4 درجات مئوية لعدة أشهر.
- يذوى العينات في 15 مل سلسلة الايثانول في درجة حرارة الغرفة على النحو التالي: 30٪ من الإيثانول لمدة 30 دقيقة، 50٪ من الإيثانول لمدة 30 دقيقة، و 70٪ من الإيثانول لمدة 1 ساعة، 85٪ من الإيثانول لمدة 54 دقيقة لأنسجة أصعب و 30 دقيقة للأنسجة ليونة، 95٪ من الإيثانول لمدة 54 دقيقة لأنسجة أصعب و 30 دقيقة للأنسجة ليونة، و 100٪ من الإيثانول مرتين لمدة 54 دقيقة لأنسجة أصعب و 30 دقيقة للأنسجة ليونة.
- التسلل العينات مع 15 مل من الإيثانول والزيلين بديلا الخليط لمدة 54 دقيقة لكل منهما لأنسجة أصعب و 30 دقيقة للأنسجة ليونة، في درجة حرارة الغرفة على النحو التالي: بديل الايثانول / زيلين (2: 1، ت / ت)، والإيثانول / زيلين بديل (1 : 1، ت / ت)، بديلا الإيثانول / زيلين (1: 2، ت / ت)، ونقية زيلين بديلا مرتين. تحذير: الزيلين سامة. القيام بهذه الخطوة في غطاء الدخان.
- التسلل العينة في قارورة مع 15 مل بديلا زيلين وخليط البارافين في الفرن على 60 درجة مئوية، وبين عشية وضحاها لأنسجة أصعب، ولمدة 60 دقيقة للأنسجة ليونة على النحو التالي: زيلين بديل / البارافين (2: 1، ت / ت)، زيلين بديل / البارافين (1: 1، ت / ت)، والزيلين بديل / البارافين (1: 2، ت / ت).
- التسلل العينة مع 15 مل البارافين النقي مرتين في اليوم، واحتضان عند 60 درجة مئوية في الفرن.
- كرر الخطوة 1.5.3 في اليوم التالي.
- تبديل على السلطة من المركز الأنسجة تضمين 1 ساعة مقدما لإذابة الشمع في خزان البارافين قبل تضمين الأنسجة في كتلة البارافين.
- الاحماء القوالب المعدنية (حجم قاعدة 3.3 سم عرض طول × 2 سم) على علبة الاحترار في 62 درجة مئوية، وتصب حوالي 13 مل من الشمع المنصهر في قاعدة العفن.
- نقل عينات الأنسجة واحد من القسم 1.5.4 في القالب مع ملقط تحسنت وتوجيهه في الموضع المطلوب.
- نقل العفنعلى لوحة باردة بعناية، وترك حتى توطد الشمع.
2. الأنسجة باجتزاء
- البارافين طريقة باجتزاء
- جعل قاعدة الشمع عن طريق وضع كاسيت تضمين على رأس قالب (نفس الحجم في القسم 1.6.2)، وملء مع الشمع المنصهر وإزالة العفن بعد توطد الشمع.
ملاحظة: سيتم كاسيت تضمين تشكيل قاعدة الشمع لترسيخ كتلة عينة البارافين. - تقليم كتلة البارافين إلى الشكل والحجم المناسب، ووضع بعض قطع الشمع على ملعقة مسطحة. تسخين قطع الشمع باستخدام الموقد الكحول حتى يذوب الشمع وبعد ذلك وضع الشمع المصهور على قاعدة الشمع في القسم 2.1.1 التمسك كتلة. المشبك في مشراح.
- وضع شفرة جديدة على مشراح، وضبط زاوية إلى 5 درجات لتسهيل باجتزاء في مشراح.
- خفض كتلة البارافين العينة إلى شرائح رقيقة (10 ميكرون)، كما هو موضح سابقا (11).
- قص الهجين باجتزاء طريقة
- تقليم كتلة البارافين عينة من الخطوة 1.6.4 إلى عمود مع سطح شبه منحرف في الجزء العلوي إلى الحجم المناسب باستخدام شفرة حلاقة.
- إضافة بعض الأمثل مركب قطع درجة الحرارة (أكتوبر) إلى وسط المسرح ناظم البرد. إرفاق كتلة البارافين إلى مرحلة ناظم البرد، ثم سرعان ما توجه كتلة الأنسجة في الموضع المطلوب.
- نقل البارافين كتلة / مرحلة إلى غرفة ناظم البرد. السماح أكتوبر لترسيخ على شريط تجميد سريع في -42 درجة مئوية لمدة 10 دقيقة. لا تتحرك كتلة خلال التصلب من أكتوبر (الشكل 2C).
- تسمح لمحول ناظم البرد ودرجة حرارة الغرفة حتى يبرد إلى -20 درجة مئوية و -16 درجة مئوية على التوالي قبل إرفاق البارافين كتلة / مرحلة إلى محول ناظم البرد. الأنسجة قسم إلى 10 ميكرون في سمك.
- اختيار أقسام الأنسجة مع ملقط. تعويم المقاطع على 800 ميكرولتر المياه المعالجة DEPC في بولي - L - يسين الصتيد شريحة ونقل الشرائح على طبق ساخن في درجة حرارة 42 درجة مئوية.
- تسمح المقاطع للشد على المياه المعالجة DEPC-في 42 درجة مئوية. استخدام ورق الترشيح لتصريف المياه من الحافة.
- جبل الأنسجة على الشريحة عن طريق وضع شريحة على طبق من ذهب 42 ° C ساخنة بين عشية وضحاها.
3. الأنسجة تلطيخ
- Deparaffinization
- جمع الشرائح من صفيحة ساخنة ووضعها في رف تلطيخ. إضافة 150 مل زيلين في جرة تلطيخ في غطاء الدخان وتزج رف في الزيلين لمدة 5 دقائق.
- الإماهة
- إعداد تركيزات مختلفة من الحلول الإيثانول (100٪، 95٪، 70٪، 50٪، و 30٪) في المياه المعالجة DEPC وملء 150 مل من محلول في الجرار تلطيخ متميزة، على التوالي.
- ترطيب عينات من خلال سلسلة من خفض تركيز الإيثانول، كل خطوة لمدة 3 دقائق في درجة حرارة الغرفة. نقل الشرائح في تلطيخ الرف جرة واحدة على جرة تحتوي على د آخرتركيزات الإيثانول ifferent: الإيثانول بنسبة 100٪، 95٪ الايثانول و 70٪ الايثانول و 50٪ إيثانول، و 30٪ من الإيثانول.
- بعد الإماهة، تزج العينات في ده 2 O لمدة 3 دقائق.
- الهيماتوكسيلين تلطيخ
- عينات الأنسجة وصمة عار عن طريق غمر شرائح الأنسجة في حل الهيماتوكسيلين لمدة 1.5 دقيقة.
- شطف لفترة وجيزة في DDH 2 O التي تحتوي على 1-2 قطرات من 12 N حمض الهيدروكلوريك (حمض الهيدروكلوريك) لبضع ثوان، ثم يغسل لفترة وجيزة في DDH 2 O.
- جفاف
- يذوى العينات من خلال سلسلة من زيادة تركيزات الإيثانول لمدة 3 دقائق في درجة حرارة الغرفة: 30٪ الايثانول و 50٪ إيثانول، الايثانول 70٪، 95٪ إيثانول، و 100 الإيثانول٪. مسح العينات مع زيلين في غطاء الدخان لمدة 5 دقائق.
- متزايد
- إسقاط بشكل مناسب 600 ميكرولتر من المتوسطة المتزايدة على أساس زيلين على الشريحة. وضع بعناية ساترة على العينة. تجنب فقاعات الهواء تشكيل للحصول على صور ذات نوعية جيدة.
- السماح للشرائح لجوية ليلية الجاف. مراقبة العينة تحت المجهر في اليوم التالي.
تم التقاط الصور في 25X إلى 400X التكبير اعتمادا على حجم العينات: مذكرة.
4. في الموقع التهجين
- تركيب التحقيق
- استنساخ فالاينوبسيس أفروديت أكتين جينية معينة تسلسل الترميز باستخدام بادئات 5'-GGCAGAGTATGATGAATCTGGTCC-3 'و5'- AGGACAGAAGTTCGGCTGGC -3 "(للحصول على 242 شركة بريتيش بتروليوم PCR amplicon) وCyclinB1؛ (1) جين معين تسلسل الترميز باستخدام بادئات 5'-TCGTAGCAAGGTTGCTTGTG-3" و5'- ATGAGCATGGCGCTAATACC-3 "(للحصول على 327 شركة بريتيش بتروليوم PCR amplicon) كما هو موضح 12.
- Ligate تسلسل الترميز محددة في ناقلات (على سبيل المثال، pGEMT) وفقا لبروتوكول الشركة المصنعة.
- توليد digoxigenin (DIG) المسمى معنى والعقاقير تحقيقات باستخدام SP6 / T7 DIG RNA وضع العلامات عدة وفقا لتعليمات الشركة الصانعةالصورة.
- في الموقع التهجين
- قطع 2 الثانية والثالثة 3 شرائح الأنسجة إبطي برعم (10 ميكرون سمك) ولدت باستخدام طريقة الهجين قص وتركيب شرائح على الشرائح المغلفة.
- Deparaffinize أقسام الأنسجة في زيلين (انظر 3.1.1)، ترطيب في خفض تركيزات الإيثانول (انظر 3.2.2)، وهضم مع 2 ملغ / مل بروتين كاف عند 37 درجة مئوية لمدة 30 دقيقة.
- أداء التهجين في الموقع وفقا لبروتوكول سبق وصفها 11،13 مع بعض التعديلات، أي مع درجة الحرارة التهجين لأكتين كما 59 درجة مئوية و 60 درجة مئوية لمدة CyclinB1؛ 1 هجن الشرائح مع 40 نانوغرام المسمى DIG RNA التحقيق.
- استخدام تترازوليوم نتروبلو / 5-برومو-4-كلورو-3-indolyl الفوسفات (NBT / BCIP) حل للكشف عن الإشارات التهجين كما هو موضح 11.
- جعل قاعدة الشمع عن طريق وضع كاسيت تضمين على رأس قالب (نفس الحجم في القسم 1.6.2)، وملء مع الشمع المنصهر وإزالة العفن بعد توطد الشمع.
النتائج
الهجين قطع يحسن النزاهة من أقسام الأنسجة
فهم تشريح بنية الأزهار الإنجاب المهم للتحقق من الآلية الكامنة وراء بدء زهرة في بساتين الفاكهة. ومع ذلك، فإن تراكم بلورات أكسالات الكالسيوم داخل الخلايا في بساتين الفاكهة فالاينوبسيس يجعل مثل هذه الدراسات مهمة صعبة. الالتفاف على المشاكل المرتبطة يمزق الناجمة عن بلورات أثناء عملية باجتزاء (الشكل 1)، قمنا بتطوير النظام الذي يدعى الهجين قص. هذا البروتوكول يجمع بين تقنيات التضمين البارافين وcryosection التقليدية. نحن أول اختبار في البراعم الإبطية من فالاينوبسيس السحلبية لأنها سيئة السمعة لصلابة الأنسجة ومحتوى الكريستال عالية قطع الهجين. تم إصلاح الأنسجة برعم إبطي في 4٪ PFA (انظر البروتوكول، خطوة 1.3). بعد الجفاف الايثانول التسلسلي والبارافين الشمع طnfiltration، كان جزءا لا يتجزأ من برعم إبطي في كتلة البارافين. وقد تم خفض كتلة إلى حجم مناسب قبل باجتزاء (الشكل 2A). ثم تم تطبيق كمية صغيرة من أكتوبر إلى وسط المسرح ناظم البرد (الشكل 2B). وبعد ذلك انضمت كتلة البارافين إلى المرحلة عبر أكتوبر وقد حضنت المرحلة في ناظم البرد لمدة 10 دقيقة للسماح التصلب كاملة من أكتوبر قبل باجتزاء (الشكل 2C) وبعد ذلك تم إجراء cryosection في -16 ° C غرفة (الشكل 2D).
وعلى سبيل المقارنة، تعرض كتلة البارافين تحتوي على برعم إبطي من فالاينوبسيس السحلبية إلى باجتزاء مشراح منتظم. كما هو مبين في الشكل 1A، لوحظ تمزق شديد في أشرطة البارافين بعد باجتزاء مشراح. وقد يؤثر سلبا على سلامة الأنسجة والبنية الخلوية أيضا (الشكل 1B). هجين قص، من ناحية أخرى،أقسام المنتجة سليمة الأنسجة (الشكل 3A) مع السلامة الهيكلية الحفاظ عليها (الشكل 3B).
تطبيق الهجين قطع لأنسجة مختلفة من P. أفروديت
لمزيد من اختبار قابليته للالهجين قص، نحن اختبار أنسجة مختلفة من زهور الأوركيد فالاينوبسيس. غالبا ما يكون من الصعب الحصول على أجزاء من البذور مع سلامة الأنسجة جيدة بسبب المعاطف البذور متانة. باستخدام هذا البروتوكول، والحفاظ على الهياكل التفصيلية من البذور بعد باجتزاء الشكل (4A). كما هو مبين في الشكل 4A، والهيئات البروتين، ومنتجات التخزين المشتركة 14، يمكن تحديدها بوضوح. كما عملت الهجين قص بنجاح وأظهرت الهياكل التفصيلية من النسيج الإنشائي تبادل لاطلاق النار قمي من protocorm عمره شهر واحد (هيكل نبتت من بذرة) (الشكل 4B) ومثل protocorm أجسام (PLBs، الشكل 4C). وقد لوحظت بلورات داخل الخلايا في أجزاء من بساتين الفاكهة PLB. فالاينوبسيس ديك أوراق سميكة والنضرة ويؤدون Crassulacean حمض الأيض (CAM) من نوع الضوئي 15. وأظهر المقطع العرضي من رقة شفرة خلايا نسيج الورقة المتوسط كبيرة والحزم الوعائية التي تحتوي على الخشب واللحاء (الشكل 4D). وقد لوحظت قليل من فتحات الثغور على سطح ورقة مجافي المحور أثناء النهار (الشكل 4D). في الواقع، والنباتات CAM تطورت لتعظيم مكاسب الكربون ولكن تقليل وقت واحد وفقدان المياه من خلال فتح stomates في الليل تحت الظروف الجافة 15،16. جذور النسيج الإنشائي القمي من P. يظهر أفروديت في الشكل 4E. ظهرت الخلايا قمة الجذر تحتوي على عدد كبير من البلورات، والتي تم الحفاظ عليها بشكل جيد للغاية بعد باجتزاء (الشكل 4E). قدمت المقاطع الطولية من المسامير الزهور الشابة المعلومات حول عمليةايون حول بنية primordials الأزهار الصغيرة (الشكل 4F). وعلاوة على ذلك، كأسية، بتلات، labellum، وpollinia يمكن تحديد بشكل واضح من المقطع الطولي من براعم الزهور الشابة التي استكملت التمايز في هذا 5 مم برعم زهرة (الشكل 4G). لاحظ أن تراكمت البلورات في كأسية من البراعم الزهرية الصغيرة. باختصار، هذا البروتوكول يعمل باستمرار للحفاظ على سلامة الأنسجة وتنتج التشكل سليمة تمكن الدراسات الخلوية التشريحية والممكنة.
الهجين قطع يحافظ على سلامة الأنسجة في محاصيل الحبوب
اختبرنا أيضا على محاصيل الحبوب مثل الأرز والقمح والذرة التي تحتوي على نسبة عالية من السيليكا 17،18 قص الهجين. كما هو مبين في الشكل (5)، وتحسين سلامة الأنسجة من المقاطع العرضية من الأرز، والقمح، وأوراق الذرة بشكل كبير من قبل هاي brid قص الأسلوب. خلايا الخشب، اللحاء، وخلايا نسيج الورقة المتوسط، stomates، وbulliform التي تتحكم في المتداول من ورقة شفرة لتجنب فقدان المياه وحددت بشكل واضح من أقسام أوراق الأرز. وقد تم التعرف على التشريح كرانز، خلايا نسيج الورقة المتوسط، والحزم الوعائية للأوراق الذرة 19،20 بوضوح. وكان فضول لإيجاد كثافة عالية من stomates على كلا الجانبين متجه نحو المحور ومجافي المحور من أوراق الذرة (الشكل 5). تم الإبلاغ عن نسبة الثغور متجه نحو المحور ومجافي المحور من 0.7 في الذرة سابقا 21. وبالإضافة إلى ذلك، كما عملت هذا البروتوكول بنجاح لتوفير مورفولوجيا الخلايا مفصل السنبيلات من الأرز والقمح والذرة (الشكل 6). ومن المعروف السنبيلات لاحتواء وفرة السيليكا 9. عادة، الذي يسبب صعوبة في إجراء باجتزاء الأنسجة.
في التهجين الموضعي
= "1"> تستخدم الجينوم والنهج transcriptomic عادة لتعليم وظائف الجينات. توفير التوزيع المكاني للنصوص جينات الفائدة في السياقات التنموية والبيئية المهم لإضافة نظرة جديدة إلى الوظائف المحتملة من الجينات. التهجين (ISH) وقد وضعت في الوضع الطبيعي لحصر أنماط التعبير الجيني على مستوى الأنسجة 11، 22-25. وبالإضافة إلى ذلك، يمكن ISH توفير الخلوي، وفي بعض الحالات شبه الخلوية، قرار التوزيع مرنا في الكائنات متعددة الخلايا (26). خلال فرط ضغط الدم، RNA وسلامة الأنسجة ضروري للحصول على المعلومات المكانية موثوقة حول نص المحدد. اختبرنا ISH باستخدام بروتوكول الهجين قص تم استنساخ الجين الأكتين (PATC157348) باستخدام بادئات 5'-GGCAGAGTATGATGAATCTGGTCC-3 'و5'- AGGACAGAAGTTCGGCTGGC -3 "للحصول على 242 شركة بريتيش بتروليوم PCR amplicon السيكلين B1: 1 (PATC146999) جينة محددة تسلسل الترميز باستخدام بادئات 5'-TCGTAGCAAGGTTGCTTGTG-3 "و5'- ATGAGCATGGCGCTAATACC-3" للحصول على 327 شركة بريتيش بتروليوم PCR amplicon. بعد فرط ضغط الدم، أكتين والسيكلين B1: 1 التعبير الجيني تم رصدها في البراعم الإبطية شابة وناضجة . وأعرب عن (الشكل 7) كل من الجينات في الخلايا الإنشائية في الثانية 2 و 3 البراعم الإبطية الثالثة، مع إشارات أقوى اكتشفت في 3 البراعم الإبطية الثالثة. وأظهرت هذه النتائج أن الهجين قص الاحتفاظ تشريح جيدة وتوفير المكاني نمط التعبير الجيني.

الشكل 1: القسم البارافين التقليدية يسبب تمزق شديد في الأنسجة تعرض كتلة البارافين تحتوي على برعم إبطي من فالاينوبسيس السحلبية إلى باجتزاء مشراح منتظم. وقد لوحظ تمزق شديد في أشرطة البارافين بعد باجتزاء مشراح التقليدي (A) . وقد خطر على سلامة الأنسجة والبنية الخلوية أيضا (B). وتشير الأسهم تمزق شديد في شريحة الأنسجة. يظهر رأس السهم الهيئات وضوح الشمس. شريط مقياس 100 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: الهجين قص باجتزاء الطريقة تم إصلاح أحد الأنسجة إبطي برعم في منهاج العمل، وكانت الأنسجة المجففة، تسللت من شمع البرافين، وجزءا لا يتجزأ من كتلة البارافين. وقد تم خفض كتلة البارافين إلى الحجم المناسب (A). تم تطبيق الأمثل قطع درجة الحرارة المركب (أكتوبر) إلى وسط المسرح ناظم البرد (B). وعلقت كتلة البارافين إلى أكتوبر على المسرح ناظم البرد. تحت درجة حرارة منخفضة، وكتلة البارافين وقد انضمت إلى مرحلة ناظم البرد عبر أكتوبر (C). ومقطوع شرائح الأنسجة في الغرفة ناظم البرد في -16 درجة مئوية (D). أشرطة النطاق تمثل 0.5 سم (A)، و 1 سم (دينار بحريني). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
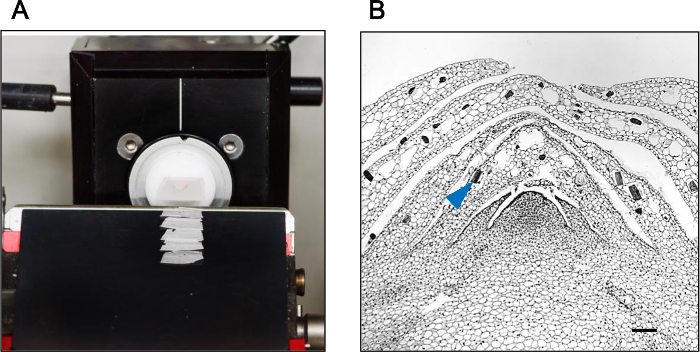
الشكل (3): الهجين قص يحسن النزاهة القسم تعرض كتلة البارافين تحتوي على برعم إبطي من فالاينوبسيس السحلبية لالهجين قص باجتزاء (A) وطريقة الهجين قص إنتاج المقاطع مع سلامة الأنسجة الممتازة (ب). يظهر رأس السهم الهيئات الكريستال الذاتية جزءا لا يتجزأ من النسيج إبطي مهدها. شريط مقياس 100 ميكرون.r يمكنك الحصول = "_ فارغة"> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: تطبيق لأقسام الأنسجة المختلفة للفالاينوبسيس السحلبية قص الهجين السحلية المختلفة. ومقطوع الأنسجة باستخدام طريقة الهجين قص، مثل المقطع الطولي من البذور السحلية أثناء مرحلة النضج (A)، المقطع الطولي من protocorm (B)، المقطع الطولي من هيئات مثل protocorm (PLB) (C)، المقطع العرضي لل رقة شفرة (D)، المقطع الطولي من الجذر (E)، المقطع الطولي من الشباب زهرة سنبلة (F)، والمقطع الطولي من براعم الزهور الصغيرة (G). كانت ملطخة أقسام الأنسجة التي كتبها الهيماتوكسيلين. SC، معطف البذور؛ PB، الجسم البروتين. M،النسيج الإنشائي. النائب والدة PLB. موانئ دبي، ابنة PLB. إعلان، سطح الورقة متجه نحو المحور. أب، سطح ورقة مجافي المحور. شارع الثغور. MC، خلية نسيج الورقة المتوسط. VB، الحزمة الوعائية. الصليب الأحمر، قلنسوة الجذر. أف ب، برعم زهرة. حد ذاتها، سيبال. المؤسسة العامة، البتلة. لا، labellum. بو، pollinia. رو، منقاف. كاليفورنيا، الكالس. تظهر رؤوس سهام البلورات. تمثل الحانات نطاق 20 ميكرون (AE) و 200 ميكرون (FG). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الرقم 5: الهجين قص يحافظ على سلامة الأنسجة ورقة في عدة محاصيل الحبوب مقارنة بين الأنسجة ورقة باستخدام الطريقة التقليدية البارافين (لوحة اليسار) وتقنية الهجين قص وضعت في هذه الدراسة (لوحة الأيمن). الصور تظهر المقاطع العرضية ورقة من الأرز والقمح والذرة. MC، خلية نسيج الورقة المتوسط. الرقم الهيدروجيني، اللحاء. شارع الثغور. قبل الميلاد، بو خلية lliform. وتشير الأسهم إلى تمزيق شريحة الأنسجة. تظهر رؤوس سهام الهيئات السيليكا. وتشير الدوائر الزرقاء متقطع التشريح كرانز في C4 الذرة. على نطاق ويمنع 20 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الرقم 6: الهجين قص يحافظ على سلامة الأنسجة بالسنبيله في عدة محاصيل الحبوب مقارنة سلامة الأنسجة من أقسام السنبيلة بين أساليب البارافين والهجين قص التقليدية. وتشير الأسهم إلى تمزيق شريحة الأنسجة. وتشير النصال الهيئات السيليكا. الحانات نطاق 20 ميكرون (الأرز)، و 200 ميكرون (القمح والذرة). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الرقم 7: في الموقع التهجين أكتين وCyclinB1؛ (1) أنماط التعبير في إبطي برعم من أعدت فالاينوبسيس السحلبية شرائح الأنسجة من 2 الثانية البراعم الإبطية و 3 الثالثة إبطي برعم باستخدام طريقة الهجين قص. واستخدمت 1 المسمى حفر التحقيق لتهجين، ما مجموعه 40 نانوغرام من الأكتين وCyclinB1. تم استخدام التحقيق الشعور كوسيلة لمراقبة سلبية. تشير الأسهم في النسيج الإنشائي التناسلي للبرعم إبطي. على نطاق ويمنع 100 ميكرون. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
الخلايا النباتية والجدران الصلبة المحمولة، والألياف صعبة، البلورات، ونسبة عالية من المياه التي تسبب مشاكل تمزق الأنسجة أثناء باجتزاء الأنسجة النباتية. على الرغم من أن كثيرا ما يستخدم باجتزاء القائم على البرافين لأنسجة النبات، وبلورات الذاتية غالبا ما ممزق الأنسجة النباتية خلال باجتزاء (الشكل 1). ونظرا لنسبة عالية من المياه بطبيعتها داخل الخلايا النباتية، باجتزاء القائم ناظم البرد وغالبا ما يسبب خلايا مكسورة وأقسام الأنسجة متصدع.
في هذه الدراسة، تم تطوير جنبا إلى جنب بروتوكول البارافين التضمين وcryosection اسمه الهجين قص وتم الحصول عليها جيدة أقسام الأنسجة الجودة. هذا البروتوكول يحل المشكلة المرتبطة نسبة عالية من المياه عن طريق إدخال البارافين التضمين، ويقلل من تأثير تمزق لتصلب شمع البارافين تحت درجة حرارة منخفضة خلال باجتزاء (الشكل 3). لذلك، هذا البروتوكول المعدل هو مفيد أكثر من أي التقطيعة القائم على البرافيننينغ أو cryosectioning للحفاظ على سلامة الأنسجة النباتية.
توضح هذه المخطوطة أن طريقة الهجين قص يحافظ على سلامة الأنسجة في العديد من الأنسجة من فالاينوبسيس السحلبية مثل برعم إبطي، والبذور، وPLB، الخ التي تحتوي على مستويات عالية من بلورات (الشكلان 3-4). وعلاوة على ذلك، وهذا البروتوكول هو قابل للمحاصيل الحبوب مثل الأعضاء التناسلية وأوراق الأرز، والذرة، والقمح التي تحتوي على السيليكا عالية (الشكلان 5-6). ويفترض، ويمكن تطبيق هذا البروتوكول لودي النباتات التي تحتوي على الألياف عالية.
بشكل عام، وتحديد الأنسجة بدقة بالغة الأهمية لالهجين قص. وجدنا أن تثبيتي حامض الفورمالديهايد الكحول الحمضية (FAA) هو أفضل من منهاج العمل للحفاظ على سلامة الأنسجة من بعض الأنسجة المتمردة مثل براعم محوريا، والجذور، وما إلى ذلك، PFA يعمل بشكل أفضل من القوات المسلحة الأنغولية في الحفاظ على سلامة الحمض النووي الريبي. لذلك يوصى PFA لإصلاحعينة لفي الموقع التهجين (ISH) العمل. تم تصميم البروتوكول الموصوفة هنا لتجربة RNA ISH. لذلك، تم إعداد جميع الكواشف لتجنب تدهور الحمض النووي الريبي عن طريق القضاء على التلوث ريبونوكلياز عن طريق العلاج DEPC. إذا الهجين قص القسم للدراسات تشريحية، التناضح العكسي (RO) المياه العادية وعازلة أو الكواشف المشتقة منها مقبولة.
تقليل حجم العينة وسماكة أقل من 3 مم مفيد للتسلل. وعلاوة على ذلك، وزيادة الوقت الغمر للجفاف وتسلل ضرورية لأنسجة الملمس الصعبة. الحد من هذا البروتوكول قد يرجع ذلك إلى المشاكل الناجمة عن عدم كفاية التثبيت، والجفاف، وتسلل من العينة. لذلك، وتعديل الوقت لتجهيز كل خطوة أمر بالغ الأهمية لإنتاج كتلة البارافين نوعية جيدة. عادة، الأنسجة أصعب تحتاج وقتا أطول معالجة من الأنسجة ليونة.
وبالإضافة إلى ذلك، أظهرت لنا أن الهجين قص عملت بنجاح في تركيبة وايISH التاسع لتوفير التوزيع المكاني للنصوص مختارة (الشكل 7). باختصار، هذا البروتوكول هو مفيد لدراسة علم تشريح النبات ويوفر خريطة الحمض النووي الريبي الأنسجة محددة للجينات منتقاة. بالإضافة إلى ذلك فإنه يمكن تطبيقها على الدراسات الجزيئية الأخرى مثل محطة deoxynucleotidyl ترانسفيراز dUTP نيك نهاية الوسم (النفق) مقايسة، مضان في الموقع التهجين (FISH)، والتقنيات المناعية. في الختام، هذا المحسن بروتوكول باجتزاء الأنسجة على حد سواء مفيدة ومفيدة للباحثين في المجتمعات النباتية.
Disclosures
No conflicts of interest declared.
Acknowledgements
We are grateful to the technical support from Ms. Hong Xian Hsing, Mr. Min Jeng Li, and Mr. Eric C. P. Wu. We express our appreciation to Miranda Loney for English editing.
Materials
| Name | Company | Catalog Number | Comments |
| Embedding Center model EC780-1 | CSA | ||
| Microtome model RM2255 | Leica | ||
| Cryostat model CM 1950 | Leica | ||
| Axio Scope A1 microscope | Zeiss | ||
| Murashige & Skoog medium including vitamins | Duchefa Biochemia | M0222.0050 | |
| RNase free surface decontaminant | Apex | 10-228 | |
| Diethyl pyrocarbonate (DEPC) | Bio Basic Inc. | D801154 | |
| Sodium chloride (NaCl) | MDBio, Inc. | 101-7647-14-5 | |
| Potassium chloride, crystal (KCl) | J.T. Baker | 7447-40-7 | |
| Sodium phosphate dibasic (Na2HPO4) | Sigma-Aldrich | 7558-79-4 | |
| Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | 7778-77-0 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 16005 | |
| Sodium hydroxide (NaOH) | Showa | 19430160 | |
| Sulfuric acid (H2SO4) | Sigma-Aldrich | 7664-93-9 | |
| Glutaraldehyde solution | Sigma-Aldrich | 111-30-8 | |
| Polyoxyethylene 20 sorbitan monolaurate (Tween 20) | J.T. Baker | 9005-64-5 | |
| Octyl Phenol Ethoxylate (Triton X100) | J.T. Baker | 9002-93-1 | |
| Glass scintillation vials | Newastar | DG60805-00020 | |
| Desiccator vacuum | Violet Bioscience Inc. | TS-402030 | |
| Rotary vane pump RZ2.5 | Vacuubrand | 36149406 | |
| Ethanol | J.T. Baker | 64-17-5 | |
| Sub-X | Leica Surgipath | 3803670 | Xylene substitute |
| Paraplast Plus | Leica Surgipath | 39602004 | Tissue embedding paraffin |
| SUPERFROST micro slide glass | Matsunami | S7441 | |
| FSC 22 Clear | Leica Surgipath | 3801480 | Optimal Cutting Temperature compound (OCT) |
| Xylenes, Purified | Leica Surgipath | 3803665 | |
| Hematoxylin | Merck | HX305311 | |
| Hydrochloric acid (HCl) | Sigma-Aldrich | 7647-01-0 | |
| Micromount | Leica Surgipath | 3801731 | Mounting medium |
| pGEM T-easy vector | Promega | A1360 | |
| Proteinase K | Roche | 3115879001 | |
| SP6/T7 DIG RNA Labeling Kit | Roche | 11175025910 | |
| NBT/BCIP stock solution | Roche | 11681451001 |
References
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Cryosectioning tissues. Cold Spring Harb Protoc. 3, 1-2 (2008).
- Knox, R. B. Freeze-sectioning of plant tissues. Stain Technol. 45, 265-272 (1970).
- Ruan, J. L., et al. An improved cryosection method for polyethylene glycol hydrogels used in tissue engineering. Tissue Eng.: Part C Methods. 19, 794-801 (2013).
- Prychid, C. J., Rudall, P. J. Calcium oxalate crystals in monocotyledons: A review of their structure and systematics. Ann Bot. 84, 725-739 (1999).
- Prychid, C. J., Rudall, P. J., Gregory, M. Systematics and biology of silica bodies in monocotyledons. Bot. Rev. 69 (4), 377-440 (2004).
- Arnott, H. J., Pautard, F. G. E., Steinfink, H. Structure of calcium oxalate monohydrate. Nature. 208, 1197-1198 (1965).
- Mitani, N., Yamaji, N., Ma, J. F. Identification of maize silicon influx transporters. Plant Cell Physiol. 50, 5-12 (2009).
- Hayasaka, T., Fujii, H., Ishiguro, K. The role of silicon in preventing appressorial penetration by the rice blast fungus. Phytopathology. 98, 1038-1044 (2008).
- Ma, J. F., Yamaji, N. Silicon uptake and accumulation in higher plants. Trends Plant Sci. 11, 392-397 (2006).
- Chen, W., Tang, C., YL, K. Ploidy doubling by in vitro culture of excised protocorms or protocorm-like bodies in Phalaenopsis species. Plant Cell Tiss Org. 98, 229-239 (2009).
- Javelle, M., Marco, C. F., Timmermans, M. In Situ Hybridization for the Precise Localization of Transcripts in Plants. J. Vis. Exp. (57), e3328 (2011).
- Park, D. J. E. PCR Protocols. Methods in Molecular Biology. 687, (2011).
- Lin, H. Y., et al. Genome-wide annotation, expression profiling, and protein interaction studies of the core cell-cycle genes in Phalaenopsis aphrodite. Plant Mol Biol. 84, 203-226 (2014).
- Lee, Y. -. I., Yeung, E. C., Lee, N., Chung, M. -. C. Embryology of Phalaenopsis amabilis var. formosa: embryo development. Bot Stud. 49, 139-146 (2008).
- Endo, M., Ikusima, I. Diurnal rhythm and characteristics of photosynthesis and respiration in the leaf and root of a Phalaenopsis plant. Plant Cell Physiol. 30, 43-47 (1989).
- Guo, W. J., Lee, N. Effect of leaf and plant age, and day/night temperature on net CO2 uptake in Phalaenopsis amabilis var. formosa. J. Amer. Soc. Hort. Sci. 131, 320-326 (2006).
- Lewin, J., Reimann, B. Silicon and plant growth. Ann. Rev. of Plant Physiol. 20, 289-304 (1969).
- Kaufman, P. B., Simpson, T. L., Valcani, B. E., et al. Silica in shoots of higher plants. Silicon and siliceous structures in biological systems. , 409-449 (1981).
- Lundgren, M. R., Osborne, C. P., Christin, P. A. Deconstructing Kranz anatomy to understand C4 evolution. J Exp Bot. 65, 3357-3369 (2014).
- Liu, W. Y., et al. Anatomical and transcriptional dynamics of maize embryonic leaves during seed germination. Proc Natl Acad Sci U S A. 110, 3979-3984 (2013).
- Driscoll, S. P., Prins, A., Olmos, E., Kunert, K. J., Foyer, C. H. Specification of adaxial and abaxial stomata, epidermal structure and photosynthesis to CO2 enrichment in maize leaves. J Exp Bot. 57, 381-390 (2006).
- Karlgren, A., Carlsson, J., Gyllenstrand, N., Lagercrantz, U., Sundström, J. F. Non-radioactive in situ Hybridization Protocol Applicable for Norway Spruce and a Range of Plant Species. J. Vis. Exp. (26), (2009).
- Hejatko, J., et al. In situ hybridization technique for mRNA detection in whole mount Arabidopsis samples. Nat Protoc. 1, 1939-1946 (2006).
- Javelle, M., Timmermans, M. C. In situ localization of small RNAs in plants by using LNA probes. Nat Protoc. 7, 533-541 (2012).
- Drea, S., et al. In situ analysis of gene expression in plants. Methods Mol Biol. 513, 229-242 (2009).
- Drea, S., et al. A streamlined method for systematic, high resolution in situ analysis of mRNA distribution in plants. Plant Methods. 1, 8 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved