Method Article
Híbrido-Cut: un método de seccionamiento mejorada para muestras de tejido de la planta recalcitrante
En este artículo
Resumen
This protocol describes a simple Hybrid-Cut tissue sectioning method that is useful for recalcitrant plant tissues. Good quality tissue sections enable anatomical studies and other biological studies including in situ hybridization (ISH).
Resumen
El mantenimiento de la integridad sección de la planta es esencial para el estudio de las estructuras anatómicas detalladas en el celular, tisular, o incluso a nivel de órganos. Sin embargo, algunas células vegetales tienen paredes celulares rígidas, fibras duras y cristales (oxalato de calcio, sílice, etc.), y alto contenido de agua que a menudo interrumpen la integridad del tejido durante el corte del tejido de la planta.
Este estudio establece un método simple de seccionar el tejido híbrido-Cut. Este protocolo modifica una técnica de corte a base de parafina y mejora la integridad de secciones de tejido de diferentes plantas. Los tejidos vegetales fueron incluidos en parafina antes de seccionar en un criostato a -16 ° C. Seccionar a baja temperatura endureció el bloques de parafina, la reducción de rasgado y el rascado, y mejoró significativamente la integridad del tejido. Este protocolo se aplicó con éxito a los tejidos Phalaenopsis orquídeas ricos en oxalato de calcio, así como tejidos recalcitrantes tales como orga reproductivans y hojas de arroz, maíz y trigo. Además, la alta calidad de secciones de tejido de Hybrid-Cut podría ser utilizado en combinación con hibridación in situ (ISH) para proporcionar los patrones de expresión espacial de genes de interés. En conclusión, este protocolo es particularmente útil para el tejido vegetal que contiene recalcitrante alto contenido de sílice cristalina o. secciones de tejido de buena calidad permiten a los estudios biológicos y morfológicos otros.
Introducción
El método de corte a base de parafina es una técnica ampliamente utilizada para estudios anatómicos. La preservación de la anatomía del tejido intacto es importante para los estudios morfológicos y biológicos. La técnica de corte incluido en parafina es ventajoso porque de inclusión en parafina conserva la morfología celular y tisular. Además, los bloques de parafina se pueden almacenar convenientemente durante largos períodos de tiempo. Sin embargo, seccionamiento embebido en parafina no es adecuado para los tejidos vegetales que contienen cristales intracelulares. Cristales dentro de las células a menudo rasgan las cintas de parafina y la integridad del tejido daños durante el corte.
A diferencia de seccionamiento de parafina, cryosectioning es relativamente rápido y secciones se puede obtener sin la fijación, deshidratación serial o incrustación de infiltración medio 1. Criosecciones son compatibles con muchas aplicaciones tales como inmunohistoquímica, hibridación in situ, y la histoquímica enzimática. La otra ventaja de cryosectioning esque este método no pasa por un potencial de los procesos de desnaturalización como de alta temperatura y tratamientos químicos, moléculas de modo celulares están bien conservados dentro de las secciones de tejido 2. Cryosectioning se prefiere generalmente sobre base de parafina de seccionamiento para estudios en los tejidos animales. Sin embargo, cryosectioning no es la primera opción en las plantas debido a la temperatura de congelación a veces provoca la formación de cristales de hielo que afectan a la calidad de la sección de integridad. Aunque la osmorregulación tales como soluciones de sacarosa, polietilenglicol (PEG), o glicerol 3 han sido reportados para reducir la formación de cristales de hielo en condiciones de congelación, la mejora es menos que óptima.
Para adaptarse a diferentes entornos, diferentes plantas a menudo tienen células textura del tejido y de plantas distintas han evolucionado para formar las paredes rígidas de células, fibras duras, y los cristales de 4,5. Por ejemplo, los cristales de oxalato de calcio insolubles y cuerpos de sílice son bastante comunes en6 plantas. Cuerpos de silicato / cristales se han reportado para ayudar a mantener la arquitectura de planta, erectos, y prevenir la enfermedad o plaga de plantas de cereales 7-9.
Las orquídeas en maceta y el mercado de la orquídea de flores cortadas está floreciendo y es una industria en crecimiento. Phalaenopsis aphrodite (orquídea de polilla) es una de las plantas ornamentales de exportación más importantes de Taiwán. Se han hecho esfuerzos significativos para comprender los cambios morfológicos y fisiológicos de los procesos de floración de las orquídeas Phalaenopsis. Espigas florales de orquídeas Phalaenopsis se inician a partir de yemas axilares en la base de la hoja. Después de un período de temperatura ambiente fresco (aproximadamente un mes y medio), yemas axilares se agrandan, romper la latencia y sobresalir de la base de la hoja de convertirse en espigas florales jóvenes. Para entender la fisiológica, celular, y los procesos moleculares de iniciación de la espiga, es esencial desarrollar una técnica anatómica robusto para visuaLize tejidos o marcadores en el momento oportuno. Sin embargo, la presencia de cristales omnipresentes en los tejidos de orquídeas, sobre todo en las yemas axilares, hace que el trabajo anatómico difícil.
Aquí hemos tratado de mejorar la sección de la integridad de los tejidos vegetales recalcitrantes que han sido considerados hasta ahora como un desafío técnico. Aquí se muestra un protocolo mejorado llamado Hybrid-Cut. Es un método de corte a base de parafina que se realiza usando un criostato. la inclusión en parafina resuelve alto contenido de agua en el tejido vegetal. Seccionar a baja temperatura endurece el bloque de parafina, reduce cristal desgarro problema, y mejora significativamente la integridad del tejido. Este protocolo mejora significativamente la integridad del tejido para muestras de plantas recalcitrantes.
Protocolo
1. fijación e inclusión
- preparación de los reactivos
- solución salina amortiguada con fosfato 10x (PBS)
- Añadir 80 g de NaCl, 2 g de KCl, 14,4 g de Na 2 HPO 4, y 2,4 g de KH 2 PO 4 en 800 ml de agua doble destilada (ddH2O) y ajustar el pH a 7,4 con HCl. Añadir ddH2O a un volumen total de 1 l, a continuación, añadir 1.000 l de pirocarbonato de dietilo (DEPC) y agitar enérgicamente. Tienda PBS durante la noche a temperatura ambiente y autoclave a 121 ° C durante 20 min al día siguiente.
- 1x PBS
- Diluir el Stock 10x PBS a una relación de 01:10 en ddH 2 O para obtener una concentración final de 0,01 M Na 2 HPO 4, 0,002 M KH 2 PO 4, 0,003 M KCl, y 0,13 M NaCl.
- Paraformaldehído (PFA) fijador
Precaución: El paraformaldehído es tóxico. Prepararlo bajo una campana de humos. Usar guantes.- Para preparar 250 ml de PFA fijador, calentar 100ml 1x PBS a 70-80 ° C y añadir 1,750 l de NaOH. A continuación, añadir 10 g de paraformaldehído y mezclar bien hasta que se disuelva. Coloque la solución en hielo y luego ajustar el pH a 7,2 con H 2 SO 4 (260 - 270 l por cada 100 ml) después de enfriamiento.
- Ajustar el volumen a 250 ml con PBS 1x, añadir 625 l de glutaraldehído a una concentración final de 0,25%. Añadir 250 l Triton X-100 y 250 l de Tween 20 para facilitar la infiltración de la fijador.
NOTA: El fijador PFA se puede almacenar a 4 ° C durante un mes, sin perder su capacidad de fijación.
- Preparar diferentes concentraciones de etanol (30%, 50%, 70%, 85%, y 95%) con agua tratada con DEPC.
- solución salina amortiguada con fosfato 10x (PBS)
- recogida de muestras de plantas
- yemas axilares
- Utilizar las plantas de orquídea Phalaenopsis maduros en la etapa de cuatro hojas. Retirar con cuidado las hojas por desgarro de la hoja después de la nervadura central usando las manos.
- Utilizar un bisturí afilado para CAREFully eliminar yemas axilares de la base de la tercera o cuarta hoja en el tallo monopodial.
- muestra de semillas
- Cosechar las vainas de semillas de orquídeas maduros a los 4 meses después de la polinización. Cortar las vainas de semillas longitudinalmente con un escalpelo. Agitar la vaina de la semilla apertura suavemente y liberar las semillas secas en papel de filtro.
- protocormo
- Sembrar semillas de orquídeas maduros en un medio de Murashige y Skoog placa de agar 1 / 2x, y crecer en un ambiente de cultivo de tejidos en un período de 12 h de luz y temperatura constante de 25 ° C. Muestra protocormo verde a las 7 semanas después de la siembra.
- protocormo órganos similares (PLB)
- PLB crecer orquídeas en T2 regeneración de placas de agar como se ha descrito anteriormente y el lugar 10 en las mismas condiciones de crecimiento que en el paso 1.2.3.1. Recoge 10 PLB a una altura de 5 - 8 mm.
- muestra de hojas
- Recoger tejido de las hojas de una planta de orquídea Phalaenopsis madura como se describe en el paso1.2.1.1.
- Utilizar un bisturí afilado para cortar un pequeño trozo de tejido de la hoja (7 mm de longitud x 5 mm de anchura) de la segunda hoja de nuevo desarrollo.
- muestra de raíz
- Usando la misma planta se describe en el paso 1.2.1.1, diseccionar 1 cm de longitud de punta de tejido radicular utilizando un escalpelo afilado.
- pico joven
- Utilizar un bisturí afilado para cortar el tejido joven pico de la parte de la punta del tallo de la flor de 10 cm de longitud.
- Capullo de la flor
- Extirpar un pequeño brote de flor de 5 mm de diámetro de tallo de la flor de la orquídea. Cortar la parte del tejido del brote de flor longitudinalmente (3 mm de espesor).
- Los tejidos foliares y tejidos de espiguillas de los cultivos de cereales
- Cortar 1 cm de longitud de la hoja de tejido de hoja de las primeras hojas de nuevo desarrollo de plantas de arroz, trigo y maíz.
- Recoge 10 espiguillas de las plantas (arroz, trigo y maíz) un día antes de la antesis.
- yemas axilares
- Fijación
- Fijar muestras de plantas de inmediato transfiriéndolos a un vial de centelleo de vidrio que contiene 15 ml de PFA fijador enfriado con hielo.
- Aplicar un vacío (~ 720 mm de Hg) para muestras de plantas en una habitación fresca 4 ° C. Mantenga pulsado el vacío durante 15 - 20 min (pequeñas burbujas deben ser liberados de las muestras). Repita este paso hasta que la mayoría de los tejidos sumidero después de la liberación del vacío. Mantenga el vacío durante la noche y liberar el vacío lentamente el día siguiente.
- Deshidración
NOTA: Utilice el mismo vial partir de la fijación a través de los pasos de infiltración. Verter o utilizar una pipeta para drenar la solución en el paso anterior y reemplazar con 15 ml de solución nueva en el vial. Dependiendo de la textura de los tejidos, el tratamiento de los tejidos duros como el brote axilar orquídea, semillas, protocormo, y PLB, y la espiguilla de arroz, trigo y maíz por más tiempo; el tratamiento de los tejidos blandos como la yema de la flor de la orquídea, pico joven, hoja y raíz, y la hoja de arroz, el trigo y el maíz durante un tiempo más corto.- Después de la fijación, sumergir la muestra en 15 ml de 1x PBS durante 10 min en hielo.
- Deshidratar muestras en serie de etanol 15 ml a temperatura ambiente como sigue: 30% de etanol durante 30 min, 50% de etanol durante 30 min, 70% de etanol durante 1 hr, 85% de etanol durante 54 min para los tejidos duros y 30 min para los tejidos más blandos, 95% de etanol durante 54 min para los tejidos duros y 30 min para los tejidos más blandos, y 100% de etanol dos veces para 54 min para los tejidos duros y 30 min para los tejidos más suaves.
Nota: Las muestras de las plantas se pueden almacenar en 70% de etanol a 4 ° C durante varios meses.
- Deshidratar muestras en serie de etanol 15 ml a temperatura ambiente como sigue: 30% de etanol durante 30 min, 50% de etanol durante 30 min, 70% de etanol durante 1 hr, 85% de etanol durante 54 min para los tejidos duros y 30 min para los tejidos más blandos, 95% de etanol durante 54 min para los tejidos duros y 30 min para los tejidos más blandos, y 100% de etanol dos veces para 54 min para los tejidos duros y 30 min para los tejidos más suaves.
- Después de la fijación, sumergir la muestra en 15 ml de 1x PBS durante 10 min en hielo.
- la infiltración de parafina
- Infiltrarse en las muestras con 15 ml de una mezcla sustituto etanol y xileno durante 54 min cada uno de los tejidos más duros y 30 min para los tejidos más suaves, a temperatura ambiente como sigue: sustituto etanol / xileno (2: 1, v / v), etanol / sustituto xileno (1 : 1, v / v), sustituto de etanol / xileno (1: 2, v / v), y el sustituto de xileno puro dos veces. Precaución: El xileno es tóxico. Hacer este paso en campana de humos.
- Infiltrarse en la muestra en el vial con 15 ml sustituto xileno y la mezcla de parafina en un horno a 60 ° C, durante la noche para los tejidos duros, y por 60 min para los tejidos blandos de la siguiente manera: xileno sustituto / parafina (2: 1, v / v), xileno sustituto / parafina (1: 1, v / v), y xileno sustituto / parafina (1: 2, v / v).
- Infiltrarse en la muestra con 15 ml de parafina pura dos veces al día y se incuba a 60 ° C en un horno.
- Repita el paso 1.5.3 al día siguiente.
- incrustación de tejidos
- Alimentar el circuito del centro de la incorporación de tejido de 1 hora de antelación para derretir la cera de parafina en el depósito antes de la incrustación de tejidos en un bloque de parafina.
- Calentar los moldes de metal (tamaño de la base 3.3 cm de longitud ancho x 2 cm) en la bandeja de calentamiento a 62 ° C, y vierta aproximadamente 13 ml de cera fundida en la base del molde.
- Transferir una muestra de tejido de la sección 1.5.4 en el molde calentado con unas pinzas y orientarla en la posición deseada.
- Mover el moldesobre la placa fría con cuidado, y dejar hasta que se solidifica la cera.
2. Tejido Seccionamiento
- método de corte de parafina
- Hacer una base de cera mediante la colocación de un casete de incrustación en la parte superior de un molde (del mismo tamaño en la sección 1.6.2), llenar con cera fundida y retirar el molde después de la cera se solidifica.
NOTA: El casete incrustar formará una base de cera para fijar el bloque de muestras de parafina. - Recorte el bloque de parafina en una forma y tamaño adecuado, y colocar algunas piezas de cera con una espátula plana. Calentar las piezas de cera utilizando un mechero de alcohol hasta que se derrita la cera y luego colocar la cera fundida sobre la base de cera en la sección 2.1.1 para adherir el bloque. Fijarlo en el microtomo.
- Coloque una nueva cuchilla en el microtomo, y ajustar el ángulo de 5 grados para facilitar el seccionamiento en el microtomo.
- Cortar el bloque de parafina de muestras en rodajas finas (10 micras), como se ha descrito previamente 11.
- Híbrido-Cut método de seccionamiento
- Recorte el bloque de parafina de la muestra desde el paso 1.6.4 a una columna con una superficie trapezoidal en la parte superior de un tamaño adecuado usando una hoja de afeitar.
- Añadir un poco de compuesto de corte temperatura óptima (OCT) en el centro de la etapa de criostato. Coloque el bloque de parafina a la etapa de criostato y luego orientar rápidamente el bloque de tejido en la posición deseada.
- Transferir el bloque de parafina / escenario para una cámara de criostato. Permitir OCT para solidificar en la barra de congelación rápida a -42 ° C durante 10 min. No mueva el bloque durante la solidificación de la TCO (Figura 2C).
- Permiten que el adaptador de criostato y temperatura de la cámara se enfríen hasta -20 ° C y -16 ° C, respectivamente, antes de colocar el bloque de parafina / escenario para el adaptador de criostato. Sección tejidos a 10 micras de espesor.
- Escoja secciones de tejido con unas pinzas. Flotar las secciones en 800 l de agua tratada con DEPC en un poli - L - lisina coaTed diapositiva y transferir las diapositivas sobre una placa caliente a 42 ° C.
- Permitir a las secciones para aplanar el agua tratada con DEPC a 42 ° C. El uso de papel de filtro para drenar el agua desde el borde.
- Montar en el tejido de la diapositiva posicionando el cursor sobre una placa caliente 42 ° C durante la noche.
3. Tejido de tinción
- desparafinación
- Recoger las diapositivas de la placa caliente y colocarlos en un estante de tinción. Añadir 150 ml de xileno a una cubeta en la campana de humos y sumergir el estante en xileno durante 5 minutos.
- rehidratación
- Preparar diferentes concentraciones de soluciones de etanol (100%, 95%, 70%, 50%, y 30%) en agua tratada con DEPC y llenar 150 ml de solución en frascos de tinción distintos, respectivamente.
- Rehidratar las muestras a través de una serie de disminuir la concentración de etanol, cada paso de 3 min a temperatura ambiente. La transferencia de las diapositivas de la tinción de rack un frasco a otro frasco que contiene dconcentraciones de etanol ifferent: 100% de etanol, 95% de etanol, 70% de etanol, 50% de etanol y 30% de etanol.
- Después de la rehidratación, sumergir las muestras en ddH2O durante 3 min.
- tinción con hematoxilina
- muestras de tejido de la mancha por inmersión de diapositivas de tejidos en solución de hematoxilina durante 1,5 minutos.
- Enjuagar brevemente en ddH2O que contiene 1 - 2 gotas de ácido clorhídrico 12 N (HCl) durante unos segundos, y luego lavar brevemente en ddH2O
- Deshidración
- Deshidratar las muestras a través de una serie de concentraciones crecientes de etanol durante 3 minutos a temperatura ambiente: 30% de etanol, 50% de etanol, 70% de etanol, 95% de etanol, y 100% de etanol. Desactive las muestras con xileno en la campana de humos durante 5 min.
- Montaje
- Caída apropiadamente 600 l de medio de montaje a base de xileno en un portaobjetos. Con cuidado, coloque un cubreobjetos sobre la muestra. Evitar la formación de burbujas de aire para obtener imágenes de buena calidad.
- Deje que los portaobjetos de aire durante la noche seco. Observar la muestra bajo un microscopio el día siguiente.
Nota: Las imágenes fueron capturadas a 25X a una ampliación de 400X, dependiendo del tamaño de las muestras.
4. Hibridación In Situ
- síntesis de la sonda
- Clon Phalaenopsis aphrodite gen actina específicas de codificación de secuencias usando cebadores 5'-GGCAGAGTATGATGAATCTGGTCC-3 'y 5'-AGGACAGAAGTTCGGCTGGC -3' (para obtener 242 pb de amplificación por PCR) y CyclinB1; secuencia de codificación específica 1 de genes usando primers 5'-TCGTAGCAAGGTTGCTTGTG-3 ' y 5'-ATGAGCATGGCGCTAATACC-3 '(para obtener 327 pb de amplificación por PCR) como se describe 12.
- Ligar las secuencias de codificación específicos en vectores (por ejemplo, pGEMT) de acuerdo con el protocolo del fabricante.
- Generar digoxigenina (DIG) sondas marcadas con sentido y antisentido utilizando kit de marcaje / T7 DIG ARN SP6 de acuerdo con las instrucciones del fabricantes.
- La hibridación in situ
- Cortar las 2 a y 3 secciones de tejido de yemas axilares (10 micras de espesor) generada usando el método híbrido-Cut, y montar las rebanadas en un portaobjetos recubierto.
- Desparafinar secciones de tejido en xileno (ver 3.1.1), rehidratar con concentraciones decrecientes de etanol (véase 3.2.2), y digieren con 2 mg / ml de proteinasa K a 37 ° C durante 30 min.
- Realizar la hibridación in situ de acuerdo con el protocolo descrito previamente 11,13 con algunas modificaciones, es decir, con la temperatura de hibridación para la actina como 59 ° C y 60 ° C para CyclinB1;. 1 Hibridar de diapositivas con sonda de ARN DIG marcado con 40 ng.
- Utilice solución de nitroazul de tetrazolio / 5-bromo-4-cloro-3-indolil fosfato (NBT / BCIP) para detectar las señales de hibridación como se ha descrito 11.
- Hacer una base de cera mediante la colocación de un casete de incrustación en la parte superior de un molde (del mismo tamaño en la sección 1.6.2), llenar con cera fundida y retirar el molde después de la cera se solidifica.
Resultados
Híbrido-Cut mejora la integridad de secciones de tejido
La comprensión de la anatomía de la estructura floral reproductiva es importante para investigar el mecanismo subyacente de la iniciación de la floración de orquídeas. Sin embargo, la acumulación de cristales de oxalato de calcio intracelular en las orquídeas Phalaenopsis hace que este tipo de estudios una tarea difícil. Para evitar los problemas asociados con desgarro causado por los cristales durante el proceso de corte (Figura 1), hemos desarrollado un sistema híbrido nombramos-Cut. Este protocolo combina las técnicas tradicionales de inclusión en parafina y cryosection. Primero probamos híbrido-Cortar en yemas axilares de la orquídea Phalaenopsis, ya que son conocidos por la rigidez del tejido y contenido de cristales de alta. tejido de yemas axilares se fija en el 4% PFA (véase el Protocolo, el paso 1.3). Después de la deshidratación de etanol en serie y E cera de parafinanfiltration, la yema axilar se ha incrustado en un bloque de parafina. El bloque se cortó a un tamaño adecuado antes de seccionamiento (Figura 2A). Una pequeña cantidad de octubre luego se aplicó al centro de la etapa de criostato (Figura 2B). A continuación, el bloque de parafina se adhirió a la etapa a través de-OCT-. La etapa se incubó en un criostato para 10 min para permitir la solidificación completa de la OCT antes de seccionamiento (Figura 2C) y luego sección criogénica se realizó en un -16 Cámara ° C (Figura 2D).
Como comparación, un bloque de parafina que contiene una yema axilar de Phalaenopsis orquídea se sometió a seccionamiento microtomo regular. Como se muestra en la Figura 1A, se observó la rotura severa de las cintas de parafina después de seccionamiento microtomo. La integridad del tejido y la estructura celular también se vio comprometida (Figura 1B). Hybrid-Cut, por otra parte,secciones producirse intacto de tejido (Figura 3a) con la integridad estructural conservada (Figura 3b).
La aplicación de híbrido-Cut a varios tejidos de P. Afrodita
A fin de probar la susceptibilidad de los híbridos-Cut, hemos probado diferentes tejidos de orquídeas Phalaenopsis. A menudo es difícil obtener secciones de semillas con buena integridad de los tejidos a causa de las cubiertas de las semillas se endureció. El uso de este protocolo, las estructuras detalladas de las semillas se conservan después de la sección (Figura 4A). Como se muestra en la Figura 4A, cuerpos proteicos, los productos de almacenamiento comunes 14, podrían ser claramente identificados. Híbrido-Cut también trabajó con éxito y mostró las estructuras detalladas del meristemo apical del brote del viejo protocormo de un mes (la estructura de una semilla germinada) (Figura 4B) yprotocormo-como-cuerpos (PLB, Figura 4C). Se han observado los cristales intracelulares en las secciones de orquídeas PLB. Phalaenopsis tienen hojas gruesas y suculentas y llevar a cabo el metabolismo ácido de las crasuláceas (CAM) de tipo 15 fotosíntesis. La sección transversal de la lámina de la hoja mostró grandes células del mesófilo y haces vasculares que contienen xilema y floema (Figura 4D). Se observaron pocas aberturas de los estomas en la superficie abaxial de la hoja durante el día (Figura 4D). De hecho, las plantas CAM evolucionaron para maximizar la ganancia de carbono, pero al mismo tiempo reducir al mínimo la pérdida de agua al abrir sus estomas en la noche bajo condiciones áridas 15,16. La raíz meristemo apical de P. Afrodita se muestra en la Figura 4E. Las células de la punta de la raíz parecían contener un número significativo de cristales, que se conserva muy bien después de la sección (Figura 4E). secciones longitudinales de picos florales jóvenes siempre infion sobre la arquitectura de los primordiales florales jóvenes (Figura 4F). Por otra parte, sépalos, pétalos, labelo, y polinias pueden ser claramente identificados a partir de la sección longitudinal de los botones florales jóvenes que han completado la diferenciación en este 5 mm capullo de la flor (Figura 4G). Tenga en cuenta que los cristales se acumulan en los sépalos de brotes florales jóvenes. En pocas palabras, este protocolo funciona constantemente para mantener la integridad del tejido y produce la morfología intacta permitiendo estudios celulares y anatómicas posibles.
Híbrido-Cut Preserva la integridad del tejido en cultivos de cereales
También probamos híbrido de acceso directo en cultivos de cereales como el arroz, el trigo y el maíz que contienen alto contenido de sílice 17,18. Como se muestra en la Figura 5, la integridad de los tejidos de las secciones transversales de arroz, trigo, maíz y hojas se han mejorado de manera significativa por la Hybrid-Cut método. células de xilema, floema, las células del mesófilo, estomas, y bulliform que controlan la rodadura de la lámina de la hoja para evitar la pérdida de agua fueron claramente identificados a partir de secciones de las hojas del arroz. La anatomía Kranz, las células del mesófilo, y haces vasculares de la hoja de maíz 19,20 fueron claramente identificadas. Fue interesante encontrar una alta densidad de estomas en ambos lados adaxial y abaxial de hojas de maíz (Figura 5). La relación de los estomas adaxial y abaxial de 0,7 en el maíz se ha informado anteriormente 21. Además, este protocolo también trabajó con éxito para proporcionar la morfología de las células detallada de espiguillas de arroz, el trigo y el maíz (Figura 6). Se conocen espiguillas para contener abundante sílice 9. Normalmente, que causa dificultad en la realización de seccionamiento de tejido.
Hibridación In Situ
Genómica y transcriptómica enfoques son comúnmente utilizados para anotar las funciones de los genes. Proporcionando la distribución espacial de las transcripciones de los genes de interés en contextos de desarrollo o ambientales es importante añadir una nueva visión de las posibles funciones de los genes. La hibridación in situ (ISH) se ha desarrollado para localizar patrones de expresión génica a nivel de tejido 11, 22-25. Además, ISH puede proporcionar celular, y en algunos casos sub-celular, la resolución de la distribución de ARNm en los organismos multicelulares 26. Durante ISH, ARN y la integridad del tejido es esencial para obtener información espacial fiable sobre la transcripción seleccionado. Hemos probado ISH utilizando el protocolo Hybrid-Cut gen de la actina (PATC157348) se clonó usando los cebadores 5'-GGCAGAGTATGATGAATCTGGTCC-3 'y 5'-AGGACAGAAGTTCGGCTGGC -3' para obtener 242 pb PCR amplicón Ciclina B1:.. Gen 1 (PATC146999) específica secuencia de codificación usando los cebadores 5'-TCGTAGCAAGGTTGCTTGTG3 'y 5' ATGAGCATGGCGCTAATACC-3 'para obtener 327 pb de amplificación por PCR. Después de ISH, actina y la ciclina B1: 1 la expresión génica se controló en yemas axilares jóvenes y maduras (Figura 7). Ambos genes se expresaron en células meristemáticas de 2 ° y 3 yemas axilares rd, con las señales más fuertes detectados en 3 yemas axilares rd. Estos resultados demostraron que Hybrid-Cut retener buena anatomía y proporcionar patrón de expresión génica espacial.

Figura 1: Sección de parafina tradicional Causas desgarre severo de Tejido Un bloque de parafina que contiene una yema axilar de la orquídea Phalaenopsis se sometió a seccionamiento microtomo regular.. Se observó desgarre severo de las cintas de parafina después de seccionamiento microtomo tradicional (A) . También se vio comprometida la integridad del tejido y la estructura celular (B). Las flechas muestran la grave desgarro de la lámina de tejido. La punta de flecha muestra los cuerpos de cristal. La barra de escala 100 micras. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2:. Híbrido-Cut seccionamiento Método Un tejido de yemas axilares se fijó en PFA y los tejidos se deshidrataron, se infiltró con cera de parafina y embebido en un bloque de parafina. El bloque de parafina se cortó a un tamaño adecuado (A). Optimal compuesto de corte de temperatura (OCT) se aplicó al centro de la etapa de criostato (B). El bloque de parafina se adjuntó a la OCT en el escenario criostato. En condiciones de baja temperatura, el bloque de parafina se adhirió a la etapa de criostato a través de OCT (C). Cortes de tejido se seccionaron en la cámara de criostato a -16 ° C (D). Las barras de escala representan 0,5 cm (A), y 1 cm (BD). Por favor, haga clic aquí para ver una versión más grande de esta figura.
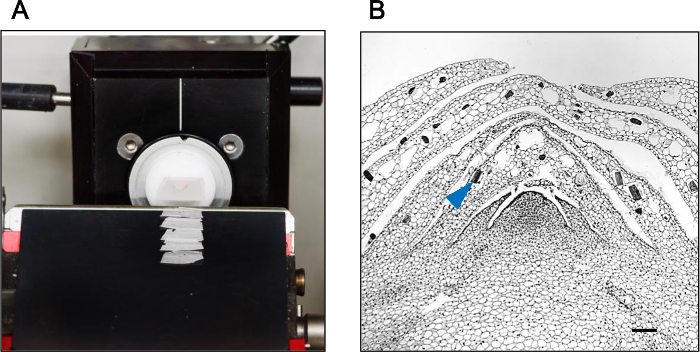
Figura 3: Hybrid-Cut Mejora la Sección de Integridad Un bloque de parafina que contiene una yema axilar de la orquídea Phalaenopsis se sometió a Hybrid-Cut de seccionamiento (A) y el método híbrido-Cut produjo secciones con la integridad del tejido excelente (B).. La punta de flecha muestra los cuerpos de cristal endógenos incrustados en el tejido de yemas axilares. La barra de escala 100 micras.rget = "_ blank"> Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Aplicación de híbrido-cortadas de distintas secciones de tejido de la orquídea Phalaenopsis diferente. los tejidos se seccionaron utilizando el método híbrido-Cut, tal como la sección longitudinal de semillas de orquídeas durante la etapa de madurez (A), la sección longitudinal de protocormo (B), la sección longitudinal de los cuerpos protocormo similar (PLB) (C), la sección transversal de limbo de la hoja (D), la sección longitudinal de la raíz (e), la sección longitudinal del joven punto de la flor (F), y la sección longitudinal de los botones florales jóvenes (G). Las secciones de tejido se tiñeron por hematoxilina. SC, cubierta de la semilla; PB, el cuerpo de proteína; METRO,meristema; MP, madre PLB; DP, hija PLB; Anuncio, la superficie foliar adaxial; Ab, superficie foliar abaxial; St, estomas; MC, célula del mesófilo; VB, haz vascular; RC, cofia; fb, capullo de la flor; Se, sépalos; Pe, pétalos; La, labelo; Po, polinias; Ro, rostellum; Ca, callo. Las puntas de flecha muestran cristales. Las barras de escala representan 20 micras (AE) y 200 m (FG). Haga clic aquí para ver una versión más grande de esta figura.

Figura 5:. Híbrido-Cut Preserva la integridad del tejido de la hoja en varios cultivos de cereales Comparación de tejido de la hoja utilizando el método tradicional de parafina (panel de la izquierda) y la técnica híbrida-Cut desarrollado en este estudio (panel de la derecha). Las imágenes muestran secciones transversales de la hoja de arroz, trigo y maíz. MC, célula del mesófilo; Ph, floema; St, estomas; BC, bu lliform celular. Las flechas muestran el desgarro de corte de tejido. Las puntas de flecha muestran cuerpos de sílice. Los círculos azules discontinuas indican anatomía Kranz en el maíz C4. Escala de barras de 20 micras. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 6:. Híbrido-Cut Preserva la integridad del tejido de la espiguilla en varios cultivos de cereales Comparación de la integridad de los tejidos de las secciones de espiguillas entre los métodos de parafina y el híbrido-Cut tradicionales. Las flechas muestran el desgarro de corte de tejido. Las puntas de flecha indican cuerpos de sílice. Las barras de escala 20 micras (arroz), y 200 micras (trigo y maíz). Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Hibridación in situ de actina y CyclinB1; 1 patrones de expresión en el axilar del brote de la orquídea Phalaenopsis cortes de tejido de la tercera yema axilar 2º yemas axilares y 3 se prepararon utilizando el método híbrido-Cut.. Un total de 40 ng de actina y CyclinB1; 1 sonda de excavación marcados se utilizaron para la hibridación. La sonda sentido se utilizó como control negativo. Las flechas indican el meristemo reproductivo de las yemas axilares. Escala de barras de 100 micras. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Discusión
Las células vegetales tienen paredes rígidas de células, fibras duras, cristales y alto contenido de agua que causan problemas de desgarro de tejido durante el corte de tejidos vegetales. A pesar de seccionamiento a base de parafina se utiliza con frecuencia para tejidos de la planta, los cristales endógenos menudo laceran el tejido de la planta durante el corte (Figura 1). Debido a la inherentemente alto contenido de agua dentro de las células de la planta, de corte a base de criostato a menudo hace que las células rotas y las secciones de tejido agrietados.
En el presente estudio, un protocolo de inclusión en parafina y cryosection combinado llamado Hybrid-Cut se desarrolló y se obtuvieron buenos cortes de tejidos de calidad. Este protocolo resuelve el problema asociado con alto contenido de agua mediante la introducción de la inclusión en parafina, y reduce el efecto de rasgado por el endurecimiento de la cera de parafina en condiciones de baja temperatura durante el corte (Figura 3). Por lo tanto, este protocolo modificado es ventajosa sobre cualquiera secció a base de parafinaNing o cryosectioning para preservar la integridad del tejido vegetal.
Este manuscrito demuestra que el método híbrido-Cut preserva la integridad del tejido en muchos tejidos del Phalaenopsis orquídea tales como yema axilar, semilla, y PLB, etc. que contienen altos niveles de cristales (Figuras 3-4). Por otra parte, este protocolo es susceptible de cultivos de cereales tales como órganos reproductivos y las hojas de arroz, el maíz y el trigo, que contienen alta de sílice (Figuras 5-6). Presumiblemente, este protocolo se puede aplicar a las plantas leñosas que contienen alto contenido de fibra.
En general, el tejido que se fijan a fondo es muy importante para Hybrid-Cut. Hemos encontrado que el ácido de formaldehído-alcohol-ácido (FAA) de fijación es mejor que PFA para preservar la integridad de los tejidos de algunos tejidos recalcitrantes tales como brotes axialmente, raíces, etc. Sin embargo, PFA funciona mejor que la FAA en la preservación de la integridad del ARN. Por lo tanto PFA Se recomienda fijarmuestra para la hibridación in situ el trabajo (ISH). El protocolo descrito aquí está diseñado para el experimento ARN ISH. Por lo tanto, se prepararon todos los reactivos para evitar la degradación del ARN mediante la eliminación de la contaminación por RNasa tratamiento DEPC. Si la sección híbrido-Cut es para estudios anatómicos, agua regular de ósmosis inversa (OI) y su tampón o reactivos derivados son aceptables.
La reducción de tamaño de la muestra y el grosor de menos de 3 mm es útil para la infiltración. Por otra parte, el aumento del tiempo de inmersión para deshidratación e infiltración son necesarios para los tejidos de textura dura. Limitación de este protocolo podría Debido a los problemas causados por la fijación inadecuada, deshidratación, y la infiltración de la muestra. Por lo tanto, el ajuste del tiempo de procesamiento para cada paso es fundamental para producir bloques de parafina de buena calidad. Normalmente, el tejido más duro necesita más tiempo de procesamiento que el tejido más suave.
Además, puso de manifiesto que Hybrid-Cut trabajó con éxito en combinación wiTH ISH para proporcionar una distribución espacial de los transcritos seleccionados (Figura 7). En resumen, este protocolo es útil para el estudio de la anatomía de la planta y proporciona un mapa de ARN de tejidos específicos de los genes seleccionados. Además, puede aplicarse a otros estudios moleculares tales como ensayo de desoxinucleotidil transferasa terminal etiquetado final dUTP nick (TUNEL), hibridación in situ fluorescente (FISH), y las técnicas de inmunotinción. En conclusión, este protocolo seccionar los tejidos mejorada es útil y conveniente para los investigadores en las comunidades de plantas.
Divulgaciones
No conflicts of interest declared.
Agradecimientos
We are grateful to the technical support from Ms. Hong Xian Hsing, Mr. Min Jeng Li, and Mr. Eric C. P. Wu. We express our appreciation to Miranda Loney for English editing.
Materiales
| Name | Company | Catalog Number | Comments |
| Embedding Center model EC780-1 | CSA | ||
| Microtome model RM2255 | Leica | ||
| Cryostat model CM 1950 | Leica | ||
| Axio Scope A1 microscope | Zeiss | ||
| Murashige & Skoog medium including vitamins | Duchefa Biochemia | M0222.0050 | |
| RNase free surface decontaminant | Apex | 10-228 | |
| Diethyl pyrocarbonate (DEPC) | Bio Basic Inc. | D801154 | |
| Sodium chloride (NaCl) | MDBio, Inc. | 101-7647-14-5 | |
| Potassium chloride, crystal (KCl) | J.T. Baker | 7447-40-7 | |
| Sodium phosphate dibasic (Na2HPO4) | Sigma-Aldrich | 7558-79-4 | |
| Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | 7778-77-0 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 16005 | |
| Sodium hydroxide (NaOH) | Showa | 19430160 | |
| Sulfuric acid (H2SO4) | Sigma-Aldrich | 7664-93-9 | |
| Glutaraldehyde solution | Sigma-Aldrich | 111-30-8 | |
| Polyoxyethylene 20 sorbitan monolaurate (Tween 20) | J.T. Baker | 9005-64-5 | |
| Octyl Phenol Ethoxylate (Triton X100) | J.T. Baker | 9002-93-1 | |
| Glass scintillation vials | Newastar | DG60805-00020 | |
| Desiccator vacuum | Violet Bioscience Inc. | TS-402030 | |
| Rotary vane pump RZ2.5 | Vacuubrand | 36149406 | |
| Ethanol | J.T. Baker | 64-17-5 | |
| Sub-X | Leica Surgipath | 3803670 | Xylene substitute |
| Paraplast Plus | Leica Surgipath | 39602004 | Tissue embedding paraffin |
| SUPERFROST micro slide glass | Matsunami | S7441 | |
| FSC 22 Clear | Leica Surgipath | 3801480 | Optimal Cutting Temperature compound (OCT) |
| Xylenes, Purified | Leica Surgipath | 3803665 | |
| Hematoxylin | Merck | HX305311 | |
| Hydrochloric acid (HCl) | Sigma-Aldrich | 7647-01-0 | |
| Micromount | Leica Surgipath | 3801731 | Mounting medium |
| pGEM T-easy vector | Promega | A1360 | |
| Proteinase K | Roche | 3115879001 | |
| SP6/T7 DIG RNA Labeling Kit | Roche | 11175025910 | |
| NBT/BCIP stock solution | Roche | 11681451001 |
Referencias
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Cryosectioning tissues. Cold Spring Harb Protoc. 3, 1-2 (2008).
- Knox, R. B. Freeze-sectioning of plant tissues. Stain Technol. 45, 265-272 (1970).
- Ruan, J. L., et al. An improved cryosection method for polyethylene glycol hydrogels used in tissue engineering. Tissue Eng.: Part C Methods. 19, 794-801 (2013).
- Prychid, C. J., Rudall, P. J. Calcium oxalate crystals in monocotyledons: A review of their structure and systematics. Ann Bot. 84, 725-739 (1999).
- Prychid, C. J., Rudall, P. J., Gregory, M. Systematics and biology of silica bodies in monocotyledons. Bot. Rev. 69 (4), 377-440 (2004).
- Arnott, H. J., Pautard, F. G. E., Steinfink, H. Structure of calcium oxalate monohydrate. Nature. 208, 1197-1198 (1965).
- Mitani, N., Yamaji, N., Ma, J. F. Identification of maize silicon influx transporters. Plant Cell Physiol. 50, 5-12 (2009).
- Hayasaka, T., Fujii, H., Ishiguro, K. The role of silicon in preventing appressorial penetration by the rice blast fungus. Phytopathology. 98, 1038-1044 (2008).
- Ma, J. F., Yamaji, N. Silicon uptake and accumulation in higher plants. Trends Plant Sci. 11, 392-397 (2006).
- Chen, W., Tang, C., YL, K. Ploidy doubling by in vitro culture of excised protocorms or protocorm-like bodies in Phalaenopsis species. Plant Cell Tiss Org. 98, 229-239 (2009).
- Javelle, M., Marco, C. F., Timmermans, M. In Situ Hybridization for the Precise Localization of Transcripts in Plants. J. Vis. Exp. (57), e3328 (2011).
- Park, D. J. E. PCR Protocols. Methods in Molecular Biology. 687, (2011).
- Lin, H. Y., et al. Genome-wide annotation, expression profiling, and protein interaction studies of the core cell-cycle genes in Phalaenopsis aphrodite. Plant Mol Biol. 84, 203-226 (2014).
- Lee, Y. -. I., Yeung, E. C., Lee, N., Chung, M. -. C. Embryology of Phalaenopsis amabilis var. formosa: embryo development. Bot Stud. 49, 139-146 (2008).
- Endo, M., Ikusima, I. Diurnal rhythm and characteristics of photosynthesis and respiration in the leaf and root of a Phalaenopsis plant. Plant Cell Physiol. 30, 43-47 (1989).
- Guo, W. J., Lee, N. Effect of leaf and plant age, and day/night temperature on net CO2 uptake in Phalaenopsis amabilis var. formosa. J. Amer. Soc. Hort. Sci. 131, 320-326 (2006).
- Lewin, J., Reimann, B. Silicon and plant growth. Ann. Rev. of Plant Physiol. 20, 289-304 (1969).
- Kaufman, P. B., Simpson, T. L., Valcani, B. E., et al. Silica in shoots of higher plants. Silicon and siliceous structures in biological systems. , 409-449 (1981).
- Lundgren, M. R., Osborne, C. P., Christin, P. A. Deconstructing Kranz anatomy to understand C4 evolution. J Exp Bot. 65, 3357-3369 (2014).
- Liu, W. Y., et al. Anatomical and transcriptional dynamics of maize embryonic leaves during seed germination. Proc Natl Acad Sci U S A. 110, 3979-3984 (2013).
- Driscoll, S. P., Prins, A., Olmos, E., Kunert, K. J., Foyer, C. H. Specification of adaxial and abaxial stomata, epidermal structure and photosynthesis to CO2 enrichment in maize leaves. J Exp Bot. 57, 381-390 (2006).
- Karlgren, A., Carlsson, J., Gyllenstrand, N., Lagercrantz, U., Sundström, J. F. Non-radioactive in situ Hybridization Protocol Applicable for Norway Spruce and a Range of Plant Species. J. Vis. Exp. (26), (2009).
- Hejatko, J., et al. In situ hybridization technique for mRNA detection in whole mount Arabidopsis samples. Nat Protoc. 1, 1939-1946 (2006).
- Javelle, M., Timmermans, M. C. In situ localization of small RNAs in plants by using LNA probes. Nat Protoc. 7, 533-541 (2012).
- Drea, S., et al. In situ analysis of gene expression in plants. Methods Mol Biol. 513, 229-242 (2009).
- Drea, S., et al. A streamlined method for systematic, high resolution in situ analysis of mRNA distribution in plants. Plant Methods. 1, 8 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados