Method Article
Hybrid-Cut: Une méthode Sectionnement améliorée pour les échantillons de tissus végétaux récalcitrantes
Dans cet article
Résumé
This protocol describes a simple Hybrid-Cut tissue sectioning method that is useful for recalcitrant plant tissues. Good quality tissue sections enable anatomical studies and other biological studies including in situ hybridization (ISH).
Résumé
Le maintien de la section centrale de l'intégrité est essentielle pour l'étude des structures anatomiques détaillées au niveau cellulaire, des tissus, ou le niveau même organe. Cependant, certaines cellules végétales ont des parois cellulaires rigides, des fibres dures et cristaux (oxalate de calcium, silice, etc.), et de haute teneur en eau qui perturbent souvent l' intégrité des tissus pendant la coupe des tissus végétaux.
Cette étude établit une méthode de sectionner tissu hybride-Cut simple. Ce protocole modifie une technique de découpe à base de paraffine et améliore l'intégrité des coupes tissulaires provenant de différentes plantes. Les tissus végétaux ont été inclus dans la paraffine avant sectionnant dans un cryostat à -16 ° C. Sectionnement sous basse température trempé les blocs de paraffine, déchirure réduite et gratter, et l'intégrité des tissus améliorée de manière significative. Ce protocole a été appliqué avec succès à des tissus d'oxalate de calcium riche Phalaenopsis orchidées ainsi que les tissus récalcitrants tels que les orga reproductivens et les feuilles de riz, le maïs et le blé. En outre, la qualité des coupes de tissus de coupe hybride peut être utilisé en combinaison avec l' hybridation in situ (ISH) pour fournir des profils d'expression spatiaux des gènes d'intérêt. En conclusion, ce protocole est particulièrement utile pour les tissus végétaux récalcitrants contenant haute cristal ou teneur en silice. coupes de tissus de bonne qualité permettent des études biologiques morphologiques et autres.
Introduction
Le procédé de découpe à base de paraffine est une technique largement utilisée pour des études anatomiques. La préservation de l'anatomie des tissus intacts est important pour les études morphologiques et biologiques. La technique de découpe paraffine est avantageuse car la paraffine-plongement conserve cellulaire et tissulaire morphologie. En outre, des blocs de paraffine peuvent être stockés commodément pendant de longues périodes de temps. Cependant, le sectionnement inclus dans la paraffine ne convient pas pour les tissus végétaux contenant des cristaux intracellulaires. Cristaux dans les cellules se déchirent souvent des rubans de paraffine et de l'intégrité des dommages aux tissus pendant la coupe.
Contrairement à la paraffine tronçonnage, cryosectioning est relativement rapide et sections peuvent être obtenues sans fixation, déshydratation serial ou milieu d' inclusion infiltration 1. Des cryosections sont compatibles avec de nombreuses applications telles que l' immunohistochimie, l' hybridation in situ, et l' enzyme histochimie. L'autre avantage de cryosectioning estque cette méthode ne passe pas par un processus de dénaturation potentiels tels que la température et les traitements chimiques, les molécules de sorte cellulaires sont bien conservés dans les sections de tissu 2. Cryosectioning est généralement préférée à base de paraffine sectionnant pour les études dans les tissus animaux. Cependant, cryosectioning est pas le premier choix dans les plantes, car la température de congélation provoque parfois la formation de cristaux de glace qui affectent la qualité de l'article intégrité. Bien que osmorégulation telles que des solutions de saccharose, le polyéthylène glycol (PEG) ou le glycérol 3 ont été rapportés pour réduire la formation de cristaux de glace dans des conditions de congélation, l'amélioration est moins qu'optimale.
Pour adapter à différents environnements, différentes plantes ont souvent des cellules de texture des tissus et végétales distinctes ont évolué pour former des parois rigides cellulaires, fibres dures, et des cristaux de 4,5. Par exemple, insolubles des cristaux d'oxalate de calcium et corps de silice sont assez communs dans6 plantes. Organismes Silicate / cristaux ont été signalés pour aider à maintenir l' architecture des plantes, droiture, et prévenir la maladie ou d'un parasite dans les plantes de céréales 7-9.
Les orchidées en pot et le marché des orchidées de fleurs coupées est florissante et il est une industrie en pleine croissance. Phalaenopsis aphrodite (orchidée papillon) est l' une des plantes ornementales exportation les plus importants de Taiwan. D' importants efforts ont été faits pour comprendre les changements morphologiques et physiologiques des processus de floraison dans les orchidées Phalaenopsis. Épis floraux d'orchidées Phalaenopsis sont initiées à partir de bourgeons axillaires à la base des feuilles. Après une période de température ambiante froide (environ un mois et demi), les bourgeons axillaires agrandir, dormance, et font saillie à partir de la base de la feuille de se développer en jeunes pointes florales. Pour comprendre l'état physiologique, cellulaire, et les processus moléculaires de pic initiation, il est essentiel de développer une technique anatomique robuste pour Visuades tissus ou des marqueurs liser en temps opportun. Cependant, la présence de cristaux omniprésents dans les tissus d'orchidées, en particulier dans les bourgeons axillaires, rend le travail anatomique difficile.
Ici, nous avons cherché à améliorer la section intégrité des tissus végétaux récalcitrants qui ont été jusque-là considérées comme techniquement difficile. Ici, nous montrons un protocole amélioré baptisé Hybrid-Cut. Il est un procédé de découpe à base de paraffine qui est réalisée à l'aide d'un cryostat. plongement Paraffine résout haute teneur en eau dans les tissus végétaux. Sectionner durcit à basse température du bloc de paraffine, réduit le cristal déchirement problème, et améliore de façon significative l'intégrité des tissus. Ce protocole améliore de manière significative l'intégrité des tissus pour les échantillons de plantes récalcitrantes.
Protocole
1. Fixation and Embedding
- Préparation des réactifs
- saline 10x tamponnée au phosphate (PBS)
- Ajouter 80 g de NaCl, 2 g de KCl, 14,4 g de Na 2 HPO 4, et 2,4 g KH 2 PO 4 dans 800 ml d' eau distillée deux fois (ddH 2 O) et ajuster le pH à 7,4 avec HCl. Ajouter ddH 2 O à un volume total de 1 L, puis ajouter 1 000 pi du pyrocarbonate de diéthyle (DEPC) et agiter vigoureusement. Magasin de PBS pendant une nuit à la température ambiante et on autoclave à 121 ° C pendant 20 minutes le jour suivant.
- PBS 1x
- Diluer le stock 10x PBS à 1:10 en ddH 2 O pour obtenir une concentration finale de 0,01 M Na 2 HPO 4, 0,002 M KH 2 PO 4, 0,003 M KCl, et 0,13 M de NaCl.
- Paraformaldéhyde (PFA) fixateur
Attention: paraformaldéhyde est toxique. Préparer sous une hotte. Porter des gants.- Pour préparer 250 ml PFA fixateur, chauffer 100ml de 1 x PBS à 70 - 80 ° C et on ajoute 1,750 ul de NaOH. Ensuite, ajoutez 10 g de paraformaldéhyde et bien mélanger jusqu'à dissolution. Placer la solution sur de la glace, puis ajuster le pH à 7,2 avec H 2 SO 4 (260 - 270 pi pour 100 ml) après refroidissement.
- Ajuster le volume à 250 ml avec 1 x PBS, ajouter 625 ul de glutaraldéhyde à une concentration finale de 0,25%. Ajouter 250 ul de Triton X-100 et 250 pi de Tween 20 pour faciliter l'infiltration du fixatif.
NOTE: Le fixateur PFA peut être conservé à 4 ° C pendant un mois sans perdre sa capacité de fixation.
- Préparer diverses concentrations d'éthanol (30%, 50%, 70%, 85% et 95%) avec de l'eau traitée par DEPC.
- saline 10x tamponnée au phosphate (PBS)
- la collecte des échantillons des plantes
- Les bourgeons axillaires
- Utiliser des plantes d'orchidées Phalaenopsis matures au stade quatre feuilles. Retirez délicatement les feuilles en déchirant la feuille suivante de la nervure médiane à l'aide des mains.
- Utilisez un scalpel à CAREFenlever ully bourgeons axillaires à partir de la base de la troisième ou de la quatrième feuille sur la tige monopodial.
- échantillon de semences
- Récolter matures gousses d'orchidées à 4 mois après la pollinisation. Couper les gousses longitudinalement avec un scalpel. Agiter la gousse d'ouverture en douceur et libérer les graines sèches sur du papier filtre.
- protocorme
- Semez les graines d'orchidées matures sur un Murashige et Skoog plaque 1 / 2x agar, et de grandir dans une salle de culture de tissus dans une période de lumière de 12 h et une température constante de 25 ° C. Exemple protocorme vert à 7 semaines après le semis.
- organes protocorme-like (PLB)
- Cultivez PLB d'orchidées sur T2 régénération des plaques d' agar comme décrit précédemment 10 et dans les mêmes conditions de croissance que dans l'étape 1.2.3.1. Récupérez 10 PLB à une hauteur de 5 - 8 mm.
- Feuille échantillon
- Collecter les tissus foliaires d'une plante d'orchidée Phalaenopsis matures comme décrit à l' étape1.2.1.1.
- Utiliser un scalpel tranchant pour couper un petit morceau de tissu de feuille (7 mm de largeur longueur x 5 mm) de la deuxième feuille nouvellement développé.
- échantillon de Racine
- En utilisant la même installation décrite à l'étape 1.2.1.1, disséquer 1 cm de longueur de tissu de bout de racine à l'aide d'un scalpel.
- Jeune pic
- Utiliser un scalpel tranchant pour couper les jeunes tissus de pointe de la partie de la fleur de pointe tige 10 cm de longueur.
- Bourgeon floral
- Exciser une petite fleur bourgeon de 5 mm de diamètre de fleur d'orchidée tige. Couper une partie du tissu de bourgeons floraux longitudinalement (3 mm d'épaisseur).
- les tissus foliaires et les tissus épillets de cultures céréalières
- Coupez 1 cm de tissu de lame longueur de la feuille des premières feuilles nouvellement développées à partir de plantes de riz, de blé et de maïs.
- Récupérez 10 épillets à partir de plantes (riz, blé et maïs) un jour avant l'anthèse.
- Les bourgeons axillaires
- Fixation
- Fixer immédiatement des échantillons de plantes en les transférant dans un flacon à scintillation en verre contenant 15 ml glacé fixatif PFA.
- Appliquer un vide (~ 720 mm Hg) à des échantillons de plantes dans un 4 ° C chambre froide. Tenir le vide pendant 15 - 20 min (petites bulles doivent être libérés à partir des échantillons). Répétez cette étape jusqu'à ce que la plupart des tissus couler après la libération du vide. Tenir le vide pendant une nuit et libérer le vide lentement le lendemain.
- déshydration
REMARQUE: Utilisez le même flacon de la fixation à travers les étapes d'infiltration. Verser ou utiliser une pipette pour évacuer la solution dans l'étape précédente et le remplacer par 15 ml de solution nouvelle dans le flacon. En fonction de la texture des tissus, traiter les tissus durs tels que orchidée bourgeon axillaire, graines, protocorme et PLB, et l'épillet du riz, du blé et du maïs pour une période plus longue; traiter les tissus plus doux comme fleur d'orchidée bourgeon, jeune pic, feuilles et racines, et la feuille de riz, de blé et de maïs pour un temps plus court.- Après fixation, immerger l'échantillon dans 15 ml 1x PBS pendant 10 minutes sur la glace.
- Déshydrater les échantillons dans 15 ml série d'éthanol à température ambiante comme suit: 30% d'éthanol pendant 30 min, 50% d'éthanol pendant 30 min, 70% d'éthanol pendant 1 heure, l'éthanol 85% pendant 54 min pour les tissus durs et 30 min pour les tissus tendres, éthanol à 95% pendant 54 min pour les tissus durs et 30 min pour les tissus tendres et éthanol à 100% deux fois pendant 54 min pour les tissus durs et 30 min pour les tissus tendres.
REMARQUE: Des échantillons de plantes peuvent être stockés dans 70% d'éthanol à 4 ° C pendant plusieurs mois.
- Déshydrater les échantillons dans 15 ml série d'éthanol à température ambiante comme suit: 30% d'éthanol pendant 30 min, 50% d'éthanol pendant 30 min, 70% d'éthanol pendant 1 heure, l'éthanol 85% pendant 54 min pour les tissus durs et 30 min pour les tissus tendres, éthanol à 95% pendant 54 min pour les tissus durs et 30 min pour les tissus tendres et éthanol à 100% deux fois pendant 54 min pour les tissus durs et 30 min pour les tissus tendres.
- Après fixation, immerger l'échantillon dans 15 ml 1x PBS pendant 10 minutes sur la glace.
- infiltration paraffine
- S'infiltrer échantillons avec 15 ml d'éthanol et substitut de xylène mélange pendant 54 minutes à chaque fois pour les tissus durs et 30 min pour les tissus tendres, à la température ambiante de la manière suivante: un mélange éthanol / substitut de xylène (2: 1, v / v) d'éthanol / substitut de xylène (1 : 1, v / v) d'éthanol / substitut de xylène (1: 2, v / v) et un substitut de xylène pur à deux reprises. Attention: Xylène est toxique. Pour ce faire, pas dans la hotte.
- S'infiltrer échantillon dans le flacon avec 15 ml d'un substitut de xylène et un mélange de paraffine dans un four à 60 ° C pendant une nuit pour les tissus durs et pendant 60 min pour les tissus tendres comme suit: substitut de xylène / paraffine (2: 1, v / v), substitut de xylène / paraffine (1: 1, v / v) et un substitut de xylène / paraffine (1: 2, v / v).
- S'infiltrer échantillon avec 15 ml de paraffine pure deux fois par jour et on incube à 60 ° C dans un four.
- Répétez l'étape 1.5.3 le lendemain.
- plongement Tissue
- Mettre sous tension du centre enrobage de tissus 1 h à l'avance pour faire fondre la cire dans le réservoir de paraffine, avant enrobage de tissus dans un bloc de paraffine.
- Réchauffer les moules métalliques (taille de la base de 3,3 cm de largeur longueur x 2 cm) sur le plateau de réchauffement à 62 ° C, et versez environ 13 ml de cire fondue dans la base de moule.
- Transfert d'un échantillon de tissu de la section 1.5.4 dans le moule avec des pinces chauffées et l'orienter dans la position souhaitée.
- Déplacer le moulesur la plaque froide avec soin, et laisser jusqu'à ce que la cire est solidifié.
2. Tissue Sectionnement
- méthode de sectionnement de paraffine
- Faire une base de cire en plaçant une cassette intégrant sur le dessus d'un moule (même taille dans la section 1.6.2), remplir avec de la cire fondue et retirer le moule après la cire est solidifié.
NOTE: La cassette enrobage formera une base de cire pour ancrer le bloc échantillon de paraffine. - Coupez le bloc de paraffine dans une forme et une taille appropriée et placez quelques morceaux de cire sur une spatule plate. Faire chauffer les morceaux de cire à l'aide d'un brûleur à alcool jusqu'à ce que la cire fond et ensuite placer la cire fondue sur la base de cire dans la section 2.1.1 pour faire adhérer le bloc. Fixer dans le microtome.
- Placez une nouvelle lame sur le microtome, et d'ajuster l'angle de 5 degrés pour faciliter le sectionnement dans le microtome.
- Couper le bloc de paraffine de l' échantillon en tranches minces (10 um), comme décrit précédemment 11.
- Hybrid-Cut méthode sectionnant
- Coupez le bloc de paraffine échantillon de l'étape 1.6.4 à une colonne avec une surface de trapèze au sommet d'une taille appropriée à l'aide d'une lame de rasoir.
- Ajoutez un peu de composé de coupe de température optimale (OCT) au centre de la scène de cryostat. Fixer le bloc de paraffine à l'étape de cryostat puis orienter rapidement le bloc de tissu dans la position souhaitée.
- Transférer la paraffine bloc / stade à une chambre de cryostat. Laisser OPO pour solidifier sur la barre de congélation rapide à -42 ° C pendant 10 min. Ne pas déplacer le bloc lors de la solidification de l' OCT (figure 2C).
- Permettent à l'adaptateur de cryostat et la température de la chambre de refroidir à -20 ° C et -16 ° C, respectivement, avant de fixer le bloc de paraffine / étape à l'adaptateur de cryostat. Section des tissus à 10 um d'épaisseur.
- Choisissez des coupes de tissus avec une pince. Float les sections sur l' eau traitée par DEPC 800 ul dans un poly - L - lysine coaslide ted et transférer les lames sur une plaque chaude à 42 ° C.
- Laisser les sections pour aplatir sur l'eau traitée au DEPC à 42 ° C. Utilisez du papier filtre pour évacuer l'eau à partir du bord.
- Un tissu de montage sur la lame en plaçant la lame sur une plaque chaude à 42 ° C pendant une nuit.
3. Tissue Staining
- Déparaffinage
- Collecter les diapositives de la plaque chaude et placez-les dans un rack de coloration. Ajouter 150 ml de xylène dans un bocal de coloration dans la hotte et immerger le support dans le xylène pendant 5 min.
- réhydratation
- Préparer différentes concentrations de solutions d'éthanol (100%, 95%, 70%, 50% et 30%) dans de l'eau traitée au DEPC et remplir 150 ml de solution dans des pots de coloration distincte, respectivement.
- Réhydrater les échantillons à travers une série de concentrations décroissantes d'éthanol, chaque étape pendant 3 min à température ambiante. Transférer les lames dans la coloration en rack un pot à un autre bocal contenant dconcentrations d'éthanol de ifférents: 100% d'éthanol, 95% d'éthanol, 70% d'éthanol, 50% d'éthanol et 30% d'éthanol.
- Après réhydratation, immerger les spécimens ddH 2 O pendant 3 min.
- hématoxyline coloration
- des échantillons de tissu Stain par immersion lames de tissu dans une solution d'hématoxyline pendant 1,5 min.
- Rincer brièvement dans ddH 2 O contenant 1 - 2 gouttes d'acide chlorhydrique 12 N (HCl) pendant quelques secondes, puis lavez brièvement dans ddH 2 O.
- déshydration
- Déshydrater les échantillons à travers une série de concentrations croissantes d'éthanol pendant 3 minutes à la température ambiante: 30% d'éthanol, 50% d'éthanol, 70% d'éthanol, 95% d'éthanol, et 100% d'éthanol. Effacer les échantillons avec du xylène dans la hotte pendant 5 min.
- Montage
- Baisse appropriée 600 pi de milieu de montage à base de xylène sur la glissière. Placez délicatement une lamelle sur l'échantillon. Évitez les bulles d'air formant pour obtenir des images de bonne qualité.
- Laisser les lames à l'air sécher pendant la nuit. Observer l'échantillon au microscope le lendemain.
Note: Les images ont été capturées à 25X à 400X en fonction de la taille des échantillons.
4. In Situ Hybridation
- synthèse de la sonde
- Séquence codant pour le clone en utilisant les amorces aphrodite Phalaenopsis gène Actine spécifiques GGCAGAGTATGATGAATCTGGTCC 5'-3 'et 5' AGGACAGAAGTTCGGCTGGC -3 '(pour obtenir 242 pb amplicon PCR) et CyclinB1, la séquence codante du gène 1 spécifique en utilisant les amorces 5'-3' TCGTAGCAAGGTTGCTTGTG- et 5'ATGAGCATGGCGCTAATACC-3 '(pour obtenir 327 pb amplicon PCR) comme décrit 12.
- Ligaturer les séquences de codage spécifiques dans des vecteurs (par exemple, pGEMT) selon le protocole du fabricant.
- Générer digoxigénine (DIG) étiqueté sens et antisens sondes utilisant SP6 kit de marquage / T7 DIG ARN selon les instructions du fabricants.
- Hybridation in situ
- Couper les 2 e et 3 e tranches de tissus des bourgeons axillaires (10 um d'épaisseur) généré en utilisant la méthode Hybrid-Cut, et monter des tranches sur la glissière enduite.
- sections Déparaffiner de tissus dans le xylène (voir 3.1.1), réhydrater dans la diminution des concentrations d'éthanol (voir 3.2.2), et de digérer avec 2 mg / ml de proteinase K à 37 ° C pendant 30 min.
- Réaliser une hybridation in situ , selon le protocole décrit précédemment 11,13 , avec quelques modifications, à savoir, avec une température d'hybridation pour Actine comme 59 ° C et 60 ° C pendant CyclinB1;. 1 Hybrider lame avec 40 ng de sonde d'ARN marquée à la DIG.
- Utiliser nitrobleu de tétrazolium / 5-bromo-4-chloro-3-indolylphosphate (NBT / BCIP) Solution pour détecter les signaux d'hybridation comme décrit 11.
- Faire une base de cire en plaçant une cassette intégrant sur le dessus d'un moule (même taille dans la section 1.6.2), remplir avec de la cire fondue et retirer le moule après la cire est solidifié.
Résultats
Hybrid-Cut améliore l'intégrité des sections de tissu
Comprendre l'anatomie de la structure florale de reproduction est important d'enquêter sur le mécanisme sous-jacent de l'initiation florale dans les orchidées. Cependant, l'accumulation de calcium intracellulaire des cristaux d'oxalate dans les orchidées Phalaenopsis fait de telles études une tâche difficile. Pour contourner les problèmes associés à la déchirure provoquée par des cristaux au cours du processus de découpe (Figure 1), nous avons développé un système que nous avons appelé Hybrid-Cut. Ce protocole combine les techniques traditionnelles de paraffine encastrements et cryosection. Nous avons d' abord testé Hybrid-Cut dans les bourgeons axillaires de Phalaenopsis orchidée parce qu'ils sont connus pour la rigidité des tissus et haute teneur en cristal. tissu bourgeon axillaire a été fixé à 4% PFA (voir le protocole, l'étape 1.3). Après déshydratation de l'éthanol série et la cire de paraffine infiltration, le bourgeon axillaire a été incorporé dans un bloc de paraffine. Le bloc a été coupé à une taille appropriée avant de sectionner (figure 2A). Une petite quantité d'octobre a ensuite été appliquée au centre de l'étage de cryostat (figure 2B). Le bloc de paraffine a été ensuite collé à la scène via octobre L'étape a été mis en incubation dans un cryostat pendant 10 minutes pour permettre la solidification complète de l' OCT avant sectionner (figure 2C), puis cryosection a été réalisée dans un -16 Chambre ° C (figure 2D).
A titre de comparaison, un bloc de paraffine contenant un bourgeon axillaire de Phalaenopsis orchidée a été soumis à régulière tronçonnage de microtome. Comme on le voit sur la figure 1A, la déchirure sévère des rubans de paraffine a été observée après découpe au microtome. L'intégrité des tissus et la structure cellulaire a également été compromise (figure 1B). Hybrid-Cut, d'autre part,des sections de tissus intacts produites (figure 3A) avec une intégrité structurelle conservée (figure 3B).
Application de Hybrid-Cut à divers tissus de P. Aphrodite
Pour tester davantage la susceptibilité de Hybrid-Cut, nous avons testé différents tissus d'orchidées Phalaenopsis. Il est souvent difficile d'obtenir des coupes de graines avec une bonne intégrité des tissus en raison des téguments durcis. En utilisant ce protocole, les structures détaillées des graines ont été conservées après la coupe (figure 4A). Comme le montre la figure 4A, les corps protéiques, les produits de stockage communs 14, pourraient être clairement identifiées. Hybrid-Cut a également travaillé avec succès et a montré les structures détaillées du méristème apical de tournage de l'un mois vieux protocorme (la structure germée d'une graine) (figure 4B) etprotocormes-like-corps (BLP, figure 4C). Les cristaux intracellulaires ont été observés dans les sections d'orchidées PLB. Phalaenopsis ont des feuilles épaisses et succulentes et ils effectuer le métabolisme des acides Crassulacean (CAM) de type de photosynthèse 15. La section transversale du limbe des feuilles a montré de grandes cellules du mésophylle et faisceaux vasculaires contenant xylème et le phloème (Figure 4D). Quelques stomates ont été observées sur la surface abaxiale des feuilles pendant la journée (figure 4D). En fait, les plantes CAM ont évolué pour maximiser le gain de carbone , mais de minimiser simultanément la perte d'eau en ouvrant leurs stomates dans la nuit dans des conditions arides 15,16. La racine méristème apical de P. aphrodite est représenté sur la figure 4E. Les cellules de pointe des racines semblaient contenir un nombre important de cristaux qui ont été très bien conservés après sectionnant (Figure 4E). sections longitudinales de jeunes pointes florales fournis information sur l'architecture des jeunes primordiaux floraux (Figure 4F). De plus, sépales, pétales, labelle et pollinies pourraient être clairement identifiés à partir de la section longitudinale de jeunes bourgeons de fleurs qui ont terminé la différenciation dans ce 5 mm bourgeon de fleur (figure 4G). Notez que les cristaux ont été accumulés dans les sépales de jeunes bourgeons floraux. En bref, ce protocole fonctionne de manière cohérente afin de maintenir l'intégrité des tissus et produit la morphologie intacte permettant des études cellulaires et anatomiques possibles.
Hybrid-Cut Préserve l' intégrité des tissus dans les cultures de céréales
Nous avons également testé Hybrid-Cut sur les cultures de céréales telles que le riz, le blé et le maïs qui contiennent une teneur élevée en silice 17,18. Comme on le voit sur la figure 5, l'intégrité tissulaire de coupes transversales de riz, de blé, de maïs et les feuilles ont été considérablement améliorée par l'Hybrid-Cut méthode. cellules Xylem, phloème, cellules mésophylle, stomates et bulliform qui contrôlent de roulement de la lame de feuille pour éviter la perte d'eau ont été clairement identifiées à partir des sections de feuilles de riz. L'anatomie Kranz, les cellules mésophylle et faisceaux vasculaires de la feuille de maïs 19,20 ont été clairement identifiés. Il était intéressant de découvrir une forte densité de stomates sur les deux côtés adaxiales et abaxiales de feuilles de maïs (figure 5). Le rapport des stomates adaxial et abaxial de 0,7 dans le maïs a été rapporté précédemment 21. En outre, ce protocole a également travaillé avec succès pour fournir la morphologie cellulaire détaillée des épillets de riz, de blé et de maïs (figure 6). Les épillets sont connues pour contenir de la silice abondante 9. Normalement, cela provoque des difficultés dans la conduite de sectionnement des tissus.
Hybridation In Situ
Génomique et transcriptomique approches sont couramment utilisés pour annoter les fonctions des gènes. Fournir la répartition spatiale des transcriptions des gènes d'intérêt dans des contextes de développement ou de l' environnement est important d'ajouter un nouvel éclairage sur les fonctions possibles des gènes. Hybridation in situ (ISH) a été développée pour localiser les profils d'expression des gènes au niveau des tissus 11, 22-25. En outre, ISH cellulaire peut fournir, dans certains cas , la sous-cellulaire, la résolution de la distribution de l' ARNm dans des 26 organismes multicellulaires. Pendant ISH, l'ARN et l'intégrité des tissus est essentielle pour obtenir des informations spatiales fiables sur la transcription sélectionnée. Nous avons testé en utilisant le protocole ISH Hybrid-Cut gène Actine (de PATC157348) a été clone en utilisant les amorces 5 'GGCAGAGTATGATGAATCTGGTCC-3' et 5 'AGGACAGAAGTTCGGCTGGC -3' pour obtenir 242 pb par PCR amplicon cycline B1:.. 1 (PATC146999) gène spécifique la séquence codante en utilisant des amorces 5 'TCGTAGCAAGGTTGCTTGTG-3 'Et 5'ATGAGCATGGCGCTAATACC-3' pour obtenir 327 pb amplicon PCR. Après ISH, actine et cycline B1: 1 expression génique a été surveillée chez les jeunes et matures bourgeons axillaires (Figure 7). Les deux gènes ont été exprimés dans les cellules méristématiques de 2 e et 3 e bourgeons axillaires, avec des signaux plus forts détectés dans 3 bourgeons axillaires rd. Ces résultats ont démontré que Hybrid-Cut conserver une bonne anatomie et fournir spatiale motif d'expression génique.

Figure 1: Section de paraffine traditionnelle Causes Tearing sévère des tissus Un bloc de paraffine contenant un bourgeon de Phalaenopsis orchidée axillaire a été soumis à régulière tronçonnage de microtome.. Déchirure sévère des rubans de paraffine a été observée après tronçonnage de microtome traditionnelle (A) . L'intégrité des tissus et la structure cellulaire a également été compromise (B). Les flèches indiquent la déchirure sévère de la tranche de tissu. Arrowhead montre les corps de cristal. Barre d' échelle de 100 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2:. Hybrid-Cut Sectionnement Méthode Un tissu des bourgeons axillaires a été fixé en PFA et les tissus ont été déshydratés, infiltré avec de la cire de paraffine, et incorporé dans un bloc de paraffine. Le bloc de paraffine a été coupé à une taille appropriée (A). Composé de coupe optimale de température (octobre) a été appliquée au centre de l'étage de cryostat (B). Le bloc de paraffine a été attaché à l'OPO sur la scène cryostat. À basse température, le bloc de paraffine On a fait adhérer à la phase du cryostat par l' intermédiaire d' octobre (C). Des coupes de tissu ont été sectionnées dans la chambre de cryostat à -16 ° C (D). Les barres d'échelle représentent 0,5 cm (A), et 1 cm (BD). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
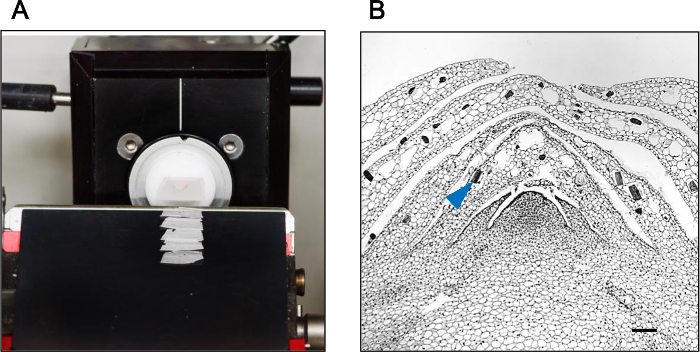
Figure 3: Hybrid-Cut améliore l' intégrité de la section Un bloc de paraffine contenant un bourgeon de Phalaenopsis orchidée axillaire a été soumis à Hybrid-Cut sectionnant (A) et la méthode Hybrid-Cut sections avec une excellente intégrité des tissus (B) produit.. La flèche montre les corps de cristal endogènes intégrés dans le tissu des bourgeons axillaires. Barre d'échelle de 100 um.rget = "_ blank"> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 4: Application de Hybrid-Cut aux différentes sections de tissus de Phalaenopsis orchidée différente orchidée. les tissus ont été sectionnés en utilisant la méthode Hybrid-Cut, comme coupe longitudinale de graines d'orchidées pendant la phase de maturité (A), la section longitudinale de protocorme (B), section longitudinale des corps de protocormes-like (PLB) (C), la section transversale de limbe (D), la section longitudinale de racine (E), section longitudinale de jeune hampe florale (F), et la section longitudinale des jeunes bourgeons floraux (G). Les coupes de tissus ont été colorées par l'hématoxyline. SC, tégument; PB, corps de protéines; M,méristème; MP, mère PLB; DP, fille PLB; Ad, surface foliaire adaxial; Ab, surface foliaire abaxiale; St, stomates; MC, cellule mésophylle; VB, faisceau vasculaire; RC, coiffe; fb, bourgeon floral; Se, sépales; Pe, pétale; La, labelle; Po, pollinies; Ro, rostellum; Ca cals. Arrowheads montrent des cristaux. Les barres d'échelle représentent 20 pm (AE) et 200 um (FG). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 5:. Hybrid-Cut Préserve l' intégrité des tissus des feuilles dans plusieurs cultures de céréales Comparaison des tissus de la feuille en utilisant la méthode traditionnelle de paraffine (panneau de gauche) et la technique hybride-Cut développée dans cette étude (panneau de droite). Les images montrent des sections transversales de la feuille de riz, le blé et le maïs. MC, cellule mésophylle; Ph, phloème; St, stomates; BC, bu cellule lliform. Les flèches indiquent le déchirement de tranche de tissu. Arrowheads montrent corps de silice. Les cercles bleus en pointillés indiquent Kranz anatomie C4 maïs. Echelle barres 20 um. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.

Figure 6:. Hybrid-Cut Préserve l' intégrité des tissus épillet dans plusieurs cultures de céréales Comparaison de l' intégrité des tissus des sections épillets entre les méthodes de paraffine et Hybrid-Cut traditionnels. Les flèches indiquent le déchirement de tranche de tissu. Arrowheads indiquent corps de silice. Les barres d'échelle 20 um (riz), et 200 um (blé et maïs). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 7: Hybridation in situ d'actine et CyclinB1; 1 Expression Patterns dans le bourgeon axillaire de Phalaenopsis orchid Les tranches de tissus de la rd bourgeon axillaire 2 e bourgeons axillaires et 3 ont été préparés en utilisant la méthode Hybrid-Cut.. Un total de 40 ng d'actine et CyclinB1; 1 sonde dig marqué ont été utilisés pour l' hybridation. La sonde de détection a été utilisé comme témoin négatif. Les flèches indiquent le méristème reproducteur de bourgeon axillaire. Echelle barres 100 um. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
Discussion
Les cellules végétales ont des parois rigides cellulaires, fibres dures, des cristaux, et forte teneur en eau qui causent des problèmes de déchirement du tissu pendant la coupe des tissus végétaux. Même si tronçonnage à base de paraffine est fréquemment utilisée pour les tissus végétaux, les cristaux endogènes lacèrent souvent le tissu végétal pendant la coupe (Figure 1). En raison de la teneur élevée en soi de l'eau dans les cellules végétales, à base de tronçonnage cryostat provoque souvent des cellules cassées et des coupes de tissus fissurés.
Dans la présente étude, une paraffine-plongement et cryosection protocole combiné baptisé Hybrid-Cut a été développé et des coupes de tissus de bonne qualité ont été obtenus. Ce protocole résout le problème lié à la forte teneur en eau par l' introduction d' inclusion dans la paraffine, et réduit l'effet de déchirure par le durcissement de la paraffine à basse température pendant la coupe (figure 3). Par conséquent, ce protocole modifié est avantageux par rapport soit sectio à base de paraffinening ou cryosectioning pour préserver l'intégrité des tissus de la plante.
Ce manuscrit démontre que la méthode Hybrid-Cut préserve l' intégrité des tissus dans de nombreux tissus de Phalaenopsis orchidées telles que bourgeon axillaire, les semences, et PLB, etc. qui contiennent des niveaux élevés de cristaux (figures 3-4). En outre, ce protocole se prête aux cultures de céréales telles que les organes reproducteurs et les feuilles de riz, le maïs et le blé qui contiennent haute teneur en silice (figures 5-6). Vraisemblablement, ce protocole peut être appliqué aux plantes ligneuses contenant haute teneur en fibres.
En général, le tissu de fixation est bien très important pour Hybrid-Cut. Nous avons constaté que l' acide formaldéhyde-alcool-acide (FAA) fixateur est meilleure que PFA pour préserver l'intégrité des tissus de certains tissus récalcitrants tels que les bourgeons axialement, racines, etc. Cependant, PFA fonctionne mieux que la FAA à préserver l'intégrité de l' ARN. Par conséquent PFA est recommandé de fixeréchantillon pour l' hybridation in situ (ISH) travail. Le protocole décrit ici est conçu pour l'expérience ARN ISH. Par conséquent, tous les réactifs ont été préparés pour éviter la dégradation de l'ARN en éliminant la contamination RNase par traitement DEPC. Si l'article Hybrid-Cut est pour les études anatomiques, l'osmose inverse (OI) de l'eau ordinaire et son tampon ou des réactifs dérivés sont acceptables.
Réduction de la taille et de l'épaisseur de l'échantillon inférieure à 3 mm est utile pour l'infiltration. En outre, l'augmentation du temps d'immersion pour la déshydratation et l'infiltration sont nécessaires pour les tissus de texture dure. Limitation de ce protocole pourrait en raison de problèmes causés par une mauvaise fixation, la déshydratation et l'infiltration de l'échantillon. Par conséquent, l'ajustement du temps de traitement pour chaque étape est essentielle pour produire bloc de paraffine de bonne qualité. Normalement, un tissu plus dur nécessite un temps plus le temps de traitement de tissu mou.
En outre, nous avons montré que Hybrid-Cut a travaillé avec succès en combinaison wie ISH pour fournir une distribution spatiale des transcriptions sélectionnées (figure 7). En résumé, ce protocole est utile pour l'étude de l'anatomie des plantes et fournit un ARN carte spécifique au tissu des gènes sélectionnés. En outre , il peut être appliqué à d' autres études moléculaires tels que désoxynucléotidyltransférase terminale dUTP nick étiquetage final (TUNEL) dosage, l' hybridation fluorescente in situ (FISH), et les techniques de immunocoloration. En conclusion, cette amélioration de protocole de découpe de tissu est à la fois utile et utile pour les chercheurs dans les communautés végétales.
Déclarations de divulgation
No conflicts of interest declared.
Remerciements
We are grateful to the technical support from Ms. Hong Xian Hsing, Mr. Min Jeng Li, and Mr. Eric C. P. Wu. We express our appreciation to Miranda Loney for English editing.
matériels
| Name | Company | Catalog Number | Comments |
| Embedding Center model EC780-1 | CSA | ||
| Microtome model RM2255 | Leica | ||
| Cryostat model CM 1950 | Leica | ||
| Axio Scope A1 microscope | Zeiss | ||
| Murashige & Skoog medium including vitamins | Duchefa Biochemia | M0222.0050 | |
| RNase free surface decontaminant | Apex | 10-228 | |
| Diethyl pyrocarbonate (DEPC) | Bio Basic Inc. | D801154 | |
| Sodium chloride (NaCl) | MDBio, Inc. | 101-7647-14-5 | |
| Potassium chloride, crystal (KCl) | J.T. Baker | 7447-40-7 | |
| Sodium phosphate dibasic (Na2HPO4) | Sigma-Aldrich | 7558-79-4 | |
| Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | 7778-77-0 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 16005 | |
| Sodium hydroxide (NaOH) | Showa | 19430160 | |
| Sulfuric acid (H2SO4) | Sigma-Aldrich | 7664-93-9 | |
| Glutaraldehyde solution | Sigma-Aldrich | 111-30-8 | |
| Polyoxyethylene 20 sorbitan monolaurate (Tween 20) | J.T. Baker | 9005-64-5 | |
| Octyl Phenol Ethoxylate (Triton X100) | J.T. Baker | 9002-93-1 | |
| Glass scintillation vials | Newastar | DG60805-00020 | |
| Desiccator vacuum | Violet Bioscience Inc. | TS-402030 | |
| Rotary vane pump RZ2.5 | Vacuubrand | 36149406 | |
| Ethanol | J.T. Baker | 64-17-5 | |
| Sub-X | Leica Surgipath | 3803670 | Xylene substitute |
| Paraplast Plus | Leica Surgipath | 39602004 | Tissue embedding paraffin |
| SUPERFROST micro slide glass | Matsunami | S7441 | |
| FSC 22 Clear | Leica Surgipath | 3801480 | Optimal Cutting Temperature compound (OCT) |
| Xylenes, Purified | Leica Surgipath | 3803665 | |
| Hematoxylin | Merck | HX305311 | |
| Hydrochloric acid (HCl) | Sigma-Aldrich | 7647-01-0 | |
| Micromount | Leica Surgipath | 3801731 | Mounting medium |
| pGEM T-easy vector | Promega | A1360 | |
| Proteinase K | Roche | 3115879001 | |
| SP6/T7 DIG RNA Labeling Kit | Roche | 11175025910 | |
| NBT/BCIP stock solution | Roche | 11681451001 |
Références
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Cryosectioning tissues. Cold Spring Harb Protoc. 3, 1-2 (2008).
- Knox, R. B. Freeze-sectioning of plant tissues. Stain Technol. 45, 265-272 (1970).
- Ruan, J. L., et al. An improved cryosection method for polyethylene glycol hydrogels used in tissue engineering. Tissue Eng.: Part C Methods. 19, 794-801 (2013).
- Prychid, C. J., Rudall, P. J. Calcium oxalate crystals in monocotyledons: A review of their structure and systematics. Ann Bot. 84, 725-739 (1999).
- Prychid, C. J., Rudall, P. J., Gregory, M. Systematics and biology of silica bodies in monocotyledons. Bot. Rev. 69 (4), 377-440 (2004).
- Arnott, H. J., Pautard, F. G. E., Steinfink, H. Structure of calcium oxalate monohydrate. Nature. 208, 1197-1198 (1965).
- Mitani, N., Yamaji, N., Ma, J. F. Identification of maize silicon influx transporters. Plant Cell Physiol. 50, 5-12 (2009).
- Hayasaka, T., Fujii, H., Ishiguro, K. The role of silicon in preventing appressorial penetration by the rice blast fungus. Phytopathology. 98, 1038-1044 (2008).
- Ma, J. F., Yamaji, N. Silicon uptake and accumulation in higher plants. Trends Plant Sci. 11, 392-397 (2006).
- Chen, W., Tang, C., YL, K. Ploidy doubling by in vitro culture of excised protocorms or protocorm-like bodies in Phalaenopsis species. Plant Cell Tiss Org. 98, 229-239 (2009).
- Javelle, M., Marco, C. F., Timmermans, M. In Situ Hybridization for the Precise Localization of Transcripts in Plants. J. Vis. Exp. (57), e3328(2011).
- Park, D. J. E. PCR Protocols. Methods in Molecular Biology. 687, (2011).
- Lin, H. Y., et al. Genome-wide annotation, expression profiling, and protein interaction studies of the core cell-cycle genes in Phalaenopsis aphrodite. Plant Mol Biol. 84, 203-226 (2014).
- Lee, Y. -I., Yeung, E. C., Lee, N., Chung, M. -C. Embryology of Phalaenopsis amabilis var. formosa: embryo development. Bot Stud. 49, 139-146 (2008).
- Endo, M., Ikusima, I. Diurnal rhythm and characteristics of photosynthesis and respiration in the leaf and root of a Phalaenopsis plant. Plant Cell Physiol. 30, 43-47 (1989).
- Guo, W. J., Lee, N. Effect of leaf and plant age, and day/night temperature on net CO2 uptake in Phalaenopsis amabilis var. formosa. J. Amer. Soc. Hort. Sci. 131, 320-326 (2006).
- Lewin, J., Reimann, B. Silicon and plant growth. Ann. Rev. of Plant Physiol. 20, 289-304 (1969).
- Kaufman, P. B., et al. Silica in shoots of higher plants. Silicon and siliceous structures in biological systems. Simpson, T. L., Valcani, B. E. , Springer-Verlag. 409-449 (1981).
- Lundgren, M. R., Osborne, C. P., Christin, P. A. Deconstructing Kranz anatomy to understand C4 evolution. J Exp Bot. 65, 3357-3369 (2014).
- Liu, W. Y., et al. Anatomical and transcriptional dynamics of maize embryonic leaves during seed germination. Proc Natl Acad Sci U S A. 110, 3979-3984 (2013).
- Driscoll, S. P., Prins, A., Olmos, E., Kunert, K. J., Foyer, C. H. Specification of adaxial and abaxial stomata, epidermal structure and photosynthesis to CO2 enrichment in maize leaves. J Exp Bot. 57, 381-390 (2006).
- Karlgren, A., Carlsson, J., Gyllenstrand, N., Lagercrantz, U., Sundström, J. F. Non-radioactive in situ Hybridization Protocol Applicable for Norway Spruce and a Range of Plant Species. J. Vis. Exp. (26), (2009).
- Hejatko, J., et al. In situ hybridization technique for mRNA detection in whole mount Arabidopsis samples. Nat Protoc. 1, 1939-1946 (2006).
- Javelle, M., Timmermans, M. C. In situ localization of small RNAs in plants by using LNA probes. Nat Protoc. 7, 533-541 (2012).
- Drea, S., et al. In situ analysis of gene expression in plants. Methods Mol Biol. 513, 229-242 (2009).
- Drea, S., et al. A streamlined method for systematic, high resolution in situ analysis of mRNA distribution in plants. Plant Methods. 1, 8(2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon