Method Article
Dirigido Embalagem Proteína da Membrana Externa no interior de vesículas
Neste Artigo
Resumo
A protocol for the production, purification, and use of enzyme packaged outer membrane vesicles (OMV) providing for enhanced enzyme stability for implementation across diverse applications is presented.
Resumo
Um crescente interesse na aplicação de técnicas de biologia sintética para programar vesículas de membrana externa (OMV) estão levando a algumas aplicações muito interessantes e originais para OMV, onde nanopartículas tradicionais estão provando muito difícil de sintetizar. Até à data, todas as bactérias Gram-negativas têm sido mostrados para produzir embalagens OMV demonstrando um de uma variedade de carga que inclui pequenas moléculas, péptidos, proteínas e material genético. Com base na sua carga diversa, OMV estão implicadas em muitos processos biológicos que vão desde a comunicação célula-célula para a transferência de genes e entrega de factores de virulência, dependendo de quais as bactérias são a produção de OMV. Só recentemente é que OMV bacteriana se tornar acessível para uso em uma ampla gama de aplicações através do desenvolvimento de técnicas para controlar e embalagem direta de proteínas recombinantes em OMV. Este protocolo descreve um método para a produção, purificação, e da utilização de enzima embalados OMV para proporcionar melhorada Overaprodução ll da enzima recombinante, o aumento da vesiculação e estabilidade da enzima melhorada. a utilização bem sucedida deste protocolo irá resultar na criação de uma estirpe bacteriana que produz simultaneamente uma proteína recombinante e dirige-o para o encapsulamento OMV através da criação de uma ligação sintética entre a proteína recombinante e uma proteína de âncora de membrana externa. Este protocolo também detalha métodos para isolar OMV a partir de culturas de bactérias, bem como técnicas de manejo adequadas e coisas a considerar quando se adaptando este protocolo a ser utilizado para outras aplicações únicas, tais como: entrega farmacêutica de medicamentos, diagnósticos médicos, e remediação ambiental.
Introdução
Apresentado aqui é um método para a concepção, produção e purificação de vesículas carregadas por enzimas bacterianas da membrana externa (OMV). OMV são pequenos, principalmente unilamelar, proteolipossomas que variam em tamanho de 30-200 nm, de 1,2. Todas as bactérias Gram-negativas e Gram-positivas que foram estudados até à data demonstraram libertação de qualquer das OMV ou vesículas extracelular (EV) de sua superfície de 3,4. O mecanismo preciso pelo qual OMV são produzidos ainda não foram completamente elucidados, devido às diversas populações bacterianas que eles, bem como as diferentes funções que eles servem secretam. OMV foram mostrados para o transporte de uma ampla gama de cargas de pequenas moléculas, péptidos, proteínas e material genético para servir uma variedade de sinalização complexas, a translocação do gene, e virulência funciona 5,6.
Os mecanismos exactos de OMV biogénese não estão bem caracterizados, e parecem diferir entre as espécies bacterianas. apesar this verdade, temos desenvolvido um método para melhorar a eficiência de embalagem de uma proteína recombinante em OMV através da criação de uma ligação sintética entre uma proteína de interesse e uma proteína endógena altamente abundantes na membrana externa bacteriana e subsequente OMV. Na ausência de uma ligação sintética, ou incorporados artificialmente afinidade, entre a proteína expressa de forma recombinante e a OMV a eficiência de embalagem observada é muito baixo 7. Este resultado é de se esperar que a incorporação das proteínas dentro da OMV quer ocorre por meio de encapsulamento acaso no preciso momento da formação de OMV na superfície bacteriana ou através de uma embalagem dirigido por mecanismos que não são bem compreendidos. Algum sucesso foi observado em proteínas de embalagem simplesmente através da sobre-expressão dentro do espaço periplásmico que depende de encapsulamento acaso mas eficaz embalagem é altamente dependente da proteína com algumas proteínas de embalagens, a eficiência elevada comparado com outras tha não embalar em tudo 8-10. Através da utilização de técnicas de biologia sintética comuns procuramos projetar Escherichia coli (E. coli) para produzir simultaneamente, pacote e secretar uma enzima ativa de interesse em OMV que contorna as limitações do conhecimento atual sobre como OMV são formados e como a carga é selecionada pelas bactérias para embalagem.
Para os fins deste pedido de um sistema de divisão de bioconjugação proteína foi escolhida como a ligação sintética de escolha para facilitar a embalagem direccional no OMV. Tal como o nome sugere um sistema de bioconjugação proteína de separação é constituída por duas subunidades domínios complementares que interagem um com o outro. Os domínios proteicos separação seleccionadas para efeitos deste protocolo são referidos como o SpyCatcher (SC) e SpyTag domínio (ST) e são derivados da proteína de ligação pyogenes Streptococcus fibronectina (FbaB) 11. Este sistema de proteína de divisão é incomum em que wuando as duas subunidades estão dentro da proximidade de uma ligação isopéptido forma espontaneamente entre as extremidades proximal resíduos de ácido aspártico e de ácido amino de lisina, criando uma ligação covalente. Formação da ligação isopéptido não requer a adição de proteínas chaperonas, enzimas, catalisadores ou cofactores e pode facilmente ocorrer à temperatura ambiente (TA) e sobre uma ampla gama de condições f isiologicamente relevantes 12.
Como prova do conceito, phosphotriesterase (TEP) (EC 3.1.8.1) a partir de Brevundimonas diminuta foi seleccionado para ser embalado em E. coli derivada OMV 13. TEP contém um Zn / Zn local activo binuclear e tem a capacidade de quebrar organofosfatos através de uma reacção de hidrólise convertendo aryldialkylphosphates em dialkylphosphates e álcoois arilo 14. A exposição a organofosforados prejudica a função neurotransmissor adequada através da inibição da hidrólise da acetilcolina pela acetilcolinesterase nas junções neuromusculares Makincompostos derivados g organofosforados extremamente perigosas 15. A exposição prolongada ou significativa para organofosforados geralmente resulta em convulsões incontroláveis e, normalmente, causa a morte por meio de asfixia. Enquanto TEP apresenta a maior actividade catalítica em relação paraoxon, um insecticida muito potente, ele também é capaz de hidrolisar uma variedade de outros pesticidas e V / G tipo nervosas agentes químicos 16. Para facilitar a embalagem OMV, um plasmídeo bacteriano foi concebido que codifica uma construção de genes que contém um promotor indutível, uma sequência de localização periplasmático, e um local de clonagem múltipla curto a montante da sequência do gene CS. Inserção do gene da TEP entre o líder e a sequência de SC permitido para a criação de um interruptor genético que tem como alvo a proteína de fusão PTE-SC para o espaço periplásmico de embalagem OMV. Enquanto os esforços descritos aqui concentrar em PTE, o gene da enzima é intermutável e pode ser facilmente substituída por outra sequência de gene com o FACilitate embalagem de uma enzima ou proteína alternativa.
À medida que a segunda parte da ligação sintética, uma proteína da membrana externa abundante (OmpA) é escolhido para apresentar a sequência do péptido ST. Embora a escolha de proteína de ancoragem pode variar, é essencial que a proteína tem um domínio permissiva, que apresenta no interior do espaço periplasmático, tolera a construção de fusão sem induzir citotoxicidade, é conhecido por estar presente em OMV, e não se agregar quando é recombinantemente produzido. OmpA kDa é uma proteína transmembranar de porina 37.2 que é conhecida por ser altamente expresso na membrana externa bacteriana e subsequente OMV 17. Ele está implicado no transporte de moléculas pequenas, <2 nm de tamanho, através da membrana bacteriana 18. Nativo OmpA tem dois domínios estruturalmente únicos, um motivo barril beta transmembranar e uma porção C-terminal solúvel periplasmically conhecido para interagir com o peptidoglicano 19. No designe mutante fusão OmpA-STd aqui a porção C-terminal de OmpA foi eliminado e o ST foi fundido com o N- periplasmically virado ou C-terminais. Excluindo a parte periplasmático de OmpA diminui o número de interacções entre a membrana exterior eo peptidoglycan resultando na desestabilização da membrana levando a hiper-vesiculation 7. OmpA genómico foi mantida para além da construção de OmpA-ST expressa de forma recombinante para mitigar a desestabilização da membrana bruta.
Protocolo
1. Preparação dos plasmídeos
- Prepare um plasmídeo (por exemplo, pET22) contendo a proteína de ancoragem (OmpA) fundido com um domínio de ligação bi-ortogonal (referido no presente protocolo como âncora-ST), tag epitopo (como 6xHis, myc ou bandeira de tags para a purificação e identificação), tag periplasmático localização, a resistência aos antibióticos, e de origem adequada de replicação com base na estirpe bacteriana seleccionada 7.
- Extrair DNA de plasmídeo a partir de culturas durante a noite utilizando um kit de isolamento de ADN comercialmente disponível seguindo o protocolo do fabricante.
- Preparar um plasmídeo (por exemplo, pACYC184) contendo a enzima / proteína (TEP) a ser embalado dentro do OMV fundido com o domínio de ligação bioorthogonal complementar à da proteína de ancoragem (referido neste protocolo como enzima-SC), etiqueta de epitopo, tag periplasmático localização, a resistência aos antibióticos, que é diferente do que o plasmídeo de proteína de âncora, e orig adequadoem de replicação com base na estirpe bacteriana seleccionada 7.
- Extrair DNA de plasmídeo a partir de culturas durante a noite utilizando um kit de isolamento de ADN comercialmente disponível seguindo o protocolo do fabricante 7.
2. Geração de uma cultura de E. coli OMV Packaging
- O isolamento de plasmídeo
- Purifica-se plasmídeos que codificam a enzima-SC construir e âncora-ST constrói a partir de linhas celulares de manutenção separadas utilizando um kit de isolamento de plasmídeo comercial de acordo com o protocolo do fabricante 7. Determinar a concentração e pureza do DNA por medição da absorvência a 260 nm e 280 nm.
- A co-transformação
- Seleccionar uma estirpe de E. coli, que está comercialmente disponível para facilitar a expressão de proteínas.
NOTA: BL21 células (DE3) foram utilizados aqui. O lisogene de T7 é necessário para a expressão da construção de ancoragem-ST, que se baseia no promotor T7 e T7 ARN polimerase para protexpressão ein. A utilização de outras estirpes de bactérias exige quer a presença do gene lisogénio de T7 ou a utilização de um plasmídeo diferente pET22 7. - Dilui-se DNA de plasmídeo purificado a concentrações equivalentes molares, em seguida transformá-las em células bacterianas competentes, quer através de transformação de choque térmico ou electroporação, seguindo o protocolo do fabricante para as células competentes escolhidas.
- células da placa transformada Onto Luria-Bertani (LB) placas de ágar com ampicilina (pET22) e cloranfenicol (pACYC184) contendo antibiótico; ambos presentes em concentrações finais de 25 ug / ml.
- Colocar a placa de cultura a 37 ° C durante a noite para isolar apenas os clones que contêm ambos os plasmídeos.
NOTA: As colónias que sobrevivem a selecção de antibiótico irá ser utilizado para todas as preparações futuras de OMV. Os antibióticos (ampicilina e cloranfenicol) será adicionada a todas as culturas líquidas para manter a pressão selectiva e assegurar a presença de ambos os plasmídeos.
- Seleccionar uma estirpe de E. coli, que está comercialmente disponível para facilitar a expressão de proteínas.
3. OMV Produção
- Expansão Colony
- Inocular 5 ml de meio de cultura (tipicamente Terrific Broth (TB) ou LB) contendo antibióticos nas concentrações acima mencionadas (passo 2.2.3) com uma única colónia a partir das placas de selecção descrito no 2.2.4.
- Efectuar uma diluição 1: 100 de dobragem da cultura fermento durante a noite em frascos de cultura com deflectores.
NOTA: Use um volume de mídia entre 250-500 ml. - Manter a cultura a 37 ° C com agitação a 250 rpm para garantir que o arejamento suficiente da cultura é atingido.
- Indução de cada plasmídeo
- Permitir que a cultura bacteriana para crescer a uma DO 600 de 0,6-0,8, cerca de 3 h de crescimento após a inoculação do balão de crescimento primário.
- Para melhorar o rendimento final de TEP-SC vesículas carregadas, centrifugar toda a cultura a 7000 xg durante 15 min. Ressuspender o sedimento celular em pré-aquecido, o meio de cultura fresco.
NOTA: Este optional passo ajuda a remover qualquer OMV vazio que estão presentes no meio de cultura antes da indução PTE-SC. - Adicione uma solução de 20% de L-arabinose em água e filtro estéril usando um filtro de 0,22 um. Loja solução de L-arabinose a 4 ° C durante 2-4 semanas.
- Adicionar a solução de L-arabinose para o frasco de cultura para uma concentração final de 0,2% para iniciar a produção de TEP-SC.
NOTA: Isso ajuda a pré-carregar o espaço periplásmico com PTE-SC antes da promoção de um maior vesiculation através da indução do mutante OmpA-ST. - Adicione uma solução 1 M de isopropilo β-D-1-tiogalactopiranósido (IPTG) em água e filtro estéril usando um filtro de 0,22 um.
NOTA: IPTG deve ser utilizado imediatamente, uma vez hidratado. Alíquotas de IPTG pode ser armazenado congelado durante 3-6 meses e pode ser descongelado imediatamente antes de usar. - Adicionar IPTG após um período de incubação adicional de três horas a uma concentração final de 0,5 mM, para iniciar a produção do OmpA-ST.
- Permitir que a cultura-se crescer durante um adicional de 8-14 h a 37 ° C enquanto se agita.
4. OMV Purificação
- Remoção de bactérias intactas
- Centrifuga-se o meio de cultura bacteriana durante 15 minutos a 7000 xg, a 4 ° C para sedimentar as bactérias intactas.
- Decante, e salvar, os meios de comunicação fora do topo do poste centrifugação pellet celular tomando cuidado para não perturbar o pellet celular.
- Repita os passos 4.1.1 e 4.1.2 para um ciclo de centrifugação adicional para garantir todas as bactérias intactas são removidos do meio de cultura tendo a certeza de decantar e salvar a mídia.
- A remoção de agregados de proteína
- Purificar o meio de cultura bacteriana utilizando um filtro de membrana de 0,45 um para remover as bactérias residuais e material celular indesejada grande.
NOTA: Use um material de membrana biologicamente compatível para recuperações mais elevadas e adsorção de proteínas inferior, tais como acetato de celulose (CA) ou fluoreto de polivinilideno (PVDF). volumes de filtro de seringa inferior a 100 ml e volumes de filtro de vácuo superiores a 100 ml.- Para filtro de seringa, desenhar meio de cultura em estéril seringa 10-50 ml. Encaixe de 0,45 um filtro de extremidade de Luer da seringa. Deprimir êmbolo e recolher flow-through em um novo navio.
- Para aspirar filtro, transferir o meio de cultura a um aparelho de filtração estéril. Anexar unidade a bomba de vácuo ou afundar aspirador para gerar sucção. Transferência médio filtrada para nova embarcação.
- Purificar o meio de cultura bacteriana utilizando um filtro de membrana de 0,45 um para remover as bactérias residuais e material celular indesejada grande.
- Isolamento de OMV através Ultracentrifugação
- Adicione o meio de cultura filtrado em tubos de centrifugação tendo o cuidado de equilibrar tubos opostos na centrífuga.
- Pelete a ~ 150.000 x g durante 3 horas a 4 ° C em uma ultracentrífuga com o rotor correspondente combinando tanto o instrumento e os tubos a ser utilizado.
- Decanta-se o meio de cultura esgotado OMV a partir do sedimento OMV, tomando cuidado para não perturbar o sedimento OMV, imediatamente após a conclusão óf centrifugação como permitir a pastilha OMV permanecer nos meios de comunicação irá amolecer o sedimento reduzindo recuperação OMV.
NOTA: Este sedimento será ligeiramente acastanhada e, dependendo da quantidade de partida de cultura bacteriana podem ou não podem ser visíveis a olho nu. Aspirando o suporte directamente a partir do topo do tubo de centrifugação, também é uma opção tendo em mente que os materiais removidos mais do OMV sedimentar o mais pura a amostra final será OMV. - Salve o sobrenadante centrifugado para testes mais tarde dinâmica de espalhamento de luz (DLS) para verificar se as partículas OMV foram totalmente descarregada a partir da mídia.
- Adicionar 0,5-1 ml de filtrado tampão fosfato salino (PBS), pH 7,4 ou 100 mM de tampão estéril N -ciclo-hexil-2-aminoetanossulfónico ácido (CHES) a pH 8,0 e o sedimento de OMV permitindo-se incubar durante 30 min à temperatura ambiente. Certifique-se de que o sedimento não seca.
NOTA: Os extremos em solução de força iónica, pH e temperatura podem resultar em reduzida solubilidade OMV e promover aggregação. - Cuidadosamente pipetar a solução purificada OMV a partir do tubo de centrífuga, misturando suavemente para assegurar que toda a pelete foi solubilizada.
5. OMV Caracterização
- Usar qualquer software DLS ou rastreamento de nanopartículas comercialmente disponível seguindo os protocolos do fabricante fornecida únicas para cada instrumento para determinar a distribuição de tamanho OMV e concentração de partículas.
NOTA: Aqui, distribuição de tamanho de OMV e concentração foi determinada utilizando NanoSight LM10 nanopartículas de rastreamento e software Análise NTA 2.3.- Abra o software.
- Ligue microscópio e limpar todas as superfícies da unidade de microscópio e rastreamento de nanopartículas.
- Adicionar ~ 0,5 ml de amostra OMV directamente para a janela de visualização do dispositivo de localização de partículas através do encaixe Luer, com uma seringa esterilizada de 1 ml sendo certo para cobrir toda a janela de visualização, sem qualquer injecção de bolhas de ar no sistema.
- lugar tele nanopartículas unidade de rastreamento no palco microscópio e ligar o laser.
- Clique "captura" do software.
- Ajuste o foco do microscópio e palco para visualizar as partículas na tela de visualização atual na janela do software.
- Ajuste o "obturador da câmera" e "Ganho Camera" até que as partículas brilhantes são claramente visualizados em um fundo escuro.
- Ajustar a duração de captura a 60 seg.
- Clique em "Record".
- Quando solicitado, a entrada da temperatura / dispositivo de amostra, rotular a amostra, e salvar os dados de vídeo na conclusão da cada correr em uma pasta designada usuário.
- Mantenha todos os parâmetros de análise (limiar de detecção, Blur, Pista Min Comprimento, Min esperado Particle Size) no modo de detecção automática e clique em "sequência do processo."
NOTA: Consulte o manual para saber como cada parâmetro pode ser ajustado de forma independente para os resultados da análise sintonia fina. - Ficha de distribuição de tamanho de partícula e as partículas / mL concentração tal como determinado pelo software.
NOTA: Uma gama de tamanho hidrodinâmico OMV típica situa-se entre 30-200 nm com uma concentração de partículas / ml de ~ 10 x 10 8.
- Determinando OMV conteúdo Protein
- Use padrão de SDS-PAGE e protocolos de Western blot para avaliar a pureza OMV, a produção da enzima, e a eficiência de reticulação SC-ST 7.
NOTA: A reticulação eficiência não é 100% 7.
- Use padrão de SDS-PAGE e protocolos de Western blot para avaliar a pureza OMV, a produção da enzima, e a eficiência de reticulação SC-ST 7.
6. Verificação de Enzyme Packaging
- PTE Activity Assay
- Executar todos os ensaios enzimáticos em um tampão adequado, tal como tampão CHES 100 mM (pH 8) a 25 ° C em qualquer uma cuvete ou multiplexados numa placa de 96/384.
- Adicionam-se 5 ul de uma diluição de 1: 1000 em tampão de paraoxon CHES 90 ul de CHES e 5 ul de OMV purificado (~ 36 vezes concentrada em comparação com a concentração de OMV presente no meio de cultura).
Cuidado: Paraoxônio é um pesticida tóxicoe devem ser manuseados por fabricante e diretrizes institucionais. - Aqui as leituras de absorvância a intervalos regulares (cada 20 seg durante ~ 2 horas tempo total de reacção), a 405 nm (ε = 18,1 mM -1 cm -1) e a 348 nm (ponto ε isosbestic = 5,4 mM-1cm-1) para se monitorizar a progressão da reacção do produto de decomposição paraoxon cromogénico, p-nitrofenol.
NOTA: A valores de pH acima de 8 a forma desprotonada dominante do p-nitrofenol está presente permitindo um acompanhamento preciso a 405 nm. Em todas as outras soluções de complexo ou a diminuição do pH, é necessário utilizar o ponto isosbestic de 348 nm como múltiplas formas de o p-nitrofenol estará presente. - Calcular as velocidades iniciais de reacção através da determinação do declive da porção linear das curvas de progresso do passo 6.1.3 para comparar a quantidade relativa de TEP, em cada amostra, a eficiência de embalagem, e a produção total de TEP.
- Execute enzimática padrãoprotocolos de ensaio para determinar K M, V max e gato k para a OMV encapsulado PTE.
NOTA: A análise de Lineweaver-Burk pode ser utilizado para a determinação destes parâmetros cinéticos em que a intercepção de y = 1 / V max e de K = declive M / 20 V máx.
- Transmembrana Substrato / difusão do produto.
- Realizar a mesma análise cinética de ensaio tal como descrito no passo 6.1 utilizando concentrações crescentes de Triton X-100 em tampão CHES de 0-3% em volume.
NOTA: A adição de Triton X-100 para as funções de OMV solubilizados para interromper a bicamada lipídica para permitir que o conteúdo do OMV ser livremente acessível à solução de reacção. - Calcular e comparar as velocidades iniciais em cada nível de Triton X-100 para verificar a passagem transmembranar do substrato / produto indicado por alteração mínima da actividade da enzima (velocidades iniciais) em comparação com a actividade da enzima in a ausência de Triton X-100. Se um aumento substancial na actividade enzimática é observado na presença de Triton X-100, é provável que o substrato não difundem livremente para dentro do OMV.
- actividade da enzima livre de ensaio (como descrito acima na secção 6.1) na presença de Triton X-100 para verificar que a actividade da enzima não é inibida pelo próprio agente tensioactivo.
NOTA: Se a actividade é grandemente influenciado por Triton X-100, aditivos alternativos, tais como saponinas ou diferentes polissorbato / tween surfactantes podem ser mais adequados para romper a membrana de OMV.
- Realizar a mesma análise cinética de ensaio tal como descrito no passo 6.1 utilizando concentrações crescentes de Triton X-100 em tampão CHES de 0-3% em volume.
7. OMV Armazenamento
- Congelando
- alíquotas lugar ~ 100 l de OMV purificado diretamente em nitrogênio líquido para tirar congelar as alíquotas sendo cuidado para não submergir totalmente os frascos ou entre em contato com qualquer azoto líquido com a própria amostra.
NOTA: Purificada OMV podem ser congeladas rapidamente directamente no tampão que foi escolhida para solubilizar o sedimento durante a purificação de OMVprocesso de ion sem crioprotetores adicionais necessárias 7. - Conserve as alíquotas congeladas rapidamente a -80 ° C.
- Descongelar alíquotas congeladas a partir do passo 7.1.1, colocando-os à temperatura ambiente sendo cuidado para não aquecer as amostras.
- Antes da preparação de todas as amostras para o armazenamento desta maneira realizar o ensaio enzimático descrito no passo 6.1 comparando as velocidades iniciais antes e após congelação para verificar que não há perda significativa de actividade da enzima pós congelação-descongelação.
NOTA: loja purificado OMV a 4 ° C, se uma redução na actividade enzimática é observada devido à congelação.
- alíquotas lugar ~ 100 l de OMV purificado diretamente em nitrogênio líquido para tirar congelar as alíquotas sendo cuidado para não submergir totalmente os frascos ou entre em contato com qualquer azoto líquido com a própria amostra.
- Liofilização
- Liofilizar as aliquotas congeladas rapidamente OMV purificadas utilizando equipamento de liofilização comercialmente disponível 21.
- Loja liofilizada alíquotas à temperatura ambiente durante semanas ou a -80 ° C durante muitos meses.
- Adicionar o mesmo volume de água purificada para a OMV como liofilizado antes da liofilização e deixar em repouso à temperatura ambiente durante 30 minutos para re-hidratar tele provar. Misture delicadamente quando seja necessário cuidado para não vórtice ou sonicate da OMV.
- Adicionar liofilizado em pó OMV directamente para o ponto-de-cuidado para aplicações onde antes de diluição / solubilização não é necessário.
Resultados
A expressão simultânea de duas proteínas recombinantes, como é necessário para a estratégia de embalagem OMV detalhado neste protocolo, podem ser realizadas através de um número de diferentes caminhos. Aqui, um sistema de dois vectores foi utilizado com origens de replicação compatíveis e cassetes de genes indutíveis separadas. Para a expressão do PTE-SC construir uma estrutura do plasmídeo comercial (pACY184) foi manipulado para incluir uma cassete de gene indutível arabinose e um duplo arginina sequência líder localização periplásmica seguido por uma série de sítios de restrição únicos para facilitar a clonagem do gene da enzima como um fusão de uma proteína CS C-terminal. A construção de plasmídeo que codifica a proteína de âncora da membrana externa é o vector pET22 comercial, que utiliza o operão lac para o controlo da expressão da proteína e a sequência de localização periplásmica pelB. A sequência curta ST foi clonado a proteína OmpA truncada antes de insertion no plasmídeo de expressão. Em ambos os plasmídeos, a sequência de hexa-histidina do terminal C foi mantida para permitir a identificação simultânea das proteínas de fusão em amostras de OMV. Construção e caracterização destas construções de genes, incluindo ambas as construções de fusão de terminal N- e C- ST para OmpA, estão completamente descritos em Alves et al. 7. As construções de genes aqui descritos podem não ser favoráveis para a embalagem de todas as enzimas. Em alguns casos, pode ser necessário mudar o sinal de localização periplasmático, os elementos de regulação, ou os marcadores de epitopo. Além disso, algumas proteínas podem ser proibitivamente grande e incapaz de atravessar a membrana interna completamente. A actividade enzimática e OMV eficiência de embalagem não pode ser determinada a priori, e terão de ser determinadas empiricamente para cada proteína alvo.
A seguir estão os resultados que seria normalmente esperar após o levar a bomut este protocolo. Está incluído um esquema dos dois domínios da proteína / SC divisão ST, OmpA-ST e fusão PTE-SC constrói, bem como um exemplo de formação de isopéptido na membrana externa bacteriana e subsequente encapsulamento de TEP-SC dentro de uma OMV (Figura 1) . Também estão incluídos os resultados representativos da morfologia OMV purificada através de SEM, bem como distribuição de tamanho e concentração de OMV absoluta determinada através de um software de rastreamento de partículas (Figura 2). A caracterização adicional do teor de proteína OMV e a expressão de proteína recombinante são vistos através de SDS-PAGE e Western blot (Figura 3). pesos moleculares para proteínas de interesse específico para o protocolo fornecido aqui são os seguintes: OmpA nativa (37,2 kDa), OmpA-ST (23 kDa), PTE-SC (51 kDa), OmpA-ST / PTE-SC (74 kDa) . Purificada OMV deve ter uma banda escura em aproximadamente 37 kDa o que é indicativo da OmpA nativo altamente abundantes. Dependendo da resolução gel pode haver vários baNDS presente nesta região do gel como OmpA, OmpC OmpF e são todos relativamente abundante e partilhar um peso molecular semelhante. Uma banda adicional que é de 2,2 kDa maior do que OmpA-ST também pode ser observado, devido à clivagem incorrecta da sequência líder, como resultado de sobrecarregar o E. coli máquinas expressão. É importante notar que uma amostra OMV purificado com êxito não terá muitas outras proteínas altamente expressas. Se outras bandas estão presentes, quer a purificação foi levada a cabo de forma inadequada ou a estirpe de bactérias a ser utilizado pode ser embalagem outras proteínas não observadas nesta estirpe de E. coli BL21 (DE3).
Além disso, os ensaios de actividade e experiências de ruptura de vesícula foram fornecidos para demonstrar resultados representativos que seria de esperar se o substrato enzimático podem entrar livremente no OMV através de proteínas transmembranares porina (Figura 4). Paraoxon relativamente entra livremente oOMV através de proteínas porina transmembranar endógenas reajam com o TEP embalados e o produto da reacção, p-nitrofenol, também relativamente passa livremente através da membrana OMV. Este fenómeno não será onipresente entre todos os produtos, substrato e conjuntos de enzimas e deve ser determinado experimentalmente. Apesar de bem sucedido OMV ruptura e a libertação de enzimas tem sido visto com baixas concentrações de detergente e de contos (aqui de Triton X-100), tais adições podem afectar a actividade de outras enzimas.
Mapas de plasmídeos também foram incluídos para demonstrar a concepção de uma estratégia de embalagem duas plasmídeo utilizando o sistema SC / ST (Figura 5).
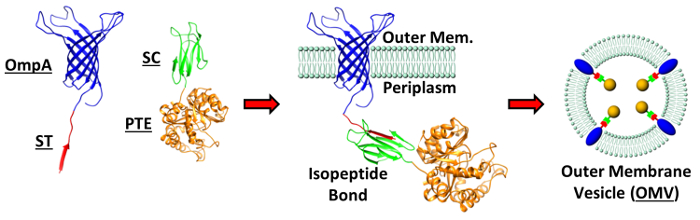
Figura 1: embalagens Dirigido de proteínas em OMV. As estruturas cristalinas para as proteínas utilizadas na embalagem Strat OMV descritoegy: OmpA, PTE, SpyTag (ST) e SpyCatcher (SC); PDB: 2GE4, 1PTA, 4MLI, 4MLI, respectivamente. Uma representação esquemática das construções de fusão OmpA-ST e TEP-SC formar uma ligação isopéptido na membrana externa das bactérias é mostrado. Esta fusão de membrana impulsiona incorporação do PTE dentro da OMV formando. Figura reproduzida (adaptada) de Alves et al. ACS Appl Mat Interfaces (2015), 7 (44), pp 24,963-24,972 7. Copyright 2015 da Sociedade Americana de Química. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2: Caracterização da OMV. (A) SEM de ultracentrífuga OMV purificado a partir de E. coli nativas [BL21 (DE3)]. (B) trac partícula Representante rei distribuições de tamanho e (C) a concentração total da vesícula em média mais de 90 seg exemplo lê para Native OMV, PTE-SC na ausência de activação arabinose (PTE-No A), PTE-SC na presença de activação arabinose (PTE-A) , N-terminal de OmpA-ST co-transformada com TEP-SC na presença de arabinose e activação de IPTG (PTE / OMV-N), e o sobrenadante ultracentrífuga (UC sobrenadante). Um aumento significativo da produção de OMV foi observada na amostra de TEP / OMV-N comparado com o nativo OMV e TEP-SC constrói sozinho. OMV foram quantificados no sobrenadante UC para demonstrar uma recuperação quase completa da OMV no sedimento UC deixando pouco ou nenhum OMV no sobrenadante pós ultracentrifugação. Todos os dados representam os meios (± DP) de experiências em triplicado. Figura reproduzida (adaptada) de Alves et al. ACS Appl Mat Interfaces (2015), 7 (44), pp 24,963-24,972 7. Copyright 2015 da Sociedade Americana de Química.d 54.458 / 54458fig2large.jpg "target =" / _ blank "> Clique aqui para ver uma versão maior desta figura.

Figura 3: Purificada OMV determinação do teor de proteína. (A) SDS-PAGE do purificada pellet OMV UC da fusão OmpA-ST C-terminal co-expressos com PTE-SC (PTE / OMV) construir demonstrando abundância representante da OmpA-ST, Native OmpA, PTE-SC eo OmpA- ST / PTE-SC fusão isopeptídica. (B) análise por Western blot utilizando o incluídos His-marcador presente na OmpA e TEP construções para facilitar a visualização por meio de um anticorpo anti-6xHis. É importante notar que o TEP é conhecido para dimerizar, como evidenciado na mancha pela presença de maior peso molecular marcada com His espécies. Apesar de existirem níveis de expressão muito elevados OmpA-ST observado que não é uma conversão completa de livrePTE-SC ligado à membrana para OmpA-ST / PTE-SC. Apesar disso, o aumento da produção PTE global ea melhoria da eficiência embalagens sugerem que, embora a formação da ligação covalente não é onipresente a associação não-covalente do ST e domínios SC é um fator importante na embalagem dirigido dentro da OMV. Figura reproduzida (adaptada) de Alves et al. ACS Appl Mat Interfaces (2015), 7 (44), pp 24,963-24,972 7. Copyright 2015 da Sociedade Americana de Química. Por favor clique aqui para ver uma versão maior desta figura.
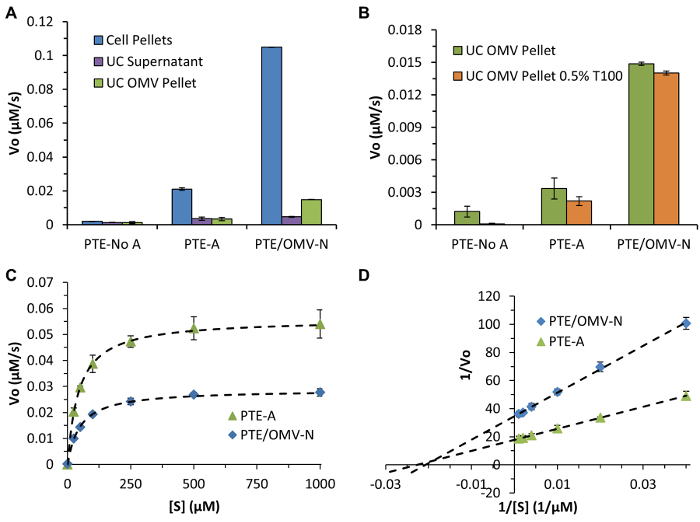
Figura 4: Atividade PTE e caracterização de embalagem. Os níveis de expressão (A) Em geral PTE e OMV eficiência embalagens, determinado através de medições de velocidade iniciais utilizando ParáOxon como um substrato cromogénico comparando TEP presente nas peletes celulares, o sobrenadante UC, e as pelotas purificados UC OMV. (B) Os dados representativos que demonstram o uso de Triton X-100 (0,5% T100) para romper a bicamada OMV permitindo o livre acesso do substrato para o interior da OMV. Comparando estes dados com os ensaios realizados na ausência de T100 facilita a verificação de translocação de substrato entre bicamadas OMV intactas se as velocidades iniciais enzimáticas são inalteradas. No caso de paraoxon houve muito pouca diferença actividade observada na presença ou ausência de T100 paraoxon indicando que passa livremente através dos poros na endógenos OMV. (C) PTE-SC ajuste dos dados cinéticos com a equação cinética enzimática Michaelis-Menten padrão para PTE / OMV-N e PTE-A. (D) A análise de Lineweaver-Burk utilizado para determinar K M e gato k / K M (48, 4,4 x 10 7; 44 mm, 4,9 x10 7 s -1 M -1, respectivamente), demonstrando parâmetros cinéticos literatura TEP similares como enzima nativa (90 | iM, 2,7 x 10 7 M -1 seg -1) com R2 ≥ 0,999 em todos os casos. Todos os dados representam os meios (± DP) de experiências em triplicado. Figura reproduzida (adaptada) de Alves et al. ACS Appl Mat Interfaces (2015), 7 (44), pp 24,963-24,972 7. Copyright 2015 da Sociedade Americana de Química. Por favor clique aqui para ver uma versão maior desta figura.

Figura 5: construções de plasmídeos representativos para o sistema de exemplo descrito aqui. SpyCatcher enzima-SC modificado (PTE-SC) plasmídeo alvo para encapsulação dentro da OMV (esquerda). SpyTag modifIED membrana âncora-ST (OmpA-ST-N) plasmídeo (direita). Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo funções para demonstrar um representante dirigido técnica de embalagem em que uma enzima de interesse é produzido e embalado em OMV por E. coli. Tal como com muitas técnicas complexas, existem várias áreas em que o protocolo pode ser modificado para acomodar para uso em diferentes aplicações únicas, algumas das quais são descritas abaixo. Enquanto o mecanismo de OMV embalagem e encapsulamento enzima pode ser adaptado às necessidades específicas existem várias etapas dentro deste protocolo que são críticos para o seu sucesso. A remoção inicial da bactéria intacto e restos celulares é de importância significativa e afetará todas as tentativas derivados a quantificação ou análise de amostras. Dois sucessivos passos de centrifugação seguido por filtração é normalmente adequada para remover estes contaminantes. No entanto, em todos os casos, deve ser tomado cuidado quando as soluções de decantação após centrifugação para minimizar a transferência de contaminantes. Da mesma forma, a final OMV pellet obtained seguinte ultracentrifugação é muitas vezes apenas fracamente aderente à parte inferior do tubo de centrifugação. Nas fases finais, deve ser tomado cuidado ao remover o meio de cultura gasto para assegurar que a pastilha permanece intacta na parte inferior do navio. Em alguma instância, pode ser melhor para reter o meio de cultura definitivo após a análise da amostra utilizando DLS ou rastreamento de nanopartículas dispositivo para garantir a pelota OMV não foi perdido nas etapas finais do protocolo. Abaixo estão algumas preocupações adicionais que possam surgir tanto com este protocolo especial e outros que são adaptados às necessidades específicas dos pesquisadores.
O uso de TEP em este sistema prevê um excelente encapsulamento enzima modelo para a recuperação ambiental das regiões organofosforados contaminado com PTE sendo facilmente substituível por uma enzima ou proteína de interesse alternativo. Conforme descrito aqui, a co-expressão de PTE-SC com OmpA-ST resultou em um grande aumento na expressi geral PTEno, bem como os níveis mais elevados de produção de vesículas com mais TEP a ser embalado dentro das vesículas em relação ao TEP e TEP-SC expressa sozinha. Ao reduzir o número de interacções entre a membrana exterior e o peptidoglicano através da deleção C-terminal de OmpA hiper-vesiculação é atingido. Isto proporciona um percurso fácil para as bactérias para exportar o TEP recombinante que mitiga os efeitos tóxicos que são frequentemente observados na sobre-expressão de proteínas não nativas.
Enquanto PTE pode ser facilmente substituído neste sistema modelo é importante notar que nem todos os substratos enzimáticos vai passar livremente através da bicamada OMV e por isso é imperativo que cada enzima única e par substrato ser testados em uma base caso a caso. Mesmo se um substrato não passa através da membrana esta técnica ainda pode ser utilizado para produzir e empacotar uma enzima em OMV e a adição de Triton X-100, ou tensioactivo alternativo adequado, pode ser adicionado no le suficienteVels para romper as vesículas antes da utilização.
Na ausência de expressão de proteína recombinante e de embalagem deste protocolo pode também servir como um método básico para a produção de OMV e purificação a partir de diversas espécies bacterianas. Métodos alternativos de purificação de OMV, tais como fraccionamento em gradiente de densidade 22, filtração por membrana 23, e ultra-filtração 24, também existe e pode ser mais técnicas adequadas, dependendo da aplicação pretendida. Estas técnicas de purificação alternativos também podem ser prontamente completadas em este protocolo em lugar da peletização ultracentrifugação do OMV para o acondicionamento de uma proteína dirigida a uma OMV através da utilização de uma ligação sintética bi-ortogonal.
Outras modificações podem ser feitas ao sistema de ligação sintética específica utilizada neste protocolo, bem como a proteína de membrana seleccionado amarrar. Existem várias estratégias sintéticas para emparelhamento de duas proteínas diferentess dentro de um sistema biológico que incluem: proteínas de divisão 25, super-hélices 26, e dividida inteins 27, apenas para listar alguns. Outras proteínas ligadas à membrana ou transmembranares, tais como OmpF e OmpC provavelmente prever locais adequados de modificação ST bem 28. Em alguns casos, também pode ser necessário trocar o ST e domínios SC colocando o SC na proteína de ancoragem e o muito menor ST no recombinante enzima / proteína. Há também um certo número de diferentes estratégias de clonagem que podem ser implementadas aqui, incluindo a utilização de vários plasmideos de acordo com as mesmas ou diferentes sistemas de indução, um único plasmídeo com várias proteínas codificadas, ou mesmo utilizando técnicas de recombinação homólogas de incorporar todas ou partes da expressão sistema no genoma bacteriano.
O microambiente da OMV ajuda a estabilizar a enzima embalados reduzindo inactivação enzimática que geralmente ocorre em menos do que o ST idealcondições orage, congelamento e descongelamento e liofilização 29. Prevê-se também que a OMV proporcionará muito melhor resistência à clivagem proteolítica como a bicamada OMV irá funcionar como uma barreira física entre a enzima activa e as proteínas presentes no espaço extra-OMV. Este protocolo pode ser expandida para incluir uma molécula, um péptido ou uma proteína pequena marcação virado para o exterior para facilitar a entrega direccionada de proteínas encapsuladas OMV e purificação por afinidade. Enquanto PTE foi selecionada para este aplicativo exclusivo os resultados deste estudo e conteúdo deste protocolo, facilmente pode ser utilizado para desenhar estratégias de embalagem proteínas análogas para uso na entrega farmacêutica diversificada, médicos de diagnóstico e remediação ambiental aplicações 30.
Divulgações
Os autores não têm nada para revelar.
Agradecimentos
This research was funded by the Office of Naval Research through Core funds provided to the Naval Research Laboratory.
Materiais
| Name | Company | Catalog Number | Comments |
| IPTG | Any | Always prepare fresh or aliquot and freeze. | |
| L-arabinose | Any | Can be prepared ahead of time and stored at 4 °C. | |
| Ampicillin | Any | Add immediately prior to use after media cools sufficiently from being autoclaved. | |
| Chloramphenicol | Any | Add immediately prior to use after media cools sufficiently from being autoclaved. | |
| TB/LB Culture Media | Any | Other growth medias will likely work similarly. | |
| Triton X-100 | Any | One of many potential suitable surfactants. | |
| Baffled culture flasks | Any | The baffles promote higher levels of aeration. | |
| CHES | Fisher Bioreagents | BP318-100 | Optimal buffer used for paraoxon degredation (pH > 8). |
| Paraoxon | Chem Service | N-12816 | Very toxic substance to be handled carefully and disposed of properly. |
| Syringe Filter 0.45 µm | Thermo Scientific | 60183-221 (30 mm) | Filter diameter will depend on volume of sample. Low protein binding membrane is critical. |
| Shaker incubator | New Brunswick | Excella E24 | Precise temperature and mixing is essential for reproducable bacterial growth. |
| Sorvall Culture Centrifuge | Thermo Scientific | RC 5B PLUS | Large volume (500 ml) culture centrifuge capable of 7,000 x g. |
| Sorvall Ultracentrifuge | Thermo Scientific | WX Ultra 90 | Capable of centrifugal forces ≥150,000 x g. |
| Ultracentrifuge Rotor | Thermo Scientific | AH-629 | Ensure the proper rotor and tubes are used and that everything is properly balanced. |
| Ultra-Clear Ultracentrifuge Tubes (25 x 89 mm) | Beckman Coulter | 344058 | Ensure no stress fractures are present prior to use and that tubes are presicely balanced. |
| Spectrophotometer | Tecan | Infinite M1000 | Necessary for enzyme kinetic assays. |
| DLS/particle tracking | NanoSight | LM10 | Necessary for OMV size distribution and concentration determination. |
| BL21(DE3) | NEB | Suitable bacterial expression strain. | |
| pET22 | EMD Millipore | 69744-3 | Other plasmids can be used in place of these. |
| pACYC184 | NEB | Other plasmids can be used in place of these. | |
| Gel Extraction Kit | Qiagen | 28704 | Example kit. |
Referências
- Avila-Calderon, E. D., et al. Roles of bacterial membrane vesicles. Arch. Microbiol. 197, 1-10 (2015).
- Kulp, A., Kuehn, M. J. Biological functions and biogenesis of secreted bacterial outer membrane vesicles. Annu. Rev. Microbiol. 64, 163-184 (2010).
- Beveridge, T. Structures of Gram negative cell walls and their derived membrane vesicles. J. Bacteriol. 181, 4725-4733 (1999).
- Kulkarni, H. M., Jagannadham, M. V. Biogenesis and multifaceted roles of outer membrane vesicles from Gram-negative bacteria. Microbiology. 160, 2109-2121 (2014).
- Ellis, T. N., Kuehn, M. J. Virulence and immunomodulatory roles of bacterial outer membrane vesicles. Microbiol. Mol. Biol. Rev. 74, 81-94 (2010).
- Berleman, J., Auer, M. The role of bacterial outer membrane vesicles for intra- and interspecies delivery. Environ. Microbiol. 15, 347-354 (2013).
- Alves, N. J., et al. Bacterial nanobioreactors-directing enzyme packaging into bacterial outer membrane vesicles. ACS Appl. Mater. Interfaces. 7, 24963-24972 (2015).
- Kim, J. Y., et al. Engineered bacterial outer membrane vesicles with enhanced functionality. J. Mol. Biol. 380, 51-66 (2008).
- Haurat, M. F., et al. Selective sorting of cargo proteins into bacterial membrane vesicles. J. Biol. Chem. 286, 1269-1276 (2011).
- Kesty, N. C., Kuehn, M. J. Incorporation of heterologous outer membrane and periplasmic proteins into Escherichia coli outer membrane vesicles. J. Biol. Chem. 279, 2069-2076 (2003).
- Zakeri, B., et al. Peptide tag forming a rapid covalent bond to a protein, through engineering a bacterial adhesion. Proc. Natl. Acad. Sci. U. S. A. 109, e690-e697 (2012).
- Li, L., Fierer, J. O., Rapoport, T. A., Howarth, M. Structural analysis and optimization of the covalent association between SpyCatcher and a peptide tag. J. Mol. Biol. 426, 309-317 (2014).
- Dumas, D. P., Durst, H. D., Landis, W. G., Raushel, F. M., Wild, J. R. Inactivation of organophosphorus nerve agents by the phophotriesterase from Pseudomonas-Diminuta. Arch. Biochem. Biophys. 277, 155-159 (1990).
- Bigley, A. N., Raushel, F. M. Catalytic mechanisms for phosphotriesterases. Biochimica et Biochim. Biophys. Acta, Proteins Proteomics. 1834, 443-453 (2013).
- Minton, N. A., Murray, V. S. G. A review of organo-phosphate poisoning. Med. Toxicol. Adverse Drug Exper. 3, 350-375 (1988).
- Bigley, A. N., Xu, C., Henderson, T. J., Harvey, S. P., Raushel, F. M. Enzymatic neutralization of the chemical warfare agent VX: Evolution of phosphotriesterase for phosphorothiolate hydrolysis. J. Am. Chem. Soc. 135, 10426-10432 (2013).
- Chatterjee, S. N., Chaudhuri, K. Gram-negative bacteria: the cell membranes. Outer Membrane Vesicles of Bacteria. SpringerBriefs in Microbiology. , 15-34 (2012).
- Wang, Y. The function of OmpA in Escherichia coli. Biochem. Biophys. Res. Commun. 292, 396-401 (2002).
- Danoff, E. J., Fleming, K. G. The soluble, periplasmic domain of OmpA folds as an independent unit and displays chaperone activity by reducing the self-association propensity of the unfolded OmpA transmembrane beta-barrel. Biophys. Chem. 159, 194-204 (2011).
- Alves, N. J., Kline, J. A. Comparative study on the inhibition of plasmin and delta-plasmin via benzamidine derivatives. Biochem. Biophys. Res. Commun. 457, 358-362 (2015).
- Wang, W. Lyophilization and development of solid protein pharmaceuticals. Int. J. Pharm. 203, 1-60 (2000).
- Goormaghtigh, E., Scarborough, G. A. Density-based separation of liposomes by glycerol gradient centrifugation. Anal. Biochem. 159, 122-131 (1986).
- Alves, N. J., et al. Functionalized liposome purification via Liposome Extruder Purification (LEP). Analyst. 138, 4746-4751 (2013).
- Mayer, L. D., StOnge, G. Determination of free and liposome-associated doxorubicin and vincristine levels in plasma under equilibrium conditions employing ultrafiltration techniques. Anal. Biochem. 232, 149-157 (1995).
- Blakeley, B. D., Chapman, A. M., McNaughton, B. R. Split-superpositive GFP reassembly is a fast, efficient, and robust method for detecting protein-protein interactions in vivo. Mol. BioSyst. 8 (2036), (2012).
- De Crescenzo, G., Litowski, J. R., Hodges, R. S., O'Connor-McCourt, M. D. Real-time monitoring of the interacation of two-stranded de novo designed coiled-coils: effect of chain length on the kinetic and thermodynamic constants of binding. Biochemistry. 42, 1754-1763 (2003).
- Charalambous, A., Antoniades, I., Christodoulou, N., Skourides, P. A. Split-Intein for simultaneous site-specific conjugation of quantum dots to multiple protein targets in vivo. J. Nanobiotechnol. 9, 1-14 (2011).
- Lee, E. Y., et al. Global proteomic profiling of native outer membrane vesicles derived fromEscherichia coli. Proteomics. 7, 3143-3153 (2007).
- Alves, N. J., Turner, K. B., Medintz, I. L., Walper, S. A. Protecting enzymatic function through directed packaging into bacterial outer membrane vesicles. Sci. Rep. 6, 24866 (2016).
- Alves, N. J., Turner, K. B., Medintz, I. L., Walper, S. A. Emerging therapeutic delivery capabilities and challenges utilizing enzyme/protein packaged bacterial vesicles. Ther. Delivery. 6, 873-887 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados