Method Article
からの外膜小胞内の指向性タンパク質包装
要約
A protocol for the production, purification, and use of enzyme packaged outer membrane vesicles (OMV) providing for enhanced enzyme stability for implementation across diverse applications is presented.
要約
外膜小胞(OMV)をプログラムするために、合成生物学の技術を適用する際の関心の高まりは、従来のナノ粒子が合成することが非常に困難証明しているOMVのためのいくつかの非常に興味深く、ユニークなアプリケーションにつながっています。現在までに、すべてのグラム陰性菌には、小分子、ペプチド、タンパク質および遺伝物質を含む貨物の種々のOMV実証パッケージを生成することが示されています。それらの多様な貨物に基づいて、OMVは、細胞間コミュニケーションの遺伝子導入及び細菌がOMVを生成しているに応じて病原性因子の送達に至るまで多くの生物学的プロセスに関与しています。ごく最近になって、細菌のOMVは制御し、OMVへの組換えタンパク質の直接包装するための技術の開発を通じてアプリケーションの広い範囲にわたって使用するためにアクセス可能となっています。このプロトコルは、生産、精製する方法を記載し、そして酵素の使用を向上Overaのために提供するOMVをパッケージ化組換え酵素、小胞形成の増加、及び強化酵素安定性のLL製造。このプロトコルの成功利用は同時に、組換えタンパク質を産生する組換えタンパク質および外膜アンカータンパク質との間に合成リンケージを作成を通じてOMVのカプセル化のためにそれを指示する細菌株の作成になります。医薬品送達、医療診断、および環境修復:このプロトコルはまた、などの他のユニークなアプリケーションのための使用のためにこのプロトコルを適応する際に考慮すべき細菌培養と同様に適切な取り扱い技術や物事からOMVを単離するための方法を詳しく説明します。
概要
ここで紹介するには、設計、生産、および酵素ロード細菌の外膜小胞(OMV)の精製方法です。 OMVは、30から200 nmの1,2からサイズの範囲でプロテオ主に単層、小さいです。現在までに研究されているすべてのグラム陰性及びグラム陽性菌は、その表面3,4からOMVまたは細胞外小胞(EV)のいずれかの放出を示しました。 OMVが生成されることにより、正確なメカニズムは完全に起因する彼らだけでなく、彼らが仕える様々な機能を分泌し、多様な細菌集団に解明されていません。 OMVは、複雑なシグナル伝達、遺伝子転座の様々なサービスを提供する遺伝物質を小分子、ペプチド、及びタンパク質から貨物の広い範囲を輸送することが示されており、毒性は5,6機能します。
OMVの生合成の正確なメカニズムは十分に特徴付けられ、そして細菌種間で異なるように思われていません。 THIにもかかわらず、事実は、我々は、目的のタンパク質と細菌の外膜に非常に豊富なタンパク質の内因性およびその後のOMVの間の合成結合を作成することによりOMVへの組換えタンパク質のパッケージング効率を高めるための方法を開発しました。合成結合、または人工的に組み込まれた親和性の非存在下で、組換えにより発現されたタンパク質およびOMVの間に観測されたパッケージング効率は7非常に低いです。この結果は、どちらかがよく理解されていないメカニズムによって細菌表面にまたは指向包装を通してOMV形成の正確な瞬間に偶然カプセル化を介して起こるOMV内のタンパク質の取り込みとして期待されます。第他人と比較して高い効率でパッケージング、いくつかのタンパク質との依存性タンパク質は非常にいくつかの成功は偶然のカプセル化が、効果的なパッケージに依存してペリプラズム空間内で過剰発現は、単にを通じてパッケージングタンパク質で観察されているですまったく8-10でパッケージ化しないでください。我々は同時に、パッケージを生成し、OMVが形成されている方法と貨物がために細菌によって選択される方法に関する現在の知識の限界を回避するOMVに関心の活性酵素を分泌する大腸菌 (E. coli)を操作するために求められる一般的な合成生物学の技術を利用することによって包装。
本出願の目的のためにスプリットタンパク質バイオコンジュゲーションシステムは、OMVに指向性パッケージングを容易にするために選択した合成結合として選択しました。名前が示すように、分割のタンパク質バイオコンジュゲーションシステムは、互いに相互作用する二つの相補的なサブドメインで構成されています。このプロトコルの目的のために選択された分割されたタンパク質ドメインはSpyCatcher(SC)とSpyTag(ST)ドメインと呼ばれ、 化膿連鎖球菌のフィブロネクチン結合タンパク質(FbaB)11から誘導されます。この分割されたタンパク質系は、ワットに珍しいです鶏は、2つのサブユニットが近接範囲内であるイソペプチド結合は、自然に共有結合を作成酸およびリジンのアミノ酸残基アスパラギン近位の間に形成されます。イソペプチド結合の形成は、シャペロンタンパク質、触媒酵素、または補因子の添加を必要とせず、容易に室温(RT)で、かつ生理学的に関連する条件12の広い範囲にわたって起こり得ます。
コンセプトの証明としては、Brevundimonasのディミニュータからホスホトリエステラーゼ(PTE)(EC 3.1.8.1)は、OMV 13由来の大腸菌にパッケージ化されるように選択されました。 PTEは、二核のZn / Znの活性部位を含み、ジアルキルホスフェートおよびアリールアルコール14にaryldialkylphosphatesを変換する加水分解反応を通じて有機リン酸塩を打破する能力を有しています。有機リンへの曝露は、神経筋接合部のmakinでアセチルコリンエステラーゼによってアセチルコリンの加水分解を阻害することにより、適切な神経伝達物質の機能を損ないます15非常に危険グラムの有機リン由来の化合物。有機リン酸エステルへの長期的または重大なエクスポージャーは、一般的に制御不能な痙攣をもたらし、一般的に窒息を介して死を引き起こします。 PTEは、パラオキソンに向かって最も高い触媒活性を示すが、非常に強力な殺虫剤は、また、他の殺虫剤とV / G型化学神経剤16の広い範囲を加水分解することが可能です。 OMVのパッケージングを容易にするために、細菌プラスミド、誘導性プロモーターを含む遺伝子構築物、ペリプラズム局在化配列、およびSC遺伝子配列の上流の短い多重クローニング部位をコードするように設計しました。 OMV包装用ペリプラズム空間にPTE-SC融合タンパク質を標的に遺伝スイッチの作成を許可されたリーダーとSC配列との間のPTE遺伝子の挿入。ここで説明する努力がPTEに焦点を当てながら、酵素遺伝子が交換可能であると容易にFACに別の遺伝子配列で置換することができ代替酵素またはタンパク質のilitate包装。
合成結合の第二の部分として、豊富な外膜タンパク質(のOmpA)は、STペプチド配列を提示するように選択されます。アンカータンパク質の選択を変えることができるが、タンパク質がペリプラズム空間に提示許容ドメインを有し、細胞毒性を誘発することなく融合構築を許容することが不可欠である、OMV中に存在することが知られており、それは、組換えとき凝集していません生産。 OmpAは非常に細菌の外膜およびその後のOMV 17内で発現することが知られている37.2 kDaの膜貫通ポリンタンパク質です。これは、大きさが2nmで細菌膜18を横切って、<、小分子の輸送に関与しています。ネイティブのOmpAは、2つの構造のユニークなドメイン、膜貫通βバレルモチーフとペプチドグリカン19と相互作用することが知られペリプラズム可溶性C末端部分を有しています。変異型のOmpA-ST融合デザイン性でDここでのOmpAのC末端部分は削除されたとSTは、ペリプラズムに面しN末端またはC末端に融合させました。 OmpAのペリプラズム部分を削除すると、外膜と超小胞7につながる膜不安定化をもたらしペプチドグリカンとの間の相互作用の数を減少させます。ゲノムのOmpAは、総膜不安定化を緩和するために、組換え的に発現のOmpA-ST構築に加えて維持しました。
プロトコル
プラスミドの調製
- 双直交リンケージドメインに融合アンカータンパク質(のOmpA)(アンカー-STとしてこのプロトコルで呼ばれる)、(そのような精製および同定のための6xHis、MYCまたはFLAGタグなど)エピトープタグを含むプラスミド( 例えば、pET22)を準備し、選択された細菌株7に基づいて複製のペリプラズム局在タグ、抗生物質耐性、および適切な起源。
- 製造業者のプロトコルに従って市販のDNA単離キットを使用して、一晩の培養物からプラスミドDNAを抽出します。
- プラスミド( 例えば、pACYC184に)(酵素SCとして、このプロトコルに記載)(PTE)がアンカータンパク質のそれに相補的なバイオ直交結合ドメインに融合したOMV内にパッケージされる酵素/タンパク質を含有する調製、エピトープタグ、ペリプラズム局在タグ、アンカータンパク質のプラスミドとは異なる抗生物質耐性、および適切なORIGレプリケーションの中で選択された細菌株7に基づきます。
- 製造業者のプロトコル7次市販のDNA単離キットを使用して、一晩の培養物からプラスミドDNAを抽出します。
OMV包装大腸菌培養の2世代
- プラスミド分離
- 酵素SC構築物をコードするプラスミドを精製し、アンカー-STは、製造業者のプロトコール7に従って商用プラスミド単離キットを使用して、別個のメンテナンス細胞株から構築します。 260 nmおよび280 nmの吸光度を測定することにより、DNA濃度及び純度を決定します。
- 同時形質転換
- タンパク質の発現を促進するために市販されている大腸菌株を選択します。
注:BL21(DE3)細胞を、ここに使用しました。 T7溶原菌はPROTためのT7プロモーターおよびT7 RNAポリメラーゼに依存しているアンカー-STの構築物の発現のために必要とされますEIN表現。他の細菌株の使用は、T7溶原菌遺伝子の存在またはpET22 7以外のプラスミドの使用のいずれかが必要です。 - その後、選択したコンピテント細胞のための製造者のプロトコルに従って、熱ショック形質転換またはエレクトロポレーションのいずれかを経由してコンピ細菌細胞にそれらを変換する同等のモル濃度に精製されたプラスミドDNAを希釈します。
- アンピシリン(pET22)及びクロラムフェニコール(のpACYC184)の両方で寒天プレート抗生物質を含むルリア - ベルターニ(LB)上でプレートを形質転換細胞。両方を25μg/ mlの最終濃度で存在します。
- 両方のプラスミドを含む唯一のクローンを単離するために、37℃で一晩培養皿を置きます。
注:抗生物質選択を生き残るコロニーは将来のすべてのOMV調製物に使用されます。抗生物質(アンピシリン及びクロラムフェニコール)は、選択圧を維持し、両方のプラスミドの存在を確実にするために、すべての液体培養物に添加されます。
- タンパク質の発現を促進するために市販されている大腸菌株を選択します。
3. OMV生産
- コロニー拡張
- 2.2.4で説明した選択プレートから単一コロニーを上記の濃度で抗生物質を含む培養培地(通常、テリフィックブロス(TB)またはLB)(ステップ2.2.3)の5ミリリットルを接種します。
- バッフル付き培養フラスコに一晩スターター培養物の100倍希釈:1を実行します。
注:250〜500ミリリットルの間でメディアのボリュームを使用してください。 - 文化の十分な通気が達成されることを保証するために、250 rpmで振盪しながら37℃で培養物を維持します。
- 各プラスミドの誘導
- 細菌培養物は、一次成長フラスコの接種後OD 0.6〜0.8の600、成長の約3時間に成長することを可能にします。
- PTE-SCロードされた小胞の最終収量を向上させるために、15分間、7000×gで培養物全体を遠心分離します。予熱した、新鮮な培地中に細胞ペレットを再懸濁します。
注:このオプトionalステップは、PTE-SC誘導する前に培養培地中に存在する任意の空のOMVを除去するのに役立ちます。 - 0.22μmのフィルターを用いて水と滅菌フィルターでのL-アラビノースの20%ストック溶液を作ります。 2-4週間4℃で保存L-アラビノースソリューション。
- PTE-SCの産生を開始するために最後の0.2%濃度になるように培養フラスコにL-アラビノース溶液を加えます。
注:これは、従来の変異体のOmpA-STの誘導を介して増加した小胞形成を促進することにPTE-SCとのペリプラズム空間をプリロードするのに役立ちます。 - 0.22μmのフィルターを用いて、1 Mイソプロピルβ-D-1-チオガラクトピラノシド(IPTG)水溶液および滅菌フィルターを作成します。
注:IPTGは、水和直後に一度使用されなければなりません。 IPTGのアリコートを3~6ヶ月間凍結保存することができ、使用直前に解凍することができます。 - OmpA-STの産生を開始するために、0.5mMの最終濃度まで追加の3時間のインキュベーション期間後にIPTGを加えます。
- CULを許可します振盪しながら37℃でさらに8-14時間、成長するチャー。
4. OMV精製
- 無傷細菌の除去
- 無傷の細菌をペレット化し、4℃で7000×gで15分間、細菌培養培地を遠心します。
- デカントし、細胞ペレットポスト遠心分離は、細胞ペレットを乱さないように注意してくださいの上から、メディアを保存します。
- 繰り返して、すべての無傷の細菌を培養培地は、メディアをデカントし、保存してくださいされてから削除されていることを確認するために、1つの追加の遠心分離サイクルのために4.1.1と4.1.2を繰り返します。
- タンパク質凝集体の除去
- さらに、残留細菌および望ましくない大きな細胞物質を除去するために0.45μmのメンブレンフィルターを用いて細菌培養液を精製します。
注:高い回収のために生物学的に適合性の膜材料を使用し、例えば、セルロースアセテート(CA)またはポリフッ化ビニリデン(のような低タンパク質吸着PVDF)。および100mLより大きい真空フィルター体積未満シリンジフィルターボリューム。- シリンジフィルターに、滅菌した10〜50ミリリットル注射器に培地を描きます。注射器のルアー端に0.45μmのフィルターを取り付けます。プランジャーを押し下げて、新しい容器にフロースルーを収集します。
- 真空フィルターに、滅菌ろ過装置に培地を転送します。吸引力を生成するために、真空ポンプまたはシンクアスピレーターにユニットを取り付けます。転送は、新しい容器に培地を濾過しました。
- さらに、残留細菌および望ましくない大きな細胞物質を除去するために0.45μmのメンブレンフィルターを用いて細菌培養液を精製します。
- 超遠心分離を介したOMVの単離
- 遠心機で、対向する管のバランスをとるように注意しながら遠心分離チューブに濾過した培養培地を追加します。
- 楽器とチューブの両方に一致する対応するローターを使用して、超遠心分離機で4℃で3時間〜15万×gでペレットが利用されています。
- すぐに完了Oにおける、OMVペレットを乱さないように注意しながら、OMVペレットからOMV枯渇培地をデカントOMVペレットがメディアに残るすることを可能にするようFの遠心分離は、OMV回復を減らすペレットを柔らかくします。
注:このペレットはわずかに茶色になり、細菌培養の開始量に応じて、または目で見ることができない場合があります。遠心管の上部から直接メディアを吸引することもOMVから削除複数のメディアが最終OMVのサンプルがされるより純粋をペレット化することを念頭においてオプションです。 - OMV粒子は完全にメディアから枯渇されたことを確認するために、後で動的光散乱(DLS)テストのための遠心上清を保存します。
- それはRTで30分間インキュベートすることを可能にするOMVペレットにpH8.0のバッファー濾過滅菌リン酸緩衝生理食塩水(PBS)pHが7.4または100 mMのN -シクロヘキシル-2-アミノエタンスルホン酸(CHES)0.5〜1 mlを加え。ペレットが乾燥しないことを確認してください。
注:ソリューションのイオン強度、pH、および温度の極端な減少OMVの溶解性をもたらし、aggre促進することができますゲーション。 - 慎重に可溶化されたペレット全体を確実にするために、静かに混合、遠心管から精製されたOMVソリューションをピペット。
5. OMVキャラクタリゼーション
- OMVのサイズ分布と粒子濃度を決定するために、各機器に固有の提供製造者のプロトコルに従って、任意の市販のDLSまたはナノ粒子追跡ソフトウェアを使用してください。
注:ここでは、OMVサイズ分布と濃度がNanoSight LM10ナノ粒子トラッキングおよびNTA 2.3解析ソフトウェアを利用して決定しました。- ソフトウェアを開きます。
- 顕微鏡の電源をオンにして、顕微鏡とナノ粒子追跡ユニット上のすべての表面を洗浄。
- 〜任意の空気を注入することなく、全体表示ウィンドウをカバーすることを確認されて1ミリリットルの無菌注射器を用いてフィッティングルアーを通して粒子追跡装置の表示画面に直接OMVサンプルの0.5ミリリットルをシステムに泡を追加します。
- プレイストン彼は顕微鏡ステージ上のユニットを追跡し、レーザーをオンナノ粒子。
- ソフトウェアで「キャプチャ」をクリックしてください。
- ソフトウェアのウィンドウでプレビュー画面の存在上の粒子を可視化するために、顕微鏡の焦点とステージを調整します。
- 明るい粒子が明らかに暗い背景上で可視化されるまで、「カメラシャッター」と「カメラゲイン」を調整してください。
- 60秒にキャプチャ持続時間を調整します。
- 「レコード」をクリックしてください。
- プロンプトが表示されたら、入力サンプル/デバイスの温度は、サンプルを標識し、フォルダを指定されたユーザに実行する各の完了時に映像データを保存します。
- モードを検出し、クリックして自動ですべての解析パラメータ(検出しきい値、ぼかし、最小トラック長、最小期待される粒子サイズを)キープ」処理シーケンスを。」
注:各パラメータを微調整解析結果に独立して調整することができる方法のマニュアルを参照してください。 - レコード粒度分布及び粒子/ mソフトウェアによって決定されるL濃度。
注:典型的なOMV流体力学的サイズの範囲は約10×10 8粒子/ mlの濃度で30〜200 nmの間です。
- OMVタンパク質含量を決定します
- OMV純度、酵素生産、およびSC-STの架橋効率7を評価するために、標準的なSDS-PAGEおよびウエスタンブロットプロトコルを使用してください。
注:架橋効率は100%7になりません。
- OMV純度、酵素生産、およびSC-STの架橋効率7を評価するために、標準的なSDS-PAGEおよびウエスタンブロットプロトコルを使用してください。
酵素包装の6.検証
- PTE活性アッセイ
- いずれかのキュベット中、25℃で適切な緩衝液などの、100mMのCHES緩衝液(pH 8)中のすべての酵素アッセイを行うまたは96/384ウェルプレート中に多重化されます。
- 1の5μlの追加:CHES90μlの精製OMVの5μlにCHES緩衝液中のパラオキソン1,000希釈(〜36倍培養培地中に存在するOMVの濃度に比べて濃縮さ)。
注意:パラオキソンは有毒農薬でありますそして、メーカーや制度ガイドラインごとに処理する必要があります。 - 405 nmで一定の間隔で吸光度測定(〜2時間の総反応時間ごとに20秒)を取る(ε= 18.1 mMの-1 cm -1 で )と348 nmの(等吸収点のε= 5.4 mMの-1 cm -1 で )までに発色性パラオキソン分解産物、p個のニトロフェノールの反応の進行を監視します。
注:8上記のpH値でのpニトロフェノールの支配的な脱プロトン化形態は、405 nmで正確なモニタリングを可能にする存在です。他のすべての複雑なまたはより低いpH溶液では、p個のニトロフェノールの複数の形態が存在することになるとして348 nmでの等吸収点を利用する必要があります。 - 各サンプル、パッケージング効率、および総PTE生産にPTEの相対量を比較するために、ステップ6.1.3からの進行曲線の直線部分の傾きを決定することによって、初期反応速度を計算します。
- 標準的な酵素を実行しますOMVのためにK M、V maxとの k catを決定するためのアッセイプロトコルは、PTEをカプセル化。
注:ラインウィーバー-バーク分析は、y切片= 1 / V maxおよび傾き= K M / V maxの20これらの動力学的パラメーターの決意に利用することができます。
- 貫通基板/製品の普及。
- ボリュームによって0から3パーセントからCHES緩衝液中のトリトンX-100の濃度の増加を利用するステップ6.1で説明したのと同じ動的アッセイ分析を実行します。
注:OMVの内容は反応溶液に自由にアクセスできるようにするためにできるように脂質二重層を破壊する可溶化OMV機能へのトリトンX-100の追加。 - 計算し、アクティビティiを酵素に比較して酵素活性の変化が最小限である(初期速度)で示される基材/製品の貫通通路を確認するために、それぞれのトリトンX-100レベルでの初期速度を比較nはトリトンX-100の存在しません。酵素活性の実質的な増加は、トリトンX-100の存在下で観察された場合には、基板が自由OMV中に拡散しないようです。
- その酵素活性を検証するためのトリトンX-100の存在下でアッセイ遊離酵素活性(セクション6.1で上述したように)界面活性剤単独では阻害されません。
注:活性が大幅トリトンX-100の影響を受けている場合、例えば、サポニンまたは様々なポリソルベート/トゥイーン界面活性剤などの代替添加剤は、OMV膜を破壊することがより適切であり得ます。
- ボリュームによって0から3パーセントからCHES緩衝液中のトリトンX-100の濃度の増加を利用するステップ6.1で説明したのと同じ動的アッセイ分析を実行します。
7. OMVストレージ
- 凍結
- 直接液体窒素中に精製されたOMVの場所〜100μlアリコートは、スナップ必ず完全にバイアルを水没またはサンプル自体に任意の液体窒素に接触しないというアリコートを凍結します。
注:精製したOMVは、スナップpurificat中にOMVペレットを可溶化するために選択したバッファに直接凍結させることができます7必要に応じていない追加の凍結保護剤とのイオンプロセス。 - -80℃でスナップ凍結アリコートを保管してください。
- サンプルを加熱しないでくださいというRTでそれらを配置することによって、ステップ7.1.1から凍結した一定分量を解凍します。
- このように、ストレージのすべてのサンプルを準備する前には、前と酵素活性のポスト凍結融解の有意な損失がないことを確認するために、凍結後に初期速度を比較するステップ6.1で説明した酵素アッセイを行います。
注:酵素活性の低下が原因で凍結することが観察されている場合Storeは4℃でOMVを精製しました。
- 直接液体窒素中に精製されたOMVの場所〜100μlアリコートは、スナップ必ず完全にバイアルを水没またはサンプル自体に任意の液体窒素に接触しないというアリコートを凍結します。
- 凍結乾燥
- 市販の凍結乾燥機21を利用し 、スナップ凍結し、精製OMVアリコートを凍結乾燥。
- ストアは、数週間または何ヶ月のために-80℃でRTでアリコートを凍結乾燥させました。
- 凍結乾燥する前のような凍結乾燥OMVに精製された同体積の水を追加し、トンを再水和するために室温で30分間放置彼はサンプリングします。 OMVをボルテックスまたは超音波処理しないように注意してくださいされて、必要なときに穏やかに混合します。
- ポイント・オブ・ケア希釈前/可溶化を必要としないアプリケーションのために直接凍結乾燥OMV粉末を追加します。
結果
このプロトコールで詳述OMVパッケージング戦略のために必要とされるように、2つの組換えタンパク質の同時発現は、異なる道の数を介して達成することができます。ここでは、2つのベクター系は、複製と独立した誘導性遺伝子カセットの互換性の起源で利用されました。 PTE-SCの発現のために商業的なプラスミド骨格(pACY184)を構築アラビノース誘導性遺伝子カセットとのような酵素遺伝子のクローニングを容易にするための唯一の制限部位の続く一連ツインアルギニンペリプラズム局在リーダー配列を含むように操作されましたC末端SCのタンパク質との融合。プラスミドは、外膜アンカータンパク質をコードする構築物、タンパク質発現とのpelBペリプラズム局在配列を制御するためのlacオペロンを使用する市販のベクターpET22あります。短いSTシーケンスはinse前に切り捨てられたのOmpAタンパク質にクローニングしました発現プラスミドにrtion。両方のプラスミドは、C末端ヘキサヒスチジン配列は、OMV試料中の融合タンパク質の同時同定を可能にするために維持しました。 OmpAのN末端およびC末端ST融合構築物の両方を含むこれらの遺伝子構築物の構築および特徴付けは、完全にアウベスらに記載されています。 7。本明細書に記載の遺伝子構築物は、全ての酵素の包装に資するではないかもしれません。いくつかの例では、調節要素、またはエピトープタグをペリプラズム局在化シグナルを変更する必要があるかもしれません。さらに、いくつかのタンパク質は法外に大きく、完全に内膜を横断することができません。酵素活性およびOMVのパッケージング効率は、 先験的に決定することができず、経験的に各標的タンパク質について決定する必要があります。
以下は正常に運ぶO後の1は、一般的に期待される結果ですこのプロトコルをユタ。 OMV内の2 ST / SC分割タンパク質ドメインの概略、のOmpA-STとPTE-SC融合構築物だけでなく、細菌外膜でのイソペプチド形成の例とPTE-SCのその後のカプセル化が含まれる( 図1) 。また、代表的なSEMを介して精製したOMV形態の結果だけでなく、粒子追跡ソフトウェア( 図2)を介して決定されたサイズ分布と絶対OMV濃度も含まれています。 OMVタンパク質含量および組換えタンパク質発現のさらなる特徴付けは、SDS-PAGEおよびウェスタンブロット( 図3)を介して見られます。次のように、ここで提供されたプロトコルに固有の目的のタンパク質のための分子量は次のとおりです。ネイティブのOmpA(37.2キロダルトン)、のOmpA-ST(23キロダルトン)、PTE-SC(51キロダルトン)、のOmpA-ST / PTE-SCを(74 kDaの) 。精製されたOMVは非常に豊富なネイティブのOmpAの指標である暗帯で約37キロダルトンを持つ必要があります。ゲルの解像度に応じて複数のBAがあるかもしれませんOmpA、のOmpFとのOmpCとしてゲルのこの領域に存在するNDSはすべて比較的豊富であり、類似の分子量を共有しています。 OmpA-STはまたによる大腸菌の発現機構を圧倒した結果として、リーダー配列の不適切な切断に観察することができるよりも2.2 kDaの大きい追加のバンド。成功した精製されたOMVのサンプルは、他の多くの高度に発現するタンパク質を持っていないことに注意することが重要です。他のバンドが存在する場合、精製が不適切に行われたか、細菌が利用されている株のいずれかこれを大腸菌 BL21(DE3)株では観察されない他のタンパク質をパッケージングすることができます。
さらに、活性アッセイおよび小胞破壊実験は、酵素基質を自由タンパク質( 図4)ポーリン貫通介しOMVを入力することができる場合に予想されるであろう代表的な結果を実証するために提供されています。パラオキソンは比較的自由に入ります内在性膜貫通ポリンタンパクを介しOMVはまた、OMV膜を介して比較的自由に通過し、パッケージ化されたPTEとの反応生成物、p個のニトロフェノールと反応させます。この現象は、すべての製品、基板、および酵素セット間ユビキタスされず、実験的に決定されなければなりません。成功したOMVの破裂および酵素放出は、界面活性剤およびPTE(本明細書中のTriton X-100)の低濃度で見られたが、そのような追加は、他の酵素の活性に影響を及ぼし得ます。
プラスミドマップは、SC / STシステム( 図5)を利用した 2プラスミドのパッケージング戦略の設計を実証するために含まれています。
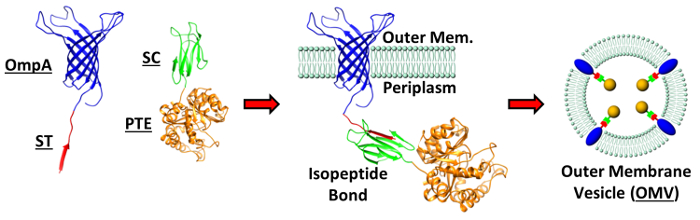
図1:OMVへのタンパク質の監督包装。説明OMV包装ストラトで利用するタンパク質のための結晶構造EGY:のOmpA、PTE、SpyTag(ST)とSpyCatcher(SC); PDB:2GE4、1PTA、それぞれ4MLI、4MLI、。細菌の外膜にイソペプチド結合を形成するのOmpA-STとPTE-SC融合構築物の概略図が示されています。この膜融合が形成OMV内のPTEの取り込みを駆動します。アウベスらから図に再現(適応)。 ACS APPLマットインタフェース (2015)、7(44)、頁24,963-24,972 7。著作権2015年アメリカ化学会。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図2:OMV の特性評価。超遠心ネイティブ大腸菌からOMV精製の(A)SEM [BL21(DE3)]。 (B)代表粒子のtracキングサイズ分布および(C)の総小胞の濃度は、90秒以上のサンプルがアラビノースの活性化(PTE-A)の存在下で、アラビノース活性化(PTE-Aいいえ)の不在下でネイティブOMV、PTE-SC用の読み込みPTE-SC平均しましたアラビノースおよびIPTG活性化(PTE / OMV-N)の存在下でのPTE-SCを用いて同時形質転換、N末端のOmpA-ST、および超遠心上清(UC上清)。 OMV産生の有意な増加がネイティブOMVおよびPTE-SCは、単独の構成と比較してPTE / OMV-Nのサンプルで観察されました。 OMVは、上清ポスト超遠心分離でno OMVに少し残しUCペレット中のOMVのほぼ完全な回復を実証するためにUC上清中に定量しました。すべてのデータは、3回の実験の平均(±SD)を表します。アウベスらから図に再現(適応)。 ACS APPLマットインタフェース (2015)、7(44)、頁24,963-24,972 7。著作権2015年アメリカ化学会。D / 54458 / 54458fig2large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。

図3: 精製OMVタンパク質含量決意。 PTE-SC(PTE / OMV)と共発現C末端のOmpA-ST融合の精製されたOMV UCペレットの(A)SDS-PAGEのOmpA-STの代表的な豊かさ、ネイティブのOmpA、PTE-SCとOmpA-を実証構築ST / PTE-SCイソペプチド融合。 OmpAおよびPTEに存在含まhisタグを利用する(B)ウエスタンブロット分析は、抗の6xHis抗体を介して視覚化を容易にするように構成します。より大きな分子量のhisタグ付けされた種の存在によってブロット上で証明されるようにPTEが、二量体化することが知られていることに注意することが重要です。非常に高いのOmpA-STの発現レベルがあるにもかかわらず自由の完全な変換が存在しない観察膜へのPTE-SCはのOmpA-ST / PTE-SCを結合しました。この事実にもかかわらず、全体的なPTEの生産と改良パッケージング効率の増加は、共有結合の形成は遍在ないがST及びSCドメインの非共有結合は、OMV中に向け包装において重要な因子であることを示唆しています。アウベスらから図に再現(適応)。 ACS APPLマットインタフェース (2015)、7(44)、頁24,963-24,972 7。著作権2015年アメリカ化学会。 この図の拡大版をご覧になるにはこちらをクリックしてください。
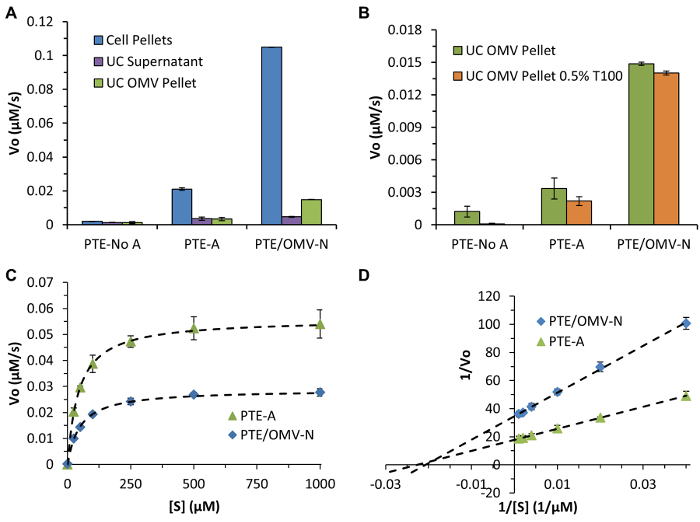
図4:PTE 活動や包装の特性評価。 (A)全体PTE発現レベルとOMVパッケージング効率はパラを利用する最初の速度測定を介して決定します細胞ペレット、UC上清、および精製UC OMVペレットにPTEの存在を比較する発色基質としてオクソン。 (B)OMV内部に基板の妨げられることなくアクセスを許可するOMV二重層を破壊するためにトリトンX-100(0.5%T100)の使用方法を示す代表的なデータ。酵素初期速度が変更されていない場合T100の不存在下で行われるアッセイにこのデータを比較すると、無傷のOMV二重層を横切って基板の転座の検証を容易にします。パラオキソンの場合、パラオキソンは、OMVに内因性の細孔を通って自由に通過することを示すT100の存在下または非存在下で観察された非常に小さな活動の差がありました。 (C)PTE-SC動態データは、PTE / OMV-NおよびPTE-Aのための標準的なミカエリス-メンテン酵素動力学方程式にフィット。 (D)K Mとの k cat / K M(48、4.4×10 7を決定するために使用されるラインウィーバー・バーク分析; 44μM、4.9のx10 7秒-1それぞれM -1、)天然酵素と同様のPTE文献動態パラメータを実証(90μM、2.7×10 7秒-1 M -1)すべての場合において、R 2≥0.999で。すべてのデータは、3回の実験の平均(±SD)を表します。アウベスらから図に再現(適応)。 ACS APPLマットインタフェース (2015)、7(44)、頁24,963-24,972 7。著作権2015年アメリカ化学会。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図5: ここで説明する例のシステムのための代表的なプラスミド構築物。 SpyCatcher修飾酵素-SC(PTE-SC)プラスミドは、OMV(左)内のカプセル化の対象となります。 SpyTag MODIFIED膜アンカー-ST(のOmpA-ST-N)プラスミド(右)。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
代表性を実証するために、このプロトコル機能は、目的の酵素が生産され、 大腸菌によりOMVにパッケージ化されたパッケージング技術を指示しました。多くの複雑な技術と同様のプロトコルは以下に詳述されているいくつかの異なるユニークな用途での使用に適応するように変更することができる複数の領域が存在します。 OMVのパッケージングと酵素カプセル化のメカニズムは、特定のニーズに適合させることができますが、その成功に不可欠であるこのプロトコル内のいくつかのステップがあります。無傷の細菌および細胞破片の初期の除去が非常に重要であり、定量またはサンプルの分析では、すべての下流の試みに影響します。続いて濾過二つの連続遠心分離工程通常、これらの汚染物質を除去するのに十分です。ソリューションをデカントただし、すべてのインスタンスのケア中の汚染物質の移動を最小限にするために遠心分離した後に取られるべきです。同様に、最終的なOMVペレットObtained以下の超遠心分離は、多くの場合のみゆるく遠心管の底に接着されています。ペレットは、容器の底に乱されないままであることを保証するために、使用済みの培地を除去したときに、最終段階では、注意を払わなければなりません。いくつかのインスタンスでは、プロトコルの最終段階で失われなかったOMVペレットを確実にするためにDLSまたはナノ粒子追跡装置を用いた試料の分析後まで最終培養培地を保持するのが最善かもしれません。以下は、研究者の特定のニーズに合わせて調整されているこの特定のプロトコルおよびその他の両方で発生する可能性のあるいくつかの追加の懸念があります。
このシステムでPTEの使用は、PTEが代替酵素または目的のタンパク質によって容易に交換可能であるとの有機リン汚染された地域の環境修復のための優れたモデル酵素のカプセル化のために用意されています。ここで説明したようにはOmpA-STとPTE-SCの共発現は、全体的なPTE expressiの大幅な増加をもたらしました上と同様にPTEおよびPTE-SCに比べて小胞内にパッケージ化された複数のPTEでより高いベシクルの生産レベルは単独で発現しました。 OmpA超小胞のC末端欠失を介して外膜とペプチドグリカンとの間の相互作用の数を減らすことによって達成されます。これは、細菌は、多くの場合、非天然タンパク質の過剰発現で観察された毒性効果を軽減する組換えPTEをエクスポートするための簡単な経路を提供します。
PTEが容易にこのモデル系に置き換えることができるが、すべての酵素基質を自由OMV二重層を通過することに留意することが重要であり、それぞれ固有の酵素および基質対がケースバイケースでテストされることが肝要です。基板は、この技術はまだOMVに酵素およびTriton X-100、または適切な代替界面活性剤の添加を製造し、パッケージするために利用することができる膜を通過しない場合でも、十分ルで添加することができます使用前に小胞を破裂するVELS。
組換えタンパク質の発現及びパッケージングの非存在下で、このプロトコルはまた、多様な細菌種からのOMVの産生および精製のための基本的な方法としての役割を果たすことができます。このような密度勾配分画22、膜濾過23、及び限外濾過24としてOMV精製のための別の方法は、また存在し、意図する用途に応じて、より適切な技術であってもよいです。これらの代替の精製技術も、容易に双直交合成結合の使用によってOMVへのタンパク質の方向付け包装用OMVの超遠心ペレットの代わりに、このプロトコルに補充することができます。
他の修飾は、このプロトコルで使用される特定の合成連携システムと同様に、選択した膜テザリングタンパク質に対して行うことができます。二つの異なるタンパク質をペアリングするための様々な合成方法があります含まれる生物学的システム内の:スプリットタンパク質25、コイルドコイル26、および分割インテイン27は 、ほんの数を一覧表示します。そのようなのOmpFとのOmpCなどの他の膜結合または貫通タンパク質は、おそらく同様に適切STの修飾部位のために28を提供します。いくつかの例では、また、組換え酵素/タンパク質上のSTとアンカータンパク質にSCを置くSCドメインとはるかに小さいSTを交換する必要があるかもしれません。同じまたは異なる誘導システムで複数のプラスミドの使用を含む、ここで実現可能なクローニング戦略の数、符号化された複数のタンパク質と単一のプラスミド、あるいは発現の全部または部分を組み込むための相同組換え技術を利用してもあります細菌のゲノムへのシステム。
OMVの微小環境は、一般的に理想的なセント未満で発生酵素の不活性化を減少させるパッケージ化された酵素を安定化するのに役立ちますオラージ条件、凍結融解、凍結乾燥29。また、OMV二重層は、活性酵素、エクストラOMV空間中に存在するタンパク質間の物理的障壁として機能するようOMVは、タンパク質分解的切断に大幅に改善された耐性を与えることが予想されます。このプロトコルは、さらにOMVカプセル化されたタンパク質との親和性精製の標的化送達を容易にするために、外側に面し、小分子、ペプチド、またはタンパク質タグを含むように拡張することができます。 PTEは、このユニークなアプリケーションのために選択されたが、このプロトコルのこの研究の結果、その内容は、容易に多様な薬学的送達に使用するための類似のタンパク質包装戦略を設計するために利用することができ、 医療診断、および環境修復アプリケーション30。
開示事項
著者らは、開示することは何もありません。
謝辞
This research was funded by the Office of Naval Research through Core funds provided to the Naval Research Laboratory.
資料
| Name | Company | Catalog Number | Comments |
| IPTG | Any | Always prepare fresh or aliquot and freeze. | |
| L-arabinose | Any | Can be prepared ahead of time and stored at 4 °C. | |
| Ampicillin | Any | Add immediately prior to use after media cools sufficiently from being autoclaved. | |
| Chloramphenicol | Any | Add immediately prior to use after media cools sufficiently from being autoclaved. | |
| TB/LB Culture Media | Any | Other growth medias will likely work similarly. | |
| Triton X-100 | Any | One of many potential suitable surfactants. | |
| Baffled culture flasks | Any | The baffles promote higher levels of aeration. | |
| CHES | Fisher Bioreagents | BP318-100 | Optimal buffer used for paraoxon degredation (pH > 8). |
| Paraoxon | Chem Service | N-12816 | Very toxic substance to be handled carefully and disposed of properly. |
| Syringe Filter 0.45 µm | Thermo Scientific | 60183-221 (30 mm) | Filter diameter will depend on volume of sample. Low protein binding membrane is critical. |
| Shaker incubator | New Brunswick | Excella E24 | Precise temperature and mixing is essential for reproducable bacterial growth. |
| Sorvall Culture Centrifuge | Thermo Scientific | RC 5B PLUS | Large volume (500 ml) culture centrifuge capable of 7,000 x g. |
| Sorvall Ultracentrifuge | Thermo Scientific | WX Ultra 90 | Capable of centrifugal forces ≥150,000 x g. |
| Ultracentrifuge Rotor | Thermo Scientific | AH-629 | Ensure the proper rotor and tubes are used and that everything is properly balanced. |
| Ultra-Clear Ultracentrifuge Tubes (25 x 89 mm) | Beckman Coulter | 344058 | Ensure no stress fractures are present prior to use and that tubes are presicely balanced. |
| Spectrophotometer | Tecan | Infinite M1000 | Necessary for enzyme kinetic assays. |
| DLS/particle tracking | NanoSight | LM10 | Necessary for OMV size distribution and concentration determination. |
| BL21(DE3) | NEB | Suitable bacterial expression strain. | |
| pET22 | EMD Millipore | 69744-3 | Other plasmids can be used in place of these. |
| pACYC184 | NEB | Other plasmids can be used in place of these. | |
| Gel Extraction Kit | Qiagen | 28704 | Example kit. |
参考文献
- Avila-Calderon, E. D., et al. Roles of bacterial membrane vesicles. Arch. Microbiol. 197, 1-10 (2015).
- Kulp, A., Kuehn, M. J. Biological functions and biogenesis of secreted bacterial outer membrane vesicles. Annu. Rev. Microbiol. 64, 163-184 (2010).
- Beveridge, T. Structures of Gram negative cell walls and their derived membrane vesicles. J. Bacteriol. 181, 4725-4733 (1999).
- Kulkarni, H. M., Jagannadham, M. V. Biogenesis and multifaceted roles of outer membrane vesicles from Gram-negative bacteria. Microbiology. 160, 2109-2121 (2014).
- Ellis, T. N., Kuehn, M. J. Virulence and immunomodulatory roles of bacterial outer membrane vesicles. Microbiol. Mol. Biol. Rev. 74, 81-94 (2010).
- Berleman, J., Auer, M. The role of bacterial outer membrane vesicles for intra- and interspecies delivery. Environ. Microbiol. 15, 347-354 (2013).
- Alves, N. J., et al. Bacterial nanobioreactors-directing enzyme packaging into bacterial outer membrane vesicles. ACS Appl. Mater. Interfaces. 7, 24963-24972 (2015).
- Kim, J. Y., et al. Engineered bacterial outer membrane vesicles with enhanced functionality. J. Mol. Biol. 380, 51-66 (2008).
- Haurat, M. F., et al. Selective sorting of cargo proteins into bacterial membrane vesicles. J. Biol. Chem. 286, 1269-1276 (2011).
- Kesty, N. C., Kuehn, M. J. Incorporation of heterologous outer membrane and periplasmic proteins into Escherichia coli outer membrane vesicles. J. Biol. Chem. 279, 2069-2076 (2003).
- Zakeri, B., et al. Peptide tag forming a rapid covalent bond to a protein, through engineering a bacterial adhesion. Proc. Natl. Acad. Sci. U. S. A. 109, e690-e697 (2012).
- Li, L., Fierer, J. O., Rapoport, T. A., Howarth, M. Structural analysis and optimization of the covalent association between SpyCatcher and a peptide tag. J. Mol. Biol. 426, 309-317 (2014).
- Dumas, D. P., Durst, H. D., Landis, W. G., Raushel, F. M., Wild, J. R. Inactivation of organophosphorus nerve agents by the phophotriesterase from Pseudomonas-Diminuta. Arch. Biochem. Biophys. 277, 155-159 (1990).
- Bigley, A. N., Raushel, F. M. Catalytic mechanisms for phosphotriesterases. Biochimica et Biochim. Biophys. Acta, Proteins Proteomics. 1834, 443-453 (2013).
- Minton, N. A., Murray, V. S. G. A review of organo-phosphate poisoning. Med. Toxicol. Adverse Drug Exper. 3, 350-375 (1988).
- Bigley, A. N., Xu, C., Henderson, T. J., Harvey, S. P., Raushel, F. M. Enzymatic neutralization of the chemical warfare agent VX: Evolution of phosphotriesterase for phosphorothiolate hydrolysis. J. Am. Chem. Soc. 135, 10426-10432 (2013).
- Chatterjee, S. N., Chaudhuri, K. Gram-negative bacteria: the cell membranes. Outer Membrane Vesicles of Bacteria. SpringerBriefs in Microbiology. , 15-34 (2012).
- Wang, Y. The function of OmpA in Escherichia coli. Biochem. Biophys. Res. Commun. 292, 396-401 (2002).
- Danoff, E. J., Fleming, K. G. The soluble, periplasmic domain of OmpA folds as an independent unit and displays chaperone activity by reducing the self-association propensity of the unfolded OmpA transmembrane beta-barrel. Biophys. Chem. 159, 194-204 (2011).
- Alves, N. J., Kline, J. A. Comparative study on the inhibition of plasmin and delta-plasmin via benzamidine derivatives. Biochem. Biophys. Res. Commun. 457, 358-362 (2015).
- Wang, W. Lyophilization and development of solid protein pharmaceuticals. Int. J. Pharm. 203, 1-60 (2000).
- Goormaghtigh, E., Scarborough, G. A. Density-based separation of liposomes by glycerol gradient centrifugation. Anal. Biochem. 159, 122-131 (1986).
- Alves, N. J., et al. Functionalized liposome purification via Liposome Extruder Purification (LEP). Analyst. 138, 4746-4751 (2013).
- Mayer, L. D., StOnge, G. Determination of free and liposome-associated doxorubicin and vincristine levels in plasma under equilibrium conditions employing ultrafiltration techniques. Anal. Biochem. 232, 149-157 (1995).
- Blakeley, B. D., Chapman, A. M., McNaughton, B. R. Split-superpositive GFP reassembly is a fast, efficient, and robust method for detecting protein-protein interactions in vivo. Mol. BioSyst. 8 (2036), (2012).
- De Crescenzo, G., Litowski, J. R., Hodges, R. S., O'Connor-McCourt, M. D. Real-time monitoring of the interacation of two-stranded de novo designed coiled-coils: effect of chain length on the kinetic and thermodynamic constants of binding. Biochemistry. 42, 1754-1763 (2003).
- Charalambous, A., Antoniades, I., Christodoulou, N., Skourides, P. A. Split-Intein for simultaneous site-specific conjugation of quantum dots to multiple protein targets in vivo. J. Nanobiotechnol. 9, 1-14 (2011).
- Lee, E. Y., et al. Global proteomic profiling of native outer membrane vesicles derived fromEscherichia coli. Proteomics. 7, 3143-3153 (2007).
- Alves, N. J., Turner, K. B., Medintz, I. L., Walper, S. A. Protecting enzymatic function through directed packaging into bacterial outer membrane vesicles. Sci. Rep. 6, 24866 (2016).
- Alves, N. J., Turner, K. B., Medintz, I. L., Walper, S. A. Emerging therapeutic delivery capabilities and challenges utilizing enzyme/protein packaged bacterial vesicles. Ther. Delivery. 6, 873-887 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved