Method Article
에서 외부 막 소포 내에서 감독 단백질 포장
요약
A protocol for the production, purification, and use of enzyme packaged outer membrane vesicles (OMV) providing for enhanced enzyme stability for implementation across diverse applications is presented.
초록
외막 소체 (OMV)를 프로그래밍하는 합성 생물학 기술을 적용 점점 관심은 기존의 나노 입자를 합성하기에 너무 어려운 증명 OMV에 대한 몇 가지 매우 흥미로운 독특한 응용 프로그램을 선도하고 있습니다. 지금까지 모든 그람 음성균은 소분자, 펩티드, 단백질, 및 유전 물질을 포함하는화물의 다양한 OMV 시연 용기를 생산하는 것으로 나타났다. 그들의 다양한화물 바탕 OMV 셀 - 셀 통신에서 유전자 전달과 박테리아 OMV를 생성하는 의존 독성 인자의 전달에 이르기까지 여러 생물학적 과정에 연루되어있다. 최근 세균 OMV 제어하고 OMV 재조합 단백질을 직접 포장 기술의 개발을 통해 다양한 애플리케이션에 걸쳐 사용하기 위해 액세스 될 수있다. overa 개선이 프로토콜은 생산, 정제 방법, 및 효소 패키지 OMV 사용 제공 설명재조합 효소 증가 수포 및 향상된 효소의 안정성 게요 생산. 이 프로토콜의 성공적인 이용은 동시에 재조합 단백질을 생산하고, 재조합 단백질과 외막 사이에 앵커 단백질 합성 결합을 통해 생성 OMV 밀봉 용을 지시하는 균주의 생성한다. 제약 약물 전달, 의료 진단 및 환경 개선 :이 프로토콜은 또한 다른 고유 한 애플리케이션에 사용하기 위해이 프로토콜을 채택 할 때 고려해야 할 박테리아 문화뿐만 아니라 적절한 처리 기술과 일에서 OMV를 분리하기위한 방법을 자세히 설명합니다.
서문
효소 로딩 박테리아 외막 소체 (OMV)의 설계, 생산 및 정제 방법이 여기에서 제시 하였다. OMV는 30-200 nm의 1, 2에서 크기가 다양 테오 주로 단층, 작은 수 있습니다. 현재까지 연구 된 모든 그람 음성 및 그람 양성 박테리아는 표면 3,4에서 OMV 또는 세포 외 소포 (EV) 중 하나의 릴리스를 증명하고있다. OMV가 생산되고있는 정확한 메커니즘은 아직 완전히 때문에 그들뿐만 아니라 그들이 섬기는 다양한 기능을 분비하는 다양한 세균 집단을 규명해야한다. OMV 복잡한 시그널링 유전자 전위 다양한 서빙 유전 물질 소분자, 펩티드, 단백질로부터화물 다양한 수송 도시되어 있고, 독성은 5,6 기능한다.
OMV의 생물 발생의 정확한 메커니즘은 잘 특징, 세균 종 사이의 차이 표시되지 않습니다. 생에도 불구하고S 사실, 우리는 목적 단백질과 세균의 외막에 매우 풍부한 단백질 내생 이후 OMV 간의 합성 결합을 만들어 OMV으로하는 재조합 단백질의 포장 효율을 향상시키는 방법을 개발했다. 합성 결합 또는 인위적으로 혼입 친화력의 부재에서, 상기 재조합 발현 된 단백질과 OMV 사이 관찰 포장 효율 7 매우 낮다. 이 결과는 잘 이해되지 않은기구에 의해 하나가 박테리아 표면이나 직접 포장 통해 OMV 형성의 정확한 순간에 우연 밀봉 통해 발생 OMV 내 단백질의 혼입으로 예상 할 수있다. 일 다른 사람에 비해 높은 효율로 포장 일부 단백질과 종속 단백질은 매우 약간의 성공이 우연 캡슐화하지만 효과적인 포장에 의존 주변 세포질 공간 내 표현을 통해 단순히 통해 단백질을 포장에서 관찰 된입니다전혀 8-10에서 포장하지 않습니다. 일반적인 합성 생물학 기술을 이용하여, 우리는 대장균 (E. coli에) 동시에 제조, 포장 및화물을위한 박테리아에 의해 선택되는 방법 OMV가 형성되는 방식에 대한 현재의 기술 한계를 회피 OMV에 목적 활성 효소를 분비을 설계하고자 포장.
선택 합성 링크가 OMV 방향으로 포장을 용이하게하도록 본 출원의 목적을 위해 분리 된 단백질 바이오 콘쥬 게이션 시스템을 선택 하였다. 이름이 암시 하듯이 분할 단백질 바이오 콘쥬 게이션 시스템은 서로 상호 보완적인 두 서브 유니트 도메인으로 구성된다. 이 프로토콜의 목적을 위해 선택한 분할 단백질 도메인은 연쇄상 구균 화농의 피브로넥틴 결합 단백질 (FbaB) (11)에서 파생 된 SpyCatcher (SC) 및 SpyTag (ST) 도메인으로하고라고합니다. 이 분할 단백질 시스템은 w에서 이례적인 일이다암탉 개의 서브 유닛이 근접 내에 isopeptide 결합되어 자발적으로 공유 결합을 생성 산과 라이신 아미노산 잔기 아스파르트 기단 사이에 형성한다. Isopeptide 결합 형성은 샤페론 단백질, 효소, 촉매 또는 보조 인자의 첨가를 필요로하지 않고, 용이하게 실내 온도 (RT)에서 생리 학적으로 관련된 조건 (12)의 넓은 범위에 걸쳐 일어날 수있다.
개념의 증거로, Brevundimonas의 diminuta에서 phosphotriesterase (PTE) (EC 3.1.8.1)는 OMV (13) 파생 대장균으로 포장하기 위해 선택되었다. PTE는 이핵 아연 / 아연 활성 부위를 포함하고 dialkylphosphates 및 아릴 알코올 (14)에 aryldialkylphosphates 변환 가수 분해 반응을 통해 유기 인산 화합물을 분해 할 수있는 능력을 가지고 있습니다. 유기 인산 화합물에 노출되면 신경 근육 접합부 보는 건에서 아세틸 콜린 에스 테라 제에 의해 아세틸 콜린의 가수 분해를 억제을 통해 적절한 신경 전달 물질의 기능을 손상15 극도로 위험한 g의 유기 인산 화합물 유래 화합물 등을들 수있다. 장기간 또는 유기 인산 화합물에 상당한 노출은 일반적으로 통제 할 수없는 경련을 초래 일반적으로 질식을 통해 죽음을 발생합니다. PTE가 paraoxon 향해 높은 촉매 활성을 나타내는 반면, 매우 강력한 살충, 또한 다른 살충제 및 V / G 형 화학 신경 제제 (16)의 넓은 범위를 가수 분해 할 수있다. OMV 패키징을 용이하게하기 위해, 박테리아 플라스미드는 유도 성 프로모터하는 주변 세포질 위치 파악 시퀀스 및 SC 유전자 서열 상류 짧은 다중 클로닝 부위를 포함하는 유전자 구조를 인코딩되도록 설계 하였다. OMV 포장에 대한 주변 세포질 공간으로 PTE-SC 융합 단백질을 대상으로하는 유전자 스위치의 생성을 허용하는 지도자와 SC 시퀀스 사이의 PTE 유전자의 삽입. 여기서 설명하는 노력이 PTE에 집중하지만, 효소 유전자가 상호 교환 용이 FAC 다른 유전자 서열로 대체 될 수있다다른 효소 또는 단백질의 ilitate 포장.
합성 링크의 두 번째 부분으로 풍부 외막 단백질 (하는 OmpA)는 ST의 단백질 서열을 제공하도록 선택된다. 변할 수 앵커 단백질의 선택은, 단백질은 원형질막 주위 공간에 표시하는 허용 도메인이 세포 독성을 유발하지 않고 융합 구조를 견뎌 것이 중요하면서 재조합 때, OMV에 존재하는 것으로 알려져 있으며, 응집하지 않는다 생산했다. 높게하는 OmpA 박테리아 외막 이후 OMV (17)에 표시 될 것으로 알려진 37.2 kDa의 포린 횡단 단백질이다. 그것은 작은 분자의 운반에 관여하고, 박테리아 막 (18)을 가로 질러 크기가 2 nm의 <. 네이티브하는 OmpA 두 구조적 고유 도메인, 경막 베타 배럴 모티브 및 펩티도 글리 칸 (19)과 상호 작용하는 것으로 알려진 periplasmically 수용성 C 말단 부분을 가진다. 돌연변이하는 OmpA-ST 융합 고안에서D 여기하는 OmpA의 C 말단 부분은 삭제하고, ST는 periplasmically 직면 N- 또는 C 말단에 융합되었다. 하는 OmpA의 주변 세포질 부분을 삭제하면 외막과 하이퍼 수포 7로 이어지는 막 불안정의 결과로 펩티도 글리 사이의 상호 작용의 수를 감소시킨다. 게놈하는 OmpA은 총 멤브레인 불안정을 완화하는 재조합 발현하는 OmpA-ST 구조 이외에 유지 하였다.
프로토콜
플라스미드 1. 준비
- A (앵커-ST로서이 프로토콜 함) biorthogonal 결합 도메인 융합 플라스미드 (예, pET22) 앵커 단백질 함유 (하는 OmpA), 에피토프 태그 (예 : 정제 및 식별 6xHis, myc의 또는 FLAG 태그)를 준비 세포질 파악 태그 항생제 내성, 선택된 균주 7에 기초하여 적절한 복제 원점.
- 제조 업체의 프로토콜 다음 시중에서 판매하는 DNA 분리 키트를 사용하여 야간 문화의 플라스미드 DNA를 추출합니다.
- 플라스미드 (예, pACYC184) (효소 SC 등이 프로토콜에 언급) (PTE)를 앵커 단백질의 상보 bioorthogonal 결합 도메인에 융합 OMV 내에 패키징 될 수있는 효소 / 단백질을 함유 준비 에피토프 태그 앵커 단백질 플라스미드와 다른 주변 세포질 현지화 태그, 항생제 내성, 적절한 오리지널복제 선택된 균주 7을 기반으로.
- 제조 업체의 프로토콜 (7) 다음 시중에서 판매하는 DNA 분리 키트를 사용하여 야간 문화의 플라스미드 DNA를 추출합니다.
OMV 포장 대장균 문화의 2 세대
- 플라스미드 분리
- 효소-SC는 구성 및 앵커-ST는 제조 업체의 프로토콜 7에 따라 상업용 플라스미드 격리 키트를 사용하여 별도의 유지 보수 세포주에서 구축 인코딩하는 플라스미드를 정제. 260 nm의 280 nm에서 흡광도를 측정하여 DNA 농도 및 순도를 결정합니다.
- 공동 변환
- 단백질 발현을 용이하게하기 위해 상업적으로 사용할 수있는 대장균 균주를 선택한다.
주 : BL21 (DE3) 세포를 여기에 사용 하였다. T7의 lysogen는 제자의 T7 프로모터 및 T7 RNA 중합 효소에 의존 앵커-ST 구조의 표현이 필요합니다EIN 식입니다. 다른 박테리아 균주를 사용하면 T7의 lysogen 유전자의 존재 또는 pET22 7 이외의 플라스미드를 사용하는 하나를 요구한다. - 다음 선택 권한있는 셀의 제조 업체의 프로토콜 다음 열 충격 변환하거나 전기 중 하나를 통해 유능한 박테리아 세포로 변형 동등한 몰 농도 정제 된 플라스미드 DNA를 희석.
- ; 위에 항생제 함유 모두 암피실린 (pET22) 및 클로람페니콜 (pACYC184)와 접시 한천 루리아 - 베르 타니 (LB)를 플레이트 형질 전환 된 세포 모두 25 μg의 / ㎖의 최종 농도로 존재.
- 모두 플라스미드를 포함하는 경우에만 클론을 분리하기 위해 밤새 37 ° C에서 배양 접시를 놓습니다.
참고 : 항생제 선택 살아남을 식민지 이후의 모든 OMV 제제에 사용됩니다. 항생제 (암피실린과 클로람페니콜)을 선택적으로 압력을 유지하고 두 플라스미드의 존재를 확인하기 위해 모든 액체 배양 물에 첨가한다.
- 단백질 발현을 용이하게하기 위해 상업적으로 사용할 수있는 대장균 균주를 선택한다.
3. OMV 생산
- 식민지 확장
- 2.2.4에 설명 된 선택 플레이트의 단일 콜로니로 상기 농도의 항생제를 함유하는 배지 (전형적 굉장 브로 쓰 (TB) 또는 LB) (단계 2.2.3) 5 ㎖를 접종한다.
- 당황 배양 플라스크에 하룻밤 스타터 문화의 100 배 희석 : 1을 수행합니다.
참고 : 250-500 ml의 사이에 미디어의 볼륨을 사용합니다. - 문화의 충분한 통기가 달성하기 위해 250 rpm으로 흔들어 37 ° C에서 문화를 유지한다.
- 각 플라스미드의 유도
- 박테리아 문화가 주 성장 플라스크의 접종 후, OD 0.6-0.8의 600 성장의 약 3 시간을 증가 할 수 있습니다.
- PTE-SC로드 소포의 최종 수율을 향상시키기 위해 15 분 동안 7,000 XG에서 전체 문화를 원심 분리기. 예열 신선한 배지에서 세포 펠렛을 재현 탁.
참고 :이 옵트하는 ional 단계 PTE-SC 유도 전에 배양 배지에 존재하는 빈 OMV를 제거 할 수 있습니다. - 0.22 μm의 필터를 사용하여 물과 살균 필터 L - 아라비 노스의 20 % 원액을 확인합니다. 2~4주 4 ℃에서 보관 L - 아라비 노스 솔루션입니다.
- PTE-SC 생산을 시작 최종 0.2 %의 농도로 배양 플라스크에 L-아라비 노스 솔루션을 추가합니다.
참고 :이 전에 돌연변이하는 OmpA-ST의 유도를 통해 증가 된 수포를 홍보에 PTE-SC와 주변 세포질 공간을 미리로드하는 데 도움이됩니다. - 0.22 μm의 필터를 사용하여 물과 살균 필터의 1 M 이소 프로필 β-D-1-D- 티오 갈 락토 피 라노 시드 (IPTG) 솔루션을합니다.
참고 : IPTG 한 번 즉시 사용 수화해야합니다. IPTG의 분취 3-6 개월간 동결 보관하고, 사용 전에 즉시 해동 할 수있다. - 하는 OmpA-ST의 생산을 시작하는 0.5 mm의 최종 농도에 추가 3 시간의 잠복기 후 IPTG를 추가합니다.
- 막 다른 허용진탕하면서 37 ℃에서 추가로 8 ~ 14 시간 동안 성장 진짜야.
4. OMV 정화
- 본래 박테리아의 제거
- 그대로 박테리아를 펠렛 4 ° C에서 7,000 XG에 15 분 동안 세균 배양 배지를 원심 분리기.
- 세포 펠렛을 방해하지에 캔트, 그리고 조심 세포 펠렛 포스트 원심 분리의 맨 위에 떨어져, 미디어를 저장합니다.
- 하나의 추가 원심 분리 사이클은 모두 그대로 박테리아가 가만히 따르다 미디어를 저장해야되는 문화 미디어에서 제거되도록하는 반복 4.1.1와 4.1.2 단계를 반복합니다.
- 단백질 응집체를 제거하여
- 또한 잔류 세균 원하지 않는 큰 세포 물질을 제거하기 위해 0.45 ㎛의 멤브레인 필터를 사용하여 세균 배양액을 정제.
주 : (셀룰로오스 아세테이트 (CA) 또는 폴리 비닐 리덴 디 플루오 라이드 등의 높은 회수율 및 낮은 단백질 흡착 생물학적 호환 막 재료를 사용하여PVDF). 100 ㎖ 및 100 ㎖보다 큰 진공 필터 볼륨보다 작은 주사기 필터 볼륨.- 주사기 필터, 멸균 10 ~ 50 ML의 주사기에 배지를 그립니다. 주사기의 루어 끝에 0.45 μm의 필터를 연결합니다. 플런저를 우울하게하고 흐름을 통해 새로운 용기를 수집합니다.
- 필터 진공 멸균 여과 장치에 배지를 전송합니다. 펌프를 진공 또는 흡입을 생성하는 흡입기를 싱크 장치를 연결합니다. 새로운 용기에 여과 매체를 전송합니다.
- 또한 잔류 세균 원하지 않는 큰 세포 물질을 제거하기 위해 0.45 ㎛의 멤브레인 필터를 사용하여 세균 배양액을 정제.
- 초 원심 분리를 통해 OMV의 분리
- 원심 분리기에 반대 튜브의 균형을주의하면서 원심 분리 튜브에 필터링 된 배양 배지를 추가합니다.
- 악기 및 튜브 모두 일치하는 해당 로터를 사용하여 초 원심 분리기에서 4 ° C에서 3 시간 동안 ~ 150,000 XG에 펠렛 사용된다.
- 즉시 완료 오에서의 OMV 펠렛을 방해하지 않도록주의하면서 OMV 펠릿에서 OMV 고갈 문화 매체를 가만히 따르다OMV 복구 저감 펠릿 연화 매체에 남아 있도록 OMV 펠렛을 허용 같은 F 원심.
참고 :이 펠릿은 약간 갈색과 세균 배양의 시작 양에 따라하는 또는 눈으로 볼 수 없습니다 수있을 것입니다. 원심 분리 튜브의 상단에서 직접 미디어를 흡입하는 것은 또한 OMV에서 제거 더 많은 미디어가 최종 OMV 샘플이 될 것입니다 더 순수 펠렛 것을 염두에두고하는 옵션입니다. - OMV 입자가 완전히 미디어에서 고갈되었는지 확인 나중에 동적 광산란 (DLS) 테스트를위한 원심 분리하여 상층 액을 저장합니다.
- 추가가 RT에서 30 분 동안 배양 허용 OMV 펠릿하여 pH 8.0 멸균 여과하고 인산염 완충 식염수 (PBS) pH 7.4의 100 mM의 N 사이클로 헥실 -2- 아미노 에탄 술폰산 (CHES) 버퍼 0.5 ml의. 펠릿 건조하지 않도록하십시오.
참고 : 솔루션 이온 강도, pH를, 및 온도 극단이 감소 OMV 용해도가 발생하고 aggre 촉진 할 수있다gation. - 조심스럽게 용해 된 전체 펠릿을 위해 부드럽게 혼합 원심 분리 튜브로부터 정제 OMV 용액을 피펫.
5. OMV 특성
- OMV 크기 분포 및 입자 농도를 측정하기 위해 각 기기에 고유 제공된 제조사의 프로토콜에 따라 시판 DLS 또는 나노 추적 소프트웨어를 사용한다.
주 : 여기에서, OMV의 크기 분포 및 농도 NanoSight LM10 나노 입자 추적 및 NTA 2.3 분석 소프트웨어를 이용하여 측정 하였다.- 소프트웨어를 엽니 다.
- 현미경을 켜고 현미경과 나노 입자 추적 장치의 모든 표면을 청소합니다.
- ~ 모든 공기를 주입하지 않고 전체 뷰잉 윈도우를 커버해야되는 1 ㎖의 멸균 주사기와 피팅 루어 통해 입자 추적 장치의 뷰잉 윈도우에 직접 OMV 시료 0.5 mL를이 시스템에 거품을 추가한다.
- 장소 t그는 현미경 무대에서 장치를 추적하고 레이저를 켜 나노 입자.
- 소프트웨어에서 "캡처"를 클릭합니다.
- 현미경의 초점을 조절하고 소프트웨어 윈도우의 미리보기 화면에 존재하는 입자를 시각화하는 스테이지.
- 밝은 입자가 명확하게 어두운 배경에 가시화 될 때까지 "카메라 셔터"와 "카메라 이득"을 조정합니다.
- 60 초에 촬영 시간을 조정합니다.
- "기록"을 클릭합니다.
- 입력 샘플 / 소자 온도를 프롬프트 할 때, 샘플을 레이블 및 사용자 지정 폴더에 실행되는 각각의 완료시 상기 비디오 데이터를 저장한다.
- (감지 임계 값은, 흐림, 최소 트랙 길이, 최소 예상 입자 크기) 자동차에이 모드를 감지하고 클릭 모든 분석 매개 변수를 유지 "공정 순서를."
참고 : 각 매개 변수를 미세 조정 분석 결과를 독립적으로 조절할 수있는 방법에 대한 설명서를 참조하십시오. - 기록 입도 분포 및 입자 / m소프트웨어에 의해 결정된 L 농도.
참고 : 전형적인 OMV 유체 역학적 크기 범위는 ~ 10 × 10 (8)의 입자 / ml의 농도 30-200 나노 미터 사이이다.
- OMV의 단백질 함량을 결정
- OMV 순도, 효소 생산 및 SC-ST 가교 효율 7 평가 표준 SDS-PAGE 및 웨스턴 블롯 프로토콜을 사용한다.
참고 : 가교 효율이 100 % 7되지 않습니다.
- OMV 순도, 효소 생산 및 SC-ST 가교 효율 7 평가 표준 SDS-PAGE 및 웨스턴 블롯 프로토콜을 사용한다.
효소 포장 6. 확인
- PTE 활동 분석
- 하나 큐벳에 25 ° C에서 적절한 버퍼와 같은 100 mM의 CHES 완충액 (pH 8) 모든 효소 분석을 수행하거나 384분의 96 웰 플레이트에 다중화.
- 1의 5 μl를 추가 CHES의 90 μl를 정제 OMV의 5 μL에 CHES 버퍼에 paraoxon 1,000 희석 (~ 36 배 배양 배지에 존재하는 OMV 농도에 비해 농축).
주의 : Paraoxon은 독성 농약이다및 제조 업체 및 기관의 지침에 따라 처리해야합니다. - 405 nm에서 일정한 간격으로 흡광도 측정 (~ 2 시간 총 반응 시간 동안 매 20 초)을 가지고 (ε = 18.1 밀리미터 -1 cm -1) 및 348 nm의 (등 흡수 점의 ε = 5.4 밀리미터 -1 cm -1)에의 발색 paraoxon 고장 제품, P는 니트로 페놀의 반응 진행을 모니터링 할 수 있습니다.
참고 : 8 위의 pH 값에서 P는 니트로 페놀의 지배적 인 탈 양성자 형태로 405 nm에서 정확한 모니터링을 가능하게 존재한다. 다른 복잡한 또는 낮은 pH 용액에서 그것은 P 개의 니트로 페놀의 다양한 형태가 존재할 수있는 바와 같이 348 nm 인 등 흡수 점을 활용하는 것이 필요하다. - 각 샘플 포장 효율 및 총 PTE 생산 PTE의 상대적인 양을 비교하는 단계 6.1.3에서 진행 곡선의 직선 부분의 기울기를 결정함으로써 초기 반응 속도를 계산한다.
- 표준 효소를 수행분석 프로토콜은 K M, V 최대를 결정하고 OMV에 대한 K 고양이 PTE를 캡슐화.
참고 : 위버 - 버크 분석이이 운동 매개 변수의 결정에 이용 될 수있는 y 절편 = 1 / V 최대 및 기울기 = K M / V 최대 20.
- 횡단 기판 / 제품 확산.
- 체적 단계 0-3%에서 CHES 완충액 트리톤 X-100의 농도 증가를 이용하여 6.1에서 설명한 것과 동일한 역학적 분석 분석을 수행한다.
주 : OMV 가용화 기능에 트리톤 X-100의 첨가는 OMV의 내용이 반응 용액에 자유롭게 접근 할 수 있도록 허용하는 지질 이중층을 방해. - 계산하고 활성을 I 효소 효소 활성에 비해 최소한의 변화 (초기 속도)에 의해 표시 기판 / 제품의 횡단 통과를 확인하기 위해 각각의 트리톤 X-100 수준에서 초기 속도를 비교할N 트리톤 X-100의 부재. 효소 활성의 상당한 증가는 트리톤 X-100의 존재하에 관찰되는 경우에는, 기판이 자유롭게 OMV에 확산하지 않는 것 같다.
- 이 효소의 활성을 확인하기 트리톤 X-100의 존재하에 분석 자유 효소 활성 (6.1 절에서 설명한 바와 같이) 자체가 계면 활성제에 의해 저해되지 않는다.
참고 : 활동이 크게 트리톤 X-100, 같은 사포닌 또는 다양한 폴리 소르 베이트 등의 다른 첨가제에 의해 영향을 경우 / 트윈 계면 활성제는 OMV 막 파열하는 것이 더 적합 할 수있다.
- 체적 단계 0-3%에서 CHES 완충액 트리톤 X-100의 농도 증가를 이용하여 6.1에서 설명한 것과 동일한 역학적 분석 분석을 수행한다.
7. OMV 저장
- 동결
- 직접 액체 질소로 정제 OMV의 장소 ~ 100 μL 씩 스냅인을 확인 완전히 유리 병을 잠수함 또는 샘플 자체에 액체 질소를 접촉하지되는 분취 량을 동결합니다.
주 : 정제 OMV가 버퍼에 직접 고정 할 수있는 스냅 purificat OMV 중에 펠렛을 용해시켰다 선정7 필요한 추가 cryoprotectants와 이온 과정. - -80 ° C에서 스냅 냉동 분취 량을 저장합니다.
- RT 확실 샘플을 가열하지 않는 것을에서 그들을 배치하여 단계 7.1.1에서 냉동 분취 량을 해동.
- 이러한 방식으로 스토리지의 모든 샘플을 준비하기 전 단계 이전에 초기 속도를 비교 6.1 및 효소 활동 후 동결 융해에 큰 손실이 없음을 확인하기 위해 동결 후 설명 효소 분석을 수행합니다.
참고 : 효소 활성의 감소가 동결로 인해 관찰되는 경우 스토어는 4 ° C에서 OMV를 정제 하였다.
- 직접 액체 질소로 정제 OMV의 장소 ~ 100 μL 씩 스냅인을 확인 완전히 유리 병을 잠수함 또는 샘플 자체에 액체 질소를 접촉하지되는 분취 량을 동결합니다.
- 동결 건조
- 시중에서 판매하는 동결 건조 장비 (21)을 이용하여 스냅 냉동 정제 OMV 씩을 동결 건조.
- 상점은 주 또는 여러 달 동안 -80 ° C에서 RT에서 분취 액을 동결 건조.
- 동결 건조 이전과 동결 건조 OMV에 정제수의 동일한 볼륨을 추가하고 t을 재수 할 실온에서 30 분 동안 서 보자그는 샘플. 필요한 확인되는 경우 와동 또는 OMV를 초음파 처리하지 부드럽게 섞는다.
- 이전에 희석 / 가용화가 필요하지 않은 점의 배려하는 응용 프로그램에 대한 직접 동결 건조 OMV 분말을 추가합니다.
결과
이 프로토콜에 설명 된 OMV 패키징 전략을 필요로 두 가지 재조합 단백질의 동시 발현은 다른 도로의 숫자를 통해 달성 될 수있다. 여기서, 두 벡터 시스템은 복제 분리 유도 유전자 카세트 호환 기원 이용 하였다. PTE-SC의 발현하는 아라비 노스 유도 성 유전자 카세트와 같은 효소 유전자의 클로닝을 용이하게하는 독특한 제한 부위의 시리즈 다음 세포질 파악 리더 서열 아르기닌 트윈을 포함하도록 설계 한 상업적 플라스미드 골격 (pACY184)를 구축 C- 말단 SC 융합 단백질. 외막 앵커 단백질을 코딩하는 플라스미드 구조체는 단백질 발현의 제어와 pelB 세포질 지역화 순서의 락토스 오페론을 이용하는 상업적 벡터 pET22이다. 짧은 ST 서열 INSE 전에 절단하는 OmpA 단백질로 클로닝발현 플라스미드에 rtion. 양 플라스미드에서, C 말단 헥사 히스티딘 서열 OMV 샘플의 융합 단백질의 동시 식별이 가능하도록 유지 하였다. 하는 OmpA에 N-와 C- 터미널 ST 융합 구조 모두를 포함하여이 유전자 구조의 건설 및 특성은 완전히 알베스 등에 설명되어 있습니다. 7. 여기에 설명 된 유전자 구조는 모든 효소의 포장에 도움이되지 않을 수 있습니다. 몇몇 경우에 주변 세포질 이행 시그널의 조절 요소 또는 에피토프 태그를 변경하는 것이 필요할 수있다. 또한, 일부 단백질은 엄청나게 크고 모두 내부 막 횡단하지 못할 수 있습니다. 효소 활성 및 OMV 포장 효율은 선험적으로 결정되지 않을 수 경험적 각 표적 단백질에 대해 결정해야한다.
다음은 성공적으로 수행 오 후 하나가 일반적으로 기대하는 결과는이 프로토콜을 유타. OMV 내의 두 ST / SC 분할 단백질 도메인의 개략적하는 OmpA-ST 및 PTE-SC 융합체가 구축뿐만 아니라, 박테리아 외막의 isopeptide 형성의 예와 PTE-SC 후속 캡슐이 포함되어있다 (도 1) . 또한 대표 SEM을 통해 정제 된 OMV 형태의 결과뿐만 아니라, 크기 분포 및 절대 OMV 농도 입자 추적 소프트웨어를 통해 결정 (그림 2)가 포함되어 있습니다. OMV 단백질 함량 및 재조합 단백질의 발현을 더 특성화 SDS-PAGE 및 웨스턴 블롯 (도 3)를 통해 볼 수있다. 다음과 같이 여기에 제공된 프로토콜에 특정 관심의 단백질 분자량은 다음과 같습니다 네이티브하는 OmpA (37.2 kDa의)하는 OmpA-ST (23 kDa의), PTE-SC (51 kDa의)하는 OmpA-ST / PTE-SC를 (74 kDa의) . 정제 된 OMV는 매우 풍부한 네이티브하는 OmpA 나타내는 어두운 밴드에서 약 37 kDa의를 가져야한다. 겔 해상도에 따라 여러 바이있을 수 있습니다하는 OmpA, OmpF 및 OMPC로 젤이 지역의 NDS 존재하는 모든 상대적으로 풍부하고 유사한 분자량을 공유 할 수 있습니다. 하는 OmpA-ST 또한 의한 대장균 발현 기계 압도의 결과로서 리더 서열의 부적절한 절단 관찰 될 수보다 2.2 kDa의 큰 추가적인 밴드. 또한 성공적으로 정제 OMV 샘플은 많은 다른 고도로 발현 된 단백질이없는 점에 유의하는 것이 중요하다. 다른 밴드가 존재하는 경우에 어느 정제가 잘못 행했다 또는 세균이 대장균 BL21 (DE3) 균주에서 관찰되지 않는 다른 단백질을 포장 할 수있다 이용되는 균주.
또한, 활성 분석 및 소포 파열 실험은 효소 기판 자유롭게 횡단 포린 단백질 (그림 4)를 통해 OMV를 입력 할 경우 예상되는 대표적인 결과를 보여주기 위해 제공되었습니다. Paraoxon 비교적 자유롭게 진입내인성 트랜스 포린 단백질 통해 OMV 또한 OMV 막을 통해 비교적 자유롭게 통과 포장 PTE 반응 생성물 (P)의 니트로 페놀과 반응한다. 이러한 현상은 모든 제품 기판 및 효소의 세트들 유비쿼터스 없으며 실험적으로 결정되어야한다. 성공적인 OMV 파열 및 효소 릴리스 세제 및 PTE (이하 트리톤 X-100)의 낮은 농도로 볼 하였지만, 이러한 추가는 다른 효소의 활성에 영향을 미칠 수 있습니다.
플라스미드 맵은 또한 SC / ST 시스템 (도 5)를 이용하여 두 개의 플라스미드 패키징 전략의 디자인을 설명하기 위해 포함되었다.
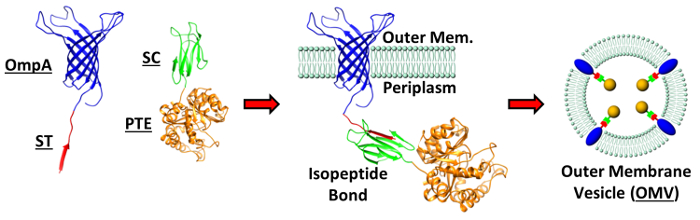
그림 1 : OMV에 단백질의 감독 포장. 상술 OMV 스트랫 포장에 사용되는 단백질의 결정 구조EGY :하는 OmpA, PTE, SpyTag (ST) 및 SpyCatcher (SC) PDB : 2GE4, 1PTA 각각 4MLI, 4MLI. 박테리아의 세포 외막에서 isopeptide 결합을 형성하는 OmpA-ST 및 PTE-SC 융합 구조의 개략도가 도시되어있다. 이 막 융합이 형성 OMV 내에서 PTE의 통합을 구동한다. 알베스 등의 알에서 그림 복제 (개정판). ACS 출원 매트 인터페이스 (2015), 7 (44), PP 24,963-24,972 7. 저작권 2015 미국 화학 학회. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2 : OMV 특성. 초 원심 분리기의 (A) SEM 네이티브 대장균 OMV 정제 [BL21 (DE3)]. (B) 주제 입자 TRAC 킹 크기 분포 및 (C) 총 소포 농도가 샘플 네이티브 OMV, 아라비 활성화 (PTE 아니 A) 아라비 활성화의 존재 PTE가-SC의 부재 PTE-SC에 대한 판독을 90 초 동안의 평균 (PTE-A) , N 말단하는 OmpA-ST 공동 형질 아라비 노스 및 IPTG 활성화 (PTE / OMV-N)의 존재 PTE-SC, 및 초 원심 상청 (UC 상층)과. OMV 생산이 크게 증가 네이티브 OMV와 PTE-SC 단독 구축 비교 PTE / OMV-N 샘플에서 관찰되었다. OMV는 뜨는 포스트 초 원심 분리에없는 OMV에 조금 떠나는 UC 펠릿의 OMV의 거의 완전한 회복을 보여주기 위해 UC의 상층 액을 정량화 하였다. 모든 데이터는 세중의 실험 (SD ±) 수단을 나타냅니다. 알베스 등의 알에서 그림 복제 (개정판). ACS 출원 매트 인터페이스 (2015), 7 (44), PP 24,963-24,972 7. 저작권 2015 미국 화학 학회.D / 54458 / 54458fig2large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3 : 정제 된 OMV 단백질 함량 결정. PTE-SC와 동시 발현 C- 말단하는 OmpA-ST 융합의 정제 OMV UC 펠릿의 (A) SDS-PAGE는 (PTE / OMV는)하는 OmpA-ST, 네이티브하는 OmpA, PTE-SC와 OmpA-의 대표 풍요 로움을 보여주는 구성 ST / PTE-SC isopeptide 융합. (B)를하는 OmpA 및 PTE에 존재하는 자기 - 포함 된 태그를 이용하여 웨스턴 블롯 분석을 방지 6xhis 항체를 통하여 시각화를 용이하게 구성한다. 또한 큰 분자량 그의 태깅 된 종의 존재에 의해 입증 블롯에 PTE가 이량 공지되어 있음에 유의해야한다. 매우 높은하는 OmpA-ST의 발현이 관찰된다하더라도 무료의 완전한 전환이없는막에 PTE-SC는하는 OmpA-ST / PTE-SC를 결합. 이러한 사실에도 불구하고, 전체적인 PTE 생산 향상된 포장 효율의 증가는 공유 결합의 형성은 유비쿼터스 아니지만 명세서 및 SC 도메인의 비공유 연관이 OMV 내의 관한 포장에서 중요한 요소임을 시사한다. 알베스 등의 알에서 그림 복제 (개정판). ACS 출원 매트 인터페이스 (2015), 7 (44), PP 24,963-24,972 7. 저작권 2015 미국 화학 학회. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
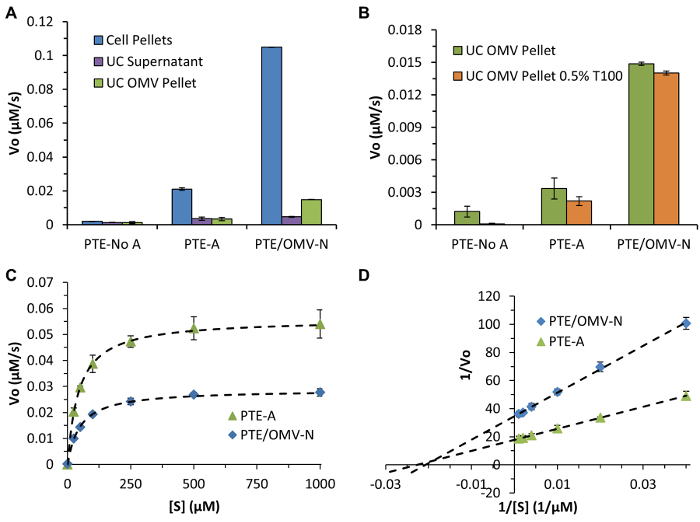
그림 4 : PTE 활동 및 포장의 특성. (A) 전체 PTE 발현 수준과 OMV 포장 효율 항을 이용하여 초기 속도 측정을 통해 결정될옥슨 세포 펠렛의 UC 상층 액에서 PTE 선물을 비교하는 발색 기질, 그리고 정제 된 UC OMV 펠릿있다. (B)을 OMV 내부에 기판의 방해받지 않는 액세스를 허용 OMV 이중층을 방해 트리톤 X-100 (0.5 % T100)의 사용을 보여주는 대표적인 데이터. 효소 초기 속도가 변경되지 않은 경우 T100의 부재 하에서 수행되는 분석이 데이터를 비교하면 그대로 OMV 이중층 걸쳐 기판의 전위의 검증을 용이하게한다. paraoxon의 경우 존재 paraoxon을 OMV에 내인성 세공을 자유롭게 통과 나타내는 T100의 유무를 관찰 거의 활성 차이가 있었다. (C) PTE / OMV-N 및 PTE-A 표준 미카엘리스 - 멘텐 효소 반응 속도 식에 PTE-SC 운동 데이터 맞습니다. (D) K M과 K 고양이 / K M (48 결정에 사용되는 위버 - 버크 분석, 4.4 × 10 7 44 μM, 4.9 X10 7 초 -1 각각 M -1) 천연 효소와 유사한 PTE 문학 운동 매개 변수를 보여 (90 μM, 2.7 × 10 7 초 -1 M-1) 모든 경우에 R 2 ≥ 0.999와. 모든 데이터는 세중의 실험 (SD ±) 수단을 나타냅니다. 알베스 등의 알에서 그림 복제 (개정판). ACS 출원 매트 인터페이스 (2015), 7 (44), PP 24,963-24,972 7. 저작권 2015 미국 화학 학회. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5 : 여기에 설명 된 예 시스템 대표 플라스미드 구조. SpyCatcher 개변 효소-SC (PTE-SC) 플라스미드 OMV (왼쪽) 내에 밀봉 대상. SpyTag modifIED 막 앵커-ST (하는 OmpA-ST-N) 플라스미드 (오른쪽). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
대표적인 방법을 설명하기 위해이 프로토콜 기능은 관심있는 효소를 생산 E. coli에 의해 OMV로 패키징하는 패키징 방법을 지시했다. 많은 복잡한 기술과 같이, 프로토콜은 아래에 설명되는 일부 다른 고유 한 애플리케이션에서 사용하기 위해 수용하도록 변형 될 수있는 복수의 영역이있다. OMV 포장 및 효소 캡슐의 메커니즘은 특정 요구에 적용 할 수있는 반면 성공에 중요한이 프로토콜 내에서 몇 가지 단계가 있습니다. 그대로 세균 및 세포 파편의 초기 제거는 크게 중요하고 정량 또는 샘플 분석에서 모든 다운 스트림 시도에 영향을 미칠 것입니다. 여과 한 다음 두 개의 연속 원심 분리 단계에서는 이러한 오염 물질을 제거 할 수있는 일반적으로 적절하다. 경사 솔루션은 원심 분리 후 오염 물질의 전달을 최소화 할 때, 모든 인스턴스 관리에주의해야한다. 유사하게, 최종 OMV 펠릿 Obtained 다음 초 원심 분리는 종종 느슨하게 원심 관의 바닥에 부착된다. 펠렛이 상기 용기의 바닥에 방해받지 않고 유지되도록 폐 배지를 제거 할 때 마지막 단계에서,주의를 기울여야한다. 몇몇 경우에 그것은 프로토콜의 최종 단계에서 손실되지 않은 OMV 펠렛을 위해 DLS 또는 나노 추적 장치를 이용한 시료 분석 전까지 최종 배양액을 유지하는 것이 가장 수있다. 아래는 연구자의 특정 요구에 맞는 특정 프로토콜과 다른 사람 모두 발생할 수있는 몇 가지 추가 우려가 있습니다.
이 시스템 PTE의 사용은 PTE는 다른 효소 또는 관심의 단백질에 의해 쉽게 교체 할 수있는과 유기 인계 오염 지역의 환경 개선을위한 훌륭한 모델 효소 캡슐을 제공한다. 여기에 설명 된 바와 같이하는 OmpA-ST와 PTE-SC의 동시 발현은 전체 PTE의 expressi에 큰 증가 하였다뿐 아니라 더 높은 PTE와 소포 생산량은 PTE 단독 발현 PTE-SC에 비해 소포 내에 포장된다. 로 ompA 하이퍼 수포의 C 말단 결실을 통해 외막과 펩티도 글리 칸 사이의 상호 작용의 수를 감소시킴으로써 달성된다. 이 박테리아는 종종 비 네이티브 단백질의 과발현에서 관찰 된 독성을 완화 재조합 PTE를 내보낼 수있는 쉬운 경로를 제공합니다.
PTE 용이 모델 시스템으로 대체 될 수 있지만, 이는 모든 효소 기질 자유롭게 OMV 이중층 통과 점에 유의하는 것이 중요하며 각각의 고유 효소 및 기질 쌍은 사례별로 테스트되어야하므로 필수적이다. 막을 통해이 기술을 통과하지 않는 기판이 여전히 생산 OMV에 효소 및 트리톤 X-100을 첨가하거나, 다른 적절한 계면 활성제를 패키징하는 데에 이용 될 수있다하더라도, 충분한 르 첨가 될 수있다VELS는 사용하기 전에 소포를 파열합니다.
재조합 단백질의 발현 및 포장이없는 경우,이 프로토콜은 다양한 박테리아 종으로부터 OMV 생산 및 정제를위한 기본적인 방법이 될 수있다. 이러한 밀도 구배 분획 (22), 막 여과 (23) 울트라 여과 24 OMV 정화용 다른 방법이 또한 존재하며, 의도 된 용도에 따라보다 적합한 기술 일 수있다. 이러한 다른 정제 기술은 용이하게 합성 biorthogonal 링크 사용을 통해 OMV에 단백질 관한 포장용 OMV의 초 원심 펠렛 대신에,이 프로토콜로 보충 될 수있다.
다른 변형이 프로토콜뿐만 아니라 선택된 더링 막 단백질에 사용되는 특정 합성 연동 시스템에 이루어질 수있다. 페어링 두 개의 서로 다른 단백질에 대한 다양한 합성 전략이있다포함 생물학적 시스템 내에서의 : 분할 단백질 (25), 코일 코일 (26), 및 분할 inteins (27)는 몇 가지를 나열합니다. 이러한 OmpF 및 OMPC 같은 다른 막 결합 또는 횡단 단백질은 가능성이 적합 ST 수정 사이트뿐만 아니라 28 제공한다. 어떤 경우에는 또한 재조합 효소 / 단백질에 ST와 고정 단백질의 SC 배치 SC 도메인 및 훨씬 작은 ST를 교환 할 필요가있다. 동일하거나 상이한 유도 시스템으로 여러 플라스미드의 사용을 포함하여 여기에서 구현 될 수있는 다른 클로닝 전략의 수는 있는데, 여러 단백질 단일 플라스미드 부호화, 또는 식의 상동 재조합을 모두 포함하는 기술 또는 부품을 이용하여 박테리아 게놈에 시스템.
OMV의 미세 일반적 이상적 일 미만에서 발생 효소의 불 활성화를 감소시키는 포장 효소를 안정화하는데 도움orage 조건, 동결 해동 및 동결 건조 29. 또한 OMV 이중층 활성 효소 및 엑스트라 OMV 공간에 존재하는 단백질들 사이의 물리적 인 장벽으로서 기능 할 것 같은 단백질 분해 절단 OMV가 크게 개선 된 내성을 제공 할 것으로 예상된다. 이 프로토콜은 또한 OMV 캡슐화 된 단백질 및 친 화성 정제의 표적 전달을 용이하게하기 위해 외부 대향 소분자, 펩티드, 단백질 또는 태그를 포함하도록 확장 될 수있다. PTE가이 응용 프로그램 고유 선정되었지만,이 프로토콜이 연구의 결과 및 컨텐츠를 쉽게 다양한 약제 전달에 사용하기위한 유사 단백질 패키징 전략을 설계하는데 이용 될 수있다, 진단 의료 및 환경 개선 프로그램 30.
공개
저자는 공개 아무것도 없어.
감사의 말
This research was funded by the Office of Naval Research through Core funds provided to the Naval Research Laboratory.
자료
| Name | Company | Catalog Number | Comments |
| IPTG | Any | Always prepare fresh or aliquot and freeze. | |
| L-arabinose | Any | Can be prepared ahead of time and stored at 4 °C. | |
| Ampicillin | Any | Add immediately prior to use after media cools sufficiently from being autoclaved. | |
| Chloramphenicol | Any | Add immediately prior to use after media cools sufficiently from being autoclaved. | |
| TB/LB Culture Media | Any | Other growth medias will likely work similarly. | |
| Triton X-100 | Any | One of many potential suitable surfactants. | |
| Baffled culture flasks | Any | The baffles promote higher levels of aeration. | |
| CHES | Fisher Bioreagents | BP318-100 | Optimal buffer used for paraoxon degredation (pH > 8). |
| Paraoxon | Chem Service | N-12816 | Very toxic substance to be handled carefully and disposed of properly. |
| Syringe Filter 0.45 µm | Thermo Scientific | 60183-221 (30 mm) | Filter diameter will depend on volume of sample. Low protein binding membrane is critical. |
| Shaker incubator | New Brunswick | Excella E24 | Precise temperature and mixing is essential for reproducable bacterial growth. |
| Sorvall Culture Centrifuge | Thermo Scientific | RC 5B PLUS | Large volume (500 ml) culture centrifuge capable of 7,000 x g. |
| Sorvall Ultracentrifuge | Thermo Scientific | WX Ultra 90 | Capable of centrifugal forces ≥150,000 x g. |
| Ultracentrifuge Rotor | Thermo Scientific | AH-629 | Ensure the proper rotor and tubes are used and that everything is properly balanced. |
| Ultra-Clear Ultracentrifuge Tubes (25 x 89 mm) | Beckman Coulter | 344058 | Ensure no stress fractures are present prior to use and that tubes are presicely balanced. |
| Spectrophotometer | Tecan | Infinite M1000 | Necessary for enzyme kinetic assays. |
| DLS/particle tracking | NanoSight | LM10 | Necessary for OMV size distribution and concentration determination. |
| BL21(DE3) | NEB | Suitable bacterial expression strain. | |
| pET22 | EMD Millipore | 69744-3 | Other plasmids can be used in place of these. |
| pACYC184 | NEB | Other plasmids can be used in place of these. | |
| Gel Extraction Kit | Qiagen | 28704 | Example kit. |
참고문헌
- Avila-Calderon, E. D., et al. Roles of bacterial membrane vesicles. Arch. Microbiol. 197, 1-10 (2015).
- Kulp, A., Kuehn, M. J. Biological functions and biogenesis of secreted bacterial outer membrane vesicles. Annu. Rev. Microbiol. 64, 163-184 (2010).
- Beveridge, T. Structures of Gram negative cell walls and their derived membrane vesicles. J. Bacteriol. 181, 4725-4733 (1999).
- Kulkarni, H. M., Jagannadham, M. V. Biogenesis and multifaceted roles of outer membrane vesicles from Gram-negative bacteria. Microbiology. 160, 2109-2121 (2014).
- Ellis, T. N., Kuehn, M. J. Virulence and immunomodulatory roles of bacterial outer membrane vesicles. Microbiol. Mol. Biol. Rev. 74, 81-94 (2010).
- Berleman, J., Auer, M. The role of bacterial outer membrane vesicles for intra- and interspecies delivery. Environ. Microbiol. 15, 347-354 (2013).
- Alves, N. J., et al. Bacterial nanobioreactors-directing enzyme packaging into bacterial outer membrane vesicles. ACS Appl. Mater. Interfaces. 7, 24963-24972 (2015).
- Kim, J. Y., et al. Engineered bacterial outer membrane vesicles with enhanced functionality. J. Mol. Biol. 380, 51-66 (2008).
- Haurat, M. F., et al. Selective sorting of cargo proteins into bacterial membrane vesicles. J. Biol. Chem. 286, 1269-1276 (2011).
- Kesty, N. C., Kuehn, M. J. Incorporation of heterologous outer membrane and periplasmic proteins into Escherichia coli outer membrane vesicles. J. Biol. Chem. 279, 2069-2076 (2003).
- Zakeri, B., et al. Peptide tag forming a rapid covalent bond to a protein, through engineering a bacterial adhesion. Proc. Natl. Acad. Sci. U. S. A. 109, e690-e697 (2012).
- Li, L., Fierer, J. O., Rapoport, T. A., Howarth, M. Structural analysis and optimization of the covalent association between SpyCatcher and a peptide tag. J. Mol. Biol. 426, 309-317 (2014).
- Dumas, D. P., Durst, H. D., Landis, W. G., Raushel, F. M., Wild, J. R. Inactivation of organophosphorus nerve agents by the phophotriesterase from Pseudomonas-Diminuta. Arch. Biochem. Biophys. 277, 155-159 (1990).
- Bigley, A. N., Raushel, F. M. Catalytic mechanisms for phosphotriesterases. Biochimica et Biochim. Biophys. Acta, Proteins Proteomics. 1834, 443-453 (2013).
- Minton, N. A., Murray, V. S. G. A review of organo-phosphate poisoning. Med. Toxicol. Adverse Drug Exper. 3, 350-375 (1988).
- Bigley, A. N., Xu, C., Henderson, T. J., Harvey, S. P., Raushel, F. M. Enzymatic neutralization of the chemical warfare agent VX: Evolution of phosphotriesterase for phosphorothiolate hydrolysis. J. Am. Chem. Soc. 135, 10426-10432 (2013).
- Chatterjee, S. N., Chaudhuri, K. Gram-negative bacteria: the cell membranes. Outer Membrane Vesicles of Bacteria. SpringerBriefs in Microbiology. , 15-34 (2012).
- Wang, Y. The function of OmpA in Escherichia coli. Biochem. Biophys. Res. Commun. 292, 396-401 (2002).
- Danoff, E. J., Fleming, K. G. The soluble, periplasmic domain of OmpA folds as an independent unit and displays chaperone activity by reducing the self-association propensity of the unfolded OmpA transmembrane beta-barrel. Biophys. Chem. 159, 194-204 (2011).
- Alves, N. J., Kline, J. A. Comparative study on the inhibition of plasmin and delta-plasmin via benzamidine derivatives. Biochem. Biophys. Res. Commun. 457, 358-362 (2015).
- Wang, W. Lyophilization and development of solid protein pharmaceuticals. Int. J. Pharm. 203, 1-60 (2000).
- Goormaghtigh, E., Scarborough, G. A. Density-based separation of liposomes by glycerol gradient centrifugation. Anal. Biochem. 159, 122-131 (1986).
- Alves, N. J., et al. Functionalized liposome purification via Liposome Extruder Purification (LEP). Analyst. 138, 4746-4751 (2013).
- Mayer, L. D., StOnge, G. Determination of free and liposome-associated doxorubicin and vincristine levels in plasma under equilibrium conditions employing ultrafiltration techniques. Anal. Biochem. 232, 149-157 (1995).
- Blakeley, B. D., Chapman, A. M., McNaughton, B. R. Split-superpositive GFP reassembly is a fast, efficient, and robust method for detecting protein-protein interactions in vivo. Mol. BioSyst. 8 (2036), (2012).
- De Crescenzo, G., Litowski, J. R., Hodges, R. S., O'Connor-McCourt, M. D. Real-time monitoring of the interacation of two-stranded de novo designed coiled-coils: effect of chain length on the kinetic and thermodynamic constants of binding. Biochemistry. 42, 1754-1763 (2003).
- Charalambous, A., Antoniades, I., Christodoulou, N., Skourides, P. A. Split-Intein for simultaneous site-specific conjugation of quantum dots to multiple protein targets in vivo. J. Nanobiotechnol. 9, 1-14 (2011).
- Lee, E. Y., et al. Global proteomic profiling of native outer membrane vesicles derived fromEscherichia coli. Proteomics. 7, 3143-3153 (2007).
- Alves, N. J., Turner, K. B., Medintz, I. L., Walper, S. A. Protecting enzymatic function through directed packaging into bacterial outer membrane vesicles. Sci. Rep. 6, 24866 (2016).
- Alves, N. J., Turner, K. B., Medintz, I. L., Walper, S. A. Emerging therapeutic delivery capabilities and challenges utilizing enzyme/protein packaged bacterial vesicles. Ther. Delivery. 6, 873-887 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유