Method Article
Packaging proteine diretto all'interno della membrana esterna vescicole da
In questo articolo
Riepilogo
A protocol for the production, purification, and use of enzyme packaged outer membrane vesicles (OMV) providing for enhanced enzyme stability for implementation across diverse applications is presented.
Abstract
Un crescente interesse per l'applicazione di tecniche di biologia sintetica per programmare vescicole membrana esterna (OMV) stanno portando ad alcune applicazioni molto interessanti e uniche per OMV in cui le nanoparticelle tradizionali si stanno rivelando troppo difficili da sintetizzare. Ad oggi, tutti i batteri Gram-negativi hanno dimostrato di produrre OMV confezionamento dimostrazione di una varietà di carico che comprende piccole molecole, peptidi, proteine e materiale genetico. Sulla base della loro diversa carico, OMV sono implicati in molti processi biologici che vanno dalla comunicazione cellulare per il trasferimento genico e consegna dei fattori di virulenza seconda di quale batteri producono l'OMV. Solo di recente sono batterica OMV diventati accessibili per l'uso in una vasta gamma di applicazioni attraverso lo sviluppo di tecniche per il controllo e il confezionamento diretta di proteine ricombinanti in OMV. Questo protocollo descrive un metodo per la produzione, purificazione, e l'uso di enzima confezionato OMV prevede migliorata overala produzione ll di enzima ricombinante, aumento vescicole, e una maggiore stabilità dell'enzima. utilizzazione di successo di questo protocollo comporta la creazione di un ceppo batterico che produce contemporaneamente una proteina ricombinante e la dirige per OMV incapsulamento attraverso la creazione di un collegamento sintetica tra la proteina ricombinante e una proteina della membrana esterna di ancoraggio. Questo protocollo dettagli anche i metodi per isolare OMV da colture batteriche così come le tecniche di manipolazione e cose da considerare quando si adattare questo protocollo per l'uso per altre applicazioni uniche quali: la consegna della droga farmaceutica, diagnostica medica e risanamento ambientale.
Introduzione
Qui presentata è un metodo per la progettazione, produzione e purificazione di vescicole enzimi batterici caricato membrana esterna (OMV). OMV sono piccole, soprattutto unilamellare, proteoliposomi che variano nel formato 30-200 nm 1,2. Tutti i batteri Gram-negativi e Gram-positivi che sono stati studiati fino ad oggi hanno dimostrato rilascio di una OMV o vescicole extracellulari (EV) dalla loro superficie 3,4. Il meccanismo preciso con cui sono prodotti OMV devono ancora essere completamente chiarito causa delle diverse popolazioni batteriche che loro così come le funzioni diverse che servono secernono. OMV hanno dimostrato di trasportare una vasta gamma di carico da piccole molecole, peptidi e proteine di materiale genetico serve una varietà di segnalazione complesso, gene traslocazione, e virulenza FUNZIONI 5,6.
I meccanismi esatti di OMV biogenesi non sono ben caratterizzati, e sembrano differire tra le specie batteriche. nonostante this Infatti, abbiamo sviluppato un metodo per migliorare l'efficienza di confezionamento di una proteina ricombinante in OMV creando un legame sintetico tra una proteina di interesse e altamente abbondante endogena proteina alla membrana esterna batterica e successiva OMV. In assenza di un legame sintetico, o di affinità artificialmente incorporato, tra la proteina ricombinante espressa e la OMV l'efficienza confezione osservato è molto basso 7. Questo risultato è prevedibile come l'incorporazione delle proteine all'interno della OMV sia avviene attraverso l'incapsulamento casualità nel momento preciso della formazione OMV in superficie batterica o attraverso il packaging diretto da meccanismi che non sono ben compresi. Qualche successo è stato osservato nel confezionamento proteine semplicemente attraverso sovraespressione nello spazio periplasmatico che si basa su incapsulamento casualità ma efficace imballaggio è altamente proteina dipendente con alcune proteine Confezioni ad alta efficienza rispetto ad altri tha non comprimere affatto 8-10. Utilizzando le tecniche comuni di biologia sintetica abbiamo cercato di progettare Escherichia coli (E. coli) per produrre contemporaneamente, pacchetto e secernere un enzima attivo di interesse in OMV che aggira le limitazioni attuali conoscenze su come si formano e come OMV carico viene selezionato dai batteri per confezionamento.
Ai fini della presente domanda, un sistema di proteine bioconjugation scaglionato è stato selezionato come il legame sintetici di scelta per facilitare confezionamento direzionale nel OMV. Come suggerisce il nome un sistema proteico bioconjugation scissione comprende due domini subunità complementari che interagiscono tra loro. I domini di proteine spaccatura selezionati ai fini del presente protocollo sono indicati come la SpyCatcher (SC) e SpyTag dominio (ST) e sono derivati dal Streptococcus pyogenes fibronectina-binding protein (FbaB) 11. Questo sistema proteina spaccatura è insolito in quanto wgallina le due subunità sono all'interno di prossimità un legame isopeptide forma spontaneamente tra la prossimale aspartico residui acidi acidi e lisina aminoacidi che creano un legame covalente. Formazione del legame Isopeptide non richiede l'aggiunta di proteine chaperone, enzimi catalitici o cofattori e può verificarsi facilmente a temperatura ambiente (RT) e su un ampio intervallo di condizioni fisiologicamente rilevanti 12.
Come prova di concetto, phosphotriesterase (PTE) (CE 3.1.8.1) dal Brevundimonas minuto è stato scelto per essere confezionato in E. coli derivati OMV 13. PTE contiene un sito attivo binuclear Zn / Zn e ha la capacità di abbattere organofosfati attraverso una reazione di idrolisi conversione aryldialkylphosphates in dialkylphosphates e alcoli arilici 14. L'esposizione a organofosfati compromette il corretto funzionamento dei neurotrasmettitori attraverso inibendo l'idrolisi di acetilcolina da acetilcolinesterasi alle giunzioni neuromuscolari makincomposti derivati g organofosfati estremamente pericolose 15. Prolungata o significativa esposizione a organofosfati si traduce spesso in preda a convulsioni incontrollabili e di solito provoca la morte tramite asfissia. Mentre PTE presenta la più alta attività catalitica verso paraoxon, un insetticida molto potente, è anche in grado di idrolizzare una vasta gamma di altri pesticidi e V / tipo G agenti nervini chimici 16. Per facilitare confezionamento OMV, un plasmide batterico creata che codifica un costrutto genico che contiene un promotore inducibile, una sequenza di localizzazione periplasmatica, ea breve polylinker monte della sequenza SC gene. Inserimento del gene PTE tra il leader e la sequenza SC permette la creazione di un interruttore genetico che colpisce la proteina di fusione PTE-SC allo spazio periplasmatico per imballaggi OMV. Mentre gli sforzi descritti qui concentrano sulla PTE, il gene dell'enzima è intercambiabile e può essere facilmente sostituita con un'altra sequenza genica a FACconfezionamento ilitate di un enzima alternativo o proteine.
Come la seconda parte del collegamento sintetico, viene scelto per presentare la sequenza peptidica ST un'abbondante proteina della membrana esterna (OmpA). Mentre la scelta di proteine di ancoraggio può variare, è essenziale che la proteina ha un dominio permissiva che presenta all'interno dello spazio periplasmatico, tollera il costrutto di fusione senza indurre citotossicità, è noto per essere presente in OMV, e non aggrega quando è ricombinante prodotta. OmpA è un kDa proteina transmembrana 37,2 porin che è noto per essere altamente espresso nella membrana esterna batterica e conseguente OMV 17. Si è implicato nel trasporto di piccole molecole, <2 nm in termini di dimensioni, attraverso la membrana batterica 18. Native OmpA ha due domini strutturalmente unici, un barile motivo transmembrana beta e una porzione C-terminale periplasmically solubile noto per interagire con il peptidoglicano 19. Nel mutante OmpA-ST fusione designed qui la porzione C-terminale della OmpA stato eliminato e la ST è stata fusa alla periplasmically fronte N- o C-Termini. Eliminare la parte periplasmic del OmpA diminuisce il numero di interazioni tra la membrana esterna e il peptidoglicano con conseguente destabilizzazione della membrana che porta a iper-vescicole 7. Genomic OmpA stata mantenuta in aggiunta al costrutto OmpA-ST ricombinante espressa per mitigare destabilizzazione membrana lordo.
Protocollo
1. Preparazione di plasmidi
- Preparare un plasmide (ad esempio, pET22) contenente la proteina di ancoraggio (OmpA) fusa a un dominio di legame biortogonale (di cui al presente protocollo come anchor-ST), tag epitopo (come 6xHis, myc o la bandiera tag per la purificazione e identificazione), tag periplasmic localizzazione, la resistenza agli antibiotici, e l'origine appropriata di replica in base al ceppo batterico selezionato 7.
- Estrarre il DNA plasmide da culture durante la notte utilizzando un kit di isolamento del DNA disponibile in commercio seguendo il protocollo del produttore.
- Preparare un plasmide (ad esempio, pACYC184) contenente l'enzima / proteine (PTE) da confezionare all'interno della OMV fusa al dominio di legame bioorthogonal complementare a quella della proteina di ancoraggio (denominato nel presente protocollo come enzima-SC), epitopo, tag periplasmic localizzazione, la resistenza agli antibiotici che è diverso da quello del plasmide proteine di ancoraggio, e orig appropriatain di replica basata sul ceppo batterico selezionato 7.
- Estrarre il DNA plasmide da culture durante la notte utilizzando un kit di isolamento del DNA disponibile in commercio seguendo il protocollo 7 del produttore.
2. Generazione di un OMV Packaging E. coli Cultura
- Isolamento plasmidi
- Purificare plasmidi che codificano l'enzima-SC costruire ed ancoraggio-ST costruisce da linee cellulari di manutenzione separati utilizzando un kit di isolamento plasmide commerciale come da protocollo 7 del produttore. Determinare la concentrazione di DNA e la purezza misurando l'assorbanza a 260 nm e 280 nm.
- Co-trasformazione
- Selezionare un ceppo di E. coli che è disponibile in commercio per facilitare l'espressione delle proteine.
NOTA: BL21 cellule (DE3) sono stati utilizzati qui. Il lysogen T7 è necessaria per l'espressione del costrutto ancoraggio-ST, che si basa sul promotore T7 e T7 RNA polimerasi per protespressione ein. L'uso di altri ceppi batterici richiede o la presenza del gene lysogen T7 o l'uso di un plasmide diverso pET22 7. - Diluire purificato DNA plasmidico a concentrazioni molari equivalenti poi trasformarle in cellule batteriche competenti tramite uno shock termico trasformazione o elettroporazione seguenti protocollo del produttore per le cellule competenti scelti.
- cellule piastra trasformato Onto antibiotico contenente Luria-Bertani (LB) piastre di agar sia con ampicillina (pET22) e cloramfenicolo (pACYC184); entrambi presenti a concentrazioni finali di 25 ug / ml.
- Porre la capsula cultura a 37 ° C durante la notte per isolare solo i cloni che contengono entrambi i plasmidi.
NOTA: Le colonie che sopravvivono selezione antibiotica saranno utilizzati per tutti i futuri preparati OMV. Antibiotici (ampicillina e cloramfenicolo) saranno aggiunti a tutti colture liquide per mantenere la pressione selettiva e garantire la presenza di entrambi i plasmidi.
- Selezionare un ceppo di E. coli che è disponibile in commercio per facilitare l'espressione delle proteine.
3. OMV Produzione
- Colony espansione
- Seminare 5 ml di terreni di coltura (tipicamente Brodo Terrific (TB) o LB) contenenti antibiotici alle concentrazioni di cui sopra (punto 2.2.3) con una singola colonia dalle piastre di selezione descritti al punto 2.2.4.
- Eseguire una diluizione 1: 100 volte della coltura starter durante la notte in fiasche di coltura sconcertato.
NOTA: utilizzare un volume di file multimediali tra 250-500 ml. - Mantenere la coltura a 37 ° C agitando a 250 rpm per garantire che sufficiente aerazione della cultura è raggiunto.
- Induzione di ogni plasmide
- Lasciare che la coltura batterica a crescere ad un OD 600 di 0,6-0,8, a circa 3 ore di crescita dopo l'inoculazione del pallone di crescita primario.
- Per migliorare la resa finale del PTE-SC vescicole caricate, centrifugare l'intera cultura a 7.000 xg per 15 min. Risospendere il pellet di cellule in pre-riscaldato, terreni di coltura fresco.
NOTA: Questo optionale passaggio consente di rimuovere qualsiasi OMV vuoto che sono presenti nel terreno di coltura prima dell'induzione PTE-SC. - Ottenere una soluzione stock al 20% di L-arabinosio in acqua e filtro sterile utilizzando un filtro di 0,22 micron. Conservare la soluzione L-arabinosio a 4 ° C per 2-4 settimane.
- Aggiungere la soluzione L-arabinosio al pallone di coltura ad una concentrazione finale dello 0,2% di avviare la produzione PTE-SC.
NOTA: Questo aiuta a precaricare spazio periplasmatico con PTE-SC prima di promuovere una maggiore vescicolazione attraverso l'induzione del mutante OmpA-ST. - Fare una soluzione 1 M isopropil β-D-1-thiogalactopyranoside (IPTG) in acqua e filtro sterile utilizzando un filtro di 0,22 micron.
NOTA: IPTG deve essere utilizzato immediatamente una volta idratato. Aliquote di IPTG possono essere conservati congelati per 3-6 mesi e possono essere scongelati immediatamente prima dell'uso. - Aggiungere IPTG dopo un ulteriore periodo di incubazione 3 ore ad una concentrazione finale di 0,5 mM di avviare la produzione del OmpA-ST.
- Lasciare che il culture a crescere per un ulteriore 8-14 ore a 37 ° C sotto agitazione.
4. OMV Purificazione
- Rimozione dei batteri Intact
- Centrifugare terreni di coltura batterica per 15 min a 7000 xga 4 ° C per sedimentare batteri intatti.
- Decantare, e salvare, i media la parte superiore del post centrifugazione pellet cellulare facendo attenzione a non disturbare il pellet.
- Ripetere i punti 4.1.1 e 4.1.2 per un ciclo di centrifugazione ulteriore per garantire tutti i batteri intatti vengono rimossi dal terreno di coltura avendo cura di decantare e salvare i media.
- La rimozione di aggregati proteici
- Ulteriori purificare il terreno di coltura batterica usando un filtro da 0,45 micron a membrana per rimuovere batteri residui e grande materiale cellulare indesiderato.
NOTA: utilizzare un materiale a membrana biologicamente compatibile per i recuperi più elevati e minore assorbimento di proteine, come acetato di cellulosa (CA) o polivinilidene difluoruro (PVDF). volumi filtri Siringa meno di 100 ml e volumi filtra sotto vuoto superiore a 100 ml.- Per il filtro della siringa, disegnare terreno di coltura in siringa sterile 10-50 ml. Fissare 0,45 micron filtro per Luer fine della siringa. Premere stantuffo e raccogliere flusso continuo in una nuova nave.
- Per aspirare il filtro, il trasferimento terreno di coltura ad un apparato di filtrazione sterile. Fissare unità a vuoto della pompa o affondare aspiratore per generare aspirazione. Trasferimento medio filtrata a nuova nave.
- Ulteriori purificare il terreno di coltura batterica usando un filtro da 0,45 micron a membrana per rimuovere batteri residui e grande materiale cellulare indesiderato.
- Isolamento di OMV via Ultracentrifugazione
- Aggiungere il terreno di coltura filtrato in tubi centrifugazione facendo attenzione a bilanciare i tubi opposte nella centrifuga.
- Pellet a ~ 150.000 xg per 3 ore a 4 ° C in un'ultracentrifuga utilizzando il rotore corrispondente corrispondenza dello strumento e tubi essendo utilizzata.
- Decantare il terreno di coltura impoverito OMV dal pellet OMV, facendo attenzione a non disturbare il pellet OMV, immediatamente al completamento of centrifugazione a consentire il pellet OMV rimanere nei media ammorbidire il pellet riducendo recupero OMV.
NOTA: Questo pellet sarà leggermente marrone e seconda della quantità di partenza di coltura batterica può o non può essere visibile ad occhio. Aspirare il supporto direttamente dalla parte superiore del tubo di centrifugazione è anche un'opzione tenendo presente che i media più rimossi dal OMV pellet più pura campione finale OMV sarà. - Salvare il surnatante centrifugato per la prova successiva Dynamic Light Scattering (DLS) per verificare che le particelle OMV sono state completamente esaurite da parte dei media.
- Aggiungere 0,5-1 ml di soluzione sterile a pH 7,4 o 100 mM N -Cyclohexyl-2-aminoethanesulfonic tampone filtrata tampone fosfato (PBS) Acido (CHES) a pH 8,0 al pellet OMV permettendogli di incubare per 30 minuti a RT. Assicurarsi che il pellet non si asciughi.
NOTA: Gli sbalzi di soluzione forza ionica, il pH e la temperatura può causare ridotta solubilità OMV e promuovere aggregazione. - pipetta con attenzione la soluzione purificata OMV dalla provetta, mescolando delicatamente per garantire l'intero pellet è stato solubilizzato.
5. OMV Caratterizzazione
- Utilizzare qualsiasi software DLS o di monitoraggio nanoparticelle disponibile in commercio seguendo i protocolli del produttore fornito uniche per ogni strumento per determinare la distribuzione delle dimensioni OMV e concentrazione di particelle.
NOTA: Qui, distribuzione delle dimensioni OMV e la concentrazione è stata determinata utilizzando NanoSight LM10 nanoparticelle di monitoraggio e NTA 2.3 Software di analisi.- Aprire il software.
- Accendere il microscopio e pulire tutte le superfici dell'unità microscopio e il monitoraggio delle nanoparticelle.
- Aggiungere ~ 0,5 ml di OMV campione direttamente alla finestra di visualizzazione del dispositivo di tracciamento di particelle attraverso il raccordo Luer con 1 ml siringa sterile avendo cura di coprire l'intera finestra di visualizzazione senza iniettare eventuali bolle d'aria nel sistema.
- luogo tegli nanoparticelle unità di monitoraggio sul palco microscopio e accendere il laser.
- Fai clic su "Capture" nel software.
- Regolare il fuoco microscopio e mettere in scena per visualizzare le particelle sullo schermo di anteprima presente nella finestra del software.
- Regolare il "Shutter" e "guadagno della telecamera" fino a quando le particelle brillanti sono chiaramente visualizzati su uno sfondo scuro.
- Regolare la durata di cattura per 60 sec.
- Fai clic su "Record".
- Quando richiesto, immettere la temperatura del / dispositivo campione, etichettare il campione, e salvare i dati video al termine della ciascuna correre in una cartella utente designato.
- Tenere tutti i parametri di analisi (Rilevazione soglia, Blur, lunghezza minima traccia, Min atteso Particle Size) su auto modalità di rilevamento e cliccare su "svolgimento del processo."
NOTA: Consultare il manuale per come ogni parametro può essere regolato in modo indipendente per fini risultati delle analisi sintonia. - Record distribuzione granulometrica e particelle / mconcentrazione l come determinato dal software.
NOTA: Una tipica gamma di dimensioni idrodinamica OMV è compresa tra 30-200 nm con una concentrazione di particelle / ml di ~ 10 x 10 8.
- Determinazione OMV contenuto proteico
- Utilizzare SDS-PAGE e protocolli standard Western Blot per valutare la purezza OMV, la produzione di enzimi, e l'efficienza di reticolazione SC-ST 7.
NOTA: La reticolazione efficienza non sarà al 100% 7.
- Utilizzare SDS-PAGE e protocolli standard Western Blot per valutare la purezza OMV, la produzione di enzimi, e l'efficienza di reticolazione SC-ST 7.
6. Verifica di Enzyme Packaging
- PTE Activity Assay
- Eseguire tutti saggi enzimatici in un tampone adatto ad esempio 100 mM CHES tampone (pH 8) a 25 ° C sia in una cuvetta o multiplato in un piatto ben 96/384.
- Aggiungere 5 ml di una diluizione 1: 1.000 in tampone paraoxon CHES a 90 ml di CHES e 5 ml di purificato OMV (~ 36 volte concentrato rispetto alla concentrazione OMV presente nei mezzi di coltura).
Attenzione: Paraoxon è un pesticida tossicoe deve essere gestito per produttore e linee guida istituzionali. - Le letture di assorbanza a intervalli regolari (ogni 20 sec per ~ tempo di reazione totale di 2 ore) a 405 nm (ε = 18.1 mM -1 cm -1) e a 348 nm (ε punto isosbestic = 5.4 mM -1 cm -1) monitorare la progressione della reazione il prodotto guasto paraoxon cromogenico, p -nitrophenol.
NOTA: A valori di pH superiore a 8 è presente la forma deprotonato dominante di p -nitrophenol consentendo accurato monitoraggio a 405 nm. In tutte le altre soluzioni pH complessa o inferiore è necessario utilizzare il punto isosbestico di 348 nm come molteplici forme di p -nitrophenol saranno presenti. - Calcolare velocità di reazione iniziali determinando la pendenza della porzione lineare delle curve progressi dal punto 6.1.3 di confrontare in ciascun campione, efficienza confezionamento e produzione totale PTE la quantità relativa di PTE.
- Eseguire enzimatica di serieprotocolli di analisi per determinare K M, V max e K gatto per la OMV incapsulati PTE.
NOTA: un'analisi Lineweaver-Burk può essere utilizzato per la determinazione di questi parametri cinetici dove l'intercetta = 1 / V max e pendenza = K M / V max 20.
- Transmembrane substrato / diffusione del prodotto.
- Eseguire la stessa analisi analisi cinetica come descritto al punto 6.1 utilizzando concentrazioni crescenti di Triton X-100 in tampone CHES da 0-3% in volume.
NOTA: L'aggiunta di Triton X-100 per le funzioni solubilizzate OMV perturbare il doppio strato lipidico consentendo il contenuto della OMV il libero accesso alla soluzione di reazione. - Calcolare e confrontare le velocità iniziali per ogni livello di Triton X-100 per verificare transmembrana passaggio del substrato / prodotto indicato dal minimo cambiamento nell'attività enzimatica (velocità iniziali) rispetto al enzimatica in mancanza di Triton X-100. Se un sostanziale aumento dell'attività enzimatica è osservata in presenza di Triton X-100 è probabile che il substrato non diffonde liberamente nel OMV.
- attività enzimatica libera Assay (come descritto sopra nel paragrafo 6.1) in presenza di Triton X-100 per verificare che l'attività enzimatica non è inibita dal tensioattivo stesso.
NOTA: Se l'attività è notevolmente influenzato dalle Triton X-100, additivi alternativi, come saponine o vari polisorbato / tensioattivi interpolazione può essere più adatto alla rottura della membrana OMV.
- Eseguire la stessa analisi analisi cinetica come descritto al punto 6.1 utilizzando concentrazioni crescenti di Triton X-100 in tampone CHES da 0-3% in volume.
7. OMV bagagli
- Congelamento
- aliquote luogo ~ 100 ml di purificato OMV direttamente in azoto liquido a scatto per congelare il aliquote assicurandosi di non immergere completamente le fiale o contattare qualsiasi azoto liquido con il campione stesso.
NOTA: purificata OMV può essere congelato a scatto direttamente nel buffer che è stato selezionato per solubilizzare il pellet OMV durante il depuprocesso ionico senza crioprotettori supplementari necessari 7. - Conservare le aliquote a scatto congelato a -80 ° C.
- Scongelare aliquote congelate dal punto 7.1.1 mettendoli a temperatura ambiente assicurandosi di non riscaldare i campioni.
- Prima di preparare tutti i campioni per la conservazione in questo modo eseguire il saggio enzimatico descritto al punto 6.1 confrontando velocità iniziali prima e dopo il congelamento per verificare che non vi è alcuna perdita significativa di attività enzimatica dopo congelamento-scongelamento.
NOTA: Conservare purificato OMV a 4 ° C se una riduzione dell'attività enzimatica si osserva dovuti al gelo.
- aliquote luogo ~ 100 ml di purificato OMV direttamente in azoto liquido a scatto per congelare il aliquote assicurandosi di non immergere completamente le fiale o contattare qualsiasi azoto liquido con il campione stesso.
- Liofilizzazione
- Lyophilize gli snap congelato purificati aliquote OMV che utilizzano attrezzature liofilizzazione disponibili in commercio 21.
- Conservare aliquote liofilizzato a temperatura ambiente per settimane oa -80 ° C per molti mesi.
- Aggiungere lo stesso volume di acqua purificata al liofilizzato OMV come prima liofilizzazione e lasciare riposare a temperatura ambiente per 30 min per reidratare tlui campione. Mescolare delicatamente quando sia necessario assicurarsi di non vortice o ultrasuoni la OMV.
- Aggiungere polvere liofilizzata OMV direttamente al punto di cura per le applicazioni dove prima diluizione / solubilizzazione non è necessario.
Risultati
L'espressione simultanea di due proteine ricombinanti, come è richiesto per la strategia di imballaggio OMV descritto in questo protocollo, può essere realizzato attraverso diverse vie. Qui, un sistema a due vettoriale è stato utilizzato con origini compatibili di replicazione e cassette geniche inducibili separati. Per l'espressione del PTE-SC costruire un backbone plasmide commerciale (pACY184) è stato progettato per includere una arabinosio inducibile cassetta genica e una doppia arginina periplasmatico sequenza leader localizzazione seguita da una serie di siti di restrizione unici per facilitare la clonazione del gene dell'enzima come fusione ad una proteina SC C-terminale. Il costrutto plasmidico codificante la proteina di ancoraggio membrana esterna è il pET22 vettore commerciale che utilizza l'operone lac per il controllo dell'espressione proteica e la sequenza di localizzazione periplasmic pelB. La breve sequenza di ST è stato clonato nel tronco proteina OmpA prima di inseincidenza sulle nel plasmide di espressione. In entrambi i plasmidi, è stata mantenuta la sequenza hexahistidine C-terminale per consentire l'identificazione simultanea delle proteine di fusione in campioni OMV. Costruzione e caratterizzazione di questi costrutti genici, compresi sia gli N- e C-terminale ST fusione costrutti a OmpA, sono descritti in Alves et al. 7. I costrutti genici descritti nel presente documento potrebbero non essere favorevole al confezionamento di tutti gli enzimi. In alcuni casi può essere necessario cambiare il segnale periplasmic localizzazione, gli elementi regolatori, o tag epitopo. Inoltre, alcune proteine possono essere proibitivi e incapace di trasversale membrana interna del tutto. L'attività enzimatica e l'efficienza di imballaggio OMV non può essere determinato a priori e dovranno essere determinati empiricamente per ogni proteina bersaglio.
Qui di seguito sono i risultati che ci si aspetterebbe in genere dopo o portando con successout questo protocollo. Incluso è una schematica dei due domini proteici / SC spaccati ST, OmpA-ST e fusione PTE-SC costruisce nonché un esempio di formazione isopeptide alla membrana esterna batterica e conseguente incapsulamento di PTE-SC in un OMV (Figura 1) . Inoltre, sono disponibili i risultati rappresentativi del purificato morfologia OMV tramite SEM, nonché la distribuzione delle dimensioni e concentrazione assoluta OMV determinato tramite il software di monitoraggio di particelle (Figura 2). Ulteriore caratterizzazione della proteina OMV e l'espressione di proteine ricombinanti sono considerati tramite SDS-PAGE e Western blot (Figura 3). pesi molecolari per le proteine di interesse specifico per il protocollo qui fornite sono le seguenti: nativa OmpA (37,2 kDa), OmpA-ST (23 kDa), PTE-SC (51 kDa), OmpA-ST / PTE-SC (74 kDa) . Purificata OMV dovrebbe avere una banda scura di circa 37 kDa che è indicativo del tanto abbondante OmpA nativa. A seconda della risoluzione di gel non ci può essere più bands presente in questa regione del gel come OmpA, OmpF e OmpC sono tutti relativamente abbondanti e condividono un peso molecolare simile. Una banda aggiuntiva che è di 2,2 kDa maggiore di OmpA-ST può essere osservato anche per scissione improprio della sequenza leader come risultato di un sovraccarico del macchinario E. coli espressione. E 'importante notare che un campione OMV purificato correttamente non avrà molte altre proteine altamente espressi. Se altre band sono presenti sia la purificazione è stata effettuata in modo improprio o batteri ceppo viene utilizzato può essere il confezionamento di altre proteine non osservati in questo ceppo di E. coli BL21 (DE3).
Inoltre, saggi di attività ed esperimenti vescicola di rottura sono stati forniti per dimostrare i risultati rappresentativi che ci si aspetterebbe se il substrato enzimatico può entrare liberamente nel OMV attraverso proteine transmembrana porina (Figura 4). Paraoxon relativamente entra liberamente laOMV attraverso proteine transmembrana Porin endogene reagire con il PTE confezionati e il prodotto di reazione, p -nitrophenol, passa anche relativamente liberamente attraverso la membrana OMV. Questo fenomeno non sarà onnipresente tra tutti i prodotti, supporto e set di enzimi e devono essere determinati sperimentalmente. Anche se il successo di rottura OMV e il rilascio di enzimi è stato visto con basse concentrazioni di detergente e PTE (qui Triton X-100), tali aggiunte possono influenzare l'attività di altri enzimi.
Mappe plasmidi sono stati inclusi per dimostrare la progettazione di una strategia di imballaggio due plasmide utilizzando il SC / sistema ST (Figura 5).
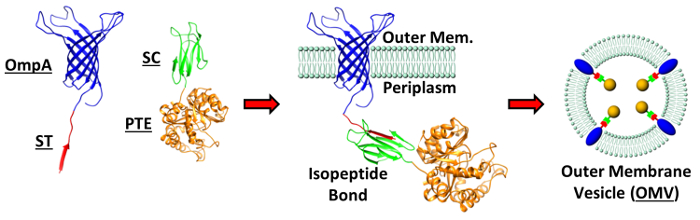
Figura 1: confezioni Regia di proteine in OMV. strutture cristalline per le proteine utilizzate nella confezione descritto strat OMVegy: OmpA, PTE, SpyTag (ST) e SpyCatcher (SC); PDB: 2GE4, 1PTA,, 4MLI, 4MLI rispettivamente. Viene mostrata una rappresentazione schematica dei OmpA-ST e PTE-SC fusione costrutti che formano un legame isopeptide alla membrana esterna dei batteri. Questa fusione della membrana spinge incorporazione della PTE all'interno della formatura OMV. Figura riprodotta (adattato) da Alves et al. ACS Appl Mat Interfaces (2015), 7 (44), pp 24,963-24,972 7. Copyright 2015 American Chemical Society. Clicca qui per vedere una versione più grande di questa figura.

Figura 2: OMV caratterizzazione. (A) SEM di ultracentrifuge purificato OMV da E. coli nativi [BL21 (DE3)]. (B) trac particelle Rappresentante re distribuzioni size e (C) concentrazione totale vescicola media di oltre 90 sec esempio legge per Native OMV, PTE-SC in assenza di attivazione arabinosio (PTE-No A), PTE-SC in presenza di attivazione arabinosio (PTE-A) , N-terminale OmpA-ST co-trasformato con PTE-SC in presenza di arabinosio e l'attivazione IPTG (PTE / OMV-N), e il surnatante ultracentrifuga (UC supernatante). Un aumento significativo della produzione OMV è stato osservato nel campione PTE / OMV-N rispetto alla nativa OMV e PTE-SC costruisce solo. OMV sono stati quantificati nel surnatante UC di dimostrare un recupero quasi completo della OMV nel pellet UC lasciando poco o nessun OMV nel supernatante dopo ultracentrifugazione. Tutti i dati rappresentano mezzi (± DS) di esperimenti in triplo. Figura riprodotta (adattato) da Alves et al. ACS Appl Mat Interfaces (2015), 7 (44), pp 24,963-24,972 7. Copyright 2015 American Chemical Society.d / 54458 / 54458fig2large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.

Figura 3: determinazione del contenuto proteico purificato OMV. (A) SDS-PAGE del purificato OMV UC pellet del C-terminale fusione OmpA-ST coexpressed con PTE-SC (PTE / OMV) costruire dimostrando l'abbondanza rappresentante della OmpA-ST, nativo OmpA, PTE-SC e il OmpA- ST / SC-PTE fusione isopeptide. (B) Analisi Western Blot utilizzando il incluso il suo tag presente nel OmpA e PTE costruisce per facilitare la visualizzazione tramite un anticorpo anti-6xhis. È importante notare che PTE è noto per dimerize, come evidenziato sul blot dalla presenza di grande peso molecolare His-tag specie. Anche se ci sono molto alti livelli di espressione OmpA-ST osservato non vi è una conversione completa del liberoPTE-SC a membrana legato OmpA-ST / SC-PTE. Nonostante questo fatto, l'aumento della produzione PTE complessiva e migliore efficienza confezionamento suggeriscono che mentre la formazione del legame covalente non è ubiquitaria l'associazione non covalente della ST e domini SC è un fattore importante nella confezione diretto all'interno della OMV. Figura riprodotta (adattato) da Alves et al. ACS Appl Mat Interfaces (2015), 7 (44), pp 24,963-24,972 7. Copyright 2015 American Chemical Society. Clicca qui per vedere una versione più grande di questa figura.
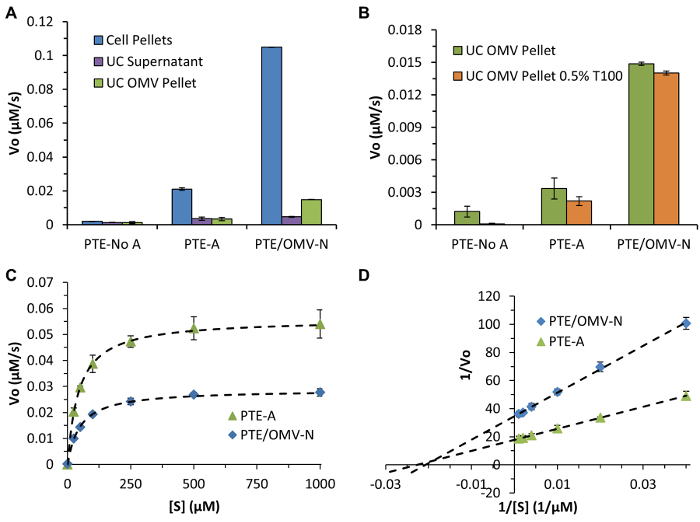
Figura 4: attività PTE e caratterizzazione confezionamento. Livelli di espressione (A) Nel complesso PTE e l'efficienza di imballaggio OMV determinati tramite misure di velocità iniziali che utilizzano paraoxon come substrato cromogenico confronto PTE presenti nei pellet cellulari, il surnatante UC, e purificati pellets UC OMV. (B) i dati rappresentativi che dimostrano l'uso di Triton X-100 (0,5% T100) per interrompere il doppio strato OMV che consente il libero accesso di substrato alla OMV interno. Confrontando questi dati per esperimenti eseguiti in assenza di T100 facilita verifica della traslocazione di substrato attraverso intatte bistrati OMV se enzimatiche velocità iniziali sono invariati. Nel caso di paraoxon vi era poca differenza attività osservata in presenza o assenza di T100 indicando che paraoxon passa liberamente attraverso i pori endogeni sul OMV. (C) PTE-SC cinetica fit dei dati di Michaelis-Menten cinetica enzimatica equazione standard per PTE / OMV-N e PTE-A. (D) un'analisi Lineweaver-Burk utilizzato per determinare K M e k cat / K M (48, 4.4 x 10 7; 44 mM, 4,9 x10 7 sec -1 m -1, rispettivamente) dimostrando simili PTE letteratura parametri cinetici come enzima nativo (90 micron, 2,7 x 10 7 sec -1 m-1) con R 2 ≥ 0.999 in tutti i casi. Tutti i dati rappresentano mezzi (± DS) di esperimenti in triplo. Figura riprodotta (adattato) da Alves et al. ACS Appl Mat Interfaces (2015), 7 (44), pp 24,963-24,972 7. Copyright 2015 American Chemical Society. Clicca qui per vedere una versione più grande di questa figura.

Figura 5: costrutti plasmide rappresentante per la sistema di esempio qui descritto. SpyCatcher modificato enzima-SC (PTE-SC) plasmide mirato per l'incapsulamento all'interno della OMV (a sinistra). SpyTag modified membrana ancoraggio-ST (OmpA-ST-N) plasmide (destra). Clicca qui per vedere una versione più grande di questa figura.
Discussione
Questo funzioni di protocollo per dimostrare un rappresentante dirette tecnica imballaggio in cui viene prodotto e confezionato in OMV da E. coli un enzima di interesse. Come per molte tecniche complesse ci sono più aree in cui il protocollo può essere modificato per ospitare per l'utilizzo in diverse applicazioni uniche, alcune delle quali sono descritte di seguito. Mentre il meccanismo di imballaggi OMV e l'enzima incapsulamento può essere adattata alle esigenze specifiche ci sono diversi passaggi all'interno di questo protocollo che sono critici per il successo. La rimozione iniziale di batterio intatto e detriti cellulari è di notevole importanza e interesserà tutti i tentativi a valle a quantificazione o l'analisi del campione. Due le fasi di centrifugazione successivi seguita da filtrazione è in genere sufficiente per eliminare questi contaminanti. Tuttavia, in tutti i casi si deve prestare attenzione quando le soluzioni di decantazione dopo la centrifugazione per ridurre al minimo il trasferimento di contaminanti. Allo stesso modo, la finale OMV pellet obtained seguente ultracentrifugazione è spesso solo vagamente aderito al fondo della provetta. Nelle fasi finali, bisogna fare attenzione quando si rimuove il terreno di coltura speso per garantire che il pellet rimane indisturbato sul fondo del recipiente. In qualche caso può essere meglio per mantenere il terreno di coltura definitivo soltanto dopo l'analisi del campione utilizzando DLS o di monitoraggio nanoparticelle dispositivo per garantire il pellet OMV non è stato perso nelle fasi finali del protocollo. Qui di seguito sono alcune preoccupazioni aggiuntive che possono sorgere sia con questo particolare protocollo e altri che sono su misura per le esigenze specifiche dei ricercatori.
L'uso di PTE in questo sistema prevede un eccellente modello incapsulamento enzimatico per la bonifica delle regioni organofosfati contaminato con PTE essendo facilmente sostituibile da un enzima alternativa o proteina di interesse. Come descritto qui la coespressione di PTE-SC con OmpA-ST ha determinato un forte aumento espressivo generale PTEcome pure più elevati livelli di produzione delle vescicole con più PTE di essere confezionato all'interno delle vescicole rispetto al PTE e PTE-SC espresso solo. Riducendo il numero di interazioni tra la membrana esterna e il peptidoglicano attraverso la delezione C-terminale di OmpA iper-vescicole è raggiunto. Questo fornisce un percorso facile per i batteri per esportare il PTE ricombinante che mitiga gli effetti tossici che sono spesso osservate nella sovraespressione di proteine non nativi.
Mentre PTE può essere facilmente sostituito in questo sistema modello, è importante notare che non tutti i substrati enzimatici passeranno liberamente attraverso il doppio strato OMV ed è quindi indispensabile che ciascun enzima unico e pair substrato testati su un caso per caso. Anche se un substrato non passa attraverso la membrana questa tecnica può ancora essere utilizzata per produrre e confezionare un enzima in OMV e l'aggiunta di Triton X-100, o adatto tensioattivo alternativa, può essere aggiunto a una sufficiente levels rottura vescicole prima dell'uso.
In assenza di espressione della proteina ricombinante e confezionamento questo protocollo può anche servire come un metodo di base per la produzione OMV e purificazione da diverse specie batteriche. Metodi alternativi per la purificazione OMV, come gradiente di densità di frazionamento 22, filtrazione a membrana 23, e ultrafiltrazione 24, esistono anche e possono essere tecniche più opportune a seconda dell'applicazione prevista. Queste tecniche di purificazione alternativi possono essere facilmente integrati in questo protocollo al posto del pellet ultracentrifugazione della OMV per il confezionamento diretto di una proteina in un OMV attraverso l'uso di un legame sintetico biortogonale.
Altre modifiche possono essere apportate al sistema specifico linkage sintetico utilizzato in questo protocollo, così come la proteina di membrana tethering selezionato. Ci sono varie strategie sintetiche per l'accoppiamento di due proteine diverses all'interno di un sistema biologico che includono: le proteine di divisione 25, bobine a spirale 26, e diviso inteins 27, solo per citarne alcuni. Altre proteine di membrana legati o transmembrana quali OmpF e OmpC sarebbe probabilmente prevedere idonei siti di modifica ST, nonché 28. In alcuni casi, può anche essere necessario scambiare la ST e domini SC ponendo l'SC sulla proteina ancoraggio e molto più piccolo ST sull'enzima / proteina ricombinante. Ci sono anche una serie di differenti strategie di clonaggio che possono essere implementati qui compreso l'uso di più plasmidi alle stesse o differenti sistemi di induzione, un singolo plasmide con più proteine codificate, o anche utilizzando tecniche di ricombinazione omologa per incorporare tutte o parti dell'espressione sistema nel genoma batterico.
Il microambiente del OMV aiuta a stabilizzare l'enzima confezionato riducendo inattivazione enzimatica che si verifica comunemente in meno di st idealecondizioni Orage, gelo-disgelo, e liofilizzazione 29. Si prevede inoltre che il valore normale fornirà notevolmente migliorata resistenza al taglio proteolitico come bistrato OMV funziona come una barriera fisica tra l'enzima attivo e le proteine presenti nello spazio extra-OMV. Questo protocollo può essere ulteriormente ampliato per includere una piccola molecola, il peptide, o tag esterno di fronte proteine per facilitare la somministrazione mirata di proteine OMV incapsulati e purificazione di affinità. Mentre PTE è stato selezionato per questa applicazione unica i risultati di questo studio, e il contenuto di questo protocollo, possono essere facilmente utilizzati per la progettazione di strategie di packaging proteine analoghe per l'uso in consegna farmaceutica diversa, medici diagnostici e di bonifica ambientale applicazioni 30.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
This research was funded by the Office of Naval Research through Core funds provided to the Naval Research Laboratory.
Materiali
| Name | Company | Catalog Number | Comments |
| IPTG | Any | Always prepare fresh or aliquot and freeze. | |
| L-arabinose | Any | Can be prepared ahead of time and stored at 4 °C. | |
| Ampicillin | Any | Add immediately prior to use after media cools sufficiently from being autoclaved. | |
| Chloramphenicol | Any | Add immediately prior to use after media cools sufficiently from being autoclaved. | |
| TB/LB Culture Media | Any | Other growth medias will likely work similarly. | |
| Triton X-100 | Any | One of many potential suitable surfactants. | |
| Baffled culture flasks | Any | The baffles promote higher levels of aeration. | |
| CHES | Fisher Bioreagents | BP318-100 | Optimal buffer used for paraoxon degredation (pH > 8). |
| Paraoxon | Chem Service | N-12816 | Very toxic substance to be handled carefully and disposed of properly. |
| Syringe Filter 0.45 µm | Thermo Scientific | 60183-221 (30 mm) | Filter diameter will depend on volume of sample. Low protein binding membrane is critical. |
| Shaker incubator | New Brunswick | Excella E24 | Precise temperature and mixing is essential for reproducable bacterial growth. |
| Sorvall Culture Centrifuge | Thermo Scientific | RC 5B PLUS | Large volume (500 ml) culture centrifuge capable of 7,000 x g. |
| Sorvall Ultracentrifuge | Thermo Scientific | WX Ultra 90 | Capable of centrifugal forces ≥150,000 x g. |
| Ultracentrifuge Rotor | Thermo Scientific | AH-629 | Ensure the proper rotor and tubes are used and that everything is properly balanced. |
| Ultra-Clear Ultracentrifuge Tubes (25 x 89 mm) | Beckman Coulter | 344058 | Ensure no stress fractures are present prior to use and that tubes are presicely balanced. |
| Spectrophotometer | Tecan | Infinite M1000 | Necessary for enzyme kinetic assays. |
| DLS/particle tracking | NanoSight | LM10 | Necessary for OMV size distribution and concentration determination. |
| BL21(DE3) | NEB | Suitable bacterial expression strain. | |
| pET22 | EMD Millipore | 69744-3 | Other plasmids can be used in place of these. |
| pACYC184 | NEB | Other plasmids can be used in place of these. | |
| Gel Extraction Kit | Qiagen | 28704 | Example kit. |
Riferimenti
- Avila-Calderon, E. D., et al. Roles of bacterial membrane vesicles. Arch. Microbiol. 197, 1-10 (2015).
- Kulp, A., Kuehn, M. J. Biological functions and biogenesis of secreted bacterial outer membrane vesicles. Annu. Rev. Microbiol. 64, 163-184 (2010).
- Beveridge, T. Structures of Gram negative cell walls and their derived membrane vesicles. J. Bacteriol. 181, 4725-4733 (1999).
- Kulkarni, H. M., Jagannadham, M. V. Biogenesis and multifaceted roles of outer membrane vesicles from Gram-negative bacteria. Microbiology. 160, 2109-2121 (2014).
- Ellis, T. N., Kuehn, M. J. Virulence and immunomodulatory roles of bacterial outer membrane vesicles. Microbiol. Mol. Biol. Rev. 74, 81-94 (2010).
- Berleman, J., Auer, M. The role of bacterial outer membrane vesicles for intra- and interspecies delivery. Environ. Microbiol. 15, 347-354 (2013).
- Alves, N. J., et al. Bacterial nanobioreactors-directing enzyme packaging into bacterial outer membrane vesicles. ACS Appl. Mater. Interfaces. 7, 24963-24972 (2015).
- Kim, J. Y., et al. Engineered bacterial outer membrane vesicles with enhanced functionality. J. Mol. Biol. 380, 51-66 (2008).
- Haurat, M. F., et al. Selective sorting of cargo proteins into bacterial membrane vesicles. J. Biol. Chem. 286, 1269-1276 (2011).
- Kesty, N. C., Kuehn, M. J. Incorporation of heterologous outer membrane and periplasmic proteins into Escherichia coli outer membrane vesicles. J. Biol. Chem. 279, 2069-2076 (2003).
- Zakeri, B., et al. Peptide tag forming a rapid covalent bond to a protein, through engineering a bacterial adhesion. Proc. Natl. Acad. Sci. U. S. A. 109, e690-e697 (2012).
- Li, L., Fierer, J. O., Rapoport, T. A., Howarth, M. Structural analysis and optimization of the covalent association between SpyCatcher and a peptide tag. J. Mol. Biol. 426, 309-317 (2014).
- Dumas, D. P., Durst, H. D., Landis, W. G., Raushel, F. M., Wild, J. R. Inactivation of organophosphorus nerve agents by the phophotriesterase from Pseudomonas-Diminuta. Arch. Biochem. Biophys. 277, 155-159 (1990).
- Bigley, A. N., Raushel, F. M. Catalytic mechanisms for phosphotriesterases. Biochimica et Biochim. Biophys. Acta, Proteins Proteomics. 1834, 443-453 (2013).
- Minton, N. A., Murray, V. S. G. A review of organo-phosphate poisoning. Med. Toxicol. Adverse Drug Exper. 3, 350-375 (1988).
- Bigley, A. N., Xu, C., Henderson, T. J., Harvey, S. P., Raushel, F. M. Enzymatic neutralization of the chemical warfare agent VX: Evolution of phosphotriesterase for phosphorothiolate hydrolysis. J. Am. Chem. Soc. 135, 10426-10432 (2013).
- Chatterjee, S. N., Chaudhuri, K. Gram-negative bacteria: the cell membranes. Outer Membrane Vesicles of Bacteria. SpringerBriefs in Microbiology. , 15-34 (2012).
- Wang, Y. The function of OmpA in Escherichia coli. Biochem. Biophys. Res. Commun. 292, 396-401 (2002).
- Danoff, E. J., Fleming, K. G. The soluble, periplasmic domain of OmpA folds as an independent unit and displays chaperone activity by reducing the self-association propensity of the unfolded OmpA transmembrane beta-barrel. Biophys. Chem. 159, 194-204 (2011).
- Alves, N. J., Kline, J. A. Comparative study on the inhibition of plasmin and delta-plasmin via benzamidine derivatives. Biochem. Biophys. Res. Commun. 457, 358-362 (2015).
- Wang, W. Lyophilization and development of solid protein pharmaceuticals. Int. J. Pharm. 203, 1-60 (2000).
- Goormaghtigh, E., Scarborough, G. A. Density-based separation of liposomes by glycerol gradient centrifugation. Anal. Biochem. 159, 122-131 (1986).
- Alves, N. J., et al. Functionalized liposome purification via Liposome Extruder Purification (LEP). Analyst. 138, 4746-4751 (2013).
- Mayer, L. D., StOnge, G. Determination of free and liposome-associated doxorubicin and vincristine levels in plasma under equilibrium conditions employing ultrafiltration techniques. Anal. Biochem. 232, 149-157 (1995).
- Blakeley, B. D., Chapman, A. M., McNaughton, B. R. Split-superpositive GFP reassembly is a fast, efficient, and robust method for detecting protein-protein interactions in vivo. Mol. BioSyst. 8 (2036), (2012).
- De Crescenzo, G., Litowski, J. R., Hodges, R. S., O'Connor-McCourt, M. D. Real-time monitoring of the interacation of two-stranded de novo designed coiled-coils: effect of chain length on the kinetic and thermodynamic constants of binding. Biochemistry. 42, 1754-1763 (2003).
- Charalambous, A., Antoniades, I., Christodoulou, N., Skourides, P. A. Split-Intein for simultaneous site-specific conjugation of quantum dots to multiple protein targets in vivo. J. Nanobiotechnol. 9, 1-14 (2011).
- Lee, E. Y., et al. Global proteomic profiling of native outer membrane vesicles derived fromEscherichia coli. Proteomics. 7, 3143-3153 (2007).
- Alves, N. J., Turner, K. B., Medintz, I. L., Walper, S. A. Protecting enzymatic function through directed packaging into bacterial outer membrane vesicles. Sci. Rep. 6, 24866 (2016).
- Alves, N. J., Turner, K. B., Medintz, I. L., Walper, S. A. Emerging therapeutic delivery capabilities and challenges utilizing enzyme/protein packaged bacterial vesicles. Ther. Delivery. 6, 873-887 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon