Method Article
Isolamento e expansão de CTM / células estromais derivadas de placenta humana Tissue
Neste Artigo
Resumo
Descreve-se aqui métodos para a dissecação de tecidos fetais e maternas de placenta humana, seguido por isolamento e expansão de células estaminais mesenquimais / estroma (MSC) a partir desses tecidos.
Resumo
Mesenchymal stem/stromal cells (MSC) are promising candidates for use in cell-based therapies. In most cases, therapeutic response appears to be cell-dose dependent. Human term placenta is rich in MSC and is a physically large tissue that is generally discarded following birth. Placenta is an ideal starting material for the large-scale manufacture of multiple cell doses of allogeneic MSC. The placenta is a fetomaternal organ from which either fetal or maternal tissue can be isolated. This article describes the placental anatomy and procedure to dissect apart the decidua (maternal), chorionic villi (fetal), and chorionic plate (fetal) tissue. The protocol then outlines how to isolate MSC from each dissected tissue region, and provides representative analysis of expanded MSC derived from the respective tissue types. These methods are intended for pre-clinical MSC isolation, but have also been adapted for clinical manufacture of placental MSC for human therapeutic use.
Introdução
-Tronco mesenquimais / células do estroma (MSC) estão emergindo como um candidato promissor para uso em terapias baseadas em células 1. A maioria das aplicações parecem ter como alvo a reparação de tecidos mediada por MSC ou regulação imune 2. Em muitas destas aplicações, alogênico MSC pode ser tão eficaz como MSC autólogo 3. O uso de MSC alogénico tem a vantagem económica de ser compatível com o fabrico em grande escala de múltiplas doses de células a partir de uma única fonte de tecido 4 para tratar muitos pacientes.
Historicamente, os estudos pré-clínicos e clínicos utilizaram-MSC derivadas da medula óssea 4. A medula óssea é geralmente recolhida a partir da crista ilíaca de um dador voluntário. Este processo é invasiva, e apenas um pequeno volume de medula (~ 20 ml) é recolhido através de um único punção. Gerar números clinicamente significativas de MSC exige ampla expansão in vitro. potência celular diminui com o número de passagens 3, criando um paradoxo que o número teórico de células necessárias para a eficácia clínica é aumentado mais a população de células é expandida. Em contraste com os aspirados de medula óssea, a placenta é um termo fisicamente grandes tecidos de partida (tipicamente 500-750 g 4), que pode ser colhido assepticamente durante cesariana sem risco para o dador. MSC derivadas de placenta têm proliferação 5 e imunomodulador capacidade a longo prazo 6, superior ao MSC derivadas de medula óssea. Num estudo anterior, demonstrou-se que um único termo placenta continha MSC suficiente para o fabrico de 7.000 até 4 doses clínicas. Estas características tornam placenta um tecido fonte ideal para o fabrico de MSC alogénica.
A placenta é um órgão feto-materna consiste em ambos fetal e materna tecido 7, e, assim, MSC de origem fetal ou materno pode ser, teoricamente, isolado. As seguintes referências fornecem deatado informações sobre o desenvolvimento e patologia, bem como exame microscópico e macroscópico da placenta humana e anexos 8,9. A placenta adequada é composta em grande parte dos vasos sanguíneos fetais e secretora e células de suporte chamadas trofoblastos, tornando-se as vilosidades coriônicas abrangidos pelo frondosum córion (placa) 8. As vilosidades da placenta ramificados são banhadas em sangue materno entregues a partir das artérias em espiral uterina, permitindo nutrientes, hormônios e as trocas gasosas entre o feto ea mãe. A placenta é ancorado ao endométrio através de células do estroma deciduais maternas e os trofoblastos fetais extravillious são intercaladas em oito matriz extracelular. As vilosidades convergem para a placa coriônica fetal onde formam o cordão umbilical 8.
Um resultado do primeiro Workshop Internacional sobre Células-tronco derivadas de placenta (2008) era uma apreciação da necessidade de padronizar o isolamento e characterization de células de placenta humana 10. Devido à anatomia da placenta, dissecção dos diferentes tecidos, isolamento de MSC e os resultados esperados cultura pode ser esmagadora para os recém-chegados ao campo. Neste protocolo, a colheita de tecidos coriônicas da placenta, seguido pelo isolamento MSC e expansão é completamente detalhado. MSC caracterização por meio de citometria de fluxo e na diferenciação in vitro são consideradas de rotina 5,11-13, e, assim, apenas brevemente detalhado aqui.
Conforme destacado em uma recente revisão sistemática da literatura 14, MSC obtidos a partir das vilosidades coriônicas da placenta são geralmente assumido ser fetal. Embora, apenas 18% dos estudos examinou a origem do MSC obtido, e desses, apenas metade dos estudos relataram MSC fetal ea outra metade relatou populações MSC maternos ou mistos. Cada um dos três componentes do tecido aqui descritos (vilo corial, placa e decídua basalis coriônica) são composed principalmente da membrana fetal / vilosidades, e uma pequena proporção de células maternas derivada-uterinas, que permanecem ligados à placenta entregue. Nós fornecer dados que demonstram que o isolamento MSC do lado materno da placenta, em vez do lado fetal da placenta, como já anteriormente relatado 5,11, é um material de partida mais adequado se MSC materno são desejados. Este protocolo descreve também o uso de XY peixe para validar contribuição fetal ou materno para culturas de células. Enquanto este é um protocolo padrão do fabricante, esta análise é muitas vezes negligenciada e sua importância subestimada 14.
Protocolo
Os Comitês de Ética em Pesquisa em Serviços de Saúde Mater, Real Brisbane e Hospital da Mulher, Queensland University of Technology e da Universidade de Queensland aprovou a pesquisa e coleta de amostras de placenta humana utilizados no estudo. Todos os protocolos de cumpridas as diretrizes nacionais de investigação. Pacientes forneceram o seu consentimento informado por escrito para o uso de tecido para fins de investigação.
placentas trimestre terceiros foram obtidos a partir de mães saudáveis seguintes nascimentos de rotina cesariana (CS) a prazo dos hospitais mencionados acima em Brisbane, Austrália. gestações discordantes masculinos para amostras prazo foram utilizados neste estudo para distinguir fetal a partir de células maternas. sexo fetal foi determinada por ultra-som antes do nascimento e / ou inspeção visual do recém-nascido no nascimento por pessoal clínico. X e Y cromossoma fluorescência de hibridação in situ (FISH), foi utilizado para validar adicionalmente sexo e origem materna ou fetal de tecido preservado doplacentas originais.
1. Antes da colheita, preparar os seguintes
Nota: Ao fazer-se soluções enzimáticas, as exigências e as concentrações específicas fornecidas pelo fabricante para cada produto devem ser seguidas. Enzimas são muitas vezes fornecidos como uma mistura bruta de proteínas, portanto enzimas semelhantes de diferentes empresas são susceptíveis de ter diferentes actividades / concentrações. Por esta razão, o conselho do fabricante deve ser reconhecido e preparação da solução podem ter de ser alteradas em conformidade.
- Preparar ou comprar 1,5 a 2 L no total estéril Solução Salina Equilibrada de Hank (HBSS) para este protocolo.
- Preparar a solução da colagenase I por pesagem de colagenase de tipo I e dissolve-se 1 mg / ml em HBSS e vórtice suavemente para assegurar a dissolução completa. Determinar o volume de HBSS (contendo cálcio e magnésio), necessários para trazer a solução de colagenase 100 unidades (U) / mL (solução estoque 1.000x) e, em seguida, filtrar através de um 0,2 &# 181; filtro de seringa m. Alíquotas volumes de 1 ml em tubos de 1,5 ml e armazenar a -20 ° C até ser necessário.
- Preparar a solução de estoque de dispase por dissolução de dispase não-estéril a 10 mg / ml em solução salina tamponada com fosfato de Dulbecco (DPBS), sem cálcio ou magnésio. Diluir com DPBS sem cálcio ou magnésio para uma concentração final de 2,4 U / ml. Filtrar esterilizar através de um filtro de seringa de 0,2 | im. Alíquotas volumes de 1 ml em tubos de 1,5 ml e armazenar a -20 ° C até ser necessário.
- Prepare desoxirribonuclease solução estoque -I (ADNase) por dissolução de ADNase-I a 10 mg / mL em NaCl 0,15 M. Filtrar hospedei lá de um filtro de seringa de 0,2 um. Alíquotas volumes de 1 ml em tubos de 1,5 ml e armazenar a -20 ° C até ser necessário.
- Preparar a solução de digestão de trabalho através da combinação de 100 U / ml de colagenase de tipo I, I.5 ug / ml de DNase I e de 2,4 U / ml de dispase em DMEM isento de soro. Recém descongelar e diluir os estoques de enzimas imediatamente antes da utilização. Aproximadamente, uma proporção de 1: 1 de solução de digestãode volume para volume de tecido é necessária (por exemplo, 10 ml de tecido, medida em um tubo de 50 ml, requer 10 ml da solução de digestão).
- Prepara-se uma solução de paraformaldeído a 4% (PFA) em PBS e ajustar para pH 7,4 15. Loja 25 mL de alíquotas a -20 ° C para a longo prazo ou a 4 ° C durante 1 semana.
- Prepare meio de cultura MSC de DMEM-Low Glucose (DMEM-LG) suplementado com solução de antibiótico e antimicótico 1x e soro bovino a 10% não-fetal inactivado pelo calor. FBS MSC grau podem ser adquiridos a partir de diversos fornecedores de FBS.
- Autoclave esterilizar equipamentos dissecção de antecedência conforme as diretrizes institucionais. Estes incluem tesouras, pinças, bisturis, e uma bandeja de dissecação de metal grande. Recolhe utensílios de plástico adicional estéril de cultura de tecidos e produtos de consumo (por exemplo, lâminas de bisturi, 50 mL e tubos de 15 ml, 25 ml, 10 ml e 5 ml, pipetas e 75 ou 175 frascos de cultura de células cm 2).
- Use padrão do equipamento de laboratório de cultura de células primárias: a classe II bgabinete iosafety adequado para o isolamento de células primárias, a cultura da célula incubadora a 5% de CO 2 e 37 ° C, um balancim de 37 ° C incubadora, e uma centrifugadora com uma capacidade para produção de tubos de 50 ml.
- Use equipamento adequado de proteção pessoal: um casaco de laboratório, 2 pares de luvas (em todos os tempos), óculos de segurança e sapatos close-toed de acordo com as diretrizes institucionais.
- Preparar soluções de descontaminação apropriados para as amostras de sangue humano como por diretrizes institucionais e recipientes para resíduos biológicos líquidos com antecedência.
2. Isolamento de MSC Placentário
- Preparação da placenta
- Vestir-se de equipamento de proteção pessoal necessário. Configure o gabinete de segurança biológica com materiais necessários, soluções e contentores de lixo para a realização do processo até à digestão enzimática (seção 2.5.6).
- Obter uma placenta com o consentimento informado e aprovação ética. Recolher a placenta via sec cesarianação sob condições cirúrgicas assépticas, e embalagem num saco estéril ou balde para o transporte para o laboratório.
- Durante o transporte e antes da dissecação, armazenar a placenta, à temperatura ambiente ou a 4 ° C.
Nota: Os tecidos podem ser armazenadas por até 6 horas sem afetar o desempenho de cultura de células.- Limitar o tempo entre a coleta de placenta e processamento de tecidos, sempre que possível. Esta recomendação é baseada em questões práticas. Em alguns casos, temos atrasou o processo de isolamento de células de até 6 horas após o nascimento. Nestes casos, as placentas foram mantidas à temperatura ambiente ou a 4 ° C (em laboratório ou no centro de recolha). Não foram observadas diferenças detectáveis, acima da variação geral doador, no MSC obtido a partir de placentas quando foram armazenadas a 4 ° C ou à temperatura ambiente.
- Coloque o recipiente com placenta na cabine de segurança biológica. Abrir o recipiente e transferir a placenta num tabuleiro estéril.
- Abrem-se as membranas fetais (saco amniótico ou laeve âmnio-coriônica) 8. Torna-se orientadas com as partes da placenta. O lado do feto tem a inserção do cordão umbilical, que é de um modo geral, inserida centralmente na placenta. O lado materno (alinhado com decídua basal), o qual é oposto ao lado fetal, tem óbvias cotilédones (ou lóbulos).
- Para iniciar a dissecção, orientar a placenta com o cordão umbilical voltada para cima no tabuleiro estéril.
Nota: Este protocolo é concebido para produzir células suficientes para semente em um balão T175 a partir de cada um dos três tipos de tecido. Cada digestão começa com cerca de 10 g de tecido. Este é um número semelhante de partida frascos como culturas de MSC iniciadas a partir de um aspirado de medula óssea de 20 mL. Se mais células são desejados, em seguida, mais tecido pode ser colhido e o protocolo pode ser dimensionado de forma linear. Os tamanhos de tecido a ser colhidas são meramente indicativos do que é prática com o tecido placentário. Há poucos definincaracterísticas de g nas vilosidades da placenta, que pode ser utilizado como um ponto de referência. As dimensões indicadas servir como uma estimativa e do cordão umbilical é utilizado como um ponto de referência na superfície do feto.
- A dissecção da decidual (D) Tissue
- Virar a placenta mais para que a superfície materna (decídua basal) está voltado para cima. Certifique-se de que o lado fetal, com o ponto de inserção do cordão umbilical está voltada para baixo.
- Corte pedaços de cm de espessura de 0,5 a partir do lado materno da placenta (contendo tecido decídua basal).
- Colocar as peças de tecido numa placa de Petri contendo HBSS durante a dissecção para manter os pedaços de tecido hidratado.
- Transferir tecido suficiente para encher um tubo até à marca de 10 ml num tubo de 50 ml (esta é, aproximadamente, 10 g de tecido).
- Dissecção da placa coriônica (CP) Tissue
- Mecanicamente remover a membrana amniótica de a partir da superfície fetal da placenta (não o saco amniótico), deixando o chofrondosum rionic (placa coriônica) intacta.
- Corte pedaços ~ 1 cm de largura por 0,5 cm de profundidade a partir da placa coriônica. Recolher as coriónica placa a partir da região mais próxima do cordão umbilical, para longe da borda da placenta.
- Colocar as peças de tecido numa placa de Petri contendo HBSS durante a dissecção para mantê-los hidratado.
- Transferir tecido suficiente para encher um tubo de 50 ml até à marca de 10 ml (~ 10 g de tecido).
- Dissecção da coriônica Villi (CV) Tissue
- Dissecar tecido CV ~ 1 cm 2 x 0,5-1 cm de profundidade a partir de tecido placentário em que o CP já tenha sido removida. Mais uma vez, a colheita CV da região mais próxima do cordão umbilical, para longe da borda da placenta. Tente ficar pelo menos 1 cm de distância do lado materno da placenta (contendo tecido decídua basal); o objectivo é a colheita do tecido a partir do interior do tecido placentário vilosidades.
- Colocar as peças de tecido em uma placa de Petri contendo HBSS durante o Dissecção para mantê-los hidratados.
- Transferir tecido suficiente para encher um tubo de 50 ml até à marca de 10 ml (~ 10 g de tecido).
- Picar e digestão enzimática do D, CP, e CV placenta tecidos
- Como existem ~ 10 g de D, CP ou CV tecidos em três diferentes tubos de 50 ml, encher cada tubo com cerca de 40 ml de HBSS e repetidamente inverter o tubo, a fim de lavar o tecido (repetir para ~ 10 seg).
- Decantar o sobrenadante e repetir este passo de lavagem 2-3 vezes até que a solução é em grande parte livre de sangue. Usar uma pipeta de 10 mL ou uma pinça longa para assegurar que os pedaços de tecido não são perdidos para fora do tubo (s) quando decantação do sobrenadante.
- Retornar pedaços de tecido a um 10 cm placa de Petri com a transferência de líquido mínimo. Costeleta / picar o tecido em pedaços finos de cerca de 1-5 mm 3 com tesoura ou lâmina de barbear.
- Transferir os tecidos picados volta para devidamente rotulados (D, CP ou CV) tubos de 50 ml.
- Adicionar recém-preparEd digerir meios de comunicação em pelo menos uma razão de 1: 1 com o tecido (por exemplo, 10 ml de tecido mais 10 ml de digerir a media). Recoloque a tampa em cada tubo e inverta os tubos várias vezes para misturar.
- Incubar os tecidos em tubos com os meios digerir durante 1-2 horas a 37 ° C. Uma atmosfera húmida e 5% de CO 2 não são necessários para esta etapa.
Nota: agitação rápida é necessária, a fim de dissociar eficientemente as células do tecido e maximizar o rendimento do MSC. rendimento limitado será evidente por muito poucas células ligadas ao frasco de cultura de 48 h e um primeiro tempo de passagem mais longo de 1-2 semanas. O tempo de incubação e método de agitação é dependente da incubadora a 37 ° C disponível no laboratório e podem requerer optimização.- Para uma incubadora com um mecanismo de agitação rápida e controlável, o tecido local e digerir meio em um tubo de 50 ml ou balão cónico estéril, lugar na incubadora e definir agitando velocidade para 250 rpm. Isto irá resultar em uma digest completa deo tecido em 1 h.
- Alternativamente, para uma incubadora com um balanço suave ou nenhum mecanismo de balanço, agitar manualmente o tubo rapidamente e vigorosamente à mão durante 10 segundos a cada 30 minutos para 1,5 a 2 horas. O período de incubação enzimática é um tempo adequado para descartar resíduos, limpar a cabine de segurança biológica de itens desnecessários, mude bata de laboratório, se suja e se preparar para a próxima parte do procedimento.
- Recolha de células mononucleares e revestimento em frascos
Nota: A partir do passo anterior, existem três tubos de 50 ml (D, CP ou CV) com digestão de pedaços de tecido. Quando a solução para análise dos tecidos desenvolve uma aparência turva e vasos brancas do sangue são evidentes no tecido, a digestão é completa.- Adicionar 30 ml de meio contendo FBS a MSC a cada tubo para inactivar os enzimas contidos na solução de digestão.
- Para separar as células mononucleares a partir do grande detritos não digerido, pulso Centrifugar o tubo de 50 ml. Resumidamente, permitira centrífuga para atingir 340 x g durante 5 segundos e depois parar. Isto forçará o grande para sedimentar os detritos na parte inferior do tubo, enquanto deixa as células mononucleares em suspensão líquida.
Nota: As células mononucleares permanecerá na fase líquida, se o tubo é apenas brevemente (pulsado) centrifugada. Se a centrifugação é estendido, as células mononucleares também irá sedimentar no fundo do tubo com os pedaços de tecido, resultando na perda de células indesejáveis. - Recolhe-se o sobrenadante, contendo as células mononucleares, e transferir esta para um novo tubo de 50 ml com uma pipeta.
- Adicionar 30 ml de mídia ou HBSS ao restos de tecido placentário restante e agitar vigorosamente. Isto trará restantes células mononucleares desacopladas em suspensão e permitir uma segunda colheita de MSC putativa do tecido.
- Pulso centrifugue o tubo uma segunda vez, e novamente transferir o sobrenadante para um novo tubo de 50 ml. Repita este passo uma terceira vez para maximizar a eficiência de coletade células mononucleares a partir de cada fonte de tecido.
- Reúnem-se os sobrenadantes de cada um dos tipos de tecidos individuais em dois tubos de 50 ml. Isto irá produzir 6 tubos totais (2 tubos de cada D, CP e CV). Centrifugar cada tubo durante 5 min a 340 x g. Este passo irá sedimentar as células mononucleares para o fundo dos tubos.
- Cuidadosamente decantar ou pipeta fora do sobrenadante para o lixo. Não é necessário tentar eliminar cada gota de sobrenadante.
Nota: O sedimento celular será frágil devido a um grande número de células vermelhas do sangue. Tenha cuidado para não acidentalmente descartar o pellet se você estiver decantação directamente a partir do tubo de 50 ml. - Depois de remover a maior parte do sobrenadante, suavemente apertar o tubo várias vezes com um dedo para desalojar o sedimento celular. Combinam-se as peletes, para que haja um único tubo para cada D, CP ou CV tecido e ressuspender cada um em 35 ml de meio de MSC.
- Opcional: filtre a fração mononuclear através de um filtro de células de malha 100 um set uP num tubo de 50 mL para remover aglomerados de células ou material fibroso.
Nota: Cuidado é necessária como os filtros pode facilmente entupir e sobre-enchimento. Além disso, as bolhas de ar podem obstruir filtros de drenagem. Se isto ocorrer, lentamente levantar o filtro de fora do tubo para permitir que o ar flua sob a filtrar, lavar com filtro por meio de meios de cultura celular ou de troca para um novo filtro. Excluindo o passo de filtragem não parece alterar a qualidade ou rendimento das culturas MSC subsequentes.- Opcionalmente, um glóbulo vermelho do sangue (RBC) lise ou centrifugação em gradiente de densidade pode ser levada a cabo nesta fase 15. No entanto, nossa experiência é que RBC não interferem com o acessório MSC ou a proliferação e, portanto, a lise RBC não é necessário. As células mononucleares poderia ser contado nesta etapa se a remoção RBC foi realizado 15. Embora, a grande maioria das células nesta fase não será MSC, mas ser de origem trofoblasto fetal, células endoteliais e células hematopoéticas, bem como MAcélulas de origem hematopoiéticas ternas e células do estroma deciduais.
- Transferir a suspensão de célula para cada D, CP ou tecido CV em um único frasco T175 e cultura numa incubadora humidificada a 37 ° C e 5% de CO 2.
- Expansão de células de isolamento pós
- A 48 h após o isolamento inicial, remover o meio de cada um dos frascos (D, CP e CV) e substituir por 35 ml de meio fresco MSC. As células isoladas e o meio gasto pode ser descartado, como MSC putativo se presume estar ligado ao frasco de cultura de tecidos de 16. Retorno frascos para a incubadora durante mais 24 h.
- Após mais 24 horas adicionais de cultura, os frascos lavar duas vezes com DPBS (25 ml) para remover os detritos e RBCs. Agitar o líquido em torno do fundo do frasco para desalojar RBCs. Usar uma pipeta para remover o líquido e os detritos. Adicionar 35 ml de meio de MSC para os frascos e os frascos de regresso para a incubadora.
- Substituir a mídia duas vezes por semana, e emculturas Cubate até as monocamadas de células são 80- 90% confluentes. Esta expansão inicial demora 4-14 dias, dependendo da qualidade do tecido, a quantidade de material e a eficiência e o tempo de incubação começando com a solução de digestão.
3. Subcultura de PMSCs
- Quando as culturas são 80-90% confluentes, lavar duas vezes com 20 ml de HBSS ou 1x DPBS e descartar lavagens. Adicionar tripsina-substituto para cada frasco (ou seja, utilizar 5 ml de um frasco T175).
- Incubar os frascos de 5 min a 37 ° C para libertar o MSC da superfície da cultura de tecidos. Os lados do frasco de cada ~ 2 minutos para facilitar a desprendimento.
- Quando as células são separadas da superfície e numa suspensão de células individuais, lavar as células do frasco com meio de MSC e recolher as células em tubos. Os meios de comunicação MSC irá diluir e desactivar o tripsina-substituto (uso ~ 15 ml de meio MSC por frasco T175).
- Transferir o conteúdo de cada balão de cultura de tecidos a uma 50tubo ml.
- tubos de centrifugação a 340 xg durante 5 min para sedimentar as células.
- Descartar o sobrenadante e ressuspender as peletes de células em 1 ml de meios de MSC.
- Dilui-se 10 ul de suspensão de células em 10 ul de azul de tripano. Contagem de células utilizando um hemocitómetro, e calcular o número total de células 15.
- Transferir células para novos frascos a 1.150 células / cm2 em meio de MSC frescos e incubar numa incubadora de cultura de tecidos. Neste densidade de semeadura, sementes 200.000 MSC em cada novo frasco T175 em 35 ml de meio MSC. Alimentar as células duas vezes por semana até 80-90% confluentes. Semente passagens subsequentes a 1.150 células / cm 2 ou 200.000 MSC em cada frasco T175.
- Quando a passagem 1 (P1) ou células P2 são confluentes, criopreservar a maioria das células para utilização futura, e propagar novamente apenas um balão T175 para propagação adicional e caracterização. As células podem ser propagadas utilizado em P3 ou P4 para ensaios de diferenciação mesodérmicos e caracterização de células via FLow citometria.
Nota: Nas primeiras passagens, pode haver muito poucas colónias escassamente separados, mas a densidade de célula local dentro de cada colónia pode ser muito alta. Este não é o ideal, como a embalagem densa locais das células resultará na inibição de contacto, atrasando o crescimento e reduzir o desempenho cultura. Sugerimos que quando são observadas colónias densas, as células devem ser colhidas e re-semeadas para um novo frasco. Este processo de redistribuição fornece células com espaço para proliferar, e desempenho global cultura será melhorada. - Para criopreservar MSC, recolher ~ 1 x 10 6 células em 1 ml de 90% de FCS e 10% de dimetilsulfóxido (DMSO) e congelam utilizando protocolos padrão.
Nota: Na seção de resultados representativos, há descrições de caracterização MSC utilizando citometria de fluxo, a diferenciação da mesoderme e análise FISH XY para determinar o sexo do três diferentes (D, CP e CV) populações de células expandidas. Em nosso estudo, placentas eram de bebés do sexo masculino; assim todocélulas fetais podem ser distinguidos como macho (cromossomo Y) e todas as células maternas poderiam ser distinguidos como feminino (cromossoma X apenas).
Resultados
O processo de isolamento da placenta MSC está sumariado na Figura 1. As três áreas de a anatomia da placenta a partir do qual foram isolados MSC são destacadas na Figura 2. Estes são o decídua materna, bem como os tecidos fetais em grande parte da placa coriónica e vilosidades coriónicas. Muitos livros de texto, artigos e detalhe recursos on-line o desenvolvimento eo papel funcional dos vários tecidos placentários (ver referência 8).
Morfologia das culturas 48 horas após o isolamento e a remoção dos detritos de tecido.
Na sequência de 48 horas de cultura, a MSC vai ter anexado ao plástico de cultura de tecidos, enquanto hemácias ea maioria dos outros restos celulares não vai ter anexado. Neste momento, a forma deve ser substituído com 35 ml de meio de cultura fresco. Antes desta troca de meio, é difícil fazer observações precisos devido aoum grande número de glóbulos vermelhos, o que vai obstruir a avaliação visual. A aparência do sobrenadante da cultura pode variar substancialmente entre os doadores de placenta. Esta variação pode ser visto visualmente no Exemplo 1 e 2 (Figura 3A). Estes dois isolamentos MSC, que pareciam ser muito diferentes, foram realizadas simultaneamente de duas placentas diferentes. No entanto, uma vez lavada, ambas as culturas apareceram semelhante (ver exemplo lavada 3, Figura 3A).
Sob um microscópio, após a troca de meios 48 h, apenas algumas células irá ser ligado ao frasco (Figura 3B), e as células aparece significativamente diferente do MSC expandidas mais extensivamente. Alguns restos de glóbulos vermelhos e será visível como flutuantes ou ligados aglomerados e estes não vão interferir com o crescimento de MSCs. As células fibroblásticas já aderiram ao fundo do frasco são susceptíveis de ser uma mistura de células, incluindo MSC, hematopoiético,trofoblástica ou células endoteliais. Mais uma vez, as células não-MSC não comprometer as culturas de MSC, uma vez que estas células não irá geralmente sobreviver mais do que 1-2 passagens nas condições de cultura MSC. Apesar de algumas variações no aparecimento inicial de culturas, os resultados subsequentes de expansão são geralmente consistentes.
Morfologia das culturas MSC ao longo do tempo.
Neste exemplo representativo, sete dias após o isolamento, as pequenas colónias MSC fibroblásticas foram visível, embora as células não-MSC pode também ser visto como redonda ou células fracamente ligados (Figura 4A). As células ligadas são o que foi originalmente designado por "unidade de formação de colónia -fibroblast "(CFU-F) 17 e, mais tarde denominado MSC 18. Treze dias após o isolamento, as colónias MSC fibroblásticas eram grandes (Figura 4B). Geralmente, a monocamada será de 80-90% confluentes neste ponto e as células devem ser Passa GED. De passagem 2 em diante, a monocamada de MSC placentária irá desenvolver a morfologia de hidromassagem-como característica a confluência (Figura 4C). A menos que as células são passadas a uma densidade baixa, já não será observada a formação de CFU-M. A baixa densidade, MSC derivadas de placenta têm uma aparência mais pequeno, mais quadrada de osso adulto MSC derivadas de medula 1. Enquanto MSC derivadas da placenta e do MSC derivadas da medula óssea apresentam taxas de proliferação semelhantes, as células derivadas da placenta-são menos propensas a senescência rápida 5.
Caracterização da MSC placenta in vitro.
Cada população de células expandida devem ser caracterizados para garantir que está de acordo com critérios MSC padrão 16, incluindo (1) adesão de plástico (2) a presença de marcadores de superfície mesenquimais e a ausência de marcadores de superfície hematopoiéticas, e (3) a capacidade de se submeter mesodérmica diferenciação.
Como mostrado na Figura 4, as MSC em cultura são de plástico aderente e têm uma morfologia fibroblástica semelhantes; Isso valida que as células atender os primeiros critérios que definem MSC 16.
MSC marcadores de superfície de exibição mesenquimais placentária.
A segunda característica definidora MSC é a presença de marcadores de superfície mesenquimais e a ausência de marcadores de superfície 16 hematopoiéticas. Como não há um único marcador capaz de identificar definitivamente um MSC, painéis de marcadores são geralmente utilizados em conjunto com a análise de citometria de fluxo para identificar células que são mesenquimal, mas não hematopoiéticas. No conjunto de dados representativo aqui fornecida (Figura 5A), avaliou-se a expressão de células de mesenquimais marcadores CD73, CD105, CD90, CD146 e CD44, os marcadores hematopoiéticas CD45 e CD34, e HLA-DR, como WELl como o CD31 marcador endotelial. Todos os anticorpos utilizados neste processo de caracterização MSC placentária estão listados na Tabela de materiais / equipamentos. A coloração foi realizada de acordo com as instruções do fabricante, com métodos de análise aqui descritos 19.
As células foram positivas para os marcadores mesenquimais CD73, CD105, CD44, e negativos para os marcadores de superfície celular CD45, CD34, HLA-DR e CD31, como era esperado 5,20. Aproximadamente, 37% e 57% das células no nosso conjunto de dados representativos foram positivas para CD90 e CD146 21, respectivamente. Ambos CD90 e CD146 são comumente utilizados MSC marcadores 21. Perfis marcador da superfície celular do MSC pode ser diferente dependendo da fonte MSC tecido, composição do meio, ou o número de passagem 22. Em nossos muitos anos de experiência, não observamos a contaminação a longo prazo da MSC derivadas de placenta com células não-mesenquimais seguinte 1-2 passages 5,11.
exibição MSC placentária potencial de diferenciação mesenquimal
Por definição, a MSC deve possuir in vitro mesodérmico capacidade de diferenciação 5,13. potencial de diferenciação mesodérmica é comumente avaliada, quer através de ensaios de diferenciação tri- ou bi-linhagem. ensaios Bi-linhagem geralmente avaliar osteogênico e capacidade de diferenciação adipogênica, enquanto os testes de tri-linhagem, adicionalmente, avaliar a capacidade de diferenciação condrogênica. Nos resultados representativos aqui apresentados, que demonstram que as MSC populações expandidas formar ambos os depósitos de cálcio, indicativos de diferenciação osteogénica, e vacúolos lipídicos, indicativo da adipogénese (Figura 5B).
Para caracterizar as populações MSC relatados, semeadas em células de cultura de 24 poços a 6 x 10 4 células em 1 ml de meio de indução. A compo médionentes estão listadas na Tabela de materiais / equipamentos. Enquanto formulações meio de indução são comuns na literatura, há variabilidade considerável em formulações publicadas. Por este motivo, uma breve lista nossos indução meio de formulações e abordagens de coloração aqui. meio de indução osteogénico continha DMEM-HG, 10% de FBS, solução de antibiótico antimicótico 1x, 10 mM β-glicerol fosfato, 100 nM de dexametasona, e 50 uM de ácido L-ascórbico 2-fosfato. meio de indução Adipog�ica continha DMEM-HG, 10% de FBS, solução de antibiótico antimicótico 1x, 10 ug / ml de insulina, 100 nM de dexametasona, 200 uM indometacina, e 500 uM xantina 3-isobutil-1-metil. Aqui, as culturas foram mantidas num banho a 37 ° C, 5% de CO2 e foram cultivadas durante 14 dias. meio de indução foi trocado duas vezes por semana durante o período de cultura. Após 14 dias de indução, as culturas foram caracterizados para qualquer matriz óssea-like (osteogênese) ou vacúolos lipídicos (adipogênese) como por nossa prevpublicação ious 5. análise deposição de matriz de cálcio osteogénica foi alcançado por primeiro aspiração para fora da forma, que fixa as culturas com 4% de paraformaldeído durante 20 min, lavagem da monocamada com DPBS, e então coloração com Vermelho de Alizarina S de acordo com as instruções do fabricante. Adipog�ica indução foi avaliada por aspiração para fora da forma, que fixa as culturas com 4% de paraformaldeído durante 20 minutos, lavando a monocamada, e coloração com Oil Red O solução de acordo com as instruções do fabricante. depósitos de cálcio manchado e vacúolos de petróleo foram então visualizados com um microscópio de luz, e as imagens gravadas para referência futura.
Em publicações anteriores, temos caracterizado o potencial de diferenciação das MSC derivadas de placenta mais extensivamente 4,5. Derivados de MSC placentária osteogénese é semelhante ao MSC derivadas de medula óssea, ao passo que a adipogénese é geralmente menos eficaz em MSC derivadas de placenta 5 </ Sup>. Nós não costumam realizar diferenciação condrogênica por várias razões, embora este tenha sido previamente relatada por nós para placentária-MSC 5. Em primeiro lugar, enquanto a capacidade de diferenciação da mesoderme é uma característica de definição de MSC, que é susceptível de importância secundária 23-25, especialmente quando o benefício terapêutico é provável que seja derivada de secreções o MSC 26 parácrinos. Em segundo lugar, embora Dominici et al. Propuseram critérios mínimos para a produção clínica de adultos óssea MSC derivadas de medula humana 16, estudos mais recentes indicam MSC de diferentes nichos têm diferentes propriedades inerentes e capacidades de diferenciação 5,13,27-32. Na verdade, Parolini et ai. Proposto que MSC derivadas da placenta deve diferenciar em linhagens "um ou mais" mesodérmica, em vez de todas as três linhagens 10. Finalmente, muitos estudos MSC excluir condrogénica diferenciação, uma vez que ocorre através de uma semelhantevia intracelular de sinalização como a osteogênese (via de família TGF) 33-35.
Placentária MSC são materna na origem, utilizando este método de cultura, apesar da localização anatômica do material de partida.
Muitas publicações assumir que as células isoladas a partir do cório rendimento MSC fetal fetal após cultura 14. No entanto, como já relatado anteriormente 5, todas as culturas derivadas de córion fetal, utilizando este protocolo, rapidamente tornar-se enriquecido para MSC materna como intuitivamente ser esperado para os maternos culturas MSC deciduais. Nestes resultados representativos foi utilizado a partir de tecido placentário bebés do sexo masculino de modo que era possível delinear facilmente a contribuição da célula fetal e materno nas populações de células expandidas. Para estes estudos utilizou-se o kit FISH XY listadas na Tabela de materiais / equipamentos, e seguiu as instruções do fabricante.
Nos dados representativos aqui apresentados, as culturas derivadas de decídua materna eram células maternas ~ 90% (XX) e ~ 10% de células fetais (XY) na passagem 0 (Figura 6) . Por passagem 2, as populações de células derivadas a partir dos tecidos maternos foram ~ 100 células maternas% (XX), e as células fetais (XY) foram indetectáveis. Isto sugere que a dissecção física do tecido materno conduzido para o enriquecimento de células maternas nas culturas subsequentes. No entanto, é importante considerar os resultados de cultura de vilosidades coriónicas fetal e culturas derivadas de placa coriônicos. Na passagem 0, placa culturas derivadas tanto fetal de vilosidades coriónicas e coriônicos foram ~ 85% XY, ou de origem fetal, indicando que a dissecção alvejado enriquecida para células fetais (Figura 6). Na passagem 0, ambas as culturas continham contaminação ~ celular materna de 15% (XX). Surpreendentemente, na passagem 2, ambas as culturas fetais foram povoados com ~ 100% de células maternas (XX), e as células fetais (XY)já não eram detectáveis. análise FISH XY revela que células maternas (cromossomos XX) de forma rápida e consistente de aquisição das culturas derivadas de tecidos fetais coriônica. Esta é uma observação cultura crítica que é frequentemente esquecido 5. O detalhe desta análise está incluído neste protocolo porque demonstra a observação muito importante que as células maternas preencher rapidamente todas as culturas quando DMEM suplementado com FBS a 10% é utilizado sem factores adicionais concebidos para apoiar as populações de derivação fetal.
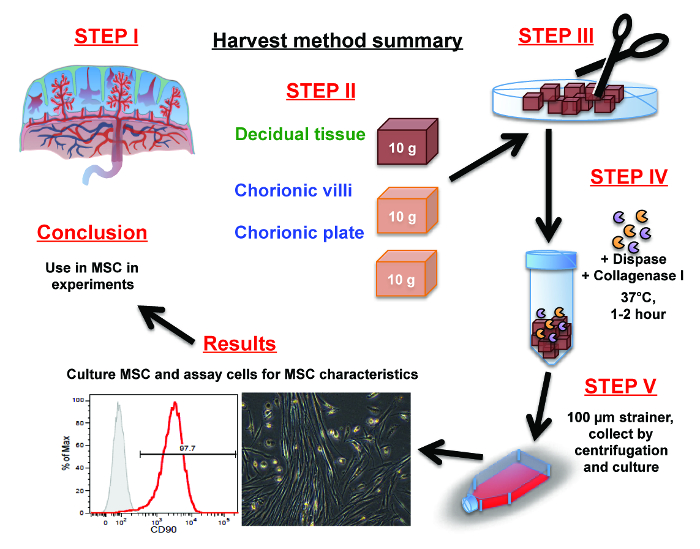
Figura 1:. Resumo do processo de isolamento MSC placentária (Passo 1) orientar-se com a anatomia da placenta. (Passo 2) dissecar manualmente 10 g de tecido a partir de qualquer decídua, vilo corial ou a placa coriônica com uma tesoura. (Passo 3) Mince tele dissecou porções de decídua, vilo corial ou os tecidos placa coriônica em pedaços finos com uma tesoura ou um bisturi.
(Passo 4) a partir de células de libertar os pedaços finos por meio de uma digestão de 1-2 horas em dispase e colagenase I.
(Passo 5) separar as células do tecido fibroso por centrifugação de pulso e / ou lavá-las através de um filtro de células. Recolha e ressuspender as células em meio de cultura e colocados em frascos de cultura. Por favor clique aqui para ver uma versão maior desta figura.
células estromais mesenquimatosas (MSC) serão seleccionados com base na sua propensão para a aderência ao plástico e capacidade para sobreviver e proliferar no meio de cultura. Por último, na secção de resultados, a MSC expandida pode ser caracterizado e armazenado para utilização em experiências futuras.
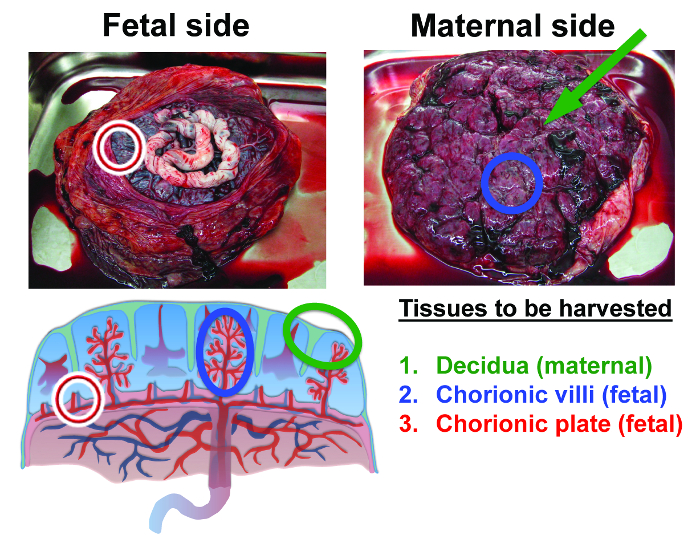
Figura 2:. Anatomia da placenta prazo e tecidos humanos isolados Neste procedimento, o primeiro tecido a ser colhida é decídua materna. Decidua é o tecido que permanece como uma camada fina sobre a superfície da placenta após o que se desprende da parede uterina (decidua é identificado pelos marcadores verdes). O segundo tecido que irá ser colhida a partir do interior da placenta é vilosidades coriónicas fetal (marcadores azul). O terceiro tecido a ser colhida é de placa fetal coriônica (marcadores vermelhos) (adaptado da referência 36). Por favor clique aqui para ver uma versão maior desta figura.

Figura 3: Morfologia de culturas de 48 h depois do isolamento e remover os detritos de tecido. (A) O aparecimento do sobrenadante da cultura pode variar substancialmente entre os doadores de placenta antes de lavar os detritos. Exemplo culturas 1 e 2 demonstram esta variação. Estes dois isolamentos foram realizadas simultaneamente, mas a partir de duas placentas diferentes. Uma vez que as culturas lavadas será claro de hemácias e restos de tecido, como mostrado no exemplo 3. Os resultados de expansão subsequentes são geralmente consistentes. (B) Seguindo o intercâmbio meios 48 h, apenas algumas células irá ser ligado ao frasco. Barra de escala = 200 mm. Por favor clique aqui para ver uma versão maior desta figura.

Figura 4:. Morfologia de culturas MSC ao longo do tempo (A), sete dias após o isolamento, a pequena fcolónias MSC ibroblastic são visíveis embora as células não-MSC estará também presente como redonda ou células fracamente ligados. (B) 13 dias após o isolamento, as colónias MSC fibroblásticas são grandes e muitas vezes a monocamada de MSC é confluentes e pronto para a passagem. (C) De passagem 2 em diante, a monocamada MSC irá desenvolver uma morfologia de hidromassagem-como característica a confluência. Barra de escala = 200 mm. Por favor clique aqui para ver uma versão maior desta figura.
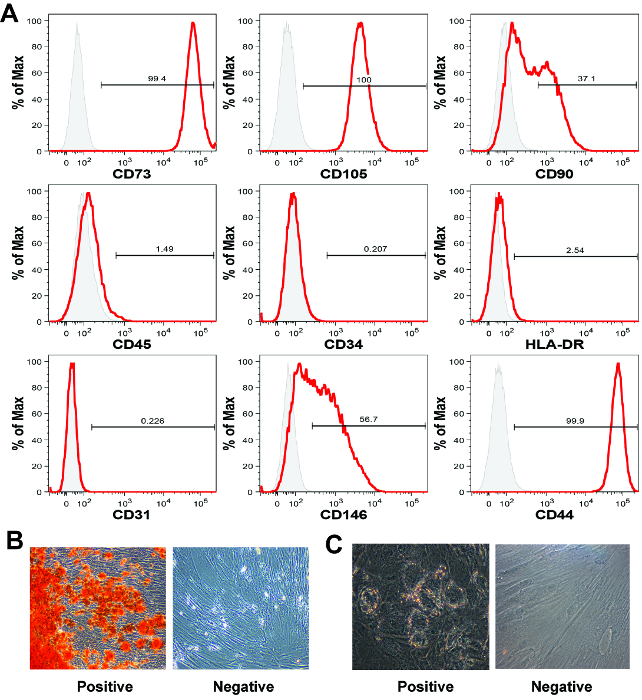
Figura 5:. Caracterização MSC por citometria de fluxo e a diferenciação da mesoderme (A) O MSC derivadas de vilosidades coriónicas placentária exibir um perfil clássico MSC marcador por análise de citometria de fluxo, ainda que para estes marcadores de superfície celular, expressSion é semelhante para todos os tipos de MSC humana. Cada histograma mostra a intensidade do sinal (eixo x) versus o número de células normalizada no eixo Y (% da máxima). Neste dados representativos definidas as células foram positivas para CD73, CD105 e CD44 e negativo para os marcadores hematopoiéticas CD45 e CD34 e HLA-DR. (B) placentária MSC geralmente sofrem diferenciação osteogénica robusta, no entanto (C) adipogênica diferenciação pode ser menos eficiente do que com a MSC derivadas de medula óssea. Imagens em rubricas B e C foram tomadas em 40X de ampliação. Por favor clique aqui para ver uma versão maior desta figura.

Figura 6: MSC placentária são materna na origem, utilizando este método de cultura, apesar da localização anatômica do material de partida.Os gráficos mostram quantificação do fetal (masculino, XY) e materna composição celular (feminino, XX) das culturas MSC placenta isoladas de decidual, vilo corial e tecidos placa coriônica em cada segunda passagem. células maternas (XX) de forma rápida e reprodutível assumir as culturas derivadas de tecidos fetais coriônica. Fetal = masculino = cromossomos XY detectados em uma célula individual, materno = feminino = XX cromossomos detectados em uma célula individual. Os dados aqui apresentados foi a partir de n = 3 placentas doadores independentes de bebés do sexo masculino, com um mínimo de 100 células coradas para XY FISH e contados para cada ponto de dados. As barras representam as médias e barras de erro refletem um desvio padrão. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
A placenta é um órgão feto-materna fisicamente grande, a partir do qual MSC fetal ou materno pode ser isolado 22. Aqui, nós fornecemos um panorama detalhado da anatomia da placenta e instruções sobre como dissecar especificamente decídua (materna), vilo corial (fetal), e placa coriônica (fetal) de tecido (Passo 2,2-2,4). Posteriormente, traçamos um protocolo robusto que permite o isolamento MSC de cada um destes três tecidos (Passo 2,5-2,6). Expansão da placenta MSC é eficiente e culturas aparecer semelhante ao osso derivadas de medula culturas MSC (Figuras 3 e 4). Diferenciação osteogénica é fiável (Figura 5B), enquanto que a diferenciação adipogênica é geralmente menos eficientes (Figura 5C) 5.
Muitos recém-chegados ao campo irá presumir que as culturas derivadas de vilo corial fetal ou tecidos placa coriônica será enriquecido por MSC fetal. No entanto, em nossas mãos feenriquecimento de células tal só é transitória quando o meio de expansão MSC padrão tal como DMEM-LG + 10% FBS é utilizado 5. Aqui nós fornecemos resultados representativos usando tecidos da placenta derivadas de um bebê do sexo masculino. Ao usar o tecido da placenta de um bebê do sexo masculino, as células fetais são facilmente identificáveis como tendo cromossomos XY, enquanto as células maternas são identificáveis como tendo cromossomas XX. A Figura 6 mostra XY resultados peixe para uma cultura representativa. Enquanto MSC fetal (XY) são enriquecidos (até 80%) nas culturas iniciais derivados de vilosidades coriónicas fetal ou tecidos placa coriónicas, estas mesmas culturas são rapidamente ultrapassada (~ 100%) por materna (XX) MSC sobre as duas primeiras passagens . Na forma padrão, composto por DMEM-LG + FBS a 10%, o MSC materno-derivados poucos que contaminam os tecidos fetais outcompete as células fetais derivadas em cultura.
Um passo crítico descrito neste protocolo é uma apreciação da anatomia da placenta e de onde fetale tecido materno pode ser mais eficazmente colhidas. Conforme descrito na seção de resultados representativos, dissecção de tecido fetal não permitir o enriquecimento transitória para MSC derivadas de fetal. Melhorias na formulação do meio de expansão, através da suplementação exógena específico médio do factor de crescimento deve permitir a expansão selectiva das populações MSC de derivação fetal, e fabricar um produto celular que é enriquecido por fetal, em vez de células maternas (o nosso grupo está actualmente a desenvolver tais formulações médias). O fabrico de populações MSC fetais pode ter um número de vantagens, como MSC fetal são supostas ter maior angiogénese e propriedades imunossupressoras do que equivalentes populações MSC 37 maternas.
Em cada um dos protocolos de isolamento descritos, utilizou-se cerca de 10 g de tecido. Toda uma placenta é tipicamente 500-750 g, e em trabalhos anteriores que demonstraram que através do tecido automatizada digestão e um biorreator proc expansão celularcessos que deveria ser possível fabricar mais de 7.000 doses de células clínicos de uma única placenta 4. Esses números destacam a adequação potencial de MSC derivadas da placenta em terapias MSC alogénicas, ea importância deste método, independentemente da origem MSC (fetal ou materna). Do ponto de vista terapêutico, é mais crítico que os usuários tenham um entendimento completo do produto celular e capacidade para fabricar de forma confiável este produto celular. Esperamos que o nosso vídeo vai ajudar os pesquisadores a entender a anatomia da placenta, isolar MSC a partir da placenta, e antecipar a composição celular fetal ou materna provável de suas culturas.
Divulgações
The authors have nothing to disclose.
Agradecimentos
RP foi apoiado por um Conselho Nacional de Saúde e de Investigação Médica (NHMRC) Pós-Doutorado Training Fellowship. VS foi apoiado por uma bolsa de estudos da Universidade de Queensland International Postgraduate Student. MRD foi apoiado pela NHMRC e Inner Roda Austrália.
Agradecemos pessoal clínico e de enfermagem para auxiliar o consentimento do paciente e coleta de amostras. Agradecemos Prof. Nickolas Fisk, Prof. Kerry Atkinson eo Dr. Rohan Lourie para discussões criteriosas em obstetrícia, o desenvolvimento feto-placentária e anatomia placenta.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| HBSS | Gibco/Invitrogen | 14185-052 | Long name: Hanks Balanced Salt Solution |
| FBS | Gibco/Invitrogen | Long name: Fetal Bovine Serum | |
| trypsin-substitute | Gibco/Invitrogen | 12563-029 | Long name: TrypLE Select |
| DMEM-LG | Gibco/Invitrogen | 11885-092 | Long name: Dulbecco’s Modified Eagles Medium-Low Glucose |
| DMEM-HG | Gibco/Invitrogen | 11965118 | Long name: Dulbecco’s Modified Eagles Medium-HIgh Glucose (4.5 g/L) |
| PBS (Mg+Ca+ free) | Gibco/Invitrogen | 14190-250 | Long name: Dulbecco's Phosphate buffered saline, magnesium and calcium free |
| Anti- anti- | Gibco/Invitrogen | 15240-062 | Long name: antibiotic-antimycotic solution x100 |
| paraformaldehyde powder or 4% solution | any | ||
| Collagenase I | Invitrogen | 17100-017 | 2,500 U/ml |
| Dnase I | Sigma | D5025 | 10 mg/ml in 0.15 M NaCl |
| Dispase | Invitrogen | 17105-041 | 10 mg/ml in water (20,000 U/ml). |
| Material | Company | Catalog Number | Comments |
| Disposables: | |||
| 50 ml centrifuge tubes | Falcon or any brand | ||
| petri dishes, sterile plactic (25 cm and 10 cm diameter) | Nunc | ||
| Cell strainers (100 μm) | Becton Dickinson | 352340 | |
| 175 and 75 cm2 (T175 and T75) tissue culture flasks | Nunc | ||
| 5 ml, 10 ml, 25 ml sterile serolgical pipettes | any brand | ||
| Material | Company | Catalog Number | Comments |
| Equipment: | |||
| Centrifuge | |||
| tissue culture incubator 37 °C, 5% CO2 | |||
| Biological safety cabinet | |||
| Sterile scissors and tweezers | |||
| Tube racks | |||
| Pipette-boy or equivalent | |||
| Gilson type pipetters and sterile tips 1,000 µl, 200 µl, 20 µl. | |||
| rocking or shaking incubator (37 °C) | |||
| personal protective equipment | |||
| cleaning solutions (suitable for blood) | |||
| waste containers, correct disposal bins for tissue/blood | |||
| Reagents for MSC characterization | |||
| Antibody (Clone ID) | Manufacturer | Catalogue No. | Isotype |
| CD73 (AD2) | Miltenyi Biotec | 130-095-183 | Mouse IgG1 |
| CD105 (43A4E1) | Miltenyi Biotec | 130-094-941 | Mouse IgG1 |
| CD90/Thy-1 (AC122) | Miltenyi Biotec | 130-095-403 | Mouse IgG1 |
| CD45 (5B1) | Miltenyi Biotec | 130-080-202 | Mouse IgG2a |
| CD34 (AC136) | Miltenyi Biotec | 130-090-954 | Mouse IgG2a |
| HLA-DR (AC122) | Miltenyi Biotec | 130-095-298 | Mouse IgG2a |
| CD31 (PECAM-1) | BD Pharmingen | 555446 | Mouse IgG1 |
| CD146 (541-10B2) | Miltenyi Biotec | 130-092-849 | Mouse IgG1 |
| CD44 (DB105) | Miltenyi Biotec | 130-095-180 | Mouse IgG1 |
| Isotype Controls (Clone ID) | Manufacturer | Catalogue No. | |
| Mouse IgG1 Isotype (IS5-21F5) | Miltenyi Biotec | 130-092-214 | |
| Mouse IgG1 Isotype (IS5-21F5) | Miltenyi Biotec | 130-092-212 | |
| Mouse IgG1 Isotype (IS5-21F5) | Miltenyi Biotec | 130-092-213 | |
| Mouse IgG2a (S43.10) | Miltenyi Biotec | 130-091-837 | |
| Mouse IgG2a (S43.10) | Miltenyi Biotec | 130-098-849 | |
| MACS Buffer | Miltenyi Biotec | 130-091-221 | |
| Osteogenic differentation | Manufacturer | Catalogue No. | |
| DMEM-HG | Gibco/Invitrogen | 11965118 | Long name: Dulbecco’s Modified Eagles Medium-HIgh Glucose (4.5 g/L) |
| FBS | Gibco/Invitrogen | Long name: Fetal Bovine Serum | |
| Anti- anti- | Gibco/Invitrogen | 15240-062 | Long name: antibiotic-antimycotic solution x100 |
| Dexamethasone | Sigma | D4902 | |
| β-Glycerol Phophate | Sigma | 50020 | |
| L-ascorbic acid 2-phosphate | Sigma | A8960-5G | |
| Alizarin Red S | Sigma | A5533-25G | For calcium matrix staining |
| Adipogenic differentation | Manufacturer | Catalogue No. | |
| DMEM-HG | Gibco/Invitrogen | 11965118 | Long name: Dulbecco’s Modified Eagles Medium-HIgh Glucose (4.5 g/L) |
| FBS | Gibco/Invitrogen | Long name: Fetal Bovine Serum | |
| Anti- anti- | Gibco/Invitrogen | 15240-062 | Long name: antibiotic-antimycotic solution x100 |
| insulin | Sigma | I2643 | |
| Dexamethasone | Sigma | D4902 | |
| Indomethacin | Sigma | I7378 | |
| 3-isobutyl-1-methyl xanthine | Sigma | I5879 | |
| Oil Red O solution | Sigma | O1391-250ML | For lipid vacuole staining |
| XY FISH kit to determine fetal or maternal origin of cells | |||
| XY chomosome FISH kit | Vysis (Abbott Molecular) | 07J20-050 | Long name: CEP X SpectrumOrange/Y SpectrumGreen Direct Labeled Fluorescent DNA Probe Kit |
Referências
- Brooke, G., et al. Therapeutic applications of mesenchymal stromal cells. Semin Cell dev Biol. 18, 846-858 (2007).
- Wei, X., et al. Mesenchymal stem cells: a new trend for cell therapy. Acta Phamacol Sin. 34, 747-754 (2013).
- Ma, S., et al. Immunobiology of mesenchymal stem cells. Cell Death Differ. 21, 216-225 (2014).
- Timmins, N. E., et al. Closed system isolation and scalable expansion of human placental mesenchymal stem cells. Biotechnol Bioeng. 109, 1817-1826 (2012).
- Barlow, S., et al. Comparison of human placenta- and bone marrow-derived multipotent mesenchymal stem cells. Stem Cell Dev. 17, 1095-1107 (2008).
- Jones, B. J., Brooke, G., Atkinson, K., McTaggart, S. J. Immunosuppression by placental indoleamine 2,3-dioxygenase: a role for mesenchymal stem cells. Placenta. 28, 1174-1181 (2007).
- Parolini, O., et al. Toward cell therapy using placenta-derived cells: disease mechanisms, cell biology, preclinical studies, and regulatory aspects at the round table. Stem Cell Dev. 19, 143-154 (2010).
- Benirschke, K., Burton, G. J., Baergen, R. N. Pathology of the Human Placenta. , 6 edn (2012).
- Moore, K., Persaud, T., Torchia, M. The developing human: clinically oriented embryology. , Elsevier/ Saunders. (2013).
- Parolini, O., et al. Concise review: isolation and characterization of cells from human term placenta: outcome of the first international Workshop on Placenta Derived Stem Cells. Stem cells. 26, 300-311 (2008).
- Brooke, G., et al. Manufacturing of human placenta-derived mesenchymal stem cells for clinical trials. Brit J Haematol. 144, 571-579 (2009).
- Pelekanos, R. A., et al. Intracellular trafficking and endocytosis of CXCR4 in fetal mesenchymal stem/stromal cells. BMC cell biology. 15, 15(2014).
- Chen, Y. S., et al. Small molecule mesengenic induction of human induced pluripotent stem cells to generate mesenchymal stem/stromal cells. Stem Cells Transl Med. 1, 83-95 (2012).
- Heazlewood, C. F., et al. High incidence of contaminating maternal cell overgrowth in human placental mesenchymal stem/stromal cell cultures: a systematic review. Stem Cells Transl Med. 3, 1305-1311 (2014).
- Horn, P., Bork, S., Wagner, W. Standardized isolation of human mesenchymal stromal cells with red blood cell lysis. Methods Mol Biol. 698, 23-35 (2011).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8, 315-317 (2006).
- Friedenstein, A. J., et al. Precursors for fibroblasts in different populations of hematopoietic cells as detected by the in vitro colony assay method. Exp Hematol. 2, 83-92 (1974).
- Caplan, A. I. Mesenchymal stem cells. J Orthop Res. 9, 641-650 (1991).
- Futrega, K., et al. The microwell-mesh: A novel device and protocol for the high throughput manufacturing of cartilage microtissues. Biomaterials. 62, 1-12 (2015).
- Liu, Y., Goldberg, A. J., Dennis, J. E., Gronowicz, G. A., Kuhn, L. T. One-step derivation of mesenchymal stem cell (MSC)-like cells from human pluripotent stem cells on a fibrillar collagen coating. PloS one. 7, 33225(2012).
- Maleki, M., Ghanbarvand, F., Reza Behvarz, M., Ejtemaei, M., Ghadirkhomi, E. Comparison of mesenchymal stem cell markers in multiple human adult stem cells. Int J Stem Cell. 7, 118-126 (2014).
- Hass, R., Kasper, C., Bohm, S., Jacobs, R. Different populations and sources of human mesenchymal stem cells (MSC): A comparison of adult and neonatal tissue-derived MSC. Cell Commun Signal. 9, 12(2011).
- Bianco, P., Robey, P. G., Simmons, P. J. Mesenchymal stem cells: revisiting history, concepts, and assays. Cell stem cell. 2, 313-319 (2008).
- Bianco, P., et al. The meaning, the sense and the significance: translating the science of mesenchymal stem cells into medicine. Nature med. 19, 35-42 (2013).
- Da Silva Meirelles, L., Caplan, A. I., Nardi, N. B. In search of the in vivo identity of mesenchymal stem cells. Stem cells. 26, 2287-2299 (2008).
- Caplan, A. I., Correa, D. The MSC: an injury drugstore. Cell Stem Cell. 9, 11-15 (2011).
- Wegmeyer, H., et al. Mesenchymal Stromal Cell Characteristics Vary Depending on Their Origin. Stem Cell Dev. , (2013).
- Guillot, P. V., Gotherstrom, C., Chan, J., Kurata, H., Fisk, N. M. Human first-trimester fetal MSC express pluripotency markers and grow faster and have longer telomeres than adult MSC. Stem cells. 25, 646-654 (2007).
- Covas, D. T., et al. Multipotent mesenchymal stromal cells obtained from diverse human tissues share functional properties and gene-expression profile with CD146+ perivascular cells and fibroblasts. Exp Hemol. 36, 642-654 (2008).
- Crisan, M., et al. A perivascular origin for mesenchymal stem cells in multiple human organs. Cell stem cell. 3, 301-313 (2008).
- Pelekanos, R. A., et al. Comprehensive transcriptome and immunophenotype analysis of renal and cardiac MSC-like populations supports strong congruence with bone marrow MSC despite maintenance of distinct identities. Stem cell res. 8, 58-73 (2012).
- da Silva Meirelles, L., Chagastelles, P. C., Nardi, N. B. Mesenchymal stem cells reside in virtually all post-natal organs and tissues. J Cell Sci. 119, 2204-2213 (2006).
- James, A. W. Review of Signaling Pathways Governing MSC Osteogenic and Adipogenic Differentiation. Scientifica (Cairo). 2013, 684736(2013).
- Xu, C., et al. Cross-Talking between PPAR and WNT Signaling and Its Regulation in Mesenchymal Stem Cell Differentiation. Curr Stem Cell Res Ther. , (2015).
- Zhuang, H., et al. Molecular Mechanisms of PPAR-gamma Governing MSC Osteogenic and Adipogenic Differentiation. Curr Stem Cell Res Ther. , (2015).
- Moore, K., Persaud, T., Torchia, M. Before We Are Born: Essentials of Embryology and Birth Defects. , Elsevier Health Sciences. 8 edn (2011).
- Zhu, Y., et al. Placental mesenchymal stem cells of fetal and maternal origins demonstrate different therapeutic potentials. Stem Cell Res Ther. 5, 48(2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados