Method Article
Isolierung und Expansion von mesenchymalen Stamm- / Stroma-Zellen aus humanen Placenta Gewebe gewonnen
In diesem Artikel
Zusammenfassung
Hier beschreiben wir Verfahren zur Präparation von fetalen und mütterlichen Geweben aus menschlichen Plazenta, gefolgt von der Isolierung und Expansion von mesenchymalen Stamm- / Stromazellen (MSC) aus diesen Geweben.
Zusammenfassung
Mesenchymal stem/stromal cells (MSC) are promising candidates for use in cell-based therapies. In most cases, therapeutic response appears to be cell-dose dependent. Human term placenta is rich in MSC and is a physically large tissue that is generally discarded following birth. Placenta is an ideal starting material for the large-scale manufacture of multiple cell doses of allogeneic MSC. The placenta is a fetomaternal organ from which either fetal or maternal tissue can be isolated. This article describes the placental anatomy and procedure to dissect apart the decidua (maternal), chorionic villi (fetal), and chorionic plate (fetal) tissue. The protocol then outlines how to isolate MSC from each dissected tissue region, and provides representative analysis of expanded MSC derived from the respective tissue types. These methods are intended for pre-clinical MSC isolation, but have also been adapted for clinical manufacture of placental MSC for human therapeutic use.
Einleitung
Mesenchymale Stammzellen / Stromazellen (MSC) entstehen als aussichtsreicher Kandidat für die Verwendung in zellbasierten Therapien 1. Die meisten Anwendungen werden zwei MSC-vermittelte Gewebereparatur oder Immunregulation zu zielen. In vielen dieser Anwendungen kann allogenen MSC sein , so effektiv wie autologe MSC 3. Der Einsatz von allogenen MSC hat den wirtschaftlichen Vorteil , der mit der großtechnischen Herstellung von mehreren Zelldosen aus einer Hand Gewebe 4 kompatibel für viele Patienten zu behandeln.
Historisch gesehen , aus dem Knochenmark 4 präklinische und klinische Studien haben MSC-derived verwendet. Knochenmark wird aus dem Beckenkamm eines Freiwilligen Spender im Allgemeinen gesammelt. Dieses Verfahren ist invasiv und nur ein kleines Volumen von marrow (~ 20 ml) wird durch eine einzige Punktion entnommen. Generierung klinisch bedeutsame Zahl von MSC erfordert in vitro - Expansion umfangreich. Totipotenz nimmt mit Passage-Nummer 3, ein Paradoxon zu schaffen , wo die theoretische Anzahl der für die klinische Wirksamkeit erforderlich Zellen desto mehr wird die Zellpopulation erhöht wird erweitert. Im Gegensatz zu Knochenmark - Aspiraten ist Begriff Plazenta eine physikalisch große Ausgangsgewebe (typischerweise 500-750 g 4), die ohne Risiko für den Spender während aseptisch Sectio geerntet werden können. MSC aus der Plazenta haben MSC langfristige Proliferation 5 und immunmodulierende Kapazität 6, überlegen aus dem Knochenmark abgeleitet. In einer früheren Studie haben wir gezeigt , dass eine einzige Begriff Plazenta für die Herstellung von bis zu 7.000 klinischen Dosen 4 ausreichend MSC enthalten. Diese Eigenschaften machen placenta eine ideale Quelle Gewebe für die Herstellung von allogenen MSC.
Die Plazenta ist ein fetomaternalen Organ , bestehend aus sowohl fötalen und mütterlichen Gewebe 7 und damit MSC fetaler oder mütterlichen Ursprungs kann theoretisch sein, isoliert. Die folgenden Referenzen bieten detailed Informationen über die Entwicklung und Pathologie sowie mikroskopische und makroskopische Untersuchung der menschlichen Plazenta und adnexa 8,9. Die Plazenta richtige ist weitgehend von fetalen Blutgefäße und sekretorischen und Stützzellen genannt Trophoblasten besteht, die Chorionzotten durch die Chorion frondosum (Platte) 8 abgedeckt bilden. Die verzweigten Plazentazotten werden im mütterlichen Blut geliefert von der Gebärmutterspiralarterien gebadet, so dass Nährstoff, Hormon-und Gasaustausch zwischen Fötus und Mutter. Die Plazenta auf das Endometrium über mütterliche dezidualen Stromazellen und fetale extravillious Trophoblasten verankert ist , sind in der extrazellulären Matrix 8 durchsetzt. Die Zotten konvergieren auf die fetale Chorionplatte , wo sie die Nabelschnur 8 bilden.
Ein Ergebnis der ersten internationalen Workshop über Plazentare gewonnenen Stammzellen (2008) war eine Anerkennung der Notwendigkeit, die Isolation und characterizatio zu standardisierenn von Zellen aus der menschlichen Plazenta 10. Aufgrund der Anatomie der Plazenta, Präparation der verschiedenen Gewebe, Isolierung von MSC und erwartete Kultur Ergebnisse können für Neulinge auf dem Gebiet überwältigend sein. In diesem Protokoll ist die Ernte von Plazenta Chorion-Gewebe, gefolgt von MSC Isolierung und Expansion gründlich detailliert. MSC Charakterisierung mittels Durchflusszytometrie und in vitro Differenzierung Routine 5,11-13 betrachtet und daher hier nur kurz beschrieben.
Wie kürzlich in einer systematischen Literaturrecherche 14 hervorgehoben, erhalten MSC aus der Plazenta Chorionzotten sind fetale werden allgemein angenommen wird . Obwohl nur 18% der Studien untersuchten die Herkunft der MSC erhalten werden, und von denen nur die Hälfte der Studien berichtet fötalen MSC und die andere Hälfte berichtet mütterlichen oder gemischte Populationen MSC. Jede der drei Gewebe hier beschriebenen Komponenten (Chorionzotten, Chorionplatte und Decidua basalis) sind compin erster Linie aus der fetalen Membran / Zotten und einem geringen Anteil an uterine abgeleitetes mütterlichen Zellen osed, die der entbundenen Plazenta befestigt bleiben. Wir liefern Daten , die zeigen , dass MSC von der mütterlichen Seite der Plazenta zu isolieren, anstatt der fetalen Seite der Plazenta, wie wir zuvor 5,11 berichtet haben, ist ein geeigneter Ausgangsstoff , wenn mütterliche MSC erwünscht sind. Dieses Protokoll beschreibt auch die Verwendung von XY FISH fötalen oder maternalen Beitrag zur Zellkulturen zu validieren. Während dies ein Standardprotokoll des Herstellers ist, wird diese Analyse oft vernachlässigt und seine Bedeutung unterschätzt 14.
Protokoll
Die Human Research Ethikkommissionen bei Mater Health Services Royal Brisbane und Frauenklinik, Queensland University of Technology und der University of Queensland genehmigt die Forschung und Sammlung von menschlichen Plazenta-Proben in der Studie verwendet. Alle Protokolle mit den nationalen Forschungsrichtlinien eingehalten werden. Patienten erbracht zu Forschungszwecken für die Verwendung von Gewebe schriftliche Zustimmung informiert.
Dritten Trimenon Plazenten wurden von gesunden Müttern folgende Routine Sectio (CS) Geburten Begriff aus den oben genannten Krankenhäuser in Brisbane, Australien erhalten. Männliche diskordanten Schwangerschaften Begriff Proben wurden in dieser Studie verwendet, um fötale von mütterlichen Zellen zu unterscheiden. Fetal Geschlecht hatte durch Ultraschall vor der Geburt und / oder visuelle Inspektion des Neugeborenen bei der Geburt durch das Klinikpersonal bestimmt. X und Y - Chromosom - Fluoreszenz in situ Hybridisierung (FISH) wurde aus der erhaltenen Geschlecht und fötalen oder maternalen Ursprungs des Gewebes weiter zu validieren verwendetOriginal Plazenten.
1. Vor der Ernte, Bereiten Sie die folgenden
Hinweis: Bei der Enzymlösungen bilden, die spezifischen Anforderungen und vom Hersteller bereitgestellt Konzentrationen für jedes Produkt befolgt werden sollten. Enzyme werden häufig als rohe Mischung von Proteinen zur Verfügung gestellt, damit ähnliche Enzyme aus verschiedenen Unternehmen sind wahrscheinlich unterschiedliche Aktivitäten / Konzentrationen zu haben. Aus diesem Grund den Rat des Herstellers sollte und Herstellung der Lösung kann modifiziert werden, anerkannt entsprechend werden müssen.
- Bereiten Sie oder kaufen, 1,5 bis 2 L total steril Hanks Balanced Salt Solution (HBSS) für dieses Protokoll.
- Bereiten Sie Kollagenase I-Stammlösung durch Auswiegen Kollagenase Typ I und lösen 1 mg / ml in HBSS und Wirbel sanft vollständige Auflösung zu gewährleisten. Bestimmen das Volumen an HBSS (mit Calcium und Magnesium) erforderlich Kollagenase-Lösung zu 100 Einheiten (U) / & mgr; l (1,000x Stammlösung) zu bringen und dann gefiltert unter Verwendung eines 0,2 &# 181; m-Spritzenfilter. Aliquot 1 ml Volumina in 1,5-ml-Röhrchen und bei -20 ° C bis benötigt.
- Bereiten Dispase Stammlösung durch Auflösen von unsterilen Dispase bei 10 mg / ml in Dulbeccos phosphatgepufferter Salzlösung (DPBS) ohne Calcium oder Magnesium. ohne Calcium oder Magnesium in einer Endkonzentration von 2,4 U / ml weiter mit DPBS verdünnt. Filter zu sterilisieren durch einen 0,2 & mgr; m Spritzenfilter. Aliquot 1 ml Volumina in 1,5-ml-Röhrchen und bei -20 ° C bis benötigt.
- Bereiten Sie Desoxyribonuklase (DNase) -I-Stammlösung durch Auflösen von DNase-I bei 10 mg / ml in 0,15 M NaCl. Filter thorugh ein 0,2 & mgr; m Spritzenfilter. Aliquot 1 ml Volumina in 1,5-ml-Röhrchen und bei -20 ° C bis benötigt.
- Bereiten Sie die Arbeitsaufschlußlösung durch Kombination von 100 U / ml Kollagenase Typ I, I.5 & mgr; g / ml DNase I und 2,4 U / ml Dispase in serumfreiem DMEM. Frisch auftauen und Enzymbestände unmittelbar vor der Verwendung zu verdünnen. Etwa ein 1: 1-Verhältnis von AufschlußlösungVolumen Gewebevolumen erforderlich ist (beispielsweise 10 ml von Gewebe, in einem 50 - ml - Röhrchen gemessen wird , erfordert 10 ml Aufschlußlösung).
- Eine Lösung aus 4% Paraformaldehyd (PFA) in PBS und Einstellen auf pH 7,4 15. Speicher 25 ml Aliquots bei -20 ° C für die langfristige oder bei 4 ° C für 1 Woche.
- Bereiten MSC Kulturmedium aus DMEM-Low Glucose (DMEM-LG), ergänzt mit 1x Antibiotika und Antimykotika-Lösung und 10% nicht hitzeinaktiviertem fötalen Rinderserum. MSC-grade FBS können aus vielen FBS Lieferanten erworben werden.
- Autoklav sterilisieren Dissektion Ausrüstung im Voraus gemäß Richtlinien des Instituts. Dazu gehören Scheren, Zangen, Skalpelle und eine große Metall Dissektion Fach. Sammeln Sie zusätzliche sterile Gewebekulturkunststoffgeschirr und Verbrauchsmaterialien (zB Skalpellklingen, 50 ml und 15 ml Röhrchen, 25 ml, 10 ml und 5 ml Pipetten und 75 oder 175 cm 2 Zellkulturflaschen).
- Verwenden Sie Standard-Primärzellkultur Laborausstattung: eine Klasse II biosafety Schrank geeignet für primäre Zellisolierung, Zellkultur - Inkubator bei 5% CO 2 und 37 ° C, einer Wippe in einem 37 ° C Inkubator und einer Zentrifuge mit einem Fassungsvermögen von 50 ml - Röhrchen eingestellt.
- Verwenden Sie geeignete persönliche Schutzausrüstung: Laborkittel, 2 Paar Handschuhe (jederzeit), Schutzbrille und nahen Schuhe, die vorne nach Richtlinien des Instituts.
- Bereiten Sie geeignete Dekontaminationslösungen für den menschlichen Blutproben nach institutionellen Richtlinien und flüssigen biologischen Abfallbehälter im Voraus.
2. Isolierung der Plazentare MSC
- Herstellung der Placenta
- Kleid in der erforderlichen persönlichen Schutzausrüstung. Stellen Sie den biologischen Sicherheitsschrank mit benötigten Materialien, Lösungen und Abfallbehälter, das Verfahren zur Durchführung von bis zum enzymatischen Abbau (siehe Abschnitt 2.5.6).
- Besorgen Sie sich eine Plazenta mit Einwilligung nach Aufklärung und ethische Genehmigung. Sammeln Sie die Plazenta über cesarean section unter aseptischen chirurgischen Bedingungen und Verpackung in einem sterilen Beutel oder Eimer für den Transport zum Labor.
- Während des Transports und vor der Dissektion, speichern Sie die Plazenta bei Raumtemperatur oder 4 ° C.
Hinweis: Tissue können ohne Beeinträchtigung der Zellkulturleistung für bis zu 6 Stunden gelagert werden.- Begrenzen Sie die Zeit zwischen Plazenta Sammlung und Gewebeverarbeitung, soweit möglich. Diese Empfehlung basiert auf praktische Fragen. In einigen Fällen haben wir die Zellisolierungsverfahren für bis zu 6 Stunden nach der Geburt verzögert. In diesen Fällen Plazenten wurden bei Raumtemperatur oder 4 ° C (im Labor oder an der Sammelstelle) gehalten. Keine nachweisbaren Unterschiede wurden beobachtet obigen allgemeinen Spender Variation in der MSC aus Plazenten erhalten, wenn sie bei 4 ° C oder bei Raumtemperatur gelagert wurden.
- Stellen Sie den Behälter mit der Plazenta in der biologischen Sicherheitsschrank. Öffnen Sie den Behälter und übertragen die Plazenta in einen sterilen Behälter.
- Öffnen Sie die Eihüllen (Fruchtblase oder Amnion-Chorion laeve) 8. Werden mit den Teilen der Plazenta orientiert. Die fetale Seite hat die Nabelschnur Insertion, die in der Regel ist, zentral in der Plazenta eingeführt. Die mütterliche Seite (gefüttert mit Decidua basalis), die an der fetalen Seite gegenüberliegt, hat offensichtliche Kotyledonen (oder Lappen).
- Um die Präparation beginnen, orientieren die Plazenta mit der Nabelschnur nach oben in den sterilen Behälter.
Hinweis: Dieses Protokoll genügend Zellen zu erhalten ist entworfen, um Samen in einem T175-Kolben von jeder der drei Gewebetypen. Jeder Verdau beginnt mit etwa 10 g Gewebe. Dies ist eine ähnliche Ausgangs Anzahl der Fläschchen, wie MSC-Kulturen aus einem 20 ml Knochenmark aspirieren eingeleitet. Wenn mehrere Zellen gewünscht sind, dann kann mehr Gewebe geerntet werden, und das Protokoll kann linear skaliert werden. Die Größen des Gewebes geerntet werden soll nur als Hinweis, was mit dem Plazentagewebe praktisch ist. Es gibt nur wenige defining Merkmale im Plazentazotten, der als Bezugspunkt verwendet werden kann. Die angegebenen Maße dienen als eine Schätzung und die Nabelschnur wird als Meilenstein auf dem fötalen Oberfläche verwendet.
- Dissektion der Deziduale (D) Gewebe
- Drehen Sie die Plazenta über so die mütterliche Oberfläche (Decidua basalis) nach oben zeigt. Stellen Sie sicher, dass die fetale Seite mit der Nabelschnur Einfügemarke nach unten zeigt.
- Schneiden Sie Stücke von 0,5 cm Dicke von der mütterlichen Seite der Plazenta (Decidua basalis Gewebe enthält).
- Legen Gewebestücke in eine Petrischale mit HBSS während der Präparation hydratisiert die Gewebestücke zu halten.
- Bringen Sie genügend Gewebe ein Rohr bis zur 10 ml-Marke in einem 50-ml-Röhrchen zu füllen (das etwa 10 g Gewebe).
- Dissektion der Chorionplatte (CP) Gewebe
- Mechanisch entfernen der Amnionmembran aus der fetalen Oberfläche der Plazenta (nicht die Fruchtblase), die cho verlassenrionic frondosum (Chorionplatte) intakt.
- Schneiden Sie Stücke ~ 1 cm breit und 0,5 cm tief von der Chorionplatte. Ernten Sie die Chorionplatte aus der Region am nächsten an der Nabelschnur, weg vom Rand der Plazenta.
- Legen Gewebestücke in eine Petrischale mit HBSS während der Präparation sie mit Feuchtigkeit versorgt.
- Bringen Sie ausreichend Gewebe eine 50-ml-Röhrchen bis zur 10 ml-Markierung (~ 10 g Gewebe) zu füllen.
- Dissektion der Chorionzotten (CV) Gewebe
- Präparieren CV Gewebe ~ 1 cm 2 x 0,5-1 cm tief aus Plazentagewebe , wo der CP bereits entfernt wurde. Wieder Ernte CV aus der Region am nächsten an der Nabelschnur, weg vom Rand der Plazenta. Versuchen Sie, von der mütterlichen Seite der Plazenta mindestens 1 cm weg zu bleiben (Decidua basalis Gewebe enthält); das Ziel ist, Gewebe aus dem Inneren des plazentaren Zotten Gewebe zu ernten.
- Legen Gewebestücke in eine Petrischale mit HBSS während der dissection sie mit Feuchtigkeit versorgt.
- Bringen Sie ausreichend Gewebe eine 50-ml-Röhrchen bis zur 10 ml-Markierung (~ 10 g Gewebe) zu füllen.
- Mincing und enzymatische Spaltung der D, CP und CV Plazentare Tissues
- Da es ~ 10 g D, CP oder CV Gewebe in drei verschiedenen 50-ml-Röhrchen, jedes Röhrchen mit ca. 40 ml HBSS füllen und zu invertieren wiederholt das Rohr, um das Gewebe zu waschen (Wiederholung für ~ 10 sec).
- Den Überstand abgießen und wiederholen Sie diesen Waschschritt 2-3 mal, bis die Lösung weitgehend frei von Blut ist. Verwenden Sie eine 10 ml Pipette oder lange Pinzette die Gewebestücke zu gewährleisten, sind nicht aus der Röhre (n) verloren, wenn der Überstand dekantiert.
- Rückgewebestücke zu einer 10 cm Petrischale mit einem minimalen Flüssigkeitstransfer. Hieb / Hackfleisch , das Gewebe in feine Stücke von ca. 1-5 mm 3 mit einer Schere oder Rasierklinge.
- Übertragen Sie die gehackten Gewebe wieder in entsprechend markierten (D, CP oder CV) 50-ml-Röhrchen.
- In frisch prepared verdauen Medien in mindestens einem 1: 1 - Verhältnis mit dem Gewebe (zB 10 ml Gewebe plus 10 ml Medien verdauen). Setzen Sie die Kappe auf jedem Rohr und invertieren die mehrmals Rohre zu mischen.
- Inkubiere die Gewebe in den Rohren mit verdauen Medien für 1-2 Stunden bei 37 ° C. Befeuchteter Atmosphäre und 5% CO 2 sind für diesen Schritt nicht erforderlich.
Hinweis: Schnelle Schütteln wird benötigt, um effizient zu Zellen aus dem Gewebe dissoziiert und MSC-Ausbeute zu maximieren. Begrenzte Ausbeute wird nur von sehr wenigen Zellen an dem Kulturflasche bei 48 Stunden und einer ersten Durchlaufzeit länger als 1-2 Wochen deutlich. Die Inkubationszeit und Schütteln Methode ist abhängig von der 37 ° C-Inkubator im Labor möglich und kann optimiert werden müssen.- Für einen Inkubator mit einem schnellen und steuerbaren Schütteln Mechanismus, Platz Gewebe und zu verdauen Medium in einem 50-ml-Röhrchen oder sterilen Erlenmeyerkolben, in Inkubator und eingestellte Geschwindigkeit auf 250 Umdrehungen pro Minute schütteln. Dies führt zu einem vollständigen Verdau vondas Gewebe in 1 Std.
- Alternativ kann für einen Inkubator mit einem sanften Schaukeln oder ohne Wippmechanik, schüttelt von Hand den Schlauch schnell und kräftig mit der Hand für 10 Sekunden alle 30 Minuten für 1,5 bis 2 h. Das Enzym Inkubationszeit ist eine geeignete Zeit Abfall zu entsorgen, die biologische Sicherheit Kabinett unnötige Elemente zu löschen, Laborkittel ändern, wenn für den nächsten Teil des Verfahrens, verschmutzt und vorzubereiten.
- Sammlung von mononukleären Zellen und Oberflächen in Flaschen
Anmerkung: Aus dem vorherigen Schritt, gibt es drei 50 ml-Röhrchen (D, CP oder CV) mit Gewebestücken zu verdauen. Wenn die Gewebeaufschlußlösung ein trübes Aussehen und weißen Blutgefäße im Gewebe entsteht offensichtlich sind, ist der Verdau vollständig ist.- 30 ml MSC-Medium, das FBS zu jedem Röhrchen, die Enzyme in der Aufschlußlösung enthaltenen, zu inaktivieren.
- Um die mononukleären Zellen aus dem großen unverdauten Schutt trennen, pulszentrifugieren 50-ml-Tube. Kurz gesagt, erlaubendie Zentrifuge 340 x zu erreichen für 5 s g und dann aufhören. Dadurch wird die große Trümmer Kraft am Boden des Röhrchens zu sedimentieren, während die mononukleären Zellen in flüssiger Suspension zu verlassen.
Anmerkung: Die mononukleären Zellen in der flüssigen Phase bleibt, wenn das Rohr nur kurz ist (gepulst) zentrifugiert. Wenn Zentrifugation verlängert wird, werden die mononukleären Zellen auch mit den Gewebestücken am Boden des Röhrchens pelletieren, was zu einer unerwünschten Zellverlust. - Die überstehende Flüssigkeit, die einkernigen Zellen enthält, und übertragen diese in einen neuen 50-ml-Röhrchen mit einer Pipette.
- In 30 ml Medium oder HBSS auf die restlichen Trümmer Plazentagewebe und kräftig schütteln. Dies wird noch freistehende einkernigen Zellen in Suspension zu bringen und eine zweite Ernte von mutmaßlichen MSC aus dem Gewebe zu ermöglichen.
- Pulszentrifugieren das Rohr ein zweites Mal, und wieder den Überstand in ein neues 50-ml-Tube. Wiederholen Sie diesen Schritt ein drittes Mal die Sammeleffizienz zu maximierenmononukleärer Zellen aus jeder Gewebequelle.
- Pool die Überstände aus jeder der einzelnen Gewebetypen in zwei 50-ml-Röhrchen. Dies ergeben 6 Rohre insgesamt (2 Tuben jedes D, CP und CV). Zentrifuge jedes Röhrchen für 5 min bei 340 x g. Dieser Schritt wird die mononukleären Zellen auf den Boden der Röhrchen pelletieren.
- dekantieren oder Pipette vorsichtig den Überstand in den Abfall ab. Es ist unnötig, zu versuchen, jeden Tropfen Überstand zu beseitigen.
Hinweis: Das Zellpellet durch eine große Anzahl von roten Blutkörperchen zerbrechlich sein. Achten Sie darauf, nicht aus Versehen das Pellet zu verwerfen, wenn Sie werden direkt aus dem 50-ml-Röhrchen dekantiert. - Nachdem die meisten Überstand zu entfernen, Flick sanft das Rohr mehrmals mit einem Finger das Zellpellet zu entfernen. Kombinieren der Pellets, so daß es ein einziges Rohr für jeden D, CP oder CV Gewebe und resuspendieren jeweils in 35 ml von MSC Medien.
- Optional: Filtern Sie die einkernigen Fraktion durch ein Sieb 100 & mgr; m Maschenzelle gesetzt up in einer 50-ml-Röhrchen Zellklumpen oder Fasermaterial zu entfernen.
Hinweis: Vorsicht ist geboten, da die Filter leicht verstopfen können und Überfüllung. Zusätzlich können Luftblasen Filter von der Entwässerung behindern. Wenn dies der Fall ist, heben sich langsam den Filter aus dem Rohr Luft zu ermöglichen, unter dem Filter zu fließen, Waschfilter durch mit Zellkulturmedien oder einen Austausch zu einem neuen Filter. die Filterschritt Ohne erscheint nicht Ausbeute oder Qualität der nachfolgenden MSC Kulturen zu verändern.- Gegebenenfalls kann ein rotes Blutkörperchen (RBC) Lyse oder Dichtegradientenzentrifugation in dieser Stufe 15 durchgeführt werden. Aber unsere Erfahrung ist, dass RBC nicht mit MSC-Anhang oder Proliferation stören und daher ist RBC-Lyse nicht erforderlich. Mononukleäre Zellen konnte in diesem Schritt gezählt werden , wenn RBC Entfernung 15 wurde durchgeführt. Zwar wird die überwiegende Mehrheit der Zellen in diesem Stadium nicht MSC, aber fötalen Ursprungs Trophoblasten, Endothelzellen und hämatopoetischen Zellen sowie ma seininterne Herkunft hämatopoetischen Zellen und dezidualen Stromazellen.
- Übertragen die Zellsuspension für jedes D, CP oder CV Gewebe in einem einzigen T175 - Kolben und die Kultur in einem befeuchteten Inkubator bei 37 ° C und 5% CO 2.
- Beitrag Isolation-Zellen-Expansion
- Bei 48 Stunden nach der anfänglichen Isolation, entfernen Sie das Medium aus jedem der Kolben (D, CP und CV) und mit 35 ml frischem MSC Medien ersetzen. Das verbrauchte Medium und abgelösten Zellen können verworfen werden, da putative MSC vermutet werden dem Gewebekulturkolben 16 angebracht werden. Rück Kolben in den Inkubator für weitere 24 hr.
- Nach einer weiteren 24 Stunden der Kultur, wasche die Kolben zweimal mit DPBS (25 ml) und Schutt RBCs zu entfernen. Verwirbeln die Flüssigkeit rund um den Boden des Kolbens RBCs zu entfernen. Verwenden einer Pipette Flüssigkeit und Debris zu entfernen. In 35 ml MSC Medien zu den Kolben und das Rück die Kolben in den Inkubator.
- Ersetzen Medien zweimal pro Woche, und incubate Kulturen bis in die Zellmonolayern sind 80- 90% konfluent. Diese anfängliche Expansion dauert 4-14 Tagen, je nach der Qualität des Gewebes, Menge an Ausgangsmaterial und die Effizienz und Zeit der Inkubation mit der Aufschlußlösung.
3. Subkultur von PMSC
- Wenn Kulturen 80-90% konfluent sind, waschen zweimal mit 20 ml 1x HBSS oder DPBS und Waschungen zu verwerfen. In Trypsin-Ersatz zu jedem Kolben (dh verwenden 5 ml für einen T175 - Kolben).
- Inkubieren der Kolben für 5 min bei 37 ° C MSC von der Gewebekulturoberfläche zu befreien. Tippen Sie auf den Seiten des Kolbens jedes ~ 2 min Ablösung zu erleichtern.
- Wenn die Zellen von der Oberfläche und in eine Einzelzellsuspension abgelöst werden, wasche die Zellen aus dem Kolben mit MSC Medien und die Zellen in Röhrchen sammeln. Die MSC Medien verdünnen und die Trypsin-Ersatz (Verwendung ~ 15 ml MSC Medien pro T175-Kolben) zu deaktivieren.
- Übertragen Sie die Inhalte der einzelnen Gewebekulturflasche zu einer 50ml-Tube.
- Zentrifugenröhrchen bei 340 xg für 5 min, um die Zellen zu pelletieren.
- Überstand verwerfen und Resuspendieren der Zellpellets in 1 ml MSC Medien.
- Verdünnen Sie 10 ul der Zellsuspension in 10 ul Trypanblau. Zählen von Zellen unter Verwendung eines Hämozytometers und berechnet die Gesamtzahl der Zellen 15.
- Übertragen Zellen zu neuen Kolben bei 1.150 Zellen / cm 2 in frischen MSC Medien und Inkubation in einem Gewebekultur - Inkubator. An dieser Einsaatdichte, Samen 200.000 MSC in jede neue T175-Kolben in 35 ml MSC Medien. Feed-Zellen zweimal pro Woche, bis 80-90% konfluent. Seed nachfolgenden Passagen bei 1.150 Zellen / cm 2 oder 200.000 MSC in jedem T175 - Kolben.
- nur ein T175-Kolben für die weitere Vermehrung und Charakterisierung, wenn die Passage 1 (P1) oder P2 Zellen konfluent sind, Kryokonservierung die Mehrheit der Zellen für die zukünftige Verwendung und reseed. Die vermehrten Zellen können bei P3 oder P4 für mesodermalen Differenzierungsassays und Zellcharakterisierung über fl verwendet werdenow-Zytometrie.
Hinweis: In frühen Passagen kann es nur sehr wenige dünn getrennt Kolonien, aber die lokale Zelldichte innerhalb jeder Kolonie kann sehr hoch sein. Dies ist nicht ideal, da die lokale dichte Packung der Zellen in Kontakthemmung führen wird, das Wachstum zu verzögern und Kultur Leistung reduziert wird. Wir empfehlen, wenn dichte Kolonien beobachtet werden, sollten die Zellen geerntet und in einen neuen Kolben reseeded werden. Dieser Umverteilungsprozess stellt Zellen mit Raum zu vermehren, und die allgemeine Kultur Leistung verbessert werden. - Zur Kryokonservierung MSC, sammeln ~ 1 x 10 6 Zellen in 1 ml 90% FCS und 10% Dimethylsulfoxid (DMSO) und gefrier Verwendung von Standardprotokollen.
Hinweis: In der repräsentativen Abschnitt Ergebnisse gibt es Beschreibungen von MSC Charakterisierung fließen mit Zytometrie, mesodermalen Differenzierung und XY-FISH-Analyse das Geschlecht des drei verschiedenen (D, CP und CV) erweitert Zellpopulationen zu bestimmen. In unserer Studie waren Plazenten von männlichen Babys; damit allefötale Zellen könnten als männliche (Y-Chromosom) unterschieden werden und alle mütterlichen Zellen als Weibchen unterschieden werden konnten (X-Chromosom nur).
Ergebnisse
Die Plazenta MSC Isolationsverfahren ist in Abbildung 1 Die drei Bereiche der Plazenta - Anatomie , von dem MSC wurden isoliert werden hervorgehoben in Abbildung 2 zusammengefasst Dies sind die mütterliche Dezidua, sowie die weitgehend fötale Gewebe der Chorionplatte und Chorionzotten. Viele Text - Bücher, Artikel und Online - Detail - Ressourcen die Entwicklung und funktionelle Rolle der verschiedenen Plazentagewebe (bitte Referenz 8).
Morphologie der Kulturen 48 h nach der Isolierung und Entfernung des Gewebetrümmer.
Nach 48 Stunden der Kultur wird sich die MSCs an die Gewebekultur Kunststoff befestigt, während RBCs und den meisten anderen Zelltrümmer werden nicht angeschlossen haben. Zu diesem Zeitpunkt muß das Medium durch 35 ml frisches Kulturmedium ersetzt. Vor diesem Medium Austausch ist es schwierig, genaue Beobachtungen zu machen, weil dereine große Anzahl von roten Blutkörperchen, die visuelle Beurteilung behindern wird. Das Aussehen des Kulturüberstand kann variieren erheblich zwischen placenta Donatoren. Diese Variation kann in Beispiel 1 und 2 (3A) gesehen visuell. Diese zwei MSC-Isolationen, die sehr unterschiedlich zu sein schien, wurden gleichzeitig durchgeführt, aus zwei verschiedenen Plazenten. Wenn jedoch einmal gewaschen, erschienen beide Kulturen ähnlich (siehe gewaschen Beispiel 3, 3A).
Unter einem Mikroskop nach dem 48 h Medienaustausch, werden nur wenige Zellen in den Kolben (3B) angebracht werden, und die Zellen werden aus ausgiebiger erweitert MSCs signifikant unterschiedlich erscheinen. Einige Ablagerungen und RBCs wird sichtbar als schwimmende oder daran befestigt Klumpen und diese werden nicht mit dem Wachstum der MSCs eingreifen. Die längeren fibroblastische Zellen an den Boden des Kolbens eingehalten werden wahrscheinlich eine Mischung von Zellen, einschließlich MSC, hämatopoetischen sein,trophoblastic oder Endothelzellen. Auch hier haben die nicht-MSC-Zellen nicht die MSC-Kulturen zu rechnen, da diese Zellen im Allgemeinen nicht mehr als 1-2 Passagen in den MSC-Kulturbedingungen überleben wird. Trotz einiger Unterschiede in der ursprünglichen Aussehen der Kulturen sind die nachfolgenden Ergebnisse Expansion im Allgemeinen konsistent.
Morphologie der MSC-Kulturen über die Zeit.
In diesem repräsentativen Beispiel, sieben Tage nach der Isolierung, kleine fibroblastic MSC Kolonien sichtbar waren, obwohl nicht MSC - Zellen auch als runde gesehen werden konnte oder lose anhaftenden Zellen (4A). Die anhaftenden Zellen sind , was bezeichnet ursprünglich eine "Kolonie bildende Einheit -fibroblast "(CFU-F) 17 und bezeichnet später MSC 18. Dreizehn Tage nach der Isolierung, waren fibroblastic MSC Kolonien groß (4B). Im Allgemeinen wird die einschichtige 80-90% konfluent an dieser Stelle, und die Zellen sollten passa sein ged. Von Durchgang 2 an wird die Plazenta MSC einschichtigen die charakteristische Whirlpool förmige Morphologie bei Konfluenz (4C) zu entwickeln. Es sei denn, die Zellen bei geringer Dichte passagiert werden, wird die CFU-F Bildung nicht mehr zu beobachten. Bei geringer Dichte, der Plazenta abgeleitete MSC einen kleineren Quadrierer Aussehen als adulten Knochenmark abgeleiteten MSC 1. Während plazentalen abgeleitetes MSC und Knochenmark stammenden MSC ähnliche Proliferationsraten aufweisen, die Plazenta-abgeleitete Zellen sind weniger anfällig für eine schnelle Seneszenz 5.
Charakterisierung von plazentalem MSC in vitro.
Jeder expandierte Zellpopulation muss gekennzeichnet werden , um sicherzustellen , dass es Standard - MSC Kriterien entspricht 16, einschließlich (1) Kunststoffadhärenz (2) die Anwesenheit von mesenchymalen Oberflächenmarker und das Fehlen von hämatopoetischen Oberflächenmarker, und (3) die Fähigkeit, mesodermalen laufen Differenzierung.
Wie in 4 gezeigt, sind die MSCs in Kultur Kunststoff anhaftenden und eine fibroblastic förmige Morphologie aufweisen; Dies bestätigt , dass die Zellen , die die ersten Kriterien erfüllen , die 16 MSC definieren.
Plazentare MSC Anzeige mesenchymalen Oberflächenmarker.
Die zweite Definition MSC Merkmal ist das Vorhandensein von mesenchymalen Oberflächenmarker und die Abwesenheit von hämatopoetischen Oberflächenmarker 16. Da es keine Einzelmarke eines MSC Lage ist, definitiv zu identifizieren, Platten von Markern sind in der Regel in Verbindung mit Durchflusszytometrie-Analyse verwendeten Zellen zu identifizieren, die mesenchymalen sind, aber nicht hämatopoetischen. In der repräsentativen Datensatz hier zur Verfügung gestellten (5A), werteten wir Zellexpression von mesenchymalen Marker CD73, CD105, CD90, CD146 und CD44, die hämatopoetischen Marker CD45 und CD34 und HLA-DR, als well als Endothel-Marker CD31. Alle in dieser Plazenta MSC Charakterisierung Verfahren verwendeten Antikörper sind in der Tabelle der Materialien / Geräte aufgeführt. Die Färbung wurde durchgeführt gemäß den Anweisungen produziert, mit Analyseverfahren hier 19 beschrieben.
Die Zellen waren positiv für den mesenchymalen Marker CD73, CD105, CD44 und negativ für die Zelloberflächenmarker CD45, CD34, HLA-DR und CD31 als 5,20 erwartet. Ungefähr 37% und 57% der Zellen in unserem repräsentativen Datensatz waren positiv für CD90 und CD146 21, beziehungsweise. Sowohl CD90 und CD146 werden häufig verwendet MSC 21 Marker. MSC Zelloberflächenmarker Profile können unterschiedlich sein , abhängig von MSC Gewebequelle, Medium - Zusammensetzung oder Passage - Nummer 22. In unserer langjährigen Erfahrung haben wir folgende 1-2 p langfristige Kontamination der Plazenta abgeleitete MSC mit nicht-mesenchymale Zellen nicht beobachtetassages 5,11.
Plazentare MSC Anzeige mesenchymalen Differenzierungspotential
Per Definition muss MSC besitzen in vitro mesodermalen Differenzierung Kapazität 5,13. Mesodermalen Differenzierungspotential wird üblicherweise entweder durch Assays Differenzierung Tri- oder bi-Abstammungslinie bewertet. Bi-Abstammungslinien-Assays beurteilen im Allgemeinen osteogene und adipogenetische Differenzierungsfähigkeit, während Tri-Abstammungslinien-Assays zusätzlich chondrogene Differenzierungsfähigkeit zu bewerten. In den repräsentativen hier vorgestellten Ergebnisse zeigen wir , dass die gespreizte MSC Populationen sowohl Kalkablagerungen bilden, was auf eine osteogene Differenzierung und Lipidvakuolen, bezeichnend für Adipogenese (5B).
Um die MSC - Populationen zu charakterisieren hier berichtet, entkernt wir Zellen in 24 Kulturschalen mit 6 x 10 4 Zellen in 1 ml Induktionsmedium. Das Medium Kompoponenten sind in der Tabelle der Materialien / Geräte aufgeführt. Während Induktionsmedium Formulierungen in der Literatur weit verbreitet sind, gibt es eine beträchtliche Variabilität in der veröffentlichten Formulierungen. Aus diesem Grund führen wir kurz unsere Induktionsmedium Formulierungen und Färbung Ansätze hier. Osteogene Induktionsmedium enthielt DMEM-HG, 10% FBS, 1x Antibiotikum antimykotischen Lösung, 10 mM β-Glycerinphosphat, 100 nM Dexamethason und 50 uM L-Ascorbinsäure-2-phosphat. Adipogenen Induktionsmedium enthielt DMEM-HG, 10% FBS, 1x Antibiotikum Antimykotika-Lösung, 10 ug / ml Insulin, 100 nM Dexamethason, 200 & mgr; M Indomethacin und 500 & mgr; M 3-Isobutyl-1-methyl Xanthin. Hier Kulturen wurden in einem 37 ° C, 5% CO 2 -Inkubator kultiviert , und für 14 Tage gehalten. Induktions-Medium wurde zweimal pro Woche über die Kulturdauer ausgetauscht. Nach 14 Tagen nach Induktion wurden die Kulturen für entweder knochenartige Matrix (Osteogenesis) oder Lipidvakuolen (Adipogenese) gemäß unserer i.Vj. gekennzeichnetious Veröffentlichung 5. Osteogenen Calcium Matrix Abscheidungsanalyse wurde durch erste Absaugen des Mediums erreicht wird, für 20 min die Kulturen mit 4% Paraformaldehyd Fixieren der Monolayer mit DPBS gewaschen und dann mit Alizarin Red S-Färbung gemäß den Anweisungen des Herstellers. Adipogenen Induktions wurde durch Absaugen des Mediums beurteilt, während 20 min, die Kulturen mit 4% Paraformaldehyd Fixierung, Waschen der Monoschicht und Färbung mit Oil Red O-Lösung gemäß den Anweisungen des Herstellers. Stained Kalkablagerungen und Öl Vakuolen wurden dann mit einem Lichtmikroskop sichtbar gemacht, und Bilder für zukünftige Referenz gespeichert.
In früheren Veröffentlichungen haben wir das Differenzierungspotential von plazentalem abgeleitetes MSC ausgiebiger 4,5 charakterisiert. Placental-derived MSC Osteogenese ist ähnlich dem Knochenmark stammenden MSC, während Adipogenese in Plazenta abgeleitetes MSC 5 im Allgemeinen weniger effizient ist </ Sup>. Wir tragen nicht routinemäßig chondrogene Differenzierung aus mehreren Gründen aus, obwohl dies von uns ist für Plazenta-MSC 5 zuvor berichtet. Erstens, während mesodermalen Differenzierung Kapazität ein bestimmendes Merkmal der MSC ist, ist es wahrscheinlich zweitrangig 23-25, insbesondere dann, wenn der therapeutische Nutzen ist wahrscheinlich von den MSC parakrine Sekrete 26 abgeleitet werden. Zweitens, obwohl Dominici et al. Minimal Kriterien für die klinische Herstellung von humanem adultem Knochenmark stammenden MSC 16 vorgeschlagen, neuere Studien zeigen MSC aus verschiedenen Nischen 5,13,27-32 unterschiedlichen inhärenten Eigenschaften und Differenzierungs Fähigkeiten haben. Tatsächlich Parolini et al. Vorgeschlagen, Placenta-abgeleitete MSC in "ein oder mehrere mesodermalen" Abstammungslinien anstatt alle drei Linien 10 unterscheiden soll. Schließlich ausschließen viele MSC Studien chondrogene Differenzierung, da es ein ähnliches geschieht durchintrazellulären Signalweg wie Osteogenesis (TGFß Familie Weg) 33-35.
Plazentare MSC sind mütterlichen Ursprungs mit dieser Methode der Kultur trotz der anatomischen Lage des Ausgangsmaterials.
Viele Publikationen gehen davon aus, dass aus der fetalen Chorion Ausbeute fötalen MSC auf die Kultur 14 isolierten Zellen. Wie wir jedoch vorher 5 berichtet haben, alle Kulturen von fetalen Chorion abgeleitet, die dieses Protokoll verwenden, schnell für mütterliche MSC anreichern als würde intuitiv für den mütterlichen dezidualen MSC Kulturen zu erwarten. In dieser repräsentativen Ergebnissen verwendet wir Plazentagewebe von männlichen Babys, so dass es möglich war leicht die fetale und maternale Zellen Beitrag in der expandierten Zellpopulationen zu beschreiben. Für diese Untersuchungen verwendeten wir das Kit XY FISH aufgeführt in der Tabelle der Materialien / Ausrüstung, und folgte den Anweisungen des Herstellers.
In den repräsentativen Daten hier vorgesehen, wobei die Kulturen aus mütterlichem Dezidua abgeleitet waren ~ 90% mütterlichen Zellen (XX) und ~ 10% fötalen Zellen (XY) bei Passage 0 (6) . Durch Hindurch 2 wurden die Zellpopulationen aus dem mütterlichen Geweben stammen ~ 100% mütterlichen Zellen (XX) und fötalen Zellen (XY) waren nicht nachweisbar. Dies deutet darauf hin, dass körperliche Dissektion des mütterlichen Gewebes auf die Anreicherung von mütterlichen Zellen in den nachfolgenden Kulturen geführt. Jedoch ist es wichtig, die Kulturergebnisse aus dem fötalen Chorionzotten und Chorionplatte abgeleitete Kulturen zu betrachten. Bei Passage 0, beide fetalen Zotten und Chorionplatte abgeleitete Kulturen waren ~ 85% XY oder fötalen Ursprungs, was darauf hinweist , dass eine gezielte Präparation für fötale Zellen angereichert (Abbildung 6). Bei Passage 0, enthalten beide Kulturen ~ 15% mütterlichen Zelle (XX) Kontamination. Überraschenderweise bei Passage 2, beide fötalen Kulturen wurden mit ~ 100% mütterlichen Zellen (XX) bevölkert, und fötale Zellen (XY)waren nicht mehr nachweisbar. XY-FISH-Analyse zeigt, dass die mütterlichen Zellen (XX-Chromosomen) schnell und konsequent Übernahme die Kulturen von den fetalen Chorion-Gewebe abgeleitet. Dies ist eine kritische Beobachtung , die Kultur wird oft 5 übersehen. Die Einzelheiten dieser Analyse wird in diesem Protokoll enthalten, weil sie die sehr wichtige Beobachtung zeigt, dass mütterliche Zellen schnell alle Kulturen füllen, wenn DMEM mit 10% FBS ergänzt wird ohne zusätzliche Faktoren verwendet entwickelt, um die fötale abgeleiteten Populationen zu unterstützen.
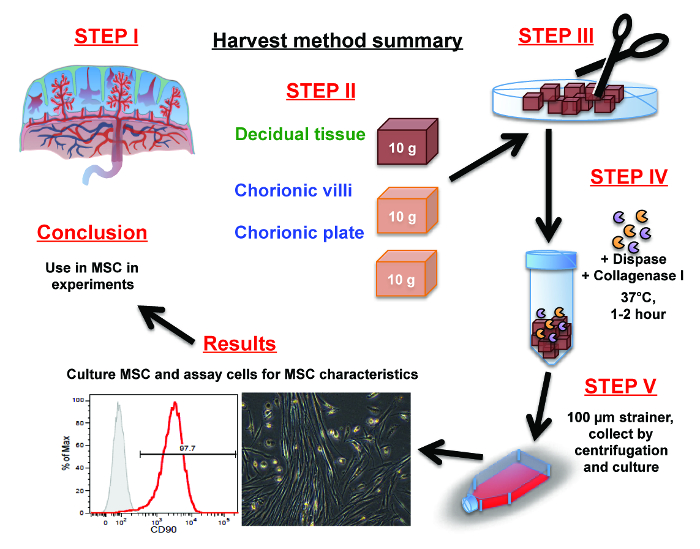
Abb . 1: Zusammenfassung der Plazenta MSC Isolationsverfahren (Schritt 1) Orientieren Sie sich mit der Plazenta Anatomie. (Schritt 2) sezieren manuell je 10 g Gewebe entweder aus der Decidua, Chorionzotten oder Chorionplatte mit einer Schere. (Schritt 3) Mince ter seziert Teile der Decidua, Chorionzotten oder die Chorionplatte Gewebe in feine Stücke mit einer Schere oder einem Skalpell.
(Schritt 4) Befreien Zellen aus den feinen Stücken über eine 1-2 Stunden Verdauung in Dispase und Kollagenase I.
(Schritt 5) Trennen der Zellen von dem Fasergewebe durch Puls Zentrifugation und / oder sie durch ein Zellsieb waschen. Sammeln und resuspendieren Zellen in Kulturmedium und platziert in Kulturflaschen. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Mesenchymale Stromazellen (MSC) wird aufgrund ihrer Neigung zur Kunststoffadhärenz und Kapazität zu überleben und vermehren sich in dem Kulturmedium ausgewählt werden. Schließlich im Ergebnisteil kann die expandierte MSC gekennzeichnet und für die Verwendung in zukünftigen Experimenten gespeichert werden.
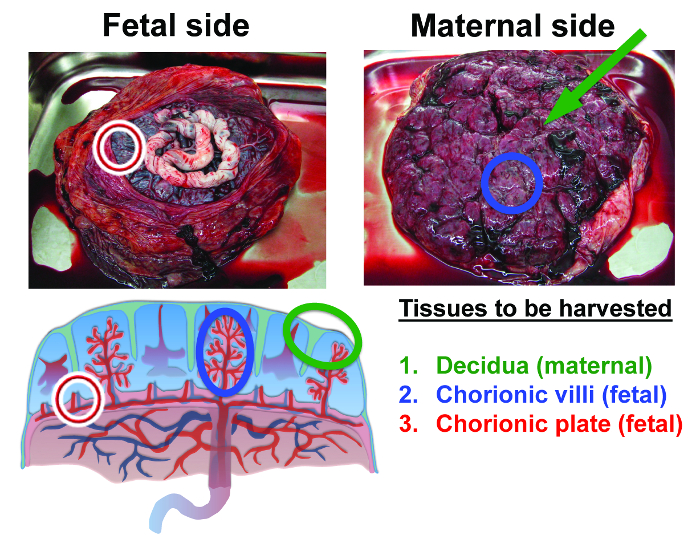
Abbildung 2:. Anatomie der menschlichen Plazenta und in diesem Verfahren isoliert Gewebe Das erste Gewebe geerntet werden soll , mütterliche Dezidua. Decidua ist Gewebe, das auf der Oberfläche der Plazenta als dünne Schicht bleibt, nachdem es von der Gebärmutterwand vergossen wird (Decidua durch den grünen Marker identifiziert wird). Das zweite Gewebe, das aus dem Inneren der Plazenta gewonnen wird, ist die fötale Chorionzotten (blue-Marker). Das dritte Gewebe. Fötale Chorionplatte (rote Markierungen) (aus Referenz 36 angepasst) geerntet werden Bitte klicken Sie hier um eine größere Version dieser Figur zu sehen.

Abbildung 3: Morphologie der Kulturen 48 Stunden nach der Isolierung und WiederBewegen des Gewebetrümmer. (A) Das Aussehen des Kulturüberstand die Trümmer vor dem Abwaschen wesentlichen zwischen placenta Donatoren variieren. Beispiel Kulturen 1 und 2 zeigen diese Variante. Diese beiden Isolationen wurden gleichzeitig durchgeführt, aber von zwei verschiedenen Plazenten. Einmal wird gewaschen Kulturen frei von roten Blutkörperchen und Gewebereste werden wie in Beispiel 3 Die nachfolgenden Expansion Ergebnisse im Allgemeinen konsistent sind gezeigt. (B) Nach 48 hr Medienaustausch, nur wenige Zellen in den Kolben angebracht werden. Maßstabsbalken = 200 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abb . 4: Morphologie der MSC - Kulturen im Laufe der Zeit (A) Sieben Tage nach der Isolierung kleine fibroblastic MSC Kolonien sind sichtbar, obwohl nicht MSC-Zellen auch vorhanden als rund sein oder lose anhaftenden Zellen. (B) 13 Tage nach der Isolierung sind fibroblastic MSC Kolonien groß und häufig die Monoschicht von MSC ist konfluent und bereit für den Durchgang. (C) aus dem Kanal 2 an wird die MSC einschichtigen eine charakteristische Whirlpool förmige Morphologie bei Konfluenz entwickeln. Maßstabsbalken = 200 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
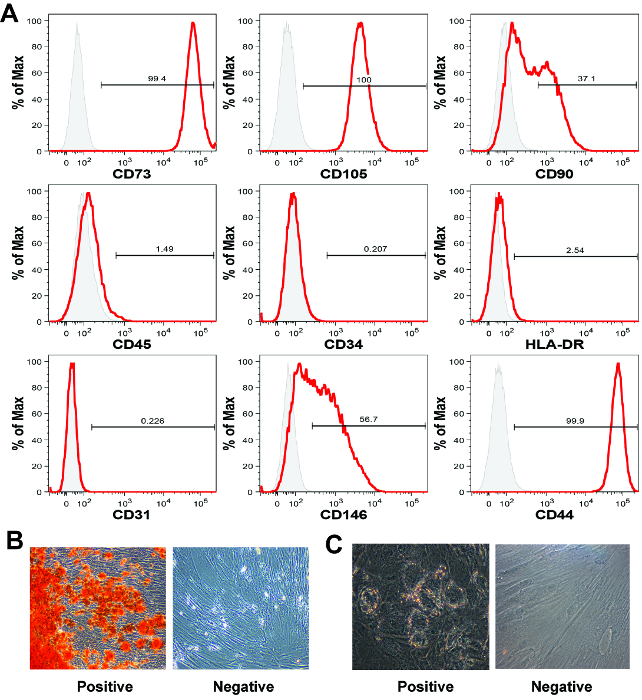
Abbildung 5:. MSC Charakterisierung mittels Durchflusszytometrie und mesodermalen Differenzierung (A) Die Plazenta Chorionzotten abgeleiteten MSC mittels Durchflusszytometrie - Analyse, obwohl für diese Zelloberflächenmarker, Expres ein klassisches MSC Marker Profil anzeigension ist für alle Arten von menschlichen MSC ähnlich. Jedes Histogramm zeigt die Signalintensität (x-Achse) gegen die normierte Zellenzahl auf der y-Achse (% von Max). In dieser repräsentativen Datensatz wurden die Zellen positiv für CD73, CD105 und CD44 und negativ für den hämatopoetischen Marker CD45 und CD34 und HLA-DR. (B) Plazentare MSC durchlaufen im Allgemeinen robust osteogene Differenzierung jedoch (C) adipogenetische Differenzierung weniger effizient sein kann , als mit Knochenmark abgeleiteten MSC. Bilder in Bildunterschriften B und C bei 40 - facher Vergrößerung aufgenommen wurden. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 6: Placental MSC sind mütterlichen Ursprungs mit dieser Methode der Kultur, trotz der anatomischen Lage des Ausgangsmaterials.Die Diagramme zeigen die Quantifizierung des fetalen (männlich, XY) und mütterlichen (weiblich, XX) Zellzusammensetzung der Plazenta MSC Kulturen isoliert von dezidualen, Chorionzotten und Chorionplatte Gewebe bei jedem zweiten Durchgang. Mütterlichen Zellen (XX) schnell und nehmen reproduzierbar über die Kulturen von den fetalen Chorion-Gewebe abgeleitet. Fetal = männlich = XY-Chromosomen nachgewiesen in einer einzelnen Zelle, mütterliche = weiblich = XX-Chromosomen in einer einzelnen Zelle nachgewiesen. Hier präsentierten Daten war von N = 3 unabhängige Spender Plazenten von männlichen Babys, mit einem Minimum von 100 Zellen gefärbt für XY-FISH und für jeden Datenpunkt gezählt. Die Balken stellen Mittelwerte und Fehlerbalken reflektieren einer Standardabweichung. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Diskussion
Die Plazenta ist eine physikalisch große fetomaternalen Organ, von dem Fötus oder der Mutter MSC 22 isoliert werden. Dabei stellten wir einen detaillierten Überblick über Plazenta Anatomie und Anleitung, wie man speziell sezieren Decidua (mütterlicherseits), Chorionzotten (fötalen) und Chorionplatte (fötalen) Gewebe (Schritt 2,2-2,4). Anschließend skizzierte wir ein robustes Protokoll, das MSC Isolierung von jedem dieser drei Gewebe ermöglicht (Schritt 2,5-2,6). Placental MSC Expansion ist effizient und Kulturen erscheinen ähnlich wie Knochenmark stammenden MSC - Kulturen (3 und 4). Osteogene Differenzierung ist zuverlässig (5B), während adipogene Differenzierung der Regel weniger effizient (5C) 5.
Viele Neulinge auf dem Gebiet wird davon ausgehen, dass abgeleitete Kulturen von fötalen Chorionzotten oder Chorionplatte Gewebe wird für die fetale MSC angereichert werden. Doch in unseren Händen fetal Zellanreicherung ist nur vorübergehend , wenn Standard - MSC Expansionsmedium wie DMEM-LG + 10% FBS 5 verwendet wird. Hier bieten wir repräsentative Ergebnisse Plazentagewebe unter Verwendung von einem männlichen Baby abgeleitet. Durch die Verwendung von Plazentagewebe von einem männlichen Baby, die fötalen Zellen sind leicht erkennbar als XY - Chromosomen, während mütterlichen Zellen als mit XX - Chromosomen erkennbar sind. Abbildung 6 zeigt XY FISH Ergebnisse für eine repräsentative Kultur. Während fötalen MSC (XY) (bis zu 80%) in den ersten Kulturen von fötalen Chorionzotten oder Chorionplatte Gewebe, diese gleichen Kulturen schnell überholt (~ 100%) durch mütterliche (XX) MSC über die ersten beiden Stellen abgeleitet angereichert sind, . In Standardmedium, bestehend aus DMEM-LG + 10% FBS, die wenigen mütterlichen abgeleiteten MSC, die die fötale Gewebe outcompete die fetale abgeleiteten Zellen in Kultur verunreinigen.
Ein entscheidender Schritt in diesem Protokoll skizziert ist eine Anerkennung der Plazenta-Anatomie und von wo aus fötalenund mütterlichen Gewebe kann am effektivsten geerntet. Wie in den repräsentativen Ergebnissen Abschnitt beschrieben, wird Präparation von fetalen Gewebe transienter Anreicherung für MSC fötalen abgeleiteten ermöglichen. Verbesserungen in der Expansionsmedium Formulierung durch spezifische exogene Wachstumsfaktor Mediumergänzung sollten selektive Expansion der fetalen abgeleiteten MSC Populationen erlauben und ein Zellprodukt herzustellen, das für die fetale angereichert ist, anstatt mütterlichen Zellen (unsere Gruppe gegenwärtig solche Medium Formulierungen zu entwickeln). Die Herstellung von fötalen MSC Populationen kann eine Reihe von Vorteilen aufweisen, wie fötales MSC größer Angiogenese und immunsuppressive Eigenschaften als gleichwertig mütterlichen MSC Populationen 37 haben werden vorgab.
In jeder der beschriebenen Isolierungsprotokollen verwendeten wir etwa 10 g Gewebe. Eine ganze placenta ist typischerweise 500-750 g, und in früheren Arbeiten haben wir gezeigt, dass digest durch automatisierte Gewebe und einer Zellexpansions Bioreaktor proczesse , dass es möglich sein sollte , 4 mehr als 7.000 klinische Zell Dosen aus einer einzigen Plazenta herzustellen. Diese Zahlen unterstreichen die mögliche Eignung von plazentalem abgeleitetes MSC in allogenen MSC-Therapien, und die Bedeutung dieses Verfahren unabhängig von der MSC Ursprungs (Fötus oder der Mutter). Aus therapeutischer Sicht ist es sehr wichtig, dass Benutzer ein umfassendes Verständnis der Zellprodukt haben und die Fähigkeit, zuverlässig diese Zellprodukt herzustellen. Wir hoffen, dass unsere Video-Forscher unterstützen Plazenta Anatomie zu verstehen, zu isolieren MSC aus der Plazenta, und erwarten, dass die wahrscheinlich Fötus oder der Mutter Zelle Zusammensetzung ihrer Kulturen.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
RP wurde von einem National Health and Medical Research Council (NHMRC) Postdoc Fellowship unterstützt. VS wurde von einer Universität von Queensland International Postgraduate Studienstipendium unterstützt. MRD wurde von der NHMRC und Inner Wheel Australien unterstützt.
Wir danken der klinischen und Pflegepersonal in die Zustimmung des Patienten und Probensammlung zu unterstützen. Wir danken Prof. Nickolas Fisk, Prof. Kerry Atkinson und Dr. Rohan Lourie für aufschlussreiche Diskussionen in der Geburtshilfe, feto-Entwicklung der Plazenta und der Plazenta Anatomie.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| HBSS | Gibco/Invitrogen | 14185-052 | Long name: Hanks Balanced Salt Solution |
| FBS | Gibco/Invitrogen | Long name: Fetal Bovine Serum | |
| trypsin-substitute | Gibco/Invitrogen | 12563-029 | Long name: TrypLE Select |
| DMEM-LG | Gibco/Invitrogen | 11885-092 | Long name: Dulbecco’s Modified Eagles Medium-Low Glucose |
| DMEM-HG | Gibco/Invitrogen | 11965118 | Long name: Dulbecco’s Modified Eagles Medium-HIgh Glucose (4.5 g/L) |
| PBS (Mg+Ca+ free) | Gibco/Invitrogen | 14190-250 | Long name: Dulbecco's Phosphate buffered saline, magnesium and calcium free |
| Anti- anti- | Gibco/Invitrogen | 15240-062 | Long name: antibiotic-antimycotic solution x100 |
| paraformaldehyde powder or 4% solution | any | ||
| Collagenase I | Invitrogen | 17100-017 | 2,500 U/ml |
| Dnase I | Sigma | D5025 | 10 mg/ml in 0.15 M NaCl |
| Dispase | Invitrogen | 17105-041 | 10 mg/ml in water (20,000 U/ml). |
| Material | Company | Catalog Number | Comments |
| Disposables: | |||
| 50 ml centrifuge tubes | Falcon or any brand | ||
| petri dishes, sterile plactic (25 cm and 10 cm diameter) | Nunc | ||
| Cell strainers (100 μm) | Becton Dickinson | 352340 | |
| 175 and 75 cm2 (T175 and T75) tissue culture flasks | Nunc | ||
| 5 ml, 10 ml, 25 ml sterile serolgical pipettes | any brand | ||
| Material | Company | Catalog Number | Comments |
| Equipment: | |||
| Centrifuge | |||
| tissue culture incubator 37 °C, 5% CO2 | |||
| Biological safety cabinet | |||
| Sterile scissors and tweezers | |||
| Tube racks | |||
| Pipette-boy or equivalent | |||
| Gilson type pipetters and sterile tips 1,000 µl, 200 µl, 20 µl. | |||
| rocking or shaking incubator (37 °C) | |||
| personal protective equipment | |||
| cleaning solutions (suitable for blood) | |||
| waste containers, correct disposal bins for tissue/blood | |||
| Reagents for MSC characterization | |||
| Antibody (Clone ID) | Manufacturer | Catalogue No. | Isotype |
| CD73 (AD2) | Miltenyi Biotec | 130-095-183 | Mouse IgG1 |
| CD105 (43A4E1) | Miltenyi Biotec | 130-094-941 | Mouse IgG1 |
| CD90/Thy-1 (AC122) | Miltenyi Biotec | 130-095-403 | Mouse IgG1 |
| CD45 (5B1) | Miltenyi Biotec | 130-080-202 | Mouse IgG2a |
| CD34 (AC136) | Miltenyi Biotec | 130-090-954 | Mouse IgG2a |
| HLA-DR (AC122) | Miltenyi Biotec | 130-095-298 | Mouse IgG2a |
| CD31 (PECAM-1) | BD Pharmingen | 555446 | Mouse IgG1 |
| CD146 (541-10B2) | Miltenyi Biotec | 130-092-849 | Mouse IgG1 |
| CD44 (DB105) | Miltenyi Biotec | 130-095-180 | Mouse IgG1 |
| Isotype Controls (Clone ID) | Manufacturer | Catalogue No. | |
| Mouse IgG1 Isotype (IS5-21F5) | Miltenyi Biotec | 130-092-214 | |
| Mouse IgG1 Isotype (IS5-21F5) | Miltenyi Biotec | 130-092-212 | |
| Mouse IgG1 Isotype (IS5-21F5) | Miltenyi Biotec | 130-092-213 | |
| Mouse IgG2a (S43.10) | Miltenyi Biotec | 130-091-837 | |
| Mouse IgG2a (S43.10) | Miltenyi Biotec | 130-098-849 | |
| MACS Buffer | Miltenyi Biotec | 130-091-221 | |
| Osteogenic differentation | Manufacturer | Catalogue No. | |
| DMEM-HG | Gibco/Invitrogen | 11965118 | Long name: Dulbecco’s Modified Eagles Medium-HIgh Glucose (4.5 g/L) |
| FBS | Gibco/Invitrogen | Long name: Fetal Bovine Serum | |
| Anti- anti- | Gibco/Invitrogen | 15240-062 | Long name: antibiotic-antimycotic solution x100 |
| Dexamethasone | Sigma | D4902 | |
| β-Glycerol Phophate | Sigma | 50020 | |
| L-ascorbic acid 2-phosphate | Sigma | A8960-5G | |
| Alizarin Red S | Sigma | A5533-25G | For calcium matrix staining |
| Adipogenic differentation | Manufacturer | Catalogue No. | |
| DMEM-HG | Gibco/Invitrogen | 11965118 | Long name: Dulbecco’s Modified Eagles Medium-HIgh Glucose (4.5 g/L) |
| FBS | Gibco/Invitrogen | Long name: Fetal Bovine Serum | |
| Anti- anti- | Gibco/Invitrogen | 15240-062 | Long name: antibiotic-antimycotic solution x100 |
| insulin | Sigma | I2643 | |
| Dexamethasone | Sigma | D4902 | |
| Indomethacin | Sigma | I7378 | |
| 3-isobutyl-1-methyl xanthine | Sigma | I5879 | |
| Oil Red O solution | Sigma | O1391-250ML | For lipid vacuole staining |
| XY FISH kit to determine fetal or maternal origin of cells | |||
| XY chomosome FISH kit | Vysis (Abbott Molecular) | 07J20-050 | Long name: CEP X SpectrumOrange/Y SpectrumGreen Direct Labeled Fluorescent DNA Probe Kit |
Referenzen
- Brooke, G., et al. Therapeutic applications of mesenchymal stromal cells. Semin Cell dev Biol. 18, 846-858 (2007).
- Wei, X., et al. Mesenchymal stem cells: a new trend for cell therapy. Acta Phamacol Sin. 34, 747-754 (2013).
- Ma, S., et al. Immunobiology of mesenchymal stem cells. Cell Death Differ. 21, 216-225 (2014).
- Timmins, N. E., et al. Closed system isolation and scalable expansion of human placental mesenchymal stem cells. Biotechnol Bioeng. 109, 1817-1826 (2012).
- Barlow, S., et al. Comparison of human placenta- and bone marrow-derived multipotent mesenchymal stem cells. Stem Cell Dev. 17, 1095-1107 (2008).
- Jones, B. J., Brooke, G., Atkinson, K., McTaggart, S. J. Immunosuppression by placental indoleamine 2,3-dioxygenase: a role for mesenchymal stem cells. Placenta. 28, 1174-1181 (2007).
- Parolini, O., et al. Toward cell therapy using placenta-derived cells: disease mechanisms, cell biology, preclinical studies, and regulatory aspects at the round table. Stem Cell Dev. 19, 143-154 (2010).
- Benirschke, K., Burton, G. J., Baergen, R. N. Pathology of the Human Placenta. , 6 edn (2012).
- Moore, K., Persaud, T., Torchia, M. The developing human: clinically oriented embryology. , Elsevier/ Saunders. (2013).
- Parolini, O., et al. Concise review: isolation and characterization of cells from human term placenta: outcome of the first international Workshop on Placenta Derived Stem Cells. Stem cells. 26, 300-311 (2008).
- Brooke, G., et al. Manufacturing of human placenta-derived mesenchymal stem cells for clinical trials. Brit J Haematol. 144, 571-579 (2009).
- Pelekanos, R. A., et al. Intracellular trafficking and endocytosis of CXCR4 in fetal mesenchymal stem/stromal cells. BMC cell biology. 15, 15(2014).
- Chen, Y. S., et al. Small molecule mesengenic induction of human induced pluripotent stem cells to generate mesenchymal stem/stromal cells. Stem Cells Transl Med. 1, 83-95 (2012).
- Heazlewood, C. F., et al. High incidence of contaminating maternal cell overgrowth in human placental mesenchymal stem/stromal cell cultures: a systematic review. Stem Cells Transl Med. 3, 1305-1311 (2014).
- Horn, P., Bork, S., Wagner, W. Standardized isolation of human mesenchymal stromal cells with red blood cell lysis. Methods Mol Biol. 698, 23-35 (2011).
- Dominici, M., et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8, 315-317 (2006).
- Friedenstein, A. J., et al. Precursors for fibroblasts in different populations of hematopoietic cells as detected by the in vitro colony assay method. Exp Hematol. 2, 83-92 (1974).
- Caplan, A. I. Mesenchymal stem cells. J Orthop Res. 9, 641-650 (1991).
- Futrega, K., et al. The microwell-mesh: A novel device and protocol for the high throughput manufacturing of cartilage microtissues. Biomaterials. 62, 1-12 (2015).
- Liu, Y., Goldberg, A. J., Dennis, J. E., Gronowicz, G. A., Kuhn, L. T. One-step derivation of mesenchymal stem cell (MSC)-like cells from human pluripotent stem cells on a fibrillar collagen coating. PloS one. 7, 33225(2012).
- Maleki, M., Ghanbarvand, F., Reza Behvarz, M., Ejtemaei, M., Ghadirkhomi, E. Comparison of mesenchymal stem cell markers in multiple human adult stem cells. Int J Stem Cell. 7, 118-126 (2014).
- Hass, R., Kasper, C., Bohm, S., Jacobs, R. Different populations and sources of human mesenchymal stem cells (MSC): A comparison of adult and neonatal tissue-derived MSC. Cell Commun Signal. 9, 12(2011).
- Bianco, P., Robey, P. G., Simmons, P. J. Mesenchymal stem cells: revisiting history, concepts, and assays. Cell stem cell. 2, 313-319 (2008).
- Bianco, P., et al. The meaning, the sense and the significance: translating the science of mesenchymal stem cells into medicine. Nature med. 19, 35-42 (2013).
- Da Silva Meirelles, L., Caplan, A. I., Nardi, N. B. In search of the in vivo identity of mesenchymal stem cells. Stem cells. 26, 2287-2299 (2008).
- Caplan, A. I., Correa, D. The MSC: an injury drugstore. Cell Stem Cell. 9, 11-15 (2011).
- Wegmeyer, H., et al. Mesenchymal Stromal Cell Characteristics Vary Depending on Their Origin. Stem Cell Dev. , (2013).
- Guillot, P. V., Gotherstrom, C., Chan, J., Kurata, H., Fisk, N. M. Human first-trimester fetal MSC express pluripotency markers and grow faster and have longer telomeres than adult MSC. Stem cells. 25, 646-654 (2007).
- Covas, D. T., et al. Multipotent mesenchymal stromal cells obtained from diverse human tissues share functional properties and gene-expression profile with CD146+ perivascular cells and fibroblasts. Exp Hemol. 36, 642-654 (2008).
- Crisan, M., et al. A perivascular origin for mesenchymal stem cells in multiple human organs. Cell stem cell. 3, 301-313 (2008).
- Pelekanos, R. A., et al. Comprehensive transcriptome and immunophenotype analysis of renal and cardiac MSC-like populations supports strong congruence with bone marrow MSC despite maintenance of distinct identities. Stem cell res. 8, 58-73 (2012).
- da Silva Meirelles, L., Chagastelles, P. C., Nardi, N. B. Mesenchymal stem cells reside in virtually all post-natal organs and tissues. J Cell Sci. 119, 2204-2213 (2006).
- James, A. W. Review of Signaling Pathways Governing MSC Osteogenic and Adipogenic Differentiation. Scientifica (Cairo). 2013, 684736(2013).
- Xu, C., et al. Cross-Talking between PPAR and WNT Signaling and Its Regulation in Mesenchymal Stem Cell Differentiation. Curr Stem Cell Res Ther. , (2015).
- Zhuang, H., et al. Molecular Mechanisms of PPAR-gamma Governing MSC Osteogenic and Adipogenic Differentiation. Curr Stem Cell Res Ther. , (2015).
- Moore, K., Persaud, T., Torchia, M. Before We Are Born: Essentials of Embryology and Birth Defects. , Elsevier Health Sciences. 8 edn (2011).
- Zhu, Y., et al. Placental mesenchymal stem cells of fetal and maternal origins demonstrate different therapeutic potentials. Stem Cell Res Ther. 5, 48(2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten